Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión impresa ISSN 0797-0048versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.31 no.3 Montevideo dic. 2016
Ergometría positiva en paciente asintomático.
Revisión del tema a partir de un caso poco frecuente
1. Cardiólogo en Formación, tercer año. Centro Cardiovascular Casa de Galicia
Correo electrónico: lorenzoseba@hotmail.com
Recibido Oct 21, 2016; aceptado Nov 2, 2016.
Palabras clave:
Ergometría
Informes de Casos
Fístula Vascular
Key words:
Ergometry
Case Reports
Vascular Fistula
Caso clínico
Paciente de 56 años de edad, sexo masculino. Bronquítico crónico, estresado, tabaquista intenso, hipertenso en tratamiento con ARA II. En control con cardiólogo por su hipertensión arterial se le solicita una prueba ergométrica graduada (PEG). Examen físico normal. El electrocardiograma (ECG) basal es normal. El ecocardiograma muestra un ventrículo izquierdo (VI) de dimensiones normales con fracción de eyección del VI (FEVI) conservada e hipertrofia ventricular izquierda (HVI) leve; aurícula izquierda normal y alteración de la relajación ventricular izquierda.
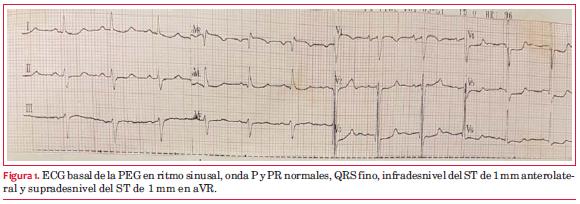
El ECG basal de la PEG presenta infradesnivel del ST de
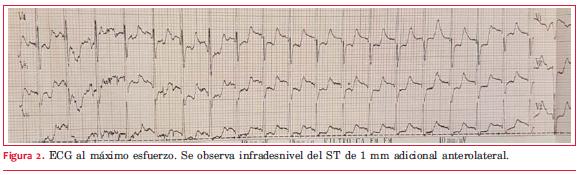
Al máximo esfuerzo (
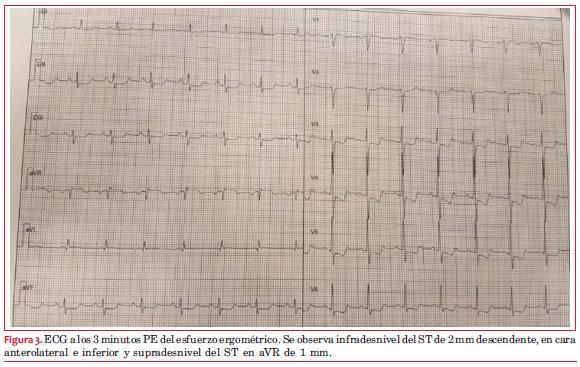
Ante el resultado de la PEG se decide realizar centellograma de perfusión miocárdica MIBI sensibilizado con esfuerzo ergométrico. El ECG basal del estudio muestra una repolarización ventricular normal. El ECG al máximo esfuerzo (
Test presor normal. El paciente no presentó ángor. Al máximo esfuerzo se inyectó el radiofármaco y a los 60 minutos se obtuvieron las imágenes posesfuerzo. A las 24 horas se reitera el estudio en condiciones basales. Se observa captación uniforme del radiofármaco en el VI, tanto en reposo como en esfuerzo. No hay evidencia centellográfica de isquemia. La FEVI en reposo fue de 61% y en luego del esfuerzo de 67%.
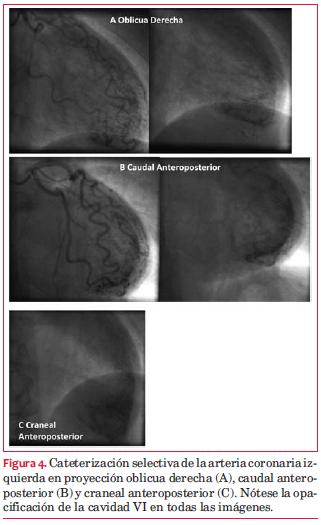
Por presentar una PEG de alto riesgo se consideró que el estudio no permitía descartar que el paciente presentara una patología de tres vasos con isquemia balanceada. Se decide realizar cineangiocoronariografía (CACG) de coordinación que informa ausencia de lesiones coronarias obstructivas significativas, observándose pequeñas fístulas arteriolo-ventriculares desde los ramos de la coronaria izquierda (figura 4).
Comentario
Presentamos el caso de un paciente asintomático con ECG compatible con isquemia durante la prueba de esfuerzo. Sin embargo, el centellograma no evidenció áreas de isquemia, aunque no la descarta completamente, ya que puede ocurrir que se trate de un fenómeno de isquemia balanceada. Se decide ahondar en el diagnóstico realizando un estudio angiográfico, el cual no muestra alteraciones de los vasos epicárdicos, aunque sí hace evidente la presencia de microfístulas hacia la cavidad ventricular izquierda.
Frente a este caso se plantean una serie de interrogantes. ¿Es adecuada la indicación de estudios funcionales en pacientes asintomáticos? ¿Se trata de un falso positivo (FP)? ¿Presenta realmente isquemia subendocárdica a consecuencia de las microfístulas y, de ser así, tiene mayor riesgo cardiovascular que la población general? ¿Cuál es el tratamiento?
Indicación de prueba ergométrica graduada en asintomáticos
La prevalencia de un resultado anormal en la PEG en hombres asintomáticos de mediana edad oscila entre 5% y 12%(1). Tanto en la guía referente al riesgo cardiovascular en adultos asintomáticos de la ACCF/AHA publicada en el 2010(2), como en la guía de prueba de esfuerzo de la Sociedad Española de Cardiología(3), la indicación de una PEG en pacientes asintomáticos es clase IIb, estableciéndose en la guía norteamericana un nivel de evidencia B. Esta última hace hincapié en la realización de la prueba con motivo de valorar el riesgo cardiovascular del paciente, teniendo en cuenta no solo el trazado electrocardiográfico sino también otros elementos como la capacidad funcional lograda y la respuesta cronotrópica. Tanto en la guía española como en la declaración científica de la AHA del 2005(4) respecto a este tema, se destaca la indicación sobre todo en pacientes con múltiples factores de riesgo cardiovascular (FRCV)(3,4), hombres mayores de 45 años y mujeres mayores de 55 años que planean comenzar a realizar ejercicio vigoroso o desempeñan tareas de alto riesgo(4).
Si bien el hecho de no presentar síntomas cardiovasculares a priori se asocia a un pronóstico favorable, la presencia de infradesnivel del ST en la PEG se relaciona con resultados adversos. En un estudio finlandés publicado en 2001, con un promedio de seguimiento de diez años a 1.769 hombres asintomáticos entre 42 y 60 años (promedio de edad 52 años) sin enfermedad coronaria, el infradesnivel asintomático del ST, tanto en el esfuerzo como en el posesfuerzo durante la PEG, predijo eventos coronarios agudos y muerte cardiovascular(5). En otro estudio realizado con la misma población, publicado en 2009, con un promedio de seguimiento a 18,7 años, dicha alteración del ST fue un fuerte predictor de muerte súbita cardíaca en hombres con FRCV(6). De acuerdo a las recomendaciones actuales, la realización de la PEG en este paciente podría tener lugar considerando los FRCV del paciente.
Sensibilidad, especificidad y falsos positivos de la prueba ergométrica graduada
La sensibilidad (S) es el porcentaje de pacientes con enfermedad arterial coronaria (EAC) obstructiva que efectivamente tienen un resultado anormal en la PEG. La especificidad (E) es la proporción de individuos sin EAC obstructiva cuyo resultado del estudio es negativo(1,7). Ambas varían según los diferentes trabajos publicados, ya que dependen de la población seleccionada, la prevalencia y el grado de severidad de la enfermedad en esa población, el número de derivaciones electrocardiográficas durante la prueba y los criterios de positividad aplicados(1,7). En un metaanálisis que incluyó 147 publicaciones acerca de la exactitud diagnóstica de la PEG, publicado por Gianrossi y colaboradores, se determinó que la S era de 67% y la E de 72%(8).
La S puede aumentarse intensificando el estrés ergométrico aplicado, aumentando el número de derivaciones del registro electrocardiográfico, y descendiendo el valor del infradesnivel del ST necesario para considerarla positiva(7). Si se invierten estas condiciones, la E aumenta a expensas de la S (aumentan los falsos negativos y disminuye el número de falsos positivos)(7,9).
Con respecto a la severidad de la enfermedad epicárdica: la S variaba entre 25% y 60% en pacientes con enfermedad de un vaso, entre 38% y 91% en pacientes con enfermedad de dos vasos, y entre 73% y 100% en pacientes con enfermedad de tres vasos(2). Cuando el segmento ST en reposo se encuentra descendido
Un FP se define como el resultado anormal de la prueba en un paciente sin el trastorno. En este caso serían pacientes con resultado anormal de la PEG y ausencia de EAC. Es sabido desde hace tiempo que la falsa positividad de la PEG puede deberse a variadas causas, desde alteraciones basales del ECG, tales como patrón de preexcitación, trastornos de la conducción intraventricular, cardiopatías (como la hipertrofia ventricular izquierda) y el uso de diversos fármacos(3). Sin embargo, no debemos soslayar que la positividad o negatividad de la prueba fue establecida en base a la presencia o ausencia de lesiones obstructivas significativas detectadas en la coronariografía (es decir, según la presencia o no de enfermedad coronaria obstructiva significativa, y no específicamente a la existencia de isquemia)(9). Como menciona Ellestad en su libro, muchos pacientes considerados FP o falsos negativos podrían ser verdaderos positivos y verdaderos negativos, respectivamente, si consideramos la perfusión miocárdica y no la anatomía coronaria(9). En otras palabras, muchos de los pacientes con resultados FP son verdaderos positivos cuando a isquemia nos referimos.
El resultado del estudio funcional en este paciente podría ser considerado un FP, ya que la PEG fue positiva y no presenta lesiones coronarias obstructivas significativas. ¿Podría existir alguna causa de isquemia con arterias epicárdicas sin obstrucciones significativas y, en consecuencia, explicar los hallazgos electrocardiográficos?
Enfermedad arterial coronaria no obstructiva
En consonancia con la presencia de isquemia sin EAC obstructiva, es oportuno poner sobre la mesa el concepto de EAC no obstructiva, con implicancias tanto pronósticas como terapéuticas.
Tal y como se menciona en una revisión del tema elaborada por Pepine y colaboradores, la EAC no obstructiva puede estar presente en pacientes con síntomas o signos de isquemia miocárdica en los cuales la enfermedad arteriosclerótica epicárdica no limita el flujo coronario a juzgar por la angiografía (estenosis menores a 50% o 70%, según qué definición de EAC no obstructiva se considere), pero en quienes otros procesos pueden entrar en juego y provocar isquemia(10).
Aunque años atrás fue aceptado que algunas condiciones fisiológicas distintas a la EAC obstructiva podían causar isquemia, la opinión prevalente de la época era que no tenía implicancias clínicas más allá de las propias asociadas a la condición subyacente (citando como ejemplos la estenosis aórtica y la cardiomiopatía hipertrófica). Este concepto actualmente ha cambiado(10). Recientes estudios ponen en evidencia isquemia sin EAC obstructiva. Por ejemplo, pacientes con angina crónica y tests funcionales positivos para isquemia no tenían enfermedad coronaria obstructiva demostrable en la angiografía, pero sí isquemia por resonancia nuclear magnética (RNM)(11). Asimismo, pacientes con pruebas funcionales positivas sin EAC obstructiva significativa eran asociados con buen pronóstico a corto plazo(12). En trabajos recientes, sin embargo, en pacientes con isquemia la EAC no obstructiva se asoció a resultados adversos en comparación con pacientes asintomáticos sin isquemia(13) y en comparación con pacientes con isquemia sin estenosis mayores a 20% en la angiografía(14).
En el trabajo elaborado por Bong-Ki Lee y colaboradores, publicado en Circulation en el año 2015(15), quienes estudiaron con métodos invasivos la circulación coronaria en pacientes con angina crónica en ausencia de EAC obstructiva, todos los pacientes tenían al menos aterosclerosis coronaria y un gran porcentaje presentaba enfermedad arterial oculta no diagnosticada en la coronariografía (definida como disfunción endotelial, disfunción microvascular y puentes miocárdicos).
Si este paciente presenta o no EAC no obstructiva es algo que desconocemos. Sin embargo, es portador de una anomalía a nivel de los vasos coronarios no epicárdicos. ¿Puede el hallazgo de microfístulas explicar los resultados de las pruebas funcionales?
Microfístulas
Las fístulas coronarias son consideradas una anomalía coronaria, de acuerdo a la definición de P. Angelini(16), porque están presentes en menos del 1% de la población. Consisten en la comunicación anormal entre una arteria coronaria y el lumen de alguna de las cuatro cavidades cardíacas, el seno coronario, vena cava superior, arteria pulmonar o venas pulmonares(17,18). Pueden ser de causa congénita (la gran mayoría) o adquirida (debidas a procedimientos invasivos como biopsia endomiocárdica, miomectomía septal, angioplastia coronaria o postraumáticas)(18,19). La incidencia angiográfica es de 0,02% a 2,1%(17).
Aunque no se mencionan en las publicaciones de Angelini, una entidad poco frecuente son las microfístulas hacia el VI, pequeñas fístulas que drenan a la cavidad ventricular izquierda. Su prevalencia es desconocida. De la base de datos de la Dutch Survey of coronary artery fistulas en la población adulta, de 71 pacientes con fístulas, 20 eran portadores de microfístulas múltiples desde las coronarias al VI(17). El diagnóstico se realiza mediante angiografía, observando la rápida opacificación de la cavidad del VI a través de las fístulas(19).
La clínica es inespecífica. La mayoría de los pacientes son asintomáticos, pero pueden ser causantes de ángor e infarto sin EAC epicárdica(17). Algunos trabajos han reportado evidencia que apoya el fenómeno de robo coronario como causa de isquemia subendocárdica(20,21). Dada la característica difusa de la anomalía se plantea el tratamiento médico conservador(17). En pacientes sintomáticos se ha logrado alivio con el uso de betabloqueantes o calcioantagonistas, así como también con nitratos(22).
Bibliografía
1. Chaitman BR. Prueba de esfuerzo. En: Bonow RO, Mann DL, Zipes DP, Libby P. Braunwald. Tratado de cardiología. Texto de medicina cardiovascular. 9na ed. Barcelona: Elsevier; 2013: 170-202.
2. Greenland P, Alpert JS, Beller GA, Benjamin EJ, Budoff MJ, Fayad ZA, et al. 2010 ACCF/AHA Guideline for assessment of cardiovascular risk in asymptomatic adults: a report of the American College of Cardiology Foundation/American Heart Association task force on practice guidelines. J Am Coll Cardiol. 2010;56(25):e50-103.
3. Arós F, Boraita A, Alegría E, Alonso AM, Bardají A, Lamiel R, et al. Guías de práctica clínica de la Sociedad Española de Cardiología en pruebas de esfuerzo. Rev Esp Cardiol 2000;53(8):1063-94.
4. Lauer M, Froelicher ES, Williams M, Kligfield P. Exercise Testing in Asymptomatic Adults: a statement for professionals from the American Heart Association Council on Clinical Cardiology, Subcommittee on Exercise, Cardiac Rehabilitation, and Prevention. Circulation 2005;112(5):771-6.
5. Laukkanen JA, Kurl S, Lakka TA, Tuomainen TP, Rauramaa R, Salonen R, et al. Exercise-induced silent myocardial ischemia and coronary morbidity and mortality in middle-aged men. J Am Coll Cardiol 2001;38(1):72-9.
6. Laukkanen JA, Mäkikallio TH, Rauramaa R, Kurl S. Asymptomatic ST-segment depression during excercise testing and the risk of SCD in middle aged men: a population-based follow-up study. Eur Heart J 2009;30(5):558–65.
7. Lerman J. Ergometría. En: Bertolasi CA, Barrero C, Gimeno G, Liniado G, Mauro V. Cardiología 2000. Buenos Aires: Editorial Médica Panamericana; 2000: 299-328
8. Gianrossi R, Detrano R, Mulvihill D, Lehmann K, Dubach P, Colombo A, et al. Exercise-Induced ST Depression in the Diagnosis of Coronary Artery Disease: A Meta-Analysis. Circulation 1989;80(1): 87-98.
9. Ellestad MH. Predictive implications. En:Ellestad MH. Stress testing: principles and practice. 5th ed. New York: Oxford University Press; 2003:271-307.
10. Pepine CJ, Ferdinand KC, Shaw LJ, Light-McGroary KA, Shah RU, Gulati M. Emergence of nonobstructive coronary artery disease. A woman’s problem and need for change in definition on angiography. J Am Coll Cardiol 2015;66(17): 1918-33.
11. Panting JR, Gatehouse PD, Yang GZ, Grothues F, Firmin DN, Collins P, et al. Abnormal subendocardial perfusion in cardiac syndrome X detected by cardiovascular magnetic resonance imaging. N Engl J Med 2002;346(25):1948–53.
12. Bemiller CR, Pepine CJ, Rogers AK. Long-term observations in patients with angina and normal coronary arteriograms. Circulation 1973;47(1):36-43.
13. Jespersen L, Hvelplund A, Abildstrøm SZ, Pedersen F, Galatius S, Madsen JK, et al. Stable angina pectoris with no obstructive coronary artery disease is associated with increased risks of major adverse cardiovascular events. Eur Heart J 2012;33(6): 734–44.
14. Maddox TM, Stanislawski M, Grunwald G, Bradley S, Ho PM, Tsai T, et al. Non-obstructive coronary artery disease is not benign: Insights from the VA CART program on the association between non-obstructive disease and cardiac events [abstract]. Circ Cardiovasc Qual Outcomes 2014;7:A24.
15. Lee BK, Lim HS, Fearon WF, Yong AS, Yamada R, Tanaka S, et al. Invasive evaluation of patients with angina in the absence of obstructive coronary artery disease. Circulation 2015;131(12):1054-60.
16. Angelini P. Coronary artery anomalies: an entity in search of an identity. Circulation 2007;115(10): 1296-305.
17. Said SAM, van der Werf T. Dutch survey of congenital coronary artery fistulas in adults: coronary artery-left ventricular multiple micro-fistulas multi-center observational survey in the Netherlands. Int J Cardiol 2006;110(1):33-9.
18. Mangukia CV. Coronary artery fistula. Ann Thorac Surg 2012;93(6):2084-92.
19. Durán A, Michelis V, Díaz P, Lujambio M, Kuster F, Lluberas R, et al. Evaluación de pacientes portadores de fístulas coronario-ventriculares múltiples. Rev Med Urug 2003; 19(3):237-41.
20. Oshiro K, Shimabukuro M, Nakada Y, Chibana T, Yoshida H, Nagamine F, et al. Multiple coronary LV fistulas: demonstration of coronary steal phenomenon by stress thallium scintigraphy and exercise hemodynamics. Am Heart J 1990;120(1): 217-9.
21. Cottier C, Kiowski W, von Bertrab R, Pfisterer M, Burkart F. Multiple coronary arteriocameral fistulas as a cause of myocardial ischemia. Am Heart J 1988;115(1Pt.1):181-4.
22. Wolf A, Rockson SG. Myocardial ischemia and infarction due to multiple coronary-cameral fistulae: two case reports and review of the literature. Cathet Cardiovasc Diagn. 1998;43(2):179-83.