Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
Print version ISSN 0797-0048On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.31 no.2 Montevideo Aug. 2016
Artículo original
Rev Urug Cardiol 2016; 31
La ateromatosis aórtica aumenta el riesgo de ataque cerebrovascular isquémico
Dres. Lucía Florio (1), Carlos Américo(2), Fabián Martínez(3), Gabriel Parma(4),
Natalia Lluberas(5), Arturo Pazos(6), Ana Fajardo(7), Andrés Gaye(8), Cecilia Legnani(9), Claudia Camejo(10).
1. Departamento de Cardiología. Unidad de Accidente Cerebro Vascular. Centro Cardiovascular Universitario. UdelaR.
Correo electrónico: lu.florio@gmail.com
Recibido May 11, 2016; aceptado Jul 25, 2016.
Resumen
Antecedentes: el ataque cerebrovascular isquémico (ACVi) es causa de mortalidad y discapacidad importante en adultos, siendo la cardioembolia, sobre todo por fibrilación auricular (FA), una etiología importante. Se conocen otras etiologías, cardíacas y no cardíacas, que no siempre pueden definirse, refiriéndose como probables o posibles de cardioaortoembolia. El rol de alguna de ellas, como la ateromatosis aórtica (AA), continúa siendo discutido.
Objetivo: analizar fuentes posibles de cardioaortoembolia en pacientes con ACVi reciente.
Material y método: estudio caso-control. Se analizaron 100 sujetos con ACVi de menos de 30 días de evolución estudiados prospectivamente con ecocardiograma transesofágico (ETE), entre febrero de 2012 y marzo de 2014. Se apareó cada caso según edad, sexo, presencia de flutter/FA y ausencia de prótesis valvular cardíaca, con un control que se buscó retrospectiva y aleatoriamente entre sujetos con ETE estudiados entre 2010 y 2015 sin ACVi. Se compararon variables binarias mediante test de McNemar y las cuantitativas por test de t pareado; se realizó regresión logística múltiple para ACVi con variables clínicas y hallazgos de ETE y p < 0,1 en el análisis univariado. Se consideró significativo p < 0,05. Variables cuantitativas se expresan en media y desvío estándar (DE) y nominales en valor absoluto y porcentaje, índice de probabilidad (OR) en su valor e intervalo de confianza (IC) 95%.
Resultados: se formaron finalmente 76 pares caso-control. Edad casos: 64,3±1,4 y control 64,9±1,3 años (p=0,19); 39 mujeres (51,3%) y 15 sujetos (19,7%) con flutter/FA en cada grupo (p=1). No hubo diferencias significativas según factores de riesgo cardiovascular (FRCV) globales (p=0,06) ni alcoholismo (p=0,80); se encontraron diferencias significativas en la prevalencia de dislipemia (p=0,03) e hipertensión arterial (HTA) (p <0,05). Las indicaciones principales del ETE en los controles fueron: previo a cardioversión eléctrica de FA, sospecha de endocarditis, y valoración de valvulopatía mitral. La ateromatosis aórtica proximal y compleja (AAPC) (p=0,002, OR 5,5, IC95% 1,9-15,9) y la AA en forma global (p=0,001, OR 4,1, IC95% 1,8-9,3), además de la dislipemia (p=0,02, OR 2,8 IC95% 1,2-6,4), se asociaron significativamente con la presencia de ACVi en el análisis multivariado.
Conclusión: la AA aumenta significativamente las chances de ACVi y las quintuplica cuando es proximal y compleja. La dislipemia se asoció a ACVi.
Palabras clave:
ACCIDENTE CEREBROVASCULAR
ATEROSCLEROSIS
ECOCARDIOGRAFÍA TRANSESOFÁGICA
Aortic atheromatosis increases the risk of ischemic stroke
Summary
Background: Ischemic stroke is an important cause of death and disability in adults; cardio-embolism especially due to atrial fibrillation is a major cause of cerebrovascular attack. Other cardiac and non-cardiac causes are known but it is not always possible to establish etiology. There are probable and possible sources of cardio-embolism. The causal role of some possible etiologies as aortic atheromatosis remains discussed.
Objective: To analyze possible sources of cardio-aortoembolism in acute ischemic cerebrovascular attack patients.
Method: Study Design: Case-control. 100 subjects with ischemic cerebrovascular attack and less than 30 days from diagnosis were prospectively studied with transesophageal echocardiography between February 2012 and March 2014. They were matched by age, sex and presence of flutter / atrial fibrillation and absence of cardiac valvar prosthesis. Each control was recruited randomly and looking back among subjects without history of cerebrovascular disease, with transesophageal echocardiography previously studied between 2010 and 2015. Binary variables were compared using the McNemar test and quantitative by paired test of t, multiple logistic regression was performed with ischemic stroke as outcome, taking in consideration clinical variables and echocardiographic findings. Quantitative variables are expressed as media and standard deviation and nominal as its percentage value, association value as odds ratio (OR), value and 95% confident interval (CI 95%) Results: 76 case-control pairs were finally included. Cases´ age: 64.3 ± 1.4 years and controls´ 64.9 ± 1.3 (p=0.19). 39 women (51.3%) and 15 (19.7% subjects) with flutter / atrial fibrillation in each group (p=1). No significant differences were found about global cardiovascular risk factors (p=0.06) or alcoholism (p=0,80); significant differences in the prevalence of dyslipidemia and hypertension (p=0.03; 0.05) were found. Main reasons for transesophageal echocardiography in controls were: for cardioversion of atrial fibrillation, suspected endocarditis and mitral valve rating. Proximal and complex aortic atheromatosis (p=0,002, OR 5,5, IC95% 1,9-15,9), and aortic atheromatosis in general (p=0,001, OR 4,1, IC95% 1,8-9,3) and dyslipidemia (p=0,02, OR 2,8 IC95% 1,2-6,4), were significantly associated with the presence of ischemic cerebrovascular attack in multivariate analysis.
Conclusion: Aortic atheromatosis significantly increases the risk of ischemic stroke, five times when proximal and complex. Dyslipidemia is associated with ischemic cerebrovascular attack.
Key words:
STROKE
ATHEROSCLEROSIS
ECHOCARDIOGRAPHY TRANSESOPHAGEAL
Introducción
El ataque cerebrovascular (ACV) es la segunda causa de muerte en adultos en Uruguay y la primera de discapacidad(1). La incidencia de casos en Uruguay se estima en 181/100.000 habitantes por año(2).
El 80% de los ACV son isquémicos(3) (ACVi), siendo 20%-30% de causa cardioembólica, y dentro de ella, la fibrilación auricular (FA) es la entidad principal, sobre todo en la población más añosa(4). Sin embargo, hay una diversidad de etiologías de ACVi, tanto de origen cardíaco como extracardíaco, que no siempre es posible definir(5). La clasificación TOAST(5) contempla cinco situaciones posibles: aterosclerosis de grandes arterias, cardioembolismo, oclusión de pequeño vaso o infarto lacunar, ACVi de otra etiología determinada y ACVi de etiología indeterminada (dos o más causas determinadas, evaluación negativa o evaluación incompleta). Es una clasificación clínica, apoyada en estudios complementarios, útil para el neurólogo para aproximarse al diagnóstico etiológico.
Se ha considerado la aorta torácica como fuente de ACVi integrando el grupo amplio de las cardioaortoembolias. En relación con el lugar de origen de la cardioaortoembolia, Otto clasifica los hallazgos ecocardiográficos en causas probables o posibles(6). El rol causal de la ateromatosis aórtica proximal y compleja (AAPC), que tiene una prevalencia de 20%-30% en pacientes con ACVi reciente(7), continúa siendo discutido, y si bien se la considera causa posible de embolia encefálica, no está mencionada específicamente en la clasificación de TOAST, que considera la ateromatosis de grandes arterias como la de los vasos de cuello.
Trabajos nacionales(8) de diseño caso-control no apareado han destacado la asociación significativa de la ateromatosis aórtica (AA) con el ACVi, lo que es refrendado por trabajos internacionales(9) que marcan la importancia de detectar AA en el stroke isquémico con una prevalencia de ateromatosis del arco aórtico de 21%-27% en estudios de diseño caso-control.
Se considera proximal la presencia de placas de ateroma en aorta ascendente y cayado, y compleja la que presenta un componente móvil (debris), está ulcerada o es protruyente (³ 5 mm). El rol de otras causas posibles, en contraposición con las probables (concepto que surgiendo de la clasificación TOAST es tomado por Otto para clasificar los hallazgos ecardiográficos [anexo 1]), también es controversial, no quedando claro si representan verdaderas causas o simples asociaciones, como es el caso de la calcificación del anillo mitral o del aneurisma del septum interauricular (ASIA).
Objetivo
Es objetivo del presente trabajo analizar causas posibles de cardioaortoembolia en pacientes con ACVi reciente y buscar asociaciones significativas entre hallazgos ecocardiográficos y el ACVi, para así profundizar en planteos etiológicos.
Material y método
Se trata de un estudio caso-control. Se incluyeron 100 sujetos con ACVi de menos de 30 días de evolución estudiados prospectivamente con ecocardiograma transtorácico (ETT) y ecocardiograma transesofágico (ETE) entre febrero de 2012 y marzo de 2014 (casos). Se aplicaron protocolos de registro de los factores de riesgo cardiovascular (FRCV), presentación y etiología del ACVi (clasificación de TOAST).
Cardiólogos de la unidad de imagen con al menos nivel II de entrenamiento para ETT y ETE, según ECOSIAC(10), realizaron ambos estudios siguiendo criterios diagnósticos preestablecidos para hallazgos principales (anexo 2) durante el ingreso hospitalario. Se utilizó un ecógrafo Siemens Sequoia C512, trasductor transtorácico de 4 Mhz y sonda transesofágica de 7 Mhz.
Cada caso se apareó con un control sin antecedentes de ACVi, según década de la vida, sexo, presencia o no de flutter/FA y ausencia de prótesis valvular cardíaca. Se realizó una búsqueda retrospectiva entre 951 ETE realizados entre usuarios del Hospital de Clínicas por cualquier motivo entre 2010 y 2015. Se excluyeron de la randomización 283 ETE que fueron remitidos para estudio de ACVi más los 100 casos del estudio, quedando 568 registros que fueron colocados en un orden preferencial para formar los controles, según software generador de números aleatorios.
La AA se clasificó en: 1-AAPC y 2-AA (que incluye la ateromatosis aórtica general, o sea ateromatosis aórtica de cualquier tipo y de cualquier topografía, excluyendo solamente la proximal y compleja, con supuesto potencial embolígeno encefálico).
Se compararon hallazgos del ETE (variable nominal) mediante test de McNemar y las variables cuantitativas por test de t pareado. Para el manejo de confundentes se utilizó el apareo propiamente dicho y se realizó una regresión logística incluyendo variables clínicas y hallazgos de ETE que mostraran una asociación con p < 0,1 para presentar ACVi en el análisis univariado. Se consideró como significativa una p < 0,05. Las variables cuantitativas se expresan en media y desvío estándar (DE) y las nominales en valores absolutos y porcentaje, odds ratio (OR) en su valor e intervalo de confianza (IC) 95%. El análisis estadístico se realizó con STATA 13.
Resultados
De los 100 casos incluidos, a ocho no se les encontró su par de control que cumpliera los requisitos de edad, sexo y ritmo, 16 controles fueron excluidos tras formar el par por tener antecedente de ACV registrado en su historia. Se formaron finalmente 76 pares casos-controles (152 sujetos). La edad de los casos fue de 64,3±1,4 años y de los controles de 64,9±1,3 años (p=0,19). La distribución según sexos fue de 39 mujeres (51,3%) en cada grupo (p=1); según ritmo cardíaco, 15 sujetos (19,7%) con flutter/FA en cada grupo (p=1); de acuerdo con la forma de apareamiento. No se encontraron diferencias significativas según prevalencia de FRCV como variable global (p=0,06) ni en la prevalencia de alcoholismo (p=0,80). Sin embargo, la dislipemia y la hipertensión arterial (HTA) fueron significativamente más prevalentes en los pacientes con ACVi (p=0,03 y p=0,05). Las indicaciones más frecuentes de ETE en los controles fueron: diagnóstico de trombos intracavitarios precardioversión de flutter/FA, sospecha de endocarditis infecciosa, y valoración morfológica y funcional de la válvula mitral.
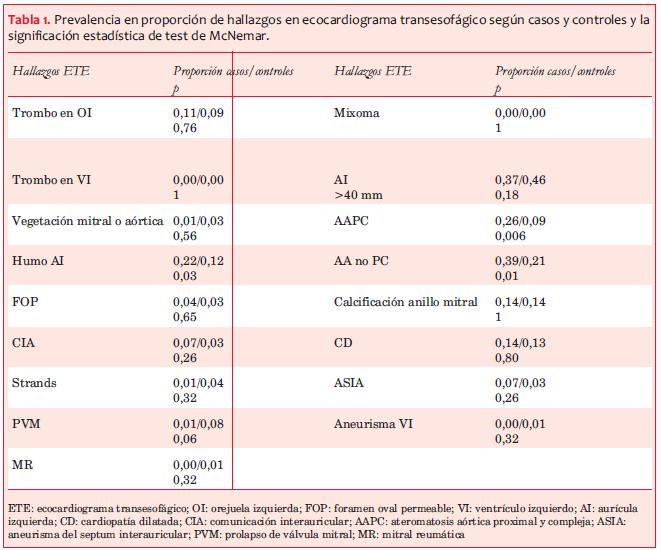
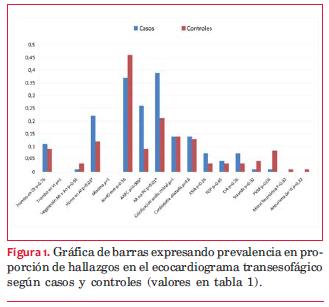
En el análisis univariado se encontró una prevalencia significativamente mayor en los pacientes con ACVi de ecogenicidad espontánea del flujo sanguíneo (humo) en la aurícula izquierda (p=0,03); de AA en general excluyendo la AAPC (p=0,01), y de AAPC en particular (p=0,006) (tabla 1 y figura 1).
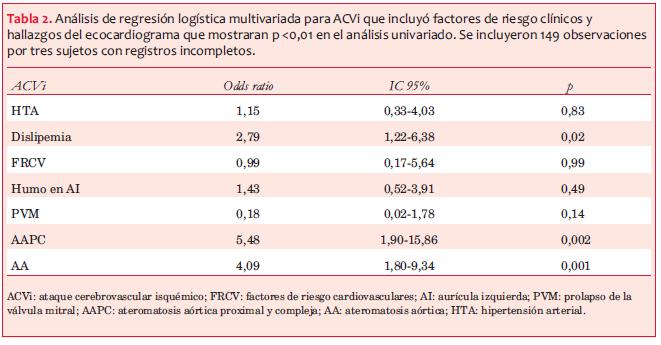
En la regresión logística multivariada la dislipemia (p=0,02, OR 2,79 IC95% 1,22- 6,38), la AA (p=0,001, OR 4,09, IC95% 1,80-9,34) y la AAPC (p=0,002, OR 5,48 IC95% 1,90-15,86) mostraron diferencias significativas (tabla 2).
Discusión
De acuerdo a los resultados obtenidos, el hallazgo de AA (excluyendo la proximal y compleja) cuadruplica las chances de sufrir un ACVi y la AAPC las quintuplica, mientras que la dislipemia se comportó como un FRCV que en forma independiente se relaciona con el riesgo de ACVi elevando las chances de sufrirlo. Destacamos además la importancia de contar con datos actuales y nacionales respecto a esta patología de alta prevalencia, que integran una línea de investigación sobre el rol del ETE en el paciente con ACVi(7,11).
La AAPC tiene alta prevalencia en la población con ACVi de cualquier etiología, siendo de 26% en nuestra cohorte. En un estudio de 2005, realizado en el Hospital Pasteur, se comunicó una prevalencia de AAPC de 35% en una población con ACVi presumiblemente debido a cardioaortoembolia(12), un resultado comparable al del presente trabajo y de relevancia para la búsqueda y el tratamiento de la AA en este escenario. La menor prevalencia encontrada en nuestros pacientes presumimos que se deba a la inclusión más amplia de sujetos que presentaron otras etiologías de ACVi, como arteriopatía de vasos de cuello, de pequeño vaso y otras, incluyendo la cardioaortoembolia.
El aumento del riesgo de la AAPC para presentar un ACVi parece estar bien documentado en la literatura(13,14). Nuestros resultados coinciden con los de otros autores que describen un OR de 6,0 y de 3,2 en hombres y mujeres con AAPC, respectivamente(11), y un metaanálisis reciente(15) que incluyó un total de 3.918 pacientes con ateromatosis del arco aórtico y establece un OR de 3,9 para presentar ACVi en aquellos con ateromatosis de arco aórtico complicada (úlcera y/o debris) y protruyente.
Además, se considera la AA como causa altamente probable de ACVi recurrente. Pujadas y colaboradores describen una prevalencia de AAPC de 88,4% en pacientes con ACVi recurrente al año vs 21,1% en una población con ACVi sin recurrencia al año(16). Nuevamente se resalta la importancia de la evaluación del ACVi mediante ETE, pues el hallazgo de AA compleja tendría un valor predictivo de recurrencias y un adecuado tratamiento podría tener impacto clínico significativo. El tratamiento de la AA no es un tema saldado, discutiéndose el beneficio de la antiagregación, la anticoagulación y las estatinas(18-20). En un estudio observacional retrospectivo, en pacientes con AA torácica severa, Tunick y colaboradores analizaron el efecto de los tres tratamientos sobre la incidencia de ACV o embolia periférica, y encontraron un efecto protector de las estatinas que disminuyeron significativamente la incidencia de eventos, mientras que ni los antiagregantes ni los anticoagulantes mostraron beneficios significativos(20).
La dislipemia es un conocido factor de riesgo para el desarrollo de enfermedad arterial coronaria y periférica, sin embargo su asociación con el ACVi no es tan clara. El tratamiento con estatinas ha demostrado disminuir el riesgo relativo de ACVi en pacientes con alto riesgo cardiovascular y mejorar la evolución del ACVi reciente(21), aunque la evidencia no es tan fuerte como en la cardiopatía isquémica.
Existen otras fuentes posibles de cardioembolia, como la calcificación del anillo mitral(22), el foramen oval permeable (FOP)(23), el ASIA(24) y los strands(25). Todas estas patologías se han relacionado de una manera no clara con riesgo embolígeno y de ACVi. Sin embargo, no está definido el riesgo concreto de ACVi o su recurrencia, ni la terapia que corresponde instaurar. De acuerdo a los resultados obtenidos en el presente trabajo, estos hallazgos ecocardiográficos no se relacionaron con un aumento de las chances de tener un ACVi y parecen corresponder más a una asociación lesional, de riesgo cardiovascular general y vinculados a la edad, como es el caso de la calcificación mitral y los strands, o a un hallazgo sin vínculo causal o con un vínculo muy débil, como el caso del ASIA y el FOP. Recordamos que tanto el ASIA(24), el FOP(23) y los strands(25) han mostrado un aumento del riesgo de ACVi solamente en los más jóvenes (menores de 55 años), quizá por eso en nuestra cohorte más añosa los resultados no han sido significativos. Nuestros resultados mostraron una asociación (aunque no significativa) del prolapso de la válvula mitral con los controles que podría explicarse por un sesgo de selección de los controles.
La asociación encontrada entre el ACVi y la AA podría deberse a la existencia de una enfermedad vascular más severa en los pacientes con ACVi respecto a los controles y no a un efecto causal. Un metaanálisis reciente de estudios observacionales apoya esta posición(26).
Este trabajo y otros similares han abierto la discusión respecto a la necesidad de incluir obligatoriamente a la AAPC como una de las posibles causas de ACVi. Las academias norteamericana y europea de neurología se encuentran analizando cambios en la clasificación etiológica TOAST para el ACVi con el fin de incluir globalmente la AA dentro del grupo otras ateromatosis o directamente integrando las cardioaortoembolias. Esto tendrá seguramente impacto en la práctica clínica al estimular su búsqueda en cada paciente individual con ACVi y al mismo tiempo considerar la necesidad de tratamiento específico para la misma; muy especialmente en el stroke criptogenético. Su prevalencia, las características de las placas por su tamaño, espesor, ulceraciones y trombos móviles se transforman en factores de riesgo para embolia arterio-arterial, lo que además permitirá un abordaje terapéutico acorde.
Es intención del equipo investigador continuar con la presente línea de trabajo mediante un estudio de cohorte que investigue la incidencia de ACVi en pacientes con AA compleja, así como para profundizar en las relaciones entre la AA compleja y las diferentes posibles etiologías de los ACVi.
Limitaciones
Si bien el número de casos es relativamente bajo, lo consideramos apropiado para el diseño del estudio. Como en todo trabajo observacional el manejo de las variables de confusión es un desafío, se ha intentado optimizar el análisis a través del análisis logístico múltiple; el componente retrospectivo del trabajo (controles) se relaciona con ausencia de sistematización y pérdida de datos a la hora de la recolección de los mismos. Considerando el diseño, el criterio de apareamiento de casos-controles y las variables utilizadas para el mismo (edad, sexo, FA/flutter y prótesis) que fueron por definición eliminadas del análisis, no es posible definir por este estudio que la FA o la edad avanzada sean factores de riesgo para ACVi.
Conclusiones
La AA y particularmente la AAPC aumentan las chances de presentar un ataque cerebrovascular isquémico.
Bibliografía
1. Comisión Honoraria para la Salud Cardiovascular. Área de Epidemiología y Estadística. Mortalidad por enfermedades cardiovasculares en el Uruguay 2008. Montevideo: CHSC; 2010.
2. Hochmann B, Coelho J, Segura J, Galli M, Ketzoian C, Pebet M. Incidencia del accidente cerebrovascular en la ciudad de Rivera, Uruguay. Rev Neurol. 2006;43(2):78-83.
3. Castillo J, Zarranz JJ, Larracoechea J. Enfermedades vasculares cerebrales. En: Zarranz JJ. Neurología. 3 ed. Madrid: Elsevier; 2004. p357-435.
4. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991;22:983-88.
5. Adams HPJr, Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke 1993; 24:35-41.
6. Chen EW, Redberg RF. Evaluaciónecocardiográfica de pacientes con episodiosembólicossistémicos. En: Otto CM. Ecocardiografía clínica práctica. 3 ed. Barcelona: Elsevier; 2010. p969-98.
7. Martínez F, Florio L, Camejo C, Pazos A, Gaye A, Fajardo A, et al. Prevalencia de ateromatosis aórtica compleja en una población con accidente cerebrovascular isquémico. [abstract] Rev Urug Cardiol 2013;27 Supl1:S37-8.
8. Beltrán A, González Moreno J, Pizzano N, Pouso J, Besada E. Ateromatosis protuyente de la aorta torácica proximal: uno de los factores de riesgo más marcados de los accidentes cerebrovasculares isquémicos. Rev Urug Cardiol 1995;10:62-72.
9. Tunick PA, Kronzon I. Atheromasof the thoracic aorta: clinical and therapeutic update. JACC 2000;35:545-54.
10. Restrepo G, Lowenstein J, Gutiérrez Fajardo P, Paz Ardaya A, Vieira MLC, Spina S, et al. Guías de acreditación en ecocardiografía del adulto y del laboratorio de ecocardiografía de la Asociación de Ecocardiografía de la Sociedad Interamericana de Cardiología. Rev Urug Cardiol
2010;25:47-63.
11. Florio L, Martínez F, Parma G, Lluberas N, Pazos A, Fajardo A, et al. Relevancia clínica del ecocardiograma transesofágico en pacientes con ataque cerebrovascular isquémico. Estudio observacional, analítico. Rev Urug Cardiol 2015;30:39-46.
12. Dufrechou C, Perendones M, Passos M, Arbelo V, Segovia F, Tenaglia K, et al. Análisis de una población con “stroke” cardio-aortoembólico. 34o Congreso Nacional de Medicina Interna; 2005 29 nov-2 dic; Montevideo, UY. Montevideo: IMM.
13. Di Tullio MR, Sacco RL, Savoia MT, Sciacca RR, Homma ES. Gender differences in the risk of ischemic stroke associated with aortic atheroma morphology and the risk of ischemic stroke in a multiethnic population. Stroke 2000;31:2623-7.
14. Jones EF, Kalman JM, Calafiore P, Tonkin AM, Donnan GA. Proximal aortic atheroma. An independent risk factor for cerebral ischemia. Stroke 1995;26(2):218-24.
15. Cui X, Li C, Liu J, He S, Liu M. Aortic arch atheroma and the risk of stroke: a meta-analysis. J Evid Based Med 2014;7:185-91.
16. Pujadas R, Arboix A, Anguera N,Oliveres M, Massons J, Comes E. Papel de las placas complejas de ateroma aórtico en la recurrencia del infarto cerebral de etiología incierta. Rev Esp Cardiol 2005; 58:34-40.
17. Dressler FA, Craig WR, Castello R, Labovitz AJ. Mobile aortic atheroma and systemic emboli: efficacy of anticoagulation and influence of plaque morphology on recurrent stroke. J Am Coll Cardiol 1998;31:134–8.
18. The Stroke Prevention in Atrial Fibrillation Investigators Committee on Echocardiography. Transesophageal echocardiography correlates of thromboembolism in high-risk patients with nonvalvular atrial fibrillation. Ann Intern Med 1998;128:639–47.
19. Ferrari E, Vidal R, Chevallier T, Baudouy M. Atherosclerosis of the thoracic aorta and aortic debris as a marker of poor prognosis: benefit of oral anticoagulants. J Am Coll Cardiol 1999;33:1317–22.
20. Tunick PA, Nayar AC, Goodkin GM, Mirchandani S, Francescone S, Rosenzweig BP, et al, NYU Atheroma Group. Effect of treatment on the incidence of stroke and other emboli in 519 patients with severe thoracic aortic plaque. Am J Cardiol 2002; 90: 1320–5.
21. Vivancos-Mora J, Gil-Núñez AC. Lipids and stroke: The opportunity of lipid-lowering treatment. Cerebrovasc Dis 2005;20(suppl 2):53–67.
22. Benjamin EJ, Plehn JF, D’Agostino RB, Belanger AJ, Comai K, Fuller DL, et al. Mitral annular calcification and the risk of stroke in an elderly cohort. N Engl J Med 1992; 327:374-9.
23. Lechat P, Mas JL, Lascault G, Loron P, Theard M, et al. Prevalence of patent foramen ovale in patients with stroke. N Engl J Med 1988; 318: 1148-52.
24. Overell JR, Bone I, Lees KR. Interatrial septal abnormalities and stroke. A meta-analysis of case-control studies. Neurology 2000;55:172-9.
25. Roberts JK, Omarali I, Di TullioMR, Sciacca RR, Sacco RL, Homma S. Valvular strands and cerebral ischemia.Effect of demographics and strand characteristics. Stroke 1997; 8: 2185-8.
26. Katsanos AH, Giannopoulos S, Kosmidou M, Voumvourakis K, Parissis JT, Kyritsis AP, et al. Complex atheromatous plaques in the descending aorta and the risk of stroke. A systematic review and meta-analysis. Stroke 2014;45:1764-70.
Anexo 2. Criterios de diagnóstico ecocardiográfico utilizados
Contraste espontáneo
- Ecogenicidad evanescente con aspecto de humo intracavitario.
Trombo en aurícula/orejuela izquierda
- Ecogenicidad con bordes relativamente bien definidos con base en pared de aurícula izquierda u orejuela izquierda, con algún movimiento perceptible.
- Ecogenicidad diferente a la de la pared.
- Sin evidencia de flujo en su interior.
- Contraste espontáneo persistente (más de ocho ciclos cardíacos), se consideró de igual valor a las tres premisas anteriores.
Ateromatosis aórtica
- Simple: engrosamiento difuso de la íntima mayor a 2 mm; engrosamiento protruyente de la íntima/media £ 4 mm.
- Compleja: engrosamiento protruyente de la íntima/media > 4 mm o irregularidad del borde luminal del engrosamiento con una profundidad hacia la media ³ 2 mm (úlcera) o componente móvil asociado al engrosamiento intimal (debris).
Aneurisma del septum interauricular
- Excursión del septum interauricular ³ 11 mm durante el ciclo cardíaco involucrando una extensión del septum ³ 15 mm.
Foramen oval permeable derecha a izquierda
- Evidencia de shunt de derecha a izquierda en la topografía del ostium secundum con maniobra de Valsalva y morfología sin solución de continuidad fuera de esta maniobra (diagnóstico de comunicación interauricular). Se realizó en todos los pacientes maniobra de suero batido para aumentar la sensibilidad del diagnóstico. Se consideró positiva la presencia de burbujas en la AI dentro de los tres primeros latidos posinyección de contraste y con maniobra de Valsalva.
Vegetación
- Masa relacionada a las válvulas y sus aparatos subvalvulares, prótesis valvulares, implantes intracardíacos o en el trayecto de jets regurgitantes, con movimiento independiente, en ausencia de una explicación anatómica alternativa y cuadro clínico compatible con endocarditis infecciosa.
Strand
- Masa filiforme única o múltiple, de 5-10 mm de longitud, asociada a las válvulas o prótesis valvulares en ausencia de cuadro clínico compatible con endocarditis infecciosa.
Anexo 1. Clasificación ecocardiográfica de fuentes de cardioaortoembolia(6)
Fuente probable del émbolo
- Trombo auricular izquierdo
- Trombo en el ventrículo izquierdo
- Vegetación mitral o aórtica (mayor 10 mm)
- Mixoma
Fuente posible del émbolo
- Foramen oval permeable (FOP)
- Aneurisma del tabique interauricular (ASIA)
- Auriculomegalia izquierda (mayor a 40 mm)
- Ateroma aórtico
- Prótesis mitral o aórtica
- Valvulopatía mitral reumática
- Calcificación anular mitral
- Comunicación interauricular (CIA)
- Filamentos valvulares fibrinosos (strands)
- Prolapso de la válvula mitral (PVM)
- Vegetación (menor a 10 mm)
- Aneurisma del ventrículo izquierdo
- Miocardiopatía dilatada
Anexo 2. Criterios de diagnóstico ecocardiográfico utilizados
Contraste espontáneo
- Ecogenicidad evanescente con aspecto de humo intracavitario.
Trombo en aurícula/orejuela izquierda
- Ecogenicidad con bordes relativamente bien definidos con base en pared de aurícula izquierda u orejuela izquierda, con algún movimiento perceptible.
- Ecogenicidad diferente a la de la pared.
- Sin evidencia de flujo en su interior.
- Contraste espontáneo persistente (más de ocho ciclos cardíacos), se consideró de igual valor a las tres premisas anteriores.
Ateromatosis aórtica
- Simple: engrosamiento difuso de la íntima mayor a 2 mm; engrosamiento protruyente de la íntima/media £ 4 mm.
- Compleja: engrosamiento protruyente de la íntima/media > 4 mm o irregularidad del borde luminal del engrosamiento con una profundidad hacia la media ³ 2 mm (úlcera) o componente móvil asociado al engrosamiento intimal (debris).
Aneurisma del septum interauricular
- Excursión del septum interauricular ³ 11 mm durante el ciclo cardíaco involucrando una extensión del septum ³ 15 mm.
Foramen oval permeable derecha a izquierda
- Evidencia de shunt de derecha a izquierda en la topografía del ostium secundum con maniobra de Valsalva y morfología sin solución de continuidad fuera de esta maniobra (diagnóstico de comunicación interauricular). Se realizó en todos los pacientes maniobra de suero batido para aumentar la sensibilidad del diagnóstico. Se consideró positiva la presencia de burbujas en la AI dentro de los tres primeros latidos posinyección de contraste y con maniobra de Valsalva.
Vegetación
- Masa relacionada a las válvulas y sus aparatos subvalvulares, prótesis valvulares, implantes intracardíacos o en el trayecto de jets regurgitantes, con movimiento independiente, en ausencia de una explicación anatómica alternativa y cuadro clínico compatible con endocarditis infecciosa.
Strand
Anexo 2. Criterios de diagnóstico ecocardiográfico utilizados
Contraste espontáneo
- Ecogenicidad evanescente con aspecto de humo intracavitario.
Trombo en aurícula/orejuela izquierda
- Ecogenicidad con bordes relativamente bien definidos con base en pared de aurícula izquierda u orejuela izquierda, con algún movimiento perceptible.
- Ecogenicidad diferente a la de la pared.
- Sin evidencia de flujo en su interior.
- Contraste espontáneo persistente (más de ocho ciclos cardíacos), se consideró de igual valor a las tres premisas anteriores.
Ateromatosis aórtica
- Simple: engrosamiento difuso de la íntima mayor a 2 mm; engrosamiento protruyente de la íntima/media £ 4 mm.
- Compleja: engrosamiento protruyente de la íntima/media > 4 mm o irregularidad del borde luminal del engrosamiento con una profundidad hacia la media ³ 2 mm (úlcera) o componente móvil asociado al engrosamiento intimal (debris).
Aneurisma del septum interauricular
- Excursión del septum interauricular ³ 11 mm durante el ciclo cardíaco involucrando una extensión del septum ³ 15 mm.
Foramen oval permeable derecha a izquierda
- Evidencia de shunt de derecha a izquierda en la topografía del ostium secundum con maniobra de Valsalva y morfología sin solución de continuidad fuera de esta maniobra (diagnóstico de comunicación interauricular). Se realizó en todos los pacientes maniobra de suero batido para aumentar la sensibilidad del diagnóstico. Se consideró positiva la presencia de burbujas en la AI dentro de los tres primeros latidos posinyección de contraste y con maniobra de Valsalva.
Vegetación
- Masa relacionada a las válvulas y sus aparatos subvalvulares, prótesis valvulares, implantes intracardíacos o en el trayecto de jets regurgitantes, con movimiento independiente, en ausencia de una explicación anatómica alternativa y cuadro clínico compatible con endocarditis infecciosa.
Strand
- Masa filiforme única o múltiple, de 5-10 mm de longitud, asociada a las válvulas o prótesis valvulares en ausencia de cuadro clínico compatible con endocarditis infecciosa.
- Masa filiforme única o múltiple, de 5-10 mm de longitud, asociada a las válvulas o prótesis valvulares en ausencia de cuadro clínico compatible con endocarditis infecciosa.