Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
Print version ISSN 0797-0048On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.31 no.2 Montevideo Aug. 2016
Artículo original
Rev Urug Cardiol 2016; 31
Riesgo cardiovascular en la enfermedad renal crónica
Dres. Ana Karina Subiza1, Mariela Odriozola2, Pablo Ríos3,
Verónica Lamadrid4,5, Nelson Mazzuchi5, Liliana Gadola6, en nombre de los nefrólogos que reportan al Programa de Salud Renal del Uruguay (ver anexo 1)
1. COMERO-IAMPP (Rocha).
2. COMEPA y ASSE (Paysandú).
3. Programa de Salud Renal del Uruguay (Fondo Nacional de Recursos).
4. COMECA (Canelones).
5. Comisión Asesora del Programa de Salud Renal del Uruguay.
6. Universidad de la República.
Correspondencia: Liliana Gadola. Correo electrónico: lilianagad@gmail.com
Recibido Abr 28, 2016; aceptado Jul 28, 2016.
Resumen
La enfermedad renal crónica (ERC) tiene elevada prevalencia y morbimortalidad cardiovascular (CV).
Objetivos: analizar la prevalencia de factores de riesgo y tratamientos en la población del Programa de Salud Renal del Uruguay (PSRU) y su asociación con eventos CV y supervivencia.
Método: estudio retrospectivo de la cohorte del registro del PSRU, que representa 58% de la población del país, entre 29/9/2006 y 31/12/2014. Los criterios de inclusión son: personas ³ 20 años, con alteraciones renales por más de tres meses, filtrado glomerular estimado (FGe) < 60 ml/min/1,73 m2 o proteinuria >300 mg/día o albuminuria >30 mg/día en diabéticos, con seis o más meses en control. Se incluye registro de nuevos eventos cardiovasculares (NECV), ingreso a tratamiento de sustitución renal (TSR) y fallecimientos.
Resultados: se incluyeron 8.407 individuos, edad 68 ± 14 años, 56% hombres, 66,6% > 65 años. Se observó elevada prevalencia de factores de riesgo CV. Se reportaron 2.245 NECV no fatales en 1.439 individuos (18,9%), tasa 10,1 por 100 pacientes-año (pac-año). Fallecieron 1.380 pacientes, 32,7% de causa CV. La tasa de ingreso a tratamiento de sustitución renal (TSR) fue de 1,94, la de mortalidad global de 6,2 y de causa CV de 2,03 por 100 pac-año. Se demostró la asociación de NECV y mortalidad con factores de riesgo tradicionales y vinculados a ERC, así como disminución con control glucídico y tratamiento con inhibidores de la enzima convertidora de angiotensina (IECA).
Conclusiones: la población con ERC presenta múltiples factores de riesgo CV con elevada morbimortalidad, lo que amerita detección precoz y tratamiento.
Palabras clave:
ENFERMEDAD RENAL CRóNICA
FACTORES DE RIESGO
PREVALENCIA
URUGUAY
Cardiovascular risk in chronic kidney disease
Summary
Chronic kidney disease (CKD) is a highly prevalent condition with high cardiovascular morbidity and mortality.
Objectives: the aim of the study was to analyze risk factors and treatments in the Uruguayan National Renal Healthcare Program (NRHP) and their association with cardiovascular events (CVE) and survival.
Methods: this is a cohort study of patients included in the Uruguayan NRHP Registry, from 29/9/2006 to 31/12/2014. The inclusion criteria were age ³ 20 years, kidney disease for more than 3 months, estimated glomerular filtration rate (eFG) < 60 ml/min/1.73 m2 and/or proteinuria >300 mg/day or albuminuria >30 mg/day in diabetics, with ³ 6 months under surveillance. The end-points were a new CV event, renal replacement therapy (RRT) or death.
Results: 8.407 patients were included, mean age 68 ± 14 years, 56% males, 66,6% >65 years. Cardiovascular risk factors were highly prevalent. 2.245 new CVE were registered in 1.439 (18.9%) patients who survived (10.1/100 patient-year (pt-yr). 1.380 patients died, 32.7% of them from a CVE. RRT rate was 1.94 / 100 pt-yr, global mortality rate 6.2 and CV mortality rate 2.03 / 100 pt-yr. There was significant association between new CVE and traditional and CKD related risk factors, as well as a better outcome with good glycemic control and treatment with angiotensin converting enzyme inhibition
Conclusion: CKD patients have many CV risk factors and high mortality, so early detection and treatment strategies are important.
Key words:
CHRONIC KIDNEY DISEASE
RISK FACTORS
PREVALENCE
URUGUAY
Introducción
La enfermedad renal crónica (ERC) tiene elevada incidencia y prevalencia, reportadas a nivel internacional(1) y nacional(2,3), elevada morbimortalidad cardiovascular y costos en salud. En pacientes con ERC, la principal causa de muerte es la cardiovascular, y el daño cardiovascular aumenta a medida que disminuye el filtrado glomerular, como ha sido reportado en varias publicaciones(4-6).
En 2010 se realizó una conferencia internacional respecto a la enfermedad cardiovascular (ECV) en la ERC, en la que se profundizó respecto a la epidemiología, fisiopatología, diagnóstico, prevención y tratamiento(7). Este compromiso cardiovascular incluye coronariopatía y miocardiopatía isquémica, hipertrofia ventricular, fibrilación auricular e insuficiencia cardíaca congestiva, enfermedad cerebrovascular y enfermedad arterial periférica(7). Los mecanismos fisiopatológicos que explican esta asociación han sido muy estudiados, así como el eventual impacto de medidas preventivas y terapéuticas, lo que aún no está completamente establecido.
Epidemiología de factores de riesgo de ECV en ERC (tradicionales y vinculados a ERC). Datos internacionales y nacionales. En los pacientes con ERC se han descrito factores de riesgo de ECV tradicionales (edad, sexo, hipertensión arterial, diabetes, dislipemia, tabaquismo, sedentarismo) y factores no tradicionales vinculados a la ERC (por efecto de las toxinas urémicas, injuria nitro-oxidativa, inflamación)(5-8). Muntner y colaboradores(8) encontraron asociación entre factores clásicos de riesgo cardiovascular e incidencia de ERC extrema y mortalidad, pero plantean que debería evaluarse el factor de confusión que implica el deterioro progresivo de la función renal. Varios autores señalan que estos factores de riesgo, si bien frecuentes en esta población, no explican completamente la alta incidencia de eventos ni la mortalidad de causa cardiovascular(7).
Mecanismos fisiopatológicos. El daño vascular en la ERC contribuye a la miocardiopatía isquémica, a la enfermedad cerebrovascular y a la arteriopatía periférica de miembros inferiores.
Numerosos autores(9-17) destacan la importancia de profundizar en el conocimiento fisiopatológico y en la detección oportuna de estos factores de riesgo, para orientar el tratamiento que permita disminuir la progresión, simultáneamente, de la ERC y de la ECV en esta población. Con el objetivo de contribuir en esta línea de investigación planificamos el presente estudio.
Objetivos
Analizar la prevalencia de factores de riesgo cardiovascular, tradicionales y vinculados a ERC, así como los tratamientos instituidos, en la población del Programa de Salud Renal del Uruguay (PSRU) y su asociación con los eventos cardiovasculares reportados y supervivencia.
Metodología
Se realizó un estudio retrospectivo de la cohorte de pacientes de las instituciones adheridas al Programa de Salud Renal del Uruguay (PSRU), e incluidos en el registro del mismo, en el período 1/10/2004 a 31/12/2014. Las instituciones adheridas representan el 58% de la población del país. Los criterios de inclusión en el registro del PSRU son: personas ³ 20 años, con alteraciones renales persistentes por más de tres meses, con filtrado glomerular estimado menor de 60 ml/min/1,73 m2, o proteinuria mayor de 300 mg/día o albuminuria mayor de 30 mg/día en diabéticos. Al registro se integran datos del registro de cirugías cardíacas y angioplastias del Fondo Nacional de Recursos (FNR) (donde captan el 100% de las mismas), del Registro Uruguayo de Diálisis y del Registro de Fallecidos del Ministerio de Salud Pública, para incluir datos de estudios y tratamientos de eventos cardiovasculares, de ingresos a tratamiento de sustitución renal y fallecimientos con la causa (se dispone de datos de causa en 90,9% de los fallecidos). Las causas de muerte se agruparon de acuerdo a la Clasificación Internacional de Enfermedades (CIE 10). Desde el 29/9/2006 se registraron los nuevos eventos cardiovasculares, por lo cual el presente estudio incluye datos de los pacientes del registro del PSRU que cumplían los criterios de inclusión al mismo y tenían seis o más meses en control, desde el 29/9/2006 hasta el 31/12/2014.
Se analizaron edad, sexo, antecedentes de enfermedad cardiovascular y de factores de riesgo (tabaquismo, glucemia, colesterolemia, índice de masa corporal [IMC] y presión arterial [sistólica y diastólica], uricemia, calcemia, fosforemia, hormona paratiroidea intacta [PTHi], hemoglobinemia, hemoglobina A1c, niveles de proteinuria [inicial y final] y tratamiento con estatinas y bloqueo del sistema renina-angiotensina. Se establecieron definiciones operativas para las variables en estudio (anexo 2).
Se consideraron nuevos eventos cardiovasculares (NECV) a los episodios (según definiciones en anexo 2) que se presenten o se diagnostiquen entre el primer control registrado de cada paciente incluido y el evento final, con igual definición que los referidos en los antecedentes, independientemente de su evolución.
El tiempo de seguimiento (para cálculo de tasa de incidencia de primer NECV): se contabilizó desde el primer control luego de 29/9/2006 hasta el primer NECV fatal o no fatal, último control, ingreso a tratamiento de sustitución renal o fallecimiento de otra causa (no cardiovascular) según corresponda.
Para el análisis multivariado de riesgo relativo de primer NECV se utilizó como “punto final” la aparición del primer NECV, independientemente de su evolución (fatales y no fatales)
Análisis estadístico. Se calcularon medias y desvío estándar de los datos con distribución normal o mediana y rango. Se analizó el riesgo de nuevos eventos cardiovasculares con el modelo de riesgo proporcional de Cox y de cada paciente se consideró el primer evento cardiovascular fatal o no fatal y el tiempo correspondiente. Se realizó un primer análisis multivariado (riesgo proporcional de Cox) en el que se utilizaron como variables de ajuste: edad, sexo, diabetes, dislipemia, antecedentes cardiovasculares, tabaquismo, neoplasia y como variables continuas, presión arterial sistólica, diastólica, IMC, filtrado glomerular estimado, uricemia y proteinuria. En una segunda etapa se realizó análisis multivariado para otros factores de riesgo específicos (calcemia, fosforemia, glucemia, hemoglobina, PTHi, tasa de progresión de ERC) y tratamientos (estatinas, bloqueo del sistema renina-angiotensina) y se utilizaron las variables iniciales significativas como variables de ajuste. Para el análisis de riesgo relativo se definió como “punto final” la aparición del primer NECV fatal o no.
Consideraciones éticas. La inclusión al registro del PSRU es voluntaria, incluye individuos de 20 o más años, los pacientes firman el consentimiento informado al ingreso y el análisis de los datos se realiza sin incluir ningún dato identificatorio, ya que la base analizada está disociada de acuerdo a la legislación vigente (ley de Hábeas Data N° 18331)
Resultados
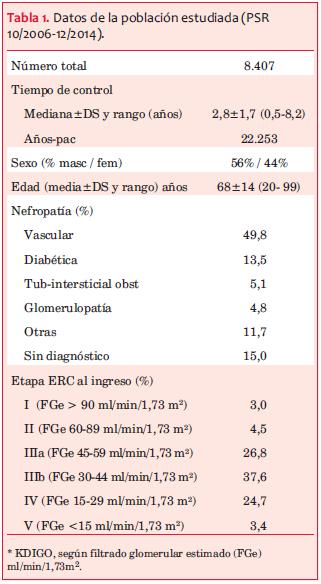
La población analizada, correspondiente al período 29/9/2006 - 31/12/2014, incluyó 8.407 individuos, con edad de 68 ± 14 años (entre 20 y 99 años), 56% hombres (tabla 1). El 66,6% eran mayores de 65 años; 26,2% entre 45 y 65 años y 7,2% entre 20 y 44 años. Los diagnósticos de nefropatía, informados por el nefrólogo tratante, fueron: vascular 49,8%, diabética 13,5%, tubulointersticial obstructiva 5,1%, glomerulopatías primarias 4,8%, otras 11,7% y sin diagnóstico 15,0%. Al momento del ingreso y de acuerdo a la clasificación KDOQI(7,18), la mayoría de los individuos se encontraban en etapa III (26,8% en IIIa y 37,6% en IIIb) y 24,7% en etapa IV. El FGe promedio al ingreso fue de 44,8± 21,4 ml/min/1,73 m2. El seguimiento en PSRU fue de 22.253 paciente-años (tabla 1) con una mediana de 2,8±1,7 años (0,5-8,2 años).
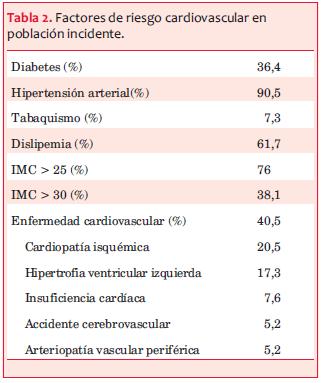
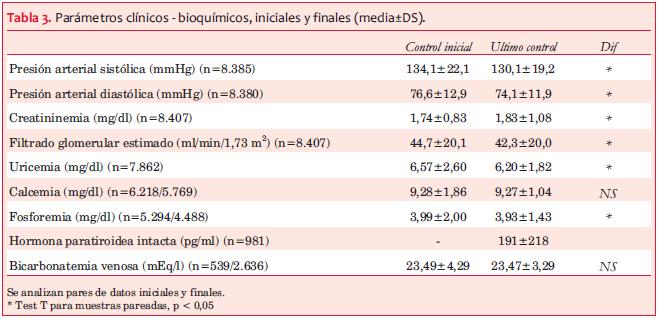
Antecedentes de ECV y de factores de riesgo cardiovascular. Previo al ingreso al registro del PSRU tenían antecedentes de diabetes mellitus 36,4% de la población incluida y 40,5% de enfermedad cardiovascular (ECV), en ellos predominaba la cardiopatía isquémica (20,5%) (tabla 2). Se analizó la frecuencia de factores de riesgo cardiovascular (disponibles en el registro): a) clásicos: tabaquismo (7,3%), diabetes (36,4%), dislipemia (61,7%), índice de masa corporal (IMC) (76,0% mayor de 25), hipertensión arterial (90,5%) (tabla 2), y b) vinculados a la ERC: uricemia, calcemia, fosforemia, hormona paratiroidea (PTHi), hemoglobinemia, y proteinuria. La tabla 3 muestra los valores iniciales y finales de estas variables.
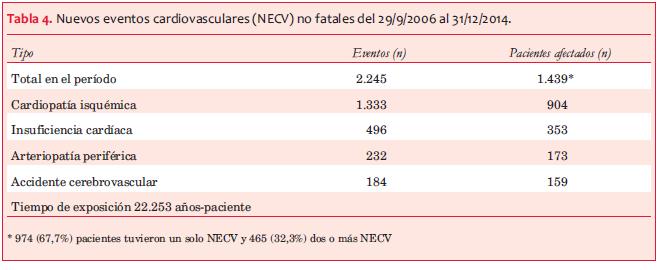
Incidencia de NECV no fatales. En el período de observación (9/2006-12/2014) se reportaron 2.245 NECV no fatales en 1.439 individuos de un total de 8.407 pacientes registrados (18,9%), (tabla 4). El 67,7% tuvo un único NECV y 32,3% más de uno. La tasa de NECV fue de 10,1 por 100 pacientes-año (pac-año), con tasas de incidencia por 100 pac-año de cardiopatía isquémica (5,99), insuficiencia cardíaca (2,23), arteriopatía periférica (1,04) y accidente cerebrovascular (0,83) (tabla 4). Las personas con eventos por enfermedad vascular periférica y por ataque cerebrovascular fueron 2% y 1,8% del total, respectivamente.
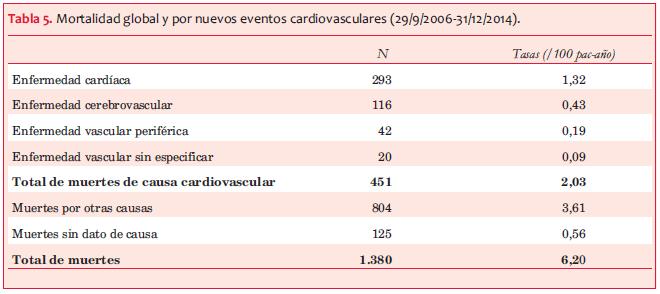
Mortalidad global e incidencia de NECV fatales. En el período considerado fallecieron 1.380 pacientes, de los cuales 32,7% fueron de causa cardiovascular y en 9,1% la causa no estaba especificada. La tasa de mortalidad global fue de 6,2 por 100 pac-año. Se registraron 451 muertes de causa cardiovascular, en los 8.407 pacientes (tiempo 22.253 años-paciente), tasa 2,03 por 100 pac-año, de las cuales 293 fueron de causa cardíaca (tasa 1,32 por 100 pac-año) (tabla 5).
Ingresos a tratamiento de sustitución renal (TSR). En el período considerado (9/2006-12/2014) ingresaron a TSR (diálisis o trasplante) 431 pacientes incluidos en el registro del PSRU, lo que determina una tasa de 1,94 pac-año.
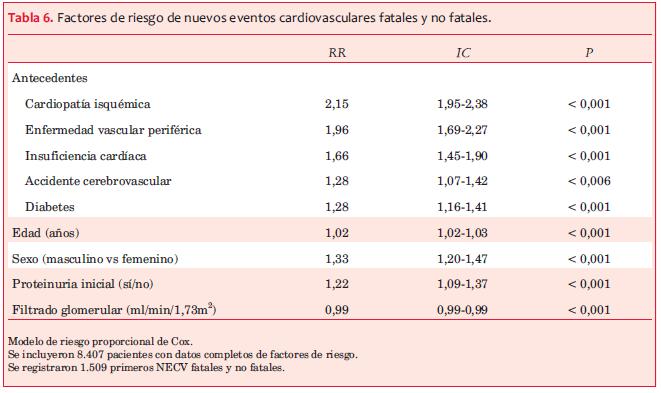
Factores de riesgo de NECV. El análisis de los factores de riesgo de NECV no fatales y fatales muestra la importancia de los antecedentes cardiovasculares (tabla 6) al momento del diagnóstico de nefropatía. Para el análisis de riesgo relativo se definió como “punto final” la aparición del primer NECV fatal o no.
a) El antecedente de evento cardiovascular (tabla 6), así como la mayor edad, el sexo masculino y la proteinuria inicial se asociaron significativamente a mayor riesgo de NECV.
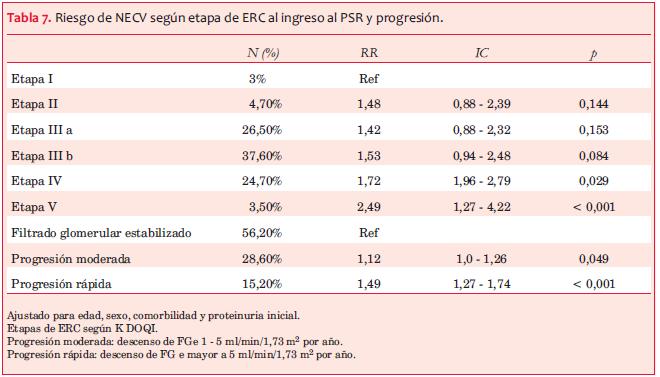
b) La disminución del filtrado glomerular aumenta el riesgo y en relación a las etapas de la ERC es significativo en las etapas IV y V (Figura 7) . La tasa de progresión de la ERC también se asocia a mayor riesgo: en referencia a los pacientes estabilizados, los pacientes con progresión rápida tuvieron RR 1,49 (IC 1,27-1,74) (p <0,001).
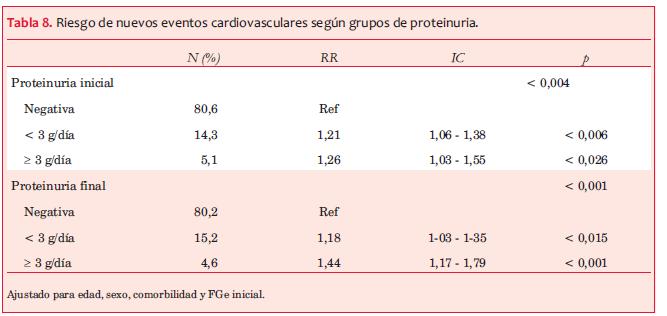
Se analizó la proteinuria como variable categórica (tabla 8) y, en el análisis multivariado, se observó una asociación significativa, con mayor riesgo de NECV, en los grupos con proteinuria mayor de 0,5 g/día.
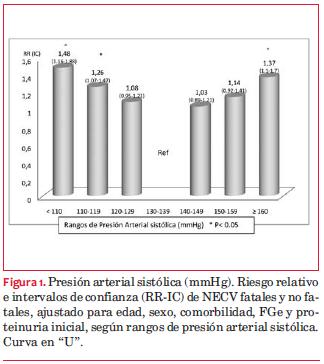
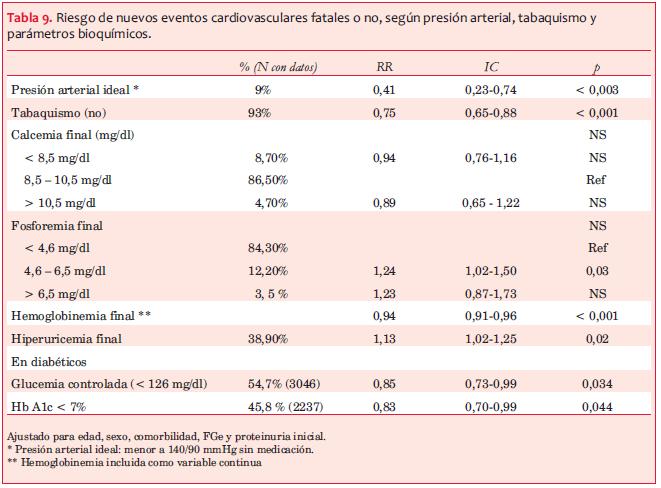
d) La PAS, PAD, glucemia en ayunas, hemoglobina A1c y uricemia finales elevadas, la hemoglobinemia descendida y el tabaquismo, se asociaron a un mayor riesgo relativo (RR) de primer NECV fatal o no (tabla 9). Al analizar el RR según los rangos de PAS, se observa una curva en U, con RR de NECV significativamente mayor en el grupo de PAS < 120 mmHg así como en el grupo de PAS ³ 160 mmHg (RR 1,37, IC 1,1-1,7) (figura 1).
El IMC, obesidad central y colesterolemia no tuvieron asociación significativa con primer NECV fatal o no en esta cohorte.
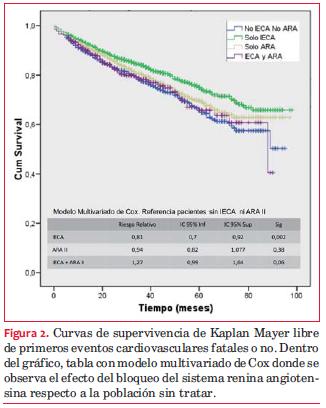
Impacto del tratamiento. En los pacientes diabéticos el adecuado control metabólico (glucemias en ayunas de control < 126 mg/dl y hemoglobina A1c < 7%) se asociaron a un menor RR de primer NECV fatal o no (0,85 y 0,83, p< 0,034 y 0,044, respectivamente) (tabla 9). En toda la población la indicación de bloqueo del sistema renina-angiotensina-aldosterona por inhibidores de la enzima conversora de angiotensina (IECA) en el primer control, disminuyó significativamente el riesgo de primeros NECV fatales y no fatales (RR 0,86, IC 0,70-0,92) (ajustado a variables de confusión) (figura 2). El uso de ARAII (RR 0,94, IC 0,82-1,07) y la asociación de ambos grupos farmacológicos (RR 1,26, IC 0,99-1,61) no se asociaron a un beneficio significativo. En el análisis univariado el uso de ARAII se asoció a menor RR, pero en el análisis multivariado, ajustado a variables de confusión, no fue significativo. El uso de estatinas no se asoció a cambios en la evolución.
Curvas de supervivencia de Kaplan Mayer libre de primeros eventos cardiovasculares fatales o no. Dentro del gráfico, tabla con modelo multivariado de Cox donde se observa el efecto del bloqueo del sistema renina angiotensina respecto a la población sin tratar.Discusión
La ERC es reconocida como un factor de riesgo independiente de enfermedad cardiovascular(1-7,20). Dado que la prevalencia de la misma es muy elevada, su presencia debe ser detectada tempranamente para instaurar medidas de nefroprevención. El estudio NAHNES III(21), en población de Estados Unidos mayor de 12 años en el período 88-1994, reporta una prevalencia de individuos con creatininemia de 1,5 mg/dl o mayor de 9,74% en hombres y de 1,78% en mujeres. Se destaca así la alta prevalencia de ERC en población general, aun con las limitaciones de la creatininemia aislada como marcador de ERC (asociación no lineal con el filtrado glomerular y variación con edad, sexo, masa corporal y raza).
El presente estudio analiza una vasta cohorte uruguaya, lo que permite conocer datos nacionales respecto a patologías de alta incidencia y agravación recíproca, como la enfermedad cardiovascular y la enfermedad renal crónica.
Población. La población (8.407 individuos, con 22.253 años-paciente de seguimiento) analizada en el presente estudio está constituida por pacientes incluidos en el PSRU, por lo tanto con diagnóstico de nefropatía y en control con nefrólogos de los grupos que reportan al registro del PSRU (de instituciones tanto públicas como privadas que representan al 58% de la población total del país). Así definida, esta población sería representativa de la población con ERC de Uruguay, aunque pudiera existir un sesgo en el sentido de que está en control nefrológico, lo que implica que fue asistida por médicos del primer nivel y fue derivada a la consulta nefrológica en el sistema de referencia-contrarreferencia recomendado por el PSRU(22).
Factores de riesgo de NECV en la ERC. El análisis de los datos registrados permitió definir los principales factores asociados con mayor riesgo de NECV. Como ha sido referido por numerosos autores(4-13), tanto el antecedente de ECV como la aparición de NECV son muy frecuentes en la población con ERC y han ameritado numerosos estudios epidemiológicos, clínicos y experimentales. Al ingreso al PSRU, 40,5% refieren antecedentes cardiovasculares (tabla 2), siendo la cardiopatía isquémica la más frecuente, seguida de HVI, como ha sido reportado por otros autores(7,23). En estudios previos de esta cohorte se observó que la prevalencia de cardiopatía aumenta en cada etapa de ERC(2). La incidencia y severidad de la coronariopatía han sido destacadas por numerosas publicaciones, en estudios clínicos y en autopsias(24) que evidencian calcificaciones vasculares y un compromiso difuso y multivaso(7), a menudo asintomático. Un estudio japonés(25) con coronariografías en pacientes con ERC etapa 5, sin síntomas de insuficiencia coronaria, al ingreso a diálisis, evidenció 50% de lesión coronaria asintomática.
Además de los factores de riesgo cardiovascular clásicos (tabla 2), comunes con la población general, los pacientes con ERC tienen un riesgo cardiovascular aumentado, vinculado a la propia ERC(4-9). En el presente estudio se analizó la frecuencia de los cinco factores de salud cardiovascular ideal (disponibles en el Registro) y destacados por Muntner(8): tabaquismo, glucemia, colesterolemia, IMC y presión arterial (sistólica y diastólica) (tabla 2), que confirma su elevada prevalencia, así como de otros factores de riesgo vinculados a la ERC (tabla 3).
Incidencia y factores de riesgo de NECV y mortalidad. Muntner(8) analiza la asociación entre los siete factores de salud cardiovascular definidos por American Heart Association (AHA) (los mencionados más actividad física y dieta) en individuos con ERC de una cohorte de 3.093 individuos con FG e menor de 60 ml/min/1,73 m2 y cuatro años de seguimiento, en la cual 160 individuos desarrollaron ERC y 610 fallecieron. En esa cohorte observaron que aquellos que tenían dos o más factores favorables tenían –progresivamente– menor riesgo de desarrollar ERC avanzada y menor mortalidad, sin embargo al ajustar por filtrado glomerular y albuminuria esta asociación se atenuaba, por lo que no se puede descartar que la nefropatía/ERC fuera un factor causal o de confusión de la asociación. En la presente cohorte uruguaya se observó un mayor riesgo relativo para NECV si presentaban antecedente de cardiopatía isquémica, enfermedad vascular periférica, insuficiencia cardíaca o ataque cerebrovascular (tabla 6). La edad mayor a 45 años y el sexo masculino, al igual que en la población general, se asociaron a un mayor riesgo (tabla 6). En la población que analizamos en el presente estudio observamos que una presión arterial ideal sin medicación, la ausencia de tabaquismo, y una glucemia controlada se asocian a un riesgo significativamente menor de presentar un primer NECV fatal o no (tabla 9), en tanto que los niveles de colesterolemia y el IMC no mostraron una asociación significativa, ajustados a edad, sexo, comorbilidades, FG y proteinuria. Al analizar el RR de la presión arterial sistólica en rangos (figura 1) se observa una curva en U, con riesgo significativamente mayor con PAS <120 mmHg y de 160 mmHg o mayores. Esta distribución del riesgo ha sido ampliamente discutida por diversos autores(26). No fue posible analizar, con los datos disponibles en el registro del PSRU, ni la actividad física ni el cumplimiento de la dieta, aunque ambos están recomendados en las Guías de Práctica Clínica del PSRU(22).
La disminución del filtrado glomerular se asoció a un riesgo significativamente mayor de NECV en las etapas avanzadas de la ERC y en los pacientes con progresión rápida (tabla 7) Asimismo, se demostró una asociación entre mayor nivel de proteinuria y la aparición de primer NECV, fatal o no, como ha sido reportado, al considerar que la albuminuria traduciría daño endotelial(27-30). En particular, la proteinuria nefrótica al final del seguimiento se asoció con un RR 44% mayor que el grupo sin proteinuria, destacando el rol de una proteinuria significativa persistente en el daño vascular(29,30). Palmer(31) destaca que existen pocos estudios que muestran solo una débil correlación entre mortalidad cardiovascular y parámetros bioquímicos del metabolismo óseo-mineral en la ERC (calcemia, fosforemia, PTHi) y ninguno que confirme fehacientemente una asociación entre tratamiento de los mismos y menor mortalidad. En la presente cohorte observamos que niveles crecientes de PTHi, así como niveles elevados de fosforemia finales, se asociaron a mayor riesgo de NECV (tabla 9).
Entre los NECV la cardiopatía isquémica fue la más frecuente, con una tasa de incidencia de 5,99/100 años-pac, y la insuficiencia cardíaca con una tasa de incidencia de 2,23/100 años-pac. Herzog(7) destaca que la ERC expone al corazón a tres mecanismos principales que pueden inducir falla miocárdica, tanto sistólica como diastólica: sobrecarga hipertensiva, sobrecarga de volumen y factores no hemodinámicos vinculados a la propia ERC (activación inapropiada del sistema renina-angiotensina-aldosterona, estrés oxidativo, inflamación y estimulación de factores profibrogénicos e hipertrofiantes: cardiotrofina-1, galectina-3, TGF-beta, FGF-23)(16). La rigidez miocárdica, vinculada a la fibrosis, conduce a la falla diastólica que puede observarse aun antes de que la HVI sea detectada. Asimismo la rigidez arterial puede tener un rol clave en el nexo entre ERC y ECV. El estudio NEFRONA(27) encuentra una alta prevalencia de ateromatosis subclínica (detectada por ultrasonido) en individuos en diferentes etapas de ERC comparada con individuos con función renal normal y destaca que aquellos que alcanzan niveles más avanzados de ERC son quienes han “evitado” eventos cardiovasculares. En la cohorte estudiada se reporta una tasa de incidencia de accidente cerebrovascular (ACV) de 0,83 y 1,04/100 años-pac de arteriopatía periférica (tabla 4), lo que coincide con los hallazgos de NEFRONA, en los cuales la arteriopatía femoral era más frecuente que la carotídea(27) y la mortalidad por ambos fue menor que la causada por miocardiopatía (cardiopatía isquémica e IC), aunque el riesgo de primer NECV, fatal o no, fue significativamente mayor tanto en quienes tenían antecedentes de miocardiopatía como de enfermedad vascular periférica. El Husseini(28) refiere una mayor incidencia de ACV, tanto isquémico como hemorrágico y con peor evolución, en individuos con FGe menor de 45 ml/min/1,73 m2, que vincula a la presencia de factores de riesgo clásicos (ya analizados) y vinculados a la ERC, como hiperhomocisteinemia, inflamación, estrés oxidativo, anemia, disfunción endotelial, rigidez arterial y predisposición a fibrilación auricular, así como disfunción plaquetaria(28,29). Un metaanálisis observó que a mayor proteinuria (independiente de otros factores y de la etapa de ERC), el riesgo de ACV aumenta un 71%, y que si se asocia a las etapas de ERC el riesgo es aún mayor al progresar las mismas(29).
Riesgo de ingreso a TSR y de muerte. Si bien las frecuencias y las tasas de muerte por causa cardiovascular pueden estar subregistradas, dado que 9,1% de los fallecimientos no tenían reporte de la causa, en el presente estudio se confirma lo reportado por otros autores(7-13) respecto a que los pacientes con ERC tienen mayor riesgo de morir que de ingresar a TSR. En esta cohorte la tasa de ingreso a TSR fue equivalente a la de mortalidad de causa cardiovascular, y un tercio que la de mortalidad global, lo que aporta un dato importante para la planificación en salud y amerita los esfuerzos realizados en la detección precoz y el tratamiento nefroprotector oportuno.
Impacto del tratamiento. El registro del PSR incluye también variables de tratamiento, lo que permite un análisis retrospectivo de la asociación entre la medicación indicada y la evolución. Estudios previos en la misma cohorte han confirmado que el deterioro del filtrado glomerular puede estabilizarse e incluso revertirse parcialmente en los pacientes asistidos en los grupos nefrológicos que reportan al PSRU(2).
Múltiples reportes asocian el control glucídico óptimo en los diabéticos con menor progresión de la ERC y menor riesgo cardiovascular(32); sin embargo, el estudio ACCORD(33) encuentra que en los pacientes con ERC un control glucémico intensivo aumenta el riesgo cardiovascular y la mortalidad (ya aumentados en este subgrupo poblacional). Es de destacar que este control glucídico intensivo tenía como objetivo lograr una Hb A1c menor de 6%, pero en el PSRU el objetivo recomendado es menor a 7%, lo que probablemente explique la correlación positiva entre Hb A1c en rango aceptable (menor de 7%) y menor mortalidad cardiovascular.
Hace varias décadas que el tratamiento con IECA ha demostrado su eficacia en enlentecer la progresión de la ERC y el riesgo cardiovascular por múltiples mecanismos, en los que contribuyen la inhibición de los ejes RAA y FGF-23/Klotho/fósforo(34). En la cohorte estudiada se observa una supervivencia libre de primer NECV significativamente mayor en el grupo tratado con IECA que en los no tratados, pero no así en los tratados con ARAII ni con el doble bloqueo (figura 2), lo que coincide con otros reportes(33).
Conclusiones
La cohorte del PSRU presenta una elevada prevalencia de factores de riesgo vascular e incidencia de eventos cardiovasculares. La incidencia de NECV, fatales o no, se asocia a factores de riesgo tradicionales (edad, sexo masculino, hipertensión arterial, diabetes, dislipemia) así como vinculados a la nefropatía (proteinuria, deterioro del filtrado glomerular, anemia, hiperfosforemia, PTHi elevada).
El buen control glucídico en los diabéticos, así como el tratamiento con IECA en la población global se asocian con menor mortalidad.
La tasa de ingreso a TSR fue similar a la mortalidad de causa cardiovascular, en tanto que la mortalidad global fue tres veces mayor, lo que amerita las estrategias de captación precoz, control de factores de riesgo y tratamiento oportuno de los individuos con ERC realizados en el PSRU.
Bibliografía
1. US Renal Data System USRDS 2013 annual data report: atlas of chronic kidney disease and end-stage renal disease in the United States. Bethesda (MD): National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases;2013 [consulta 16 Ago 2016].
Disponible en: https://www.usrds.org/atlas13.aspx
2. Schwedt E, Solá L, Ríos PG, Mazzuchi N; National Renal Health care Program. Improving the management of chronic kidney disease in Uruguay: a National Renal Healthcare Program. Nephron Clin Pract. 2010;114(1):c47-59.
3. Fondo Nacional de Recursos. Informe anual sobre desarrollo del programa de salud renal del Uruguay. Uruguay: FNR; 2004-2013 [consulta 15 Ago 2016]. Disponible en: www.fnr.gub.uy
4. Anavekar ND, McMurray JJ, Velazquez EJ, Solomon S, Kober L, Rouleau JL, et al. Relation between renal dysfunction and cardiovascular outcomes after myocardial infarction. N Engl J Med 2004; 351(13):1285-95.
5. Go AS, Chertow GM, Fan D, McCulloch CE, Hsu CY. Chronic kidney disease and the risks of death, cardiovascular events and hospitalization. N Engl J Med 2004;351(13):1296-305.
6. Ricardo AC, Lash JP, Fischer MJ, Lora CM, Budoff M, Keane MG, et al. Cardiovascular disease among hispanics and non-hispanics in the chronic renal insufficiency cohort (CRIC) study. Clin J Am Soc Neph 2011;6(9): 2121-31.
7. Herzog CA, Asinger RW, Berger AK, Charytan DM, Diez J, Hart RG, et al. Cardiovascular disease in chronic kidney disease. A clinical update from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2011; 80(6): 572-86.
8. Muntner P, Judd SE, Gao L, Gutierrez OM, Rizk DV, McClellan W, et al. Cardiovascular risk factors in CKD associate with both ESRD and mortality. J Am Soc Nephrol 2013; 24(7):1159-65.
9. Weiner DE, Tighiouart H, Elsayed EF, Griffith JL, Salem DM, Levey AS, et al. Inflammation and cardiovascular events in individuals with and without chronic kidney disease. Kidney Int 2008; 73(12): 1406-12.
10. Briet M, Schiffrin EL. Aldosterone: effects on the kidney and cardiovascular system. Nat Rev Nephrol. 2010;6(5):261-73.
11. Gutierrez OM, Mannstadt M, Isakoba T, Rauh-Hain JA, Tamez H, Shah A, et al. Fibroblast growth factor 23 and mortality among patients undergoing hemodialysis. N Engl J Med 2008; 359(6):584-92.
12. Liu M, Li XC, Lu L, Cao Y, Sun RR, Chen S, et al. Cardiovascular disease and its relationship with chronic kidney disease. Eur Rev Med Pharmacol Sci 2014;18(19):2918-26.
13. Leibowitz D. Left ventricular hypertrophy and chronic renal insufficiency in the elderly. Cardiorenal Med 2014;4(3-4):168-75.
14. Mace ML, Gravesen E, Hofman-Bang J, Olgaard K, Lewin E. Key role of the kidney in the regulation of fibroblast growth factor 23. Kidney Int. 2015;88(6):1304-13.
15. Tumlin JA, Costanzo MR, Chawla LS, Herzog CA, Kellum JA, McCullough PA, et al. Cardiorenal syndrome type 4: insights on clinical presentation and pathophysiology from the eleventh consensus conference of the Acute Dialysis Quality Initiative (ADQI). Contrib Nephrol. 2013;182:158-73.
16. Cerasola G, Nardi E, Palermo A, Mulè G, Cottone S. Epidemiology and pathophysiology of left ventricular abnormalities in chronic kidney disease: a review. J Nephrol 2011;24(1):1-10.
17. Nitta K, Iimuro S, Imai E, Matsuo S, Makino H, Akizawa T, et al. Risk factors for increased left ventricular hypertrophy in patients with chronic kidney disease. Clin Exp Nephrol 2013; 17(5):730-42.
18. Taler SJ, Agarwal R, Bakris GL, Flynn JT, Nilsson PM, Rahman M, et al. KDOQI US commentary on the 2012 KDIGO clinical practice guideline for management of blood pressure in CKD. Am J Kidney Dis. 2013;62(2):201-13.
19. Lenfant C, Chobanian AV, Jones DW, Roccella EJ; Joint National Committee on the Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Seventh report of the Joint National Committee on the Prevention, Detection, Evaluation, and Treatment of High Blood
Pressure (JNC 7): resetting the hypertension sails. Hypertension 2003;41:1178-9.
20. Foley RN, Parfrey PS, Sarnak MJ. Clinical epidemiology of cardiovascular disease in chronic renal disease. J Am Soc Nephrol 1998; 9 Suppl 12:S16-23.
21. Jones CA, McQuillan GM, Kusek JW, Eberhardt MS, Herman WH, Coresh J, et al. Serum creatinine levels in the US population: third National Health and Nutrition Examination Survey. Am J Kidney Dis 1998;32(6):992-9.
22. Guías de práctica clínica en el diagnóstico y tratamiento de la enfermedad renal crónica. Uruguay setiembre 2013. Montevideo: FNR; 2014[consulta 15 Ago 2016]. Disponible en: www.fnr.gub.uy
23. Foley RN, Parfrey PS, Sarnak MJ. Epidemiology of cardiovascular disease in chronic renal disease. J Am Soc Nephrol1998; 9 Suppl 12: S16-23.
24. Nakano T, Ninomiya T, Sumiyoshi S, Fujii H, Doi Y, Hirakata H, et al. Association of kidney function with coronary atherosclerosis and calcification in autopsy samples from Japanese elders: the Hisayama study. Am J Kidney Dis 2010; 55(1):21-30.
25. Ohtake T, Kobayashi S, Moriya H, Negishi K, Okamoto K, Maesato K, et al. High prevalence of occult coronary artery stenosis in patients with chronic kidney disease at the initiation of renal replacement therapy: an angiographic examination. J Am Soc Nephrol 2005; 16(4):1141-8.
26. Rahimi K, Emdin CA, MacMahon S. The epidemiology of blood pressure and its worldwide management. Circ Res 2015;116(6):925-36.
27. Arroyo D, Betriu A, Martinez-Alonso M, Vidal T, Valdivielso JM, et al. Observational multicenter study to evaluate the prevalence and prognosis of subclinical atheromatosis in a Spanish chronic kidney disease cohort: baseline data from the NEFRONA study. BMC Nephrol 2014; 15: 168. doi:
10.1186/1471-2369-15-168.
28. El Husseini N, Kaskar O, Goldstein LB. Chronic kidney disease and stroke. Adv Chronic Kidney Dis 2014;21(6):500-8.
29. Ninomiya T, Perkovic V, Verdon C, Barzi F, Cass A, Gallagher M, et al. Proteinuria and stroke: a meta-analysis of cohort studies. Am J Kidney Dis 2009;53(3): 417-25.
30. Tani Y, Nakayama M, Terawaki H, Iseki K, Watanabe T. Comparison of albuminuria test and urina test strip in Japanese hypertensive patients: AVA-E study. Clin Nephrol 2015; 84(5): 270-3.
31. Palmer S, Teixeira-Pinto A, Saglimbene V, Craig J, Macaskill P, Tonelli M, et al. Association of drug effects on serum parathytoid hormone, phosphorus, and calcium levels with mortality in CKD: a meta-analysis. Am J Kidney Dis 2015: 66(6):962-71.
32. Hayward RA, Reaven PD, Wiitala WL, Bahn GD, Reda DJ, Ge L, et al. Follow-up of glycemic control and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2015;372(23):2197-206.
33. Papademetriou V, Lovato L, Doumas M, Nylen E, Mottl A, Cohen RM, et al. Chronic kidney disease and intensive glycemic control increase cardiovascular risk in patients with type 2 diabetes. Kidney Int 2015; 87(3):649-59.
34. de Borst MH, Vervloet MG, ter Wee PM, Navis G. Cross talk between the renin-angiotensin-aldosterone system and vitamin D-FGF-23-klotho in chronic kidney disease. J Am Soc Nephrol 2011;22(9):1603-9.
Anexo 1. Nefrólogos del Programa de Salud Renal del Uruguay
Adriana Bourdillon Sánchez
Adriana Pastorino Fernandez
Adriana Vagnoni Silba
Adriana Mary Salvidio Carrera
Alejandra V. Canon Galusso
Alejandro Ferrero Fuentes
Alfredo Marra Diana
Alfredo Arturo Maino Jourdan
Alicia Margarita Petraglia Dalier
Alicia Nora Sans Mancebo
Alvaro Enzo Morra Abelenda
Ana k. Oyamburo dominguez
Ana Karina Subiza Prieto
Ana Lucia Verocay Fraga
Ana María Cotelo Zirollo
Ana María Díaz Luzardo
Ana María Varela Percovich
Analia Ríos Rodríguez
Andrea Banina Coppa Belmonte
Andres J Urrestarazu Fernández
Beatriz Leonor Gelabert Viña
Cair Rita Gagliardi Serlas
Carlos Dufrechou Poggi
Carlos Alberto Lasa García
Carmen Irides Soca Guarnieri
Carolina Zomar Gabriel
Catherine S. Zulberti Rizzo
Cecilia Baccino Albornoz
Cecilia Ivonne Burgos Fruniz
Claudio Giovanni Orazietti Anatra
Cristina Verdaguer Pérez
Cristina Teresa Fernández Ventoso
Daniela Marini Mazzullo
David Miller Correa
Diego Jaime Tobal Lopez
Eduardo Rügnitz Rodríguez
Elida Castelo Delpréstito
Emma Carmen Schwedt Celiberti
Federico Eduardo García Rey
Francisco Nicolás Lacordelle Leites
Gladys Veronica Lamadrid López
Graciela Suárez Sacco
Graciela Haydee Baldovino Pioli
Guillermo Armando Garra Madrid
Guillermo Rodríguez Aguilera
Hena Maria Caorsi De La Puente
Ines Rosa Olaizola Ottonello
Jacqueline Nalerio Varela
Jose Gabriel Boggia De Izaguirre
Jose M. Santiago Rodríguez
Jose Maria Valiño Maeso
Juan Carlos Díaz Salvia
Juan Carlos Lujan Pereyra Basile
Juan Francisco García Austt Otero
Juan Manuel Fernández Cean
Laura Miedzovvicz Lijtenstein
Laura Sola Schnir
Laura Elena Manzo Méndez
Liliana Gadola Bergara
Lourdes Emiria Baubeta Gutiérrez
Lucia E. Barcelo Pastorino
Luis Antonio Vilardo Cairoli
Lydia Ines Zampedri Murara
Maira Isabel Rodriguez Umpiérrez
Marcos Aristides Arena Vilalba
María Garcia Taibo
María A. Chichet Salvatore
María Amelia Rocha Conde
María Asuncion Alvarez Mosquera
María Carlota Gonzalez Bedat
María Carolina Vener Toulier
María Cecilia Tognola Firpo
Maria Cristina Sehabiague Olivera
María Del Pilar Varela Viñuela
María Enriqueta Carbonell Ravenna
María Gabriela Ottati Gamenara
María Gabriela Peydro Tomasso
María Mercedes Cha Ghiglia
Maria Ofelia Urchipia Catsouris
María Virginia Etchegaray Collazo
María Virginia Matonte Cantero
Mariana Banchero Fernández
Mariana Sottolano Reyes
Mariana Andrea Seija Alves
Marianela Pastore Pereyra
Mariela Odriozola Mendina
Marta Carolina Mimbacas Guerra
Marta Inés Lane Llopart
Marta Nidia Pereira Pallas
Mary Lilian Antunez Araujo
Melania Adrine Kurdian Barsumian
Milton Esteban Ríos Ferreira
Monica Labella Fernández
Monica Graciela Bertiz Nuñez De Moraes
Nancy Aracelli Perg Fumeaux
Nancy Stella De Souza Artia
Natalia Laura Dell Oca Maggio
Natalia Lucia Villegas Lanza
Nelly Marcela Daglio Rodano
Nora Helena Bonetti Fernández
Orlando Adolfo Canzani Vegh
Oscar Alberto Noboa Aldecoa
Pablo Germán Rios Sarro
Pablo Manuel Ambrosoni Miro
Patricia Cuña Lima
Patricia Elena Larre Borges García
Patricia Estela Domínguez Azcurrian
Paula Gauronas Lissmann
Raquel Arregui Bonora
Raul Jose Jacobo Mizraji Villalba
Ricardo A. Silvariño di rago
Rocio Del Alba Cultelli Delfino
Rodrigo Menoni Arbiza
Rosa Mabel Ferreiros Perdomo
Rossana Cordero Valenzuela
Rossana Beatriz Astesiano Alvarez
Roxana Anabella Rodríguez Fontes
Ruben Javier Coitiño Rosa
Sandra Iglesias Hernández
Sergio Lopez Buzzo
Silvana Raquel Giménez Calvete
Sofía Maria San Roman Sanchez
Soledad Brovia Cardozo
Soledad Duque Bejerez
Susana Beatriz Gonzalez Rodriguez
Sylvia - Balardini Perroni
Sylvia Boghossian Kechichian
Sylvia Maria Carrera Chouhy
Teresita Enriqueta Llopart Forne
Veronica Lamadrid
Veronica Sofia Miranda Mondada
Virginia Elena Massobrio Nodar
Viviana Vanessa Moreno Camacho
Walter Mauricio Gauronas Wagner
Xose Andres González Cancela
Anexo 2. Definiciones
- Enfermedad renal crónica (ERC) (según definición K/DOQI)(18): daño renal o tasa de filtrado glomerular (FG) <60 ml/min/1,73 m2 superficie corporal persistentes por más de tres meses, o proteinuria >300 mg/día (albuminuria >30 mg/día en los pacientes diabéticos) o por anormalidades estructurales, histología renal o estudios por imágenes.
- Hipertensión arterial (HTA): según el criterio del VIII informe del Joint National Committee(19): presión arterial ³140/90 mmHg o en tratamiento con al menos un fármaco antihipertensivo.
- Dislipemia: si en primer control refiere colesterolemia > 200 mg/dl, o LDL > 100 mg/dl, o TG > 150 mg/dl o HDL < 40 mg/dl en hombres o < 45 mg/dl en mujeres, o si recibe tratamiento con estatinas.
- Diabetes: si tiene previamente al menos dos glucemias en ayunas > 126 mg/dl o glucemia > 200 mg/dl a 2 horas poscarga de glucosa, o glucemia casual > 200 mg/dl o recibe tratamiento hipoglucemiante.
- Tabaquismo (actual): fumador actual o que abandonó hace menos de seis meses.
- Filtrado glomerular estimado (FGe): se calcula con la fórmula CDK-EPI(17).
- Progresión rápida de ERC: descenso de filtrado glomerular estimado (FGe) de más de 5 ml/min/1,73 m2/año.
Antecedentes cardiovasculares
- Cardiopatía isquémica: antecedente de infarto agudo de miocardio (IAM) o isquemia demostrada por electrocardiograma (ECG), ergometría, centellograma miocárdico, o antecedente de cirugía de revascularización miocárdica o angioplastia.
- Enfermedad vascular periférica de miembros inferiores clínica: claudicación intermitente dolorosa, ausencia de pulsos o cirugía de revascularización: angioplastia, endarterectomía o amputación por isquemia.
- Insuficiencia cardíaca: fracción de eyección del ventrículo izquierdo (FEVI) < 55% en ecocardiograma o episodio de edema pulmonar de causa circulatoria bien documentada.
- Accidente cerebrovascular (ACV) o accidente isquémico transitorio (AIT) previo de cualquier clase.
- Control glucídico: se evaluó mediante los niveles de glucemia y de HbA1c (en el último control) y se consideró “buen control glucídico” si la glucemia era < 126 mg/dl o la Hb A1c <7%.
Se consideró “tratado con IECA y/o ARAII”, según el registro en el primer control de cada paciente.