Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión impresa ISSN 0797-0048versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.31 no.1 Montevideo abr. 2016
ESPECIAL
FIBRILACIÓN
AURICULAR
Artículo de revisión
Cierre de apéndice auricular izquierdo por vía percutánea.
Actualización y experiencia adaptada
Dr. Germán Henestrosa
Cardiólogo Intervencionista, Colegio Argentino de Cardiólogos Intervencionistas.
Cardiólogo Intervencionista en Cardiopatías Congénitas, Fundación Favaloro.
Proctor para Latinoamérica, St. Jude Medical, Gore, Cardiofix Starway, Andratec.
Correo electrónico: germanhenestrosa@gmail.com
Palabras clave:
FIBRILACIÓN AURICULAR
APÉNDICE AURICULAR
PREVENCIÓN DE ACV
OCLUSIÓN DE APÉNDICE AURICULAR IZQUIERDO
Key words:
ATRIAL FIBRILLATION
ATRIAL APPENDAGE
STROKE PREVENTION
LEFT ATRIAL APPENDAGE OCCLUSION
La fibrilación auricular (FA) es la arritmia cardíaca más frecuente en la población general, estimándose su prevalencia entre 1,5% y 2%. Se estima una afectación aproximada de 12 millones de personas para el año 2030 en Estados Unidos(1). Es la causa más frecuente de accidente cerebro vascular (ACV), siendo responsable del 15% de los mismos y del 30% en las personas mayores de 80 años(2,3). En general son ACV con gran morbimortalidad, presentando secuelas neurológicas graves en el 50% de los casos o muerte en 50%. El tratamiento preventivo de elección es la terapia anticoagulante(4,5).
Las guías de la Sociedad de Cardiología de Canadá recomiendan la terapia anticoagulante con un score CHADS (antecedentes de falla cardíaca, hipertensión arterial, edad ³75 años, diabetes mellitus, ACV o accidente isquémico transitorio previos) igual o mayor a 1(6). En un intento de mejorar la selección de la población en riesgo, la Sociedad Europea de Cardiología desarrolló el score CHA2DS2-VASc, en el que además de los factores de riesgo incluidos en el CHADS agrega enfermedad vascular, edad 65-74 años y sexo femenino. De acuerdo con este score se recomienda tratamiento anticoagulante para valores iguales o mayores a 1(7).
Varios estudios randomizados han demostrado la eficacia de los anticoagulantes orales (ACO) en la prevención de los fenómenos embólicos en la FA. Un metaanálisis de los ensayos realizados con warfarina mostró hasta un 64% de reducción de ACV y 26% de reducción en la mortalidad(4,5). Sin embargo, existe un gran porcentaje de pacientes que no recibe dicha terapia, 30%-50%, por presentar contraindicaciones o riesgo aumentado de sangrado. Aproximadamente el 30% presenta mala adherencia al tratamiento o no se encuentra en rango terapéutico. La terapia crónica con ACO implica un riesgo de sangrado de 2% a 3,5% por año, según distintos trabajos(8,9).
Los “nuevos” anticoagulantes orales como rivaroxabán y dabigatrán han disminuido considerablemente el riesgo de ACV hemorrágico en relación con warfarina, siendo apixabán el único que mostró reducción en el riesgo de sangrado mayor(10-13). Debe tenerse en cuenta que en aquellos pacientes con indicación de antiagregación plaquetaria posimplante de stent el riesgo de sangrado se incrementa.
Reportes de autopsia, quirúrgicos y de hallazgos en ecocardiograma transesofágico (ETE) confirman que más del 95% de los trombos en la FA no valvular se encuentran o se originaron en el apéndice auricular izquierdo (AAI). Por lo tanto, la exclusión del mismo de la circulación ha sido intentada en forma quirúrgica desde la década de 1960 y en forma percutánea en los últimos 20 años(14).
Indicación para el cierre percutáneo del apéndice auricular izquierdo
Las guías de la Sociedad Europea de Cardiología consideran el cierre percutáneo del AAI como una recomendación clase IIB para pacientes con riesgo de ACV y contraindicación para ACO a largo plazo(7).
En un estudio presentado por Tzicas y colaboradores(15), la indicación más frecuente fue en pacientes con contraindicación para ACO o riesgo de sangrado 75%, stent coronario 23%, interacción con drogas 18%, enfermedad hepática o renal 13%, riesgo de caídas y otros 13%.
En Canadá se restringe la indicación para pacientes con CHADS2 ³1 ycontraindicación para ACO o riesgo de sangrado solo dentro de un programa especial del sistema de salud estatal(6). En Estados Unidos el dispositivo de Watchman recibió reciente aprobación de la Federal Drug Administration (FDA) para el mismo grupo de pacientes(16).
Dispositivos para cierre del apéndice auricular izquierdo
PLAATO
El dispositivo percutáneo para el cierre de orejuela izquierda con catéter PLAATO, por su sigla en inglés (Apriva Medical Inc., Sunnyvale, California), fue el primero en ser implantado en humanos en 2001(17). A pesar de sus prometedores resultados iniciales fue retirado del mercado por razones comerciales.
Watchman
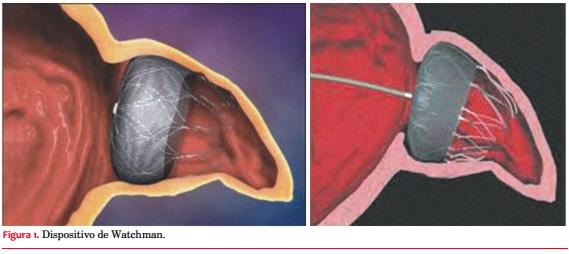
El segundo dispositivo fabricado para oclusión del AAI fue el Watchman, inicialmente desarrollado por la empresa Atritech Inc, Minnesota, y adquirido posteriormente por Boston Scientific en 2011 (figura 1).
Amplatzer Cardiac Plug
El Amplatzer Cardiac Plug (ACP) (St. Jude Medical, Plymouth, Minnnesota) fue diseñado para ocluir la entrada y el tercio proximal de la orejuela izquierda (figuras 2 y 3).
Evaluación de seguridad y eficacia de oclusión del apéndice auricular izquierdo
Estudio clínicos
Varios trabajos confirman la seguridad y eficacia del cierre del AAI en la prevención del ACV en pacientes con FA. La mayoría son registros que incluyen las experiencias iniciales, solo un estudio randomizado ha sido publicado a la fecha. Se trata
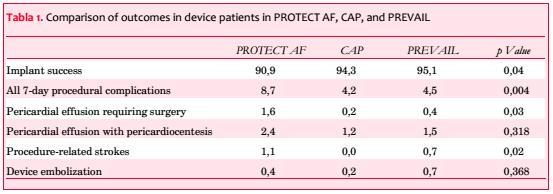
Posteriormente y en base a los resultados de eficacia de Protect AF se realizó el ensayo PREVAIL (Prospective Randomised Evaluation of the Watchman LAA Closure Device in Patients With Atrial Fibrilation vs Long Term Warfarin Therapy)(20). Se incluyeron 407 pacientes con una relación 2/1 de Watchman vs warfarina. Los resultados fueron publicados recientemente y se muestran en la tabla 1.
Superada la curva de aprendizaje se redujeron las complicaciones. La tasa de implante exitoso pasó de 90,3% a 95,0% con una significativa reducción del tiempo de procedimiento.
Desde la aparición en 2008 del ACP, más de 7.000 dispositivos se han implantado en todo el mundo. El ACP ha sido evaluado en distintos registros de Canadá, Europa, Asia y Latinoamérica(22). La tasa de derrame pericárdico relevante fue de 1,7%, embolización 1,1%, ACV isquémico 0,4% y éxito del procedimiento de 96%.
El trabajo de Tzikas(15) presenta un conjunto de 20 centros en Canadá y Europa, con una mediana de edad de 74,9 años, score CHA2DS2-VASc de 4.4, y score HAS-BLED de 3,2. La tasa de implante fue de 97,2% y en 93,2% el primer dispositivo elegido fue el implantado. La tasa de eventos adversos periprocedimientos fue de 4,1%. La tasa anual de ACV fue de 2,1%, un 63% inferior al esperado para una cohorte de pacientes con ese score CHA2DS2-VASC.
La descripción del implante del dispositivo detallado será para ACP debido a ausencia de disponibilidad del Watchman en Argentina y la falta de experiencia del autor.
La evaluación previa debe realizarse utilizando ETE, que permite descartar la presencia de trombos y tomar las medidas de zona de anclaje, profundidad y orificio de entrada del AAI. La tomografía computada cardíaca es también útil en proveer una imagen tridimensional de la orejuela así como para descartar la presencia de trombos en su interior.
Durante el procedimiento se recomienda guiarse con ETE, a pesar de reportes de la utilización de ecocardiograma intracardíaco (ICE) o radioscopia sin control ecocardiográfico. El acceso femoral derecho es el preferido ya que permite una llegada directa para la punción transeptal que debe hacerse en región más inferior y posterior que lo habitual.
Una vez realizada la punción se debe anticoagular al paciente con heparina Na hasta alcanzar un tiempo de coagulación activado mayor a 250 segundos. Es de extrema importancia evaluar la presencia de derrame pericárdico previo a la punción transeptal. Si lo hubiera, debe ser consignado como parámetro de base; los pacientes con FA crónica pueden tener derrame pericárdico laminar sin que esto signifique una complicación del procedimiento.
La medición fluoroscópica del AAI se realizará con la inyección manual de contraste con un catéter Pigtail marcado de 5 u 8 Fr, posicionado en el orificio de entrada de la misma y parcialmente introducido dentro de la vaina de 8 Fr del sistema de punción transeptal para opacificarla selectivamente. Las proyecciones angiográficas deben ser anterior y derecha con 30 grados de oblicuidad y entre 10 y 20 de cranealidad. Las proyecciones caudales dan una imagen anatómica del cuerpo de la orejuela, mientras que las craneales permiten definir el orificio de entrada y la zona de anclaje del lóbulo del ACP.
A continuación una cuerda metálica de intercambio de 260 mm con punta J tipo Amplatz Super Stijj de 0,035” se debe colocar en la vena pulmonar superior izquierda. Se debe progresar bajo cuerda la vaina de entrega hasta ser posicionada en la vena, para lo cual durante su recorrido, y especialmente en el septum interauricular, requerirá movimientos delicados rotacionales que permitan el avance de la misma. Posteriormente, con una ligera rotación antihoraria, se posiciona el extremo de la vaina en la zona de anclaje del dispositivo.
La proyección que se utilizará de guía para el implante es la oblicua anterior derecha.
Una vez medida la zona de anclaje la recomendación del fabricante es sobredimensionar entre 2 y 3 mm el diámetro máximo obtenido en la medición tanto radiológica como con ETE. Habitualmente la medición radiológica es en promedio 2 mm mayor que la ecocardiográfica. Una explicación al respecto podría ser la dilatación de la orejuela que se produce en el momento de inyección de contraste selectivo. La sobredimensión del dispositivo no es recomendable por el riesgo de laceración y ruptura además de impedir el adecuado posicionamiento de los ganchos de fijación sobre la pared de la orejuela.
El dispositivo una vez preparado se avanza hasta el extremo de la vaina, la cual debe estar adecuadamente posicionada en la zona de anclaje, coaxial al eje del cuello. El primer paso en el implante es el desenvainado con retiro del sistema de entrega hasta formar una figura circular (figura 4).
Si la posición es la adecuada con ETE y fluoroscopía se continúa desnudando el dispositivo retirándose la vaina transeptal. Si la angulación y la profundidad son los óptimos se continúa con la apertura del disco de retención. Esta maniobra requiere una ligera tracción del cable para permitir no solo la apertura del disco en la aurícula izquierda sino también la separación del mismo del lóbulo.
Si la posición del dispositivo no es la indicada en cualquiera de los pasos descritos, el dispositivo puede ser reenvainado solo hasta que el mismo tenga morfología espacial de bola, impidiendo que las marcas de platino ingresen a la vaina, protegiendo el extremo de la misma y la configuración de los ganchos de anclaje.
Previo a la liberación, cinco signos deben estar presentes para asegurar el adecuado posicionamiento del dispositivo:
1. Morfología espacial de llanta del lóbulo (apropiada compresión y anclaje de los ganchos en la pared de la orejuela).
2. Separación del lóbulo y del disco.
3. Disco de retención cóncavo que asegura el adecuado sellado del orificio de entrada.
4. Eje del lóbulo perpendicular al cuello en la zona de anclaje.
5. Lóbulo 2/3 distal a la arteria circunfleja en el ETE.
Si existen dudas acerca de la estabilidad del dispositivo se puede realizar una suave tracción del disco para asegurar el anclaje del lóbulo. La presencia de flujo residual debe ser evaluada con ETE. Se pueden realizar inyecciones de contraste a través de la vaina de entrega en distintas proyecciones que permitan evaluar el adecuado posicionamiento. No deben realizarse bajo ninguna circunstancia maniobras de empuje, ya que la movilización del dispositivo en el AAI puede provocar el desgarro y/o ruptura de la misma. Una vez alcanzada la posición satisfactoria el dispositivo es liberado con movimientos rotatorios antihorarios del cable de entrega.
Las complicaciones agudas en el implante de dispositivos de Watchman y ACP tienen una incidencia similar. El riesgo de ACV isquémico periprocedimiento es < 0,5%, derrame pericárdico relevante 1% a 2% y embolización 1% a 2%(23).
El derrame pericárdico que cause compromiso hemodinámico debe ser drenado inmediatamente. Si el dispositivo se emboliza debe ser retirado por vía percutánea, para lo cual es recomendable la utilización de vainas 2 Fr más grandes que las empleadas para la entrega del dispositivo. Si el dispositivo embolizado se encuentra en una posición estable y sin riesgo de generar complicaciones inmediatas, la extracción quirúrgica debe ser considerada como una alternativa.
En aquellos pacientes con pérdida residual peridispositivo puede ocurrir trombosis o ACV. Para la evaluación adecuada de este tipo de complicaciones se debe realizar ETE en el seguimiento inmediato y a los seis meses posimplante. La formación de trombos en la parte auricular del dispositivo puede ocurrir con una incidencia de 2% a 5%. La tasa de eventos tromboembólicos reportados relacionados al dispositivo ha sido muy baja (0,3%-0,7%)(23).
Selección de los dispositivos
A pesar de la evaluación con ETE, la información obtenida se encuentra limitada por la escasa resolución espacial del método. Habitualmente la tomografía es muy útil en proveer información detallada de las características anatómicas y de la complejidad de la orejuela. Esta información podría colaborar con la selección del dispositivo, pero en nuestro medio esta práctica está limitada por la escasa disponibilidad de distintas alternativas. En función de la anatomía se han definido cuatro tipos de orejuelas: alas de pollo, cactus, coliflor y manga de viento(24). Se debe prestar especial atención a la anatomía de la zona de anclaje, evaluándose su esfericidad, bordes pectíneos, trabeculaciones, lóbulos adicionales y divertículos.
Para el implante de los ACP/Amulet es indispensable la evaluación del cuello y la porción proximal, en tanto que para el Watchman es más relevante el análisis del cuerpo, profundidad y lóbulos de la orejuela. En general, los dos dispositivos se acomodan al 95% de las orejuelas.
Conclusiones
El cierre del AAI de forma percutánea es un procedimiento en expansión, complejo, factible, que requiere de una inestimable curva de aprendizaje. Se debe tener una experiencia apropiada no solo en la anatomía del defecto a corregir, sino también en el manejo de los dispositivos y las potenciales complicaciones relacionadas al implante de los mismos.
A pesar que el dispositivo de Watchman posee los datos de soporte más relevantes, en los últimos cinco años la utilización del ACP ha aumentado considerablemente. Por el momento es el único disponible en la mayoría de los países de la región. Sería mandatorio un estudio comparativo entre ACP y Watchman.
En la decisión de realizar el cierre de orejuela con dispositivo en lugar de la terapia anticoagulante no solo es importante la evaluación costo-beneficio, también debemos tener mayor certeza de cómo es la evolución a largo plazo en relación con la eficacia y los efectos adversos.
Bibliografía
1. Colilla S, Petkun W, Singer DE, Simon T, Liu X. Estimates of current and futureincidence and prevalence of atrial fibrillation in the U.S. adult population. Am J Cardiol 2013; 112(8):1142-7. doi: 10.1016/j.amjcard.2013.05.063.
2. Wolf PA,
3. Wolf PA,
4. Hart RG, Pearce LA, Aguilar MI. Meta analysis:antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007;146(12):857-67
5. Ezekowitz MD, Bridgers SL, James KE, Carliner NH, Colling CL, Gornick CC, et al. Warfarin in the prevention of stroke associated with nonrheumatic atrial fibrillation. Veterans affairs stroke prevention in non-rheumatic atrial fibrillation investigators. N Engl J Med 1992;327(20):1406-12.
6. Skanes AC, Healey JS, Cairns JA, Dorian P, Gillis AM, McMurtry MS, et al. Focused 2012 update of the Canadian Cardiovascular Society atrial fibrillation guidelines: recommendations for stroke prevention and rate/rhythm control. Can J Cardiol 2012;28(2):125-36. doi: 10.1016/j.cjca.2012.01.021.
7. Camm AJ, Lip GY, De Caterina R, Savelieva I, Atar D, Hohnloser SH, et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC guideline for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J 2012;33(21):2719- 47. doi: 10.1093/eurheartj/ehs253.
8. Nieuwlaat R, Capucci A, Camm AJ, Olsson SB, Andresen D, Davies DW, et al. Atrial fibrillation management: a prospective survey in ESC member countries: the Euro Heart Survey on atrial fibrillation. Eur Heart J 2005;26(22):2422-34.
9. RENAFA. Registro Nacional de FA. Trabajo presentado en: 37°. Congreso Argentino de Cardiología; 2011 Oct 2-4; Buenos Aires, Argentina.
10. Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, et al. Dabigatran vs warfarin in patients with atrial fibrillation. N Engl J Med 2009;361(12):1139-51. doi: 10.1056/NEJMoa 0905561.
11. Granger CB, Alexander JH, McMurray JJ,
12. Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, et al, for the ROCKET AF Investigators. Rivaroxaban versus warfarin in non-valvular atrial fibrillation. N Engl J Med 2011;365(10): 883-91. doi: 10.1056/NEJMoa1009638.
13. Ahrens I, Lip GY, Peter K. What do the RE-LY, AVERROES and ROCKET-AF trials tell us for stroke prevention in atrial fibrillation? Thromb Heamost 2011;105(4):574-8. doi: 10.1160/TH10-12-0808.
14. Blackshear JL, Odell JA. Appendage obliteration to reduce stroke in cardiac surgical patients with atrial fibrillation. Ann Thorac Surg 1996;61(2): 755-9.
15. Tzikas A. LAAO for stroke prevention in AF: multicenter experience with the Amplatzer Cardiac Plug. Paper presented at: Transcatheter Cardiovascular Therapeutics; 2013 Oct 28 - Nov 1;
16.
17. Sievert H, Lesh MD, Trepels T, Omran H, Bartorelli A, Della Bella P, et al. Percutaneous left atrial appendage transcatheter occlusion to prevent stroke in high risk patients with atrial fibrillation; early clinical experience. Circulation 2002;105(16): 1887-9.
18. Holmes DR, Reddy VY, Turi ZG, Doshi SK, Sievert H, Buchbinder M, et al. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation; a randomized non inferiority trial. Lancet 2009;374(9689):534-42. doi: 10.1016/S0140-6736 (09)61343-X.
19. Reddy VY, Holmes D,
20. Holmes DR, Kar S, Price MJ, Whisenant B, Sievert H, Doshi SK, et al. Prospective randomized evaluation of the Watchman Left Atrial Appendage Closure device in patients with atrial fibrillation versus long-term warfarin therapy: the Prevail Trial. J Am Coll Cardiol 2014;64(1):1-12. doi: 10.1016/j.jacc. 2014.04.029.
21. Reddy VY, Möbius-Winkler S, Miller MA, Neuzil P, Schuler G, Wiebe J, et al. Left atrial appendage closure with the Watchman device in patients with a contra indication for oral anticoagulation; the ASAP study (ASA Plavix Feasibility Study With Watchman Left Atrial Appendage Closure Technology). J Am Coll Cardiol 2013;61(25):2551-6. doi: 10.1016/j. jacc.2013.03.035.
22. Park JW, Bethencourt A, Sievert H, Santoro G, Meier B, Walsh K, et al. Left atrial appendage closure with Amplatzer Cardiac Plug in atrial fibrillation: Initial European experience. Catheter Cardiovasc Interv 2011; 77(5):700-6. doi: 10.1002/ccd. 22764.
23. Reddy VY, Doshi SK, Sievert H, Buchbinder M, Neuzil P, Huber K, et al. Percuteous left atrial appendage closure for stroke prophylaxis in patients with atrial fibrillation: 2.3-year-follow up of the PROTECT AF (Watchman Left Atrial Appendage System for Embolic Protection in Patients with Atrial Fibrillation)Trial. Circulation 2013;127(6):720- 9. doi: 10.1161/CIRCULATIONAHA.112.114389.
24. Di Biase L, Santangeli P, Anselmino M, Mohanty P, Salvetti I, Gili S, et al. Does the left atrial appendage morphology correlate with the risk of stroke in patients with atrial fibrillation? Results from a multicenter study. J Am Coll Cardiol 2012;60(6):531-8. doi: 10.1016/j.jacc.2012.04.032.