Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión impresa ISSN 0797-0048versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.31 no.1 Montevideo abr. 2016
ESPECIAL
FIBRILACIÓN
AURICULAR
Artículo de revisión
Fibrilación auricular en situaciones especiales
Dres. Jorge González Zuelgaray, Atilio M. Abud, Marcelo Abud, Agustín Picolini, Ariel E. Szyszko
Palabras clave:
FIBRILACIÓN AURICULAR
CIRUGÍA CARDÍACA
PERÍODO POSOPERATORIO
HIPERTIROIDISMO
EMBARAZO
COMPLICACIONES CARDIOVASCULARES DEL EMBARAZO
INFARTO DEL MIOCARDIO
SÍNDROME DE WOLFF-PARKINSON-WHITE
INSUFICIENCIA CARDÍACA
Key words:
ATRIAL FIBRILLATION
CARDIAC SURGERY
POSTOPERATIVE PERIOD
HYPERTHYROIDISM
PREGNANCY
PREGNANCY COMPLICATIONS, CARDIOVASCULAR
MYOCARDIAL INFARCTION
WOLFF-PARKINSON-WHITE SYNDROME
HEART FAILURE
Este artículo forma parte de la segunda edición del libro Tratamiento de la fibrilación auricular, de González Zuelgaray J (ed.), Buenos Aires: Editorial Inter-Médica (en prensa), y se publica con autorización
Fibrilación auricular en el posoperatorio de la cirugía cardíaca
Introducción
La fibrilación auricular (FA) es la arritmia cardíaca más frecuente en el posoperatorio de la cirugía cardíaca y se asocia con un aumento de la morbimortalidad intrahospitalaria, mayor tiempo de internación y aumento de los costos médicos(1-4). El reto más importante en relación con la FA poscirugía cardíaca reside en conocer los factores predisponentes, para así prevenir su aparición y sus consecuencias.
La incidencia de esta arritmia varía según el tipo de cirugía: es de 30% luego de la cirugía de revascularización miocárdica, de 40% poscirugía valvular y de 50% en el caso de cirugías combinadas. Más comúnmente, se presenta entre el segundo y el cuarto día del posoperatorio(5,6).
Predictores de la ocurrencia de fibrilación auricular
Más allá de los factores de riesgo habitualmente asociados al desarrollo de FA (como la hipertensión arterial, el índice de masa corporal elevado, el antecedente de infarto de miocardio, la diabetes, el síndrome metabólico y el tiempo de clampeo)(7), existen otros específicos que detallaremos a continuación.
Aunque todavía se encuentra en investigación, hay evidencias a favor de una respuesta inflamatoria posquirúrgica expresada en el incremento de los niveles de marcadores de inflamación (como la proteína C reactiva y la interleukina-6)(8,9). El rol del estrés oxidativo en la aparición de FA luego de una cirugía de revascularización con circulación extracorpórea ha sido destacado en un estudio reciente que mostró un aumento significativo de marcadores séricos de estrés oxidativo en los pacientes que desarrollaron FA(10).
Otros ensayos mostraron que el volumen de grasa pericárdica era una variable independiente para el desarrollo de FA poscirugía cardíaca(12,13).
Varios estudios han evaluado la influencia de la apnea obstructiva del sueño sobre la aparición de FA posquirúrgica. Así, un metaanálisis que incluyó investigaciones en las que se utilizó polisomnografía para el diagnóstico de apnea del sueño confirmó que dicho cuadro es un factor de riesgo independiente para el desarrollo de FA poscirugía de revascularización miocárdica(14,15).
Un puntaje de riesgo sencillo y de bajo costo que se ha propuesto para predecir la ocurrencia de FA incluye diferentes variables: enfermedad pulmonar obstructiva crónica, indicación de la cirugía con carácter de emergencia, necesidad de balón de contrapulsación previo a la cirugía, cirugía valvular, depresión severa de la función sistólica del ventrículo izquierdo e insuficiencia renal con clearance de creatinina menor de 15 ml/h. Los autores consideran que un score mayor o igual a 3 indica un riesgo elevado y en tal caso recomiendan la profilaxis con amiodarona, en tanto el uso de betabloqueantes quedaría reservado a los pacientes con un valor menor de 3(16).
Aunque Kolek y colaboradores diseñaron un modelo clínico-genético para predecir qué pacientes tienen más chance de padecer FA en el posoperatorio de la cirugía cardíaca, los resultados indican que el componente genético aporta una contribución solo marginal y sería apenas una variable más(17).
Por otra parte, en un análisis retrospectivo de 815 pacientes sometidos a cirugía cardíaca se mostró una correlación positiva entre la incidencia de FA y la cantidad de transfusiones de hemoderivados(18).
Al analizar los cambios del ritmo en la hora previa al inicio de la FA en pacientes sometidos a cirugía de revascularización miocárdica se detectó la presencia de extrasístoles supraventriculares frecuentes, episodios breves de taquicardia auricular y menor frecuencia cardíaca(19). También se observó en un estudio prospectivo poscirugía de revascularización miocárdica que una respuesta anormal de la turbulencia de la frecuencia cardíaca siguiendo a extrasístoles se asociaba a un aumento de FA, tanto en la fase intrahospitalaria como en el seguimiento alejado(20). La morfología de la onda P en las derivaciones aVR y V1 es un potente predictor de FA poscirugía cardíaca. Así, una escasa negatividad en aVR y gran positividad o morfología bimodal en V1 tienen valor pronóstico y podrían ser una guía para la profilaxis en pacientes sometidos a cirugía cardíaca(21).
Entre los métodos complementarios para identificar a los pacientes con riesgo aumentado de FA poscirugía cardíaca, la ecocardiografía ha sido uno de los más analizados. De todos los parámetros ecocardiográficos, el volumen, el área y la fracción de eyección de la aurícula izquierda fueron los únicos predictores independientes para la aparición de FA(22). También se postuló la duración del tiempo total de activación auricular (desde el inicio de la onda P en DII hasta el pico de la onda A en el Doppler mitral) mayor de 147,3 mseg como variable independiente para el desarrollo de FA en pacientes que serían sometidos a cirugía de revascularización(23,24).
Prevención de la fibrilación auricular en el posoperatorio de la cirugía cardíaca
Las guías de la Sociedad Europea de Cardiología para el manejo de la FA publicadas en 2010 propusieron a los betabloqueantes sin actividad simpaticomimética intrínseca como la terapia más efectiva para la prevención de la arritmia cuando son administrados en la semana previa e inmediatamente luego de la cirugía(6). Un metaanálisis evaluó la utilidad del carvedilol en la prevención de la FA debido a su efecto betabloqueante no selectivo, antioxidante, antiinflamatorio y su propiedad de bloquear múltiples canales catiónicos. El carvedilol redujo en forma significativa la incidencia de FA poscirugía cardíaca y fue superior a metoprolol. De todas maneras, se requieren estudios prospectivos randomizados(25-27).
La amiodarona profiláctica disminuye la incidencia de FA luego de la cirugía cardíaca, acorta significativamente la internación, reduce la incidencia de stroke y de taquiarritmias ventriculares, pero no reduce la mortalidad posoperatoria.
Con sotalol se demostró una disminución de 64% en la incidencia de FA poscirugía cardíaca en comparación con placebo, pero no hubo impacto sobre la duración de la estadía hospitalaria, el stroke o la mortalidad(5). Además, aumentó el riesgo de bradicardia y torsade des pointes, en especial en los pacientes con trastornos hidroelectrolíticos.
Los corticoides poseen un potente efecto antiinflamatorio y en este sentido los metaanálisis han demostrado que se asocian a una reducción de 26%-45% en el desarrollo de FA poscirugía cardíaca, con un acortamiento de la internación. Sin embargo, a este beneficio se contraponen efectos adversos como la alteración en el metabolismo de la glucosa y una mayor predisposición a infecciones, por lo que su empleo es controvertido(30).
Con respecto al uso de los inhibidores de la enzima convertidora de la angiotensina o los bloqueantes de los receptores de la angiotensina, varios estudios retrospectivos reportaron que no modifican la incidencia de FA luego de la cirugía cardíaca, a lo que debe sumarse un potencial efecto deletéreo sobre la función renal.
Aunque estudios recientes evidencian la eficacia y seguridad de la colchicina para la prevención de la FA poscirugía cardíaca y otros se encuentran en curso para evaluar este beneficio(31), existen estudios randomizados que muestran que si bien la colchicina previene el síndrome pospericardiotomía, no disminuye la incidencia de FA(32).
Opciones no farmacológicas
La estimulación auricular ha sido propuesta para la prevención de la FA en el posoperatorio de la cirugía cardíaca y aunque hay metaanálisis que afirman su utilidad, estudios recientes no confirman dicha hipótesis. Más allá de la literatura, existen inconvenientes técnicos con un potencial efecto proarrítmico (como mal funcionamiento de los cables con las consiguientes fallas de sensado o de estimulación)(33).
También se ha sugerido la pericardiotomía posterior para reducir la incidencia de FA. Sin embargo, Kongmalai y colaboradores demostraron que además de no lograrse este objetivo, hubo un incremento de las complicaciones(34).
Sobre la base de una menor incidencia de FA posquirúrgica en pacientes sometidos a trasplante cardíaco (atribuible a una denervación autonómica)(35), un reciente estudio piloto randomizado resalta el valor del mapeo y ablación de ganglios autonómicos durante la cirugía de revascularización miocárdica, aunque los autores resaltan la necesidad de un futuro metaanálisis(36) .
Finalmente, un estudio randomizado mostró que la aplicación de un parche de hidrogel con amiodarona sobre el epicardio de ambas aurículas es una técnica sencilla, rápida y eficaz que disminuye significativamente la incidencia de FA poscirugía cardíaca sin las complicaciones sistémicas de dicho fármaco(37).
Tratamiento
El tratamiento de la FA poscirugía cardíaca depende principalmente de su tolerancia hemodinámica. En pacientes estables se debe buscar la conversión a ritmo sinusal dentro de las 24 horas del inicio de la arritmia. Para ello, en primer lugar deben corregirse los factores desencadenantes (dolor, efecto deletéreo de agentes inotrópicos, alteraciones del medio interno, anemia e hipoxia), tras lo cual se recurre a los fármacos antiarrítmicos (de los cuales, la amiodarona es el más efectivo). Para el control de la frecuencia cardíaca son útiles los betabloqueantes o los bloqueantes cálcicos no dihidropiridínicos, aunque hay ocasiones en que se debe administrar digoxina.
En pacientes sintomáticos o con inestabilidad hemodinámica se debe realizar cardioversión eléctrica (CE) sincronizada con urgencia. El riesgo de stroke está incrementado en estos pacientes, por lo que se debe iniciar anticoagulación con heparina o antagonistas de la vitamina K (anti VitK ) si la FA persiste por más de 48 horas.
Conclusiones
La FA es la arritmia que ocurre con mayor frecuencia luego de la cirugía cardíaca y, además de causar deterioro hemodinámico, es un factor de riesgo para stroke y aumenta la mortalidad. Su incidencia depende del tipo de cirugía cardíaca.
Una adecuada profilaxis acorta la internación y reduce la morbimortalidad. Dado que está claramente demostrado el efecto beneficioso de los betabloqueantes para la prevención de la FA, deben ser utilizados de rutina en ausencia de contraindicaciones. Aunque el sotalol es superior a los betabloqueantes, se asocia a efectos adversos. De ser necesario, la amiodarona debería ser utilizada en forma adicional a los betabloqueantes frente a un efecto insuficiente de estos fármacos o en presencia de contraindicaciones para su utilización.
Fibrilación auricular en el hipertiroidismo
Epidemiología
El hipertiroidismo clínico se caracteriza por niveles bajos o no detectables de tirotrofina plasmática (TSH) con niveles elevados de triiodotironina (T3) y tiroxina (T4). En el hipertiroidismo subclínico se observan niveles plasmáticos bajos de TSH con valores de T3 y T4 dentro del rango normal.
La FA es la complicación cardiovascular más frecuente en estos pacientes, con una incidencia estimada de 10%-25%(38). Datos provenientes del estudio Framingham evidenciaron que el riesgo de padecer FA en el lapso de diez años en los pacientes con TSH baja (< 0,1 mU/L) fue tres veces mayor que en los pacientes con TSH normal (28% vs 11%)(39). Otro estudio observacional con un seguimiento de ocho años identificó al nivel bajo de TSH (cuartilo inferior) como un factor de riesgo independiente para el desarrollo de FA(40).
La prevalencia de FA en el hipertiroidismo clínico es de 13,7%, en tanto es de 12,7% en el hipertiroidismo subclínico y de 2,3% en los pacientes eutiroideos(41). Osman y colaboradores mostraron que los factores asociados en forma independiente a la FA en el hipertiroidismo son la edad, el antecedente de insuficiencia cardíaca, diabetes, hipertensión arterial o la existencia de hipertrofia ventricular izquierda en el electrocardiograma (ECG)(42).
Finalmente, se observó hipertiroidismo en el 3,2% de los casos en una población con FA de comienzo reciente y sin disfunción tiroidea conocida, en comparación con el 1% de la población general(43). El riesgo de padecer hipertiroidismo se incrementó sustancialmente en varones jóvenes de mediana edad.
Mecanismos
Las hormonas tiroideas tienen un impacto significativo sobre la función del aparato cardiovascular por medio de acciones genómicas (es decir, a nivel del núcleo celular) y no genómicas que finalmente producirán, en el hipertiroidismo, un incremento en el tono simpático y disminución del tono vagal con el consiguiente aumento de la frecuencia cardíaca(44). El gasto cardíaco aumenta debido a la disminución de la resistencia vascular sistémica, al aumento de la frecuencia cardíaca y del volumen intravascular, asociado al incremento de la contractilidad y de la fracción de eyección del ventrículo izquierdo.
La acción de las hormonas tiroideas sobre las propiedades electrofisiológicas cardíacas ha sido ampliamente evaluada en modelos experimentales. Se ha observado que en el hipertiroidismo aumenta el automatismo, disminuye la duración del potencial de acción y del período refractario auricular efectivo, se altera el funcionamiento y la expresión de los canales iónicos y aumenta la actividad gatillada en las venas pulmonares(45).
Asimismo, hay un marcado incremento de marcadores inflamatorios como la proteína C reactiva de alta sensibilidad(46), y de los niveles de autoanticuerpos para los receptores adrenérgicos b1 y muscarínicos de tipo 2(47). Ambas situaciones se asociaron de manera independiente al desarrollo de FA en pacientes con hipertiroidismo.
Tratamiento
El principal objetivo terapéutico en estos pacientes es restablecer el estado eutiroideo con carbimazol, metimazol, propiltiouracilo, yodo radiactivo y en algunos casos está indicada la tiroidectomía total para una rápida reversión de la tirotoxicosis(48). También pueden ser útiles el perclorato de potasio o los corticoides.
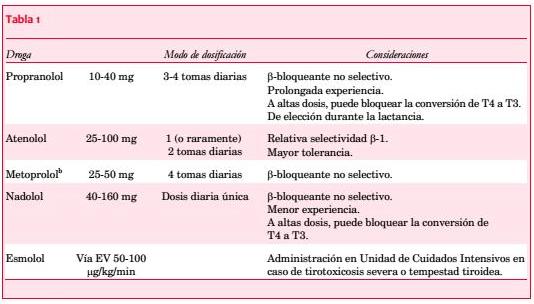
La cardioversión de la FA generalmente resulta inefectiva o se observa una alta tasa de recurrencias en tanto no se logre un estado eutiroideo(49). Por lo tanto, el tratamiento de la FA en el hipertiroidismo comienza con el control de la frecuencia cardíaca con betabloqueantes (en especial en ausencia de insuficiencia cardíaca descompensada)(6,50). Estos fármacos favorecen el control de la ansiedad o los temblores asociados a la sobreexpresión de los receptores b1. En la tabla 1 se describen los distintos betabloqueantes utilizados en el tratamiento del hipertiroidismo según las recomendaciones de American Thyroid Association / American Society of Clinical Endocrinologists (ATA/ASCE)(48).
En presencia de contraindicaciones para el empleo de betabloqueantes pueden utilizarse los antagonistas cálcicos (diltiazem o verapamilo), aunque debe considerarse que estos fármacos exacerban el efecto de las hormonas tiroideas sobre el músculo liso vascular con el riesgo de producir hipotensión arterial severa(51). La digoxina es también una opción para el control de la respuesta ventricular, aunque las variaciones hemodinámicas y autonómicas que ocurren en el hipertiroidismo producen una resistencia al efecto de la digital con necesidad de mayores dosis y el consiguiente aumento del riesgo de toxicidad.
Una vez alcanzado el estado eutiroideo, es frecuente que ocurra la reversión espontánea a ritmo sinusal. Nakazawa y colaboradores demostraron dicho efecto en las 8-10 semanas posteriores a la normalización de la función tiroidea en el 62% de los pacientes(52). Muy pocos pacientes revierten espontáneamente una vez transcurrido dicho lapso.
En pacientes con FA persistente que fueron sometidos a CE una vez normalizada la función tiroidea, Siu y colaboradores observaron mayor tasa de mantenimiento del ritmo sinusal en comparación con los pacientes con FA sin hipertiroidismo(53).
El tratamiento anticoagulante en la FA asociada a hipertiroidismo continúa siendo un tema de controversia. Chen y colaboradores comunicaron que los pacientes hipertiroideos tenían valores elevados de dímero D y un incremento significativo del riesgo de accidente cerebrovascular (ACV) isquémico en comparación con los individuos con FA sin hipertiroidismo(54). Sin embargo, la edad era más avanzada y era mayor el puntaje CHADS2 promedio. Por su parte, en una serie de 8.962 pacientes con FA, un estudio de Bruere y colaboradores mostró que el hipertiroidismo no constituye un factor de riesgo independiente de ACV o embolia sistémica(55). El riesgo embólico asociado al antecedente de hipertiroidismo no está definido en un paciente actualmente eutiroideo con CHA2DS2-VASc de 0, por lo que las guías europeas no consideran esta comorbilidad para indicar anticoagulación(6).
El hipertiroidismo es un marcador independiente de recurrencia posterior a la ablación por catéter debido a la presencia de múltiples focos ectópicos tanto en las venas pulmonares como fuera de ellas(56).
Amiodarona e hipertiroidismo
El extenso uso de la amiodarona en el contexto de la FA lleva a considerar su potencial efecto deletéreo sobre la función tiroidea. Cada molécula de amiodarona contiene dos átomos de iodo que constituyen el 37,5% de su masa. Así, una dosis diaria de 200 mg provee una cantidad de yodo libre 20-40 veces mayor que la recomendada para el consumo diario(57).
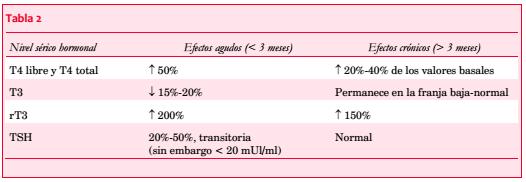
Se ha reportado hipertiroidismo inducido por amiodarona en el 5% de los pacientes(58), con una mayor prevalencia en varones mayores de 65 años y en quienes habitan en zonas con déficit de iodo(59,60).
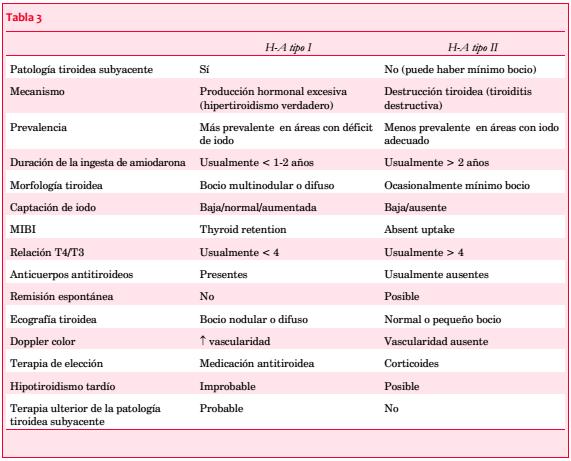
En la tabla 3 se describen las diferencias entre ambas formas de HT-A, lo cual tiene importantes implicancias terapéuticas.
El HT-A tipo I responde a las tionamidas (metimazol, propiltiouracilo) y al perclorato de potasio, mientras que el HT-A tipo II responde a la terapia con dosis altas de corticoides y a la discontinuación de la amiodarona, recuperando el estado eutiroideo a los 3-5 meses. Este último puede autolimitarse, lo cual no ha sido descrito para el HT-A tipo I(58). Por lo tanto, es de fundamental importancia evaluar la función tiroidea antes del inicio del tratamiento, entre uno y tres meses luego del inicio y a continuación cada tres a seis meses(48).
La suspensión del tratamiento con amiodarona es una decisión controvertida debido a su prolongada vida media y a sus propiedades antagonistas sobre la T3 (inhibe la enzima 5-deiodinasa que transforma T4 en T3), lo que puede exacerbar los síntomas de hipertiroidismo(48,58,59). Cuando la condición cardíaca se encuentra inestable se prefiere continuar con la administración de amiodarona, en tanto en pacientes con antecedentes de HT-A podría realizarse tratamiento preventivo con iodo radiactivo antes del reinicio de la amiodarona(59,61).
Introducción
Durante el embarazo se produce un incremento de la frecuencia cardíaca, del volumen minuto y una disminución de la resistencia vascular periférica como consecuencia de la relajación del músculo liso por efecto de la progesterona y otras sustancias vasodilatadoras (óxido nítrico, prostaglandinas y calcio). La formación de la placenta y el desarrollo de la circulación fetal contribuyen a la expansión del volumen intravascular, lo que provoca el aumento del volumen de fin de diástole ventricular y dilatación auricular.
Estas variaciones hemodinámicas, asociadas a cambios en el tono autonómico (aumento de los niveles plasmáticos de catecolaminas y mayor sensibilidad de los receptores adrenérgicos), a los efectos directos de los estrógenos sobre las propiedades electrofisiológicas cardíacas, a la hipopotasemia y –eventualmente– a la presencia de cardiopatía estructural, generan un estado arritmogénico.
Un estudio reciente en mujeres embarazadas sin cardiopatía demostró en el análisis del ECG y del eco Doppler tisular una marcada prolongación del intervalo de acoplamiento electromecánico auricular y aumento en la dispersión de la onda P, factores que incrementan el riesgo de FA(62).
La FA, que es muy rara en el embarazo, generalmente se asocia a hipertiroidismo y en el 0,5%-4% de los casos a una cardiopatía subyacente. Li y colaboradores reportaron una incidencia de FA de 2 cada 100 mil embarazadas hospitalizadas(63).
En el registro prospectivo, multicéntrico y observacional con la mayor población de pacientes embarazadas con cardiopatía estructural (ROPAC)(64), las cardiopatías más comunes fueron las congénitas (66%), y, entre las adquiridas, las valvulopatías (25,5%) y otras miocardiopatías (6%).
En relación con las cardiopatías congénitas, la comunicación interauricular, la anomalía de Ebstein y la transposición de los grandes vasos (sometida a cirugía con las técnicas de Mustard o Senning) son las que con mayor frecuencia se asocian a arritmias supraventriculares y a FA en la etapa fértil de la vida: 7,5%, 30% y 50%, respectivamente(65-67).
En una serie de gestantes con estenosis mitral la incidencia de FA fue de 2,5% y su inicio se asoció con insuficiencia cardíaca en el 75% de los casos(65,68).
En presencia de cardiopatía estructural se observaron recidivas de FA durante el embarazo en el 52% de las gestantes con episodios previamente documentados(69).
Otras asociaciones menos frecuentes con la ocurrencia de FA en el embarazo se presentan en pacientes con síndrome de Wolff-Parkinson-White, disturbios electrolíticos, embolia de pulmón y el uso de fármacos con efectos tocolíticos (terbutalina y nifedipina).
La incidencia de cardiopatía isquémica en el embarazo se correlaciona en forma positiva con la mayor edad gestacional y la existencia de obesidad, diabetes, hipertensión arterial y tabaquismo, factores que incrementan el riesgo de FA. La FA solitaria constituye una situación clínica excepcional.
Tratamiento farmacológico
La absorción, distribución, metabolización y excreción de los fármacos se encuentran alteradas por los cambios fisiológicos que acontecen en el embarazo. El mayor tiempo de vaciamiento gástrico e intestinal pueden afectar la absorción, mientras que el aumento del volumen intravascular aumenta el volumen de distribución. Las concentraciones de albúmina disminuyen, por lo que aumenta la fracción de fármacos que circulan libres en el plasma. Por su parte, el aumento del gasto cardíaco incrementa el filtrado glomerular, aumentando el clearance por orina. El incremento de la actividad de la citocromo P450 hepática, mediado por la acción de los estrógenos y la progesterona, incrementa el metabolismo. Las modificaciones en los niveles plasmáticos, asociadas al pasaje de la barrera placentaria, deben tenerse en cuenta cuando se analiza la administración de un agente antiarrítmico y se debe evaluar el beneficio de la reducción o eliminación de la arritmia en comparación con los efectos indeseables del tratamiento.
El riesgo general de malformaciones congénitas en el embarazo es de 1%-3%, de las cuales solo el 10% se asocia con el uso de diversos fármacos. El riesgo es mayor durante el primer trimestre y depende del tipo de fármaco, la duración de la exposición, la susceptibilidad genética y la capacidad de atravesar la barrera placentaria.
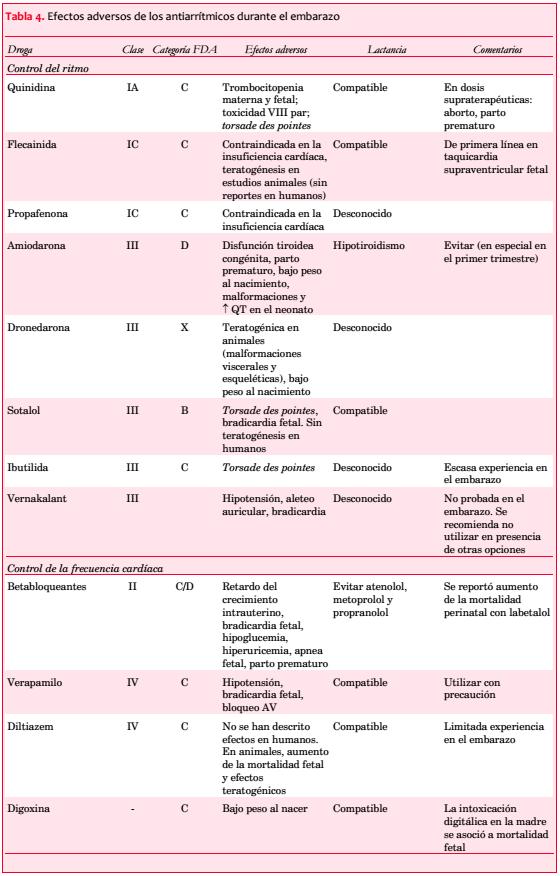
El uso de fármacos antiarrítmicos debe evitarse en el primer trimestre del embarazo por el riesgo de teratogénesis y posteriormente por la posibilidad de provocar retardo del crecimiento intrauterino, proarritmia, bradicardia e hipotensión. Por otra parte, debe utilizarse la menor dosis posible y durante breves períodos de tiempo.
· Categoría A
o Estudios controlados que no muestran riesgo.
· Categoría B
o Sin evidencias de riesgo en el embarazo en estudios adecuados.
o Efectos adversos en animales o posibilidad remota de daño fetal.
· Categoría C
o No se dispone de estudios controlados y los estudios en animales demuestran riesgo fetal.
· Categoría D
o Evidencia positiva de riesgo durante el embarazo.
· Categoría X
o Contraindicado en el embarazo.
· Categoría N
o No clasificada.
Esta clasificación presenta importantes limitaciones debido a la falta de información acerca de las dosis y la duración del tratamiento, y la edad gestacional en el momento de la exposición a las drogas investigadas, a lo que se suma la ausencia de datos en relación con la eficacia y seguridad de nuevas drogas incorporadas a la práctica médica.
Los betabloqueantes atraviesan la barrera placentaria y se asocian con los efectos adversos previamente mencionados. Se prefieren los agentes con efecto b-1 y alfabloqueante, para abolir la interferencia con la relajación uterina y la vasodilatación mediada por el efecto b-2. La FDA ha reubicado a acebutolol y pindolol en la categoría B, y junto al metoprolol (C) son considerados agentes de primera elección. Existe una amplia experiencia sin riesgos ostensibles con el uso de propranolol. Los betabloqueantes deben evitarse durante el primer trimestre del embarazo, particularmente el atenolol (categoría D), que se asocia con un riesgo elevado de retardo del crecimiento intrauterino.
En un estudio observacional retrospectivo de betabloqueantes en la embarazada con el mayor número de pacientes reportado en la literatura, Meidahl Petersen y colaboradores(71) observaron que el bloqueo betaadrenérgico en el embarazo se asoció con mayor riesgo de parto prematuro, bajo peso para la edad gestacional y mortalidad perinatal (esto último relacionado específicamente con el uso de labetalol). Concluyeron que el labetalol no es más seguro que otros betabloqueantes durante el embarazo. No hay datos suficientes en relación con la eficacia y seguridad de bisoprolol y de carvedilol, por lo cual no se recomienda su administración a las gestantes.
Para el control de la frecuencia cardíaca, el consenso de la Sociedad Europea de Cardiología recomienda en primer término a los bloqueantes betaadrenérgicos y a los antagonistas cálcicos no dihidropiridínicos. Si estos agentes están contraindicados, debería considerarse la digoxina. Según las guías norteamericanas, cualquiera de estas drogas puede ser utilizada como tratamiento de primera línea.
La Sociedad Europea de Cardiología recomienda la administración de ibutilida o flecainida (indicación clase IIb, con nivel de evidencia C) para la cardioversión farmacológica de la FA de reciente comienzo en ausencia de cardiopatía estructural, en tanto las guías estadounidenses postulan el uso de quinidina o procainamida (en ambos casos como indicaciones de clase IIb, con nivel de evidencia C).
Cardioversión eléctrica
La CE constituye una opción terapéutica en la FA refractaria a los fármacos antiarrítmicos o en presencia de severo deterioro hemodinámico que pone en riesgo a la madre o al feto. En el tercer trimestre existe el riesgo de que una mayor intensidad de energía alcance al feto debido a que el líquido amniótico y el músculo uterino son excelentes conductores de la electricidad(72-74).
La FA con alta respuesta ventricular en presencia de preexcitación ventricular constituye otra clara indicación. El incremento del volumen sanguíneo, la hemodilución y la cardiomegalia, asociados a cambios en el volumen torácico y pulmonar, no modifican la impedancia transtorácica, por lo que la energía necesaria para una CVE efectiva en el embarazo es similar a la de la población general. Debido al bajo nivel de energía que llega al útero y al elevado umbral fibrilatorio del corazón fetal, es poco probable que ocurra un efecto proarrítmico sobre el feto(75,76). La información disponible proviene de reportes de casos, de estudios observacionales con escaso número de pacientes(77,78) y de reportes relacionados con la seguridad y eficacia del cardiodesfibrilador implantable en el embarazo(79-81).
Aunque la emisión de un choque de hasta 400 joules en cualquier etapa del embarazo en general ha demostrado ser segura para el feto, también se han observado complicaciones: bradicardia fetal, alteración de la variabilidad de la frecuencia cardíaca, contracciones uterinas persistentes y distrés fetal con la necesidad de realización de una cesárea de urgencia(82). En estudios previos de pacientes embarazadas que recibieron choques eléctricos por un cardiodesfibrilador implantable, no se reportaron efectos adversos en el feto, con la excepción de un aborto espontáneo en relación con una terapia del dispositivo en la cuarta semana de gestación (en este último caso, los autores advierten sobre el riesgo potencial de esta terapia en las etapas tempranas de la gestación)(79).
La CE debe estar a cargo de un equipo multidisciplinario constituido idealmente por anestesiólogo, cardiólogo, pediatra y obstetra, en un ámbito propicio para la realización de una cesárea de urgencia y con monitoreo fetal. Se debe colocar a la paciente en decúbito lateral izquierdo (especialmente en el tercer trimestre), bajo anestesia general con intubación endotraqueal y control estricto de los gases en sangre, de la presión arterial y también del tono uterino(83). Episodios prolongados de hipoxia pueden causar vasoconstricción de la arteria uterina con reducción de la circulación útero-placentaria y riesgo de hipoxia, acidosis y muerte fetal.
Las guías de ACLS aconsejan una descarga inicial bifásica de 100 joules con las paletas en posición anteroposterior(84). Sin embargo, un estudio multicéntrico reciente mostró que con descargas de solo 100 joules hubo 60% de reversión a ritmo sinusal, lo que se elevó a 90% con choques de 200 joules(85). Consideramos que la elección del nivel de energía inicial debe basarse en la condición clínica y hemodinámica de la gestante.
Terapia anticoagulante
En el embarazo se produce una resistencia a la proteína C activada, disminuye la concentración de proteína S y aumentan los factores I, II, V, VII, VIII, X y XII, así como la actividad de los inhibidores del plasminógeno 1 y 2. El efecto neto es un estado de hipercoagulabilidad destinado a prevenir la hemorragia durante el parto.
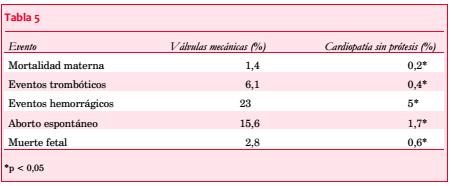
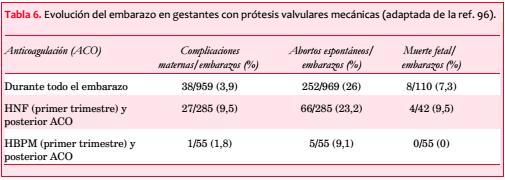
La incidencia de embolias en pacientes embarazadas con FA crónica es de 2%-10%. En el registro ROPAC se analizaron los efectos adversos en 212 pacientes con prótesis valvulares mecánicas en comparación con 2.620 pacientes con otras cardiopatías sin prótesis valvulares, con un incremento significativo de la morbilidad materno-fetal en pacientes con prótesis mecánicas (tabla 5)(64).
La tasa de nacidos vivos libres de eventos en mujeres con válvulas protésicas mecánicas fue de 58% vs 78% en cardiópatas embarazadas sin prótesis mecánicas, y más de 90% en ausencia de enfermedad cardíaca.
Las válvulas biológicas se asocian a un riesgo bajo de embolias y generalmente no requieren terapia anticoagulante, aunque la gestación puede acelerar los procesos degenerativos que habitualmente las afectan, con el consiguiente fallo valvular. Una prótesis valvular mecánica (especialmente de primera generación y en posición mitral) asociada a FA y antecedente de embolia o disfunción ventricular se asocia a un alto riesgo embólico, con una incidencia de 25%-35%, lo que constituye una cifra considerablemente mayor que en el estado no gestante (1,2%-4%). La frecuencia de estas complicaciones parece haber disminuido con el advenimiento de prótesis bivalvas de nueva generación, en especial en posición aórtica y en ausencia de los factores de riesgo previamente mencionados(86-91).
Aunque la warfarina y sus derivados cumarínicos son los agentes anticoagulantes más efectivos para la prevención de accidentes embólicos en el embarazo(92), atraviesan la barrera placentaria, y entre las 6 y las 12 semanas pueden producir graves malformaciones fetales. La embriopatía asociada a warfarina se caracteriza por hipoplasia nasal, epífisis punteadas, hipoplasia de extremidades, bajo peso al nacer, pérdida auditiva y anomalías oftálmicas. La incidencia de embriopatía es cercana a 10% cuando estos agentes son administrados en el primer trimestre de la gestación y se reduce a un nivel similar al de la población no tratada cuando se sustituyen por heparina entre las 6 y las 12 semanas de la gestación. Este efecto adverso es dosis-dependiente, y cuando se obtienen niveles terapéuticos adecuados con dosis menores de 5 mg de warfarina, de 3 mg de fenprocrumon o de 2 mg de acenocumarol, la incidencia de embriopatía disminuye a menos de 3%.
Durante el segundo y tercer trimestres del embarazo se han observado abortos espontáneos, hemorragias fetales, muerte fetal y daños neurológicos graves asociados con microhemorragias cerebrales.
Las heparinas de bajo peso molecular (HBPM), como enoxaparina, dalteparina y nandroparina, no atraviesan la barrera placentaria, carecen de efectos teratogénicos y tienen beneficios adicionales en relación con la heparina no fraccionada (HNF): respuesta antitrombótica más predecible, menor incidencia de complicaciones hemorrágicas o abortos espontáneos y menor ocurrencia de osteoporosis y trombocitopenia(93). Cada variedad de HBPM tiene propiedades farmacodinámicas y farmacocinéticas particulares y un diferente nivel terapéutico adecuado. La eficacia y seguridad de la enoxaparina en embarazadas con prótesis valvulares mecánicas y alto riesgo embólico sigue siendo un tema de controversia debido a que se han reportado eventos tromboembólicos en el primer trimestre y más frecuentemente durante el tercer trimestre del embarazo cuando se la utiliza en reemplazo de la warfarina. El aumento del volumen de distribución y del filtrado glomerular en esta etapa de la gestación favorece su rápida eliminación con el consiguiente descenso de la concentración plasmática a niveles subterapéuticos. Por dicha razón, en todas las guías se recomienda la utilización de dosis ajustadas sobre la base del monitoreo periódico de los niveles de factor anti Xa. La imposibilidad de realizar estos controles contraindica su uso en el embarazo debido al reporte de trombosis valvulares fatales con el uso de dosis fijas. Por otro lado, el real beneficio en relación con el uso de HBPM para la prevención de eventos embólicos en pacientes con prótesis valvulares mecánicas es un tema de controversia. Por cierto, se han reportado eventos embólicos a pesar del tratamiento con dosis ajustada de HBPM(94).
Danaparoide (categoría B): no atraviesa la barrera placentaria y no se asocia con teratogenicidad. Demostró ser más segura y efectiva en mujeres embarazadas con prótesis valvulares mecánicas cuando se la utilizó en reemplazo de la HBPM, en casos de trombocitopenia inducida por heparina y de trombofilias asociadas a intolerancia a la HBPM.
Fondaparinux (categoría N): está indicada en casos de trombocitopenia e hipersensibilidad cutánea relacionada con el uso de heparina. Debido a su prolongada vida media, la posibilidad de atravesar la barrera placentaria y a la escasa información existente con este agente, debería evitarse su uso en el embarazo.
Apixabán, dabigatrán y rivaroxabán (categoría C): no existe experiencia en el embarazo. Dado el potencial efecto teratogénico observado en estudios animales y el aumento de complicaciones embólicas observadas en pacientes con prótesis valvulares mecánicas –especialmente con el uso de dabigatrán–, no se recomienda su utilización en el embarazo.
Hasta el presente no existen ensayos clínicos controlados que permitan establecer recomendaciones para una terapia antitrombótica segura y efectiva.
La opción más segura para la madre es la mantención de la anticoagulación durante todo el embarazo (con riesgo de teratogenicidad y fetotoxicidad), en tanto la heparina es más segura para el feto pero brinda un menor beneficio en relación con el riesgo embólico materno.
A continuación se describe un esquema ampliamente difundido, con una aceptable relación riesgo/beneficio para la madre y el feto, que consideramos más aplicable en presencia de FA y disfunción ventricular o en casos de prótesis bivalvas de última generación en posición aórtica.
1) 6-12 semanas de embarazo
· Dosis ajustada de HBPM hasta alcanzar niveles pico de actividad antifactor Xa de 0,6-1,2 U/mL a las cuatro horas posdosis.
2) 13-35 semanas de embarazo
· Se prefiere el uso de antagonistas de la vitamina K y, como alternativa, HBPM.
3) 36 semanas de embarazo
· Debido a la alta incidencia de partos prematuros, sustituir los antagonistas de la vitamina K por HPNF o HBPM con una antelación de 12 y 4 horas respectivamente (para evitar el riesgo de hemorragia craneana fetal).
· Utilizar dosis ajustadas de HBPM hasta obtener actividad pico antifactor Xa de 0,7-1,2 U/ml a las cuatro horas posdosis, o dosis ajustada de HNF hasta duplicar el KPTT.
· Chequeo semanal de los niveles de anti Xa.
4) Parto
· Si la paciente se encuentra bajo antagonistas de la vitamina K, practicar una cesárea.
· Se debe evitar la anestesia raquídea o epidural dentro de las 24 horas y 4 horas que siguen, respectivamente, a la administración de HBPM o HNF (para evitar el riesgo de hematoma espinal)(97).
5) Puerperio
· Reiniciar la heparina a las 4-6 horas del parto (en ausencia de sangrado anormal) y reinstaurar la anticoagulación oral. La warfarina, la HBPM y la HNF son seguras durante la lactancia.
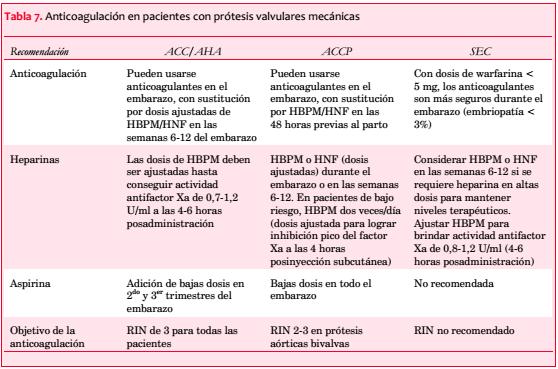
Pacientes con prótesis y alto riesgo embólico (prótesis valvulares mecánicas de primera generación en posición mitral y/o antecedente de embolia, presencia de FA o disfunción ventricular): la tabla 7 describe las recomendaciones de ACC/AHA, ACCP y SEC en relación con el tratamiento anticoagulante en este grupo de alto riesgo(98-100).
Los trombolíticos no atraviesan la barrera placentaria y en estudios animales no demostraron efectos teratogénicos. A pesar de ello, se han reportado eventos embólicos (10%), hemorragias uterinas (10%), desprendimiento de placenta y en el 8% de los casos aborto, parto prematuro y pérdida fetal.
Según las recomendaciones del ACCP, en presencia de ACV embólico asociado a FA, la terapia trombolítica (con activador tisular del plasminógeno IV) puede ser instituida dentro de las tres horas del inicio de los síntomas (indicación IA)(101).
Fibrilación auricular en el infarto agudo de miocardio
La FA es común en pacientes con enfermedad cardiovascular y continúa siendo la arritmia más frecuente en la etapa periinfarto, ya que se presenta en 2%-21% de los pacientes con síndrome coronario agudo (SCA) con elevación del segmento ST. Cuando ocurre dentro de las primeras 24 horas del evento coronario, suele ser transitoria y relacionada a isquemia auricular aguda. Es más frecuente en pacientes ancianos y en quienes al ingreso hospitalario presentan frecuencia cardíaca elevada o falla ventricular izquierda. Su incidencia es independiente del modo de terapia de reperfusión(103). El uso de IECA y betabloqueantes en las fases iniciales del SCA reduce la incidencia de FA(6,104).
Aunque la FA como complicación del SCA no es considerada por muchos clínicos como un evento con impacto clínico, su presencia incrementa el riesgo de ACV isquémico tanto en la etapa intrahospitalaria como en el seguimiento alejado. La FA relacionada con el infarto duplica la mortalidad intrahospitalaria(105,106). La mortalidad es mayor en los pacientes con infartos extensos y de localización anterior, ya que la rápida respuesta ventricular y la pérdida de la contracción auricular disminuyen el gasto cardíaco(107).
La FA aguda tiene un peor pronóstico intrahospitalario y a largo plazo en comparación con la existencia previa de la arritmia una vez ajustado por edad, sexo, o antecedentes de diabetes mellitus, hipertensión arterial, infarto previo, insuficiencia cardíaca y tipo de revascularización(108-111).
El peor pronóstico de los pacientes con infarto en quienes se observa FA se relaciona con la arritmia, la extensión del daño miocárdico y las comorbilidades(110).
En un subanálisis del registro GRACE se demostró que los pacientes que sufrieron FA en las primeras horas del infarto tenían mayor frecuencia cardíaca, mayor puntaje de GRACE, menor presión arterial y una internación más prolongada que los pacientes con FA previa o que no presentaron FA(105).
Causas
La principal causa para la ocurrencia de FA en el infarto es la isquemia auricular. La irrigación de las aurículas no es uniforme en todos los casos, con el origen de la arteria del nódulo sinusal como rama de la coronaria derecha (60%) o de la circunfleja (40%). La arteria del nódulo AV proviene de la coronaria derecha en el 90% de los casos y de la circunfleja en 10%. Aunque la arteria del nódulo AV irriga a la aurícula izquierda, la mayor parte de la irrigación de dicha cámara depende del ramo auricular izquierdo de la arteria circunfleja.
La FA que ocurre dentro de las primeras 24 horas del infarto se asocia más comúnmente a necrosis inferior, en tanto la FA de inicio tardío se vincula con infartos extensos de la cara anterior con disfunción ventricular (en cuyo caso no jugaría un papel preponderante la isquemia auricular sino el estrés mecánico por aumento de las presiones de llenado y el patrón restrictivo por disfunción diastólica e insuficiencia mitral)(112).
La ocurrencia de arritmias se ve favorecida por las alteraciones autonómicas y del medio interno, el aumento de mediadores de inflamación (proteína C reactiva) y la isquemia, con los consiguientes cambios en el potencial transmembrana, disminución de la velocidad de conducción, dispersión de los períodos refractarios y automatismo anormal(112).
Es bien conocido que la insuficiencia renal es un factor predisponente para el desarrollo de FA, como fue demostrado por Raposeiras y colaboradores en presencia de nefropatía por contraste posangioplastia coronaria(113).
Tratamiento
La CE sincronizada de urgencia debe ser considerada como primera medida ante pacientes con deterioro hemodinámico, isquemia refractaria al tratamiento o FA de alta respuesta ventricular. De lo contrario –y en ausencia de contraindicaciones– resulta suficiente el control de la frecuencia con betabloqueantes o antagonistas cálcicos no dihidropiridínicos. También puede considerarse la amiodarona o la digoxina en los pacientes con disfunción ventricular. Los antiarrítmicos de clase IC se encuentran contraindicados en el infarto.
El estudio VALIANT mostró que los pacientes de la rama control del ritmo tuvieron doble mortalidad en los primeros 45 días en comparación con los pacientes asignados a la estrategia de control de la frecuencia cardíaca(104).
Un metaanálisis sugiere que el uso de estatinas previo al infarto previene la aparición de FA “de novo”, y aunque el mecanismo no está aclarado, esto podría deberse a un efecto protector frente a la inflamación(114,115).
Conclusión
No hay correlación entre la ocurrencia de FA y la ubicación de la vía anómala o la duración de su refractariedad. Por otra parte, en ausencia de cardiopatía estructural hemos observado la desaparición prácticamente total de los episodios de FA luego de la ablación por catéter de la vía anómala(118). Esto indica que la vía constituye el elemento crítico para la ocurrencia de la arritmia.
Un problema fundamental en el síndrome de Wolff-Parkinson-White es su relación poco frecuente –pero bien conocida– con la muerte súbita. En un estudio de 273 autopsias de individuos menores de 35 años fallecidos en forma súbita, se observó preexcitación ventricular en diez casos (3,6%): ocho pacientes tenían Wolff-Parkinson-White y en dos se diagnosticó síndrome de Lown-Ganong-Levine (en un caso existía un nódulo AV hipoplásico y en otro se halló un tracto aurículo-hisiano)(119).
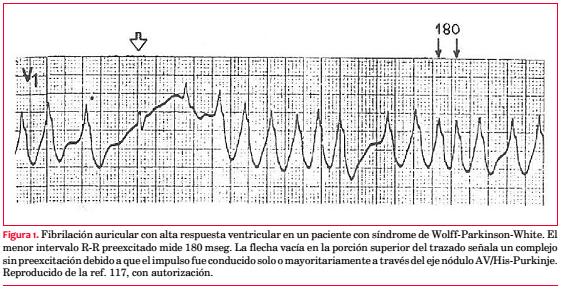
En la gran mayoría de los casos la muerte súbita se debe a un episodio de FA con alta respuesta ventricular (figura 1) que degenera en fibrilación ventricular. Por lo tanto, el pronóstico de estos pacientes se relaciona con la cantidad de impulsos que la vía es capaz de conducir por unidad de tiempo.
La respuesta ventricular durante la FA depende del período refractario anterógrado del haz anómalo, del tono autonómico y de la penetración anterógrada y retrógrada ocultas a través del nodo AV y de la vía(120).
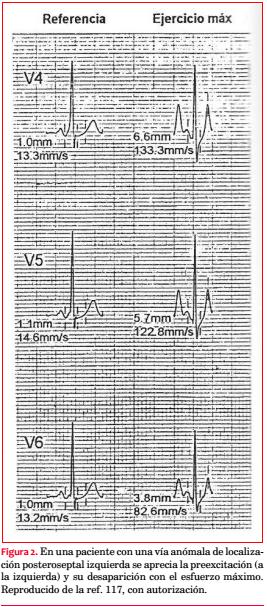
En el 17% de los pacientes asintomáticos y en el 50% de los sujetos sintomáticos con Wolff-Parkinson-White se observa un intervalo R-R preexcitado menor de 250 mseg durante los episodios de FA(121, 122). Al parecer, habría mayor riesgo de fibrilación ventricular cuando a un R-R preexcitado menor de 250 mseg se suma la existencia de más de una vía accesoria(123), lo que resulta lógico, ya que con múltiples haces se incrementa la posibilidad de circuitos reentrantes complejos. Por el contrario, la preexcitación intermitente durante el ejercicio(124), o más aún en estado basal(125), indica la existencia de un período refractario anterógrado prolongado de la vía anómala. Hemos observado la desaparición de la preexcitación en un tercio de los pacientes con Wolff-Parkinson-White sometidos a una prueba de esfuerzo (figura 2). Debe recordarse que para ser considerada de buen pronóstico, la pérdida de la preexcitación con el ejercicio ha de ocurrir en forma brusca. De lo contrario, una progresiva mejoría de la conducción nodal producida por el aumento del tono simpático puede enmascarar una vía con un período refractario corto(126).
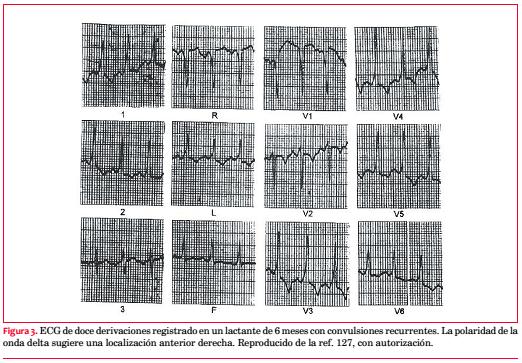
Debe intentarse la documentación electrocardiográfica que permita demostrar una correlación entre los síntomas y las arritmias en los pacientes con síndrome de Wolff-Parkinson-White. Así, frente a un paciente con Wolff-Parkinson-White y síncope es conveniente excluir otras causas (en primer término el síncope neurocardiogénico), que de existir, indican que la ablación por catéter no habrá de resolver la sintomatología. En la figura 3 se observa un ECG de 12 derivaciones obtenido en un lactante con síndrome de Wolff-Parkinson-White y episodios reiterados de síncope y convulsiones.
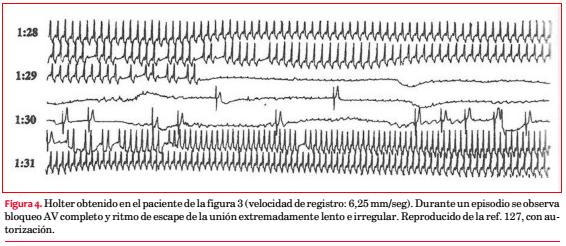
Si bien era lógico sospechar la presencia de taquiarritmias como causantes de la sintomatología, la demostración de bloqueo AV completo en el registro Holter coincidentemente con los síntomas (figura 4) llevó al implante de un marcapasos definitivo(127).
Conducta ante el paciente con Wolff-Parkinson-White asintomático
Se debe someter a estos pacientes a una rigurosa anamnesis, buscando síntomas vinculados con taquiarritmias, como palpitaciones seguidas de poliuria, aceleración de la frecuencia cardíaca durante el ejercicio sin reducción normal después del mismo o necesidad de maniobras vagales para interrumpir episodios de palpitaciones. Es importante conocer si existen antecedentes de muerte súbita en la familia y realizar electrocardiogramas a los parientes directos, ya que puede haber asociación familiar.
Cabe considerar que alrededor de 20% tiene vías accesorias con período refractario corto(128), y, por otra parte, la fibrilación ventricular fue la primera manifestación en 26% y 53% de los pacientes con Wolff-Parkinson-White asintomático en la experiencia, respectivamente, de Torner Montoya y colaboradores(129) y de Timmermans y colaboradores(130). Si bien durante el seguimiento se ha observado desaparición de la preexcitación en un tercio de los casos(131) y además el ciclo de estimulación auricular asociado a conducción 1 a 1 por la vía anómala se prolonga desde la infancia a la edad adulta, el riesgo de arritmias malignas no disminuye con la edad en aquellos pacientes asintomáticos en quienes persiste el patrón electrocardiográfico(132).
En presencia de antecedentes familiares de muerte súbita, deportistas de alto rendimiento, pilotos de avión, conductores de ómnibus o en cualquier profesión de la que dependan vidas humanas, debe realizarse la ablación por radiofrecuencia de la vía accesoria. Los riesgos de la ablación por catéter deben ser considerados cuidadosamente en los pacientes con vías anómalas próximas al sistema de conducción debido a la posibilidad de crear un bloqueo AV iatrogénico. En esos casos hemos tenido excelente resultado mediante la crioablación por catéter, con preservación de la conducción normal(133).
Tratamiento agudo de la fibrilación auricular en pacientes con síndrome de Wolff-Parkinson-White
En casos de FA preexcitada con alta respuesta ventricular es mandatoria (indicación clase I)(50) la realización de una CE para revertir dicha arritmia. Los desfibriladores con onda bifásica son notablemente más eficaces, aunque las razones para dicha superioridad no están totalmente aclaradas(134).
Las únicas drogas que se podrían utilizar en ausencia de inestabilidad hemodinámica para restaurar el ritmo sinusal o al menos enlentecer la respuesta ventricular son la procainamida o la ibutilida, no disponibles en nuestro medio.
En los pacientes sintomáticos es recomendable la realización de ablación con catéter, especialmente si el haz anómalo tiene un breve período refractario efectivo anterógrado.
La FA se observa en 10%-50% de los pacientes con insuficiencia cardíaca y existen evidencias que muestran que la arritmia constituye un predictor independiente de mortalidad(135-138).
Tratamiento farmacológico
La amiodarona oral, debido a su escaso efecto inotrópico negativo, es uno de los pocos antiarrítmicos que pueden ser utilizados en presencia de cardiopatía severa(139).
El estudio CHF-STAT (Congestive Heart Failure with Antiarrhythmic Therapy) en pacientes con deterioro grave de la función ventricular mostró una reducción a la mitad en la incidencia de FA entre quienes recibieron amiodarona comparados con aquellos que recibieron placebo, en tanto hubo reversión a ritmo sinusal en el 31% de los tratados con amiodarona y en el 8% en el grupo placebo(140).
En un subanálisis del estudio DIAMOND-CHF sobre pacientes con insuficiencia cardíaca y FA o aleteo auricular, que recibieron dofetilida o placebo en forma aleatorizada a partir de la internación, se comprobó mayor probabilidad de mantener el ritmo sinusal al año de seguimiento en el grupo dofetilida (79% vs 42%)(141). Si bien el tratamiento con dofetilida no se asoció con una reducción en la mortalidad total, la restauración y el mantenimiento del ritmo sinusal se vinculó en forma significativa con una menor mortalidad (IC 95%: 0,3-0,64; p = 0,0001). También se observó una disminución en el punto final combinado de mortalidad por cualquier causa y reinternaciones, por lo que dicho estudio mostró que la dofetilida es segura y efectiva para mantener el ritmo sinusal en pacientes con insuficiencia cardíaca, a la vez que sugirió que el mantenimiento del ritmo sinusal aumenta la sobrevida.
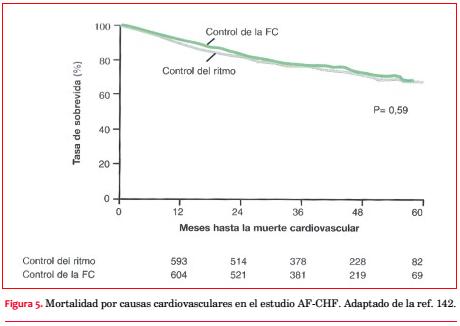
Sin embargo, esta última conclusión no fue confirmada por el estudio AF-CHF (Atrial Fibrillation in Congestive Heart Failure), específicamente diseñado para comparar las estrategias de mantenimiento del ritmo sinusal o de control de la frecuencia cardíaca en la insuficiencia cardíaca. Fueron ingresados pacientes con fracción de eyección £ 35%, historia de insuficiencia cardíaca sintomática en clase funcional II-IV (NYHA), y documentación de FA(142). La amiodarona fue el fármaco elegido para mantener el ritmo sinusal, en tanto el sotalol y la dofetilida se recomendaron como opciones de segunda línea. Luego de un seguimiento de 37 ± 19 meses se comprobó muerte cardiovascular en el 27% de los pacientes en el grupo control del ritmo y en el 25% de aquellos asignados a la rama control de la frecuencia cardíaca (p = 0,59) (figura 5). Hubo cruce a la otra rama en el 21% de los pacientes del grupo control del ritmo (principalmente por imposibilidad de mantener el ritmo sinusal) y en el 10% de aquellos asignados a control de la frecuencia (en general por agravamiento de la insuficiencia cardíaca). Ocurrió un mayor número de hospitalizaciones, particularmente durante el primer año, entre los pacientes en quienes se intentó mantener el ritmo sinusal (64% vs 59%, p = 0,0001).
Los autores del estudio AF-CHF señalan que “el valor predictivo de la FA en pacientes con insuficiencia cardíaca puede deberse a los trastornos que causan la FA (peor función ventricular, aumento de la activación neurohumoral y presencia de un estado inflamatorio) más que al efecto independiente de la FA”.
Cabe mencionar que en el grupo control del ritmo la opción terapéutica ampliamente predominante fue farmacológica, por lo que quedan interrogantes acerca del potencial beneficio de la ablación percutánea o quirúrgica de la FA. En ese sentido, un metaanálisis de una publicación reciente evaluó seis ensayos randomizados y no randomizados observacionales que incluyeron 324 pacientes y encontró una mejoría más significativa de la fracción de eyección, de la distancia en la prueba de la caminata de 6 minutos, y en el cuestionario de calidad de vida de Minnesota, con una aceptable tasa de complicaciones de 4,9%(143). Además, un estudio de Zhao y colaboradores ha mostrado mayor prevalencia de gatillos extrapulmonares en pacientes con deterioro de la fracción de eyección sometidos a ablación por catéter de la FA(144). Por otra parte, si se considera que el 36% de los óbitos se debió a muerte arrítmica, fue escaso el número de pacientes con cardiodesfibriladores implantables (7% en el momento de la randomización y 9% a lo largo del seguimiento), y tampoco se analizó en este estudio el impacto de la terapia de resincronización ventricular en pacientes con FA e insuficiencia cardíaca. Cabe agregar que estos resultados no pueden extenderse a los pacientes con insuficiencia cardíaca y función sistólica preservada.
Tratamiento eléctrico
En relación con la resincronización biventricular, el estudio MUSTIC (Multisite Stimulation in Cardiomyopathies) incluyó a 59 pacientes con insuficiencia cardíaca, deterioro de la función ventricular y FA persistente o permanente con frecuencia ventricular lenta en quienes el QRS marcapaseado tenía una duración ³ 200 mseg. No se observaron diferencias entre el marcapaseo convencional y la resincronización en el punto final primario del test de caminata de 6 minutos(146). En el estudio RAFT, que incluyó a 229 pacientes con FA o aleteo auricular permanentes tanto con adecuada respuesta ventricular o en espera de ablación del nódulo AV, no se observó una diferencia en la respuesta terapéutica según el ritmo de base(147).
Dos aspectos merecen destacarse en relación con la terapia de resincronización en los pacientes con FA: 1) cuando la arritmia no es permanente es conveniente identificar las chances de mantenimiento del ritmo sinusal, y, en este sentido, recientemente se ha destacado el mal pronóstico de los bloqueos avanzados en la conducción interauricular (lo que se conoce como síndrome de Bayés)(148), y 2) muy frecuentemente es necesario eliminar la conducción nodal para permitir que la estimulación biventricular sea permanente, ya que de lo contrario la respuesta ventricular irregular impide una adecuada resincronización(149).
En un metaanálisis que incluyó cinco estudios prospectivos con un total de 1.164 pacientes, hubo mejoría con la resincronización tanto en los pacientes en ritmo sinusal como en presencia de FA crónica, sin diferencias estadísticamente significativas en la mortalidad luego de un año de seguimiento (riesgo relativo: 1,57; IC 95%: 0,87-2,81)(150). Hubo una mejoría en la clase funcional en ambos grupos (-0,9 en los pacientes con ritmo sinusal y -0,84 en presencia de FA). Los pacientes con ritmo sinusal tuvieron una mejor evolución del test de la caminata de 6 minutos y del score de Minnesota. Resulta relevante que los pacientes con FA tratados con resincronización experimentaron una mejoría pequeña pero estadísticamente significativa en la fracción de eyección ventricular.
A continuación se enumeran las recomendaciones conjuntas de ACC/AHA/HRS para el manejo de la FA en pacientes con insuficiencia cardíaca(50).
· Clase I
1. En pacientes con FA persistente o permanente e insuficiencia cardíaca compensada con fracción de eyección preservada está recomendado el control de la frecuencia cardíaca en reposo con betabloqueantes o antagonistas del calcio no dihidropiridínicos (evidencia: B).
2. Para enlentecer la respuesta ventricular durante la FA en la situación aguda y en ausencia de preexcitación está recomendada la administración intravenosa de betabloqueantes (o de un antagonista del calcio no dihidropiridínico en presencia de fracción de eyección preservada), con precaución en pacientes con insuficiencia cardíaca manifiesta, hipotensión o insuficiencia cardíaca con fracción de eyección ventricular reducida (evidencia: B).
4. En pacientes que refieren síntomas durante la actividad es útil la evaluación de la frecuencia cardíaca durante el ejercicio para ajustar el tratamiento farmacológico (evidencia: C).
5. La digoxina es efectiva para controlar la frecuencia cardíaca en reposo en los pacientes con fracción de eyección reducida (evidencia: C).
· Clase IIa
1. En pacientes con FA es razonable la combinación de digoxina con un betabloqueante (o un antagonista del calcio no dihidropiridínico en presencia de fracción de eyección preservada) para controlar la frecuencia cardíaca en reposo y durante el esfuerzo (evidencia: B).
2. Cuando la terapia farmacológica es insuficiente o mal tolerada, es razonable la ablación del nódulo AV con implante de un marcapasos para controlar la frecuencia cardíaca (evidencia: B).
3. Cuando otras opciones son inefectivas o están contraindicadas, la amiodarona por vía intravenosa puede ser útil para controlar la frecuencia cardíaca en pacientes con FA (evidencia: C).
4. Es razonable tanto el control de la respuesta ventricular o el control del ritmo en los pacientes con FA y alta respuesta ventricular asociada (o probablemente asociada) a taquimiocardiopatía (evidencia: B).
5. Es razonable el control del ritmo en los pacientes con insuficiencia cardíaca crónica que continúan sintomáticos por FA a pesar de la estrategia de controlar la frecuencia cardíaca (evidencia: C).
· Clase IIb
1. Puede considerarse la amiodarona oral cuando la frecuencia cardíaca en reposo y durante el esfuerzo no puede ser controlada adecuadamente con un betabloqueante (o un antagonista del calcio no dihidropiridínico en presencia de fracción de eyección cardíaca preservada) o digoxina, solos o en combinación (evidencia: C).
2. Puede considerarse la ablación del nódulo AV cuando la frecuencia no puede controlarse y se sospecha taquimiocardiopatía (evidencia: C).
· Clase III
1. No debe realizarse la ablación del nódulo AV sin un intento farmacológico previo para lograr el control de la frecuencia ventricular (evidencia: C).
2. Para el control de la frecuencia cardíaca no deben administrarse antagonistas del calcio no dihidropiridínicos por vía intravenosa, betabloqueantes por vía intravenosa ni dronedarona a pacientes con insuficiencia cardíaca descompensada (evidencia: C).
Bibliografía
1. Almassi GH, Wagner TH, Carr B, Hattler B, Collins JF, Quin JA, et al. Postoperative atrial fibrillation impacts on costs and one-year clinical outcomes: the Veterans Affairs Randomized On/Off Bypass Trial. Ann Thorac Surg 2015; 99(1):109-14.
2. LaPar DJ, Speir AM, Crosby IK, Fonner E Jr, Brown M, Rich JB, et al. Postoperative atrial fibrillation significantly increases mortality, hospital readmission, and hospital costs. Ann Thorac Surg 2014; 98(2):527-33.
3. Al-Shaar L, Schwann TA, Kabour A, Habib RH. Increased late mortality after coronary artery bypass surgery complicated by isolated new-onset atrial fibrillation: a comprehensive propensity-matched analysis. J Thorac Cardiovasc Surg 2014;148(5): 1860-8.
4. Thorén E, Hellgren L, Granath F, Hörte LG, Ståhle E. Postoperative atrial fibrillation predicts cause-specific late mortality after coronary surgery. Scand Cardiovasc J 2014;48(2):71-8.
5. Crystal E, Garfinkle MS, Connolly SS, Ginger TT, Slik K, Yusuf SS. Interventions for preventing post-operative atrial fibrillation in patients undergoing heart surgery. Cochrane Database Syst Rev 2004; 4: CD003611.
6. Camm AJ, Kirchhof P, Lip GY, Schotten U, Savelieva I, Ernst S, et al. Guidelines for the management of atrial fibrillation. The Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC) Eur Heart J 2010; 31(19):2369-429.
7. Ivanovic B, Tadic M, Bradic Z, Zivkovic N, Stanisavljevic D, Celic V. The influence of the metabolic syndrome on atrial fibrillation occurrence and outcome after coronary bypass surgery: a 3-year follow-up study. Thorac Cardiovasc Surg 2014; 62(7): 561-8.
8. Paschalis A, Tousoulis D, Demosthenous M, Antonopoulos A, Papaioannou S, Miliou A. Pre-operative inflammation and post-operative atrial fibrillation in coronary artery bypass surgery. Int J Cardiol 2014; 173(2):327-8.
9. Jacob KA, Nathoe HM, Dieleman JM, van Osch D, Kluin J, van Dijk D. Inflammation in new-onset atrial fibrillation after cardiac surgery: a systematic review. Eur J Clin Invest 2014;44(4):402-28.
10. Aras D, Özeke Ö. Postoperative atrial fibrillation and oxidative stress (editorial). Turk Kardiyol Dern Ars 2014; 42(5):426-28.
11. Ali-Hassan-Sayegh S, Mirhosseini SJ, Rezaeisadrabadi M, Dehghan HR, Sedaghat-Hamedani F, Kayvanpour E, et al. Antioxidant supplementations for prevention of atrial fibrillation after cardiac surgery: an updated comprehensive systematic review and meta-analysis of 23 randomized controlled trials. Interact Cardiovasc Thorac Surg 2014;18(5):646-54.
12. Chabra L, Kluger J, Flynn AW, Spodick DH. Pericardial fat and postoperative atrial fibrillation after coronary artery bypass surgery. Eur J Cardiothorac Surg 2015;47(3):584. doi: 10.1093/ejcts/ezu220.
13. Drossos G, Koutsogiannidis CP, Ananiadou O, Kapsas G, Ampatzidou F, Madesis A, et al. Pericardial fat is strongly associated with atrial fibrillation after coronary artery bypass graft surgery. Eur J Cardiothorac Surg 2014; 46(6):1014-20.
14. Qaddoura A, Kabali C, Drew D, van Oosten EM, Michael KA, Redfearn DP, et al. Obstructive sleep apnea as a predictor of atrial fibrillation after coronary artery bypass grafting: a systematic review and meta-analysis. Can J Cardiol 2014;30(12): 1516-22.
15. Van Oosten EM, Hamilton A, Petsikas, Payne D, Redfearn DP, Zhang S, et al. Effect of preoperative obstructive sleep apnea on the frequency of atrial fibrillation after coronary artery bypass grafting. Am J Cardiol 2014;113(6):919-23.
16. Mariscalco G, Biancari F, Zanobini M, Cottini M, Piffaretti G, Saccocci M, et al. Bedside tool for predicting the risk of postoperative atrial fibrillation after cardiac surgery: the POAF score. J Am Heart Assoc 2014;3(2):e000752.
17. Kolek MJ, Muehlschlegel JD, Bush WS, Parvez B, Murray KT, Stein CM, et al. Genetic and clinical risk prediction model for postoperative atrial fibrillation. Circ Arrhythm Electrophysiol 2015;8(1): 25-31.
18. Alameddine AK, Visintainer P, Alimov VK, Rousou JA. Blood transfusion and the risk of atrial fibrillation after cardiac surgery. J Card Surg 2014;29(5):593-9.
19. Xiong F, Yin Y, Dubé B, Pagé P, Pagé P, Vinet A. Electrophysiological changes preceding the onset of atrial fibrillation after coronary bypass grafting surgery. PLoS One 2014; 9(9):e107919.
20. Park SJ, On YK, Kim JS, Jeong DS, Kim WS, Lee YT. Heart rate turbulence for predicting new-onset atrial fibrillation in patients undergoing coronary artery bypass grafting. Int J Cardiol 2014; 174(3):579-85.
21. Rader F, Costantini O, Jarrett C, Gorodeski EZ, Lauer MS, Blackstone EH. Quantitative electrocardiography for predicting postoperative atrial fibrillation after cardiac surgery. J Electrocardiol 2011; 44(6):761-7.
22. Parsaee M, Moradi B, Esmaeilzadeh M, Haghjoo M, Bakhshandeh H, Sari L. New onset atrial fibrillation after coronary artery bypass grafting: an evaluation of mechanical left atrial function. Arch
23. Takahashi S, Fujiwara M, Watadani K, Taguchi T, Katayama K, Takasaki T, et al. Preoperative tissue Doppler imaging-derived atrial conduction time can predict postoperative atrial fibrillation in patients undergoing aortic valve replacement for aortic valve stenosis. Circ J 2014;78(9):2173-81.
24. Fujiwara M, Nakano Y, Hidaka T, Oda N, Uchimura Y, Sairaku A, et al. Prediction of atrial fibrillation after off-pump coronary artery bypass grafting using preoperative total atrial conduction time determined on tissue Doppler imaging. Circ J 2014;78(2):345-52.
25. Wang HS, Wang ZW, Yin ZT. Carvedilol for prevention of atrial fibrillation after cardiac surgery: a meta-analysis. PLoS One 2014; 9(4):e94005. doi: 10.1371/journal.pone.0094005.
26. Ozaydin M, Peker O, Erdogan D, Akcay S, Yucel H, Icli A, et al. Oxidative status, inflammation, and postoperative atrial fibrillation with metoprolol vs carvedilol or carvedilol plus N-acetyl cysteine treatment. Clin Cardiol 2014; 37(5):300-6.
27. Di Nicolantonio JJ, Beavers CJ, Menezes AR, Lavie CJ, O’Keefe JH, Meier P. Meta-analysis comparing carvedilol versus metoprolol for the prevention of postoperative atrial fibrillation following coronary artery bypass grafting. Am J Cardiol 2014; 113(3):565-9.
28. Cook RC, Yamashita MH,
29. Zheng H, Xue S, Hu ZL, Shan JG, Yang WG. The use of statins to prevent postoperative atrial fibrillation after coronary artery bypass grafting: a meta-analysis of 12 studies. J Cardiovasc Pharmacol 2014; 64(3):285-92.
30. Viviano A, Kanagasabay R, Zakkar M. Is perioperative corticosteroid administration associated with a reduced incidence of postoperative atrial fibrillation in adult cardiac surgery? Interact Cardiovasc Thorac Surg 2014; 18(2):225-9.
31. Worden JC, Asare K. Postoperative atrial fibrillation: role of inflammatory biomarkers and use of colchicine for its prevention. Pharmacotherapy 2014; 34(11):1167-73.
32. Imazio M, Brucato A, Ferrazzi P, Pullara A, Adler Y, Barosi A, et al. Colchicine for prevention of postpericardiotomy syndrome and postoperative atrial fibrillation: the COPPS-2 randomized clinical trial. JAMA 2014; 312(10):1016-23.
33. Daoud EG, Snow R, Hummel JD, Kalbfleisch SJ, Weiss R, Augostini R. Temporary atrial epicardial pacing as prophylaxis against atrial fibrillation after heart surgery: a meta-analysis. J Cardiovasc Electrophysiol 2003; 14(2):127-32.
34. Kongmalai P, Karunasumetta C, Kuptarnond C, Prathanee S, Taksinachanekij S, Intanoo W, et al. The posterior pericardiotomy. Does it reduce the incidence of postoperative atrial fibrillation after coronary artery bypass grafting? J Med Assoc Thai 2014; 97 Suppl 10:S97-104.
35. Noheria A, Patel SM, Mirzoyev S, Madhavan M, Friedman PA, Packer DL, et al. Decreased postoperative atrial fibrillation following cardiac transplantation: the significance of autonomic denervation. Pacing Clin Electrophysiol 2013;36(6): 741-7.
36. Al-Atassi T, Toeg H, Malas T, Lamb BK. Mapping and ablation of autonomic ganglia in prevention of postoperative atrial fibrillation in coronary surgery: MAAPPAFS atrial fibrillation randomized controlled pilot study. Can J Cardiol 2014; 30(10):1202-7.
37. Feng XD, Wang XN, Yuan XH, Wang W. Effectiveness of biatrial epicardial application of amiodarone-releasing adhesive hydrogel to prevent postoperative atrial fibrillation. J Thorac Cardiovasc Surg 2014; 148(3):939-43.
38. Vargas-Uricoechea H, Bonelo-Perdomo A, Sierra-Torres CH. Effects of thyroid hormones on the heart. Clin Investig Arterioscler 2014; 26(6): 296-309.
39. Sawin CT, Geller A, Wolf PA, Belanger AJ, Baker E, Bacharach P, et al. Low serum thyrotropin concentrations as a risk factor for atrial fibrillation in older persons. N Engl J Med 1994; 331(19): 1249-52.
40. Heeringa J, Hoogendoorn EH, van der Deure WM, Hofman A, Peeters RP, Hop WC, et. al. High-normal thyroid function and risk of atrial fibrillation: the
41. Auer J, Scheibner P, Mische T, Langsteger W, Eber O, Eber B. Subclinical hyperthyroidism as a risk factor for atrial fibrillation. Am Heart J 2001; 142(5):838-42.
42. Osman F, Franklyn JA, Holder RL, Sheppard MC, Gammage MD. Cardiovascular manifestations of hyperthyroidism before and after antithyroid therapy: a matched case-control study. J Am Coll Cardiol 2007; 49(1):71-81.
43. Selmer C, Hansen ML, Olesen JB, Mérie C, Lindhardsen J, Olsen AM. New-onset atrial fibrillation is a predictor of subsequent hyperthyroidism: a nationwide cohort study. PLoS One 2013; 8(2): e57893.
44. Vargas-Uricoechea H, Sierra-Torres CH. Thyroid hormones and the heart. Horm Mol Biol Clin Investig 2014; 18(1):15-26.
45. Zhang Y, Dedkov EI, Teplitsky D, Weltman NY, Pol CJ, Rajagopalan V, et al. Both hypothyroidism and hyperthyroidism increase atrial fibrillation inducibility in rats. Circ Arrhythm Electrophysiol 2013; 6(5):952-9.
46. Ozaydin M, Kutlucan A, Turker Y y col. Association of inflammation with atrial fibrillation in hyperthyroidism. J Geriatr Cardiol 2012; 9:344.
47. Galloway A, Li H, Vanderlinde-Wood M, Khan M, Benbrook A, Liles C, et al. Activating autoantibodies to the â1/2-adrenergic and M2 muscarinic receptors associate with atrial tachyarrhythmias in patients with hyperthyroidism. Endocrine 2015; 49(2):457-63.
48. Bahn RS, Burch HB, Cooper DS, Garber JR, Greenlee MC, Klein I, et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Endocr Pract 2011;17(17):456-20.
49. Shimizu T, Koide S, Noh JY, Sugino K, Ito K, Nakazawa H. Hyperthyroidism and the management of atrial fibrillation. Thyroid 2002; 12(6): 489-93.
50. January CT, Wann LS, Alpert JS, Calkins H, Cigarroa JE, Cleveland JC Jr, et al. 2014 AHA/ACC/HRS guidelines for the management of patients with atrial fibrillation. A report of the American
51. Klein I, Danzi S. Thyroid disease and the heart. Circulation 2007; 116(15):1725-35.
53. Siu CW, Jim MH, Zhang X, Chan YH, Pong V, Kwok J, et al. Comparison of atrial fibrillation recurrence rates after successful electrical cardioversion in patients with hyperthyroidism-induced versus non-hyperthyroidism-induced persistent atrial fibrillation. Am J Cardiol 2009; 103(4):540-3.
54. Chen Q, Zhu W, Yan Y, Cheng K, Liu Y, Zhu W. Effect of hyperthyroidism on the hypercoagulable state and thromboembolic events in patients with atrial fibrillation. Cardiology 2014; 127(3):176-82.
55. Bruere H, Fauchier L, Bernard Brunet A, Pierre B, Simeon E, Babuty D. History of thyroid disorders in relation to clinical outcomes in atrial fibrillation. Am J Med 2015; 128(1):30-7.
56. Wongcharoen W, Lin YJ, Chang SL, Lo LW, Hu YF, Chung FP, et al. History of hyperthyroidism and long-term outcome of catheter ablation of drug-refractory atrial fibrillation. Heart Rhythm 2015; 12(9):1956-62.
57. Tavares ABW, Paula SK, Vaisman M, Teixeira PF. Amiodarona y tirotoxicosis: relatos de casos. Arq Bras Cardiol 2010; 95(5):e122-124.
58. Rajeswaran C, Shelton RJ, Gilbey SG. Management of amiodarone-induced thyrotoxicosis. Swiss Med Wkly 2003; 133(43-44):579-85.
59. Jabrocka-Hybel A, Bednarczuk T, Bartalena L, Pach D, Rucha M, Kaminski G. Amiodarone and the thyroid. Endokrynol Pol 2015; 66(2):176-86.
60. Macchia PE. Amiodarone-induced thyrotoxicosis (Internet).
61. Czarnywojtek A, Zgorzalewicz-Stachowiak M, Wolinski K, Plazinska MT, Miechowicz I, Kwiecinska B, et al. Results of preventive radioiodine therapy in euthyroid patients with history of hyperthyroidism prior to administration of amiodarone with permanent atrial fibrillation. A preliminary study. Endokrynol Pol 2014; 65(4):269-74.
62. Altun B, Tasolar H, Gazï E, Gungor AC, Uysal A, Temïz A, et al. Atrial electromechanical coupling intervals in pregnant subjects. Cardiovasc J Afr 2014; 25(1):15-20.
63. Li JM, Nguyen C, Joglar JA, Hamdan MH, Page RL. Frequency and outcome of arrhythmias complicating admission during pregnancy: experience from a high-volume and ethnically-diverse obstetric service. Clin Cardiol 2008; 31(11):538-41.
64. Roos-Hesselink JW, Ruys TP, Stein JI y col. Outcome of pregnancy in patients with structural or ischaemic heart disease: results of a registry of the European Society of Cardiology. Eur Heart J 2013; 34(9):657-65.
65. Mendelson MA. Pregnancy in patients with obstructive lesions: aortic stenosis, coarctation of the aorta and mitral stenosis. Prog Ped Cardiol 2004; 19(1):61-70.
66. Gel AF, Hankins GD. Cardiac disease and pregnancy. Obstet Gynecol Clin North Am 2001; 28(3):465-512.
67. Colman JM, Siu SCB. Pregnancy in adult patients with congenital heart disease. Prog Ped Cardiol 2003; 17(1):53-60.
68. Szekely P, Snaith L. Atrial fibrillation and pregnancy. Br Med J 1961;1(5237):1407-10.
69. Silversides CK, Harris L, Haberer K y col. Recurrence rates of arrhythmias during pregnancy in women with previous tachyarrhythmia and impact on fetal and neonatal outcomes. Am J Cardiol 2006; 97:1206.
70. Medical Economics Staff, editor. Drug Information for the Health Care Professional. 23rd ed.
71. Meidahl Petersen K, Jimenez-Solem E, Andersen JT, Petersen M, Brødbæk K, Køber L, et al. B-Blocker treatment during pregnancy and adverse pregnancy outcomes: a nationwide population-based cohort study. BMJ Open 2012; 2(4):pii: e001185. doi: 10.1136/bmjopen-2012-001185.
72. Tromp CH, Nanne AC, Pernet PJ, Tukkie R, Bolte AC. Electrical cardioversion during pregnancy: safe or not? Neth Heart J 2011; 19(3):134-36.
73. Brown O, Davidson N, Palmer J. Cardioversion in the third trimester of pregnancy. Aust N Z J Obstet Gynaecol 2001; 41(2):241-2.
74. Singh V, Bhakta P, Hashmi J, Zaidi N. Cardioversion in late pregnancy: a case report. Acta Anaesthesiol Belg 2014; 65(3):105-7.
75. DeSilva RA, Graboys TB, Podrid PJ, Lown B. Cardioversion and defibrillation. Am Heart J 1980; 100 (6 Pt1):881-95.
76. Page RL. Treatment of arrhythmias during pregnancy. Am Heart J 1995; 130(4):871-6.
77. Ueland K, McAnulty JH, Ueland FR, Metcalfe J. Special considerations in the use of cardiovascular drugs. Clin Obstet Gynecol 1981; 24(3):809-23.
78. Sánchez-Díaz CJ, González-Carmona VM, Ruesga-Zamora E, Monteverde Grethe CA. Electric cardioversion in the emergency service: experience in 1000 cases. Arch Inst Cardiol Mex 1987; 57(4):387-94.
79. Boule S, Ovart L, Marquie C, Botcherby E, Klug D, Kouakam C, et al. Pregnancy in women with an implantable cardioverter-defibrillator: is it safe? Europace 2014; 16(11):1587-94.
81. Schuler PK, Herrey A, Wade, Brooks R, Peebles D, Lambiase P, et al. Pregnancy outcome and management of women with an implantable cardioverter defibrillator: a single centre experience. http://www.ncbi.nlm.nih.gov/pubmed/22744770 Europace 2012; 14(12):1740-5.
82. Barnes EJ, Eben F, Patterson D. Direct current cardioversion during pregnancy should be performed with facilities available for fetal monitoring and emergency caesarean section. BJOG 2002; 109(12): 1406-7.
83. Van de Velde M, De Buck F. Anesthesia for non-obstetric surgery in the pregnant patient. Minerva Anesthesiol 2007;73(4):235-40.
84. Neumar RW, Otto CW, Link MS, Kronick SL, Shuster M, Callaway CW, et al. Part 8: adult advanced cardiovascular life support: 2010 American Heart Association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation 2010;122 (18 Suppl 3):S729-67.
85. Page RL, Kerber RE, Russell JK y col. Biphasic versus monophasic shock waveform for conversion of atrial fibrillation: the results of an international randomized, double-blind multicenter trial. J Am Coll Cardiol 2002; 39(12):1956-63.
86. Quinn J, Von Klemperer K, Brooks R, Peebles D, Walker F, Cohen H. Use of high intensity adjusted dose low molecular weight heparin in women with mechanical heart valves during pregnancy: a single-center experience. Haematologica 2009; 94(11): 1608-12.
87. Nassar AH, Hobeika EM, AbdEssamad HM, Taher A, Khalil AM, Usta IM. Pregnancy outcome in women with prosthetic heart valves. Am J Obstet Gynecol 2004; 191(3):1009-13.
88. Arnaout MS,Kazma H, Khalil A, Shasha N, Nasrallah A, Karam K.Is there a safe anticoagulation protocol for pregnant women with prosthetic valves? Clin Exp Obstetr Gynecol 1998; 25(3):101-4.
89. VitaleN, De Feo M, De Santo LS, Pollice A, Tedesco N, Cotrufo M. Dose-dependent fetal complications of warfarin in pregnant women with mechanical heart valves. J Am Coll Cardiol 1999; 33(6):1637-41.
90. Meschengieser S, Fondevila CG,
91. Lee JH, Park NH, Keum DY, Choi SY, Kwon KY, Cho CH. Low molecular weight heparin treatment in pregnant women with a mechanical heart valve prosthesis. J Korean Med Sci 2007; 22(2):258-61.
92. Schaefer C , Hannemann D, Meister R, Eléfant E, Paulus W, Vial T.Vitamin K antagonists and pregnancy outcome. A multi-centre prospective study. Thromb Haemost 2006; 95(6):949-57.
93. Greer IA, Nelson-Piercy C. Low-molecular weight heparins for thromboprophylaxis and treatment of venous thromboembolism in pregnancy: a systematic review of safety and efficacy. Blood 2005; 106(2):401-7.
94. Yinon Y, Siu SC, Warshafsky C, Maxwell C, McLeod A, Colman JM, et al. Use of low molecular weight heparin in pregnant women with mechanical heart valves. Am J Cardiol 2009; 104(9):1259-63.
95. Chan WS, Anand S, Ginsberg JS. Anticoagulation of pregnant women with mechanical heart valves: a systematic review of the literature. Arch Intern Med 2000; 160(2):191-6.
96. McLintock C. Anticoagulant therapy in pregnant women with mechanical prosthetic heart valves: no easy option. Thromb Res 2011; 127 Suppl 3:S56-60.
97. Horlocker TT, Wedel DJ, Benzon H, Brown DL, Enneking FK, Heit JA, et al. Regional anesthesia in the anticoagulated patient: defining the risks (the Second ASRA Consensus Conference on Neuraxial Anesthesia and Anticoagulation). Reg Anesth Pain Med 2003; 28(3):172-97.
98. Bonow RO, Carabello BA, Chatterjee K, de Leon AC Jr, Faxon DP, Freed MD, et al. 2008 focused update incorporated into the ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to revise the 1998 guidelines for the management of patients with valvular heart disease). Endorsed by the Society of Cardiovascular Anesthesiologist, Society for Cardiovascular Angiography and Interventions and Society of Thoracic Surgeons. J Am Coll Cardiol 2008; 52(13):e1-142.
99. Guyatt GH, Akl EA, Crowther M, Gutterman DD, Schuünemann HJ; American College of Chest Physicians Antithrombotic Therapy and Prevention of Thrombosis Panel. Executive summary: antithrombotic therapy and prevention of thrombosis (9th ed.): American
100. Regitz-Zagrosek V, Blomstrom-Lundqvist C, Borghi C, Cifkova R, Ferreira R, Foidart JM, et al. ESC guidelines on the management of cardiovascular diseases during pregnancy: The Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology. Eur Heart J 2011; 32(24):3147-97.
102. Ozkan M, Cakal B, Karakoyun S, Gürsoy OM, Çevik C, Kalçýk M, et al. Thrombolytic therapy for the treatment of prosthetic heart valve thrombosis in pregnancy with low-dose, slow infusion of tissue-type plasminogen activator. Circulation 2013; 128(5): 532-40.
103. Schmitt J, Duray G, Gersh BJ, Hohnloser SH. Atrial fibrillation in acute myocardial infarction: a systematic review of the incidence, clinical features and prognostic implications. Eur Heart J 2009; 30(9):1038-45.
104. Nilsson KR, Al-Khatib SM, Zhou Y, Pieper K, White HD, Maggioni AP. Atrial fibrillation management strategies and early mortality after myocardial infarction: results from the Valsartan in Acute Myocardial Infarction (VALIANT) Trial. Heart 2010; 96(11):838-42.
105. McManus DD, Hang W, Domakonda KV, Ward J, Saczysnki JS, Gore JM, et al. Trends in atrial fibrillation in patients hospitalized with an acute coronary syndrome. Am J Med 2012; 125(11):1076-84.
106. Poci D, Hartford M, Karlsson T, Edvardsson N, Caidahl K. Effect of new versus known versus no atrial fibrillation on 30-day and 10-year mortality in patients with acute coronary syndrome. Am J Cardiol 2012; 110(2):217-21.
107. Almendro-Delia M, Valle-Caballero MJ, Garcia-Rubira JC, Muñoz-Calero B, Garcia-Alcantara A, Reina-Toral A. Prognostic impact of atrial fibrillation in acute coronary syndromes: results from the ARIAM registry. Eur Heart J Acute Cardiovasc Care 2014; 3(2):141-8.
108. Rathore SS, Berger AK, Weinfurt KP, Schulman KA, Oetgen WJ, Gersh BJ, et al. Acute myocardial infarction complicated by atrial fibrillation in the elderly: prevalence and outcomes. Circulation 2000; 101(9):969-74.
109. Lehto M, Snapinn S, Dickstein K, Swedberg K, Nieminen MS; OPTIMAAL investigators. Prognostic risk of atrial fibrillation in acute myocardial infarction complicated by left ventricular dysfunction: the OPTIMAAL experience. Eur Heart J 2005; 26(4):350-6.
110. Jabre P, Roger VL, Murad MH, Chamberlain AM, Prokop L, Adnet F, et al. Mortality associated with atrial fibrillation in patients with myocardial infarction: a systematic review and meta-Analysis. Circulation 2011; 123(15):1587-93.
111. Angeli F, Reboldi G, Garofoli M, Ramundo E, Poltronieri C, Mazzotta G, et al. Atrial fibrillation and mortality in patients with acute myocardial infarction: a systematic overview and meta-analysis. Curr Cardiol Rep 2012; 14(5):601-10.
112. Gorenek B, Kudaiberdieva G. Atrial fibrillation in acute ST-elevation myocardial infarction: clinical and prognostic features. Curr Cardiol Rev 2012; 8(4):281-9.
113. Raposeiras S, Abellas-Sequeiros RA, Abu Assi E, Yousef-Abumuaileq RR, Rodríguez Mañero M, Iglesias Álvarez D. Relation of contrast induced nephropathy to new onset atrial fibrillation in acute coronary syndrome. Am J Cardiol 2015; 115(5): 587-91.
114. Zhou X, Du J, Yuan J, Chen YQ. Statins therapy can reduce the risk of atrial fibrillation in patients with acute coronary syndrome: a meta-analysis. Int J Med Sci 2013; 10(2):198-205.
115. Ramani G, Zahid M, Good CB, Macioce A, Sonel AF. Comparison of frequency of new-onset atrial fibrillation or flutter in patients on statins versus not on statins presenting with suspected acute coronary syndrome. Am J Cardiol 2007; 100 (3):404-5.
116. Josephson ME. Clinical cardiac electrophysiology. Techniques and interpretation. 2nd. ed. Philadelphia: Lea & Febiger; 1993. p. 311.
117. González Zuelgaray J. Síndromes de preexcitación. En, González Zuelgaray J, editor. Arritmias cardíacas. Buenos Aires: Ed Inter-Médica; 2006:.p. 158-91.
118. González Zuelgaray, Pérez A. Regular supraventricular tachycardias associated with idiopathic atrial fibrillation. Am J Cardiol 2006; 98:1242-4.
119. Basso C, Corrado D, Rossi L, Thiene G. Ventricular preexcitation in children and young adults. Atrial myocarditis as a possible trigger of sudden death. Circulation 2001;103(2):269-75.
120. Wellens HJJ, Durrer D. Wolff-Parkinson-White syndrome and atrial fibrillation. Relation between refractory period of the accessory pathway and ventricular rate during atrial fibrillation. Am J Cardiol 1974; 34(7):777-82.
121. Milstein S, Sharma AD y Klein GJ. Electrophysiologic profile of asymptomatic Wolff-Parkinson-White pattern. Am J Cardiol 1986; 57(13):1097- 100.
123. Teo WS, Klein GJ, Guiraudon GM, Yee R, Leitch JW, McLellan D, et al. Multiple accessory pathways in the Wolff-Parkinson-White syndrome as a risk factor for ventricular fibrillation. Am J Cardiol 1991; 67(9):889-91.
125. Wellens HJJ. Wolff-Parkinson-White syndrome, Part I. Mod Conc Cardiovascular Dis 1983; 52:53-56.
126. González Zuelgaray J. Síndromes de preexcitación (Internet). Buenos Aires; 1991(consultado 29 Feb 2016). Disponible en: http://www.suc.org.uy/emcc07/Arritmias_archivos/Bibliopdf/arritmias-Sindromes%20de%20Preexcitacion%20III.pdf
127. Kanter RJ, del Rio A, Miretti C, González- Zuelgaray J. Coexisting preexcitation syndrome and intermittent heart block presenting as neonatal seizures. J Cardiovasc Electrophysiol 1999; 10(5): 736-40.
128. SzaboTS, Singer I. Wolff-Parkinson-White and other preexcitation syndromes. En: Singer I, Kupersmith J, editors. Clinical manual of electrophysiology.
129. Montoya PT, Brugada P, Smeets J, Talajic M, Della Bella P, Lezaun R, et al. Ventricular fibrillation in the Wolff-Parkinson-White syndrome. Eur Heart J 1991; 12(2):144-50.
130. Timmermans C, Smeets J, Rodríguez LM, Vrouchos G, van den Dool A, Wellens HJ. Aborted sudden death in the Wolff-Parkinson-White syndrome. Am J Cardiol 1995; 76(7):492-4.
131. Klein GJ, Yee R y Sharma AD. Longitudinal electrophysiologic assessment of asymptomatic patients with the Wolff-Parkinson-White electrocardiographic pattern. N Engl J Med 1989; 320(19):1229-33.
132. Brembilla-Perrot B, Holban I, Houriez P y col. Influence of age on the potencial risk of sudden death in asymptomatic Wolff-Parkinson-White syndrome. Pacing Clin Electrophysiol 2001; 24(10):1514-8.
133. González Zuelgaray J, Szyszko A, Pérez A, Cassella G, Hallon L. Primera experiencia en Sudamérica con crioablación por catéter de las arritmias cardíacas. Revista de Medicina Interna (Internet). 2008 (consultado 1 Mar 2016); (aprox. 3p.). disponible en: http://www.smiba.org.ar/revista/vol_04_2008/04_01_4.htm
134. Daubert JP, Sheu S-S. Mistery of biphasic defibrillation wave form efficacy is it calcium. J Am Coll Cardiol 2008; 52(10):836-8.
135. Dries DL, Exner DV, Gresh BJ, Domanski MJ, Waclawiw MA, Stevenson LW. Atrial fibrillation is associated with an increased risk for mortality and heart failure progression in patients with asymptomatic and symptomatic left ventricular systolic dysfunction: a retrospective analysis of the SOLVD trials. Studies of left ventricular dysfunction. J Am Coll Cardiol 1998; 32(3):695-703.
136. Deedwania PC, Singh BN, Ellenbogen K, Fisher S, Fletcher R, Singh SN. Spontaneous conversion and maintenance of sinus rhythm by amiodarone in patients with heart failure and atrial fibrillation: Observations from the veterans affairs congestive heart failure survival trial of antiarrhythmic therapy (CHF-STAT). Circulation 1998; 98(23): 2574-9.
137. Middlekauff HR, Stevenson WG, Stevenson LW. Prognostic significance of atrial fibrillation in advanced heart failure. A study of 390 patients. Circulation 1991;84(1):40-8.
138. Olsson LG, Swedberg K, Ducharme A, Granger CB, Michelson EL, McMurray JJ, et al. Atrial fibrillation and risk of clinical events in chronic heart failure with and without left ventricular systolic dysfunction: Results from the Candesartan in Heart failure. Assessment of Reduction in Mortality and Morbidity (CHARM) Program. J Am Coll Cardiol 2006; 47(10): 1997-2004.
139. Pérez A, González Zuelgaray J. Drogas antiarrítmicas. En: González Zuelgaray J, editor. Arritmias cardíacas.
140. Singh SN,
141. Pedersen OD, Bagger H, Keller N, Marchant B, Køber L, Torp-Pedersen C. Efficacy of dofetilide in the treatment of atrial fibrillation-flutter in patients with reduced left ventricular function: a Danish investigations of arrhythmia and mortality on dofetilide (DIAMOND) substudy. Circulation 2001; 104(3):292-6.
142. Roy D, Talajic M, Nattel S, Wyse DG, Dorian P, Lee KL, et al. Rhythm control versus rate control for atrial fibrillation and heart failure. N Engl J Med 2008; 358(25):2667-77.
143. Zhang B, Shen D, Feng S, Zhen Y, Zhang G. Efficacy and safety of catheter ablation vs. rate control of atrial fibrillation in systolic left ventricular dysfunction. A meta-analysis and systematic review. Herz 2015 Nov 23. (Epub ahead of print)
144. Zhao Y, Di Biase L, Trivedi C, Mohanty S, Bai R, Mohanty P, et al. Importance of non-pulmonary vein triggers ablation to achieve long-term freedom from paroxysmal atrial fibrillation in patients with low ejection fraction. Heart Rhythm 2016;13(1): 141-9. doi: 10.1016/j.hrthm.2015.08.029. Epub 2015 Aug 21
146. Leclercq C, Walker S, Linde C, Clementy J, Marshall AJ, Ritter P, et al. Comparative effects of permanent biventricular and right-univentricular pacing in heart failure patients with chronic atrial fibrillation. Eur Heart J 2002; 23(22):1780-7.
147. Dickstein K, Vardas PE, Auricchio A, Daubert JC, Linde C, McMurray J, et al. 2010 focused update of ESC Guidelines on device therapy in heart failure: An update of the 2008 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure and the 2007 ESC Guidelines for cardiac and resynchronization therapy. Developed with the special contribution of the Heart Failure Association and the European Heart Rhythm Association. Eur J Heart Fail 2010; 12(11):1143-53.
148. Sadiq Ali F, Enriquez A, Conde D, Redfearn D, Michael K, Simpson C, et al. Advanced interatrial block predicts new onset atrial fibrillation in patients with severe heart failure and cardiac resynchronization therapy. Ann Noninvasive Electrocardiol 2015;20(6):586-91. doi: 10.1111/anec.12258. Epub 2015 Feb 2
149. Gianni C, Di Biase L, Mohanty S, Gökoðlan Y, Güneº MF, Al-Ahmad A, et al. How to improve cardiac resynchronization therapy benefit in atrial fibrillation patients: pulmonary vein isolation (and Beyond). Card Electrophysiol Clin 2015;7(4):755-64.
150. Upadhyay GA, Choudry NK, Auricchio A, Ruskin J, Singh JP. Cardiac resynchronization in patients with atrial fibrillation. J Am Coll Cardiol 2008;52(15):1239-46.