Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión impresa ISSN 0797-0048versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.31 no.1 Montevideo abr. 2016
ESPECIAL
FIBRILACIÓN
AURICULAR
Artículo de revisión
Tratamiento farmacológico de la fibrilación auricular
Dr. Angel Moya i Mitjans
Director del programa de Arritmias del Hospital Universitario Vall d’Hebron
Correo para correspondencia: Muntaner 496 2º 2ª. 08022 Barcelona, España
Palabras clave:
FIBRILACIÓN ATRIAL / terapia farmacológica
FIBRILACIÓN ATRIAL / prevención & control
FIBRILACIÓN ATRIAL / complicaciones
ANTICOAGULANTES
FACTORES DE RIESGO
Key words:
ATRIAL FIBRILLATION / drug therapy
ATRIAL FIBRILLATION / complications
ATRIAL FIBRILLATION / prevention & control
ANTICOAGULANTS
RISK FACTORS
Introducción
Por otra parte, la FA es un factor de riesgo independiente de ictus(4), así como de mortalidad(5) y de la presencia de eventos cardiovasculares.
Hay datos que confirman que aproximadamente un 10% de los pacientes con FA están asintomáticos(1,6), de forma que en muchas ocasiones su detección es muy difícil o se detectan por primera vez cuando ya se ha presentado una complicación de la propia FA.
La FA puede afectar a los pacientes en diversos aspectos. El primero y el más importante de ellos, tal como se ha comentado más arriba, es el riesgo de padecer un accidente tromboembólico. El segundo es la presencia de síntomas relacionados con la propia arritmia, en general en forma de palpitaciones, intolerancia al ejercicio, disnea, dolor torácico, sensación de ansiedad o en ocasiones síntomas menos específicos(7). En tercer lugar la FA puede ser causa de insuficiencia cardíaca (IC) o agravar una IC preexistente y puede ser, asimismo, causa directa de disfunción ventricular(8).
Conceptualmente el tratamiento de la FA debería de ir dirigido al control de estos tres aspectos, prevención del riesgo tromboembólico, mejoría de los síntomas y mejoría del pronóstico ya sea mejorando la disfunción ventricular o la morbimortalidad.
Desde un punto de vista de estrategia, en el tratamiento de los pacientes con FA se han planteado dos líneas, que no tiene que ser excluyentes, ya que en ocasiones pueden estar sobrepuestas. Una es la llamada estrategia de control del ritmo, que consiste en intentar mantener el ritmo sinusal (RS). En las estrategias control del ritmo hay dos niveles de actuación: uno de ellos es la conversión de un paciente que está en FA a RS, que se conoce con el nombre de cardioversión (CV), y la otra consistente en intentar mantener el RS en aquellos pacientes que tienen episodios recurrentes de caídas en FA. La otra estrategia es la llamada control de la frecuencia cardíaca (FC), que es aquella en que se decide mantener al paciente en FA sin intentar paso a RS buscando mantener una FC adecuada.
En este capítulo se hará especial referencia a los tratamientos farmacológicos, sus indicaciones, sus limitaciones y algún dato sobre su uso, aunque dado que en ocasiones puede haber cierta sobreposición entre los tratamientos farmacológicos y los no farmacológicos, y dado que además el conocimiento del resultado de las estrategias no farmacológicas es importante para la toma de decisiones, se darán algunas ideas acerca del estado de los tratamientos no farmacológicos.
Prevención de riesgo tromboembólico
La FA no solo incrementa el riesgo de presentar embolismo arterial y de forma específica ictus, sino que los ictus asociados a FA suelen ser más severos(4).
El riesgo de presentar complicaciones tromboembólicas en los pacientes con FA está en función de una serie de parámetros clínicos bien definidos(9,10).
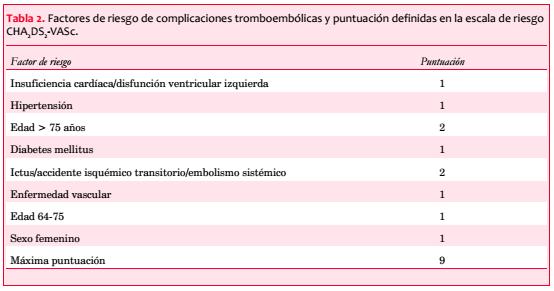
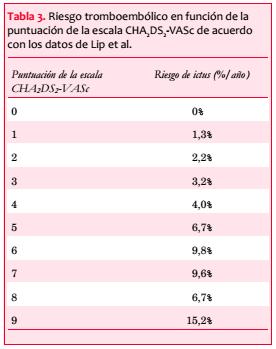
Se han descrito varias escalas de riesgo tromboembólico. Actualmente una de las más aceptadas es la escala CHA2DS2-VASc(10). En las tablas 2 y 3 se muestran los factores de riesgo que se usan para la definición de la escala CHA2DS2-VASc, así como la puntuación que se le da a cada uno de ellos y la probabilidad de complicación tromboembólica en función del número de la escala de riesgo, de acuerdo con los datos de Lip(11).
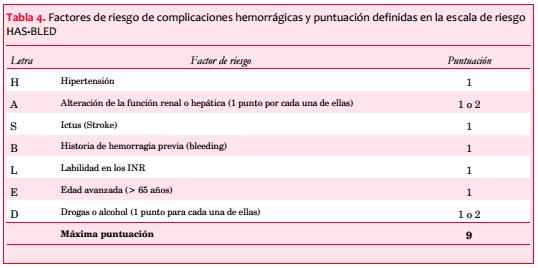
En el momento actual las técnicas de cierre de orejuela son una alternativa para pacientes que tienen clara indicación de tratamiento anticoagulante, pero que por alguna razón tienen contraindicación para su uso o un riesgo excesivo de sangrado. Se trata de todos modos de una técnica en evolución y que no está exenta de complicaciones(14). Las indicaciones, las limitaciones y los aspectos técnicos de esta alternativa están fuera de los objetivos de este artículo.
Tipo de anticoagulante y selección del mismo
Hasta hace unos años solo se disponía de los antivitamina K. Estos fármacos se caracterizan por tener una importante variabilidad en su nivel de anticoagulación, un estrecho margen terapéutico, lo que significa que frecuentemente están por debajo o por encima de sus niveles terapéuticos, aumentando el riesgo trombótico o de sangrado, y múltiples interferencias en su absorción y efecto con diferentes alimentos o fármacos. Ello implica que los pacientes que están tratados con antivitamina K deben de realizar controles periódicos de los niveles de anticoagulación, que en el mejor de los casos debe de ser cada cuatro semanas, pero que frecuentemente deben ser más a menudo por inestabilidad de los controles, interfiriendo de forma importante con el estilo de vida de muchos pacientes. Además, tanto el inicio como el final de su acción es bastante irregular, de forma que las pautas de inicio y de suspensión del mismo, habitualmente por intervenciones quirúrgicas, son complejas e inseguras, dejando a los pacientes en no pocas ocasiones desprotegidos transitoriamente.
Todo ello ha llevado a la búsqueda de alternativas más estables, seguras y efectivas, que además sean más confortables para el paciente. Así pues en los últimos años se han desarrollado los llamados nuevos anticoagulantes de acción directa (NOACs), ya sea con acción antitrombina o factor II (dabigatrán)(15) o antifactor Xa (rivaroxabán(16), apixabán(17) o edoxabán(18)).
Estos fármacos tienen mayor estabilidad terapéutica y no precisan de controles sobre su eficacia, pudiéndose administrar en dosis fijas, una o dos veces al día en función del fármaco (dos veces al día dabigatrán y apixabán y una vez al día rivaroxabán y edoxabán).
Diversos estudios que han incluido en general a más de 71.000 pacientes(19) han mostrado que en conjunto no solo no son inferiores a warfarina, sino que reducen la tasa de hemorragia intracraneal y algunos de ellos reducen la mortalidad global. Obviamente estos fármacos tienen algunas limitaciones y deben ser administrados con precauciones en determinados grupos de pacientes. Tienen metabolismo renal, de forma que en pacientes con insuficiencia renal moderada se debe de ajustar la dosis y en aquellos pacientes con insuficiencia renal severa pueden estar contraindicados.
Dado que los estudios que se han hecho con cada uno de los fármacos se han comparado con los antivitamina K, en la actualidad es difícil poder afirmar si alguno de ellos es superior a los otros y dar recomendaciones sobre cuál de ellos debe recomendarse para cada uno de los pacientes.
Situaciones especiales
De cara a optimizar el beneficio del tratamiento anticoagulante, se debe de hacer una serie de precisiones que frecuentemente pueden crear dudas.
Los pacientes con FA paroxística en tratamiento con control del ritmo, ya sea con fármacos o con ablación, y que aparentemente se mantienen en RS, deben seguir tratamiento anticoagulante con las mismas pautas que los pacientes en FA, ya que se ha visto que estos pacientes frecuentemente tiene crisis de FA asintomáticas(1,6,20), de forma que la ausencia de síntomas no es equivalente a la ausencia de episodios de FA(21) y, por lo tanto, la ausencia de tratamiento anticoagulante en este grupo de pacientes podría incrementar el riesgo de ictus(22).
Otro grupo de pacientes que merecen una consideración especial son los pacientes con flutter auricular, que se deberían de anticoagular con las mismas pautas que los pacientes con FA(23).
Control de la frecuencia cardíaca
El control de la FC se plantea de forma fundamental en los pacientes en los que se decide que se mantengan en FA, es decir aquellos con FA permanente, pero también en los pacientes en los que se decide control del ritmo con la finalidad de evitar que en los momentos en que caigan en FA lo hagan con frecuencias elevadas(24-27).
Los fármacos de que se dispone para el control de la FC son básicamente los betabloqueantes, los calcioantagonistas no dihidropiridínicos y la digoxina.
En general los betabloqueantes son los fármacos más utilizados y su selección y dosificación dependen de la preferencia y de la respuesta del paciente. Los betabloqueantes son probablemente los fármacos de elección en aquellos pacientes que presentan taquicardia especialmente de esfuerzo.
Los calcioantagonistas pueden ser una buena elección en aquellos pacientes que no toleran los betabloqueantes.
Los datos sobre la seguridad y efectividad de la digoxina son algo contradictorios y la mayoría provienen de estudios post-hoc o de metaanálisis(28-30,31). De todos modos, en el caso en que se decida su administración, se deberían de realizar con cautela, con un seguimiento estrecho especialmente en pacientes de edad y con disfunción renal, realizando controles de digoxinemia y en general como terapia coadyuvante.
Los fármacos frenadores no siempre son efectivos en conseguir detener la FC y en ocasiones su uso puede estar limitado por el hecho de provocar en momentos determinados exceso de bradicardia(32).
En los casos en que con los fármacos frenadores no se consiga controlar la FC, así como en aquellos en los que los fármacos provoquen exceso de bradicardia, puede estar indicada la implantación de un marcapasos, inicialmente con la idea de permitir la optimización del tratamiento farmacológico, especialmente en aquellos casos en que el problema con estos fármacos sea la provocación de episodios de bradiarritmias que limiten su uso. En el caso en que una vez implantado el marcapasos no sea posible el control de la FC con fármacos, se debería de valorar la realización de una ablación del nodo auriculoventricular (A-V) (33).
Se ha descrito que en aquellos pacientes con FA paroxística tratados con fármacos antiarrítmicos, especialmente del grupo IC, en algunas ocasiones estos fármacos pueden convertir los episodios de FA en flutter, habitualmente ístmico, con una activación auricular algo más lenta, pero con ciclos inferiores a 300 milisegundos (> 200 lpm), lo que podría permitir una conducción A-V 1:1, con FC muy elevadas que pueden causar síntomas severos como síncope o bajo gasto. Por este motivo en estos pacientes se aconseja asociar al tratamiento con los fármacos antiarrítmicos frenadores del nodo A-V para que, en caso de que al paciente caiga en flutter con un ciclo algo más lento, este no conduzca en una relación 1:1(24-27).
Niveles y objetivos de control de la frecuencia cardíaca
Los objetivos principales del control de la FC serían evitar por un lado los síntomas que pudieran atribuirse las FC elevadas y por otro evitar la presencia de deterioro de la función ventricular o la descompensación de insuficiencia cardíaca.
A pesar de que el aumento de la FC suele ser causa de síntomas o de deterioro de la función ventricular, ello no siempre es así, de forma que en ocasiones se ven pacientes con FC elevadas sin síntomas, mientras que en ocasiones se ven pacientes con FC controladas muy sintomáticos, ya sea por la pérdida de la contracción auricular, por la irregularidad de la FC o por la ausencia de adaptación de la FC a situaciones metabólicas determinadas.
Por otra parte, no se han establecido de forma clara cuáles deben de ser los objetivos de control de FC en estos pacientes. Clásicamente se había definido que podría ser una FC en reposo de 80 lpm y una FC en ejercicio moderado de 110 lpm(34).
Recientemente, en el estudio RACE II(32) se han estudiado las ventajas e importancia del control de la FC. En este estudio se han incluido pacientes en FA permanente y se han aleatorizado a una estrategia de control estricto, en la que el objetivo era obtener estos valores de FC con la administración de fármacos frenadores, solos o en asociación, frente a una estrategia conocida como de control laxo, en la que el objetivo era una FC en reposo de 110 lpm sin plantearse otros objetivos de FC en ejercicio. Las variables de resultado de este ensayo eran la muerte de origen cardiovascular, la presencia de insuficiencia cardíaca, ictus o embolismo periférico, hemorragia, eventos arrítmicos, como síncope o episodios de taquicardia ventricular, efectos secundarios de los fármacos, así como la necesidad de implantar marcapasos o desfibrilador.
La interpretación clínica de este estudio sería que probablemente los objetivos de control de FC en los pacientes con FA permanente se deberían de guiar más por parámetros clínicos que por criterios de FC per se.
Control del ritmo
Bajo el concepto de control del ritmo se entiende el intento de mantener el RS. Hay dos situaciones clínicas, una de ellas es la conversión de un paciente que está en FA a RS, situación que se conoce como CV, y la otra es el intento de mantener el RS en un paciente que presenta episodios recurrentes de FA.
Para ambos objetivos, CV y mantenimiento del RS, hay dos tipos de estrategias, la farmacológica y la no farmacológica. Como veremos a lo largo de la exposición, en general las estrategias no farmacológicas suelen tener una mayor efectividad que las farmacológicas, pero en cualquier caso, no siempre son aplicables, y en muchas ocasiones se utilizan una vez que han fracasado las estrategias farmacológicas(35,36). Por otra parte, frecuentemente en muchos pacientes se debe de establecer una terapia híbrida. En los siguientes apartados se expondrá en primer lugar las alternativas farmacológicas, sus estrategias y resultados con una breve comparación con las alternativas no farmacológicas.
Cardioversión
El concepto de cardioversión (CV) se refiere a la conversión aguda de una FA a RS.
Tal como se ha comentado más arriba hay dos posibles estrategias, una de ellas es la farmacológica y la otra la eléctrica.
La CV suele estar indicada en aquellos pacientes que tienen una FA, habitualmente de reciente comienzo, y en los que se considere que pueden beneficiarse de pasar a RS y que tengan probabilidades de reversión y mantenimiento del RS.
Independientemente de si se trata de una CV en una situación más o menos aguda o programada, la CV per se aumenta el riesgo de tromboembolismo, por lo que antes de realizar una CV se deben de establecer unas pautas específicas de seguridad en cuanto al riesgo tromboembólico. En primer lugar, en la medida de lo posible, antes de realizar una CV, los pacientes deberían de estar anticoagulados correctamente durante por lo menos tres semanas previas. En los pacientes tratados con fármacos antivitamina K, esto significa que se debe asegurar que los pacientes hayan estado con un INR en rango terapéutico durante las tres semanas previas y el día de la CV. Ello no siempre es fácil y lleva a suspensiones de la CV en el día programado en un porcentaje variable de pacientes(37). En los últimos años ha habido datos sugiriendo que con los nuevos anticoagulantes de acción directa, la CV puede realizarse de una forma segura(38,39). Más recientemente se ha publicado un estudio aleatorizado en el que se compara el uso de warfarina frente a rivaxobán en pacientes programados para CV, tanto en una estrategia de CV precoz como programada(37), y se ha visto que no solo no hay diferencias en la tasa de complicaciones embólicas o hemorrágicas, sino que los pacientes aleatorizados a la rama de warfarina sufrieron cancelaciones y retrasos en la CV debido a problemas de ajustes del INR con respecto al grupo de rivaroxabán. Por todo ello, en el momento actual, cuando se plantea una CV programada, probablemente la estrategia de iniciar tratamiento con un nuevo anticoagulante oral permita programar mejor la CV.
En el caso de que se deba de realizar una CV a algún paciente que no haya estado anticoagulado en las semanas anteriores, se debería descartar la presencia de un trombo en aurícula izquierda mediante la realización de un ecocardiograma transesofágico, y en el caso de que este muestre ausencia de trombos, se debe administrar una dosis de heparina antes de la CV y luego mantener al paciente en tratamiento anticoagulante al menos cuatro semanas o de forma indefinida si el paciente tiene perfil de riesgo(23).
Desde un punto de vista logístico y en relación con la duración previa de la FA, hay dos estrategias de CV: una de ellas es la FA de inicio reciente, en la que se plantea la CV de forma relativamente prioritaria, y la otra es la FA de más de 48 horas de duración, en que la CV se plantea de forma programada.
Fibrilación auricular de inicio reciente
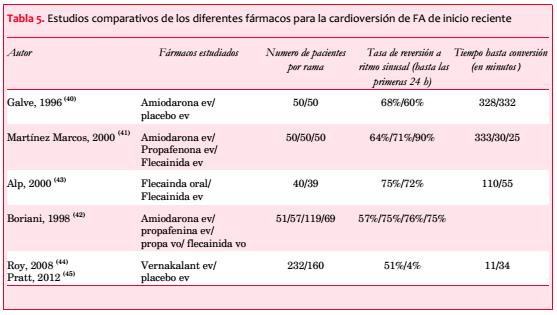
Habitualmente se entiende por FA de inicio reciente a la que tiene una duración de menos de 48 horas. La efectividad de los fármacos para la CV está en clara relación con el tiempo de evolución de la misma y, por lo tanto, es en la FA de inicio reciente en donde los fármacos pueden tener un mayor papel.
Globalmente, la amiodarona no ha mostrado ser superior al placebo en varios estudios, de forma que probablemente no debería de utilizarse como fármaco para la conversión a RS(40-42).
Los fármacos del grupo IC sí que han mostrado superioridad al placebo en la conversión a RS en FA de menos de 48 horas(41-43). Globalmente la tasa de reversiones es similar para las formas orales que para las endovenosas, si bien en las formas de administración endovenosa el efecto es algo más rápido(42,43). En cualquier caso los fármacos del grupo IC están contraindicados en pacientes con cardiopatía así como con trastornos de conducción en el electrocardiograma (ECG).
El vernakalant es un fármaco reciente que está solo en formulación endovenosa y que ha mostrado una tasa de reversiones de 50% en unos 10 minutos(44,45). Asimismo, vernakalant está contraindicado en pacientes con insuficiencia cardíaca, especialmente en aquellos que tienen un QT largo y en pacientes con estenosis aórtica.
Así pues, en el momento actual hay una serie de fármacos que administrados de forma oral o endovenosa pueden facilitar la reversión a RS en pacientes con FA de menos de 48 horas de duración. En cualquier caso, todos estos fármacos están limitados a pacientes sin cardiopatía y su efectividad es inferior a la CV eléctrica, cuya efectividad en la actualidad con la disponibilidad de choques bifásicos es superior a 90%(46,47).
Alboni y colaboradores(48), con el objetivo de aumentar la tasa de pacientes que se pudieran beneficiar de una CV farmacológica precoz y con el objetivo de intentar reducir el número de asistencias a urgencias e ingresos hospitalarios, plantearon la hipótesis de que aquellos pacientes que presentaron un episodio de FA y que fueron cardiovertidos con flecainida o propafenona oral con efectividad y seguridad en un servicio de urgencias en una primera ocasión, pudieran autoadministrarse el fármaco con el objetivo de aumentar la tasa de reversiones. En este estudio, en aquellos pacientes en los que se hubiera confirmado en una primera asistencia en urgencias que uno de estos dos fármacos hubiera sido efectivo, se les recomendó la autoadministración oral a nivel ambulatorio (300 mg de flecainida o 600 mg de propafenona, en pacientes > 70 kg o 200 y 450 mg respectivamente en caso de menor peso) de forma precoz tras el inicio del episodio de FA. Estos pacientes se administraron el fármaco en un promedio de 36 ± 93 minutos tras el inicio de la crisis y el fármaco fue efectivo en convertir la arritmia en 94% de los episodios, en un tiempo medio de 113 ± 84 minutos. La ventaja de esta estrategia es que por un lado permite iniciar el tratamiento de forma más precoz y por otro evita que el paciente tenga que acudir a urgencias. De todas maneras esta estrategia estaría limitada a pacientes sin cardiopatía ni alteraciones del ECG, a los que ya se ha realizado un primer tratamiento bajo control y que además tengan episodios relativamente ocasionales, ya que aquellos que presentan episodios frecuentes probablemente sean candidatos a una estrategia de prevención, ya sea con fármacos o con ablación.
Cardioversión en pacientes con fibrilación auricular de larga duración
En los pacientes en los que se plantea la CV en FA de mayor duración, la realización de una CV únicamente farmacológica tiene poca probabilidad de éxito y la estrategia de elección es la CV eléctrica. De todos modos se ha sugerido que la administración previa de un fármaco antiarrítmico, ya sea del grupo IC en aquellos pacientes sin cardiopatía o de amiodarona en los pacientes con cardiopatía, podría aumentar la tasa de efectividad aguda de la CV eléctrica y ayudar a mantener el RS durante varios meses tras la CV(49), ayudando al proceso de remodelado inverso de cara a mantener el RS por mayor tiempo.
Mantenimiento del ritmo sinusal
Para el mantenimiento del RS en pacientes con episodios de FA recurrentes hay dos posibles estrategias que no tienen por qué ser excluyentes, ya que en no pocas ocasiones los pacientes pueden recibir ambas: una de ellas es el tratamiento farmacológico y la otra es el tratamiento mediante ablación.
Alternativas farmacológicas para el mantenimiento del ritmo sinusal
Las alternativas farmacológicas en el momento actual se centran en dos grupos de fármacos. Los fármacos del llamado grupo IC de la clasificación de Vaughan-Williams, concretamente propafenona y flecainida, y los fármacos derivados de la amiodarona, como amiodarona, dronedarona y sotalol.
Todos ellos tienen una efectividad limitada, efectos secundarios y limitaciones de uso en diferentes grupos de pacientes.
La amiodarona es probablemente el fármaco más efectivo en el mantenimiento del RS y el único que se puede administrar en pacientes con cardiopatía de base, sin embargo, su uso prolongado se asocia a una tasa relativamente elevada de efectos secundarios, algunos de ellos potencialmente graves, como fibrosis pulmonar, alteraciones tiroideas, depósitos corneales u otras como fotosensibilidad. Por todo ello no es aconsejable administrarlo en pacientes jóvenes y su uso se debería de restringir a pacientes de edad, con cardiopatía, y en los que otras alternativas no sean posibles.
Los fármacos del grupo IC son una alternativa razonable en pacientes sin cardiopatía y sin trastornos de conducción en el ECG.
Durante los últimos años se ha desarrollado la dronedarona, que en múltiples estudios ha mostrado su efectividad en el mantenimiento del RS(50), si bien debería de evitarse asimismo en pacientes con disfunción ventricular y que hayan presentado insuficiencia cardíaca(51).
El sotalol es un fármaco que comparte cierto efecto clase III y efecto betabloqueante. Su efectividad es probablemente algo menor que la de otros fármacos.
En general la efectividad de los fármacos en el mantenimiento del RS es limitada(22), no exenta de efectos secundarios, y se ha mostrado claramente que es inferior a la ablación. Además, en los pacientes con cardiopatía de base o alteraciones del ECG las alternativas farmacológicas se limitan a la amiodarona.
Alternativas no farmacológicas
Durante los últimos años se han desarrollado técnicas de ablación que si bien siguen teniendo unos resultados relativamente subóptimos, estos siguen siendo mejores que los de los fármacos antiarrítmicos(35,36). En aquellos pacientes con FA paroxística en el momento actual la ablación se puede ofrecer como alternativa inicial incluso en pacientes que nunca han recibido fármacos o como alternativa a los fármacos cuando estos han fracasado en la FA persistente.
Escapa a los objetivos de este artículo describir aspectos técnicos y resultados de la ablación, pero en cualquier caso sí es importante destacar que algunos pacientes sometidos a ablación deberán de seguir recibiendo tratamiento con fármacos antiarrítmicos.
Asimismo, en la actualidad, aquellos pacientes que por estratificación de riesgo tengan indicación de tratamiento anticoagulante deberán de seguir en tratamiento independientemente del resultado de la ablación.
Indicaciones y estrategia
Dado que la presencia de FA per se es un factor de riesgo de aumento de la mortalidad, se ha planteado desde hace años que intentar mantener el RS debería de ser un objetivo deseable que podría mejorar no solo los síntomas sino la morbimortalidad de estos pacientes.
En la década del 2000 se publicaron varios estudios en los que se comparaban estrategias dirigidas a intentar mantener en RS, lo que se conocía como control del ritmo, frente a dejar a los pacientes en FA e intentar mantener un control de la FC(52-57). En estos estudios, la población incluida, la metodología para mantener el ritmo y los objetivos finales eran, en general, bastante similares. En todos ellos se observó que la estrategia de control del ritmo no aportaba ventajas en cuanto a supervivencia o complicaciones graves del tipo de ictus, embolismo, insuficiencia cardíaca u otro tipo de hemorragias frente a una estrategia dirigida únicamente al control de la FC. En algunos de estos estudios los pacientes asignados al grupo de control del ritmo tuvieron más hospitalizaciones y en algunos de ellos incluso hubo tendencia a tener una tasa elevada de ictus. Lo que se pudo observar en la mayoría de estos estudios era que si bien la tasa de mantenimiento del RS era algo más elevada en el grupo de pacientes aleatorizados a control del ritmo que en el grupo de los pacientes de control de la frecuencia, esta era baja incluso en los pacientes del grupo de control del ritmo. Por otra parte, tanto en el estudio STAF(57) como en un análisis post hoc del estudio AFFIRM(52) se mostró que los pacientes que se mantenían en RS tenían una reducción de las variables de los resultados principales del estudio.
El análisis de estos datos sugiere que probablemente el estar en RS es mejor que mantenerse en FA, pero que la efectividad de los fármacos antiarrítmicos en el mantenimiento del RS es limitada e incluso puede verse agravada por la presencia de efectos secundarios a los fármacos.
Datos recientes muestran que si bien también tiene limitaciones, la ablación de la FA mediante aislamiento de las venas pulmonares es superior a los fármacos en el mantenimiento del RS.
Hay una serie de factores que determinan la probabilidad de que un paciente pueda recuperar y mantener el RS, y en general son la edad, la duración de la FA, el tamaño de la aurícula izquierda y la presencia de otras comorbilidades, como puede ser la enfermedad pulmonar, la obesidad o la presencia de cardiopatía evolucionada.
Así el objetivo de mantener el RS es deseable en aquellos pacientes que por su perfil tengan probabilidades de mantenerlo. La decisión de si se deberá de hacerlo con fármacos o con ablación dependerá del perfil y de las preferencias del paciente así como de la experiencia del centro en que se vaya a realizar. En aquellos pacientes en que los fármacos para el control del ritmo no sean efectivos se deberán de retirar y optar por un intento de ablación o por mantener el control de la FC.
Bibliografía
1. Gómez-Doblas JJ, Muñiz J, Alonso Martin JJ, Rodríguez-Roca G, Lobos JM, Awamleh P, et al. Prevalencia de fibrilación auricular en España. Resultados del estudio OFRECE. Rev Esp Cardiol 2014;67(4):259-69.
2. Krijthe BP, Kunst A, Benjamin EJ, Lip GY, Franco OH, Hofman A, et al. Projections on the number of individuals with atrial fibrillation in the European Union, from 2000 to 2060. Eur Heart J 2013; 34(35):2746-51.
3. Chugh SS, Havmoeller R, Narayanan K, Singh D, Rienstra M, Benjamin EJ, et al. Worldwide epidemiology of atrial fibrillation: a global burden of disease 2010 study. Circulation 2014;129(8):837-47.
4. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: The Framingham Study. Stroke 1991; 22(8):983-8.
5. Benjamin EJ, Wolf PA, D’Agostino RB, Silbershatz H, Kannel WB, Levy D. Impact of atrial fibrillation on the risk of death: the Framingham Heart Study. Circulation 1998;98:946-52.
6. Lévy S, Maarek M, Coumel P, Guize L, Lekieffre J, Medvedowsky JL, et al. Characterization of different subsets of atrial fibrillation in general practice in
7. Kirchhof P, Auricchio A, Bax J, Crijns H, Camm J, Diener HC, et al. Outcome parameters for trials in atrial fibrillation: Recommendations from a consensus conference organized by the German atrial fibrillation competence NETwork and the European heart rhythm association. Europace 2007; 9(11):1006-23.
8. Van den Berg MP, Tuinenburg AE, Crijns HJ, Van Gelder IC, Gosselink AT, Lie KI. Heart failure and atrial fibrillation: current concepts and controversies. Heart 1997;77(4):309-13.
9. Camm AJ, Kirchhof P, Lip GYH, Schotten U, Savelieva I, Ernst S, et al. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Europace 2010;12(10): 1360-420.
10. Lip GYH, Nieuwlaat R, Pisters R, Lane DA, Crijns HJGM. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: The Euro Heart Survey on atrial fibrillation. Chest 2010;137:263-72.
11. Lip GYH, Frison L, Halperin JL, Lane DA. Identifying patients at high risk for stroke despite anticoagulation: A comparison of contemporary stroke risk stratification schemes in an anticoagulated atrial fibrillation cohort. Stroke 2010;41(12):2731-8.
12. Själander S, Själander A, Svensson PJ, Friberg L. Atrial fibrillation patients do not benefit from acetylsalicylic acid. Europace 2014;16:631-8.
13. Lau YC, Lip GYH. Acetylsalicylic acid for stroke prevention in atrial fibrillation: A conspiracy that needs to end? Europac 2014;16:619-20.
14. Pison L, Potpara TS, Chen J, Larsen TB, Bongiorni MG, Blomström-Lundqvist C, et al. Left atrial appendage closure-indications, techniques, and outcomes: results of the European Heart Rhythm Association Survey. Europace 2015;17: 642-6.
15. Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361(12):1139-51.
16. Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011;365(10):883-91.
17. Granger CB, Alexander JH, McMurray JJV, Lopes RD, Hylek EM, Hanna M, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011;365(11):981-92.
18. Giugliano RP, Ruff CT, Braunwald E, Murphy SA, Wiviott SD, Halperin JL, et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013;369(22):2093-2104.
19. Ruff CT, Giugliano RP, Braunwald E, Hoffman EB, Deenadayalu N, Ezekowitz MD, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: A meta-analysis of randomised trials. Lancet 2014;383(9921):955-62.
20. Cabrera S, Mercé J, De Castro R, Aguirre C, Carmona A, Pinedo M, et al. Pacemaker clinic: an opportunity to detect silent atrial fibrillation and improve antithrombotic treatment. Europace 2011; 13(11):1574-9.
21. Pérez-Castellano N, Fernández-Cavazos R, Moreno J, Cañadas V, Conde A, González-Ferrer JJ, et al. The COR trial: A randomized study with continuous rhythm monitoring to compare the efficacy of cryoenergy and radiofrequency for pulmonary vein isolation. Hear Rhythm 2014;11(1):8-14.
23. Camm AJ, Capucci A, Hohnloser SH, Torp-Pedersen C, Van Gelder IC, Mangal B, et al. A randomized active-controlled study comparing the efficacy and safety of vernakalant to amiodarone in recent-onset atrial fibrillation. J Am Coll Cardiol 2011;57(3):313-21.
24. Taylor R, Gandhi MM, Lloyd G. Tachycardia due to atrial flutter with rapid 1:1 conduction following treatment of atrial fibrillation with flecainide. BMJ 2010;340:b4684.
25. Bhardwaj B, Lazzara R, Stavrakis S. Wide Complex Tachycardia in the Presence of Class I Antiarrhythmic Agents: A Diagnostic Challenge. Ann Noninvasive Electrocardiol 2014;19:289-92.
26. Kawabata M, Hirao K, Horikawa T, Suzuki K, Motokawa K, Suzuki F, et al. Syncope in patients with atrial flutter during treatment with class Ic antiarrhythmic drugs. J Electrocardiol 2001;34(1): 65-72.
27. Brembilla-Perrot B, Houriez P, Claudon O, Yassine M, Suty-Selton C, Vancon AC, et al. Can the supraventricular proarrhythmic effects of class 1C antiarrhythmic drugs be prevented with the association of beta blockers? Ann Cardiol Angeiol (
28. Whitbeck MG, Charnigo RJ, Khairy P, Ziada K, Bailey AL, Zegarra MM, et al. Increased mortality among patients taking digoxin - Analysis from the AFFIRM study. Eur Heart J 2013;34(20):1481-8.
29. Gheorghiade M, Fonarow GC, Van Veldhuisen DJ, Cleland JG, Butler J, Epstein AE, et al. Lack of evidence of increased mortality among patients with atrial fibrillation taking digoxin: Findings from post hoc propensity-matched analysis of the AFFIRM trial. Eur Heart J 2013;34(20):1489-97.
30. Vamos M, Erath JW, Hohnloser SH. Digoxin-associated mortality: a systematic review and meta-analysis of the literature. Eur Heart J 2015; 36(28):1831-8.
31. Rodríguez-Mañero M, Otero-Raviña F, García-Seara J, Zugaza-Gurruchaga L, Rodríguez-García JM, Blanco-Rodríguez R, et al. Seguimiento clínico de una muestra contemporánea de pacientes con fibrilación auricular en tratamiento con digoxina: resultados del estudio AFBAR. Rev Esp Cardiol. 2014;67(11):890-7.
32. Van Gelder IC, Groenveld HF, Crijns HJGM, Tuininga YS, Tijssen JG, Alings AM, et al. Lenient versus strict rate control in patients with atrial fibrillation. N Engl J Med 2010;362(15):1363-73.
33. Brignole M, Auricchio A, Baron-Esquivias G, Bordachar P, Boriani G, Breithardt OA, et al. 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: the Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association. Eur Heart J 2013;34(29):2281-329.
34. Van Gelder IC, Van Veldhuisen DJ, Crijns HJGM, Tuininga YS, Tijssen JG, Alings AM, et al. RAte Control Efficacy in permanent atrial fibrillation: a comparison between lenient versus strict rate control in patients with and without heart failure. Background, aims, and design of RACE II. Am Heart J 2006;152(3):420-6.
35. Khan AR, Khan S, Sheikh MA, Khuder S, Grubb B, Moukarbel GV. Catheter ablation and antiarrhythmic drug therapy as first- or second-line therapy in the management of atrial fibrillation: systematic review and meta-analysis. Circ Arrhythm Electrophysiol 2014;7(5):853-60.
36. Mont L, Bisbal F, Hernández-Madrid A, Pérez-Castellano N, Viñolas X, Arenal A, et al. Catheter ablation vs. antiarrhythmic drug treatment of persistent atrial fibrillation: a multicentre, randomized, controlled trial (SARA study). Eur Heart J 2014;35(8):501-7.
37. Cappato R, Ezekowitz MD, Klein AL, Camm AJ, Ma CS, Le Heuzey JY, et al. Rivaroxaban vs. vitamin K antagonists for cardioversion in atrial fibrillation. Eur Heart J 2014;35(47):3346-55.
38. Piccini JP, Stevens SR, Lokhnygina Y, Patel MR, Halperin JL, Singer DE, et al. Outcomes after cardioversion and atrial fibrillation ablation in patients treated with rivaroxaban and warfarin in the ROCKET AF Trial. J Am Coll Cardiol 2013; 61(19): 1998-2006.
39. Flaker G, Lopes RD, Al-Khatib SM, Hermosillo AG, Hohnloser SH, Tinga B, et al. Efficacy and safety of apixaban in patients after cardioversion for atrial fibrillation: Insights from the ARISTOTLE trial (Apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation). J Am Coll Cardiol 2014;63(11):1082-7.
40. Galve E, Rius T, Ballester R, Artaza MA, Arnau JM, García-Dorado D, et al. Intravenous amiodarone in treatment of recent-onset atrial fibrillation: results of a randomized, controlled study. J Am Coll Cardiol 1996;27(5):1079-82.
41. Martínez-Marcos FJ, García-Garmendia JL, Ortega-Carpio A, Fernández-Gómez JM, Santos JM, Camacho C. Comparison of intravenous flecainide, propafenone, and amiodarone for conversion of acute atrial fibrillation to sinus rhythm. Am J Cardiol 2000;86:950-3.
43. Alp NJ, Bell JA, Shahi M. Randomised double blind trial of oral versus intravenous flecainide for the cardioversion of acute atrial fibrillation. Heart 2000;84:37-40.
44. Roy D, Pratt CM, Torp-Pedersen C, Wyse DG, Toft E, Juul-Moller S, et al. Vernakalant hydrochloride for rapid conversion of atrial fibrillation: A phase 3, randomized, placebo-controlled trial. Circulation 2008;117(12):1518-1525.
45. Pratt CM, Roy D, Torp-Pedersen C, Wyse DG, Toft E, Juul-Moller S, et al. Usefulness of vernakalant hydrochloride injection for rapid conversion of atrial fibrillation. Am J Cardiol 2010;106(9): 1277-83.
46. Mittal S, Stein KM, Markowitz SM, Iwai S, Guttigoli A, Lerman BB. An update on electrical cardioversion of atrial fibrillation. Card Electrophysiol Rev 2003;7(3):285-289.
47. Mittal S, Ayati S, Stein KM, Schwartzman D, Cavlovich D, Tchou PJ, et al. Transthoracic Cardioversion of Atrial Fibrillation. Circulation 2000; 101(11):1282-7.
48. Alboni P, Botto GL, Baldi N. Outpatient treatment of recurrent atrial fibrillation with the “pill-in-the-pocket” approach. N Engl J Med 2004; 351:2384-91.
49. Alegret JM, Viñolas X, Romero-Menor C, Pons S, Villuendas R, Calvo N, et al. Trends in the use of electrical cardioversion for atrial fibrillation: influence of major trials and guidelines on clinical practice. BMC Cardiovasc Disord 2012;12:42.
50. Singh BN, Connolly SJ, Crijns HJ, Roy D, Kowey PR, Capucci A, et al. Dronedarone for maintenance of sinus rhythm in atrial fibrillationor flutter. N Engl J Med 2007;357(10):987-99.
51. Køber L, Torp-Pedersen C, McMurray JJ V, Gøtzsche O, Lévy S, Crijns H, et al. Increased mortality after dronedarone therapy for severe heart failure. N Engl J Med 2008;358(25):2678-87.
52 Wyse DG, Waldo AC, DiMarco JO, Domanski MJ,
53. Van Gelder IC,
54. Roy D, Talajic M, Nattel S, Wyse DG, Dorian P, Lee KL, et al. Rhythm control versus rate control for atrial fibrillation and heart failure.
55. Hohnloser SH, Kuck KH, Lilienthal J. Rhythm or rate control in atrial fibrillation — Pharmacological Intervention in Atrial Fibrillation (PIAF): a randomized trial. Lancet 2000;356(9244):1789-94.
56. Opolski G, Torbicki A, Kosior DA, Szulc M, Wozakowska-Kaplon B, Kolodziej P, et al. Rate Control vs Rhythm Control in Patients With Nonvalvular Persistent Atrial Fibrillation. The Results of the Polish How to Treat Chronic Atrial Fibrillation (HOT CAFE) Study. Chest 2004;126(2):476-86.
57. Carlsson J, Miketic S, Windeler J, Cuneo A, Haun S, Micus S, et al. Randomized trial of rate-control versus rhythm-control in persistent atrial fibrillation: the strategies of treatment of atrial fibrillation (STAF) study. J Am Coll Cardiol. 2003;41(10):1690-6.