Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión impresa ISSN 0797-0048versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.31 no.1 Montevideo abr. 2016
Artículo seleccionado
Almanac 2014: las Revistas de las Sociedades Nacionales presentan investigaciones seleccionadas que han determinado recientes avances en la cardiología clínica
Imagenología cardiovascular
Satoshi Nakatani
Correspondencia: Profesor Satoshi Nakatani, Department of Health Sciences,
Correo electrónico: nakatani@sahs.med.osaka-u.acjpv
Revisado el 17 de julio de 2014. Publicado en línea por primera vez el 22 de julio de 2014
Conflicto de intereses: Ninguno.
Aprobación por comités de ética
Origen y arbitraje: Encargado; arbitraje externo.
Resumen
Las revisiones "Almanac" brindan un resumen de articulos sobre tópicos especificos publicados en Heart en los 2 años previos, poniendo en contexto los avances en ese campo incluyendo publicaciones de otras revistas. El foco de este artículo de Almanac es Imagenología Cardiovascular - siendo una revista de cardiología general, la investigación en imágenes publicada en Heart esta orientada a la clínica y frecuentemente impacta en nuestra práctica.
Deformación (“strain”) miocárdica
Las medidas ecocardiográficas de la deformación miocárdica han surgido como una herramienta promisoria a la hora de valorar la función cardíaca y predecir el pronóstico de varias patologías cardíacas(1-3). Actualmente la fracción de eyección del ventrículo izquierdo (FEVI) es el parámetro más utilizado para describir la función sistólica del VI y predecir los resultados de los pacientes con infarto miocárdico e insuficiencia cardíaca. Sin embargo, la FEVI presenta algunas limitaciones técnicas, como la dificultad para trazar los bordes endocárdicos y la necesidad de asumir la geometría del VI. Además, comparado con la FEVI, la deformación longitudinal global (DLG) que se obtiene por la técnica speckle-tracking con ecografía bidimensional parece ser un parámetro funcional más confiable y ofrece información pronóstica de mayor utilidad en los pacientes con insuficiencia cardíaca(1-3).
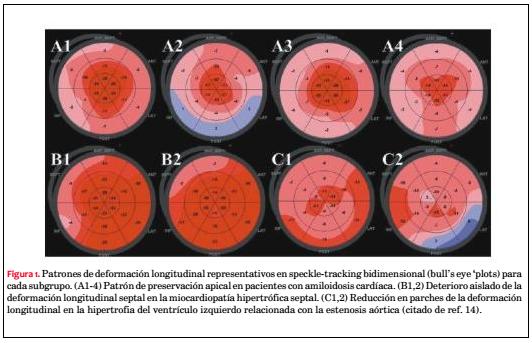
En el pasado, los estudios se enfocaron fundamentalmente en pacientes con ritmo sinusal. Sin embargo, hay muchos pacientes con fibrilación auricular e insuficiencia cardíaca(4), especialmente cuando la insuficiencia cardíaca tiene FEVI conservada. La fibrilación auricular empeora los resultados de la insuficiencia cardíaca y viceversa(5). Por lo tanto, también es importante valorar la función cardíaca en los pacientes con fibrilación auricular(6). En una serie de 196 pacientes con fibrilación auricular, Su y colaboradores(7) utilizaron el método del latido índice (index beat) para eliminar el inconveniente de los intervalos R-R variables(8,9). El latido índice se toma como el latido que sigue a dos ciclos cardíacos casi iguales. Los dos intervalos que preceden al latido índice deben durar por lo menos 500 mseg y la diferencia entre estos dos latidos debe ser menor a 60 mseg. Su y colaboradores demostraron que la DLG fue mejor que la FEVI y la velocidad sistólica del anillo mitral para predecir los eventos cardiovasculares. Los pacientes con una DLG = de-12,5% o menos tenían una mayor sobrevida libre de eventos cardiovasculares que los que tenían una DLG mayor de -12,5%. Frecuentemente la valoración de la función cardíaca de los pacientes con fibrilación auricular se basa en el promedio de mediciones de múltiples latidos, pero este enfoque es muy engorroso y lleva mucho tiempo(10). El método del latido índice constituye una solución alternativa en los pacientes con fibrilación auricular, que podría aplicarse más a menudo si se lo pudiera validar en más estudios.
Tomografía computada (TC) coronaria
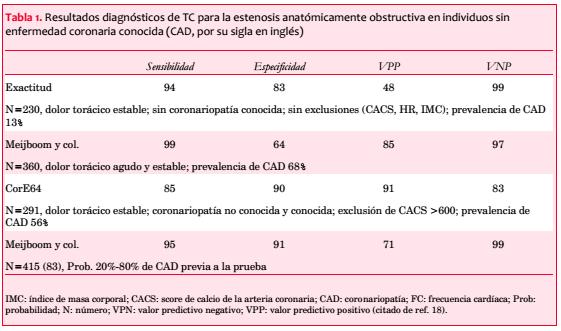
La angiografía TC coronaria con contraste (CCTA por su sigla en inglés) ofrece imágenes de alta resolución de las arterias coronarias que muestran la gravedad y la localización de las estenosis importantes y las características de la placa aterosclerótica. Gracias a su eficacia diagnóstica, la CCTA ha ido ganando popularidad para descartar la presencia de estenosis coronaria (tabla 1) (17-20). Sin embargo, no existe mucha información con respecto a la prevalencia y las características de la aterosclerosis coronaria en pacientes asintomáticos con pocos factores de riesgo de enfermedad coronaria.
Hay muchos estudios que muestran que la CCTA puede aportar información pronóstica importante y de estratificación de riesgo en pacientes en los que se sospecha coronariopatía(23,24). Sin embargo, la mayoría de los estudios anteriores se enfocan en la población general, y se cuenta con datos limitados respecto a efecto de diferencias de edad y sexo. Para evaluar estas diferencias en la incidencia de coronariopatías se realizó CCTA a 2.432 pacientes en los que se sospechaba coronariopatía en un estudio prospectivo multicéntrico(25). Se realizó el análisis de cuatro subgrupos estratificados según el sexo (masculino o femenino) y edad (edad <60 o >60 años). En 991 pacientes (41%) los resultados de CCTA fueron normales, 761 (31%) tuvieron coronariopatía no significativa y 680 (28%) mostraron coronariopatía importante. Durante el seguimiento (mediana: 819 días) ocurrió un evento cardiovascular en 59 (2,4%) individuos sin diferencias específicas de sexo ni de edad. Los resultados de CCTA fueron predictivos de la variable compuesta (infarto miocárdico no fatal y muerte cardíaca) en pacientes de sexo masculino, ambos con edades <60 y >60 años, y en pacientes de sexo femenino >60 años. Sin embargo, en pacientes de sexo femenino <60 años, los resultados de CCTA no fueron predictivos de eventos cardiovasculares adversos. Por consiguiente, si bien CCTA puede ser una valiosa herramienta para descartar coronariopatías, su valor pronóstico parece tener menor valor en mujeres <60 años.
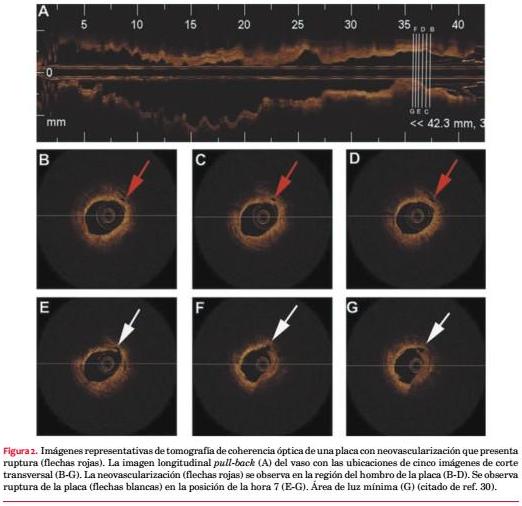
Recientemente, la tomografía de coherencia óptica (OCT) viene siendo ampliamente utilizada como método de imagenología intracoronaria gracias a su alta resolución axial, que va de 12 a 18 µm, comparado con los 150-200 µm de la ecografía intravascular(26). La OCT sirve para visualizar la microestructura de las placas, los microvasos en el interior de las placas coronarias, los stents y las alteraciones de la neoíntima en el interior de los mismos(26,27).
La neovascularización (NV) intraplaca, derivada fundamentalmente de los vasa vasorum preexistentes, ha sido reconocida como un proceso importante para la progresión de la aterosclerosis de los vasos de mayor tamaño(28). Sin embargo, no hay muchos estudios sobre la NV de las placas coronarias. Tian y colaboradores(29) estudiaron la importancia de la NV intraplaca en las placas coronarias utilizando OCT. Analizaron 92 placas causantes de eventos y 203 placas no causantes de eventos de 92 pacientes con angina de pecho inestable y 61 placas de 25 pacientes con angina de pecho estable. La NV fue definida como un pequeño agujero negro dentro de una placa con un diámetro de 50-300 µm que estuviera presente en por lo menos tres cuadros consecutivos en imágenes pull-back. La incidencia de la NV dentro de la placa fue de alrededor de 30% y no hubo diferencias entre las lesiones causantes y no causantes de eventos en pacientes con angina de pecho inestable y estable. Sin embargo, entre las lesiones causantes de eventos obtenidas de pacientes con angina de pecho inestable, las placas con NV tenían un capuchón fibroso más delgado, un núcleo lipídico de mayor tamaño y una mayor incidencia de fibroateroma del capuchón delgada que quienes no tenían NV. No hubo diferencias significativas en las características de la placa entre las lesiones causantes de eventos en casos de angina de pecho inestable y las lesiones de angina de pecho estable. Encontraron que en pacientes con angina de pecho inestable las placas causantes de eventos con NV presentaban características de vulnerabilidad comparado con las que no tenían NV (figura 2). La NV intraplaca tiene efectos duales sobre la placa, dependiendo del estadio de la enfermedad(30). En la etapa temprana ayuda a proveer de nutrientes y oxígeno a la pared del vaso y protege la placa de daño isquémico. Sin embargo, en la etapa tardía, con la aparición de un desequilibrio entre los factores antiangiogénicos y los proangiogénicos, la NV intraplaca se vuelve más inmadura y permite más filtración, promoviendo la conversión de una placa estable en una placa inestable(30.) Por ende, la NV intraplaca podría agravar la desestabilización de las placas en pacientes con angina de pecho inestable.
Perfusión miocárdica
La perfusión miocárdica ha sido estudiada mediante tomografía computarizada por emisión de fotones individuales (SPECT), tomografía de emisión
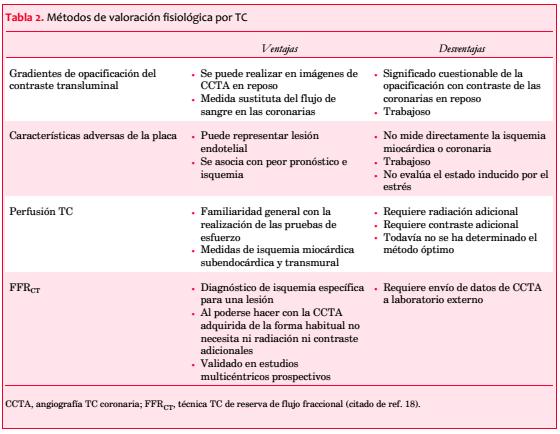
de positrones, RMN con perfusión y ecocardiografía con contraste. El SPECT ha sido lo más popular, y se ha descrito que tiene una capacidad diagnóstica aceptable para identificar a los pacientes que se beneficiarían de la revascularización(31,32).Sin embargo, el resultado de una prueba diagnóstica puede afectar la ulterior derivación para un examen más definitivo. Al ajustar por sesgo de derivación, la SPECT stress arrojó solo 65% de sensibilidad y 67% de especificidad para identificar pacientes con estenosis coronaria severa(33). Asimismo, tiene el problema de ofrecer una resolución espacial limitada y no permite la cuantificación.
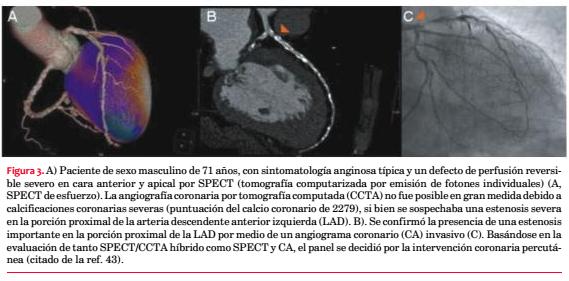
La TC con detector multifilas (MDCT) tiene una mejor resolución temporal y espacial. Hay informes que señalan que la MDCT en un modelo canino de estenosis coronaria logra medir el flujo sanguíneo miocárdico (FSM) usando un método de deconvolución(34). Nakauchi y colaboradores(35) valoraron la factibilidad de este método para cuantificar la perfusión miocárdica en pacientes con infarto agudo de miocardio. Hallaron que tanto el flujo sanguíneo tisular como el volumen de sangre a los tejidos estaban significativamente reducidos en el miocardio infartado en comparación con el miocardio no infartado. El área del defecto medida en el mapa de volumen de sangre tisular con código de colores mostró una buena correlación con el nivel pico de creatininquinasa y la puntuación de defectos en el SPECT. En los pacientes sometidos a MDCT y RMN, a los pocos días el flujo de sangre a los tejidos medido con MDCT concordó con el medido con RMN. Este estudio demostró la factibilidad de evaluar la perfusión miocárdica en una única TC, tal como se realiza en la práctica. Dado que el protocolo de imágenes es congruente con las imágenes iniciales de CCTA, se puede evaluar la perfusión miocárdica y la estenosis de la arteria coronaria simultáneamente en un único examen.
La fibrosis miocárdica se encuentra en diferentes afecciones, tales como hipertensión, cardiopatía isquémica y miocardiopatía. Como tiene una relación directa con el pronóstico, es preciso hacer una valoración no invasiva de la misma. La resonancia magnética cardiovascular (CMR) con contraste ha sido ampliamente utilizada para valorar la fibrosis local(44): desde el advenimiento de la implantación de la válvula aórtica transcatéter (TAVI) ha ido creciendo el interés por la estenosis aórtica. Se espera que uno de los determinantes del pronóstico de EA sea la fibrosis miocárdica que aparece debido a una sobrecarga de presión de larga data. Fairbairn y colaboradores(45) demostraron que la fibrosis miocárdica medida mediante CMR disminuyó después de seis meses en pacientes sometidos a TAVI, si bien no se observó ningún efecto en los pacientes sometidos a reemplazo quirúrgico de la válvula aórtica.
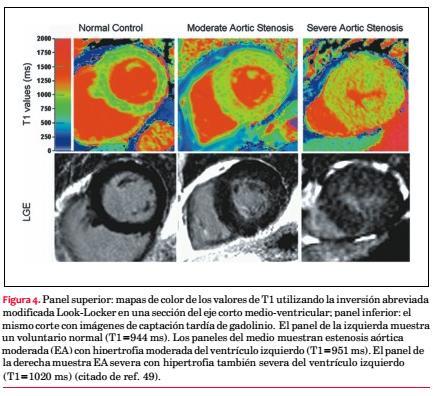
Por ende, si bien es útil, la CMR con realce tardío con gadolinio lleva mucho tiempo, requiere un procesamiento complejo y no se la puede utilizar en pacientes con daño renal severo(46). Los valores miocárdicos en T1 cambian con la composición tisular(47). Bull y colaboradores(48) hallaron que el mapeo con CMR t1 sin contraste podría identificar la fibrosis miocárdica en los pacientes con EA (figura 4). Mostraron una correlación significativa entre los valores de T1 y la fibrosis según la biopsia. Este método podría aplicarse como una valoración sencilla, no invasiva y sin contraste de la fibrosis miocárdica difusa en otras patologías cardíacas.
Bibliografía
1.
2. Cho GY, Marwick TH, Kim HS, et al. Global 2-dimensional strain as a new prognosticator in patients with heart failure. J Am Coll Cardiol 2009;54: 618–24.
3. Ersbøll M, Valeur N, Mogensen UM, et al. Prediction of all-cause mortality and heart failure admissions from global left ventricular longitudinal strain in patients with acute myocardial infarction and preserved left ventricular ejection fraction. J Am Coll Cardiol 2013;61:2365–73.
4. Wang TJ, Larson MG, Levy D, et al. Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart Study. Circulation 2003;107: 2920–5.
5. Jang SJ, Kim MS, Park HJ, et al. Impact of heart failure with normal ejection fraction on the occurrence of ischaemic stroke in patients with atrial fibrillation. Heart 2013;99:17–21.
6. Zakeri R, Borlaug BA, McNuty SE, et al. Impact of atrial fibrillation on exercise capacity in heart failure with preserved ejection fraction. A RELAX trial ancillary study. Circ Heart Fail 2014;7:123–30.
7. Su HM, Lin TH, Hsu PC, et al. Global left ventricular longitudinal systolic strain as a major predictor of cardiovascular events in patients with atrial fibrillation. Heart 2013;99:1588–96.
8. Kusunose K, Yamada H, Nishio S, et al. Index-beat assessment of left ventricular systolic and diastolic function during atrialfibrillation using myocardial strain and strain rate. J Am Soc Echocardiogr 2012;25:953–9.
10. Lang RM, Bierig M, Devereux RB, et al. Recommendations for chamber quantification: a report from the American Society of Echocardiography’s Guidelines and Standards Committee and the Chamber Quantification Writing Group, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiology. J Am Soc Echocardiogr 2005;18:1440–63.
11. Mor-Avi V, Lang RM, Badano LP, et al. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics: ASE/EAE consensus statement on methodology and indications. Endorsed by the Japanese Society of Echocardiography. J Am Soc Echocardiogr 2011;24: 277–313.
12. Sun JP, Stewart WJ, Yang XS, et al. Differentiation of hypertrophic cardiomyopathy and cardiac amyloidosis from other causes of ventricular wall thickening by two-dimensional strain imaging echocardiography. Am J Cardiol 2009;103:411–15.
13. Guan J, Mishra S, Falk RH, et al. Current perspectives on cardiac amyloidosis. Am J Physiol Heart Circ Physiol 2012;302:H544–52.
14. Phelan D, Collier P, Thavendiranathan P, et al. Relative apical sparing of longitudinal strain using two-dimensional speckle-tracking echocardiography in both sensitive and specific for the diagnosis of cardiac amyloidosis. Heart 2012;98:1442–8.
15. Bellavia D, Pellikka PA, Abraham TP, et al. Evidence of impaired left ventricular systolic function by Doppler myocardial imaging in patients with systemic amyloidosis and no evidence of cardiac involvement by standard two-dimensional and Doppler echocardiography. Am J Cardiol 2008;101:1039–45.
16. Koyama J, Falk RH. Prognostic significance of strain Doppler imaging in light-chain amyloidosis. JACC Cardiovasc Imaging 2010;3:333–42.
17. Min JK, Castellanos J, Siegel R. New frontiers in CT angiography: physiologic assessment of coronary artery disease by multidetector CT. Heart 2013;99: 661–8.
18. Budoff MJ, Dowe D, Jollis JG, et al. Diagnostic performance of 64-multidetector row coronary computed tomographic angiography for evaluation of coronary artery stenosis in individuals without known coronary artery disease: results from the prospective multicenter ACCURACY (Assessment by Coronary Computed Tomographic Angiogaphy of Individuals Undergoing Invasive Coronary Angiography) trial. J Am Coll Cardiol 2008;52:1724–32.
19. Meijboom WB, Meijs MF, Schuijf JD, et al. Diagnostic accuracy of 64-slice computed tomography coronary angiography: a prospective, multicenter, multivendor study. J Am Coll Cardiol 2008;52:2135–44.
20. Miller JM, Rochitte CE, Dewey M, et al. Diagnostic performance of coronary angiography by 64-row CT. N Engl J Med 2008;359:2324–36.
21. Kim KJ, Choi SI, Lee MS, et al. The prevalence and characteristics of coronary atherosclerosis in asymptomatic subjects classified as low risk based on traditional risk stratification algorithm: assessment with coronary CT angiography. Heart 2013;99 :1113–17.
22. Panel NCEPE. Third report of the National Cholesterol Education Program (NCEP) expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (Adult Treatment Panel III)final report. Circulation 2002;106:3143–421.
23. Aldrovandi A, Maffei E, Palumbo A, et al. Prognostic value of computed tomography coronary angiography in patients with suspected coronary artery disease: a 24-month follow-up study. Eur Radiol 2009;19:1653–60.
24. Hadamitzky M, Freissmuth B, Meyer T, et al. Prognostic value of coronary computed tomographic angiography for prediction of cardiac events in patients with suspected coronary artery disease. JACC Cardiovasc Imaging 2009;2:404–11.
25. Yiu KH, de Gaaf FR, Schuijf JD, et al. Age- and gender-specific differences in the prognostic value of CT coronary angiography. Heart 2012;98:232–7.
26. Bezerra HG, Costa MA, Guagliumi G, et al. Intracoronary optical coherence tomography: a comprehensive review. Clinical and research applications. J Am Coll Cardiol Intv 2009;2:1035–46.
27. Uemura S, Ishigami KI, Soeda T, et al. Thin-cap fibroatheroma and microchannel findings in optical coherence tomography correlate with subsequent progression of coronary atheromatous plaques. Eur Heart J 2012;33:78–85.
28. Moreno PR, Purushothaman KR, Fuster V, et al. Plaque neovascularization is increased in ruptured atherosclerotic lesions of human aorta: implications for plaque vulnerability. Circulation 2004;110:2032–8.
29. Tian J, Hou J, Xing L, et al. Significance of intraplaque neovascularization for vulnerability: optical coherence tomography study. Heart 2012;98:1504–9.
30. Virmani R, Kolodgie FD, Burke AP, et al. Atherosclerotic plaque progression and vulnerability to rupture: angiogenesis as a source of intraplaque hemorrhage. Arterioscler Thormb Vasc Biol 2005;25: 2054–61.
32. Hachamovitch R, Rozanski A, Shaw LJ, et al. Impact of ischaemia and scar on the therapeutic benefit from myocardial revascularization vs. medical therapy among patients understanding stress-rest myocardial perfusion scintigraphy. Eur Heart J 2011;32:1012–24.
33. Miller TD, Hodge DO, Christian TF,et al. Effects of adjustment for referral bias on the sensitivity and specificity of single photon emission computed tomography for the diagnosis of coronary artery disease. Am J Med 2002;112:290–7.
34. George RT, Jerosch-Herold M, Silva C, et al. Quantification of myocardial perfusion using dynamic 64-detector computed tomography. Invest Radiol 2007;42:815–22.
35. Nakauchi Y, Iwanaga Y, Ikuta S, et al. Quantitative myocardial perfusion analysis using multi-row detector CT in acute myocardial infarction. Heart 2012;98:566–72.
36. Pijls NH, Fearon WF, Tonio PA, et al. Fractional flow reserve versus angiography for guiding percutaneous coronary intervention in patients with multivessel coronary artery disease: 2-year follow-up of the FAME (Fractional Flow Reserve Versus Angiography for Multivessel Evaluation) study. J Am Coll Cardiol 2010;56:177–84.
37. Greif M, von Ziegler F, Bamberg F, et al. CT stress perfusion imaging for detection of haemodynamically relevant coronary stenosis as defined by FFR. Heart 2013;99:1004–11.
38. Bamberg F, Klotz E, Flohr T, et al. Dynamic myocardial stress perfusion imaging using fast dual source CT with alternating table positions: initial experience. Eur Radiol 2010;20:1168–73.
39. Choi JH, Min JK, Labounty TM, et al. Intracoronary transluminal attenuation gradient in coronary CT angiography for determining coronary artery stenosis. JACC Cardiovasc Imaging 2011;4:1149–57.
40. Kim HJ, Vignon-Clementel IE, Coogan JS, et al. Patient-specific modeling of blood flow and pressure in human coronary arteries. Ann Biomed Eng 2010;38:3195–209.
41. Nakazato R, Park HB, Berman DS, et al. Noninvasive fractional flow reserve derived from computed tomography angiography for coronary lesions of intermediate stenosis severity. Results from the DeFACTO study. Circ Cardiovasc Imaging 2013;6:881–9.
42. Schaap J, de Groot JAH, Nieman K, et al. Hybrid myocardial perfusion SPECT/CT coronary angiography and invasive coronary angiography in patients with stable angina pectoris lead to similar treatment decisions. Heart 2013;99:188–94.
43. Brix G, Nekolla EA, Borowski M, et al. Radiation risk and protection of patients in clinical SPECT/CT. Eur J Nucl Med Mol Imaging 2014;41(suppl 1):S125–36.
44. Kwong RY, Farzaneh-Far A. Measuring myocardial scar by CMR. JACC Cardiovasc Imaging 2011;4:157–60.
45. Fairbairn TA, Steadman CD, Mather AN, et al. Assessment of valve haemodynamics, reverse ventricular remodeling and myocardial fibrosis following transcatheter aortic valve implantation compared to surgical aortic valve replacement: a cardiovascular magnetic resonance study.Heart2013;99:1185–91.
46. Mewton N, Liu CY, Croisille P, et al. Assessment of myocardial fibrosis with cardiovascular magnetic resonance. J Am Coll Cardiol 2011;57:891–903.
47. Messroghli DR, Niendorf T, Schultz-Menger J, et al. T1mapping in patients with acute myocardial infarction. J Cardiovasc Magn Reson 2003;5:353–9.
48. Bull S,
49.
50. Jacobson AE, Senior R, Cerqueira MD, et al. Myocardial iodin-123 meta-iodobenzylguanidine imaging and cardiac events in chronic heart failure. Results of the progressive ADMIRE-HF (AdreView myocardial imaging for risk evaluation in heart failure) study. J Am Coll Cardiol 2010;55:2212–21.
51. Nakata T, Nakajima K, Yamashina S, et al. A pooled analysis of multicenter cohort studies of I-123-mIBG cardiac sympathetic innervation imaging for assessment of long-term prognosis in chronic heart failure. JACC Cardiovasc Imaging 2013;6:772–84.