Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
Print version ISSN 0797-0048On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.31 no.1 Montevideo Apr. 2016
Actualización de técnicas
Ultrasonografía carotídea para detección de placas de ateroma y medición del espesor íntima-media; índice tobillo-brazo: evaluación no invasiva en la práctica clínica. Importancia clínica y análisis de las bases metodológicas para su evaluación
Dres. Yanina Zócalo, Daniel Bia
Depto. Fisiología. Facultad de Medicina. Universidad de la República.
Centro Universitario de Investigación, Innovación y Diagnóstico Arterial (CUiiDARTE). Universidad de la República. Montevideo, Uruguay.
Correspondencia: Dr. Yanina Zócalo. Depto. Fisiología, Facultad de Medicina, Universidad de la República. Avda. General Flores 2125, CP: 11800, Montevideo, Uruguay. Correo electrónico: yana@fmed.edu.uy.
Recibido Dic 15, 2015; aceptado Feb 22, 2016.
La aterosclerosis es una enfermedad inflamatoria crónica de origen multifactorial que comienza en la infancia y habitualmente progresa silenciosamente durante las primeras cuatro o cinco décadas de vida(1). La sintomatología asociada generalmente se evidencia cuando su progresión limita crónicamente el flujo sanguíneo hacia un tejido o cuando lo hace en forma aguda como resultado de un accidente de placa.
Básicamente, el proceso aterosclerótico se sustenta en dos procesos íntimamente relacionados: la distorsión del equilibrio ingreso/egreso de lípidos en la pared arterial, con su progresiva acumulación, y el establecimiento de inflamación parietal crónica. Otros factores esencialmente hemodinámicos, como los niveles de presión arterial (PA) elevada, contribuyen a determinar modificaciones (adaptaciones) intrínsecas en la constitución parietal arterial (por ejemplo, hiperplasia/hipertrofia).
Los procesos de acumulación de material, inflamación y remodelado determinan aumento del espesor de la pared arterial, que se distribuye de manera heterogénea en los diferentes territorios (con particular modificación del espesor íntima-media carotídeo (CIMT)). Además, también con presentación heterogénea, en algunos sitios específicos los referidos procesos conducen a la conformación de placas de ateroma. Estos cambios pueden determinar obstrucción de la luz arterial y/o aumento de la rigidez parietal. Una obstrucción determina caída de la PA sistólica (PAS) en lechos distales a la misma, mientras que el aumento de rigidez arterial asocia sobreamplificación de la PAS en las arterias más alejadas del corazón. Relacionar el nivel de PAS del tobillo y del brazo (índice tobillo-brazo (ABI)) permite determinar alteraciones funcionales asociadas con aterosclerosis.
El hallazgo de alteraciones parietales o funcionales asociadas a aterosclerosis, así como su grado y extensión (carga) son indicadores de riesgo cardiovasular (RCV)(2). Las guías actuales de la práctica clínica recomiendan determinar la existencia de placas de ateroma, CIMT y/o ABI en niños, adolescentes y adultos asintomáticos, y en ciertos estados patológicos. El objetivo de este artículo es brindar información útil para una adecuada interpretación de los resultados de estos estudios.
Aspectos claves a recordar
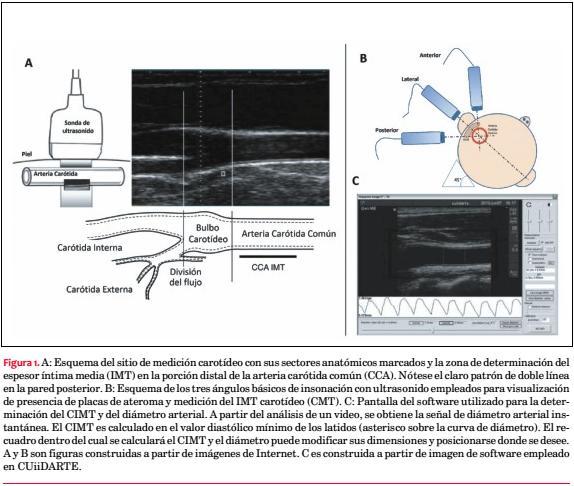
1. El espesor-íntima media (IMT, especialmente el carotídeo, CIMT) corresponde al espesor de la capa íntima y media arterial, las que con ecografía modo B (eco-MB) se ven como un patrón de doble línea. Clásicamente, su medición se realiza a partir de imágenes arteriales longitudinales (eco-MB) empleando softwares semiautomáticos de reconocimiento de bordes.
2. Ultrasonográficamente las placas de ateroma carotídeas se definen como estructuras intraparietales, anómalas, que: 1) invaden la luz arterial al menos 0,5 mm; 2) presentan ³50% de CIMT que la pared vecina, 3) tienen un IMT ³1,5 mm.
3. El índice tobillo-brazo (ABI) es el cociente entre la presión arterial sistólica (PAS) en el tobillo (o pie) y en el brazo, estando el paciente en posición horizontal. Se determina en reposo y posejercicio.
4. La existencia de: 1) placas de ateroma, 2) CIMT elevado y/o 3) ABI £0,9 o ³1,4 son predictores independientes de riesgo cardiovascular (RCV) y mortalidad cardiovascular (CV) (y de toda causa), y útiles para valorar daño de órgano blanco (por ejemplo, en hipertensión arterial) y reclasificación del RCV.
5. A diferencia de lo que ocurre para otros biomarcadores vasculares (por ejemplo, rigidez y reactividad arterial), las técnicas de medición para determinar placas carotídeas, CIMT y ABI han sido consensuadas, si bien se requiere mayor consenso sobre los protocolos de medición.
6. Niveles de referencia/normalidad de valores absolutos y tasas de cambio con la edad para CIMT y ABI en la población uruguaya, pediátrica, adolescente y adulta se han definido por CUiiDARTE.
Placas de ateroma y espesor íntima-media carotídeo: aspectos básicos, clínicos y epidemiológicos
¿Qué es el espesor íntima-media?
Utilizando eco-MB (sondas ³7 MHz) en proyecciones en que las arterias (carótida y aorta humanas) se visualizaban longitudinalmente se describió que en cada pared arterial se veían dos líneas paralelas ecogénicas separadas por un espacio anecoico o hipoecoico(3) (figura 1). Ese patrón de doble línea(3), si bien se observaba en ambas paredes, se definía mejor y con mayor reproducibilidad en la pared posterior. Estudios anatómicos e histológicos evidenciaron que las líneas se correspondían con el cambio de impedancia en la interface luz-íntima y media-adventicia. Así, al espesor combinado de la expresión ecográfica de las capas íntima y media se le denominó espesor íntima-media (IMT del inglés, intima-media thickness). Su medición a partir de imágenes ecográficas representa adecuadamente los espesores reales determinados a partir de análisis anatómicos e histológicos(3,4).
¿La existencia de elevado espesor íntima-media carotídeo define la presencia de aterosclerosis?
Esquemáticamente el aumento de CIMT tiene dos formas de presentación: a) compromiso arterial difuso o b) aumento focal con un sector parietal específico con mayor espesor que los vecinos. Las diferentes presentaciones representarían diferentes fenotipos de alteraciones o respuestas parietales frente a agresores o cambios hemodinámicos.
Un aumento focal del CIMT por encima de determinado nivel (absoluto o relativo) puede denominarse placa de ateroma, y entonces considerarse sinónimo (a la vez que define la presencia) de aterosclerosis.
¿Cómo se define una placa de ateroma carotídea?
Considerando el Mannheim CIMT Consensus Report, a partir de imágenes ecográficas se define como placa de ateroma carotídea a una estructura que: 1) invade la luz arterial ³0,5 mm; 2) presenta ³50% más de CIMT que la pared vecina; 3) presenta un CIMT ³1,5 mm(6). Esa definición ha sido la considerada en diferentes estudios y guías clínicas(2,6-8).
¿Existen estados fisiológicos que impliquen la presencia de placas de ateroma?
No. La existencia de placas de ateroma define un estado patológico: aterosclerosis. Contrariamente, no observar placas no implica que la aterosclerosis no esté presente.
¿Cuáles son los determinantes de las variaciones fisiológicas (o patológicas) del CIMT?
Todo proceso que eleve el espesor de la capa íntima y/o media aumenta el IMT. Ese aumento (fisiológico o patológico) puede ser por: a) hiperplasia celular; b) hipertrofia celular; c) aumento de la matriz extracelular por aumento de componentes propios de la matriz o acumulación de otros materiales; d) migración y proliferación de células habitualmente no presentes en las capas íntima y media.
En otras ocasiones, los cambios en IMT resultan directamente de fenómenos patológicos que conllevan aumento de la permeabilidad vascular (disfunción y activación endotelial), reducción de la capacidad de reparación parietal, acumulación de material exógeno (por ejemplo, lípidos), proliferación y migración de células musculares lisas, como parte del proceso aterosclerótico. Encontrar niveles de CIMT por encima de los esperados (por ejemplo, para edad y sexo) en un contexto hemodinámico que no explique el aumento evidenciado, pueden ser considerados marcadores de un fenotipo vascular propio de la aterosclerosis, ya que el aumento se asocia al desarrollo o progresión de lesiones ateroscleróticas.
El IMT aumenta con la edad, a expensas principalmente de la capa íntima(11), con un incremento promedio de tres veces entre el inicio de la tercera y décima década de vida(2). Además, el IMT se asocia positivamente con el tamaño de las estructuras cardiovasculares y corporales. Así, las diferencias corporales entre hombres y mujeres contribuyen a las diferencias en IMT entre sexos.
¿Cuál es el valor relativo de los factores de riesgo en la variación interindividual del CIMT?
Entre los FRCV tradicionales la edad y el sexo son los principales determinantes del nivel de CIMT; explicando ~10% de la variación interindividual del CIMT (en hispanos). Otros FRCV (hipertensión arterial, diabetes, dislipemia y tabaquismo) determinan conjuntamente <50% de la variación de la carga de placa aterosclerótica y solo ~11% de la variación interindividual del CIMT(12). Recientemente el estudio ELSA (Brasil) reportó que los FRCV tradicionales explican entre el 14,1% y 37,3% de la variación interindividual del CIMT(13). Cabe señalar que es controversial el rol que los niveles de colesterol plasmático tienen en la determinación de la variación interindividual del CIMT, existiendo trabajos que no encuentran asociación entre colesterol y CIMT. FRCV no tradicionales (por ejemplo, homocisteína, adiponectina, proteína C-reactiva, interleuquina-6) explican ~5% de las variaciones del CIMT(12). Otros factores (por ejemplo, depresión, ansiedad), que explicarían la variabilidad del CIMT, lo hacen por su asociación con FRCV tradicionales(14).
Las tasas de progresión del CIMT están asociadas a la exposición a FRCV tradicionales y a características étnicas (menor tasa de progresión en hispanos y asiáticos que en afroamericanos y caucásicos)(17).
Estos resultados apoyan la idea de que el CIMT no debería considerarse un biomarcador para la medición directa del grado de evolución de la aterosclerosis(10). Como fuera mencionado, el CIMT podría indicar el cambio (adaptativo) del sistema arterial durante el envejecimiento frente a modificaciones humorales, biomecánicas y hemodinámicas. Aun en este contexto de que los FRCV darían cuenta de un porcentaje menor del CIMT y su variación, el control de FRCV es el mecanismo principal por el que el nivel de CIMT puede modularse preventivamente.
¿Qué otros factores (no vasculares) determinan la variación interindividual del CIMT?
La variabilidad del CIMT puede atribuirse a diversos factores no vasculares. Entre ellos, características: a) del sujeto (por ejemplo, ecogenicidad tisular, anatomía del cuello); b) del sistema de medición (por ejemplo, frecuencia de muestreo, ganancias); c) del registro/técnico (por ejemplo, pared analizada, ángulos analizados), y d) del sistema de análisis y cálculo (por ejemplo, medición manual versus semiautomática, momento del ciclo arterial analizado).
¿Puede ser el CIMT modulado terapéuticamente? ¿Tiene esto implicancia pronóstica?
Los niveles y progresión del CIMT pueden modularse. En el estudio MARS (pacientes con enfermedad coronaria) la tasa anual de aumento de CIMT se redujo 0,065, 0,033 y 0,028 mm/año tras reducir: a) índice de masa corporal (reducir 5 kg/m2); b) ingesta de colesterol (reducir 100 mg/día), y c) tabaquismo (reducir 10 cigarrillos/día). En conjunto, el cambios en estilo de vida redujo el CIMT (respecto del esperado) en 0,13 mm/año, alcanzando una tasa de progresión similar al nivel mayor observado en sujetos control (placebo)(17). Igualmente, programas de prevención (por ejemplo, elevar la proporción de fibras en la comida y la actividad física) en niños y jóvenes mostraron reducir el CIMT y su tasa de aumento(18,19).
Las evidencias de que el CIMT puede ser modulado llevó a que se utilice en diversos estudios para monitorizar la eficacia terapéutica en pacientes con FRCV y aterosclerosis(20,21). La información resultante ha sido contradictoria, no estando claro aún si la reducción del CIMT o de su tasa de progresión per se asocian mejoría CV o menor tasa de eventos(22).
¿Qué utilidad clínica tiene determinar el CIMT?
A pesar de controversias que consideraremos, determinar el CIMT por parte de técnicos capacitados y experimentados es útil para: a) determinar el RCV individual (de enfermedad coronaria y evento); b) valorar daño de órgano blanco; c) reclasificar el RCV(23-25). Específicamente, a la fecha los estudios destinados a evaluar la asociación entre CIMT y RCV, y que realizaron abordajes que permiten analizar de forma independiente el riesgo asociado a CIMT, mostraron que el CIMT(2,6,12,22,26-29):
· se asocia a la presencia de FRCV;
· se asocia a riesgo de infarto agudo de miocardio (IAM), accidente cerebrovascular (ACV), muerte por enfermedad coronaria, y su combinación con independencia de otros FRCV;
· predice presencia de placas de ateroma carotídeas, coronarias y del arco aórtico, con independencia de otros FRCV; no predice aparición de nuevas placas;
· se asocia con la severidad y el grado de la aterosclerosis coronaria (evaluada por angiografía);
· aporta información adicional a la brindada por FRCV tradicionales, siendo útil para la reclasificación del RCV de enfermedad coronaria, incrementando (modestamente) el área bajo la curva para predecir eventos CV.
El rol predictivo de eventos CV alcanza su máxima potencia para sujetos de ~40-75 años(2), si bien su utilidad se demostró para un amplio rango de edades (incluyendo niños, adolescentes y jóvenes).
¿Existen discrepancias sobre el rol clínico del CIMT?
Sí. Existe acuerdo en que el CIMT se asocia con el RCV individual, pero se discute su valor agregado. Hay autores que consideran que el CIMT tiene valor por encima de los FRCV tradicionales en la determinación del RCV individual. Otros autores reconocen un aporte significativo, pero por ser de baja entidad y aportar baja tasa de reclasificación neta, no creen que deba recomendarse su utilización con esos fines(30,31). Las tasas de reclasificación usando CIMT se encuentran entre 0 y ~25%, según la bibliografía consultada(32).
¿Qué utilidad clínica tiene determinar la presencia (y características) de placas carotídeas?
De manera independiente a otros FRCV, la presencia de placa carotídea(2,22,37):
· se asocia a la presencia de múltiples FRCV;
· se asocia (valor predictivo) con riesgo de IAM, morbimortalidad coronaria y ACV, en forma independiente a otros FRCV;
· predice, en forma independiente, presencia de placas coronarias;
· aporta información adicional a la brindada por los FRCV, siendo útil en reclasificación del RCV, incrementando el área bajo la curva para predecir eventos CV. El estudio ARIC mostró reclasificación correcta de 9,9% de la población general cuando se añadió la información de presencia de placa;
· predice la mortalidad por causa CV y de toda causa.
Determinar dicotómicamente la existencia de placas y características cuantitativas relacionadas con ellas (por ejemplo, número, área y volumen de placas) tiene valor predictivo de eventos CV(38). La ecogenicidad de la placa y características intraplaca (análisis de niveles de grises) correlacionan con el RCV y proporcionarían información predictiva adicional(38-40). Actualmente se tiene una gran expectativa en que métodos de análisis ecográficos en tres dimensiones incrementen la capacidad predictiva de los estudios de imagen carotídeos(41).
¿Aporta información adicional la existencia conjunta de CIMT elevado y placas carotídeas?
Sí. Tener placas de ateroma y elevado CIMT supone una condición menos favorable en términos de RCV que tener solo una de estas condiciones(42). Con un seguimiento promedio de 15 años a personas saludables (n=13.135, edad inicial: 45-64 años), el estudio ARIC concluyó que el mejor modelo predictivo de riesgo de eventos debería considerar: (1) FRCV tradicionales; (2) CIMT, y (3) presencia de placas de ateroma(37). Otros estudios (en más de 54.000 personas) mostraron que la consideración de la existencia (o no) de placas mejoraba la predicción de riesgo que aportaba la medición del CIMT(43).
¿En quiénes se recomienda evaluar la existencia de placas carotídeas y elevado CIMT?
Las principales guías internacionales de la práctica clínica definen los sujetos que podrían beneficiarse de estudios de detección de alteraciones vasculares subclínicas e individualización de estimación de RCV. Con algunas diferencias entre las guías revisadas, la ultrasonografía carotídea sería útil en(2,23,24,44):
· sujetos sin historia de enfermedad CV o diabetes, y con RCV global intermedio (tablas de riesgo);
· sujetos con antecedentes familiares de enfermedad CV precoz;
· <60 años con alteraciones severas en un único FRCV, que de otra manera no serían candidatos a terapéutica farmacológica;
· mujeres <60 años con dos o más FRCV. Las tablas de riesgo más utilizadas predicen adecuadamente el riesgo a diez años, pero no el riesgo que para la exposición a FRCV considerada existirá en el tiempo de vida de la persona. Las mujeres desarrollan enfermedad CV a edades mayores que los hombres y aun mujeres con alteraciones vasculares subclínicas tienden a clasificarse como de menor riesgo que el real si se consideran únicamente las tablas de riesgo;
· dudas acerca de la intensidad que debe implementarse en la terapéutica preventiva;
· valoración del RCV de una persona en particular (determinación individualizada del riesgo).
Al igual que otros estudios, no existiría razón para realizar estos en forma generalizada en sujetos en quienes se tiene conocimiento de la existencia y extensión de la enfermedad aterosclerótica, o en quienes la información que podría obtenerse no cambiaría la terapéutica.
No hay evidencia suficiente que indique que la determinación del CIMT es útil para valorar la evolución o terapéutica, por lo que mediciones seriadas de CIMT no son especialmente recomendadas.
Siguiendo recomendaciones de la AHA (American Heart Association), debería medirse el CIMT en niños con(45-47): 1) hipercolesterolemia familiar, 2) hipertensión arterial, 3) obesidad, 4) diabetes mellitus, 5) síndrome metabólico, 6) enfermedad de Kawasaki, 7) trasplante de órganos sólidos, 8) enfermedad renal crónica, 9) enfermedades inflamatorias crónicas, 10) niños que recibieron tratamiento para cáncer y (11) niños con bajo peso al nacer (para la edad gestacional).
Placas de ateroma carotídeas y CIMT: aspectos técnicos y metodológicos
Los principales documentos que han guiado los aspectos metodológicos para detección de placas y medición del CIMT son: Mannheim consensus (publicado en 2004; actualizado en 2006 y 2011)(6,22), el consenso de la American Society of Echocardiography(2) y las recomendaciones para estudios en niños de la Asociación Europea de Cardiología Pediátrica(45).
Los documentos definen aspectos que deben ser sistematizados y concuerdan en que la definición de algunos criterios (por ejemplo, sitio de medición del CIMT) puede depender del protocolo de medición, tiempo de registro y preguntas a responder de cada laboratorio vascular no invasivo. Los criterios mencionados a continuación surgen de los siguientes documentos y de la experiencia de nuestro grupo(48).
Determinación de placas de ateroma y determinación del CIMT: criterios generales
· Todo estudio ultrasonográfico para determina el CIMT debe incluir la detección de placas en carótidas extracraneales.
· El estudio debe informarse como estudio ultrasonográfico carotídeo para determinación del RCV, y no sustituye a la ecografía dúplex indicada con otros fines (por ejemplo, valoración preoperatoria).
· Todo hallazgo que requiera posterior evaluación debe informarse (por ejemplo, estenosis sigificativa, masas tiroideas).
Preparación del paciente y técnico en ultrasonografía
· Tiempo/Protocolo: Debe destinarse el tiempo necesario, siguiendo un protocolo claro, buscando siempre alternativas apropiadas a cada caso. Deben evitarse apresuramientos o suposiciones basadas en la experiencia. Lo informado debe haberse visto/medido.
· Postura del paciente/Técnico: Deben estar cómodos. El paciente debe estar acostado, con la cabeza apoyada y rotada en dirección opuesta al hemicuerpo estudiado, con el cuello levemente hiperextendido. Distintas posiciones y movimientos de cabeza pueden necesitarse para optimizar la obtención de imágenes.
· Preparación: No se requiere preparación previa. Los 5-10 minutos de reposo antes de la medición tienen por objetivo estabilizar la frecuencia cardíaca y PA, y así facilitar la medida del CIMT.
Instrumentación y obtención de imágenes
· Calidad de imágenes: La calidad de las imágenes es el principal factor no biológico asociado a variaciones en CIMT y depende en gran medida de la formación y experiencia del técnico.
· Sondas/Frecuencia: Debe usarse un sistema validado y un transductor lineal con frecuencia fundamental (central) ³ 7 MHz (en niños pueden ser necesarias frecuencias ³10-15 MHz). Sondas de menor frecuencia aumentan artificialmente el CIMT. No se debe usar medios de contraste.
· Profundidad/Resolución: Las carótidas de adultos y de niños pueden escanearse con profundidad estándar 3,8 - 4,0 cm y 1,8 - 2,0 cm, respectivamente. Cuellos gruesos o arterias muy profundas pueden requerir mayor profundidad. En nuestro caso (CUiiDARTE), para una profundidad de 3,8 y 2,0 cm, se alcanzan (para imágenes crudas, previo al análisis subpixelar) resoluciones de 120 pixeles/cm (0,08 mm/pixel) y 160 pixeles/cm (0,06 mm/pixel), respectivamente. Emplear software de análisis de imágenes permite alcanzar definición subpixelar, elevando aún más la resolución y exactitud en la medida del CIMT.
· Modalidad ecográfica/Múltiples mediciones: Dado que el espesor parietal no es uniforme se debe valorar el CIMT en un punto, no solo es difícil de reproducir sino que puede no ser representativo del CIMT arterial. Por ello, se recomienda medir el CIMT a partir de imágenes de eco-MB (a pesar de la mayor resolución temporal del modo M). El CIMT reportado debe ser el promedio de múltiples mediciones en un segmento de 10 mm de largo, y de haber realizado análisis subpixelar.
· Imágenes digitizadas: Se recomienda emplear (y almacenar) imágenes digitalizadas para análisis on-line/off-line, almacenándolas directamente desde el sistema de ultrasonido (más que capturando videos a partir de dichas imágenes). Se recomienda el empleo de sistemas (por ejemplo, DICOM) que mantengan la organización y calibración de las imágenes.
Protocolo de escaneo (inspección) arterial
· Visualización transversal/longitudinal eco-MB: El estudio se inicia por escaneo transversal seguido de longitudinal, de la carótida común, bulbo y carótidas interna y externa, desde porciones proximales a distales. Las arterias deben visualizarse en diferentes ángulos (figura 1), observando pared posterior, anterior, y laterales. El Doppler color contribuye a definir la permeabilidad e interfaces sangre-pared.
· Placas/artefactos en inicio de bulbo: Sitios donde el diámetro arterial cambia abruptamente (por ejemplo, inicio del bulbo) suelen mostrar (dado que el ultrasonido no incide de manera perpendicular) falsa apariencia de aumento abrupto de CIMT o placa aterosclerótica. Así, especial atención debe tenerse para definir espesamientos en regiones transicionales.
· Detección de placa: Al verse una estructura compatible con una placa debe comprobarse si cumple los criterios de definición. Definida la placa (como mínimo) debe consignarse: su existencia, ubicación, principales características geométricas y de superficie, y significado hemodinámico. Si bien la vulnerabilidad y riesgo-asociado a una placa dependen de su geometría y composición, no hay consensos que establezcan el nivel de riesgo según estas características.
Protocolo de obtención y análisis de imágenes para determinar el CIMT
· Imágenes para CIMT: Se debe obtener una secuencia de imágenes de la carótida común distal y el bulbo carotídeo con el patrón de doble línea bien definido. Se debe medir el CIMT bilateralmente en la carótida común distal (cm proximal al bulbo) en un segmento de longitud no menor de 10 mm. La pared anterior no siempre se visualiza bien (por razones de la técnica ultrasonográfica), por lo que se recomienda medir el CIMT en la pared posterior; este aspecto es aún un tema no agotado. Si hay placas en la región de medición del CIMT, deben incluirse en su determinación.
· CIMT y ciclo arterial: Se recomienda determinar el CIMT en el momento de menor diámetro diastólico, utilizando como indicador de tiempo el registro de una derivación del electrocardiograma o la propia señal de diámetro determinada simultáneamente al CIMT (figura 1).
· Software semiautomatizado, CIMT promedio: Se recomienda emplear softwares específicos de detección de bordes, actualmente incluidos en los paquetes de análisis de los ecógrafos (figura 1). Emplear software aumenta la reproducibilidad, acorta tiempos de medición y reduce la operador-dependencia del CIMT. Siempre la determinación del CIMT con software debe supervisarse mediante inspección visual, con eventual corrección de mediciones. Las dos medidas más usadas de CIMT son el promedio (a) de mediciones semiautomáticas a lo largo de un centímetro arterial (lo más recomendado) y (b) del máximo CIMT obtenido en determinaciones consecutivas en el segmento arterial.
· Carótida interna y bulbo: Si bien el IMT obtenido en carótida interna y bulbo tiene elevado valor predictivo, su uso es limitado, ya que el porcentaje de sujetos en los que no puede medirse en estos sitios es elevado (comparado con las mediciones en carótida común: 51,4% versus 9% en el estudio ARIC y 69% versus 4% en el Rotterdam.
CIMT: valores de referencia
Se han publicado valores de referencia de CIMT para diferentes poblaciones de niños, adolescentes y adultos. Comparar el valor de CIMT de un paciente con el de la población de referencia sería útil en la definición del RCV(2): 1) CIMT ³percentil 75: indicador de RCV elevado; (2) CIMT entre percentiles 25-75: RCV promedio (normal), y (3) CIMT <percentil 25, asocia bajo RCV. La Asociación Europea de Cardiología Pediátrica recomienda utilizar el percentil 75 como punto de corte para definir normalidad(45). En CUiiDARTE se cuenta con tablas de CIMT para población de referencia uruguaya. La Sociedad Europea de Cardiología recomienda que un valor ³0,9 mm se considere indicador de daño de órgano blanco y RCV elevado(25).
Índice tobillo-brazo: aspectos básicos, clínicos y epidemiológicos
¿Qué es el índice tobillo-brazo (ABI)?
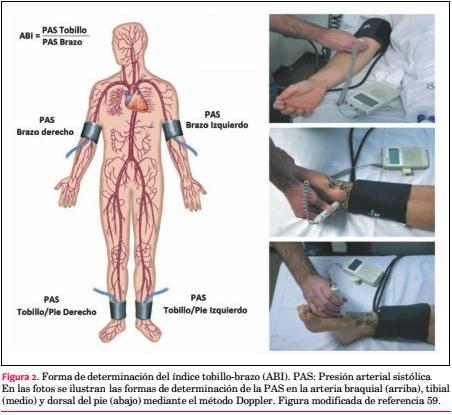
Descrito en 1950, el índice tobillo-brazo (ankle-brachial index, ABI) es el cociente entre la PAS medida en el tobillo y en el brazo(49)(figura 2)(59). Se designa en la literatura de diversas formas: ankle-brachial index, ankle-arm index, ankle-brachial blood pressure index, ankle-arm ratio, o incluso haciendo Winsor index, por el apellido de su creador.
-Amplificación centro-periferia del pulso: La onda de PA generada por la eyección ventricular se modifica progresivamente al propagarse hacia la periferia. En decúbito, la PA media (PAM) y diastólica mínima (PAD) varían poco entre arterias centrales y periféricas, mientras que la PAS y presión de pulso (PP) aumentan hacia la periferia (amplificación de la PAS o PP). Las teorías propuestas para explicar la amplificación periférica del pulso han sido analizadas en un artículo de esta serie(50). Consecuentemente, estando el individuo en posición horizontal, la PAS en arterias del tobillo se espera sea mayor que en la arteria del brazo, y por lo tanto que el cociente PAS tobillo/PAS brazo sea >1. Obstrucciones del flujo sanguíneo hacia miembros inferiores determinan la caída relativa de la PAS del tobillo respecto de la braquial, y así, la reducción del ABI. Contrariamente, aumento de rigidez arterial en aorta o miembros inferiores determina aumento relativo de la PAS del tobillo respecto de la braquial, y aumento del ABI.
-Edad/Etnia/Genética. Se espera un aumento “fisiológico” del ABI con la edad, por mayor incremento relativo de la rigidez arterial de miembros inferiores respecto de los superiores. Sin embargo, dado que la prevalencia de enfermedad arterial periférica (EAP) aumenta con la edad, en la población general (aún asintomática) el ABI se reduce “no fisiológicamente” al envejecer (por ejemplo, 0,025/5 años)(51). En bebés (menores de 24 meses), el ABI puede ser <1. La bipedestación y el caminar asociarían desarrollo muscular y cambios hemodinámicos y arteriales (aumento de rigidez) en miembros inferiores, que generarían elevación de la PAS del tobillo y así del ABI(51). Menores ABI se reportaron en afrodescendientes que en población blanca. Al igual que para CIMT, ~48% de la variabilidad del ABI se explica por factores genéticos(51).
-Altura corporal/Sexo/Frecuencia cardíaca. Si bien a mayor altura cabría esperar mayor ABI (mayor distancia para amplificación centro-periférica de la PAS)(51,52), en términos absolutos dicho efecto es reducido (por ejemplo, 0,01/20 cm de altura)(52). Tras normalizar por altura y exposición a FRCV se demostró que el ABI es menor en mujeres que en hombres (por ejemplo, 0,02 unidades menos)(52). En teoría, al elevarse la frecuencia cardíaca cabría esperar caída de la PAS, que por ser en términos relativos mayor en el tobillo (arribo de ondas reflejadas se “corre” a la fase diastólica) que a nivel braquial, determinaría reducción del ABI(50). Sin embargo, aun los estudios que encuentran esta asociación reportan variaciones poco (o nada) significativas.
¿Qué otros factores (no vasculares) determinan la variación interindividual del ABI?
Diferencias metodológicas contribuyen a explicar sus variaciones. Como ejemplo, diferencias en la posición del paciente, tamaño y ubicación de brazaletes, mediciones unilaterales versus bilaterales, método de registro (Doppler, pletismografía, oscilometría), orden de medición en los miembros, registro pre o posestabilización hemodinámica(51).
¿Qué utilidad clínica tiene determinar el ABI?
Propuesto inicialmente como herramienta para diagnóstico de EAP de miembros inferiores(53,54), actualmente su utilidad es mayor(51,55):
· Marcador de existencia (diagnóstico) y progresión de EAP, y de deterioro funcional: Si existe sospecha clínica de EAP, el ABI es útil como primer test diagnóstico(51). ABI £0,9 se considera umbral diagnóstico de EAP. Al progresar la EAP, el ABI se reduce paulatinamente a una tasa mayor que la de la población general (por ejemplo, 0,06 versus 0,025 unidades/5 años)(51). Tasa de reducción de ABI >0,15/3-5 años indica progresión de la EAP y elevada probabilidad de requerir revascularización. ABI <0,5 y/o PAS en tobillo <50 mmHg asocia riesgo elevado de amputación. Los pacientes con EAP reducen voluntariamente la actividad física, lo que dificulta la objetivación del deterioro funcional EAP asociado. En personas con y sin EAP, menor ABI asocia mayor o más rápido deterioro funcional (aun con ABI en límite inferior de normalidad)(51).
· Marcador de riesgo y aterosclerosis en sujetos con y sin enfermedad CV: El ABI es indicador del nivel de aterosclerosis sistémica y se asocia a presencia de FRCV. ABI reducido se asocia a enfermedad coronaria y cerebrovascular y a riesgo de IAM, ACV, y mortalidad CV y de toda causa(51). En pacientes con enfermedad CV establecida, menor ABI implica mayor RCV, con independencia de otros FRCV. De existir ABI en reposo normal, un ABI anormal posejercicio se asocia a mayor mortalidad. Se ha sugerido incluir el ABI en scores de RCV(55). Para cada nivel de RCV global definido por score de Framingham (a diez años, ajustado por edad), un ABI <0,90 asoció duplicación del RCV.
· Marcador útil en primer nivel de atención: Siendo un marcador de aterosclerosis de bajo costo, elevada sensibilidad y especificidad, alta disponibilidad y relativa fácil y rápida determinación, se lo considera entre los más útiles para valorar RCV en atención primaria(56).
¿Existen estados circulatorios asociados a aumento de ABI?
Aumentos de la PAS en el tobillo pueden determinar ABI por encima del rango normal. Esto principalmente se asocia a incremento en rigidez arterial, siendo relativamente frecuente en arterias calcificadas (por ejemplo, insuficiencia renal crónica). Si bien en pacientes con arterias calcificadas frecuentemente coexiste patología obstructiva (por ejemplo, 60%-80%), en estos casos el ABI no puede usarse para diagnóstico, ya que incluso puede tener niveles “normales”(51).
¿En quiénes se recomienda evaluar el ABI?
En general, en las mismas personas y condiciones en que se recomienda detección de placas de ateroma y medición del CIMT(51). Ver dicho apartado. Además, para screening o en quien se sospeche EAP.
¿Qué utilidad tiene medir el ABI antes o después de realizar ejercicio físico?
La sensibilidad del ABI aumenta al medirse posejercicio con miembros inferiores (por ejemplo, cinta ergométrica o flexiones pedio-plantares activas)(51). Estos ejercicios asocian aumento de PA en arterias centrales y de miembros superiores, y caída en miembros inferiores, lo que genera reducción del ABI (~5%) respecto del reposo. La recuperación es rápida (60-120 segundos posejercicio).
Cuando hay EAP obstructiva proximal (región aorto-ilíaca-femoral), el ejercicio asocia mayor caída de la PA en tobillo, y así mayor caída del ABI (~20%). Si la PAS del tobillo cae posejercicio >30 mmHg, se sospecha EAP. Además, la normalización posejercicio del ABI es más lenta cuanto más severa es la EAP. La recuperación de ³90% de nivel de reposo en los primeros tres minutos posejercicio tiene una especificidad de ~95% para descartar EAP(51). Evaluar el ABI posejercicio contribuye con la definición diagnóstica de personas con ABI en reposo entre 0,9 y 1,0. Alteraciones del ABI posejercicio, incluso con ABI de reposo anormal, se asocia a necesidad de revascularización futura y es indicador pronóstico de morbimortalidad CV(57).
Índice tobillo-brazo: aspectos técnicos y metodológicos
Preparación del paciente, instrumentación y tipos de registro
· Debe estar acostado horizontalmente con los miembros apoyados y realizar reposo ³10 minutos previo a la medición. Diferentes posiciones (por ejemplo, sentado, miembros no apoyados) y la falta de reposo afectan el valor de PAS.
· Otros métodos para medir el ABI, de limitada utilización, incluyen: pletismografía, fotopletismografía, método auscultatorio y palpatorio.
Protocolo de medición y análisis
· Validación del ABI obtenido: Los registros deben realizarse secuencialmente, comenzando por un miembro superior, siguiendo por los inferiores y finalizando en el miembro superior restante. La secuencia de registro puede repetirse para reducir la probabilidad del efecto de “bata blanca”. Si la diferencia de PAS entre miembros superiores o entre inferiores es >10 mmHg debe repetirse la secuencia. Si la diferencia de PAS entre brazos es >15 mmHg (validadas las mediciones) se debe sospechar estenosis subclavia (riesgo elevado de morbimortalidad CV)(51).
· Cálculo del ABI: Denominador: se aconseja utilizar la mayor PAS braquial, más que el promedio de ambos brazos. Numerador: puede usarse la PAS tibial posterior, dorsal del pie o el promedio de ambas, no existiendo diferencias significativas al variar el sitio de registro. Considerando la probabilidad pretest de EAP, se aconseja usar la mayor PAS. Usar el menor valor de PAS tibial resultó en una asociación más débil entre el EAP y FRCV, y entre EAP y aterosclerosis coronaria y carotídea(58). Debe calcularse el ABI para cada miembro inferior. Si el valor de ABI está entre 0,80-1,0 debe repetirse la medición antes del diagnóstico definitivo.
ABI: valores de referencia(51)
· ABI £0,9 se considera una referencia para el diagnóstico de EAP, si bien el ABI no debe considerarse marcador binario de EAP y se propone que el punto de corte se seleccione en función de la probabilidad pretest de EAP.
· ABI >0,9 en el contexto de sospecha clínica de EAP, sustenta la medición del ABI posejercicio o utilización de otros tests diagnósticos.
· ABI >1,40 en el contexto de sospecha clínica de EAP, sugiere la medición del índice dedo del pie-brazo o la utilización de otros tests.
· Sujetos con ABI £0,9 o ³1,40 deben considerarse de RCV elevado (para eventos y mortalidad CV), con independencia de la presencia de síntomas de EAP o FRCV(56); si bien el RCV ya aumenta cuando el ABI es <1,10.
Bibliografía
1. Zócalo Y, Arana M, Curcio S, García V, Giachetto G, Chiesa P, et al. Daño arterial subclínico en niños, adolescentes y jóvenes: Análisis de la asociación con factores de riesgo, con la aterosclerosis del adulto y de su reversibilidad mediante intervención temprana. Rev Urug Cardiol 2015;30(2):176-87.
2. Stein JH, Korcarz CE, Hurst RT, Lonn E, Kendall CB, Mohler ER, et al. Use of carotid ultrasound to identify subclinical vascular disease and evaluate cardiovascular disease risk: a consensus statement from the American Society of Echocardiography Carotid Intima-Media Thickness Task Force. J Am Soc Echocardiogr 2008;21(2):93-111.
3. Pignoli P, Tremoli E, Poli A, Oreste P, Paoletti R. Intimal plus medial thickness of the arterial wall: a direct measurement with ultrasound imaging. Circulation 1986;74(6):1399-406.
4. Persson J, Formgren J, Israelsson B, Berglund G. Ultrasound-determined intima-media thickness and atherosclerosis: direct and indirect validation. Arterioscler Thromb 1994;14(2):261-4.
5. Najjar SS, Scuteri A, Lakatta EG. Arterial aging: is it an immutable cardiovascular risk factor? Hypertension 2005;46(3):454-62.
6. Touboul PJ, Hennerici MG, Meairs S, Adams H, Amarenco P, Bornstein N, et al. Mannheim Carotid Intima-media Thickness Consensus (2004-2006): an update on behalf of the advisory board of the 3rd and 4th watching the risk symposium 13th and 15th European stroke conferences, Mannheim, Germany, 2004, and Brussels, Belgium, 2006. Cerebrovasc Dis 2007;23(1):75-80.
7. Perk J, De Backer G, Gohlke H, Graham I, Reiner Z, Verschuren WM, et al. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012): The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Atherosclerosis. 2012;223(1):1-68.
8. Roman M, Naqvi T, Gardin J, Gerhard-Herman M, Jaff M, Mohler E. Clinical application of noninvasive vascular ultrasound in cardiovascular risk stratification: a report from the American Society of Echocardiography and the Society of Vascular Medicine and Biology. J Am Soc Echocardiogr 2006;19(8): 943-54.
9. Bots ML, Hofman A,
10. Finn AV, Kolodgie FD, Virmani R. Correlation between carotid intimal/medial thickness and atherosclerosis. Atheroscler Thromb Vasc Biol. 2010; 30(2):177–81.
11. Li Z, Froehlich J, Galis ZS, Lakatta EG. Increased expression of matrix metalloproteinase-2 in the thickened intima of aged rats. Hypertension 1999;33(1):116-23.
12. Rundek T, Blanton SH, Bartels S, Dong C, Raval A, Demmer RT, et al. Traditional risk factors are not major contributors to the variance in carotid intima-media thickness. Stroke. 2013;44(8):2101-8.
13.
14. Ohira T, Diez Roux AV, Polak JF, Homma S, Iso H, Wasserman BA. Associations of anger, anxiety, and depressive symptoms with carotid arterial wall thickness: the multi-ethnic study of atherosclerosis. Psychosom Med. 2012;74(5):517–25.
15. Duggirala R, González Villalpando C, O’Leary DH, Stern MP, Blangero J. Genetic basis of variation in carotid artery wall thickness. Stroke. 1996;27(5):833–7.
16. Juo SH, Lin HF, Rundek T, Sabala EA, Boden-Albala B, Park N, et al. Genetic and environmental contributions to carotid intima-media thickness and obesity phenotypes in the Northern Manhattan Family Study. Stroke. 2004;35(10):2243-7.
17. Markus RA, Mack WJ, Azen SP, Hodis HN. Influence of lifestyle modification on atherosclerotic progression determined by ultrasonographic change in the common carotid intima-media thickness. Am J Clin Nutr. 1997;65(4):1000-4.
18. Meyer AA, Kundt G, Lenschow U, Schuff-Werner P, Kienast W. Improvement of early vascular changes and cardiovascular risk factors in obese children after a six-month exercise program, J Am Coll Cardiol 2006;48(9):1865-70.
19. Wu H, Dwyer KM, Fan Z, Shircore A, Fan J, Dwyer JH. Dietary fiber and progression of atherosclerosis: The
20. Costanzo P, Perrone-Filardi P, Vassallo E, Paolillo S, CesaranoP, Brevetti G, et al. Does carotid intima-media thickness regression predict reduction of cardiovascular events? A meta-analysis of 41 randomized trials, J Am Coll Cardiol 2010;56(24): 2006-20.
21. Kastelein JJ, Akdim F, Stroes ES, Zwinderman AH, Bots ML, Stalenhoef AF, et al. Simvastatin with or without ezetimibe in familial hypercholesterolemia. N Engl J Med 2008;358(14):1431-43.
22. Touboul PJ. Intima-media thickness of carotid arteries. Front Neurol Neurosci. 2015;36:31-9. doi: 10.1159/000366234. Epub 2014 Dec22.
23. National Cholesterol Education Program (NCEP) Expert Panel (ATP III). Third report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation 2002;106(25):3143-421.
24. Greenland P, Abrams J, Aurigemma GP, Bond MG, Clark LT, Criqui MH, et al. Prevention conference V: beyond secondary prevention, identifying the high-risk patient for primary prevention, noninvasive tests of atherosclerotic burden, writing group III. Circulation 2000;101(1):E16-22.
25. Practice guidelines for the management of arterial hypertension of the European Society of Hypertension (ESH) and the European Society of Cardiology (ESC): ESH/ESC Task Force for the Management of Arterial Hypertension. J Hypertens. 2013;31(10): 1925-38.
26. Granér M, Varpula M, Kahri J, Salonen RM, Nyyssönen K, Nieminen MS, et al. Association of carotid intima-media thickness with angiographic severity and extent of coronary artery disease. Am J Cardiol. 2006;97(5):624–9.
27. Chambless LE, Folsom AR, Sharrett AR, Sorlie P, Couper D, Szklo M, et al. Coronary heart disease risk prediction in the Atherosclerosis Risk in Communities (ARIC) study. J Clin Epidemiol 2003;56(9): 880-90.
28. Tessitore E, Rundek T, Jin Z, Homma S, Sacco RL, Di Tullio MR. Association between carotid intima-media thickness and aortic arch plaques. J Am Soc Echocardiogr 2010;23(7):772-7.
29. Kablak-Ziembicka A, Tracz W, Przewlocki T, Pieniazek P, Sokolowski A, Konieczynska M. Association of increased carotid intimamedia thickness with the extent of coronary artery disease. Heart. 2004;90(11):1286–90.
30. Bots ML, Groenewegen KA, Anderson TJ, Britton AR, Dekker JM, Engström G, et al. Common carotid intima-media thickness measurements do not improve cardiovascular risk prediction in individuals with elevated blood pressure: the USE-IMT collaboration. Hypertension. 2014;63(6):1173-81.
31. Den Ruijter HM, Peters SA, Anderson TJ, Britton AR, Dekker JM, Eijkemans MJ, et al. Common carotid intima-media thickness measurements in cardiovascular risk prediction: A meta-analysis. JAMA 2012;308(8):796–803.
32. Weber LA, Cheezum MK, Reese JM, Lane AB, Haley RD, Lutz MW, et al. Cardiovascular Imaging for the Primary Prevention of Atherosclerotic Cardiovascular Disease Events. Curr Cardiovasc Imaging Rep. 2015 Aug (cónsul tado 7 Mar 2016);8(9): (Aprox. 10p.). disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4534502
33. Polak JF, Pencina MJ, Pencina KM, O’Donnell CJ, Wolf PA, D’Agostino RB Sr. Carotid-wall intima-media thickness and cardiovascular events. N Engl J Med 2011;365(3):213-21.
34. Baldassarre D, Hamsten A, Veglia F, de Faire U, Humphries SE, Smit AJ, et al. Measurements of carotid intima-media thickness and of interadventitia common carotid diameter improve prediction of cardiovascular events: Results of the IMPROVE (Carotid Intima Media Thickness IMT) and IMT-Progression as Predictors of Vascular Events in a High Risk European Population) Study. J Am Coll Cardiol 2012;60(16):1489-99.
35. Baber U, Mehran R, Sartori S, Schoos MM, Sillesen H, Muntendam P, et al. Prevalence, impact, and predictive value of detecting subclinical coronary and carotid atherosclerosis in asymptomatic adults: The bioimage study. J Am Coll Cardiol 2015;65(11):1065–74.
36. Steinl DC, Kaufmann BA. Ultrasound imaging for risk assessment in atherosclerosis. Int J Mol Sci. 2015;16(5):9749-69.
37. Nambi V, Chambless L, Folsom AR, He M, Hu Y, Mosley T, et al. Carotid intima-media thickness and presence or absence of plaque improves prediction of coronary heart disease risk: the ARIC (Atherosclerosis Risk In Communities) study. J Am Coll Cardiol 2010;55(15):1600-7.
38. Mathiesen EB, Johnsen SH, Wilsgaard T, Bonaa KH, Lochen ML, Njolstad I. Carotid plaque area and intima-media thickness in prediction of first-ever ischemic stroke a 10-year follow-up of 6584 men and women: the tromso study. Stroke 2011;42(4):972-8.
39. Reiter M, Effenberger I, Sabeti S, Mlekusch W, Schlager O, Dick P, et al. Increasing carotid plaque echolucency is predictive of cardiovascular events in high-risk patients. Radiology 2008;248(3): 1050–5.
40. Gray-Weale AC, Graham JC, Burnett JR, Byrne K, Lusby RJ. Carotid artery atheroma: Comparison of preoperative B-mode ultrasound appearance with carotid endarterectomy specimen pathology. J Cardiovasc Surg (
41. Hossain MM, AlMuhanna K, Zhao L, Lal BK, Sikdar S. Semiautomatic segmentation of atherosclerotic carotid artery wall volume using 3D ultrasound imaging. MedPhys. 2015;42(4):2029-43.
42. Stein JH, Johnson HM. Carotid intima-media thickness, plaques, and cardiovascular disease risk: implications for preventive cardiology guidelines. J Am Coll Cardiol. 2010;55(15):1608-10.
43. Inaba Y, Chen JA, Bergmann SR. Carotid plaque, compared with carotid intima-media thickness, more accurately predicts coronary artery disease events: a meta-analysis. Atherosclerosis. 2012;220(1):128–33.
44. Lloyd-Jones DM, Leip EP, Larson MG, D’Agostino RB, Beiser A, Wilson PW, et al. Prediction of lifetime risk for cardiovascular disease by risk factor burden at 50 years of age. Circulation 2006; 113(6): 791-8.
45. Dalla-Pozza R, Ehringer-Schetitska D, Fritsch P, Jokinen E, Petropoulos A, Oberhoffer R; Association for European Paediatric Cardiology Working Group Cardiovascular Prevention. Intima media thickness measurement in children: A statement from the Association for European Paediatric Cardiology (AEPC) Working Group on Cardiovascular Prevention endorsed by the Association for European Paediatric Cardiology. Atherosclerosis 2015;238(2):380-7.
46. Urbina EM, Williams RV, Alpert BS, Collins RT, Daniels SR, Hayman L, et al. Noninvasive assessment of subclinical atherosclerosis in children and adolescents: recommendations for standard assessment for clinical research: a scientific statement from the American Heart Association. Hypertension 2009;54(5):919-50.
47. Kavey RE, Allada V, Daniels SR, Hayman LL, McCrindle BW, Newburger JW, et al. Cardiovascular risk reduction in high-risk pediatric patients: a scientific statement from the American Heart Association Expert Panel on Population and Prevention Science; the Councils on Cardiovascular Disease in the Young, Epidemiology and Prevention, Nutrition, Physical Activity and Metabolism, High Blood Pressure Research, Cardiovascular Nursing, and the Kidney in Heart Disease; and the Interdisciplinary Working Group on Quality of Care and Outcomes Research: endorsed by the American Academy of Pediatrics. Circulation. 2006;114(24):2710-38.
48. Bia D, Zócalo Y, Torrado J, Farro I, Florio L, Negreira C, et al. Estudio integral no invasivo de la estructura y función arterial. Rev Urug Cardiol 2010;25(2):105-38.
49. Winsor T. Influence of arterial disease on the systolic blood pressure radients of the extremity. Am J Med Sci. 1950;220(2):117–26.
50. Zócalo Y, Bia D. Presión aórtica central y parámetros clínicos derivados de la onda del pulso: evaluación no invasiva en la práctica clínica. Rev Urug Cardiol 2014; 29(2): 215-230
51. Aboyans V, Criqui MH, Abraham P, Allison MA, Creager MA, Diehm C, et al. Measurement and interpretation of the ankle-brachial index: a scientific statement from the American Heart Association. Circulation 2012;126(24):2890-909.
52. Aboyans V, Criqui MH, McClelland RL, Allison MA, McDermott MM, Goff DC Jr, et al. Intrinsic contribution of gender and ethnicity to normal ankle-brachial index values: the Multi-Ethnic Study of Atherosclerosis (MESA). J Vasc Surg 2007;45(2): 319-27.
53. Carter SA. Indirect systolic pressures and pulse waves in arterial occlusive diseases of the lower extremities. Circulation 1968;37(4):624-37.
55. Fowkes FG, Murray GD, Butcher I, Heald CL, Lee RJ, Chambless LE, et al. Ankle brachial index combined with Framingham risk score to predict cardiovascular events and mortality: a meta-analysis. JAMA 2008;300(2):197-208.
56. Mohler ER 3rd, Treat-Jacobson D, Reilly MP, Cunningham KE, Miani M, Criqui MH, et al. Utility and barriers to performance of the ankle-brachial index in primary care practice. Vasc Med. 2004;9(4):253-60.
57. Hammad TA, Strefling JA, Zellers PR, Reed GW, Venkatachalam S, Lowry AM, et al. The Effect of Post-Exercise Ankle-Brachial Index on Lower Extremity Revascularization. JACC Cardiovasc Interv 2015;8(9):1238-44.
58. Allison MA, Aboyans V, Granston T, McDermott MM, Kamineni A, Ni H, et al. The relevance of different methods of calculating the ankle-brachial index: the Multi-Ethnic Study of Atherosclerosis. Am J Epidemiol 2010;171(3):368-76.
59. Guindo J, Martínez-Ruiz M, Gusi G, Punti J, Bermúdez P, Martínez-Rubio A. Métodos diagnósticos de la enfermedad arterial periférica. Importancia del índice tobillo-brazo como técnica de criba. Rev Esp Cardiol 2009;9 Supl D:D11-17.