Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión impresa ISSN 0797-0048versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.31 no.1 Montevideo abr. 2016
Artículo de revisión
Accidente cerebrovascular criptogénico, fibrilación auricular subclínica y anticoagulación
Dr. Horacio Vázquez Nosiglia1
1. Servicio de Cardiología. Asociación Española. Montevideo, Uruguay.
Correo electrónico: hvazquez@asesp.com.uy
Recibido Mar 7, 2016; aceptado Mar 11, 2016.
Palabras clave:
REVISIÓN
ACCIDENTE CEREBROVASCULAR CRIPTOGÉNICO
FIBRILACIÓN AURICULAR SUBCLÍNICA
ANTICOAGULACIÓN
Key words:
REVIEW
CRYPTOGENIC STROKE
SUBCLINICAL ATRIAL FIBRILLATION
ANTICOAGULATION
Las enfermedades cardiovasculares son la principal causa de muerte en nuestro país y la enfermedad cerebrovascular ocupa el primer lugar entre las mismas, incluso superando a la enfermedad coronaria en los últimos años(1). La tasa de muerte por enfermedad cerebrovascular en Uruguay es una de las más altas de las Américas(2).
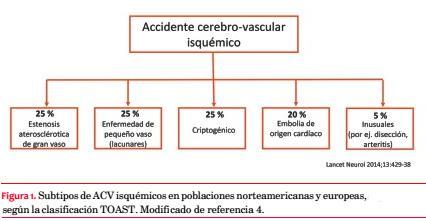
Según la clasificación usual de las causas de accidentes cerebrovasculares (ACV) isquémicos, cerca de la mitad se deben a enfermedad vascular obstructiva, divididos en partes iguales entre enfermedad de gran vaso extra o intracraneano y la enfermedad de pequeño vaso que da lugar a infartos lacunares. Un 20% obedece a cardioembolia, en su amplia mayoría fibrilación auricular (FA) y un 5% a causas raras (arteritis, disección, etcétera) (figura 1)(3,4).
La tasa de recurrencia de ACV criptogénico ha sido evaluada variablemente en diferentes series pero parece promediar un 3% a 6% anual(4,6,7). En los ACV isquémicos no cardioembólicos, incluyendo los criptogénicos, el tratamiento antitrombótico recomendado en prevención secundaria son los antiplaquetarios, básicamente el ácido acetilsalicílico (AAS), que ofrece una reducción de riesgo modesta, en el entorno del 20%(8).
La fibrilación auricular (FA) es la principal causa de cardioembolia, multiplica por cinco la posibilidad de sufrir un ACV y es un factor etiológico principal en las edades más avanzadas. Los pacientes con FA que ya han sufrido un ACV tienen una alta probabilidad de nuevos eventos. A diferencia de las otras etiologías, hay evidencia concluyente de que el ACV relacionado a FA es ampliamente prevenible con anticoagulantes, obteniendo una reducción de riesgo promedio de 64%(9).
El carácter elusivo de la FA, frecuentemente intermitente o asintomática, ha despertado expectativas de que una buena parte de los ACV criptogénicos pudiera deberse a FA oculta o eventualmente a otro mecanismo embólico. En apoyo de lo anterior existen similitudes clínicas y en estudios de neuroimágenes entre los ACV cardioembólicos y criptogénicos (infartos extensos, de distribución cortical o múltiple). Esto ha dado lugar a diversas líneas de investigación, pues, si se confirmara su mecanismo embólico, muchos pacientes con ACV hoy clasificados como criptogénicos podrían beneficiarse de un manejo antitrombótico más efectivo en la prevención de futuros eventos(4).
Fibrilación auricular subclínica registrada en dispositivos implantados
Los modernos marcapasos y cardiodesfibriladores implantables disponen de sistemas de monitorización permanente del ritmo cardíaco que permiten detectar períodos de ritmo auricular rápido equiparables a flutter o FA subclínica (TA/FA). Si bien estos registros no están exentos de falsos positivos, por lo que los electrogramas deben ser validados siempre por un médico competente, ofrecen una muy buena oportunidad a la investigación clínica. Los portadores de dispositivos tienen una frecuencia alta de episodios de TA/FA, entre 25% y 50% de los casos si el período de registro es suficientemente largo, y una frecuencia de ACV cercana a 6% en los primeros cuatro años siguientes al implante(10-12).
Desde los primeros años de la década del 2000 se han publicado estudios que tratan de relacionar la aparición de TA/FA detectada por dispositivos con la incidencia de ACV isquémico. La respuesta obtenida en ellos es categórica ya que, en promedio, los pacientes que sufrieron episodios subclínicos de TA/FA multiplicaron por 2,5 el riesgo de ACV isquémico. Por ejemplo, en el estudio MOST (Mode Selection Trial) los pacientes con al menos un episodio de TA/FA de cinco minutos de duración tuvieron 2,7 veces más riesgo de tener un ACV o morir en un seguimiento medio de 27 meses (HR 2,79, IC 1,51- 5,15; p= 0,0011)(10). Estos hallazgos fueron confirmados en el estudio TRENDS (A prospective study of the clinical significance of atrial arrhythmias detected by implanted device diagnostics) en un modelo prospectivo observacional sobre un número sustancialmente mayor de pacientes(11).
El estudio ASSERT (Asymptomatic atrial fibrillation and stroke evaluation in pacemaker patients and the atrial fibrillation reduction atrial pacing trial) reclutó más de 2.500 pacientes en los que se monitorizó la presencia de TA/FA con una duración mayor de 6 minutos durante los primeros tres meses posimplante, realizando un seguimiento de 2,5 años con un objetivo primario de ACV isquémico o embolia sistémica. El riesgo de presentar un evento se incrementó a más del doble entre los pacientes en que se detectó FA (HR 2,49, IC 1,28-4,85; p = 0,007)(12).
Existe evidencia de que una mayor duración o número de episodios subclínicos de TA/FA (mayor carga temporal) tiene una relación directa con el riesgo de ACV(10,11,13). Sin embargo es difícil establecer un umbral a partir del cual el riesgo de ACV comienza a aumentar pues ello puede variar según el riesgo clínico de cada paciente. El estudio de Botto correlacionó el riesgo clínico con la carga temporal de TA/FA y encontró que cuanto mayor es el score de riesgo clínico CHADS2 menor era la duración de TA/FA necesaria para incrementar el riesgo de ACV(14). Las guías de práctica clínica nos inducen a pensar en la FA como un factor de riesgo dicotómico (existe o no existe) pues están referidas a pacientes con alta carga temporal de FA. Resulta mucho más difícil evaluar el riesgo en pacientes que tienen episodios breves y esporádicos donde la carga de FA se parece más a un factor de riesgo continuo(15).
Un hallazgo perturbador es la muy pobre relación temporal entre los episodios de TA/FA y la ocurrencia de ACV(16,17). En el ASSERT solo en el 15% de los pacientes la TA/FA ocurrió en los 30 días precedentes al ACV y en el más reciente IMPACT (Randomized trial of anticoagulation guided by remote rhythm monitoring in patients with ICD and resynchronization devices) los episodios de TA/FA ocurrieron con más frecuencia después del ACV que antes del mismo(16-18).
La relación entre FA subclínica y ACV es mucho más compleja de lo que creíamos, lo que da lugar a varias hipótesis en busca de una explicación. Se ha postulado que la FA subclínica podría ser un marcador de riesgo que expresaría una “miopatía auricular” (fibrosis en la pared auricular, inflamación, alteraciones del endotelio, hipercoagulabilidad), lo que podría dar lugar a tromboembolia diferida o aún en períodos de ritmo sinusal(19). En apoyo de este concepto recientemente se ha demostrado que los pacientes con score CHA2DS2-VASc muy elevado tienen complicaciones tromboembólicas independientemente de que exista FA(20-22).
No existen estudios que hayan evaluado los anticoagulantes orales (ACO) en pacientes con FA detectada por dispositivos, por lo que pueden existir dudas respecto a que su efectividad sea similar que en la FA clínica para la prevención del ACV. Como ya fue dicho tampoco conocemos el umbral de carga temporal de FA subclínica por encima del cual el riesgo justifique la indicación de ACO. Las guías de práctica clínica se limitan a consignar que la FA no reconocida clínicamente constituye una importante causa potencial de ACV, pero no indican una conducta(24). Está en marcha el estudio ARTESiA (NCT 01938248), que aleatoriza a pacientes portadores de dispositivos implantables en los que se haya registrado al menos un episodio de TA/FA mayor de 6 minutos y score CHA2DS2-VASc ³ 4, a apixabán contra aspirina. Sus resultados se esperan para 2019(19).
La conducta práctica, basada en recomendaciones de expertos, ha ido en el sentido de indicar ACO a los pacientes con TA/FA detectada por dispositivos, con énfasis en los pacientes de mayor edad, con mayor carga temporal de FA y con score de riesgo clínico más alto.
Accidente cerebrovascular criptogénico y fibrilación auricular subclínica
Luego de un ACV criptogénico las guías de práctica clínica recomiendan investigar la posibilidad de FA con un monitoreo Holter no menor de 24 horas(25,26). Un monitoreo limitado a 24 horas es poco eficaz, pues la FA en su forma paroxística, ya sea sintomática o silente, puede tener largos períodos libres de arritmia. Se ha postulado que una búsqueda más prolongada podría detectar FA en un mayor número de pacientes. Esto se ha intentado con dispositivos implantables o de registro externo durante períodos de tiempo variables(27).
El estudio CRYSTAL-AF (Cyptogenic stroke and underlying atrial fibrillation) aleatorizó a dos estrategias de monitoreo electrocardiográfico a más de 400 pacientes que habían sufrido un ACV criptogénico o AIT, en los que no se detectó FA en un Holter inicial de 24 horas. A un grupo se le implantó un dispositivo de registro permanente y el segundo solo recibió controles clínicos rutinarios. El objetivo primario fue la detección de FA de 30 segundos de duración o mayor en un período de seis meses. En el grupo de monitoreo intensivo se registró FA en 8,9% contra 1,3% en el grupo control (HR 6,4; IC 1,9-21,7; p<0,001). Cuando el monitoreo se extendió a un año se detectó FA en 12,4% y cuando se extendió a tres años alcanzó al 30% de los pacientes(28).
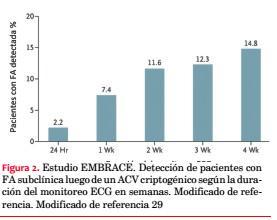
El estudio EMBRACE (30-Day cardiac event monitor belt for recording atrial fibrillation after a cerebral ischemic event) también aleatorizó a más de 500 pacientes que habían sufrido un ACV criptogénico o AIT en los que no se detectó FA en un Holter de 24 horas, a dos estrategias de monitoreo. El grupo intervención llevó un registrador de eventos externo (activado automáticamente por evento arrítmico) por 30 días y el grupo control realizó un segundo Holter de 24 horas. El objetivo primario fue la detección de FA de 30 segundos de duración o mayor, que se obtuvo en el 16,1% del grupo intervención contra 3,2% del grupo control (IC 8,0-17,6; p<0,001)(29) (figura 2).
Un segundo mensaje es que el ACV criptogénico está lejos de explicarse solo por la FA silente, pues la cantidad de pacientes en los que la arritmia se detecta en los meses siguientes al evento difícilmente supere la cuarta o quinta parte de ellos. En relación con esto es cuestionable la viabilidad de realizar monitoreos superiores a 30 días, pues en el terreno clínico es poco útil un método diagnóstico que ofrece respuestas un año o más después de indicado.
Extrasistolía auricular frecuente. Un riesgo emergente
Durante largo tiempo en la práctica clínica usual la extrasistolía auricular ha sido considerada un hallazgo irrelevante. Sin embargo, su papel como predictor clínico de futura FA ha sido reconocido en la última década en numerosas series, tanto en la población general como en pacientes que sufrieron un ACV(31-33).
Tradicionalmente las únicas arritmias asociadas a ACV fueron la FA y el flutter, por lo que las extrasístoles auriculares solo resultaban relevantes como predictoras de un grado mayor de arritmia. Luego de las publicaciones del Copenhagen Holter Study, a partir de 2010, la extrasistolía supraventricular excesiva (ESVE) surge como un importante factor de riesgo independiente para desarrollar ACV isquémico.
El Copenhagen Holter Study reclutó 678 sujetos sanos entre 55 y 75 años y les realizó un registro Holter de 48 horas. La ESVE se definió, acorde al decil superior de extrasistolía auricular presente en la población, como una frecuencia de latidos prematuros ³ 30 por hora o cualquier ráfaga ³ a 20 latidos consecutivos. El objetivo primario fue ACV o muerte y los secundarios mortalidad total, ACV y admisiones hospitalarias por FA. El 14,6% de la población tenía ESVE. Un primer reporte del estudio con un seguimiento promedio mayor de seis años encontró un riesgo de ACV o muerte significativamente mayor entre las personas con ESVE (HR 1,64; IC 1,0 -2,60; p 0,036), así como de ACV (HR 2,79; IC 1,23- 6,30; p 0,014) y FA clínica (HR 2,78; IC 1,08 a 6,99; p 0,033) (34).
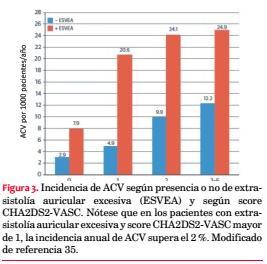
Una publicación muy reciente del mismo estudio con seguimiento promedio de casi 15 años reportó que los pacientes con ESVE duplican la incidencia de ACV isquémico y que, llevado a términos absolutos, uno de cada cinco tendrá un evento en el largo plazo. Contrariamente a lo esperado, la gran mayoría de los ACV que se producen en este grupo no son precedidos de FA clínicamente manifiesta, que solo estuvo presente en el 14,6% de los casos. El incremento en la incidencia de ACV solo fue significativo en mayores de 65 años. Cuando la población con ESVE se estudió según score CHA2DS2-VASc se encontró que con una puntuación ³2 el riesgo de ACV es de 2,4% por año, riesgo comparable con la FA clínica (figura 3)(35).
Se necesita más evidencia para saber cómo debemos manejar a los pacientes con ESVE, sin embargo la presencia de la misma debe entrar en el análisis de riesgo clínico de ACV sobre todo en presencia de edad avanzada o score de riesgo alto(36).
En los pacientes que ya han tenido un ACV criptogénico es difícil evitar la tentación de considerar la ESVE como un equivalente de FA subclínica, sobre todo teniendo en cuenta que la búsqueda de esta última es compleja e implica muchas veces un largo retraso para adoptar medidas eficientes de prevención secundaria.
Accidente cerebrovascular criptogénico: ¿Antiagregantes o anticoagulantes?
Los estudios que han comparado antiagregantes plaquetarios con anticoagulantes en prevención secundaria del ACV han sido relativamente pequeños y de diseño variado. Una revisión publicada por Cochrane en 2012 sobre ocho estudios que recolectaban más de 5.000 pacientes con ACV de causa “presumiblemente arterial”, comparando aspirina con antagonistas de vitamina K, mostró un resultado neutro en prevención secundaria de eventos vasculares y un aumento del número de sangrados con ACO. Sin embargo este análisis tiene muchas limitaciones en cuanto a la selección de la población estudiada, uso de diferentes drogas anticoagulantes y calidad de la anticoagulación(37).
De lo anterior puede deducirse que en estudios como el WARSS los ACV clasificados como criptogénicos con frecuencia han incluido un cierto número de infartos lacunares, que tienen características clínicas y de neuroimágenes claramente diferenciales y raramente obedecen a embolia. Los infartos lacunares son debidos a enfermedad oclusiva de pequeños vasos penetrantes, que afectan a estructuras profundas (sustancia blanca, núcleos basales), son pequeños (menores de 1,5 cm en la tomografía computada o de 2 cm en la resonancia magnética) y se asocian a mejor pronóstico funcional que las otras causas de ACV(42).
ESUS. Un nuevo concepto
Un grupo internacional de investigadores, liderado desde la Universidad McMaster en Canadá, ha propuesto un enfoque diferente del ACV criptogénico(4). Se postula que los ACV criptogénicos son en su amplia mayoría de mecanismo embólico. Este mecanismo no se limita a la FA silente, sino que incluye otros tipos de arritmia supraventricular, numerosas situaciones de cardiopatía orgánica con potencial embolígeno demostrado aunque de baja probabilidad, embolia paradojal a través de un foramen oval y también las embolias de origen arterial desde placas de ateroma no obstructivas, ya sea del arco aórtico o de grandes vasos extra o intracraneanos.
El concepto de ACV criptogénico es “negativo” y poco preciso, pues se refiere a los casos sin etiología demostrada luego de estudios diagnósticos que pueden ser de extensión o calidad variable. Se ha buscado una definición más asertiva y precisa bajo la denominación de ACV embólico de causa indeterminada, ESUS por su sigla en inglés (Embolic Stroke of Undetermined Source), para el que se proponen criterios más rigurosos. El ESUS es un infarto cerebral que no es lacunar, no se debe a cardioembolia manifiesta ni a enfermedad obstructiva de gran vaso (mayor de 50%). Los exámenes exigidos para este diagnóstico están dirigidos, por una parte, a confirmar un infarto cerebral con características compatibles con embolia (no lacunar) con una tomografía computada (TC) o resonancia magnética (RM). Por otro lado están destinados a descartar causas manifiestas de cardioembolia (electrocardiograma, Holter de por lo menos 24 horas y ecocardiograma transtorácico) y a descartar obstrucción de gran vaso (angiografía, o angio TC, o angio RM, o ultrasonido de vasos cervicales asociado a Doppler transcraneano) (figura 4).
1. RE-SPECT ESUS (NCT02239120) es un estudio aleatorizado doble ciego de dabigatrán 110 o 150 mg dos veces al día contra AAS 100 mg. El objetivo primario es ACV recurrente o embolismo sistémico. Se propone reclutar a 6.000 pacientes mayores de 60 años con un seguimiento de hasta tres años. Se estima que estará completado a finales de 2017(43).
2. NAVIGATE-ESUS (NCT02313909) es un estudio aleatorizado doble ciego de rivaroxabán 15 mg/día contra AAS 100 mg. El objetivo primario es ACV recurrente o embolismo sistémico. Se propone reclutar a 7.000 pacientes mayores de 50 años con un seguimiento de hasta tres años. Se estima que estará completado a principios de 2018(44).
En conclusión
El ACV criptogénico es una entidad que plantea un difícil desafío al equipo de salud. La FA subclínica puede explicar una parte de los mismos y un monitoreo electrocardiográfico prolongado puede identificarla, sin embargo está lejos de ser la única causa. La extrasistolía auricular frecuente ha sido identificada como un factor de riesgo que debe ser considerado. Subsisten importantes áreas de incertidumbre en cuanto a la relación entre la FA subclínica y el mecanismo del ACV y también en cuanto al mejor manejo en prevención secundaria. Recientemente se ha propuesto el concepto de ESUS como una forma de identificar los casos de ACV criptogénico en que el mecanismo embólico es más probable y que pueden obedecer a diferentes causas. Están en marcha dos estudios de prevención secundaria para probar la hipótesis de que los ACO son una estrategia superior a la antiagregación plaquetaria en este contexto.
Bibliografía
1. Curto S, Prats O, Zelarayan M. Mortalidad por enfermedades cardiovasculares. Uruguay, 2009. Rev Urug Cardiol 2011; 26(3): 189-96.
2. Vázquez H, Sandoya E. Mortalidad cardiovascular en Uruguay. Algunas reflexiones. Rev Urug Cardiol 2012; 27(1): 3-6
3. Adams HP Jr, Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in acute stroke tratment. Stroke 1993;24(1):35-41.
4. Hart R, Diener H, Coutts S, Easton JD, Granger CB, O’Donnell MJ, et al. Embolic strokes of undetermines source: the case for a new clinical construct. Lancet Neurol 2014;13(4): 429-38
5. Li L, Yiin GS, Geraghty OC, Schulz UG, Kuker W, Mehta Z, et al. Oxford Vascular Study. Incidence, outcome, risk factors, and long-term prognosis of cryptogenic transient ischaemic attack and ischaemic stroke: a population-based study. Lancet Neurol 2015;14(9):903-13.
7. Lovett JK, Coull AJ, Rothwell PM. Early risk of recurrence by subtype of ischemic stroke in population-based incidence studies. Neurology 2004; 62(4):569-73
8. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002;324(7329):71-86. Fe de erratas en: BMJ Jan 19; 324(7330):141
9. Hart RG, Perce LA, Aguilar MI. Meta-analysis: antighrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007;146(12):857-67
10. GlotzerTV,
11. Glotzer TV, Daoud EG, Wyse DG, Singer DE, Ezekowitz MD, Hilker C, et al. The relationship between daily atrial tachyarrhythmia burden from implantable device diagnostics and stroke risk. The TRENDS Study. Circ Arrhythmia Electrophysiol 2009;2(5):474-80.
12. HealeyJS, Connolly SJ, Gold MR, Israel CW, Van GelderI C, Capucci A, et al. Subclinical atrial fibrillation and the risk of stroke. N Engl J Med 2012;366(2):120-9.
13. Capucci A, Santini M, Padeletti L, Gulizia M, Botto G, Boriani G, et al. Monitored atrial fibrillation duration predicts arterial embolic events in patients suffering from bradycardia and atrial fibrillation implanted with antitachycardia pacemakers. J Am Coll Cardiol 2005;46(10):1913-20.
14. Botto GL, Padeletti L, Santini M, Capucci A, Gulizia M, Zolezzi F, et al. Presence and duration of atrial fibrillation detected by continuous monitoring: crucial implications for the risk of thromboembolic events. J Cardiovasc Electrophysiol 2009;20(3): 241-8.
15. Passman R, Bernstein RA. New appraisal of atrial fibrillation burden and stroke prevention. Stroke 2016;47(2):570-6.
16. Daoud EG, Glotzer TV, Wyse DG, Ezekowitz MD, Hilker C, Koehler J, et al. Temporal relationship of atrial tachyarrhythmias, cerebrovascular events and systemic emboli based on stored device data: a subgroup analysis of TRENDS. Heart Rhythm 2011;8(9):1416-23.
17. Brambatti M, Connolly SJ, Gold MR, Morillo CA, Capucci A, Muto C, et al. Temporal relationship between sub- clinical atrial fibrillation and embolic events. Circulation 2014;129(21):2094-9.
18. Martin D, Bersohn M, Waldo A, Wathen MS, Choucair WK, Lip GY, et al. Randomized trial of atrial arrhythmia monitoring to guide anticoagulation in patients with implanted defibrillator and cardiac resynchronization devices. Eur Heart J 2015; 36(26):1660-8.
19. Scarabelli C, Scarabelli T, Ellenbogen K, Halperin JL. Device-detected atrial fibrillation what to do with asymptomatic patients? J Am Coll Cardiol 2015;65(3):281-94.
20. Martínez-Selles M, Fernández Lozano I, Baranchuck A, Bayes-Genis A, Bayés de Luna A. Debemos anticoagular a pacientes en alto riesgo de sufrir fibrilacion auricular? Rev Esp Cardiol 2016 Mar (consulta 14 Mar 2016). Disponible en: http://dx.doi.org/10.1016/j.recesp.2016.01.009
21. Polenz GF, Leiria TL, Essebag V, Kruse ML, Pires LM, NogueiraTB, et al. CHA2DS2- VASc score as a predictor of cardiovascular events in ambulatory patients without atrial fibrillation. Pacing Clin Electrophysiol 2015;38(12):1412-7.
22. Tischer Ts, Schneider R, Lauschke J, Nesselmann C, Klemm A, Diedrich D, et al. Prevalence of atrial fibrillation in patients with high CHADS2- and CHA2DS2- VASc scores: anticoagulate or monitor high-risk patients? Pacing Clin Electrophysiol 2014;37(12):1651-7.
23. Healey J, Lopes R, Connolly S. The detection and treatment of subclinical atrial fibrillation: evaluating the IMPACT of a comprehensive strategy based on remote arrhythmia monitoring. Eur Heart J 2015; 36(26):1640-2
24. January CT, Wann LS, Alpert JS, Calkins H, Cigarroa JE, Cleveland JC, et al. 2014 AHA/ ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol 2014;64(21):e1-76.
25. Jauch EC, Saver JL, Adams HP Jr, Bruno A, Connors JJ, Demaerschalk BM, et al. Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2013;44(3): 870-947.
26. Kernan WN, Ovbiagele B, Black HR, Bravata DM, Chimowitz MI, Ezekowitz MD, et al. Guidelines for the prevention of stroke in patients with stroke or transient ischemic attack: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2014;45(7):2160-236.
27. Kishore A, Vail A, Majid A, Dawson J, Lees KR, Tyrrell PJ, et al. Detection of atrial fibrillation after ischemic stroke or transient ischemic attack: a systematic review and metaanalysis. Stroke 2014; 45(2):520-6.
28. Sanna T, Diener H¬C, Passman RS, Di Lazzaro V, Bernstein RA, Morillo CA, et al. Cryptogenic stroke and underlying atrial fibrillation. N Engl J Med 2014;370(26):2478-86.
29. Gladstone DJ, Spring M, Dorian P, Panzov V, Thorpe KE, Hall J, et al. Atrial fibrillation in patients with cryptogenic stroke. N Engl J Med 2014; 370(26):2467-77.
30. Kamel H. Heart-Rhythm Monitoring for Evaluation of Cryptogenic Stroke. N Engl J Med 2014;370(26): 2532-3.
31. Dewland TA, Vittinghoff E, Mandyam MC, Heckbert SR, Siscovick DS,
32. Wallmann D, Tüller D, Wustmann K, Meier P, Isenegger J, Arnold M, et al. Frequent atrial premature beats predict paroxysmal atrial fibrillation in stroke patients: an opportunity for a new diagnostic strategy. Stroke 2007;38(8):2292-4.
33. Gladstone DJ, Dorian P, Spring M, Panzov V, Mamdani M, Healey JS, et al. Atrial premature beats predict atrial fibrillation in cryptogenic stroke: results from the EMBRACE trial. Stroke 2015;46(4): 936-41.
34. Binici Z, Intzilakis T, Nielsen OW, Kober L, Sajadieh A. Excessive supraventricular ectopic activity and increased risk of atrial fibrillation and stroke. Circulation 2010;121(17):1904-11.
35. Gladstone DJ, Dorian P, Spring M, Nielsen OW, Sajadieh A. Excessive atrial ectopy and?short atrial runs increase the risk of stroke beyond incident atrial fibrillation. J Am Coll Cardiol 2015; 66(3):232-41.
36. Marcus G, Dewland T. Premature Atrial Contractions A Wolf in Sheep’s Clothing? J Am Coll Cardiol 2015;66(6):242-4.
37. De Schryver EL, Algra A, Kappelle LJ, van Gijn J, Koudstaal PJ. Vitamin K antagonists versus antiplatelet therapy after transient ischaemic attack or minor ischaemic stroke of presumed arterial origin. Cochrane Database Syst Rev 2012;9:CD001342.
38. Mohr JP, Thompson JLP, Lazar RM, Levin B, Sacco RL, Furie KL, et al, and the Warfarin-Aspirin Recurrent Stroke Study Group. A comparison of warfarin and aspirin for the prevention of recurrent ischemic stroke? N Engl J Med 2001; 345(20):1444-51.
39. Sacco RL, Prabhakaran S, Thompson JLP, Murphy A, Sciacca RR, Levin B, et al. Comparison of warfarin versus aspirin for the prevention of recurrent stroke or death: subgroup analyses from the Warfarin- Aspirin Recurrent Stroke Study. Cerebrovasc Dis 2006; 22(1): 4-12.
40. Homma S, Sacco RL, Di Tullio MR, Sciacca RR, Mohr JP; PFO in Cryptogenic Stroke Study (PICSS) Investigators. Effect of medical treatment in stroke patients with patent foramen ovale: patent foramen ovale in Cryptogenic Stroke Study. Circulation 2002; 105(22): 2625–31.
41. Longstreth WT Jr, Kronmal RA, Thompson JLP, Christenson RH, Levine SR, Gross R, et al. Amino terminal pro-B-type natriuretic peptide, secondary stroke prevention, and choice of antithrombotic therapy. Stroke 2013; 44(3): 714-19.
42. Grau AJ, Weimar C, Buggle F, Heinrich A, Goertler M, Neumaier S, et al. Risk factors, outcome, and treatment in subtypes of ischemic stroke: the German stroke data bank. Stroke 2001;32(11): 2559-66.
43. Dabigatran Etexilate for Secondary Stroke Prevention in Patients With Embolic Stroke of Undetermined Source (NCT02239120) (Internet). Washington: ClinicalTrials.gov; 2015 (consulta 14 Mar 2016). Disponible en http://www.clinicaltrials.gov .
44. Rivaroxaban Versus Aspirin in Secondary Prevention of Stroke and Prevention of Systemic Embolism in Patients With Recent Embolic Stroke of Undetermined Source (NCT02313909) (Internet).