Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
Print version ISSN 0797-0048On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.30 no.3 Montevideo Dec. 2015
FIBRILACIÓN AURICULAR
Artículo de revisión
Cómo seleccionar el mejor NOAC para los pacientes con fibrilación auricular
Nur A. Rahmat1, Gregory Y. H. Lip1,2
1. Centro de Ciencias Cardiovasculares, Universidad de Birmingham, Birmingham, Reino Unido.
2. Unidad de Investigación en Trombosis, Departamento de Medicina Clínica, Universidad de Aalborg, Aalborg, Dinamarca.
Correspondencia: Profesor Gregory Y. H. Lip. Correo electrónico: g.y.h.lip@bham.ac.uk
Resumen
Los NOAC (No antivitamina K AntiCoagulantes) representan una opción atractiva para numerosos pacientes con fibrilación auricular (FA). Los diversos NOAC tienen propiedades levemente diferentes, por lo que su prescripción debe realizarse en base a las características del paciente. Frente a la necesidad de elegir entre varios NOAC, este artículo ofrece un enfoque centrado en el paciente para seleccionar el mejor NOAC en aquellos con FA no valvular.
Palabras clave:
ANTICOAGULANTES / uso terapéutico
FIBRILACIÓN ATRIAL / quimioterapia
VITAMINA K / antagonistas & inhibidores
WARFARINA / uso terapéutico
Summary
A non-Vitamin K antagonist oral anticoagulant (NOAC) is an attractive option for many patients with atrial fibrillation (AF). The various NOACs have slightly different properties, and thus prescribing NOACs should be based on patient characteristics. With several NOACs to choose from, this article offers a patient-centred approach in choosing the best choice of NOACs for non-valvular AF patients.
Key words:
ANTICOAGULANTS / therapeutic use
ATRIAL FIBRILLATION / drug therapy
VITAMIN K / antagonists & inhibitors
WARFARIN / therapeutic use
Introducción
La FA es la arritmia cardíaca más frecuente y está asociada con un incremento de dos veces en el riesgo de muerte(1) y cinco veces en el riesgo de ataque cerebrovascular (ACV)(2), representando un importante problema de salud pública a nivel mundial. En los últimos 20 años los ingresos hospitalarios por FA han aumentado en 60% y se estima que la prevalencia de FA se triplicará para el año 2050(3).
El riesgo de ACV en pacientes con FA no es homogéneo y depende de factores de riesgo adicionales(4,5). Una prevención eficaz del ACV implica anticoagulación oral, y tanto los antagonistas de la vitamina K (AVK, por ejemplo, warfarina) y los NOAC han sido recomendados por las guías de la Sociedad Europea de Cardiología (ESC)(6).
Todos los NOAC han sido estudiados en ensayos clínicos randomizados, bien diseñados y de gran escala, y han sido evaluados extensamente mediante metaanálisis, mostrando una reducción de la mortalidad total, mortalidad cardiovascular, sangrado intracraneano y sangrado global en comparación con la warfarina(7,8).
Frente a la disponibilidad de diversos NOAC, este artículo ofrece un enfoque breve, centrado en el paciente, para la selección apropiada de un NOAC acorde a las características individuales del paciente. Esta revisión comprende tres secciones: a) enfoque inicial al elegir un anticoagulante oral (ACO); b) el tiempo en rango terapéutico (TTR) en pacientes tratados con warfarina, y c) selección de un NOAC en poblaciones específicas.
Enfoque inicial
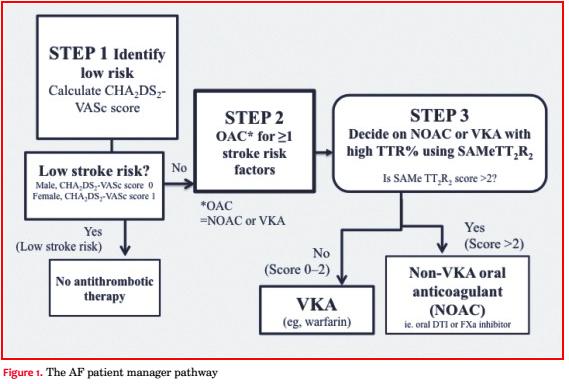
La indicación del uso de ACO para la prevención de ACV se basa en primer lugar en identificar a aquellos pacientes con “riesgo verdaderamente bajo” (score CHA2DS2-VASc de 0 [hombres] o 1 [mujeres])(9-12), que no necesitan tratamiento antitrombótico(13). En aquellos pacientes que son candidatos a tratamiento ACO (o sea, score CHA2DS2-VASc ³ 2, o 1 para hombres), el score SAMe-TT2R2 puede ayudar a identificar cuáles pacientes tendrán buena respuesta al tratamiento con AVK (TTR ³ 70%). Los pacientes con un score SAMe-TT2R2 > 2 tienen menor probabilidad de tener buena respuesta al tratamiento con AVK y podrían ser mejores candidatos a NOAC (figura 1).
AVK: ¿Importa el tiempo en rango terapéutico?
La calidad del control de la anticoagulación es crucial para el manejo de la FA. La warfarina es utilizada por millones de pacientes en el mundo en la prevención del ACV o para prevenir o tratar el tromboembolismo venoso (TEV). La warfarina ofrece su mayor eficacia y seguridad cuando el promedio del TTR individual es > 65%-70%(9). El TTR es una forma eficaz de evaluar si el paciente está alcanzado el beneficio óptimo de la administración de warfarina. Un TTR subóptimo (por ejemplo, < 60%) está asociado a un mayor número de efectos adversos, exponiendo al pacientes a eventos adversos hemorrágicos y tromboembólicos(14-16).
El score SAMe-TT2R2 (tabla 1) es una nueva forma de valoración del riesgo clínico desarrollado para predecir la respuesta a la warfarina en pacientes con FA, ayudando en la elección entre warfarina o NOAC(17). El Instituto Nacional de Salud y Excelencia en los Cuidados (National Institute for Health and Care Excellence-NICE) en su documento de consenso sobre la implementación del uso de NOAC ha recomendado la utilización del score SAMe- TT2R2(18), al igual que lo hace el documento de consenso del Grupo de Anticoagulación y Trombosis de la ESC(6).
La warfarina es eficaz en la prevención del ACV cuando es manejada y controlada adecuadamente. Debido a sus reconocidas limitaciones, una gran proporción de pacientes con alto riesgo de ACV persisten subtratados(19). Aquellos pacientes en tratamiento con warfarina que se encuentran bien manejados y controlados no deben ser cambiados inmediatamente a un NOAC; sin embargo, estos últimos han demostrado reducir significativamente el sangrado intracraneano persistiendo el beneficio clínico sin importar el nivel de control del INR(20).
La warfarina sigue siendo el anticoagulante de primera línea para pacientes con válvulas protésicas mecánicas. La tabla 3 resume las condiciones donde los NOAC no son adecuados.
NOAC
Los NOAC poseen múltiples ventajas particularmente con respecto a la conveniencia para el paciente. Existe, sin embargo, escasa evidencia para recomendar uno sobre otro y no hay información de comparación directa entre cada uno de ellos. Las sugerencias se basan en sus perfiles farmacológicos.
Los cuatro NOAC aprobados pueden ser divididos en dos grupos: (i) inhibidores directos de la trombina (dabigatrán); (ii) inhibidores del factor Xa (rivaroxabán, apixabán y edoxabán). Dado que cada uno de los NOAC tiene propiedades levemente diferentes, su prescripción debe basarse en las características de cada caso.
Interacciones farmacológicas y prescripciones concomitantes
A pesar de que se espera un menor número de interacciones farmacológicas con los NOAC(21), aún existen numerosas interacciones relevantes. Los médicos clínicos deber ser conscientes de los efectos farmacocinéticos de las drogas concomitantes, especialmente los inhibidores e inductores de la glicoproteína de permeabilidad (P-gp) y el citocromo P3A4 (CYP3A4).
P-gp es uno de los transportadores de fármacos y su actividad está modulada por numerosas drogas, hierbas y componentes de los alimentos(22). El CYP3A4, parte del citocromo P450 hepático, está expresado en el hígado de los individuos adultos y es responsable por el metabolismo oxidativo de numerosos fármacos(23). De forma general, los inductores de P-gp y CYP3A4 reducen la biodisponibilidad y los niveles plasmáticos de sus sustratos, mientras que los inhibidores de P-gp y CYP3A4 incrementan la biodisponibilidad y el nivel plasmático de sus sustratos.
Todos los NOAC son sustratos de P-gp y su absorción es dependiente del sistema de P-gp intestinal(24). Los inhibidores del factor Xa están afectados tanto por los inhibidores como por los inductores de la P-gp y el CYP3A4. Sin embargo, edoxabán es metabilizado por CYP3A4 en menor medida (< 5%) que rivaroxabán y apixabán(28). El dabigatrán no está involucrado de forma significativa con la actividad de CYP3A4(29).
Los inhibidores potentes de CYP3A4 y P-gp, como, por ejemplo, los antifúngicos azoles, no deben ser coadministrados con NOAC debido a que incrementan el área bajo la curva con aumentos paralelos de las concentraciones máximas(27,30-33), colocando al pacientes en mayor riesgo de sangrado. El tratamiento concomitante con inductores potentes de CYP3A4 y P-gp también debe ser evitado o ser utilizado con precaución. Edoxabán representaría quizá la excepción, mientras que con apixabán esta interacción puede llevar a reducciones en las concentraciones plasmáticas(26).
Para el dabigatrán, los inhibidores de P-gp y la disfunción renal pueden incrementar aún más su concentración plasmática. Una dosis reducida de dabigatrán (75 mg dos veces al día) está recomendada cuando se utiliza en combinación con potentes inhibidores de P-gp en pacientes con clearance de creatinina (ClCr) 30-50 mL/min. No se recomienda el uso de dabigatrán para pacientes con ClCr < 30 mL/min si se administra concomitantemente un inhibidor de P-gp(30,34). La coadministración de inductores potentes de P-gp también debe ser evitada debido a la reducción en la concentración de dabigatrán, sometiendo a los pacientes a un mayor riesgo de trombosis(30,32,34).
En resumen y con un enfoque práctico, las drogas más importantes que aumentan las concentraciones de todos los NOAC son verapamilo, amiodarona y dronedarona, y se debe tener mayor precaución en aquellos pacientes con disfunción renal. La terapia concomitante con inductores e inhibidores moderados y potentes del CYP3A4 y P-gp requerirá de un ajuste de dosis o discontinuación de los NOAC(25-27,30). Los pacientes deben ser controlados por la presencia de sangrados o la pérdida del efecto anticoagulante en estas situaciones.
La tabla 4 muestra ejemplos de inductores/inhibidores potentes de P-gp y CYP3A4.
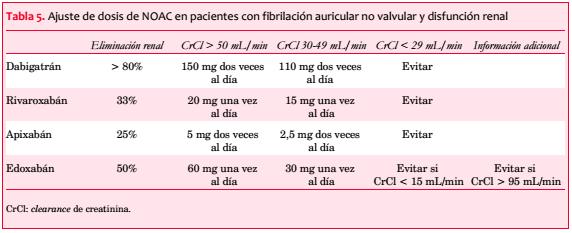
Disfunción renal: los pacientes con enfermedad renal crónica (ERC) y FA tienen riesgo de eventos tromboembólicos y hemorrágicos(35,36). Un ClCr < 50-60 mL/min es un factor de riesgo independiente para ACV y embolia sistémica(37,38). Los cuatro NOAC tienen diferentes características en su eliminación renal: dabigatrán es el que tiene la mayor depuración renal (hasta un 80%)(39,40), mientras que edoxabán, rivaroxabán y apixabán tienen una depuración renal de 50%(29), 36%(41) y 27%(42) respectivamente.
En el Reino Unido, el método estándar para determinar la función renal es la tasa de filtrado glomerular estimada (TFGe), aunque no fue designada para guiar el ajuste de dosis de las drogas. Las guías de práctica clínica sobre NOAC de la Asociación Europea del Ritmo Cardíaco (EHRA) de la ESC han sugerido la utilización del clearance de creatinina, calculado por la ecuación de Cockcroft y Gault, debido a que todos los ensayos clínicos con NOAC han utilizado este método para estimar la función renal y realizar indicación de drogas y ajuste de dosis(6).
Carecemos de información acerca de la eficacia y seguridad de los NOAC en pacientes con enfermedad renal severa debido a que estos pacientes fueron excluidos de los grandes ensayos clínicos. Los estudios RE-LY (dabigatrán) y ROCKET AF (rivaroxabán) excluyeron a los pacientes con un CrCl < 30 mL/min, mientras que el estudio ARISTOTLE (apixabán) excluyó a los pacientes con un CrCl < 25 mL/min (o una creatinina > 2,5 mg/dL). Sin embargo, sí se incluyeron pacientes con ERC leve a moderada, con y sin reducciones preespecificadas de dosis.
Las dosis de dabigatrán utilizadas en RE-LY fueron 150 mg y 110 mg dos veces al día, sin ajuste de dosis basada en el ClCr(43). La Administración Federal de Alimentos y Drogas (FDA), sin embargo, ha aprobado la dosis de 75 mg dos veces al día para pacientes con CrCl de 15-30 mL/min basándose en modelos farmacocinéticos(44,45). En contexto de deterioro severo de la función renal, la vida media plasmática de dabigatrán se incrementa al menos dos veces(40), exagerando por lo tanto su efecto anticoagulante.
En el estudio ROCKET AF fue utilizada una dosis reducida de 15 mg/día (en lugar de 20 mg) en pacientes con un CrCl de 30-50 mL/min. Esta dosis mostró ser no inferior a la de warfarina para el punto final primario de seguridad, representando una alternativa razonable a los AVK en estos pacientes(46). El rivaroxabán está contraindicado en pacientes con CrCl < 15 mL/min(27).
Los estudios Hokusai-VTE (para tromboembolismo venoso) y ENGAGE AF-TIMI 48 (para FA) indicaron la necesidad de la reducción de dosis en pacientes con enfermedad renal(48,49). Una dosis reducida de 30 mg de edoxabán (en lugar de 60 mg) es necesaria para: 1) CrCl 15-50 ml/min; 2) peso menor a 60 kg, y 3) utilización de inhibidores potentes de P-gp(26). Edoxabán no debería ser utilizado en el rango de función renal normal con CrCl > 95 mL/min, dado que su eficacia estaría reducida(26) y habría un incremento del riesgo de ACV isquémico comparado con warfarina.
En resumen, se desaconseja la utilización de NOAC en pacientes con disfunción renal severa(6) (tabla 5). En presencia de disfunción renal leve a moderada, los NOAC son al menos tan efectivos como la warfarina (bien controlada) y tan seguros (dabigatrán, rivaroxabán) o más seguros (apixabán) en términos de riesgo hemorrágico(46,50). La función renal debe ser monitorizada anualmente en caso de disfunción renal leve, semestral en presencia de disfunción moderada y más frecuentemente en situaciones que puedan agravar la función renal(6), por ejemplo hipovolemia, deshidratación y determinadas medicaciones concomitantes.
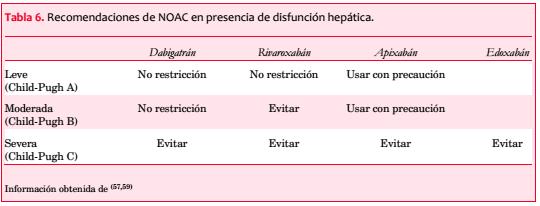
Disfunción hepática. La alteración de la función hepática puede afectar la coagulación y los pacientes tienen un riesgo incrementado de sangrado. La categorización recomendada y más ampliamente utilizada para describir el grado de disfunción hepática es la clasificación de Child-Pugh: A, B y C o leve, moderada y severa(13,51,52). Existe limitada información acerca del uso de NOAC en presencia de disfunción hepática.
Los estudios RE-LY, ROCKET AF y ARISTOTLE excluyeron a los pacientes con disfunción hepática significativa (de acuerdo a los niveles basales de ALT(43,47,53), AST(43,53), ALP(43) o bilirrubina total(53)), así como a pacientes con enfermedad hepática activa (por ejemplo, hepatitis aguda, hepatitis crónica activa y cirrosis)(43,47,53). La monitorización de la función hepática durante el desarrollo de estos estudios no mostró ningún elemento de toxicidad(43,54,55). Sin embargo, se han producido regulaciones y restricciones para identificar a pacientes en riesgo y aquellos que requieren ajuste de dosis o tienen contraindicaciones.
El dabigatrán no tiene metabolización hepática. La disfunción hepática moderada no ha mostrado afectar la farmacodinamia o farmacocinética del dabigatrán, por lo que puede ser administrado sin ajuste de dosis en este grupo(56). El dabigatrán se encuentra contraindicado en el estadio Child-Pugh C, cuando existe elevación de las enzimas hepáticas mayor a dos veces el límite superior de referencia, así como en presencia de disfunción hepática que comprometa la sobrevida(30,57).
Los inhibidores del factor Xa tienen metabolismo hepático (involucrando el CYP3A4). Los pacientes con Child-Pugh B bajo tratamiento con rivaroxabán si experimentaron un incremento mayor a dos veces está, por lo tanto, contraindicado en los estadios Child-Pugh B o C(58), incluyendo la enfermedad renal con coagulopatía asociada y riesgo de sangrado clínicamente relevante(27). En caso de disfunción hepática moderada, el área bajo la curva para el tiempo de concentración plasmática está elevado en 1,09 veces para apixabán (comparado con rivaroxabán 2,27 veces). Por lo tanto, el apixabán puede ser administrado con precaución a pacientes con disfunción hepática leve a moderada o niveles de ALT o AST > 2 veces el límite superior de referencia(57). En Japón, el uso de edoxabán no ha sido restringido en pacientes con disfunción hepática, sin embargo se recomienda precaución en pacientes con disfunción hepática severa(57).
En resumen, es prudente monitorizar las enzimas hepáticas, bilirrubina y coagulación (aPTT, TP) previo a la prescripción a largo plazo de cualquier anticoagulante. La monitorización debe ser realizada de forma regular. Los cuatro NOAC pueden ser utilizados en presencia de disfunción hepática leve (Child-Pugh A), pero ninguno debería administrarse en pacientes con disfunción hepática severa (Child-Pugh C). Tanto dabigatrán como apixabán pueden ser administrados en pacientes con disfunción hepática moderada (Child-Pugh B) siempre que no exista un factor de riesgo de sangrado clínicamente relevante. No es necesaria una reducción de dosis para ninguno de los NOAC: pueden ser administrados con precaución extrema o deberían ser evitados (de preferencia) particularmente debido a que la disfunción hepática se asocia a coagulopatía(57) (ver tabla 6). En pacientes con síndrome hepato-renal los fármacos AVK evaluados mediante INR y la heparina de bajo peso molecular pueden ser administrados como tratamiento alternativo.
Triple terapia (en pacientes con FA no valvular y tratamiento con NOAC que se realizarán una intervención coronaria percutánea). La doble terapia antiplaquetaria (DTAP), en base a aspirina y un inhibidor de P2Y12, ha probado ser beneficiosa en pacientes con infarto de miocardio (IM) reciente o intervención coronaria percutánea (ICP)(60-62). La DTAP evita la trombosis del stent y reduce de forma significativa la tasa de IM, ACV y mortalidad(60-62). Sin embargo, está asociada también a un incremento en el riesgo hemorrágico en comparación con la terapia con un único antiplaquetario(60).
Aproximadamente 34% de los pacientes con FA no valvular tienen cardiopatía isquémica concomitante(63). La triple terapia (TT) está indicada con frecuencia en estos pacientes en la situación de un síndrome coronario agudo (SCA), sin embargo siempre debe considerarse que implica un riesgo incrementado de sangrado(28,64), como también fue reportado en el estudio WOEST (para AVK) y en el Registro Nacional de Dinamarca(65). La TT es compleja y representa un desafío al momento de balancear el riesgo de tromboembolismo, sangrado severo, trombosis del stent y eventos cardíacos mayores o recurrentes(66).
Solo pocos estudios han evaluado el uso de los NOAC como TT en pacientes con SCA(67-69). Estos estudios no son comparables debido a que utilizan definiciones diferentes (particularmente con respecto al sangrado) y las múltiples variables incluidas (variables del procedimiento, diferencia en edad, severidad de las comorbilidades y pacientes estables/inestables).
La información del mundo real ha mostrado que dabigatrán 110 mg, dos veces al día (en comparación con warfarina), está asociado con una disminución en la incidencia de sangrado gastrointestinal que se ve incrementado con la dosis de 150 mg dos veces al día(70,71). Sin embargo, ambas dosis de dabigatrán han sido asociadas a un aumento en la incidencia de IM en comparación con warfarina(43,72,73), a pesar de que esto puede ser atribuido al efecto cardioprotector de la warfarina(74). Dosis bajas de rivaroxabán, 2,5 mg dos veces al día (en combinación con terapia antiplaquetaria estándar) ha mostrado un perfil riesgo-beneficio positivo con una reducción significativa del punto final combinado de eficacia: muerte cardiovascular, IM y ACV en comparación con placebo(67), a pesar de que la tasa de sangrado mayor aumentó significativamente. Además, hubo una reducción significativa en la mortalidad cardiovascular y mortalidad por todas las causas(74).
El documento de consenso del Grupo de Trombosis de la Sociedad Europea de Cardiología, de la Asociación Europea del Ritmo Cardíaco y de la Asociación Europea de Intervenciones Cardiovasculares Percutáneas ha realizado recomendaciones específicas con respecto a la duración del tratamiento combinado antitrombótico y antiagregante único o doble de acuerdo al perfil de riesgo individual del paciente: riesgo de ACV, riesgo hemorrágico y el contexto clínico (intervención coronaria percutánea de coordinación o urgente)(66).
Actualmente existen ensayos clínicos en curso que exploran la utilización de NOAC en pacientes con FA no valvular sometidos a ICP, por ejemplo el estudio PIONEER AF-PCI (identificador de estudio clínico NCT01830543) y REDUAL-PCI (identificador de estudio clínico NCT02164864).
Síntomas de dispepsia. En el estudio RE-LY, los síntomas dispepsia símil fueron los únicos efectos adversos que se incrementaron de forma significativa en los pacientes tratados con dabigatrán en comparación con los controles. Fue reportado el doble de veces en sujetos que recibían dabigatrán (110 mg 11,8%, 150 mg 11,3% tasa total; independiente de dosis) en comparación con aquellos que recibían warfarina (tasa total 5,8%)(43). En el estudio RE-LY los síntomas dispepsia símil incluyeron dolor en hemiabdomen superior, malestar abdominal, malestar epigástrico y dispepsia(43). Los síntomas dispepsia símil fueron generalmente leves o moderados, con una mayor frecuencia con dabigatrán 110 mg(43). Estos derivaron en falta de adherencia y discontinuación de dabigatrán.
Una encuesta realizada por Choi y colaboradores encontró que los pacientes que utilizaban dabigatrán eran más susceptibles a experimentar síntomas gastrointestinales (indigestión, regurgitación, náuseas, dolor abdominal) en comparación con pacientes que utilizaban warfarina. Sin embargo, los usuarios de dabigatrán utilizaron medicación adicional para tratar estos síntomas y estaban afines a tolerar los efectos adversos basados en su percepción de alta eficacia y conveniencia del fármaco(79).
Un estudio de cohorte danés reciente encontró que en pacientes con FA no valvular, sin historia de enfermedad gastrointestinal, el inicio de dabigatrán no estaba asociado con incremento del riesgo de diagnóstico de dispepsia símil, sangrado gastrointestinal que requiriera hospitalización, uso posterior de IBP o gastroscopía en comparación con warfarina(80). Sin embargo, en pacientes sin anticoagulación previa, la dosis de dabigatrán 110 mg dos veces al día fue más frecuentemente prescrita con IBP en comparación con los pacientes tratados con warfarina. Los autores creyeron que “podría indicar un sesgo de selección debido a que los pacientes más susceptibles a efectos gastrointestinales adversos iniciaron dosis menores de dabigatrán para evitar síntomas, además de tener una edad mayor (80,0 ± 8,7 años), CHA2DS2-VASc score (3,6 ± 1,4 puntos), y score HAS-BLED (2,3 ± 1,0 punto), indicando una peor condición que los otros grupos”(80).
La dispepsia es poco frecuente con rivaroxabán, apixabán o edoxabán(43,47,53). Mientras que el dabigatrán se ingiere junto con la comida para reducir el riesgo de dispepsia, ribaroxabán se ingiere con alimentos para incrementar la absorción y biodisponibilidad(82).
En resumen, la dispepsia puede ocurrir en pacientes usuarios de dabigatrán, pero habitualmente es autolimitada, leve en intensidad y el tratamiento antiácido no afecta la eficacia de los NOAC.

Ancianos (edad ³ 75 años). La FA representa un problema significativo en los ancianos, siendo responsable del 23,5% de los ACV en individuos ³ 80 años(2). Afecta a < 2% de la población menor a 65 años y cerca del 10% de los pacientes mayores a 80 años(83). La edad ³75 en sí misma es considerada un factor de riesgo en los esquemas de estratificación de riesgo y contribuye con 2 puntos de un total de 9 en el score CHA2DS2-VASc, que incluye además la presencia de insuficiencia cardíaca, hipertensión, edad, diabetes mellitus, ACV/AIT/ETV, enfermedad vascular y sexo(84,85).
Sin embargo, el estudio de cohorte ATRIA encontró que los anticoagulantes en este grupo etario siguen estando subutilizados (35% en > 85 años comparado con 62% en < 74 años)(86). El estudio BAFTA (Birmingham Atrial Fibrillation Treatment of the Aged) fue uno de los pilares en establecer que la población anciana se beneficia tanto como los jóvenes del tratamiento con warfarina. Incluso entre los pacientes ancianos con FA, la anticoagulación con warfarina (ajustando dosis) fue superior a la aspirina para la prevención primaria de ACV, con reducciones significativas en las tasas totales de ACV, ACV no fatal incapacitante y ACV isquémico. Este estudio también reafirma los conceptos de eficacia y seguridad de la warfarina sin incremento en el riesgo de sangrado con la edad(87).
A pesar de la evidencia, el miedo al sangrado ha llevado frecuentemente a que no se indiquen anticoagulantes en pacientes ancianos(88). La población anciana tiene alta prevalencia de comorbilidades (como ser disfunción renal), bajo índice de masa corporal, polifarmacia (como aspirina y clopidogrel para mantener la permeabilidad del stent), caídas, hemorragia, deterioro cognitivo y pobre adherencia al tratamiento(89).
Los estudios RE-LY, ROCKET-AF, ARISTOTLE y ENGAGE AF-TIMI 48 contaron con un número representativo de pacientes con FA no valvular mayores a 70 años. Un metaanálisis reciente de estos estudios evaluando la eficacia y la seguridad de los NOAC en este subgrupo demostró la no inferioridad comparado con warfarina (ajustando dosis)(90) en la prevención de ACV y embolias sistémicas. En pacientes ³ 75 años en comparación con < 75 años, ninguno de los NOAC se asoció con un sangrado mayor significativo o clínicamente relevante en comparación con warfarina(90), y se redujo significativamente el riesgo de ACV y embolia sistémica. En el estudio RE-LY, en pacientes ³ 75 años, dabigatrán 150 mg demostró una mayor tasa de sangrados mayores, en particular hemorragias extracraneanas en comparación con warfarina(91), por lo que se recomienda utilizar la dosis de 110 mg en ancianos.
Corsonello y colaboradores(92) encontraron que la presencia de dosis diarias múltiples se asocian con menor adherencia a la medicación comparado con el número total de drogas y la edad. En este caso, rivaroxabán representa una opción atractiva al ser una droga con una única dosis diaria. Sin embargo, Vrijens y colaboradores encontraron que a pesar de que la dosis diaria única incrementa la adherencia en términos absolutos, la administración dos veces por día resulta más flexible en pacientes con adherencia subóptima(93). La presencia de una deglución adecuada también es un factor importante; solo rivaroxabán y apixabán pueden ser fraccionados y administrados por sonda gástrica. En pacientes que necesitan ayuda en la administración de la medicación, rivaroxabán y apixabán son las opciones preferidas debido a que no requieren ningún almacenamiento especial.
En resumen, la eficacia y la seguridad de todos los NOAC se mantiene en pacientes con edad avanzada; sin embargo, la decisión de indicarlos se basa en la presencia de comorbilidades, adherencia y preferencias personales. El menor número de interacciones farmacológicas y la dosis fija sin necesidad de monitorización de rutina hace que los NOAC hayan simplificado el tratamiento anticoagulante en los ancianos.
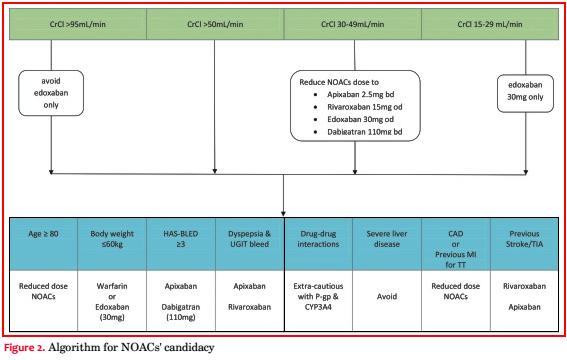
Ver tabla 7 para ajuste de dosis de los NOAC. Ver figura 2 para los algoritmos de selección de NOAC.
Conclusión
En pacientes con FA no valvular, por su perfil de seguridad y eficacia, los NOAC utilizados correctamente (y apropiadamente) tienen una clara ventaja sobre la warfarina en la prevención de ACV y embolia sistémica. Al momento de elegir un NOAC, tres aspectos deben ser evaluados: 1) el riesgo hemorrágico del paciente (score HAS-BLED ³ 3 se considera de alto riesgo de sangrado); 2) las características del paciente, y 3) las preferencias del paciente y su adherencia al tratamiento con NOAC. Los médicos pueden encontrar útil familiarizarse con un NOAC en particular, pero la elección tiene que ser individualizada de acuerdo a las características del paciente, con la participación de éste en el proceso de toma de decisiones.
1. Benjamin EJ, Wolf PA, D’Agostino RB, Silberhatz H, Kannel WB, Levy D. Impact of atrial fibrillation on the risk of death: The Framingham Heart Study. Circulation.1998;98(10):946-952
2. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke.1991;22(8):983–8.
3. Yiin GS, Howard DP, Paul NL, et al, on behalf of the Oxford Vascular Study. Age-specific incidence, outcome, cost, and projected future burden of atrial fibrillation-related embolic vascular events: A population-based study. Circulation 2014;130:1236- 44.
4. Lip GY. Stroke and bleeding risk assessment in atrial fibrillation: when, how and why? Eur Heart J 2013;34:1041-9.
5. Pisters R, Lane DA, Marin F et al. Stroke and thromboembolism in atrial fibrillation. Circ J 2012; 76:2289-304.
6. Camm AJ, et al. 2012 focused update of the ESC guidelines for the management of atrial fibrillation. An update of the 2010 ESC guidelines for the management of atrial fibrillation. Developed with the special contribution of the EUropean Heart Rhythm Association. Europace 2012;14(10):1385-413
7. Dentalli F, Riva N, Crowther M, Turpie AG, Lip GY, Ageno W. Efficacy and safety of the novel oral anticoagulants in atrial fibrillation: a systematic review and meta-analysis of the literature. Circulation 2012;126(20):2381-91.
8. Dogliotti A, Paolasso E, Giugliano RP. Novel oral anticoagulants in atrial fibrillation: a meta- analyses of large, randomized, controlled trials vs warfarin. Clin Cardiol 2013;36(2):61-7.
9. Lip GY. My approach to the use of NOACs for stroke prevention in patients with atrial fibrillation. Trends in Cardiovascular Medicine 2014;24(6):265-266
10. Lip GYH, Nielsen PB, Skjoth F, Rasmussen LH, Larsen TB. Atrial fibrillation patients categorised as “not for anticoagulation” with the 2014 Canadian Cardiovascular Society algorithm are not “low risk”. Can J Cardiol 2015;31:24-8.
11. Chao T-F, Liu C-J, Wang K-L, et al. Using the CHA2DS2-VASc score for refining stroke risk stratification in “low risk” Asian patients with atrial fibrillation. J Am Coll Cardiol 2014;64:1658-65.
12. Chen J-Y, Zhang A-D, Lu H-Y, Guo J, Wang F-F, Li Z-C. CHADS2 vs CHA2DS2-VASc score in assessing the stroke and thromboembolism risk stratification in patients with atrial fibrillation: a systematic review and meta-analysis. J Geriatr Cardiol 2013;10: 258-66.
13. Pugh RN, Murray-Lyon IM, Dawson JL, Pietroni MC, Williams R. Transection of the oesophagus for bleeding oesophageal varices. Br J Surg 1973; 60(8): 646-9.
14. Gallego P, Roldán V, Marin F, Gálvez J, Valdés M, Vicente V, et al. SAMe-TT2R2 score, time in therapeutic range, and outcomes in anticoagulated patients with atrial fibrillation. Am J Med 2014; 127: 1083-1088.
15. Abumuaileq RR, AbuAssi E, Raposeiras-Roubin S, López-López A, Redondo-Diéguez A, Álvarez-Iglesias D, et al. Evaluation of SAMe-TT2R2 risk score for predicting the quality of anticoagulation control in a real-world cohort of patients with non-valvular atrial fibrillation on vitamin-K antagonists. Europace2015. pii: euu353. [Epub ahead of print]
16. Lip GY, Haguenoer K,
17. Apostolakis S, Sullivan RM, Olshansky B, Lip GY. Factors affecting quality of anticoagulation control among patients with atrial fibrillation on warfarin: the SAMe-TT?R? score. Chest. 2013;144(5): 1555-63.
18. National Institute for Health and Care Excellence (NICE). Atrial Fibrillation: the management of atrial fibrillation. 2014;CG180. Available from: http://www.nice.org.uk/guidance/cg180/evidence/cg180-atrial-fibrillation-update-full-guideline3
19. Ogilvie IM, Newton N, Welner SA, Cowell W, Lip GY. Underuse of oral anticoagulants in atrial fibrillation: a systematic review. Am J Med 2010;123638-645.e4.
20. Wallentin L, Yusuf S, Ezekowitz MD, Alings M, Flather M, Franzosi MG, et al; RE-LY investigators. Efficacy and safety of dabigatran compared with warfarin at different levels of international normalised ratio control for stroke prevention in atrial fibrillation: an analysis of the RE-LY trial. Lancet. 2010;376(9745):975-83.
21. Eikelboom JW, Weitz JI. New anticoagulants. Circulation 2010;121:1523-32
22. Shapiro LE,
23. Hashimoto H, Toide K, Kitamura R, Fujita M, Tagawa S, Itoh S, Kamataki T. Gene structure of CYP3A4, an adult-specific form of cytochrome P450 in human livers, and its transcriptional control. Eur. J. Biochem 1993. 218 (2): 585–95
24. Stöllberger C, Finsterer J. Relevance of P-glycoprotein in stroke prevention with dabigatran, rivaroxaban, and apixaban. Herz 2015;40(2):140-145
25. Eliquis (Apixaban) tablets for oral use. Full Prescribing Information. Princeton and Pfizer Inc,
26. SAVAYSATM (edoxaban) tablets for oral use Full Prescribing Information. Parsippany: Daiichi Sankyo Inc; 2015.
27. XARELTO ®(rivaroxaban) tablets. Full prescribing information.Titusville: Janssen Phar5uticals; 2014.
28. Heidbuchel H, Verhamme P, Alings M, Antz M, Hacke W, Oldgren J, Sinnaeve P, Camm AJ, Kirchhof P. European Heart Rhythm Association Practical Guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation. Europace 2013;15(5):625-651.
29. Scaglione F. New oral anticoagulants: Comparative pharmacology with vitamin K antagonists. Clin Pharmacokinet 2013;52:69-82.
30. PRADAXA® (dabigatran etexilate mesylate) Full Prescribing Information.
31. Gnoth MJ, Buetehorn U, Muenster U, et al. In vitro and in vivo P-glycoprotein transport characteristics of rivaroxaban. J Pharmacol Exp Ther 2011; 338:372-380.
32. Frost C, Wang J, Nepal S, et al. Effect of ketoconazole and diltiazem on the pharmacokinetics of apixaban, an oral direct factor Xa inhibitor. J Clin Pharmacol. 2009;49:1091–1130. Abstract.
33. Mueck W, Kubitza D, Becka M. Co-administration of rivaroxaban with drugs that share its elimination pathways: pharmacokinetic effects in healthy subjects. Br J Clin Pharmacol 2013;76:455-66
34. Douketis JD. Pharmacologic properties of the new oral anticoagulants: a clinician-oriented review with a focus on perioperative management. Curr Pharm Des 2010;16:3436–3441
35. Olesen JB, Lip GYH, Kamper A-L, Hommel K, Kober L, Lane DA, Lindhardsen J, Gislason GH, Torp-Pedersen C. Stroke and bleeding in atrial fibrillation with chronic kidney disease. N Engl J Med 2012;367: 625-635.
36. Hohnloser SH, Hijazi Z, Thomas L, Alexander JH, Amerena J, Hanna M, et al. Efficacy of apixaban when compared with warfarin in relation to renal function in patients with atrial fibrillation: insights from the ARISTOTLE trial. Eur Heart J 2012;33:2821 – 2830
37. Piccini JP, Stevens SR, Chang Y, Singer DE, Lokhnygina Y, Go AS, et al. Renal dysfunction as a predictor of stroke and systemic embolism in patients with nonvalvular atrial fibrillation: validation of the R2CHADS2 Index in the ROCKET AF (Rivaroxaban Once-daily, oral, direct factor Xa inhibition compared with vitamin K ntagonism for prevention of stroke and embolism trial in atrial fibrillation) and ATRIA (AnTicoagulation and Risk factors In Atrial fibrillation) study cohorts. Circulation 2013;127:224 – 232.
38. Camm AJ,
39. Stangier J, Rathgen K, Stahle H, Gansser D, Roth W. The pharmacokinetics, pharmacodynamics and tolerability of dabigatran etexilate, a new oral direct thrombin inhibitor, in healthy malesubjects. Br J Clin Pharmacol 2007;64(3):292-303
40. Stangier J, Rathgen K, Stahle H, Mazur D. Influence of renal impairment on the pharmacokinetics and pharmacodynamics of oral dabigatran etexilate: an open-label, parallel-group, single-centre study. Clinical pharmacokinet 2010;49(4):259-268
41. Weinz C, Schwarz T, Kubitza D, Mueck W, Lang D. Metabolism and excretion of rivaroxaban, an oral, direct factor Xa inhibitor, in rats, dogs and humans. Drug Metab Dispos. 2009;37(5):1056-1064
42. Raghavan N, Frost CE, Yu Z, He K, Zhang H, Humphreys WG, et al. Apixaban metabolism and pharmacokinetics after oral administration to human. Drug metab dispos:biol fate chem. 2009; 37(1):74-81
43. Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009;361(12): 1139-1151
44. Beasley BN, Unger EF, Temple R. Anticoagulant options -why the FDA approved a higher but not a lower dose of dabigatran. N.Engl J Med 2011;364:1788- 1790
45. Lehr T, Haertter S, Liesenfeld KH, Staab A, Clemens A, Reilly PA, Friedman J. Dabigatran etexilate in atrial fibrillation patients with severe renal impairment: dose identification using pharmacokinetic modelling and simulation. J Clin Pharmacol 2012;52(9):1373-1378
46. Fox KA, Piccini JP, Wojdyla D, Becker RC, Halperin JL, Nessel CC, et al. Prevention of stroke and systemic embolism with rivaroxaban compared with warfarin patients with non-valvular atrial fibrillation and moderate renal impairment. Eur Heart J 2011;32:2387-2394
47. Granger CB, Alexander JH, McMurray JJV et al. Apixaban versus warfarin in patients with atrial fibrillation.
48. Giugliano RP, Ruff CT, Braunwald E, Murphy SA, Wiviott SD, Halperin JL et al. Edoxaban versus warfarin in patients with atrial fibrillation.
49. The Hokusai-VTE investigators. Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism. N Engl J Med 2013; 369:1406-15.
50. Hohnloser SH, Hijazi Z, Thomas L, Alexander JH, Amerena J, Hanna H, et al. Efficacy of apixaban when compared with warfarin in relation to renal function in patients with atrial fibrillation: Insights from the ARISTOTLE trial. Eur Heart J 2012;33(22):2821-30.
51. FDA. Guidance for industry: pharmacokinetics in patients with impaired hepatic function: study design, data analysis, and impact on dosing and labelling. 2003.
52. EMEA. Guideline on the evaluation of the pharmacokinetics of medicinal products in patients with impaired hepatic function. 2005.
53. Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011;365:883- 891
54. The EINSTEIN Investigators. Oral rivaroxaban for symptomatic venous thromboembolism. N Engl J Med. 2010;363(26):2499–510.
55. The EINSTEIN-PE Investigators. Oral rivaroxaban for the treatment of symptomatic pulmonary embolism. N Engl J Med. 2012;366(14):1287–97.
56. Stangier J, Stahle H, Rathgen K, Roth W, Shakeri-Nejad K. Phamacokinetics and pharmacodynamics of dabigatran etexilate, an oral direct thrombin inhibitor, are not affected by moderate hepatic impairment. J Clin Pharmacol 2008;48(12):1411- 1419
57. Graff J, Harder S. Anticoagulant therapy with the oral direct Factor Xa inhibitors rivaroxaban, apixaban and edoxaban and the thrombin inhibitor dabigatran etexilate in patients with hepatic impairment. Clin Pharmacokinet 2013;52:243-54.
58. Kubitza D, Roth A, Becka M, et al. Effect of hepatic impairment on the pharmacokinetics and pharmacodynamics of a single dose of rivaroxaban -an oral, direct Factor Xa inhibitor. Br J Clin Pharmacol 2013;76:89-98.
59. Randhawa J, Thiruchelvam N, Ghobrial M, Spiro T, Clark B, Haddad A, et al. Practical recommendations on incorporating new oral anticoagulants into routine practice. Clinical Advances in Hematology & Oncology 2014;12(10):675-683.
60. Yusuf S, Zhao F, Mehta SR, Chrolavius S, Tognoni G, Fox KK. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med 2001;345: 494–502.
61. Wallentin L, Becker RC, Budaj A, Cannon CP, Emanuelsson H, Held C, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2009; 361:1045-57.
62. Wiviott SD, Braunwald E, McCabe CH, Montalescot G, Ruzyllo W, Gottlieb S, et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2007; 357:2001-15.
63. Kralev S, Schneider K, Lang S, Süselbeck T, Borggrefe M. Incidence and Severity of Coronary Artery Disease in Patients with Atrial Fibrillation Undergoing First-Time Coronary Angiography. PLoS One 2011;6:e24964
64. Lamberts M, Olesen JB, Ruwald MH et al. Bleeding after initiation of multiple antithrombotic drugs, including triple therapy, in atrial fibrillation patients following myocardial infarction and coronary intervention: a nationwide cohort study. Circulation 2012;126:1185.
65. Lamberts M, Gislason GH, Olesen JB, Kristensen SL, Schjerning Olsen AM, Mikkelsen A, et al. Oral anticoagulation and antiplatelets in atrial fibrillation patients after myocardial infarction and coronary intervention. J Am Coll Cardiol 2013;62: 981-989.
66. Lip GYH, Windecker S, Huber K, Kirchhof P, Marin F, Ten Berg JM, et al. Management of antithrombotic therapy in atrial fibrillation patients presenting with acute coronary syndrome and/or undergoing percutaneous coronary or valve interventions: a joint consensus document of the European Society of Cardiology Working Group on Thrombosis, European Heart Rhythm Association (EHRA), European Association of Percutaneous Cardiovascular Interventions (EAPCI) and European Association of Acute Cardiac Care (ACCA) endorsed by the Heart Rhythm Society (HRS) and Asia-Pacific Heart Rhythm Society (APHRS). European Heart Journal 2014;35:3155- 3179
67. Mega JL, Braunwald E, Wiviott SD, Bassand JP, Bhatt DL, Bode C, et al. Rivaroxaban in patients with a recent acute coronary syndrome. N Engl J Med. 2012; 366:9-19.
68. Alexander JH,
69. Oldgren J, Budaj A, Granger CB, Khder Y, Roberts J, Siegbahn A, et al. Dabigatran vs. placebo in patients with acute coronary syndromes on dual antiplatelet therapy: a randomized, double-blind, phase II trial. Eur Heart J. 2011; 32:2781-9.
70. Larsen TB, Rasmussen LH, Skjoth F et al. Efficacy and safety of dabigatran etexilate and warfarin in ‘real-world’ patients with atrial fibrillation: a prospective nationwide cohort study. J Am Coll Cardiol 2013;61(22):2264-2273
71. Graham DJ, Reichman ME, Wernecke M et al. Cardiovascular, bleeding, and mortality risks in elderly Medicare patients treated with dabigatran or warfarin for non-valvular atrial fibrillation. Circulation 2015;131:157-164.
72. Hornloser S, Oldgren J, Yang S et al. Myocardial ischemic events in patients with atrial fibrillation treated with dabigatran or warfarin in the RE-LY (Randomized evaluation of long-term anticoagulation therapy) trial. Circulation 2012;125:669-76
73. Uchino K, Hernandez AV. Dabigatran association with higher risk of acute coronary events. Meta-analysis of noninferiority randomized controlled trials. Arch Intern Med 2012;172:397-402.
74. Verheugt FW. Long-term oral anticoagulation in patients with coronary disease, and future developments. Curr Opin Cardiol 2008;23:315-319.
75. Marco Roffi, Carlo Patrono, Jean-Philippe Collet, Christian Mueller, Marco Valgimigli, Felicita Andreotti, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. European Heart Journal 2015; DOI:10.1093/eurheartj/ ehv320
76. Nieuwlaat R, Healey JS, Ezekowitz M, Reilly P, Formella S, Wallentin L, Yusuf S, Connolly S. Management of dyspepsia symptoms on dabigatran during RELY-ABLE: long-term follow up study after RE-LY. Arryhthmias-Pacing-Resynchronisation. 2013;102(p549) Abstract
77. Wolfgang G. Eisert, Norbert Hauel, Joachim Stangier, Wolfgang Wienen, Andreas Clemens, Joanne van Ryn. Dabigatran: An Oral Novel Potent Reversible Nonpeptide Inhibitor of Thrombin. Arteriosclerosis, Thrombosis, and Vascular Biology. 2010; 30: 1885-1889
78. Stangier J, Stahle H, Rathgen K, Fuhr R. Pharmacokinetics and pharmacodynamics of the direct oral thrombin inhibitor dabigatran in healthy elderly subjects. Clin Pharmacokinet 2008;47:47-59.
79. Choi JC,
80. Staerk L, Gislason GH, Lip GY, Fosbøl EL, Hansen ML, Lamberts M, Bonde AN, Torp-Pedersen C, Olesen JB. Risk of gastrointestinal adverse effects of dabigatran compared with warfarin among patients with atrial fibrillation: a nationwide cohort study. Europace 2015; pii: euv119. [Epub ahead of print]
81. Bytzer P, Connoly SJ, Yang S, Ezekowitz M, Formella S, Reilly PA, et al. Analysis of upper gastrointestinal adverse events among patients given dabigatran in RE-LY trial. Clin Gastroenterol Hepatol 2013;11(3):246-52.
82. Stampfuss J, Kubitza D, Becka M, Mueck W. The effect of food on the absorption and pharmacokinetics of rivaroxaban. Int J Clin Pharmacol Ther 2013;51(7):549-61.
83. Go AS, Hylek EM, Phillips KA, et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA. 2001;285: 2370–2375
84. Lip GY, Halperin JL. Improving stroke risk stratification in atrial fibrillation. Am J Med 2010;123: 484–488.
85. Lip GY, Nieuwlaat R, Pisters R et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: The Euro Heart Survey on Atrial Fibrillation. Chest 2010;137:263–272.
86. Go AS, Hylek EM, Borowsky LH, Phillips KA, Selby JV, Singer DE. Warfarin use among ambulatory patients with non-valvular atrial fibrillation: the anticoagulation and risk factors in atrial fibrillation (ATRIA) study. Ann Intern Med. 1999;131(12): 927-934.
87. Mant J, Hobbs R, Fitzmaurice D, et al for the BAFTA trialists. BAFTA: A randomised controlled trial of warfarin versus aspirin for stroke prevention in atrial fibrillation in a primary care population aged over 75. 16th European Stroke Conference; May 29-June 1, 2007:
88. Marinigh R, Lip GY, Fiotti N, Giansante C, Lane DA. Age as a risk factor for stroke in atrial fibrillation patients: implications for thromboprophylaxis. J AM Coll Cardiol 2010;56:827-37.
89. Hylek EM, D’Antonio J, Evans-Molina C, et al. Translating the results of randomized trials into clinical practice: the challenge of warfarin candidacy among hospitalized elderly patients with atrial fibrillation. Stroke. 2006;37:1075–1080.
90. Ruff CT, Giugliano RP, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet. 2014;383(9921):955–62
91. Eikelboom JW, Wallentin L, Connolly SJ et al. Risk of bleeding with 2 doses of dabigatran compared with warfarin in older and younger patients with atrial fibrillation: an analysis of the randomized evaluation of long-term anticoagulation therapy (RE-LY) trial. Circulation 2011;123:2362-72.
92. Corsonello A, Pedone C, Lattanzio F, Lucchetti M, Garasto S, Carbone C, et al. Regimen complexity and medication nonadherence in elderly patients. Ther Clin Risk Manag. 2009;5(1):209-216.
93. Vrijens B, Heidbuchel H. Non-vitamin K oral anticoagulants: considerations on once- vs. twice-daily regimens and their potential impact on medication adherence. Europace. 2015;17:514-523.