Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
Print version ISSN 0797-0048On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.30 no.3 Montevideo Dec. 2015
FIBRILACIÓN AURICULAR
Artículo de revisión
Enfermedad vascular cerebral y fibrilación auricular no valvular
Dres. Carlos Cantú-Brito, Fernando Flores Silva
Departamento de Neurología, Curso de Posgrado de Alta Especialidad en Enfermedad Vascular Cerebral. Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán. México.
Palabras clave:
ACCIDENTE CEREBROVASCULAR / terapia farmacológica
FIBRILACIÓN ATRIAL
INFARTO CEREBRAL / terapia farmacológica
Key words:
ATRIAL FIBRILLATION
CEREBRAL INFARCTION / drug therapy
STROKE / drug therapy
Epidemiología
La fibrilación auricular (FA) es la arritmia sostenida más frecuente en la práctica clínica, la incidencia estimada es de 570 en hombres y de 360 en mujeres por cada 100.000 habitantes, estimándose en 5 millones los casos nuevos por año en el mundo(1).
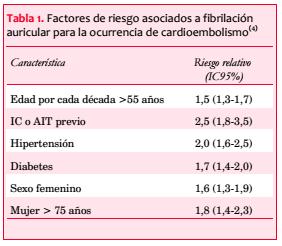
La complicación más grave de la FA es el cardioembolismo cerebral, que es responsable de 20% a 25% de los casos de infarto cerebral (IC) y su mortalidad es mayor a cualquier tipo de IC, alcanzando hasta el 40%, la mitad de ellos en el primer mes(2). El riesgo para la ocurrencia de un IC en presencia de FA no valvular es cuatro veces mayor comparado con sujetos sin FA, elevándose hasta 20% para la FA valvular(3). El riesgo se incrementa con la edad, en los pacientes mayores de 80 años que desarrollan IC se llega a detectar FA hasta en el 50% de los casos. El riesgo atribuible a la FA como causa de IC alcanza el 20% en este grupo de edad, riesgo similar al producido por la hipertensión arterial.
Los riesgos para la ocurrencia de IC en pacientes con FA asociados a otros factores se presentan en la tabla 1(4).
El riesgo de recurrencia de IC es de 12% por año en pacientes no tratados luego del primer IC, con base en la recurrencia en el grupo control de los grandes ensayos aleatorizados. Este riesgo es más alto en las primeras semanas, siendo cercano a 8% en estudios recientes. La recurrencia de eventos cerebrovasculares en pacientes que ya han sufrido un primer IC en general se asocia a eventos de mayor extensión y gravedad.
Manifestaciones clínicas
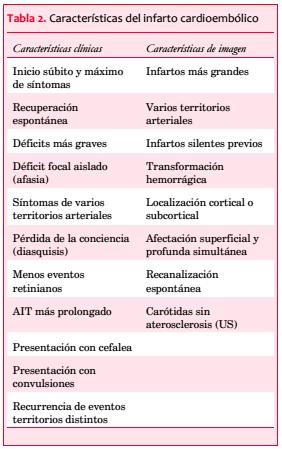
Los datos clínicos dependen de la arteria afectada por el IC, sin embargo existen algunos datos que sugieren el mecanismo embólico asociado a una fuente cardíaca.
Estos datos se resumen en la tabla 2.
Estrategias de diagnóstico
Sabiendo que la FA es responsable del 20% a 25% de los casos de un IC, la demostración de la arritmia es el principal factor relacionado con el inicio de la anticoagulación oral dado que la sola ocurrencia de un IC da un riesgo elevado de recurrencia en las escalas CHADS2 y CHA2DS2VASc.
La detección de la FA por un ECG al momento de un IC ocurre en 6,7% de los casos, elevándose con un Holter de 24 horas a 10,6% y con un monitoreo de siete días hasta en 16,4%(5). Una vez completada la evaluación de un IC es frecuente que no exista una etiología definida del mismo término, al cual se ha llamado IC criptogénico.
Se considera que el IC criptogénico ocurre en 30% a 40% de los IC(6). En este subtipo de infartos se han realizado estrategias para la detección de FA con dispositivos de monitorización prolongada, el rendimiento diagnóstico de estos dispositivos han alcanzado 15% con un dispositivo externo a un mes de monitoreo y hasta 30% con un dispositivo implantable con registro de tres meses a tres años (7-9).
Existen, como se ha mencionado, características clínicas y de imagen que sugieren la etiología embólica de un IC pese a que no se pueda detectar FA al momento de su ocurrencia. Esta observación clínica aunada a las dificultades en la práctica cotidiana del monitoreo prolongado para la detección de FA han contribuido a un nuevo constructo denominado ESUS (embolic stroke of undetermined source, infarto embólico de fuente no determinada); este término aún es debatido acerca de su utilidad clínica o para la toma de decisiones en cuanto al tratamiento.
Escalas de riesgo
Una vez que se ha documentado la FA con o sin IC la decisión terapéutica responde a las preguntas: cuál es el riesgo de embolismo sistémico y cuál es el riesgo de hemorragia en caso de anticoagulación.
Para responder a estas interrogantes se han desarrollado escalas de predicción de riesgo de embolismo sistémico CHADS2 y CHA2DS2VASc, así como riesgo de hemorragia por uso de anticoagulación oral HAS-BLED. Los riesgos de cada una se resumen en la tabla 3(10,11).
Todo paciente en quien ha ocurrido un IC atribuible a FA se considera de alto riesgo de recurrencia independientemente de los otros factores, de tal forma que en todas las estratificaciones de riesgo de pacientes con FA no valvular se ha considerado el IC previo como uno de los más serios predictores de eventos embólicos recurrentes. Esto ha sido descrito desde los primeros ensayos clínicos con antagonistas de la vitamina K en la década de 1990, como en la descripción de los puntajes de riesgo más recientes derivados del registro norteamericano ATRIA, CHADS2, y del Euro Heart Survey, CHA2DS2VASc.
Terapia anticoagulante oral
El alto riesgo de recurrencia y gravedad clínica es la base de la indicación de anticoagulación oral (ACO) por tiempo indefinido en estos pacientes. La anticoagulación reduce el riesgo de ocurrencia y recurrencia de IC asociado a la presencia de FA, la reducción de riesgo global es aproximadamente de 64% con el uso de warfarina independientemente del riesgo basal(12). Además de la reducción del riesgo de embolismo sistémico existe evidencia de que la warfarina se asocia, cuando ocurre, a IC con menor mortalidad a 30 días.
Existe un beneficio clínico neto que se traduce en indicación por diversas guías de práctica clínica de iniciar anticoagulación oral en todo paciente con CHA2DS2VASc ³ 2. Por otro lado, el uso de antiagregantes plaquetarios en monoterapia o terapia dual no se sustenta al día de hoy, independientemente de los scores de riesgo, dados los resultados poco relevantes o contradictorios cuando se le compara con placebo en la prevención de embolismo sistémico y la ocurrencia de hemorragia(13,14).
· Para pacientes con CHA2DS2-VASc ³1 se recomienda el inicio de anticoagulación oral.
· Para pacientes con CHA2DS2-VASc = 0 no se recomienda la anticoagulación.
· En pacientes con diagnóstico nuevo de FA no valvular que se considere inicio de ACO se recomienda los inhibidores directos de trombina o inhibidores de factor Xa.
· En pacientes con FA documentada y manejo de antagonista de la vitamina K con buen control de INR no se recomienda cambio a NOACs.
· Pacientes con diagnóstico nuevo de FA no valvular y dificultades para cumplir tratamiento con NOACs iniciar con antagonista de vitamina K.
· Pacientes con tasa de filtrado glomerular menor a 30 ml/min deberán usar antagonistas de vitamina K.
· Pacientes con contraindicación para NOACs, como el uso de antiepilépticos inductores enzimáticos o terapia antirretroviral con inhibidores de proteasa, deberán usar antagonista de vitamina K.
· Solo aquellos pacientes que no puedan usar un ACO por otra razón distinta al riesgo de hemorragia podrían usar doble antiagregación plaquetaria.
Manejo del infarto cerebral y fibrilación auricular en situaciones especiales
Existen varias situaciones clínicas en pacientes que desarrollan IC asociado a FA que resultan complejas de manejar y representan un desafío para el clínico, particularmente temas relacionados con el uso de ACO y enfermedad cerebrovascular incluyendo la toma de decisiones sobre el uso de trombolisis en el paciente que está recibiendo ACO y desarrolla infarto agudo cerebral, el manejo de la hemorragia intracerebral asociada al uso de ACO, así como cuándo iniciar o reiniciar (en caso de que la estuviera recibiendo) la ACO en pacientes que desarrollan IC asociado a FA. A continuación se analizan estas distintas situaciones clínicas.
Utilización de trombolíticos en el paciente bajo tratamiento con ACO que desarrolla infarto cerebral agudo
La reperfusión del vaso ocluido es el tratamiento más eficaz en pacientes con IC agudo que arriban al hospital en la ventana terapéutica (primeras hasta 4,5 horas para trombolisis intravenosa y hasta 6 horas para reperfusión invasiva). Sin embargo, la decisión de reperfusión se complica en estos pacientes por el alto riesgo de sangrado, considerando la dificultad para revertir el efecto anticoagulante en forma inmediata y que para los NOA’s no se cuenta con monitoreo de laboratorio, ni antídotos específicos para revertir el efecto anticoagulante.
Para estos pacientes que están recibiendo anticoagulación oral se presentan los siguientes escenarios de manejo(19-21):
- En los pacientes que reciben AVK y tienen INR menor de 1,7 no existe riesgo de sangrado y pueden someterse a trombolisis intravenosa.
- En los pacientes que reciben AVK y tienen INR mayor de 1,7 no es posible indicar trombolisis intravenosa y debe considerarse el uso de reperfusión invasiva mediante cateterismo y trombectomía.
- En los pacientes que reciben NOA’s y se conoce la hora de la última toma del anticoagulante podría considerarse la trombolisis intravenosa si han pasado más de 48 horas; es decir, que el paciente hubiera omitido las últimas tomas del nuevo anticoagulante.
- En los pacientes que reciben NOA’s y se desconoce la hora de la última toma del anticoagulante solo puede considerarse el uso de la reperfusión invasiva mediante trombectomía.
Inicio o reinicio de anticoagulación oral en el paciente con fibrilación auricular que ha desarrollado infarto cerebral agudo o isquemia cerebral transitoria
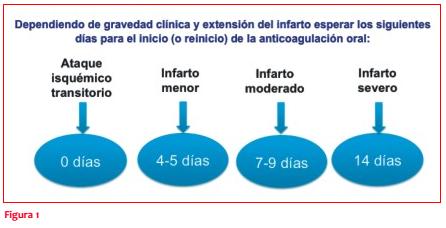
No existen estudios que permitan establecer con certeza el inicio o reinicio (en caso de que la estuviera recibiendo) de la ACO en pacientes que desarrollan IC agudo o isquemia cerebral transitoria asociada a la FA no valvular. La única evidencia indica que no debe iniciarse antes del cuarto día por el riesgo de transformación hemorrágica del IC, y no debe retrasarse después de 14 días por el riesgo de recurrencia temprana de IC(22). De acuerdo a opiniones de expertos en EVC, puede seguirse la siguiente regla de acuerdo a la gravedad clínica y extensión del IC(23,24). En todos los casos debe considerarse realizar tomografía computada cerebral de seguimiento (después de las 72 horas del evento agudo) que descarte transformación hemorrágica del infarto antes del inicio o reinicio de la anticoagulación oral (figura 1).
Conducta a adoptar en el paciente bajo tratamiento con ACO que desarrolla hemorragia intracerebral
Para la hemorragia intracerebral (HIC) asociada a los antagonistas de la vitamina K se sugiere seguir los principios NIKE descritos en la tabla 5(25).
La conducta terapéutica incluye la aplicación inicial de vitamina K endovenosa, a pesar de que su efecto sea lento y tarde algunos días, ya que permite estabilizar la normalización del INR evitando elevaciones de rebote tardías. Se administra conjuntamente con concentrados de complejo protrombínico (CCP) sobre plasma fresco congelado.
El manejo de la HIC con los NOA’s es más complejo(26,27). Con los NOA’s se debe evaluar el uso de carbón activado en las primeras dos horas de la última toma para dabigatrán así como la hemodiálisis; también debe considerarse el CCP activado (FEIBA a dosis de 80 U/kg). Por otra parte, para rivaroxabán o apixabán debe evaluarse el uso del factor -4 del CCP en dosis de 50 U/kg.
Se encuentran en progreso ensayos clínicos con antídotos para los NOA’s, incluyendo idarucizumab para dabigatrán, andexanet para los inhibidores del factor X (rivaroxabán y apixabán) y aripazine como antídoto universal. Hasta ahora dabigatrán es el que tiene el desarrollo más prometedor, demostrándose la capacidad de revertir el efecto anticoaguante en alrededor de 5 minutos(28).
Bibliografía
1. Chugh SS, Havmoeller R, Narayanan K, Singh D, Rienstra M, Benjamin EJ, et al. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation. 2014;129(8):837- 47.
2. Cantú-Brito C, Ruiz Sandoval JL, Murillo-Bonilla LM, Chiquete E, León-Jiménez C, Arauz A, et al. Acute care and one-year outcome of Mexican patients with first-ever acute ischaemic stroke: the PREMIER study. Rev Neurol 2010; 51(11):641-9.
3. Wolf P, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke. The
4. Stroke Risk in Atrial Fibrillation Working Group. Independent predictors of stroke in patients with atrial fibrillation. A systematic review. Neurology 2007 Aug 7;69(6):546-54.
5. Jabaudon D, Sztajzel J. Usefulness of ambulatory 7-day ECG monitoring for the detection of atrial fibrillation and flutter after acute stroke and transient ischemic attack. Stroke 2004;35:1647-51.
6. Kolominsky-Rabas PL, Weber M, Gefeller O, Neundoerfer B, Heuschmann PU. Epidemiology of ischemic stroke subtype saccording to TOAST criteria: incidence, recurrence, and long-term survival in ischemic stroke subtypes: a population-based study. Stroke 2001;32(12):2735-40.
7. Gladstone DJ, Spring M, Dorian P, Panzov V, Thorpe KE, Hall J, et al. Atrial fibrillation in patients with cryptogenic stroke. N Engl J Med 2014; 370(26):2467-77.
8. Sanna T, Diener HC, Passman RS, Di Lazzaro V, Bernstein RA, Morillo CA, et al. Cryptogenicstroke and underlying atrial fibrillation. N Engl J Med 2014; 370(26):2478-86.
9. Dussault C, Toeg H, Nathan M, Wang ZJ, Roux JF, Secemsky E. Electrocardiographic monitoring for detecting atrial fibrillation after ischemic stroke or transient ischemic attack: systematic review and meta-analysis. Circ Arrhythm Electrophysiol 2015; 8(2):263-9.
10. Friberg L, Rosenqvist M, Lip GY. Evaluation of risks tratification schemes for ischaemic stroke and bleeding in 182 678 patients with atrial fibrillation: the Swedish Atrial Fibrillation cohort study. Eur Heart J 2012; 33(12):1500-10.
11. Pisters R, Lane DA, Nieuwlaat R, de Vos CB, Crijns HJ, Lip GY. A novel user-friendly score (HAS-BLED) toassess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest 2010;138(5):1093-100.
12. Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who havenon valvular atrial fibrillation. Ann Intern Med 2007;146(12):857-67.
13. Själander S, Själander A, Svensson PJ, Friberg L. Atrial fibrillation patients do not benefit from acetyl salicylicacid. Europace 2014;16(5):631-8.
14. Connolly SJ, Eikelboom JW, Ng J, Hirsh J, Yusuf S, Pogue J, et al. Net clinical benefit of adding clopidogrel to aspirin therapy in patients with atrial fibrillation for whom vitamin K antagonists are unsuitable. Ann Intern Med 2011;155(9):579-86.
15. Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361(12):1139-51.
16. Patel MR, Mahaffey KE, Garg J, Pan G, Singer DE, Hacke W, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation; N Engl J Med 2011; 365(10):883-91.
17. Granger CB, Alexander JH, McMurray JJV, Lopes RD, Hylek EM, Hanna M, et al. Apixaban versus warfarin in patientswith atrial fibrillation. N Engl J Med 2011; 365(11):981-92.
18. Giugliano RP, Ruff CT, Braunwald E, Murphy SA, Wiviott SD, Halperin JL, et al. Edoxaban versus Warfarin in Patientswith Atrial Fibrillation. N Engl J Med 2013;369(22):2093-104.
19. Mazya MV, Lees KR, Markus R, Roine RO, Seet RC, Wahlgren N, et al. Safety of intravenous thrombolysis in ischemic stroke in patients treated with warfarin. Ann Neurol. 2013;74(2): 266-74.
20. Diener H-C, Foerch C, Riess H, Röther J, Schroth G, Weber R. Treatment of acute ischaemic stroke with thrombolysis orthombectomy in patients receiving antithrombotic treatment. Lancet Neurol 2013;12:677-88.
21. Hankey GJ, Norrving B, Hacke W, Steiner Th. Management of acutestroke in patientstaking novel oral anticoagulants. Int J Stroke 2014; 9:627–32.
22. Paciaroni M, Agnelli G, Falocci N, Caso V, Becattini C, Marcheselli S, et al. Early recurrence and cerebral bleeding in patients with acute ischemic stroke and atrial fibrillation: effect of anticoagulation and its timing: The RAF Study. Stroke 2015; 46(8):2175-82.
23. Hankey GJ, Norrving B, Hacke W, Steiner Th. Management of acute stroke in patients taking novel oral anticoagulants. Int J Stroke 2014;9: 627–632.
24. McGrath ER, Eikelboom JW, Kapral MK, O’Donnell MJ. Novel oral anticoagulants: a focused review for stroke physicians. Int J Stroke 2014;9:71-8.
25. Staykov D, Huttner HB, Köhrmann M, Bardutzky J, Schellinger PD. Novel approach esto the treatment of intracerebral haemorrhage. Int J Stroke 2010; 5: 457-65.
26. Siegal D, Crowther M. Acute management of bleeding in patients on novel oral anticoagulants. Eur Heart J 2013;34: 489-498
27. Crowther M, Crowther MA. Antidotes for novel oral anticoagulants: current status and future potential. Arterioscler Thromb Vasc Biol 2015; 35(8): 1736-45.
28. Pollack CV Jr, Reilly PA, Eikelboom J, Glund S, Verhamme P, Bernstein RA, et al. Idarucizumab for Dabigatran Reversal. N Engl J Med 2015; 373(6):511-20.