Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
Print version ISSN 0797-0048On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.30 no.3 Montevideo Dec. 2015
Artículo original
La enfermedad vascular carotídea como marcador de isquemia inducible en pacientes asintomáticos con múltiples factores de riesgo
Dres. Víctor Martire1,2, María Victoria Martire1,2, Emilio Pis Diez1,
Daniel Portillo1, Sergio Perelstein1
1. Instituto Médico Platense.
2. Ciencia y Tecnología en Imágenes. La Plata, Buenos Aires, Argentina.
Los autores no poseen conflictos de intereses que declarar respecto de esta publicación.
Correspondencia: Dr. Víctor Daniel Martire. Calle 55 Nº 480, La Plata (1900). Buenos Aires, Argentina.
Correo electrónico: vmartire@netverk.com.ar
Recibido mayo 12, 2105; aceptado octubre 13, 2015.
Resumen
Antecedentes: está bien establecido el valor como marcador de riesgo para eventos cardiovasculares a largo plazo del engrosamiento de íntima media carotídeo (EIM) y la correlación entre las placas carotídeas (PC) y la anatomía coronaria (SYNTAX score). Existe escasa evidencia sobre la incidencia de isquemia miocárdica en función de los diferentes grados de severidad de la enfermedad vascular carotídea (EVC).
Objetivo: evaluar la incidencia y la severidad de la isquemia miocárdica inducible en pacientes con diferentes grados de EVC, utilizando los datos cuantificados del eco Doppler carotídeo (EDC) y del estudio funcional de perfusión miocárdica con radioisótopos (SPECT).
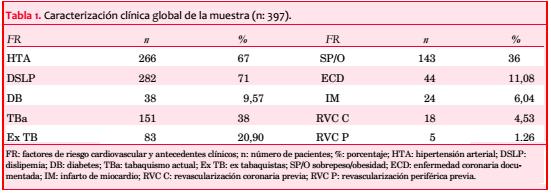
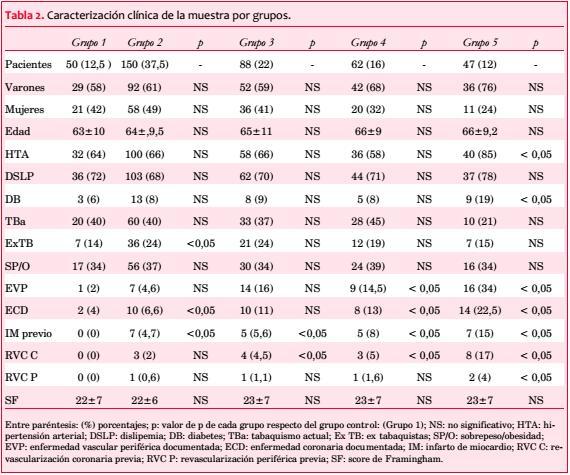
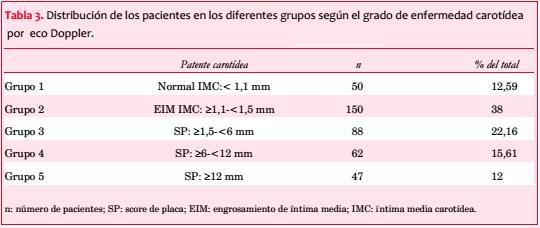
Material y método: se incluyeron sucesivamente 397 pacientes, asintomáticos, 251 varones, con edad media de 65 ± 9 años, con factores de riesgo vascular, y score de Framingham ³ 15. Los pacientes fueron estudiados mediante EDC y SPECT y divididos en cinco grupos (G), según el grado de la EVC, cuantificada mediante el score de placa (SP). G1 (control, n: 50): sin alteraciones carotídeas: íntima media carotídea (IMC): <1,1 mm; G2 (n: 150): con EIM: ³1,1-<1,5 mm; G3 (n: 88): SP: ³1,5-<6 mm; G4 (n: 62): SP: ³6-<12 mm; G5 (n: 47): SP: ³12 mm, determinando la incidencia de isquemia en cada grupo, correlación (r) entre el SP con el score diferencial de suma (SDS) por SPECT, y curva ROC.
Resultado: del total de los 397 pacientes, desarrollaron isquemia con SPECT: 169 (42%). Para cada grupo, G1: 14 (28%); G2: 41 (26%); G3: 30 (34%); G4: 45 (72%)*; G5: 39 (83%)*. Correlación: r = SP/SDS. G1: 0,13; G2: 0,23; G3: 0,25; G4: 0,47*; G5: 0,65* (* = p: <0,01). Curva ROC: 0,72 ± 0,04 (línea de corte de SP: 6 mm).
Conclusión: la cuantía de la enfermedad vascular carotídea se correlacionó con una elevada incidencia y severidad de isquemia miocárdica inducible. Este hallazgo reafirma su valor clínico como marcador de riesgo adicional a los scores disponibles en la actualidad.
Palabras clave:
ISQUEMIA MIOCÁRDICA
IMAGEN DE PERFUSIÓN MIOCÁRDICA
FACTORES DE RIESGO
GROSOR ÍNTIMA-MEDIA CAROTÍDEO
Summary
Background: the value of the carotid intima-media thickness (IMT) as a long-term risk marker for cardiovascular events and the correlation between carotid plaques (CP) and coronary anatomy (SYNTAX score) have been well demonstrated. There is little evidence about the incidence of myocardial ischemia depending on the different degrees of severity of the carotid artery disease (CAD).
Objective: to assess the incidence and severity of inducible myocardial ischemia in patients (P) with different degrees of CAD, using quantitative data of Carotid Doppler (CD) and of the functional study of radioisotope myocardial perfusion (SPECT).
Materials and methods: they were included 397 consecutive asymptomatic patients were followed up, 251 males, average age of 65 ± 9 years old, with cardiovascular risk factors and Framingham score ³ 15, patients were studied by CD and SPECT and divided into 5 groups (G) according to plaque score (PS). G1 (control, n: 50): with no carotid alterations: carotid intima media: <1,1 mm; G2 (n: 150): with thickening of IMT: PS: ³1,1-<1,5 mm; G3 (n: 88): PS: ³1,5-<6 mm, G4 (n: 62): PS: ³6-<12 mm; G5 (n: 47): PS: ³12 mm. Determination of ischemic incidence in each group, correlation (r) between PS by means of CDE with summed difference score (SDS) by means of SPECT and ROC curve.
Results: from the total of 397 P, 169 (42%) developed ischemia under SPECT. For each group: G1:14 (28%), G2:41 (26%), G3:30 (34%), G4:45 (72%) *, G5:39 (83%) *. Correlation: r=PS/SDS: G1:0.13. G2:0.23. G3:0.25. G4:0.47 *. G5:0.65 *. (* = p: <0.01). ROC curve: 0.72 ± 0.04 (PS cutting line: 6 mm).
Conclusion: the amount of carotid vascular disease correlated with a high incidence and severity of inducible myocardial ischemia. This finding reinforces their clinical marker value to additional risk scores available today.
Key words:
MYOCARDIAL ISQUEMIA
MYOCARDIAL PERFUSION IMAGING
RISK FACTORS
CAROTID INTIMA-MEDIA THICKNESS
Introducción
En los pacientes con factores de riesgo (FR) para enfermedad cardiovascular la estratificación clínica se realiza mediante herramientas de cálculo provistas por diferentes scores de riesgo (SR)(1-11), siendo el de Framingham (SF) el más utilizado(12-15).
Sin embargo, ninguno de ellos es suficiente por sí solo para resolver cada situación clínica en particular. Esto obedece a varias causas: no toman en consideración la totalidad de los FR, tienen limitaciones de cálculo en sus matrices matemáticas o no han incorporado los datos cuantificables de las diferentes técnicas de imágenes utilizadas en la actualidad(16-21).
Dentro de éstas, el ecocardiograma Doppler color cardíaco y vascular es el más utilizado por su accesibilidad, relativo bajo costo, reproducibilidad, sin riesgo para los pacientes, influenciado solamente por la confiabilidad del operador(22-27).
Los marcadores vasculares intentan sensibilizar y mejorar la eficacia predictiva de los SC. En la actualidad, el territorio vascular más estudiado es el carotídeo, con particular atención en su correlación con la afectación del árbol coronario(28-32).
La EVC abarca un amplio espectro en cuanto a severidad e importancia pronóstica, desde el engrosamiento mio-intimal(33-39) hasta la caracterización de las placas y la medición de la limitación del flujo, con el fin de decidir la mejor estrategia terapéutica(40-47).
Existen datos de correlación anatómica entre los hallazgos de la EVC y la coronaria valorada tanto por angiografía (SYNTAX score) como por tomografía (score de calcio)(48-51). Sin embargo, hay escasa evidencia de la relación de la EVC con el compromiso funcional de la afectación anatómica coronaria, fundamentalmente con la presencia de isquemia miocárdica inducible.
La hipótesis del presente trabajo es que a mayor severidad de enfermedad vascular carotídea, existe mayor incidencia y severidad de isquemia miocárdica inducible.
Material y método
Para la valoración de la EVC se utilizaron equipos Phillips HD™ 7, 15, SonoScape™ S20 y S40 con transductores lineales entre 5-12 MHZ, siguiendo normativas internacionales y nacionales para la obtención de imágenes y valoración de severidad anatómica y funcional(18,22,24-26,36,46).
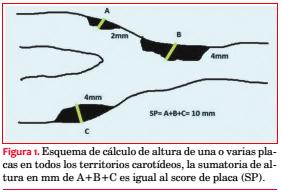
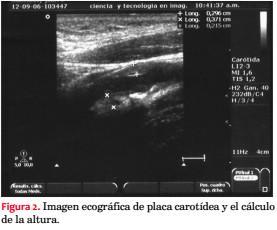
Los pacientes fueron subdivididos en cinco grupos según el grado de compromiso aterosclerótico carotídeo. Además de la obtención de datos convencionales, por protocolo se incorporó el score de placa carotídeo (SP)(30-32). El SP se obtiene mediante la sumatoria en milímetros (mm) de la altura de las placas carotídeas, constituyendo un dato numérico que permite cuantificar, reproducir y analizar estadísticamente los resultados, así como el seguimiento de los pacientes. En la figura 1 se muestra un esquema de su obtención, y en la figura 2 una imagen ecográfica real con la medición del SP. Placa significa una altura > a 1,5 mm(30-32). La caracterización clínica para cada uno de los cinco grupos se muestra en la tabla 2.
Los pacientes del grupo 1 no evidenciaban enfermedad vascular carotídea, a partir del grupo 2 todos tenían EIM, además los grupos 3, 4 y 5 presentaban verdaderas placas desde 1,5 mm hasta más de 12 mm (tabla 3). La valoración de la íntima media de los vasos carotídeos se hizo manual o por semicuantificación según equipo utilizado y los informes consensuados por dos expertos.
La valoración de la isquemia inducible se realizó mediante perfusión miocárdica con 99 Tc Sestamibi en cámara gamma (SPECT) bajo criterios convencionales de reconstrucción y cuantificación para 17 segmentos por paciente(52-54). En 337 se utilizó apremio con cicloergómetro de 12 derivaciones (85%) y en 60 apremio farmacológico con dipiridamol (15%).
Para la cuantificación de la isquemia se utilizó el score diferencial de suma (SDS) entre las imágenes de reposo y del apremio realizado, que permite cuantificar la magnitud de la isquemia y su tratamiento estadístico. Del estudio funcional SPECT se consideraron los siguientes aspectos:
1. Incidencia de isquemia: global, y para cada uno de los subgrupos.
2. Severidad de la isquemia (SDS): para cada uno de los subgrupos.
3. Correlación entre ambos parámetros (SP/SDS).
4. Cálculo de curva ROC para obtener el valor del SP como marcador de riesgo para isquemia miocárdica, con nivel de corte para positividad del SP de 6 mm(55-57).
Se utilizaron para la recolección de datos y tratamiento estadístico los siguientes programas comerciales: MS Access©, MS Excel©, Graph Pad Prism v 5.1©.
En el ingreso al protocolo solo 30% de los pacientes tenía controlados clínica y analíticamente todos sus FR. En todos los subgrupos se mantenía un elevado porcentaje de hipertensión arterial y dislipemia, particularmente en los grupos 4 y 5 (tabla 2).
La valoración con eco Doppler carotídeo mostró, a similar SF, todo el espectro de severidad de lesiones (tabla 3), siendo el hallazgo más frecuentemente observado el de EIM (G2, 38%) y SP de hasta 6 mm (G3, 22%).
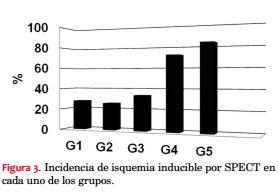
Incidencia de isquemia: del total de los 397 pacientes, desarrollaron isquemia con SPECT: 169 (42%). Trece de 397 (3,3%) presentaron alto riesgo isquémico (SDS > 8).
Para cada grupo, G1: 14 (28%); G2: 41(26%); G3: 30 (34%); G4: 45 (72%)*, G5: 39 (83%)*; (*= p:<0,01) (figura 3).
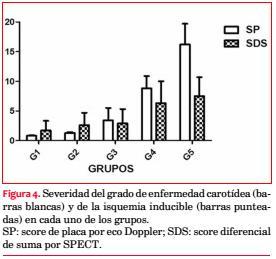
Severidad: valorada a través del SDS, se observó que fue más severa en los grupos 4 y 5 (SDS: 6,5 ± 3 y 7,4 ± 3,2 respectivamente) (figura 4).
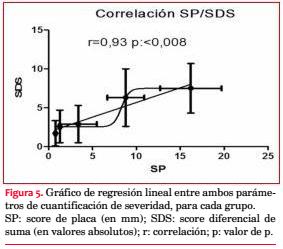
Correlación: r = SP/SDS, G1: 0,13; G2: 0,23; G3: 0,25; G4: 0,47*; G5: 0,65*; (*= p: <0,01) (figura 5). La correlación entre ambos parámetros (SP/SDS) mostró una linealidad positiva, en dirección a los grupos 4 y 5, siendo estos los pacientes con más afectación carotídea, más isquemia miocárdica y más severa (r: 0,93, p: < 0,01). Curva ROC: 0,72 ± 0,04 (línea de corte de SP: 6 mm).
Discusión
La valoración subclínica de pacientes con FR cardiovascular es un tema de análisis y discusión permanente(1,3,4,6-11,13,14). El objetivo de calidad de los diferentes protocolos y estudios es identificar subgrupos que se beneficiarían con cambios en la estrategia terapéutica y la mejora en su pronóstico.
La estratificación mediante los diferentes scores que disponemos, el de Framingham en particular, no siempre son capaces de identificar adecuadamente a estos pacientes. Para ello se está tratando de incorporar desde las diferentes técnicas de imágenes información cuantificable con el fin de sensibilizar los hallazgos clínicos(16-19,22,28,29).
Dentro de las técnicas de imágenes utilizadas están las que proveen información fundamentalmente anatómica de la carga vascular (eco Doppler, tomografía multicorte, resonancia magnética) y las que dan información funcional de la afectación anatómica (prueba ergométrica, eco estrés o perfusión miocárdica SPECT).
El engrosamiento de íntima media carotídeo ha sido el más extensamente estudiado y correlacionado con la anatomía y el pronóstico de los pacientes, sin embargo su valor predictivo es solo orientador y a largo plazo(8,9,29,30,34-39).
A diferencia de lo anterior, la presencia de placas en territorio carotídeo como evidencia de mayor grado de afectación vascular constituye un predictor más fuerte para evidenciar compromiso coronario. Desde los estudios del Dr. Ikeda y otros autores se ha establecido una correlación estrecha anatómica entre las placas carotídeas y el SYNTAX score coronario(30-32).
El score de calcio coronario por tomografía ha demostrado muy buena correlación con anatomía coronaria y pronóstico, especialmente por encima de 400 unidades Agatston(48-51); sin embargo, adolece de las limitaciones de disponibilidad, elevado costo y emisión de radiaciones que limitan su uso extensivo.
La gran mayoría de datos y de información es de carácter anatómico. Hasta la fecha es muy escasa la evidencia de correlación entre los marcadores vasculares periféricos (carotídeos en nuestro caso) y la repercusión funcional de la enfermedad coronaria (isquemia inducible), donde sabemos que la presencia de alto riesgo isquémico determina peor pronóstico y alta tasa de eventos a corto y mediano plazo(52-54).
La utilización de una herramienta sencilla de obtener, como el SP carotídeo, donde no se necesita más que un equipo de ecografía convencional y la capacitación del operador, nos permite disponer de estos datos en cualquier ámbito de complejidad asistencial con un relativo bajo costo y ausencia de riesgo para el paciente. Estos hechos permiten seleccionarla como primordial respecto del resto de las técnicas de imágenes vasculares.
En nuestro trabajo hemos observado y concluido que la presencia de alta carga vascular carotídea se correlaciona con isquemia miocárdica más frecuente y sobre todo de grado más severo. Algunos de estos pacientes presentaban un alto riesgo isquémico (13/397: 3,3%). Los datos de regresión y curva ROC indican que la presencia de placas carotídeas constituye un verdadero marcador de riesgo para enfermedad coronaria e isquemia inducible, especialmente por encima de los 6 mm.
Creemos, por lo tanto, haber logrado el objetivo de calidad de poder separar de la muestra en estudio a un subgrupo de pacientes que se beneficiaría con la pronta indicación de cineangiografía coronaria y su resolución por técnicas de revascularización y así mejorar el pronóstico.
Los pacientes de bajo o muy bajo riesgo pueden ser correctamente estratificados con estudio ergométrico convencional.
La inclusión de estos parámetros de las técnicas de imagen vascular en las matrices de cálculo de los diferentes scores clínicos podría mejorar la capacidad de predicción de eventos, permitiendo una mejor estratificación de las poblaciones estudiadas.
El otro punto a considerar es la necesidad de seguimiento y evaluación funcional periódica a partir de estas observaciones, considerando que el comportamiento habitual de la enfermedad aterosclerótica en este tipo de pacientes es la progresión y su versatilidad. Aún en el área subclínica falta establecer consensos en cuanto a tipo, frecuencia y secuencias de estudios.
Limitaciones
El número de pacientes estudiados mediante este modelo de evaluación paraclínica debería ser mayor a los fines de poder separar subpoblaciones específicas, mejorar la potencia estadística, evaluar el efecto de los tratamientos en función de los resultados, etcétera.
No contamos en este estudio con información del territorio vascular periférico aorto-ilio-femoral; si bien se sabe que su afectación también tiene correlación con el territorio coronario, hasta la fecha no hay datos de marcadores cuantificados, ni ha sido publicada una forma de unificar los criterios de severidad, como sí la hay para el carotídeo. Una comparación entre la correlación de ambos territorios periféricos y el coronario indicaría cuál tiene mayor peso predictivo.
No se contó con la información anatómica coronaria en todos los pacientes (no estuvo establecido por protocolo), pero sería muy útil. La limitante asistencial y ética es que para los pacientes con SPECT normal o de bajo riesgo no está indicada la realización de una angiografía diagnóstica de forma sistemática. Esta solo se indicó en lo asistencial a 13 pacientes (tres del grupo 4 y diez del grupo 5, que evidenciaron alto riesgo isquémico).
Conclusión
En pacientes asintomáticos con elevado score de Framingham, la cuantía de la enfermedad vascular carotídea se correlacionó, en esta muestra, con una mayor incidencia y severidad de isquemia miocárdica inducible. Este hallazgo reafirma su valor clínico como marcador de riesgo adicional a los scores disponibles en la actualidad.
En tanto que las técnicas de emisión radiactiva (SPECT) tienen su máxima utilidad en pacientes con alta carga de enfermedad vascular y elevado riesgo pretest, la pesquisa ecográfica sería de utilidad en pacientes de riesgo clínico intermedio y alto, por ser la población que más se beneficiaría adicionando marcadores de imágenes vasculares a los scores clínicos, permitiendo la correcta identificación de subgrupos de peor pronóstico.
Bibliografía
1. Ridker PM, Buring JE, Rifai N, Cook NR. Development and validation of improved algorithms for the assessment of global cardiovascular risk in women: the Reynolds Risk Score. JAMA 2007;297(6): 611–9.
2. Executive summary of the third report of the National Cholesterol Education Program (NCEP) expert panel on detection, evaluation, and treatment of high blood cholesterol in Adults (Adult Treatment Panel III). JAMA 2001;285(19):2486–97.
3. Chambless LE, Folsom AR, Sharrett AR, Sorlie P, Couper D, Szklo M, Nieto FJ. Coronary heart disease risk prediction in the Atherosclerosis Risk in Communities (ARIC)study. J Clin Epidemiol 2003; 56(9):880–90.
4. Matthews KA, Kuller LH, Sutton-Tyrrell K, Chang YF. Changes in cardiovascular risk factors during the perimenopause and postmenopause and carotid artery atherosclerosis in healthy women. Stroke 2001;32(5):1104-11.
5. Royer M, Castelo-Branco C, Blumel JE, Chedraui PA, Danckers L, Bencosme A, et al. The US National Cholesterol Education Programme Adult Treatment Panel III (NCEP ATPIII): Prevalence of the metabolic syndrome in postmenopausal Latin American women. Climacteric 2007;10(2): 164-70.
6. Lloyd-Jones DM, Tian L. Predicting cardiovascular risk: so what dowe do now? Arch Intern Med 2006;166(13):1342–4.
7. Hlatky MA, Greenland P, Arnett DK, Ballantyne CM, Criqui MH, Elkind MS, et al. Criteria for evaluation ofnovel markers of cardiovascular risk: a scientific statement from the American Heart Association. Circulation 2009;119(17):2408–16.
8. Berry JD, Liu K, Folsom AR, Carr JJ, Polak JF, Shea S, et al. Prevalence and progression ofsubclinical atherosclerosis in younger adults with low short-term buthigh lifetime estimated risk for cardiovascular disease: the coronaryartery risk development in young adults study and multi-ethnic studyof atherosclerosis. Circulation 2009;119(3):382–9.
9. Bogiatzi C, Cocker MS, Beanlands R, Spence JD. Identifying high-riskAsymptomatic carotids stenosis.Expert Opin Med Diagnostics 2012; 6:139-51.
10. Masson W, Huerin M, Vitagliano L, Zeballos C, Lobo M, Rostan M, et al. Estimación del riesgo cardiovascular y detección de ateromatosiscarotidea subclínica en mujeres posmenopáusicas de mediana edad. Rev Argent Cardiol 2013;81(4):322-328.
11. Cavanaugh-Hussey MW,
12. Vasan RS, Sullivan LM, Wilson PW,
13. Dhangana R, Murphy TP, Zafar AM, Qadeer FF, Cerezo JV, Ristuccia MB. Optimal use of
15. Lerner DJ, Kannel WB. Patterns of coronary heart disease morbidity and mortality in the sexes: a 26-year follow-up of the
16. Norris JW, Rothwell PM. Noninvasive carotid imaging to select patients for endarterectomy: is it really safer than conventional angiography? Neurology 2001;56(8):990-1.
17. Altaf N, Daniels L, Morgan PS, Auer D,
18. Johnson MB, Wilkinson ID, Wattam J, Venables GS, Griffiths PD. Comparison of Doppler ultrasound, magnetic resonance angiographic techniques and catheter angiography in evaluation of carotid stenosis. Clin Radiol 2000;55(12):912-20.
19. Yuan C, Mitsumori LM, Beach KW, Maravilla KR. Carotid atherosclerotic plaque: noninvasive MR characterization and identification of vulnerable lesions. Radiology 2001;221(2):285-99.
20. Yuan C, Kerwin WS, Ferguson MS, Polissar N, Zhang S, Cai J, et al. Contrast-enhanced high resolution MRI for atherosclerotic carotid artery tissue characterization. J Magn Reson Imaging 2002;15(1): 62-7.
21. Topakian R, King A, Kwon SU, Schaafsma A, Shipley M, Markus HS, et al. Ultrasonic plaque echolucency and emboli signals predict stroke in asymptomatic carotidstenosis. Neurology 2011; 77(8):751–8.
22. Chambless LE, Zhong MM, Arnett D, Folsom AR, Riley WA, Heiss G. Variability in B-mode ultrasound measurements in the Atherosclerosis Risk In Communities (ARIC) study. Ultrasound Med Biol 1996;22(5):545–54
23. Farro F, Farro I, Torrado J, Zócalo Y, Armentano RL, Lluberas R, et al. Composición y biomecánica de placas de ateroma carotídeas. Análisis comparativo de la distensibilidad arterial a lo largo del eje longitudinal en arterias carótidas control y con placas de ateroma de diferente composición. Rev Urug Cardiol 2014; 29(1):17-31
24. Grant EG, Benson CB, Moneta GL, Alexandrov AV, Baker JD, Bluth EI, et al. Carotid Artery Stenosis: Gray-scale and Doppler US Diagnosis. Society of Radiologists in Ultrasound Consensus Conference. Radiology 2003;229(2):340-6.
25. Grant EG, Duerinckx AJ, El Saden SM, Melany ML, Hathout GM, Zimmerman PT, et al. Ability to use duplex US to quantify internal carotid arterial stenoses: fact or fiction? Radiology 2000;214(1): 247-52.
26. Lee VS, Hertzberg BS, Workman MJ, Smith TP, Kliewer MA, DeLong DM, et al. Variability of Doppler US measurements along the common carotid artery: effects on estimates of internal carotid arterial stenosis in patients with angiographically proved disease. Radiology 2000;214(2):387-92.
27. Norris JW, Halliday A. Is ultrasound sufficient for vascular imaging prior to carotid endarterectomy? Stroke 2004;35(2):370-1.
28. Chimowitz MI, Weiss DG, Cohen SL, Starling MR, Hobson RW 2nd. Cardiac prognosis of patients with carotid stenosis and no history of coronary artery disease: Veterans Affairs Cooperative Study Group 167. Stroke 1994;25(4):759–65.
29. Nambi V, Chambless L, Folsom AR, He M, Hu Y, Mosley T, et al. Carotid Intima-Media Thickness and Presence or Absence of Plaque Improves Prediction of Coronary Heart Disease Risk The ARIC (Atherosclerosis Risk In Communities). J Am Coll Cardiol 2010; 55(15):1600-7.
30. Ikeda N, KogameN ,Iijima R , Nakamura M, Sugi K. Carotid artery intima-media thickness and plaque score can predict the SYNTAX score. Eur Heart J 2012;33(1): 113-9.
31. Ikeda N, Gupta A, Dey N, Bose S, Shafique S, Arak T, et al. Improved Correlation between Carotid and Coronary Atherosclerosis SYNTAX Score Using Automated Ultrasound Carotid Bulb Plaque IMT Measurement. Ultrasound Med Biol 2015; 41(5):1247-62. Epub 2015 Jan 28.
32. Ikeda N, Saba L, Molinari F, Piga M, Meiburger K, Sugi K, et al. Automated carotid intima-media thickness and its link for prediction of SYNTAX score in Japanese coronary artery disease patients. IntAngiol 2013;32(3):339-48.
33. Nicolaides A, Sabetai M, Kakkos SK, Dhanjil S, Tegos T, Stevens JM, et al. ACSRS Study Group. The Asymptomatic Carotid Stenosis and Risk of Stroke (ACSRS) study. Aims and results of quality control.IntAngiol 2003;22(3):263-72.
34. Lorenz MW, Markus HS, Bots ML, Rosvall M, Sitzer M. Prediction of clinical cardiovascular events with carotid intima-media thickness: a systematic review and meta-analysis. Circulation 2007; 115(4):459-67.
35. del Sol AI, Moons KG, Hollander M, Hofman A, Koudstaal PJ, Grobbee DE, et al. Is carotid intima-media thickness useful in cardiovascular disease risk assessment? The
36. Chambless LE, Heiss G, Folsom AR, Rosamond W, Szklo M,
37. Hlatky MA, Greenland P, Arnett DK, Ballantyne CM, Criqui MH, Elkind MS, et al. Criteria for evaluation of novel markers of cardiovascular risk: a scientific statement from the American Heart Association. Circulation 2009;119(17):2408–16.
38. Lester SJ, Eleid MF, Khandheria BK, Hurst RT. Carotid intimamedia thickness and coronary artery calcium score as indications of subclinical atherosclerosis. Mayo ClinProc 2009;84(3):229–33.
39. Spence JD, Hackam DG. Treating arteries instead of risk factors: a paradigm change in management of atherosclerosis. Stroke 2010;41(6):1193–9.
40. Brott TG, Hobson RW 2nd, Howard G, Roubin GS, Clark WM, Brooks W, et al. CREST Investigators. Stenting versus endarterectomy for treatment of carotid-artery stenosis. N Engl J Med 2010;363(1): 11–23.
41. Endarterectomy for asymptomatic carotid artery stenosis. Executive committee for the asymptomatic carotid atherosclerosis study. JAMA 1995; 273(18): 1421–8.
42. Halliday A, Mansfield A, Marro J, Peto C, Peto R, Potter J, et al. MRC Asymptomatic Carotid Surgery Trial (ACST) Collaborative Group. Prevention of disabling and fatal strokes by successful carotid endarterectomy in patients without recent neurological symptoms: randomised controlled trial. Lancet 2004;363(9420):1491–502.
43. Spence JD, Coates V, Li H, Tamayo A, Muñoz C, Hackam DG, et al. Effects of intensive medical therapy on microemboli and cardiovascular risk in asymptomatic carotid stenosis. Arch Neurol 2010; 67(2):180–6.
44. Barnett HJ. The inappropriate use of carotid endarterectomy. CMAJ 2004;171(5):473–4.
45. Jogestrand T, von Arbin M, Bergqvist D, Lilja A, Lindqvist M, Mätzsch T, et al. Recommendations by the Swedish quality board for carotid surgery. Ultrasound good preoperative method for evaluation degree of carotid stenosis.Lakartidningen 2003;100(30-31):2443-5.
46. El-Saden SM, Grant EG, Hathout GM, Zimmerman PT, Cohen SN, Baker JD. Imaging of the internal carotid artery: the dilemma of total versus near total occlusion. Radiology 2001;221(2):301-8.
47. Al-Mubarak N, Colombo A, Gaines PA, Iyer SS, Corvaja N, Cleveland TJ, et al. Multicenter evaluation of carotid artery stenting with a filter protection system. J Am CollCardiol 2002;39(5):841-6.
48. Shaw LJ. The exercise test is alive and well coupled with coronary calcium scoring. JACC cardiovasc Imaging 2015;8(2): 145-7.
49. Folsom AR, Kronmal RA, Detrano RC, O’Leary DH, Bild DE, Bluemke DA, et al. Coronary artery calcification compared with carotid intima-media thickness in the prediction of cardiovascular disease incidence: the Multi-Ethnic Study of Atherosclerosis (MESA). Arch Intern Med 2008; 168(12):1333-9.
50. Newman AB, Naydeck BL, Ives DG, Boudreau RM, Sutton-Tyrrell K, O’Leary DH, et al. Coronary artery calcium, carotid artery wall thickness, and cardiovascular disease outcomes in adults 70 to 99 years old. Am J Cardiol 2008;101(2):186–92.
51. Lakoski SG, Greenland P, Wong ND, Schreiner PJ, Herrington DM, Kronmal RA, et al. Coronary artery calcium scores and risk for cardiovascular events in women classified as “low risk” based on Framingham risk score: the Multi-Ethnic Study of Atherosclerosis (MESA). Arch Intern Med 2007; 167(22):2437-42.
52. Hendel R, Abbott B, Bateman T, Blankstein R, Calnon DA, Leppo JA, et al. The role of radionuclide myocardial perfusion imaging for asymptomatic individuals. J NuclCardiol 2011;18(1):3-15.
53. Holly TA, Abbott BG, Al-Mallah M, Calnon DA, Cohen MC, DiFilippo FP, et al. Single photon-emission computed tomography. J NuclCardiol 2010;17(5):941-73.
54. Tilkemeier PL, Cooke CD, Ficaro EP, Glover DK, Hansen CL, McCallister BD. American Society of Nuclear Cardiology information statement: Standardized reporting matrix for radionuclide myocardial perfusion imaging. J Nucl Cardiol 2006; 13(6):e157-71.
55. Harrell FE, Lee KL, Mark DB. Multivariable prognostic models:issues in developing models, evaluating assumptions and adequacy, and measuring and reducing errors. Stat Med 1996;15(4):361–87.
56. Steyerberg EW, Harrell FE, Borsboom GJ, Eijkemans MJ, Vergouwe Y, Habbema JD. Internal validation of predictive models: efficiency ofsome procedures for logistic regression analysis. J Clin Epidemiol 2001;54:774–81.
57. ChamblessLE, Diao G. Estimation of time-dependent area under theROC curve for long-term risk prediction. StatMed 2006;25(8):3474–86.