Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.30 no.1 Montevideo Apr. 2015
Uso de agentes antiarrítmicos y resultados clínicos en pacientes añosos con fibrilación auricular y enfermedad coronaria concomitante
Benjamin A. Steinberg1,2,3*, Samuel H. Broderick3, Renato D. Lopes2,3,
Linda K. Shaw3, Kevin L. Thomas1,2,3, Tracy A. DeWald2, James P. Daubert1,2,3, Eric D. Peterson2,3, Christopher B. Granger2,3, y Jonathan P. Piccini 1,2,3
Este artículo fue publicado en Europace 2014; 16: 1284-90, y es reproducido y traducido con autorización.
1. Centro Duke para la Fibrilación Auricular, Durham, NC, EEUU.
2. Departamento de Medicina, Centro Médico de la Universidad Duke, Durham, NC, EEUU.
3 Instituto de Investigación Clínica Duke, Centro Médico de la Universidad Duke, Casilla Postal 17969, Durham, NC 27715, EEUU.
Correspondencia: Benjamin A. Steinberg. Correo electrónico: benjamin.steinberg@duke.edu
Recibido el 12 de diciembre de 2013; aceptado tras su revisión el 17 de marzo de 2014; publicación electrónica previa a la impresión: 21 de abril de 2014.
Resumen
Objetivo: la fibrilación auricular (FA) y la enfermedad coronaria (EC) son comunes en los pacientes añosos. En este estudio nos propusimos describir el uso de agentes antiarrítmicos (AAA) y los resultados clínicos en estos pacientes.
Métodos y resultados: se analizó el tratamiento con AAA y los resultados observados en 1.738 pacientes mayores (edad ³65) con FA y EC registrados en el Banco de Datos para Enfermedad Cardiovascular de Duke. Los resultados primarios fueron mortalidad y rehospitalización al año y a los cinco años. En términos generales, 35% de los pacientes recibían un AAA al inicio, 43% eran mujeres y 85% eran blancos. Fueron frecuentes los antecedentes de infarto de miocardio (IM, 31%) e insuficiencia cardíaca (41%). La amiodarona era el AAA más frecuente (21%), seguida de agentes de Clase III pura (sotalol 6,3%, dofetilida 2,2%). La persistencia de los AAA fue baja (35% al año). Luego del ajuste, el uso de AAA al inicio no se asoció con la mortalidad al año (cociente de riesgo ajustado [HR] 1,23, intervalo de confianza [IC] 95%: 0,94-1,60) o con la mortalidad cardiovascular (HR ajustado 1,27, IC 95% 0,90-1,80). Sin embargo, el uso de AAA sí se asoció con un aumento de la rehospitalización por todas las causas (HR ajustado 1,20, IC 95%: 1,03-1,39) y rehospitalización cardiovascular (HR ajustado 1,20, IC 95% 1,01-1,43) al año. Esta asociación no se mantiene a los cinco años; sin embargo, estos pacientes tuvieron un elevado riesgo de muerte (55% para los >75 años y que recibían AAA) y rehospitalización (87% para aquellos >75 años que recibían AAA) a los cinco años.
Conclusiones: en pacientes añosos que padecen FA y EC, la terapia antiarrítmica se acompañó de aumento de la rehospitalización al año. En términos generales, estos pacientes presentan un alto riesgo de internación y muerte a largo plazo. Se necesitan desarrollar terapias más seguras, mejor toleradas y que brinden un control de los síntomas más eficaz en esta población de alto riesgo.
Palabras clave:
FIBRILACIÓN AURICULAR
CARDIOPATÍA ISQUÉMICA
MEDICACIóN ANTIARRÍTMICA
AÑOSOS
INVESTIGACIÓN DE VARIABLES
¿Qué hay de nuevo?
La fibrilación auricular (FA) y enfermedad coronaria (EC) concomitantes entrañan un mal pronóstico, con importante morbilidad y mortalidad en pacientes añosos. A los cinco años los reingresos al hospital superan 75% y la mortalidad supera 33% en todos los grupos.
Casi un tercio de los pacientes con FA y EC reciben medicación antiarrítmica, siendo la amiodarona la más frecuente.
El uso de la terapia antiarrítmica se acompañó de un aumento del riesgo de rehospitalización al año.
Es preciso desarrollar terapias más seguras y eficaces para el control de los síntomas en esta población.
La fibrilación auricular (FA) es la arritmia más frecuente en adultos y su incidencia aumenta significativamente con la edad. A más de una de cada cuatro personas mayores de 40 años se les diagnosticará FA, y ~10% de los octogenarios tiene diagnóstico de FA(1,2). La FA tiene un impacto negativo en la calidad de vida, comparable con el que se observa en los pacientes con cardiopatía isquémica, y en gran medida el efecto se puede atribuir a síntomas importantes, entre los que se incluyen palpitaciones, fatiga y limitación del ejercicio(3,4). Hay datos aleatorizados que sugieren que el mantenimiento del ritmo sinusal (“control del ritmo”) se asocia con una mejoría de los síntomas(5,6).
Métodos
Los datos para el presente análisis se obtuvieron del Banco de Datos para la Enfermedad Cardiovascular de Duke (DDCD), de una cohorte de toda la institución que incluye a todos los pacientes sometidos a procedimientos de cateterismo en el Centro Médico de la Universidad de Duke. Toda la información demográfica de las comorbilidades, signos vitales, estudios de laboratorio, resultados de imagenología y medicaciones se obtuvieron al inicio. Se realizó un seguimiento prospectivo de los pacientes con EC confirmada angiográficamente para analizar su uso de medicación y los resultados a los seis meses, al año, y anualmente de ahí en adelante. El diseño y los métodos de la DDCD ya han sido descritos(10,11).
Objetivos
Los objetivos primarios para este análisis fueron la mortalidad por todas las causas y la rehospitalización al año. Los objetivos secundarios fueron la muerte cardiovascular y la rehospitalización cardiovascular desde el momento del cateterismo hasta el año. Para profundizar la exploración de las asociaciones con los resultados se realizó un análisis de los pacientes que no presentaron eventos al año para las mismas variables evaluables a los cinco años. En términos generales, la mediana del seguimiento fue de 3,8 años.
Población del estudio
A los efectos de este análisis, se limitó la cohorte general de DDCD a los pacientes sometidos a cateterismo cardíaco con angiografía coronaria desde 2000 a 2010, que tuvieran >65 años al momento del cateterismo, que presentaran EC obstructiva (>50%) o no obstructiva (<50%, confirmada angiográficamente), y que tuvieran diagnóstico de FA dentro de los 12 meses previos. El diagnóstico de FA fue realizado mediante electrocardiograma, los datos de DDCD o la información administrativa hospitalaria y no se incluyeron los pacientes con nueva FA durante el seguimiento. Se excluyeron los siguientes pacientes: pacientes que fallecieron durante la internación del cateterismo índice; los que tenían una internación índice de >30 días; los pacientes sin datos de medicación disponible dentro de los 30 días siguientes al cateterismo índice; los pacientes que recibían quinidina o procainamida; y los pacientes con antecedentes de taquicardia ventricular o fibrilación ventricular.
Se estratificó a los pacientes según el uso de AAA inicial. A los efectos de este análisis, se definió el tratamiento con AAA como el uso de un fármaco antiarrítmico de membrana activo por vía oral (Vaughan-Williams Clase I o Clase III, o un bloqueante mixto del canal) dentro de los 30 días del cateterismo índice. Solo se consideraron los AAA citados en las guías AHA/ACC/HRS para el manejo del ritmo, como propafenona, flecainida, dofetilida, sotalol, disopiramida, dronedarona, o amiodarona(12). La procainamida y la quinidina quedaron excluidas. Se presenta el uso de AAA por grupo etario: 65-75 y >75 años. Todos los análisis de AAA se realizaron conforme el tratamiento que recibían al inicio.
Las características basales se describen usando las tasas absolutas (porcentaje) de las variables categóricas, y las medianas (rango entre cuartiles) para las variables continuas. Los resultados analíticos fueron estratificados por grupos etarios (65-75, >75), y luego usando cualquier AAA. Se calcularon las tasas de eventos Kaplan-Meier (KM) sin ajustes al año y a los cinco años para cada subgrupo (por edad y AAA). Se realizaron pruebas para las diferencias en los diferentes estratos para las características basales. Se utilizó un análisis de la prueba F de varianza para las características continuas. En los casos en que se infringieron los supuestos de normalidad para cualquiera de estas pruebas en las variables continuas se realizó una prueba de Kruskal-Wallis para esa variable particular en la que se infringieron los supuestos. Se utilizó una prueba c2 para independencia para las características basales categóricas. En caso de infracción de los supuestos para alguna prueba c2 en particular se realizó una prueba exacta de Fisher.
Posteriormente se generaron modelos de regresión del riesgo proporcional de Cox para cada variable evaluable para los resultados de un año. Los pacientes que no tuvieran un evento de las variables estudiadas al año y cuyo seguimiento fuera mayor a un año se incluyeron entonces en los análisis de referencia para evaluar los resultados a los cinco años. Se desarrollaron modelos de múltiples variables observando la relación entre los resultados y las variables del uso de AAA y el grupo etario. En los que se observó ausencia <15% de los datos, se imputaron los valores faltantes utilizando técnicas de imputación múltiple en los casos. El resultado de estas técnicas es que hay múltiples valores imputados para cada punto de datos faltante. El conjunto de valores múltiples se utiliza al correr todos los modelos y hace posible que los análisis expliquen la variación debido al hecho que algunos de los datos fueron imputados(13,14). Se verificaron los supuestos de linealidad examinando los resultados de las gráficas spline polinómicas cúbicas del cociente de riesgo (HR) logarítmico de una variable evaluable contra cada una de las variables de ajuste ordinarias o continuas. Se hicieron transformaciones para variables que tuvieran importantes relaciones no lineales que satisficieran este supuesto. Todos los análisis estadísticos de los datos fueron realizados por el Instituto de Investigación Clínica de Duke utilizando el software SAS (versión 9.2, Instituto SAS).
Resultados
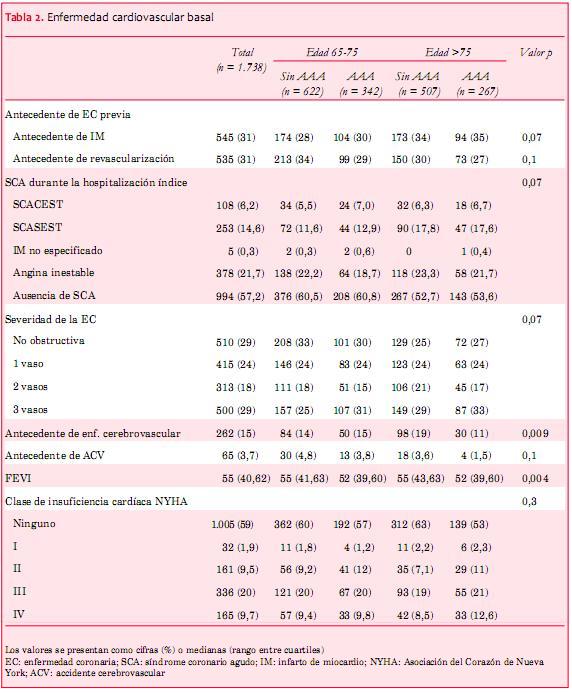
De la base de datos total de DDCD que registraba 170.629 procedimientos, se excluyeron 152.395 por ser cateterismos no cardíacos, porque los pacientes estaban fuera del rango etario del estudio, tenían antecedentes de arritmias ventriculares, o no mostraban evidencia de EC. Además de los procedimientos repetidos, se excluyeron otros 10.550 pacientes sin FA (material complementario online, figura S1). La cohorte final del estudio incluyó a un total de 1.738 pacientes (n = 964, edad 65-75 y n = 774 >75 años), 609 (35%) de los cuales recibieron un AAA. Las características de la población del estudio, estratificadas por edad y uso de AAA al inicio se muestran en la tabla 1. En general, 43% eran mujeres, quienes tienen menos probabilidades que los hombres de estar recibiendo un AAA. Los factores de riesgo para enfermedad cardiovascular aterosclerótica, como hiperlipidemia y diabetes, fueron frecuentes, con tasas menores en los pacientes mayores; 29% (n = 510) presentaban EC no obstructivas (<50%), y el 71% (n = 1.228) restante tenía una EC obstructiva (>50%) en una, dos o tres arterias coronarias epicárdicas. Se indicó terapia con warfarina a un total de 34% (65% tenían puntuaciones CHADS2 ³ 2); los detalles de las medicaciones antitrombóticas en esta población han sido descritos previamente(11). Aproximadamente un tercio de la cohorte había tenido un infarto de miocardio (IM) previo, y alrededor de un tercio había sido sometido a revascularización coronaria (percutánea o quirúrgica, tabla 2). Aproximadamente 40% de los pacientes manifestaba un síndrome coronario agudo en el momento del ingreso índice, y el uso de AAA en este subgrupo fue similar al de la cohorte total (35%); 41% padecía insuficiencia cardíaca congestiva. La mediana de la fracción de eyección del ventrículo izquierdo (FEVI) fue de 55% en los pacientes que no recibían AAA contra 52% para los pacientes que recibían un AAA. El índice de filtrado glomerular estimado fue inferior en los pacientes mayores, y menor en los pacientes mayores que recibían tratamiento con AAA.
Terapias para frecuencia y ritmo
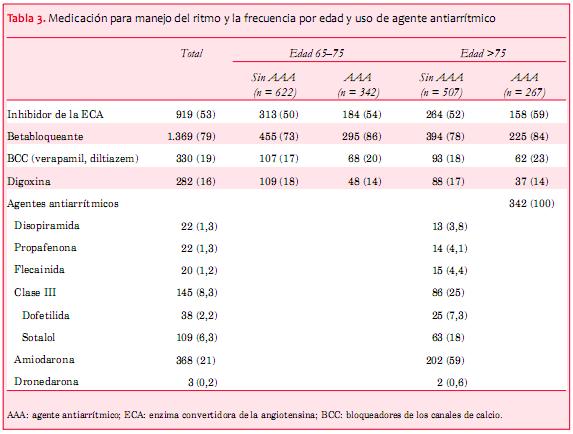
En la tabla 3 se muestran las medicaciones cardíacas concomitantes estratificadas por edad; 86% y 84% (de 65-75 y >75 años de edad, respectivamente) de los pacientes que recibían AAA también estaban recibiendo un betabloqueante, comparado con 73% y 78% de los pacientes que no recibían un AAA. No fue frecuente el uso de bloqueadores de los canales de calcio (no dihidropiridinas) y digoxina.
El AAA más frecuente en esta cohorte fue la amiodarona (~60% de los que recibían AAA, 21% en total), seguidos de sotalol (6,3% en total), y luego dofetilida (2,2% en total). Más de 75% de la cohorte estaba recibiendo terapia betabloqueante, incluyendo a los que presentaban insuficiencia cardíaca leve-moderada y severa.
Después de un año, 35% de los pacientes que recibían AAA desde el comienzo seguían con AAA; de los pacientes que no estaban recibiendo un AAA inicialmente, 16% estaban recibiendo un AAA al año (con exclusión de los pacientes que fallecieron).
Resultados clínicos sin ajustes
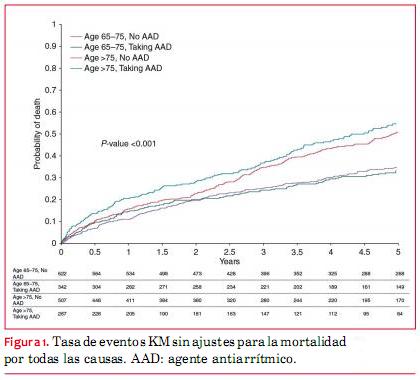
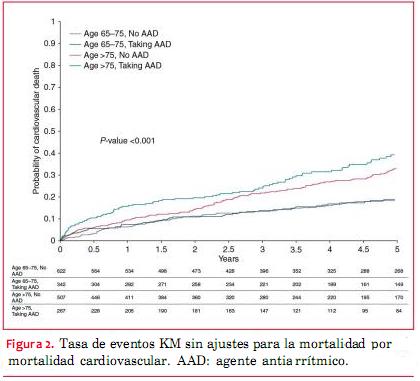
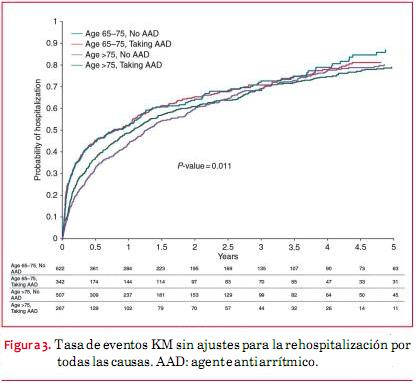
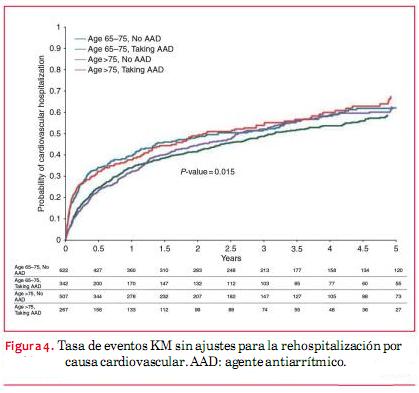
Luego de un seguimiento de cinco años, las tasas de KM no ajustadas para la rehospitalización por todas las causas variaban entre 79% en los pacientes que no recibían AAA con edades entre 65 y 75 años, hasta 87% en pacientes con AAA >75 años. Las tasas no ajustadas de KM para la mortalidad por todas las causas varió entre 33% en los pacientes con AAA, cuyas edades iban entre 65 y 75 años, hasta 55% en los pacientes que recibían AAA >75 años (figuras 1, 2, 3, 4). Las tasas de mortalidad con el tiempo fueron más elevadas en pacientes mayores, en tanto que las tasas de rehospitalización fueron más elevadas en los pacientes que recibían AAA de cualquiera de los grupos etarios (material online complementario, tabla S1). En el seguimiento una minoría de los eventos que requirieron hospitalización tuvieron diagnóstico primario de FA (52 eventos en pacientes que no recibían AAA, 45 en pacientes que sí recibían un AAA).
Variables clínicas ajustadas
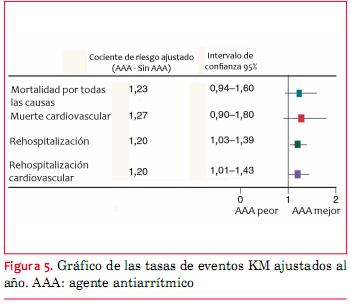
Analizamos el uso de AAA y los resultados en más de 1.700 pacientes añosos con FA y EC concomitantes. Casi un tercio de los pacientes recibieron tratamiento con un AAA, en general amiodarona. Esta población presentó un riesgo elevado de resultados clínicos adversos, incluyendo muerte y rehospitalización, independientemente del uso de AAA. A los cinco años, la rehospitalización superó el 75% y la mortalidad superó 33% en todos los grupos. Eran pocos los que se mantenían con AAA al año. Después de un ajuste de múltiples variables, la mortalidad no se asoció con el uso de AAA; sin embargo, los pacientes que recibían un AAA tenían un mayor riesgo de rehospitalización y rehospitalización por causa cardiovascular al año, comparado con los pacientes que no recibían un AAA. Este efecto no pareció persistir a los cinco años para los pacientes libres de eventos y seguidos más allá de un año.
Nuestra primera observación fue la importante mortalidad y morbilidad asociada al diagnóstico concomitante de FA y EC en personas ³65 años de edad. A los cinco años, la gran mayoría había sido internada nuevamente, y casi la mitad había fallecido. Estos hallazgos exageran descripciones previas del registro REACH, en el que las tasas al año de la mortalidad cardiovascular y por todas las causas en pacientes con FA y EC fueron 4,4% y 3,4%, respectivamente(15). Nuestro estudio ofrece datos de largo plazo, ampliados, mucho más allá de los 12 meses. Sin embargo, hay varias diferencias entre estas cohortes; es de destacar el estudio REACH, que registró pacientes ambulatorios estables en diferentes partes del mundo. En comparación, los análisis de ensayos clínicos aleatorizados en síndrome coronario agudo (SCA) han demostrado el efecto de marcado mal pronóstico de la FA en pacientes con patología aguda, y si se tienen en cuenta las diferencias de edad, nuestros resultados concuerdan con estas tasas(16). Esto puede ser atribuible a la gran proporción de individuos con SCA en nuestra cohorte (40%), para los que se han demostrado resultados significativamente peores cuando se complican con FA(17).
Hay varias distinciones muy importantes entre nuestros resultados y los del ensayo AFFIRM(18-20). Las más importantes son (i) estos son resultados contemporáneos del tratamiento con AAA; (ii) en una cohorte de pacientes mucho más enfermos (por sus diagnósticos de EC e insuficiencia cardíaca), y (iii) son datos de la práctica clínica –no un ensayo clínico aleatorizado bien controlado; hemos demostrado tasas comparables de hospitalización cardiovascular a los cinco años–, desgraciadamente esto representa poca mejora diez años después. Asimismo, los AAA aumentaron el riesgo de hospitalización en ambas cohortes, y la más común sigue siendo la amiodarona. La amiodarona sigue siendo el AAA usado más frecuentemente en pacientes añosos con FA(21), y hay evidencia confiable que respalda su uso en pacientes de alto riesgo con FA(12,22,23). No obstante ello, los importantes efectos colaterales y la toxicidad de la amiodarona son bien conocidos; estos hallazgos subrayan no solo la imperiosa necesidad de contar con farmacoterapias más seguras y eficaces para el control del ritmo en la FA, sino del riesgo constante de usar tratamientos subóptimos en pacientes de alto riesgo.
Es probable que el riesgo temprano aislado asociado con el uso de AAA sea debido a varios factores. No podemos descartar la selección de pacientes adversos para AAA, un factor que está medido de forma incompleta en nuestro ajuste de múltiples variables, lo que hace que este grupo tenga mayor rehospitalizaciones a corto plazo. Dada la edad en nuestra población, la competencia del riesgo de causas de morbilidad no relacionadas puede superar cualquier impacto adverso asociado con AAA a los cinco años, fecha para la cual todos estos pacientes tendrían >70 años de edad. Además, es posible que el uso de AAA en pacientes con SCA (aproximadamente 40% de nuestra cohorte) entrañe un riesgo agudo que se desvanece con el tiempo(9).
Sin embargo, hubo también una marcada atrición del uso de AAA en esta cohorte. Es frecuente que los agentes antiarrítmicos sean mal tolerados y combinados con una eficacia marginal lleva a altas tasas de abandono. La persistencia del tratamiento ha sido un problema de larga data con los AAA(24), incluyendo la amiodarona(25,26). En un metaanálisis se interrumpieron los AAA debido a efectos colaterales en 10,4%, debido a falla del tratamiento en 13,5%, y debido a falta de cumplimiento en 4,2%. El 0,5% de los pacientes murieron por una causa relacionada con el tratamiento(8). En nuestros datos, las tasas de eventos adversos convergían luego de interrumpir los AAA en la mayoría de los pacientes, sugiriendo una posible relación exposición-respuesta.
Independientemente de las razones para interrumpir, sigue manteniéndose la necesidad de tratamientos más seguros y eficaces para la FA, particularmente para los pacientes de alto riesgo. La dronedarona, de uso poco frecuente en nuestra cohorte, ha demostrado reducir la hospitalización en ciertas poblaciones de alto riesgo(27); sin embargo, en otros grupos con FA se plantearon inquietudes acerca de la seguridad de esta medicación(28). Y si bien los pacientes mayores pueden ser candidatos a recibir fármacos con más toxicidades a largo plazo (es decir, amiodarona), el uso de AAA en esta población está plagado de otros problemas, como la función renal dinámica, polifarmacia, amplia comorbilidad (incluyendo EC), y dificultades en la vigilancia de arritmias. Como el objetivo principal es frecuentemente el alivio de los síntomas, habría que instaurar tratamientos alternativos. Aun cuando es posible que surjan nuevos AAA con mejores perfiles de seguridad y eficacia, el uso de estrategias invasivas basadas en el uso de catéteres para el manejo de la FA sintomática es una opción posible. Los datos preliminares avalan la ablación de la FA por catéter en pacientes sintomáticos de edad avanzada(29-31), y se justifican más estudios sobre el manejo óptimo de esos pacientes.
Limitaciones
Conclusiones
Material complementario
Material online complementario está disponible en Europace online.
Conflicto de interés: B.A.S. recibió fondos de un subsidio de capacitación T-32 del NIH #5 T32 HL 7101-37. En relación con esta presentación, se dan las siguientes relaciones: B.A.S., S.H.B., L.K.S. y K.L.T. no declararon ningún conflicto de interés. Se puede encontrar información de declaraciones de conflictos de interés completa para J.P.P., R.D.S., E.D.P. y C.G. online en
https://www.dcri.org /about-us/conflict-ofinterest/.
Financiación
Bibliografía
1. Go AS, Hylek EM, Phillips KA, Chang Y, Henault LE, Selby JV et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the Anticoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001;285:2370–5.
2. Lloyd-Jones DM. Lifetime risk for development of atrial fibrillation: the Framingham Heart Study. Circulation 2004;110:1042–6.
3. Dorian P, Jung W, Newman D, Paquette M, Wood K, Ayers GM et al. The impairment of health-related quality of life in patients with intermittent atrial fibrillation: implications for the assessment of investigational therapy. Jam Coll Cardiol 2000;36:1303–9.
4. Spertus J, Dorian P, Bubien R, Lewis S, Godejohn D, Reynolds MR et al. Development and validation of the Atrial Fibrillation Effect on Quality-of-Life (AFEQT) questionnaire in patients with atrial fibrillation. Circ Arrhythm Electrophysiol 2011;4:15–25.
5. Chung MK, Shemanski L, Sherman DG, Greene HL, Hogan DB, Kellen JC et al. Functional status in rate- versus rhythm-control strategies for atrial fibrillation: results of the Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) functional status substudy. J Am Coll Cardiol 2005;46:1891–9.
6. Guglin M, Chen R, Curtis AB. Sinus rhythm is associated with fewer heart failure symptoms: insights from the AFFIRM trial. Heart Rhythm 2010; 7:596–601.
7. Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. The Cardiac Arrhythmia Suppression Trial (CAST) investigators. N Engl J Med 1989;321:406–12.
8. Calkins H, Reynolds MR, Spector P, Sondhi M,Xu Y, Martin Aetal. Treatment of atrial fibrillation with antiarrhythmic drugs or radiofrequency ablation: two systematic literature reviews and meta-analyses. Circ Arrhythm Electrophysiol 2009;2:349–61.
9. Maisel WH, Kuntz KM, Reimold SC, Lee TH, Antman EM, Friedman PL et al. Risk of initiating antiarrhythmic drug therapy for atrial fibrillation in patients admitted to a university hospital. Ann Intern Med 1997;127:281–4.
10. Newby LK, La Pointe NM, Chen AY, Kramer JM, Hammill BG, DeLong ER et al. Long-term adherence to evidence-based secondary prevention therapies in coronary artery disease. Circulation 2006;113:203–12.
11. Hess CN, Broderick S, Piccini JP, Alexander KP, Newby LK, Shaw LK et al. Antithrombotic therapy for atrial fibrillation and coronary artery disease in older patients. Am Heart J 2012;164:607–15.
12. Fuster V, Ryden LE, Cannom DS, Crijns HJ, Curtis AB, Ellenbogen KA et al. 2011 ACCF/ AHA/HRS focused updates incorporated into the ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. Circulation 2011;123:e269–367.
13. Rubin DB. Inference and missing data. Biometrika 1976;63:581–92.
14. Little RJA, Rubin DB. Statistical analysis with missing data. New York: John Wiley & Sones; 2002.
15. Goto S, Bhatt DL, Rother J, Alberts M, Hill MD, Ikeda Y et al. Prevalence, clinical profile, and cardiovascular outcomes of atrial fibrillation patients with atherothrombosis. Am HeartJ 2008;156: 855–63, 63 e2.
16. Lopes RD, Pieper KS, Horton JR, Al-Khatib SM, Newby LK, Mehta RH et al. Short-and long-term outcomes following atrial fibrillation in patients with acute coronary syndromes with or without ST-segment elevation. Heart 2008;94:867–73.
17. Crenshaw BS, Ward SR, Granger CB, Stebbins AL, Topol EJ, Califf RM. Atrial fibrillation in the setting of acute myocardial infarction: the GUSTO-I experience. Global utilization of streptokinase and TPAfor occluded coronary arteries.J Am Coll Cardiol 1997;30:406–13.
18. Steinberg JS, Sadaniantz A, Kron J, Krahn A, Denny DM, Daubert J et al. Analysis of cause-specific mortality in the Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) study. Circulation 2004;109:1973–80.
19. Saksena S, Slee A, Waldo AL, Freemantle N, Reynolds M, Rosenberg Y et al. Cardiovascular outcomes in the AFFIRM trial (Atrial Fibrillation Follow-Up Investigation of Rhythm Management): an assessment of individual antiarrhythmic drug therapies compared with rate control with propensity score-matched analyses. J Am Coll Cardiol 2011;58:1975–85.
20. Wyse DG, Waldo AL, DiMarco JP, Domanski MJ, Rosenberg Y, Schron EB et al. A comparison of rate control and rhythm control in patients with atrial fibrillation. N EnglJ Med 2002;347:1825–33.
21. Piccini JP, Mi X, Dewald TA, Go AS, Hernandez AF, Curtis LH. Pharmacotherapy in Medicare beneficiaries with atrial fibrillation. Heart Rhythm 2012;9:1403–8.
22. Zimetbaum P. Amiodarone for atrial fibrillation. N Engl J Med 2007;356:935–41.
23. Singh BN, Singh SN, Reda DJ, TangXC, Lopez B, Harris CL et al. Amiodarone versus sotalol for atrial fibrillation. N Engl J Med 2005;352:1861–72.
24. Squire A, Goldman ME, Kupersmith J, Stern EH, Fuster V, Schweitzer P. Long-term antiarrhythmictherapy. Problem of low drug levels and patient noncompliance. AmJ Med 1984;77:1035–8.
25. Guerin A, Lin J, Jhaveri M, Wu EQ, Yu AP, Cloutier M et al. Outcomes in atrial fibrillation patients on combined warfarin & antiarrhythmic therapy. Int J Cardiol 2013; 167:564–9.
26. Kim MH, Smith PJ, Jhaveri M, Lin J, Klingman D. One-year treatment persistence and potential adverse events among patients with atrial fibrillation treated with amiodarone or sotalol: a retrospective claims database analysis. Clin Ther 2011;33: 1668–81 e1.
27. Hohnloser SH, Crijns HJ, van Eickels M, Gaudin C, Page RL, Torp-Pedersen C et al. Effect of dronedarone on cardiovascular events in atrial fibrillation. N Engl J Med 2009;360:668–78.
28. Connolly SJ, Camm AJ, HalperinJL,JoynerC, Alings M, AmerenaJ et al. Dronedarone in high-risk permanent atrial fibrillation. N Engl J Med 2011;365:2268–76.
29. Zado E, Callans DJ, Riley M, Hutchinson M, Garcia F, Bala R et al. Long-term clinical efficacy and risk of catheter ablation for atrial fibrillation in the elderly. J Cardiovasc Electrophysiol 2008;19: 621–6.
30. Bunch TJ, Weiss JP, Crandall BG, May HT, Bair TL, OsbornJS et al. Long-term clinical efficacyand risk of catheterablation foratrial fibrillation in octogenarians. Pacing Clin Electrophysiol 2010;33:146–52.
31. Piccini JP, Sinner MF, Greiner MA, Hammill BG, Fontes JD, Daubert JP et al. Outcomes of medicare beneficiaries undergoing catheter ablation for atrial fibrillation. Circulation 2012;126:2200–7.