Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.30 no.1 Montevideo Apr. 2015
Relevancia clínica del ecocardiograma transesofágico en pacientes con ataque cerebrovascular isquémico. Estudio observacional, analítico
Clinical relevance of transesophageal echocardiography in patients with ischemic stroke. Observational, analytical study
Dres. Lucía Florio1, Fabián Martínez1, Gabriel Parma1, Natalia Lluberas1, Arturo Pazos1,
Ana Fajardo1, Carlos Américo1, Claudia Camejo2, Cecilia Legnani2
1. Centro Cardiovascular Universitario. Unidad de Imagen Cardíaca. Hospital de Clínicas. UdelaR
2. Centro Cardiovascular Universitario. Unidad de Ataque CerebroVascular. Hospital de Clínicas UdelaR
Correspondencia: Dra. Lucía Florio. Correo electrónico: lfloriol@adinet.com.uy
Recibido febrero 26, 2015; aceptado marzo 25, 2015.
Resumen
Antecedentes: la búsqueda de cardioaortoembolia es prioritaria en pacientes con ataque cerebrovascular isquémico (ACVi). El ecocardiograma transesofágico (ETE) tiene mayor sensibilidad que el transtorácico (ETT) para detectar fuentes de cardioaortoembolia. Sin embargo, su indicación y relevancia no están totalmente definidas en la valoración inicial de estos pacientes.
Objetivo: explorar la relevancia clínica de la realización sistemática de ETE en pacientes con ACVi.
Método: estudio de corte transversal en el que 100 pacientes consecutivos con diagnóstico de ACVi, que otorgaron consentimiento, fueron incluidos prospectivamente entre febrero de 2012 y marzo de 2014. Dos cardiólogos independientes, ciegos entre sí, realizaron ETT y ETE durante el ingreso hospitalario de cada paciente. Otro cardiólogo, según la historia clínica, electrocardiograma (ECG) y ETT definió riesgo de embolia y tratamiento siguiendo pautas habituales. Según el resultado del ETE, se respondió: ¿Cambió la estimación de riesgo embólico? ¿Cambió la indicación terapéutica? Se consideró clínicamente relevante un número de ETE necesario (NEN) £ 10 y £ 15 por cada respuesta afirmativa, respectivamente. Secundariamente se estudió la capacidad diagnóstica del ETT versus ETE para cardioaortoembolia.
Resultado: cincuenta hombres (50%); edad 64 ± 12 años, 18 con fibrilación auricular y 94 con infarto cerebral. NEN para cambiar una estimación de riesgo 2,85, IC 95% (2,3-3,9) y para cambiar un tratamiento 10, IC 95% (6,3-24,3). El ETT mostró una sensibilidad para fuente de cardioaortoembolia de 43,9% (IC 95% 31,0-56,7) y una especificidad de 81,4% (IC 95% 69,8-93,0) comparado con ETE tomado como gold standard.
Conclusión: el ETE aporta información relevante para estimación de riesgo embólico y definición terapéutica en pacientes con ACVi, esto último sin significación estadística.
Palabras clave:
ACCIDENTE CEREBROVASCULAR
Background: search of cardiac and aortic source of emboli is crucial in managing acute cerebrovascular diseases (ACVD). Systematic use of transesophageal echocardiography (TEE) has not yet been defined, even though TEE is much more sensitive than transthoracic echocardiography (TTE).
Purpose: to explore clinical relevance of systematic use of TEE in ACVD.
Method: consecutive patients diagnosed with a new ischemic stroke or transient ischemic attack (TIA), have been assessed in-hospital between 2/2012 and 3/2014. Two independent cardiologists blinded to each other performed TTE and TEE. Another cardiologist, considering clinical history and TTE, determined embolic risk and established treatment according to clinical guidelines. Considering TEE result, these questions were answered: ¿Did TEE result change risk assessment? ¿Did TEE result change treatment indication (new drug indication, new goal for an old one or new intervention)?. It was considered as clinically relevant a needed number of TEE (NNT) £10 for risk assessment and £ 15 for treatment under each affirmative answer.
Results: one hundred patients (50 men, age 64±12 years) were recruited; 18 patients with atrial fibrillation; 94 patients with stroke. NNT: 2,85 IC 95%(2,3- 3,9), to change one assessment and 10 IC 95%(6,3-24,3) to change one treatment. Diagnostic value of TTE vs TEE (as gold standard) was: TTE sensibility 43,9% (31,0-56,7) and specificity 81,4% (69,8-93,0).
Conclusions: TEE gives clinically relevant information to change risk embolic assessment in TIA/stroke patients, but this information was not statistical significant in order to define treatment changes.
Key words:
STROKE
El ataque cerebrovascular (ACV) es una de las primeras causas de muerte y la primera causa de discapacidad en adultos en Uruguay y a nivel internacional(1-4); su tratamiento implica un alto costo para la sociedad en términos de diagnóstico, tratamiento y rehabilitación(5-7). La etiología isquémica varía entre 60% y 90%(8,9) según la región geográfica considerada. Por etiología isquémica se entiende que hay una disminución crítica del flujo sanguíneo cerebral regional con la posibilidad de determinar lesiones irreversibles (infarto cerebral). Los infartos cerebrales se clasifican en diferentes subtipos según los mecanismos etiopatogénicos involucrados en base a criterios clínicos, imagenológicos y paraclínicos: ateromatosis de grandes arterias, cardioembolia, lacunar e indeterminado (sin causa aparente, con más de una causa, con estudios insuficientes) o de otras etiologías inhabituales(10). El accidente isquémico transitorio (AIT) (amenaza de infarto) comparte los mecanismos etiológicos del infarto cerebral. La cardioembolia causa entre 20% y 50% de los ACVisquémicos (ACVi), estos son típicamente más grandes, múltiples y recurrentes(10-12), siendo la fibrilación auricular la etiología más frecuente. En algunos casos los resultados de la búsqueda etiológica son negativos y en otros hay más de un mecanismo posible de ACVi en un mismo paciente, lo que dificulta su definición (ACVi de etiología incierta). Algunos hallazgos frecuentes como la aortopatía aterosclerótica(11-17) no están contemplados en las clasificaciones etiopatogénicas clásicas y el tratamiento específico no está absolutamente definido más allá de la prevención secundaria. El ecocardiograma transesofágico (ETE) es el instrumento más importante para el diagnóstico de cardioembolia con una reconocida superioridad diagnóstica en términos de sensibilidad y especificidad respecto al ecocardiograma transtorácico (ETT)(18). La búsqueda etiológica importa principalmente por las definiciones terapéuticas que emerjan de su aporte diagnóstico y que pueden variar desde la prevención cardiovascular secundaria clásica, la anticoagulación, el tratamiento antibiótico o el eventual intervencionismo cardíaco (por ejemplo, tumor cardíaco). La estratificación del riesgo embólico también es relevante al definir potenciales cambios terapéuticos (por ejemplo, antiagregación versus anticoagulación) e independientemente de ellos permite individualizar conceptos de pronóstico y controles.
Sin embargo, la evidencia acerca del rol del ETE en el estudio inicial y rutinario de los pacientes con ACVi es limitada y contradictoria, incluso en menores de 45 años, en quienes aumenta la probabilidad de encontrar una fuente cardioembólica no sospechada por la clínica, como en casos de prolapso de válvula mitral, foramen oval permeable, aneurisma del septum interauricular, comunicación interauricular, endocarditis trombótica no bacteriana y mixomas(18,19).
Método
Se realizó un estudio de corte transversal en el que se incluyeron en forma prospectiva pacientes consecutivos, valorados por neurólogos de la Unidad de Ataque Cerebrovascular del Centro Cardio Vascular Universitario (CCVU), con diagnóstico de ACVi, que otorgaron consentimiento informado entre febrero de 2012 y marzo de 2014. El proyecto fue aprobado por el comité de ética institucional.
Los neurólogos constituyeron el equipo asistencial responsable directo del paciente, diagnosticaron el ACVi y definieron la naturaleza y etiopatogenia del mismo. Los cardiólogos especializados en imagen realizaron el ETT y el ETE y un cardiólogo clínico definió los puntos diagnósticos y de tratamiento que se explican más adelante. Ambos equipos analizaron los resultados en conjunto.
Un total de 116 pacientes consecutivos fueron considerados, de los cuales 12 no otorgaron consentimiento y tres no se realizaron ETE por tener contraindicaciones para el mismo; en un paciente la intubación esofágica no fue posible. Finalmente, 100 pacientes fueron incluidos en el análisis.
Dos cardiólogos, con al menos nivel II de entrenamiento para ecocardiografía transtorácica y transesofágica según ECOSIAC(20), independientes y ciegos entre sí, realizaron ETT y ETE siguiendo criterios diagnósticos preestablecidos para hallazgos principales (apéndice 1) durante el ingreso hospitalario de cada paciente registrando los resultados. Los estudios se realizaron con ecógrafo Siemens Sequoia C512, traductor transtorácico de 4 Mhz y sonda transesofágica de 7 Mhz.
Un cardiólogo clínico diferente a los que realizaron la ecografía, según la historia, el ECG y el ETT, definió el riesgo de embolia(10,21) (apéndices 2 y 3) y el tratamiento. Para definir tratamiento se tomaron en cuenta las guías de práctica clínica vigentes de fibrilación auricular, hipertensión arterial, prevención secundaria, etcétera. Además, puntualizó las indicaciones de antiagregación, anticoagulación, tratamiento con estatinas, tratamiento con inhibidores de la enzima de conversión de angiotensina I a II, otro tratamiento farmacológico y tratamiento no farmacológico intervencionista. Luego, según el resultado del ETE, respondió las siguientes preguntas:
1. ¿Cambió la estimación de riesgo embólico?
2. ¿Cambió la indicación terapéutica?
Las variables cuantitativas son expresadas en media(s) y desvío estándar (DE), las categóricas en porcentajes y los resultados principales con su valor absoluto e IC95%.
Se reclutaron 100 pacientes, 50 hombres (50%); media de edad 64 ± 12 años, 90% con al menos un factor de riesgo cardiovascular mayor, 18% con historia de fibrilación auricular, 94% con diagnóstico de infarto cerebral y el 6% restante de AIT.
Los mecanismos etiopatogénicos identificados de los ACVi, según neurólogo especializado en el diagnóstico y tratamiento del ACVi, están representados en la figura 1. Destacamos el alto porcentaje de pacientes con mecanismo indeterminado (42%), ya sea por ausencia de un mecanismo demostrado o por presencia de más de un mecanismo posible. La aortopatía aterosclerótica torácica está presente en el 62% de los pacientes. De ellos, la aortopatía potencialmente embolígena (APE) se presenta en 27 pacientes, la cual no tiene representación en la clasificación clásica de TOAST(10); de hecho, 17 pacientes de estos 27 se encuentran en el grupo indeterminados o sin clasificar (figura 1). Se considera APE a aquellas placas ateromatosas localizadas en aorta ascendente o cayado (proximales) y que además se presentan como complejas: ulceradas, protruyentes (midiendo más de 4 mm de altura) o con componente móvil asociado (debris).
En referencia al ecocardiograma, la fracción de eyección del ventrículo izquierdo (FEVI) fue de 57% ± 10% y predominó la presencia de cardiopatía estructural (tabla 1).
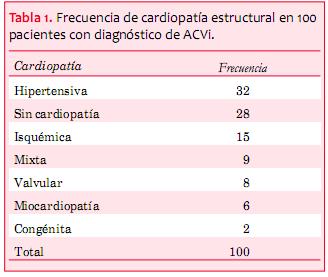
Las fuentes probables de cardioaortoembolia por ETE están ilustradas en la tabla 2 (23). Destacamos que 10 de 11 pacientes con fuente probable asociaban también una fuente posible; a su vez, 57 pacientes del total tenían al menos una fuente posible y 30 de ellos tenían al menos dos fuentes posibles. Finalmente, 42 pacientes no tenían fuente posible/probable.
Objetivo primario
El NEN para cambiar una estimación de riesgo fue de 2,85, IC 95% (2,3- 3,9) y para cambiar un tratamiento fue de 10,0, IC 95% (6,3-24,3). Los cambios de tratamientos realizados se muestran en la tabla 3. Los cálculos del NEN fueron hechos usando el paquete estadístico del libro Evidencias en Cardiología III, de Doval y Tajer, editorial Gedic, 2014.
Objetivo secundario
El ETT mostró una sensibilidad para el diagnóstico de cardioaortoembolia de 43,9% (IC 95% 31,0-56,7) y una especificidad de 81,4% (IC 95% 69,8-93,0) comparado con el ETE (tabla 4); cuando se trata de diagnosticar trombos en orejuela izquierda, la sensibilidad del ETT fue nula.
Se trata de un trabajo realizado en un servicio universitario con el concepto de integración de equipos especializados de trabajo (unidad de ACV y unidad de imagen cardíaca) con el objetivo de profundizar el conocimiento del rendimiento de las herramientas diagnósticas disponibles. Encontramos que el ETE utilizado en forma rutinaria en la valoración diagnóstica inicial de pacientes con ACVi aporta información clínicamente significativa, definiendo un cambio en la estimación del riesgo embólico en aproximadamente uno de cada tres pacientes y un cambio terapéutico efectivo en uno de cada diez, si bien este último punto no tuvo significación estadística.
Los resultados encontrados respecto a la capacidad diagnóstica del ETE versus ETT para fuentes de cardioembolia son acordes a los reportados por otros autores. Destacamos un trabajo de De Bruijin y colaboradores que reportan una sensibilidad del ETE mayor al doble que el ETT y concluyen que el ETE es superior al ETT en el estudio de pacientes de todas las edades con ACVi(18); mientras que Namara concluye que el uso de ETE en este escenario clínico no solo es superior clínicamente, sino que además es económicamente más rentable(22). Es importante destacar de todas maneras que si bien la sensibilidad del ETT es mala para fuentes de cardioembolia en su globalidad y muy mala para trombos intrauriculares, la especificidad de los hallazgos es clínicamente aceptable.
A su vez, si bien no encontramos significación estadística con los criterios de NEN definidos arbitrariamente, no llama la atención que al hacer nuevos diagnósticos y reclasificar el riesgo embólico de cada paciente, se ajuste o cambie la terapéutica, lo que sucedió también en uno de cada ocho pacientes de la serie de de Bruijin(18).
En el escenario aislado del paciente con fibrilación o flutter auricular en el cual no se plantea cardioversión y está definida la anticoagulación, la indicación de ETE se considera inapropiada según la guía de criterios para el uso de ecocardiografía transtorácica y transesofágica del 2007(19). El equipo investigador se preguntó ¿por qué deberíamos hacer ETE a estos pacientes con ACVi que tienen indicación previa de anticoagulación? No obstante, en nuestra serie encontramos otras causas posibles de embolia concomitantes en pacientes con historia de fibrilación auricular con y sin trombos en la orejuela, particularmente aortopatía. Esto ya ha sido descrito por otros autores y explicado por la epidemiología similar de ambas patologías cuya prevalencia aumenta en los más añosos(26,27).
La presencia de aortopatía incrementa el riesgo embólico si es proximal y compleja, pero también es conocido que la mera presencia de ateromatosis aórtica amerita el inicio de prevención vascular secundaria completa aun en ausencia de factores de riesgo cardiovascular o de otra evidencia de enfermedad vascular aterosclerótica (por ejemplo: joven sin factores de riesgo cardiovascular con ACVi y fibrilación auricular).
De acuerdo con los resultados de la alta prevalencia de aortopatía y aortopatía potencialmente embolígena, y su exclusión en la clasificación de TOAST para mecanismos etiopatogénicos del ACVi, nos planteamos si no sería necesario considerar que se incluya a la aortopatía potencialmente embolígena como un mecanismo independiente(11-18).
La concomitancia de potenciales fuentes de cardioaortoembolia en un mismo paciente y de otras causas posibles de ACVi no cardiogénicas plantea la duda de cuál es el mecanismo que efectivamente explicó el evento índice. Esta situación ya es conocida; dos trabajos de Howirtz en 1992 y Wessels en 2005 estudiaron pacientes con ACVi catalogados como infartos lacunares (cuyo mecanismo postulado es la oclusión in situ de pequeños vasos intracraneanos con microateromatosis o lipohialinosis) y encontraron que en un tercio era posible encontrar otro mecanismo, ya sea por patología cardíaca o de grandes arterias(28,29).
Otro elemento importante a considerar de nuestros resultados es que la presencia de trombos en la orejuela izquierda en pacientes aparentemente anticoagulados adecuadamente con antivitaminas K planteó la necesidad de aumentar el rango de anticoagulación de INR entre 2 y 3 a entre 2,5 y 3,5, o considerar el cambio a anticoagulantes orales no antivitamina K.
Finalmente, es necesario avanzar en la definición de causalidad entre los hallazgos encontrados y el mecanismo de ACVi invocado. Para eso, intentaremos definir la relevancia de los hallazgos del ETE en el diagnóstico etiopatógenico del ACVi y planificamos un estudio de diseño caso-control que pueda orientar a causalidad, según los hallazgos nos proponemos avanzar en un estudio prospectivo a largo plazo.
1. Uruguay. Ministerio de Salud Pública. Mortalidad en el Uruguay: defunciones registradas según causa de muerte, Uruguay 2008. Montevideo: MSP, 2008 Disponible en: http://www2.msp.gub.uy/ucepidemiologia_6490_1.html. [Consulta:].
2. Bonita R. Epidemiology of stroke. Lancet 1992; 339(8789):342-4.
3. Wolfe CD, Giroud M, Kolominsky-Rabas P, Dundas R, Lemesle M, Heuschmann P, et al. Variations in stroke incidence and survival in 3 areas of Europe: European Registries of Stroke (EROS) Collaboration. Stroke 2000; 31(9):2074-9.
4. Bamford J, Sandercock P, Dennis M, Warlow C, Jones L, McPherson K, et al. A prospective study of acute cerebrovascular disease in the community: the Oxfordshire Community Stroke Project 1981-86. 1. Methodology, demography and incident cases of first-ever stroke. J Neurol Neurosurg Psychiatry 1988; 51(11):1373-80.
5. Saka O, Serra V, Samyshkin Y, McGuire A, Wolfe CC. Cost-effectiveness of a stroke unit care followed by early supported discharge. Stroke 2009; 40(1):24-9.
6. Launois R, Giroud M, Mégnigbêto AC, Le Lay K, Présenté G, Mahagne MH, et al. Estimating the cost-effectiveness of stroke units in France compared with conventional care. Stroke 2004; 35(3): 770-5.
7. Zhu HF, Newcommon NN, Cooper ME, Green TL, Seal B, Klein G, et al; Calgary Stroke Program. Impact of a stroke unit on length of hospital stay and in-hospital case fatality. Stroke 2009; 40(1):18-23.
8. Sacco RL, Adams R, Albers G, Alberts MJ, Benavente O, Furie K, et al; American Heart Association/American Stroke Association Council on Stroke; Council on Cardiovascular Radiology and Intervention; American Academy of Neurology. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack: a statement for health care professionals from the American Heart Association/American Stroke Association Council on Stroke: co-sponsored by the Council on Cardiovascular Radiology and Intervention: the American Academy of Neurology affirms the value of this guideline. Circulation 2006; 113(10):e409-49.
9. Saposnik G, Del Brutto OH; Iberoamerican Society of Cerebrovascular Diseases. Stroke in South America: a systematic review of incidence, prevalence, and stroke subtypes. Stroke 2003; 34(9): 2103-7.
10. Adams HP Jr, Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL, et al. Classification of subtype of acute ischemic stroke: definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke 1993; 24(1):35-41.
11. Furie KL, Kasner SE, Adams RJ, Albers GW, Bush RL, Fagan SC, et al; American Heart Association Stroke Council, Council on Cardiovascular Nursing, Council on Clinical Cardiology, and Interdisciplinary Council on Quality of Care and Outcomes Research. Guidelines for the prevention of stroke in patients with stroke or transient ischemic attack: a guideline for health care professionals from the American Heart Association/American Stroke Association. Stroke 2011; 42(1):227-76.
12. Amarenco P, Duyckaerts C, Tzourio C, Hénin D, Bousser MG, Hauw JJ. The prevalence of ulcerated plaques in the aortic arch in patients with stroke. N Engl J Med 1992; 326(4):221-5.
13. Amarenco P, Cohen A, Tzourio C, Bertrand B, Hommel M, Besson G, et al. Atherosclerotic disease of the aortic arch and the riskof ischemic stroke. N Engl J Med 1994; 331(22):1474-9.
14. Mitusch R, Doherty C, Wucherpfennig H, Memmesheimer C, Tepe C, Stierle U, et al. Vascular events during follow-up in patients with aortic arch atherosclerosis. Stroke 1997; 28(1):36-9.
15. Toyoda K, Yasaka M, Nagata S, Yamaguchi T. Aortogenic embolic stroke: a transesophageal echocardiographic approach. Stroke 1992; 23(8):1056-61.
16. Beltrán A, González Moreno J,Pizzano N,PousoJ, Besada E. Ateromatosis protruyente de la aorta torácica proximal: uno de los factores de riesgo más marcados de los accidentes cerebrovasculares isquémicos. Rev Urug Cardiol 1995; 10:62-72.
17. deBruijn SF, Agema WR, Lammers GJ, van der Wall EE, Wolterbeek R, et al. Transesophageal echocardiography is superior to transthoracic echocardiography in management of patients of any age with transient ischemic attack or stroke. Stroke 2006; 37(10):2531-4.
18. Douglas PS, Khandheria B, Stainback RF, Weissman NJ, Brindis RG, Patel MR, et al; American College of Cardiology Foundation Quality Strategic Directions Committee Appropriateness Criteria Working Group; American Society of Echocardiography; American College of Emergency Physicians; American Society of Nuclear Cardiology; Society for Cardiovascular Angiography and Interventions; Society of Cardiovascular Computed Tomography; Society for Cardiovascular Magnetic Resonance; American College of Chest Physicians; Society of Critical Care Medicine. ACCF/ASE/ACEP/ASNC/SCAI/SCCT/SCMR 2007 appropriateness criteria for transthoracic and transesophageal echocardiography: a report of the American College of Cardiology Foundation Quality Strategic Directions Committee Appropriateness Criteria Working Group, American Society of Echocardiography, American College of Emergency Physicians, American Society of Nuclear Cardiology, Society for Cardiovascular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and the Society for Cardiovascular Magnetic Resonance endorsed by the American College of Chest Physicians and the Society of Critical Care Medicine. J Am Coll Cardiol 2007; 50(2):187-204.
19. Karalis DG, Chandrasekaran K, Victor MF, Ross JJ Jr, Mintz GS. Recognition and embolic potential of intraaortic atherosclerotic debris. J Am Coll Cardiol 1991; 17(1):73-8.
20. Chen EW, Redberg RF. Evaluación ecocardiográfica de pacientes con episodios embólicos sistémicos. En: Otto CM. Ecocardiografía clínica práctica. 3 ed. Barcelona: Elsevier, 2010:969-98.
21. Omran H, Jung W, Rabahieh R, Wirtz P, Becher H, Illien S, et al. Imaging of thrombi and assessment of left atrial appendage function: a prospective study comparing transthoracic and transoesophageal echocardiography. Heart 1999; 81(2):192-8.
22. Kronik G, Stöllberger C, Schuh M, Abzieher F, Slany J, Schneider B. Interobserver variability in the detection of spontaneous echo contrast, left atrial thrombi, and left atrial appendage thrombi by transoesophageal echocardiography. Br Heart J 1995; 74(1):80-3.
23. Masip AE, Alonso Gómez AM, Durán RM, Moreno Yagüela M, Oliver Ruiz JM, Rodríguez Padial L, et al. Guías de práctica clínica de la Sociedad Española de Cardiología en ecocardiografía. Rev Esp Cardiol 2000; 53(5):663-83.
24. McNamara RL, Lima JA, Whelton PK, Powe NR. Echocardiographic identification of cardiovascular sources of emboli to guide clinical management of stroke: a cost-effectiveness analysis. Ann Intern Med 1997; 127(9):775-87.
25. Thambidorai SK, Murray RD, Parakh K, Shah TK, Black IW, Jasper SE, et al; ACUTE investigators. Utility of transesophageal echocardiography in identification of thrombogenic milieu in patients with atrial fibrillation (an ACUTE ancillary study). Am J Cardiol 2005; 96(7):935-41.
26. Pujadas R, Arboix A, Anguera N, Oliveres M, Massons J, Comes E. Papel de las placas complejas de ateroma aórtico en la recurrencia del infarto cerebral de etiología incierta. Rev Esp Card 2005; 58(1):34-40.
27. Wessels T, Röttger C, Jauss M, Kaps M, Traupe H, Stolz E. Identification of embolic stroke patterns by diffusion-weighted MRI in clinically defined lacunar stroke syndromes. Stroke 2005; 36(4):757-61.
28. Horowitz DR, Tuhrim S, Weinberger JM, Rudolph SH. Mechanisms in lacunar infarction. Stroke 1992; 23(3):325-7.
29. Jauch EC, Saver JL, Adams HP Jr, Bruno A, Connors JJ, Demaerschalk BM, et al; American Heart Association Stroke Council; Council on Cardiovascular Nursing; Council on Peripheral Vascular Disease; Council on Clinical Cardiology. Guidelines for the early management of patients with acute ischemic stroke: a guideline for health care professionals from the American Heart Association/American Stroke Association. Stroke 2013; 44(3):870-947.
30. García Fernández MA, Bermejo J, Moreno M. Utilidad de las técnicas de imagen en la valoración etiológica y las tomas de decisiones en el paciente con ictus. Rev Esp Cardiol 2003; 56(11):1119-32.
Apéndice 1. Criterios de diagnóstico ecocardiográficos utilizados
Contraste espontáneo
- Ecogenicidad evanescente con aspecto de humo intracavitario.
Trombo en aurícula/orejuela izquierda
- Ecogenicidad con bordes relativamente bien definidos con base en pared de aurícula izquierda u orejuela izquierda, con algún movimiento perceptible.
- Ecogenicidad diferente a la de la pared.
- Sin evidencia de flujo en su interior.
- Contraste espontáneo persistente (más de ocho ciclos cardíacos), se consideró de igual valor a las tres premisas anteriores.
Ateromatosis aórtica
- Simple: engrosamiento difuso de la íntima mayor a 2 mm; engrosamiento protruyente de la íntima/media £ 4 mm.
- Compleja: engrosamiento protruyente de la íntima/media > 4 mm o irregularidad del borde luminal del engrosamiento con una profundidad hacia la media ³ 2mm (úlcera) o componente móvil asociado al engrosamiento intimal (debris).
Aneurisma del septum interauricular
- Excursión del septum interauricular ³ 11 mm durante el ciclo cardíaco involucrando una extensión del septum ³ 15 mm.
Foramen oval permeable derecha a izquierda
- Evidencia de shunt de derecha a izquierda en la topografía del ostium secundum con maniobra de Valsalva y morfología sin solución de continuidad fuera de esta maniobra (diagnóstico de comunicación interauricular). Se realizó en todos los pacientes maniobra de suero batido para aumentar la sensibilidad del diagnóstico. Se consideró positiva la presencia de burbujas en la AI dentro de los tres primeros latidos posinyección de contraste y con maniobra de Valsalva.
Vegetación
- Masa relacionada a las válvulas y sus aparatos subvalvulares, prótesis valvulares, implantes intracardíacos o en el trayecto de jets regurgitantes, con movimiento independiente, en ausencia de una explicación anatómica alternativa y cuadro clínico compatible con endocarditis infecciosa.
Strand
- Masa filiforme única o múltiple, de 5-10 mm de longitud, asociada a las válvulas o prótesis valvulares en ausencia de cuadro clínico compatible con endocarditis infecciosa.
Alto riesgo embólico:
- Prótesis valvular mecánica
- Estenosis mitral con fibrilación auricular
- Fibrilación auricular (no aislada)
- Trombo en aurícula izquierda
- Trombo en ventrículo izquierdo
- Síndrome de seno enfermo
- Infarto agudo de miocardio reciente (<4 semanas)
- Miocardiopatía dilatada
- Aquinesia de segmento ventricular izquierdo
- Mixoma auricular
- Endocarditis infecciosa
Mediano riesgo embólico:
- Infarto agudo de miocardio mayor a cuatro semanas y menor a seis meses
- Turbulencia auricular izquierda (humo)
- FA aislada
- Flutter auricular
- Endocarditis trombótica no bacteriana
- Insuficiencia cardíaca congestiva
- Hipoquinesia de segmento ventricular izquierdo
- Prótesis valvular biológica
- Foramen oval permeable (FOP)
- Aneurisma del septum interauricular (ASIA)
- Prolapso de válvula mitral (PVM)
- Calcificación anillo mitral
- Estenosis mitral en ritmo sinusal
Apéndice 3. Clasificación ecocardiográfica de fuentes de cardioaortoembolia (23)
Fuente probable del émbolo:
- Trombo auricular izquierdo
- Trombo en el ventrículo izquierdo
- Vegetación mitral o aórtica (mayor 10 mm)
- Mixoma
Fuente posible del émbolo:
- Foramen oval permeable (FOP)
- Aneurisma del tabique interauricular (ASIA)
- Auriculomegalia izquierda (mayor a 40 mm)
- Ateroma aórtico
- Prótesis mitral o aórtica
- Valvulopatía mitral reumática
- Calcificación anular mitral
- Comunicación interauricular (CIA)
- Filamentos valvulares fibrinosos (strands)
- Prolapso de la válvula mitral (PVM)
- Vegetación (menor a 10 mm)
- Aneurisma del ventrículo izquierdo
- Miocardiopatía dilatada