Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.29 no.3 Montevideo dic. 2014
CARDIOPATÍAS CONGÉNITAS
DEL ADULTO
Aspectos ecocardiográficos básicos
Dr. Daniel Felipe Guzzo de León1
1. Coordinador del Comité Docente de Cardiología Pediátrica. Universidad de la República, Escuela de Graduados, Facultad de Medicina.
Cardiólogo Pediatra de la Asociación Española y del Hospital Evangélico.
Palabras clave:
ADULTO
ECOCARDIOGRAFÍA
CARDIOPATÍAS CONGÉNITAS-diagnóstico
Key words:
ADULT
ECHOCARDIOGRAPHY
HEART DEFECTS, CONGENITAL-diagnostic
Estimaciones funcionales de carácter general y de uso rutinario en ecocardiografía
Evaluación de la presión arterial pulmonar utilizando la insuficiencia valvular tricuspídea
La hipertensión sistólica significativa del ventrículo derecho (VD) siempre produce de modo secundario algún grado de incompetencia de la válvula tricúspide. El registro ecocardiográfico de esta incompetencia con Doppler continuo permite estimar la velocidad máxima (Vmax) del chorro de regurgitación y, mediante la ecuación de Bernoulli simplificada (4 Vmax2), estimar el gradiente sistólico que se establece entre la presión sistólica del VD y la aurícula derecha (AD). Si a este gradiente se le adiciona la presión venosa central (PVC), el resultado de dicha operación expresa la presión sistólica del VD. Si se desconoce el dato de la PVC, se puede proceder de la siguiente manera: 1) Si la dimensión de la vena cava inferior (VCI) es normal (12 a 23 mm) y colapsa en inspiración por lo menos 50%, agregar 5 mmHg; 2) si la dimensión de VCI es normal pero no colapsa por lo menos 50%, agregar 10 mmHg; 3) si la VCI está dilatada pero colapsa en inspiración, agregar 15 mmHg; 4) si la VCI está dilatada y no colapsa en inspiración, agregar 20 mmHg(1). Obsérvese que lo que se estima mediante este procedimiento es la presión sistólica del VD y no la presión sistólica arterial pulmonar. Si no existe obstrucción en la vía de salida del VD, se asume que la presión sistólica arterial pulmonar es la misma que la presión sistólica del VD.
Cálculo del casto cardíaco, índice cardíaco y relación gasto pulmonar/gasto sistémico
El volumen sistólico de un latido puede estimarse confiablemente mediante ecocardiografía Doppler. El mismo se obtiene del producto entre el área de un segmento y la velocidad integral (VTI) en el mismo sitio. A gasto constante, el producto área por VTI también es constante. Para estimar el volumen sistólico sistémico es necesario medir el diámetro del tracto de salida del ventrículo izquierdo (TSVI) a nivel subvalvular aórtico. Se utiliza el enfoque paraesternal de eje largo. Asumiendo que el TSVI es una estructura circular, la medición de su diámetro permite estimar el área de ese segmento mediante la fórmula para el cálculo de área de un círculo (pR2). Este valor expresado en cm2 multiplicado por VTI expresado en cm (que surge de la envolvente realizada sobre el perfil de flujo subvalvular aórtico desde el enfoque apical de cuatro cámaras o desde apical eje largo), permite obtener el volumen-latido (en cm3). El volumen-latido multiplicado por la frecuencia cardíaca proporciona el gasto cardíaco (GC) que se expresa habitualmente en l/min. El GC dividido por el área corporal proporciona el índice cardíaco que se expresa en l/min/m2. El mismo procedimiento puede realizarse a nivel subvalvular pulmonar, habitualmente en paraesternal eje corto, para obtener el diámetro subvalvular pulmonar en el tracto de salida del ventrículo derecho (TSVD) y el VTI en ese mismo sitio. De la correlación entre ambos se deriva la relación gasto pulmonar/gasto sistémico (QP/QS), dato de importancia en la valoración de cardiopatías con cortocircuitos de izquierda a derecha. Obsérvese que el punto crucial de estas medidas es la estimación de los diámetros de los tractos de salida, de los cuales se obtiene el radio, debido a que esta medida posteriormente se eleva al cuadrado en la fórmula del área de un círculo y eso magnifica cualquier error que se haya tenido en la obtención de la misma. El GC también puede calcularse (aunque menos confiablemente) a nivel de los anillos mitral y tricuspídeo utilizando el mismo criterio (área por VTI), también asumiendo que estos anillos son estructuras circulares. Resulta de importancia destacar aquí que el lugar elegido para estas estimaciones no es igual para cualquier caso de cortocircuito. Es así que en la comunicación interauricular (CIA) el cortocircuito se produce a nivel auricular y las estructuras que se ven sobrecargadas de volumen debido al mismo son la válvula tricúspide (VT) y a nivel subvalvular pulmonar. En cualquiera de estos dos sitios puede calcularse el gasto pulmonar. En contrapartida el gasto sistémico debe calcularse a nivel del anillo valvular mitral o a nivel subvalvular aórtico. Pero si el cortocircuito se produce a nivel ventricular (comunicación interventricular [CIV]) entonces las estructuras recargadas de volumen son la válvula pulmonar y luego de la recirculación, la válvula mitral, de modo que el gasto “pulmonar” puede calcularse a nivel subvalvular pulmonar y a nivel del anillo mitral. El gasto “sistémico” debe estimarse a nivel subvalvular aórtico y en el anillo de la válvula tricúspide. Finalmente, si el cálculo a efectuar corresponde al cortocircuito que se establece en un ductus arterioso permeable (obsérvese que este cortocircuito se produce distalmente a la válvula pulmonar), entonces el gasto “pulmonar” debe calcularse a nivel del anillo mitral o a nivel subvalvular aórtico luego de la recirculación a través del árbol pulmonar y el gasto “sistémico” a nivel del anillo de la válvula tricúspide o a nivel subvalvular pulmonar(1).
Además del GC, como se explicó en al párrafo anterior, los siguientes parámetros exploran la función sistólica del ventrículo izquierdo (VI).
1. Fracción de acortamiento. Se calcula desde el enfoque paraesternal eje largo midiendo la dimensión diastólica del VI y luego la dimensión sistólica. La diferencia entre ambas, dividido la dimensión diastólica, constituye la fracción de acortamiento cuyo valor normal debe ser 28% o superior.
2. Fracción de eyección del ventrículo izquierdo (FEVI). Se calcula estimando el volumen sistólico y diastólico del VI. Constituye un método más preciso que la fracción de acortamiento. La diferencia entre ambos volúmenes, dividido el volumen diastólico, constituye el porcentaje que eyecta el ventrículo respecto de lo recibido. Existen varios métodos para estimar el volumen del VI, pero el más difundido y de mayor confiabilidad es el método de Simpson. Este método supone que el VI puede subdividirse en múltiples cilindros de pequeña altura, como una pila de monedas de diferente diámetro. Cuantas más monedas teóricas se incorporen al cálculo, mayor exactitud. LA FEVI debe ser por lo menos de 55%.
3. Doppler tisular de la extremidad septal y lateral del anillo mitral. El mismo se calcula colocando el volumen muestra en una de estas dos ubicaciones. Una excursión de la extremidad lateral del anillo (onda S’) de 10 cm/s o superior supone una función sistólica conservada.
Principales parámetros de función sistólica del ventrículo derecho
La morfología del VD dificulta la evaluación de su función sistólica porque no existe un modelo geométrico con el cual pueda compararse y además porque su dinámica de contracción “peristáltica”(2,3) complica la evaluación de las distintas fases de la contracción ventricular.
En la actualidad resulta imposible medir la fracción de eyección del VD mediante ecocardiografía bidimensional. La ecocardiografía tridimensional constituye un aporte fundamental en este aspecto. Sin embargo, existen medidas sustitutivas que han demostrado correlación satisfactoria con otros parámetros de utilidad para estimar la función sistólica de este ventrículo.
2. El Doppler tisular del anillo tricuspídeo también resulta un buen indicador de la función sistólica de este ventrículo. Un desplazamiento (onda S’) inferior a 10 cm/s es indicador de disfunción sistólica del ventrículo derecho(6).
3. Finalmente, el desplazamiento sistólico del anillo tricuspídeo (TAPSE) es otro modo conceptualmente emparentado con el anterior, que resulta útil para estimar la función sistólica del VD. Se mide colocando el cursor de modo M entre el ápex y el anillo lateral tricuspídeo. Desplazamientos inferiores a 17 mm son altamente específicos para detectar disfunción sistólica del VD en adultos. Este parámetro ha demostrado buena correlación con estimaciones de fracción de eyección realizadas mediante angiografía radioisotópica(7).
Índice de Tei o índice de performance miocárdica
El índice de Tei constituye un marcador de eficiencia ventricular global (sistólica y diastólica)(8-10) que también ha demostrado su valor en la evaluación funcional del VD(11,12). Lo mencionamos aquí solamente a modo de referencia.
Cardiopatías congénitas vírgenes de tratamiento
1. Comunicación interauricular
En la actualidad es poco frecuente que una comunicación interauricular (CIA) llegue sin diagnóstico y tratamiento a la vida adulta. Existen varios tipos de defectos del septum interauricular: secundum, primum (en el contexto de defectos de la tabicación atrioventricular), y tipo seno venoso (alto o bajo) próximos a las desembocaduras de la vena cava superior (VCS) o de la VCI respectivamente. No es el cometido de esta publicación explicar las características morfológicas de cada uno de ellos. El lector interesado puede recurrir a cualquier libro de texto convencional.
La evaluación ecocardiográfica es similar a la que se utiliza en el niño, independientemente del tipo morfológico de defecto, excepto para el ostium secundum, que por ser el único pasible de cierre con dispositivos requiere algunas consideraciones especiales.
Es importante evaluar el tamaño del defecto comparando su dimensión con la dimensión total del septum interauricular en cada uno de estos dos enfoques. Un defecto que sea igual o superior a 30% del tabique se considera amplio. Finalmente es conveniente estimar la magnitud del cortocircuito realizando el cálculo de QP/QS. Un QP/QS superior a 1,5 indica cortocircuito significativo. También debe saberse que la velocidad de flujo baja (< 1,0 m/s) a través de la CIA implica un defecto amplio, no restrictivo, y que un defecto pequeño, restrictivo, implica flujo turbulento con velocidad entre 1,0 y 2,0 m/seg. En el momento actual, todas las CIA de tipo secundum del adulto deben cerrase mediante implante de dispositivo por cateterismo intervencionista siempre que las condiciones anatómicas del defecto lo permitan.
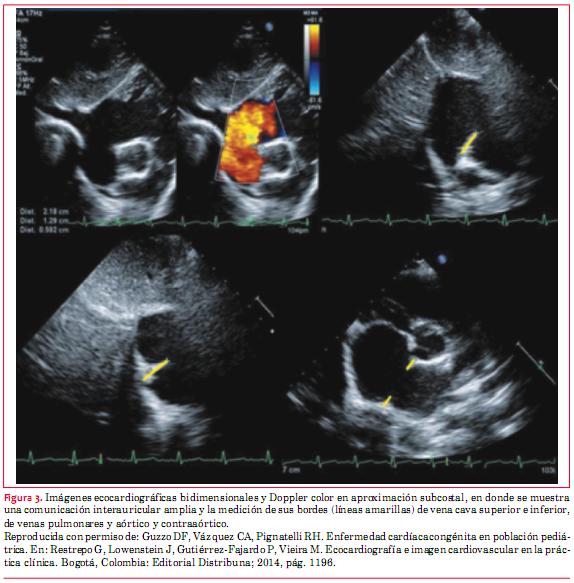
Finalmente resulta de importancia medir los bordes del defecto con miras a su oclusión mediante dispositivos. Los mismos deben medir por lo menos 5 mm(13) y debe realizarse esta medición respecto a varias estructuras circundantes a saber: VCS, VCI, venas pulmonares, mitral, aórtico y contraaórtico (figura 3)(14).
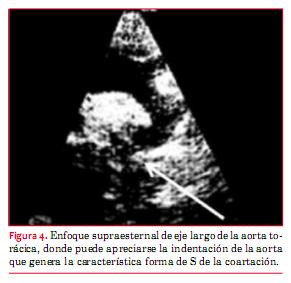
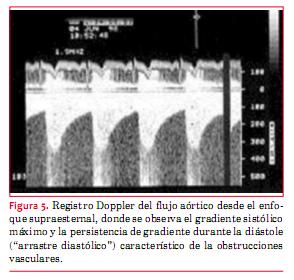
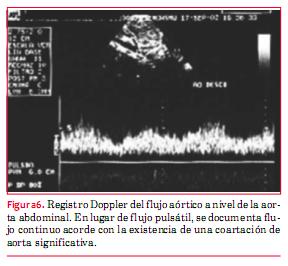
En la coartación de aorta (CoAo) posductal la morfología de la aorta es anormal en forma de S, como puede apreciarse en la figura 4. A este nivel suele observarse flujo turbulento con velocidad aumentada y gradiente que persiste en diástole (“arrastre diastólico”) (figura 5). Finalmente la aorta abdominal carece de expansión sistólica y de flujo pulsátil, registrándose, en cambio, flujo continuo (figura 6). La magnitud del gradiente registrado depende de la importancia de la coartación pero también de la magnitud de la circulación colateral que se haya desarrollado. Un gradiente sistólico máximo de 20 mmHg o superior se considera indicación para actuar sobre la misma (nivel de evidencia C)(15).
En la CoAo tratada por cirugía o de forma percutánea se deberá evaluar el posible desarrollo de aneurismas. Si se efectuó angioplastia con implante de stent, es procedente valorar posición del mismo y estado de su luz en búsqueda de trombos y la posibilidad de fracturas y desplazamientos de sectores del mismo.
3. Estenosis pulmonar
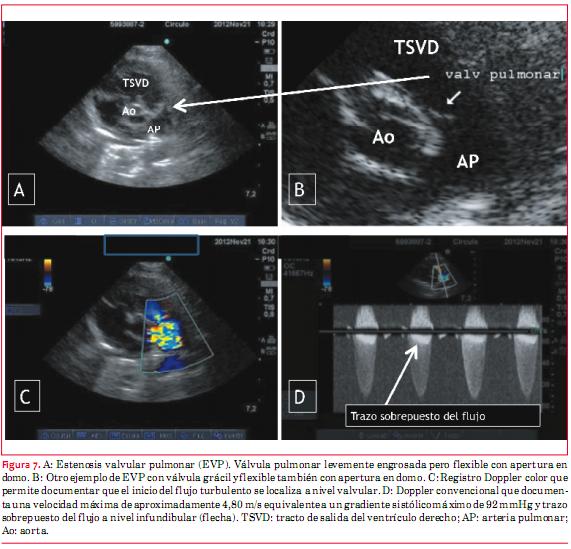
La estenosis pulmonar (EP) puede ser subvalvular, valvular o supravalvular. Abordaremos aquí únicamente la estenosis valvular pulmonar. El diagnóstico ecocardiográfico de estenosis valvular pulmonar (figura 7) incluye la visualización de la válvula para definir su anatomía, lo cual es habitualmente dificultoso en adultos. Con fines terapéuticos resulta importante definir si la válvula es delgada, fina, delicada, flexible (con apertura “en domo”), habitualmente pasible de dilatación con balón, o, si por el contrario, la misma es gruesa, displásica, rígida, la que habitualmente requiere de tratamiento quirúrgico. Las características hemodinámicas son de importancia en la elaboración diagnóstica. En primer lugar hay que determinar la dirección del flujo o chorro turbulento y estimar, en función de este, los gradientes sistólicos máximo y medio. En otro sentido debe evaluarse la existencia o no de hipertrofia del VD y también la existencia o no de incompetencia valvular pulmonar asociada. El espesor de la pared libre del VD debe definirse desde subcostal cuatro cámaras. Asimismo debe medirse el diámetro de la arteria pulmonar y las ramas que pueden estar dilatadas, principalmente la arteria pulmonar y su rama izquierda. Por último, la presencia de incompetencia tricuspídea permite calcular la presión sistólica del VD.
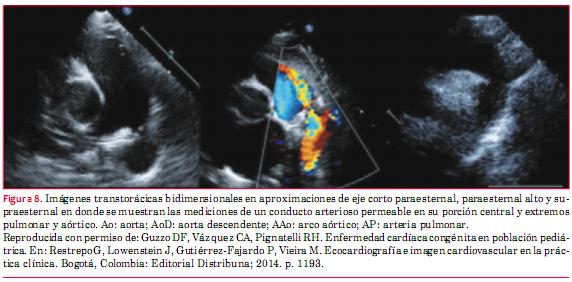
En la actualidad resulta extremadamente infrecuente que un ductus arterioso permeable (DAP) pase desapercibido hasta la vida adulta. El DAP dilata cavidades izquierdas, principalmente la aurícula izquierda (AI) y por ello un parámetro clásico en la valoración de la repercusión funcional del DAP es la relación AI/Aorta (Ao) cuyo valor máximo normal = 1,5. Se debe valorar también la función sistólica del VI. Finalmente, la valoración morfológica del ductus se logra mediante su visualización directa (figura 8 y figura 9 A y B). El enfoque ideal para este cometido suele ser paraesternal eje corto a nivel de los grandes vasos. En recién nacidos y niños habitualmente puede realizarse un barrido entre este corte y el supraesternal eje largo (paraesternal alto) que en adultos es más dificultoso. En este trayecto frecuentemente es posible obtener la imagen del ductus adecuadamente desplegado como para medir longitud y sección del mismo, aspectos de importancia si se plantea su cierre mediante dispositivos. También en este enfoque es donde habitualmente se logra un mejor alineamiento del chorro ductal con el haz del ultrasonido para registrar su flujo característico (figura 9 C y D). Finalmente, como en todo cortocircuito de izquierda a derecha, debe determinarse el QP/QS. Una comparación útil para la evaluación del tamaño ductal es su tamaño relativo respecto del tamaño de la rama izquierda de la arteria pulmonar (RPI). Un DAP cuyo diámetro supere 75% de la RPI se considera un DAP amplio; 50% mediano, y menos de 50% pequeño.
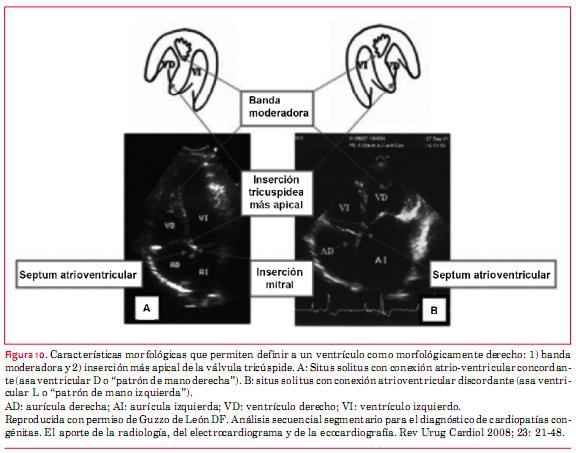
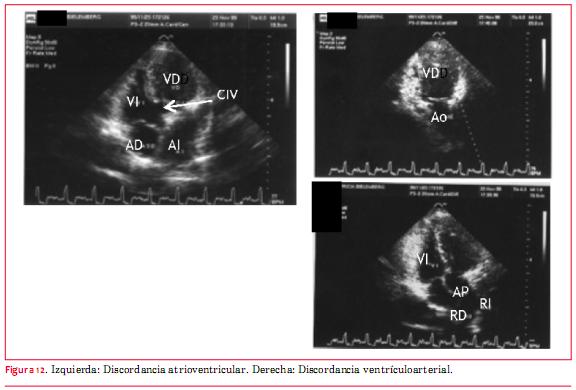
Esta anomalía, antiguamente denominada “inversión ventricular”, puede presentarse en situs solitus o inversus y consiste básicamente en la presencia de doble discordancia (atrioventricular y ventriculoarterial). De modo que la sangre proveniente de las venas cavas llega a la AD y de esta cavidad a un ventrículo morfológicamente izquierdo. Del ventrículo morfológicamente izquierdo emerge la arteria pulmonar y por ello la circulación está fisiológicamente “corregida”. En recirculación, las venas pulmonares vierten su sangre en la aurícula izquierda (AI) que aboca en un ventrículo morfológicamente derecho del cual emerge la aorta. El diagnóstico ecocardiográfico de esta anomalía requiere el conocimiento del análisis secuencial segmentario(16). Básicamente debe saberse que los ventrículos se definen ecográficamente estrictamente por su morfología. El VD es el que tiene la banda moderadora y su válvula auriculoventricular (AV) (tricúspide) presenta una inserción más apical (figura 10)(16).
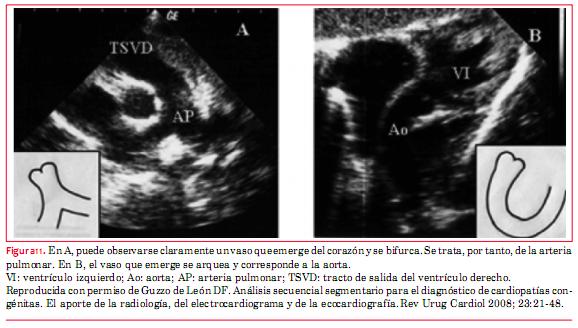
Respecto de los grandes vasos, la arteria pulmonar es el vaso que se bifurca(16) (figuras 11 y 12). Esta anomalía puede llegar a la vida adulta sin tratamiento, excepto que se desarrolle incompetencia valvular tricuspídea (válvula AV sistémica) de grado severo, o bloqueo AV completo que requiera el implante de un marcapasos, y por eso tiene importancia su conocimiento para el ecocardiografista de adultos. Las anomalías asociadas más frecuentes son CIV y estenosis subpulmonar que se evalúan del mismo modo que cuando estas alteraciones se presentan de forma independiente. La incompetencia valvular sistémica (válvula tricúspide) se evalúa de modo equivalente a la insuficiencia valvular mitral.
1. Tetralogía de Fallot
Las secuelas más frecuentes luego de la reparación quirúrgica de esta anomalía son: defecto septal ventricular residual, estenosis infundibular residual e incompetencia valvular pulmonar. De todas ellas, la insuficiencia valvular pulmonar es la de mayor importancia en la evolución alejada de estos pacientes. La evaluación ecográfica del Fallot corregido implica la evaluación de la función sistólica y diastólica de ambos ventrículos como en toda valoración ecográfica del corazón, pero debe saberse que en este contexto tanto la función sistólica como la diastólica de ambos ventrículos influyen significativamente en la magnitud de la regurgitación pulmonar(17). El volumen del VD (no medible por ecocardiografía bidimensional) es una de las medidas de mayor relevancia en la evaluación de este problema porque se recomienda el reemplazo valvular pulmonar antes de que el volumen del VD supere 170 ml/m2 en diástole u 85 ml/m2 en sístole(18,19).
Obviamente la valoración del cortocircuito residual en la CIV y la estenosis pulmonar residual son componentes adicionales de esta valoración. Además debe evaluarse la incompetencia tricuspídea porque constituye un parámetro de indicación para el reemplazo valvular pulmonar. Por último, en esta entidad resulta de importancia la evaluación de la válvula aórtica. El hecho de que esta válvula congénitamente haya carecido de septum interventricular como soporte de la misma y además la condición de una aorta habitualmente dilatada por el cortocircuito original de derecha a izquierda, propio de la anomalía, constituyen razones para que la válvula aórtica, con relativa frecuencia, sea insuficiente.
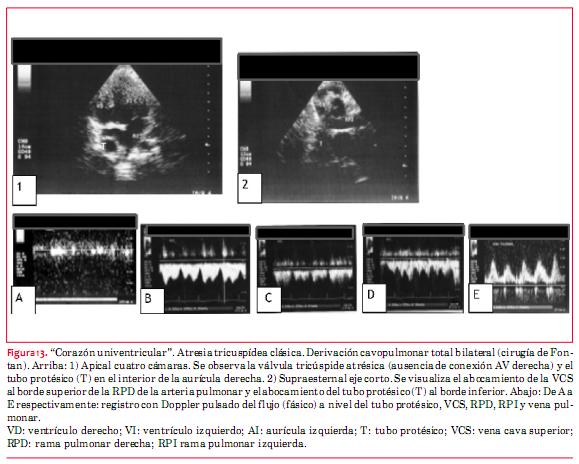
La cirugía de Fontan deriva el retorno venoso sistémico directamente hacia la rama derecha de la arteria pulmonar. Esta derivación se realiza quirúrgicamente en dos etapas. La primera abocando directamente la VCS al borde superior de la rama pulmonar derecha. La segunda derivando por intermedio de un tubo protésico el flujo procedente de la VCI al borde inferior de la misma arteria pulmonar.
La energía para este modelo circulatorio procede del único ventrículo disponible para ello, que funciona como ventrículo sistémico y por “vis a tergo” mantiene la circulación arterial pulmonar.
Como consecuencia, la circulación pulmonar deja de ser pulsátil y se transforma en una circulación fásica de tipo venoso. Esta es la característica fundamental que debe evaluarse mediante la técnica Doppler, para asegurar que el sistema está funcionando de modo adecuado. Utilizando Doppler pulsado deben obtenerse registros del tubo protésico, de la VCS, VCI, ambas ramas de la arteria pulmonar y de las venas pulmonares (figura 13). La presencia de flujo continuo implica obstrucción. Los aspectos morfológicos son de menor importancia que lo señalado precedentemente. Sin embargo debe efectuarse una evaluación minuciosa en búsqueda de trombos en los distintos sectores de la circulación de Fontan (venas cavas, tubos protésicos y ramas de la arteria pulmonar). Finalmente resulta de capital importancia evaluar la función sistólica y diastólica del único ventrículo viable, de cuya funcionalidad depende todo el sistema. En este aspecto resulta de importancia, además, valorar los aspectos funcionales (estenosis o insuficiencia) de la o las válvulas auriculoventriculares, lesiones obstructivas (valvular, subvalvular o supravalvular) o incompetencia que pudieran asentar a nivel aórtico. Cuando la aorta emerge del ventrículo hipoplásico (no viable), adquiere relevancia la evaluación en búsqueda de obstrucción, de la CIV o foramen bulbo-ventricular, que permite la comunicación entre ambos ventrículos.
Lo principal a evaluar es la existencia o no de isquemia ventricular, ya que en la cirugía existe un reimplante de las arterias coronarias y eso puede determinar un acodamiento o abocamiento inadecuado de las mismas que comprometa el flujo coronario del VI. Debemos considerar la motilidad segmentaria del VI así como la función sistólica y diastólica de ambos ventrículos.
Otro aspecto a evaluar es la evolución de las cicatrices en aorta y arteria pulmonar. La fibrosis de las mismas puede generar diversos grados de obstrucción supravalvular pulmonar o supravalvular aórtico. Obviamente estos dos aspectos son de capital importancia en la valoración del posoperatorio alejado de este procedimiento.
Además, si hubo cortocircuitos, valorar la presencia de shunts residuales a nivel atrial, ventricular o a nivel ductal.
4. Comunicación interventricular residual
Ocasionalmente, luego de un procedimiento quirúrgico, queda como secuela un defecto septal ventricular residual. Este tipo de defectos suele ser pequeño. Su evaluación ecocardiográfica se lleva a cabo del mismo modo que para valorar una CIV primitiva. Es necesario determinar dimensiones cavitarias, especialmente las izquierdas, que son las que reciben la sobrecarga de volumen en este tipo de cortocircuitos. Debe valorarse la función ventricular y, si las condiciones del estudio lo permiten, realizar una estimación del QP/QS. La presencia de cavidades izquierdas dilatadas y/o un QP/QS > 1,5 deben alertar acerca de la posibilidad de repercusión hemodinámica del defecto.
Aunque es muy poco probable que el tamaño de este tipo de defecto, habitualmente restrictivo, genere hipertensión arterial pulmonar, es conveniente realizar las estimaciones pertinentes, como se ha explicado previamente. Un parámetro adicional que debe tenerse en cuenta en este defecto es la visualización del chorro en el defecto. Un flujo turbulento (mosaico de colores con Doppler color) descarta la presencia de hipertensión arterial pulmonar. Es conveniente, sin embargo, alinear el Doppler continuo con el chorro para determinar la diferencia de presiones entre ambos ventrículos. En este contexto, si se conoce la presión sistólica arterial sistémica, por diferencia puede estimarse la presión sistólica del VD, y, en ausencia de obstrucción en el tracto de salida del ventrículo derecho (TSVD), esta diferencia de presiones permite calcular la presión sistólica arterial pulmonar.
5. Patología mitral en posoperatorio de defectos de la tabicación atrioventricular (canal AV)
La secuela quirúrgica de mayor relevancia en los pacientes corregidos quirúrgicamente de la variedad completa de defecto de la tabicación atrioventricular (canal AV) lo constituye la incompetencia de la válvula mitral. Este defecto se corrige de elección a los seis meses de edad, por lo que si la incompetencia mitral es significativa, tiene repercusión clínica tempranamente y debe reintervenirse (plastia mitral o reemplazo valvular mitral) mucho antes de alcanzar la vida adulta. Los controles posteriores del paciente adecuadamente tratado de esta anomalía lo constituyen la incompetencia valvular mitral y tricuspídea de grado leve y las estenosis leves de las mismas válvulas, que deben ser evaluadas periódicamente con los procedimientos y técnicas ecocardiográficas convencionales, de amplia difusión en publicaciones y libros de texto, para el que realiza ecocardiografía de adultos. Los defectos septales residuales a nivel de los tabiques interatrial e interventricular se evalúan, como explicamos precedentemente, del mismo modo que se valoran estos defectos en su presentación aislada fuera del contexto de este espectro de malformaciones.
Bibliografía
1. Guzzo DF, Vázquez CA, Pignatelli RH. Enfermedad cardíaca congénita en población pediátrica. En: Restrepo G, Lowenstein J, Gutiérrez-Fajardo P, Vieira M. Ecocardiografía e imagen cardiovascular en la práctica clínica. Bogotá, Colombia: Editorial Distribuna; 2014. p. 1194.
2. Ginés F, Grignola JC. Right ventricular contraction synchronization due to an acute afterload increase. Left ventricle-like mechanical properties of the right ventricle. Rev Esp Cardiol 2001; 54: 973-980.
3. Grignola JC, Pontet J, Vallarino M, Ginés F. Características propias de las fases del ciclo cardíaco del ventrículo derecho. Rev Esp Cardiol 1999; 52:37-42.
4. Guzzo de León DF. Insuficiencia valvular pulmonar en el posoperatorio alejado de tetralogía de Fallot. Aporte del ecocardiograma transtorácico convencional para la toma de decisiones. Rev Urug Cardiol 2013; 28: 42-56.
5. Anavekar NS, Gerson D, Skali H, Kwong RY, Yucel EK, Solomon SD. Two-dimensional assessment of right ventricular function: an Echocardiographic-MRI correlative study. Echocardiography 2007; 24: 452-6.
6. Mor-Avi V, Lang RM, Badano LP, Belohlavek M, Cardim NM, Derumeaux G, et al. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics: ASE/EAE consensus statement on methodology and indications: endorsed by the Japanese Society of Echocardiography. J Am Soc Echocardiogr 2011; 24:277-313.
7. Ueti OM, Camargo EE, Ueti Ade A, de Lima-Filho EC, Nogueira EA. Assessment of right ventricular function with Doppler echocardiographic indices derived from tricuspid annular motion: comparison with radionuclide angiography. Heart 2002; 88: 244-8.
8. Tei C. New non-invasive index for combined systolic and diastolic ventricular function. J Cardiol 1995; 26:135-36.
9. Tei C, Dujardin KS, Hodge DO, Bailey KR, McGoon MD, Tajik AJ, et al. Doppler echocardiographic index for assessment of global right ventricular function. J Am Soc Echocardiogr 1996; 9: 838 – 46.
10. Tei C, Nishimura RA, Seward JB, Tajik AJ. Noninvasive Doppler-derived myocardial performance index: correlation with simultaneous measurements of cardiac catheterization measurements. J Am Soc Echocardiogr 1997; 10: 169-78.
11. Jurcut R, Giusca S, La Gerche A, Vasile S, Ginghina C, Voigt J-U. The echocardiographic assessment of the right ventricle: what to do in 2010? Eur J Echocardiogr 2010; 11:81-96.
12. Grignola JC, Ginés F. Guzzo D. Comparison of the Tei index with invasive measurments of right ventricular function. Int J Cardiol 2006; 113: 25 – 33.
13. Chiesa P, Giúdice J, Morales J, Gambetta JC, Peluffo C, Duhagón P. Diez años de experiencia en el cierre percutáneo de la comunicación interauricular y del ductus arterioso persistente. Rev Urug Cardiol 2008; 23: 5-14.
14. Guzzo DF, Vázquez CA, Pignatelli RH. Enfermedad cardíaca congénita en población pediátrica. En: Restrepo G, Lowenstein J, Gutiérrez-Fajardo P, Vieira M. Ecocardiografía e imagen cardiovascular en la práctica clínica. Bogotá, Colombia: Editorial Distribuna, 2014; p. 1196
15. Warnes CA, Williams RG, Bashore TM, Child JS, Connolly HM, Dearani JA, et al. ACC/AHA 2008 guidelines for the management of adults with congenital heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Develop Guidelines on the Management of Adults With Congenital Heart Disease) Developed in Collaboration With the American Society of Echocardiography, Heart Rhythm Society, International Society for Adult Congenital Heart Disease, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol 2008; 52(23):e143-263.
16. Guzzo de León DF. Análisis secuencial segmentario para el diagnóstico de cardiopatías congénitas: el aporte de la radiología, del electrocardiograma y de la ecocardiografía. Rev Urug Cardiol 2008; 23: 21-48.
17. Kilner PJ. Pulmonary regurgitation in relation to pulmonary artery compliance and other variables. In: Redington AN, Van Arsdell GS, Anderson RH eds. Congenital heart diseases in the right heart. London: Springer–Verlag, 2009; p. 247-50.
18. Guleserian KJ. Adult congenital heart disease: surgical advances and options. Prog Cardiovasc Dis 2011; 53:254-64.
19. Oosterhof T, van Straten A, Vliegen HW, Meijboom FJ, van Dijk APJ, Spijkerboer AM, et al. Preoperative thresholds for pulmonary valve replacement in patients with corrected Tetralogy of Fallot using cardiovascular magnetic resonance. Circulation 2007; 116:545-51.