Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.29 no.3 Montevideo dic. 2014
Artículo de revisión
CARDIOPATÍAS CONGÉNITAS
DEL ADULTO
Trastornos del ritmo
Dres. José Moltedo1, Alejandro Cuesta2
1. Cardiólogo. Electrofisiólogo pediatra. Ex Fellow de Cardiología Pediátrica. Yale University, Connecticut. Ex Fellow de Electrofisiología pediátrica. Baylor College of Medicine. Clínica y Maternidad Suizo Argentina, Buenos Aires.
2. Cardiólogo. Electrofisiólogo. PhD. Instituto de Cardiología Integral (ICI-MUCAM).
Palabras clave:
Adulto
Arritmias cardíacas
Cardiopatías congénitas
Key words:
Adult
Arrhythmias, Cardiac
Heart Defects, Congenital
Introducción
Los avances en el diagnóstico de los pacientes con cardiopatías congénitas (CC), las técnicas quirúrgicas y los cuidados posoperatorios están permitiendo sobrevidas mayores y más niños alcanzan la edad adulta. Una de las consecuencias del aumento del número de adultos con CC es que asistimos a más complicaciones alejadas, y, dentro de ellas, los trastornos del ritmo. Por su alta prevalencia, afectación de sobrevida y calidad de vida, necesidad de procedimientos terapéuticos y altos costos, los trastornos del ritmo tienen gran importancia en el manejo del paciente adulto con CC(1).
El 45% de los pacientes adultos con CC tiene una forma leve, por ejemplo una comunicación intraauricular solucionada. Otro 35% tiene formas moderadas como la tetralogía de Fallot. Hay 15% que han sobrevivido a cardiopatías complejas y han sido sometidos a cirugías paliativas o correctivas que dejaron una anatomía alterada. La incidencia de arritmias es creciente en cada uno de estos grupos(2).
Las causas de las arritmias en estos pacientes son múltiples y a veces combinadas:
· Existen anormalidades estructurales cardíacas congénitas que se asocian al nacer a sustratos arritmogénicos específicos y, por lo tanto, también congénitos. En la enfermedad de Ebstein, junto a todo el defecto en la unión auriculoventricular (AV) derecha y su válvula, persisten tractos musculares que conectan la aurícula y el ventrículo y conducen el impulso eléctrico. Estas vías accesorias son causantes del síndrome de Wolff-Parkinson-White. En la transposición congénitamente corregida de los grandes vasos (L-TGA) la mala alineación de los septos auricular y ventricular determina una posición anormal del nodo AV. La conexión del nodo con el ventrículo se hace por un haz de His largo, superficial y expuesto al estrés hemodinámico. Esta es la base anatómica de los frecuentes bloqueos AV.
· Existen situaciones hemodinámicas particulares en cada cámara cardíaca, relacionadas con la fisiopatología de cada CC y que solemos esquematizar en sobrecargas de volumen y de presión. Ambas van determinando la aparición de hipertrofia, dilatación y fibrosis en distinta proporción. Con ellas, se va adquiriendo el sustrato anatómico para la aparición de trastornos del ritmo.
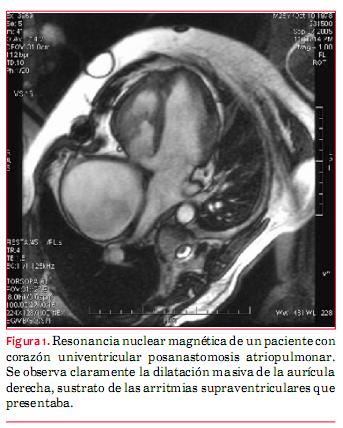
· Hay un segundo grupo de causas adquiridas y que son las que devienen de los tratamientos invasivos recibidos (figura 1). Se originan por el traumatismo directo de los tejidos, por ejemplo incisiones, interposiciones de materiales como los parches de pericardio, cierre de orificios con dispositivos, abocamiento de vasos/tubos, etcétera. Los trastornos del ritmo son más frecuentes en los pacientes con CC que han sido sometidos a algún procedimiento. Se lo acepta como un costo a pagar. Cuanto más tarde se realiza el procedimiento, correctivo o paliativo, mayor el riesgo de tener arritmias en el futuro.
· Sobre los tres tipos de problemas estructurales antes mencionados luego intervienen las alteraciones crónicas y agudas del medio interno, como la hipoxia y las disionías. También los fármacos indicados por la propia cardiopatía o por otras patologías eventualmente asociadas. Recordemos que las CC a veces asientan en pacientes con complejos síndromes genéticos y dismórficos que afectan múltiples sistemas.
Los adultos con CC presentan trastornos del ritmo rápidos y lentos. Incluso asocian ambos tipos en un mismo paciente, en los denominados síndrome bradicardia-taquicardia. La forma de presentación clínica varía ampliamente, desde el paciente que se encuentra asintomático y se descubre una arritmia hasta el que sufre una muerte súbita.
Tipos de trastornos del ritmo
Taquicardias
Las taquicardias son una complicación altamente prevalente en esta población. Si bien se pueden presentar por cualquier mecanismo, en el paciente crónico las arritmias por reentrada son las más frecuentes.
Existen algunos defectos que se asocian con mayor frecuencia a determinadas arritmias, pero no hay ningún vínculo exclusivo entre una cardiopatía y una arritmia o viceversa. Conociendo el tipo de cardiopatía y los procedimientos que se han realizado se puede inferir las arritmias esperables o viceversa, pero hay que mantener siempre la mente abierta.
Taquicardia por reentrada intraauricular
La taquicardia por reentrada intraauricular (TRIA) es la más frecuente en pacientes con CC tratadas o no(1,2). Por definición, está determinada por la instalación de un circuito de macrorreentrada confinado a las aurículas. Puede estar en torno a una cicatriz, a la salida/llegada de uno o más vasos, a una prótesis, a una zona de bloqueo funcional secundaria a la remodelación, o a una combinación de ellas.
El flutter auricular típico es la arritmia por macrorreentrada auricular más conocida en los adultos en general y también puede presentarse en pacientes con CC(3). El circuito de reentrada del flutter auricular típico involucra el istmo entre la vena cava y el anillo tricuspídeo. El electrocardiogrma (ECG) presenta una línea de base en dientes de sierra o serrucho característica y su frecuencia está entre 250 y 350 cpm.
La TRIA tiene características distintas al flutter auricular típico. En el ECG se observa una línea de base con oscilaciones regulares, pero con morfologías distintas y la frecuencia suele ser más lenta. Según la función del nodo AV, esto último permite que más veces la conducción sea 1 a 1 y se alcancen frecuencias ventriculares muy elevadas. A pesar de ello, en algunas ocasiones los pacientes no presentan síntomas. Si el índice de sospecha durante la evaluación no es alto, los pacientes pueden desarrollar taquimiocardiopatía con el subsiguiente deterioro hemodinámico y estructural. En presencia de alteraciones de la conducción ventricular y con tasas de bloqueo fijas, la TRIA puede ser difícil de diagnosticar si no se sospecha aún en el ECG (figura 2).
Para corregir la transposición de grandes arterias (D-TGA) se realizaban cirugías auriculares extensas que reorientaban los retornos venosos. Los más conocidos son los procedimientos de Mustard y Senning. Con el tiempo se vio que hasta 30% de los pacientes presentaban una o más TRIA de muy difícil tratamiento, y que a veces obligan hasta la reintervención. En gran medida y debido a esto se han dejado de practicar estos procedimientos de forma sistemática, pero muchos han llegado a adultos(4).
La comunicación auricular (CIA) es otra patología que se asocia a la ocurrencia de TRIA, antes y luego de su corrección. El flutter auricular típico también es frecuente en estos pacientes(8). La sobrecarga de volumen crónica contribuye al remodelado principalmente de cavidades derechas y al desarrollo de arritmias auriculares de ese origen. Afectan entre 34% y 41% de los pacientes de 35 a 40 años y a casi el 60% de los mayores de 40 años(9).
La tetralogía de Fallot poscorrección puede complicarse con arritmias auriculares en 10% a 12% y frecuentemente aleteo auricular. Se relacionan con la dilatación ventricular y el desarrollo de insuficiencia tricuspídea, con la consecuente dilatación auricular(10).
Taquicardia por reentrada en vía accesoria auriculoventricular
Ya dijimos que la enfermedad de Ebstein se asocia a una mayor incidencia de vías accesorias (síndrome de Wolff-Parkinson-White) y en menor medida también la L-TGA(11,12). Estos pacientes registran además una mayor incidencia de vías accesorias múltiples y, por lo tanto, mayor frecuencia de taquicardia por reentrada antidrómica y probablemente riesgo de muerte súbita.
Si a lo anterior sumamos la ocurrencia de TRIA, flutter típico y/o fibrilación auricular conducido por las vías accesorias puede resultar riesgoso. La conducción rápida de estas arritmias a los ventrículos puede degenerar en fibrilación ventricular y muerte súbita.
La presencia de vías accesorias ocultas puede darse en cualquier paciente, pero no conocemos una asociación específica con ninguna CC.
Fibrilación auricular
La fibrilación auricular es una arritmia menos frecuente que la reentrada auricular, pero más que en la población general. Puede verse en operados de CIA(8) y Fallot, pero es más común en pacientes con patologías que determinan sobrecarga de cavidades izquierdas. Los mejores ejemplos de ello son la estenosis aórtica congénita en cualquiera de sus variedades y la coartación de aorta.
Taquicardias ventriculares
Los pacientes con tetralogía de Fallot corregida tienen muy buen pronóstico, con una expectativa de vida que supera el 85% a los 30 años de intervenidos(13,14). Pero desafortunadamente su principal forma de muerte es súbita y la causa de esta son los trastornos del ritmo. Se ha estimado que hasta 12% de los pacientes seguidos a 35 años presentarán en algún momento taquicardia ventricular (figura 3) (10). Esto se debe a la presencia de cicatrices en el ventrículo derecho secundarias a la técnica de cierre de la comunicación interventricular y a la extensión de la incisión a nivel del tracto de salida del ventrículo derecho y eventual parche para mejorar la obstrucción del tracto de salida. Se han descrito como factores de riesgo: la edad tardía en que se realizó la reparación, la existencia de un cortocircuito paliativo previo (tipo Blalock-Taussig), la insuficiencia pulmonar persistente, la magnitud de la sobrecarga de volumen del ventrículo derecho y su grado de dilatación(10). Desde el punto de visto electrofisiológico los predictores más mencionados son la extrasistolía ventricular, la taquicardia ventricular no sostenida y el ancho del QRS mayor a 180 ms. La inducción de taquicardia ventricular sostenida en el estudio electrofisiológico puede ayudar a resolver los casos dudosos. A pesar de la descripción de múltiples factores y hasta de algún algoritmo de decisión, no hay acuerdo respecto en qué pacientes realizar el implante de un desfibrilador en prevención primaria(15). El riesgo de taquicardia ventricular y de todas las arritmias es mayor luego de los 40 años de edad.
Algunas veces la taquicardia ventricular es secundaria a los trastornos hemodinámicos persistentes que determinan remodelación y disfunción. Es el caso de la L-TGA (el ventrículo derecho está en posición sistémica) o de la D-TGA, luego de las cirugías de Senning o Mustard. En pacientes con corazones univentriculares el desarrollo de taquiarritmias ventriculares es menos frecuente, pero de muy mal pronóstico ya que se terminan las opciones terapéuticas(16-18).
Bradiarritmias
Los ritmos lentos pueden ser secundarios a trastornos en la generación o en la conducción del impulso que dan los bloqueos. Uno o ambos pueden estar presentes de forma congénita, acompañando la malformación o instalarse en la evolución.
En los isomerismos derechos existen dos aurículas morfológicamente derechas y dos nódulos sinusales que pueden competir en el comando del ritmo. En los isomerismos izquierdos, con dos aurículas morfológicamente izquierdas, suele no haber un nódulo sinusal y el ritmo se origina en el nódulo AV o el tejido auricular cercano (ritmo bajo). Estos últimos pueden dar más problemas por bradicardia y/o incompetencia cronotrópica.
En el seguimiento alejado de los pacientes con D-TGA poscirugía de Senning o Mustard, solo el 50% presenta un ritmo sinusal normal(18).
Es común que la disfunción sinusal se acompañe de enfermedad más extensa del tejido específico auricular y de la conducción AV. En estos casos se habla de síndrome del nódulo sinusal enfermo y suele presentarse con síndrome bradicardia-taquicardia.
El bloqueo AV completo congénito es una patología que se presenta en la mayoría de las veces aislada y solo el 30% se asocia a una cardiopatía estructural. En la mayoría de los casos se termina indicando el implante de un marcapasos y llegan a adultos con esa condición agregada. Se tiene que realizar su seguimiento adecuado y atender todas las complicaciones(20).
Pero también los trastornos de la conducción pueden instalarse en la evolución de forma espontánea o luego de procedimientos quirúrgicos. En los defectos tipo canal AV es común el bloqueo AV de primer grado. Cuando se acompañan de isomerismo izquierdo, la asociación con bloqueo AV completo es mayor que en la forma pura. Durante la reparación el riesgo de bloqueo AV completo está entre 2% y 3%, particularmente cuando se requiere más trabajo sobre las válvulas. Cuando en el adulto es necesaria la reintervención para el implante de prótesis valvulares la necesidad de marcapasos definitivos es mayor(21).
Como ya fue mencionado, en los pacientes con L-TGA la porción compacta del nodo AV no se encuentra en la posición habitual (ápex del triángulo de Koch), si no en una posición anterolateral favoreciendo el desarrollo de bloqueo AV(22). Esto puede ocurrir de forma espontánea o con un mínimo traumatismo durante un cateterismo o en la cirugía.
En los pacientes con comunicación interventricular reparada es común encontrar bloqueo de rama derecha, pero el bloqueo AV completo es poco frecuente. Su ocurrencia es casi exclusiva del perioperatorio y está en torno al 1%. Lo mismo ocurre en el Fallot(21). Incidencias mayores que esta obligan a evaluar la técnica que se está empleando.
Muerte súbita
La muerte súbita constituye una complicación a considerar en el seguimiento alejado de los pacientes con CC. Puede ser secundaria a taquiarritmias ventriculares pero también a bradicardias secundarias al desarrollo de bloqueo AV completo.
La incidencia de muerte súbita es variable de acuerdo al tipo de cardiopatía. Se ha demostrado que las cardiopatías con cortocircuito de izquierda a derecha –comunicación interauricular, interventricular, ductus arterioso persistente– o las lesiones obstructivas derechas como la estenosis valvular pulmonar, no tienen una incidencia de muerte súbita significativamente mayor a la población general. Por el contrario, en los pacientes intervenidos por tetralogía de Fallot, D-TGA y lesiones obstructivas izquierdas, la incidencia es significativamente mayor(16). En los pacientes tratados con cirugías de Senning o Mustard se ha identificado que la presencia de síntomas y/o arritmias auriculares son predictores de muerte súbita(17).
Diagnóstico
La pesquisa de síntomas compatibles con arritmias a través del interrogatorio detallado es de importancia vital en el seguimiento de estos pacientes. El ECG de superficie es parte de la semiología. Debe evaluarse con detenimiento y recurrir a la comparación con los trazados anteriores que se deben conservar. En algunas oportunidades será necesario realizar maniobras diagnósticas clínicas, como ejercicio o Valsalva. En otras serán necesarias maniobras farmacológicas, como la administración de adenosina, para llegar a un diagnóstico apropiado. Todo esto debe realizarlo personal que tenga experiencia en el manejo de estos pacientes.
En el ECG debe atenderse a las características de la onda P. Su fraccionamiento nos habla de enfermedad del tejido. Su duración prolongada en pacientes con corazones univentriculares se relaciona con el desarrollo de arritmias(8).
El bloqueo AV de primer grado en pacientes con CC adquiere mayor importancia. Todos los trastornos de la conducción en pacientes intervenidos deben evaluarse con detenimiento y no subestimarse. La asociación con bloqueo de la conducción intraventricular es un signo importante. La duración del QRS nos habla de las secuelas quirúrgicas, la desincronización y en casos particulares de su riesgo de muerte súbita.
En el seguimiento de adultos con CC será necesario solicitar paraclínica de acuerdo a la clínica y a lo protocolizado en cada situación(2,23). Por ejemplo, en los pacientes con cirugía de Senning o Mustard se recomienda la realización de un monitoreo Holter de 24 horas cada uno o dos años. Esto es para la pesquisa de taquiarritmias supraventriculares y ventriculares y la aparición de disfunción del nodo sinusal. Ante la sospecha clínica se debe realizar una ergometría para evaluar la función sinusal en actividad(23).
El desarrollo de arritmias en adultos con CC debe considerarse como un “mensajero” de alteraciones en el estado hemodinámico. Ante la detección de una arritmia se debe evaluar de manera minuciosa esta situación. Se debe solicitar la realización de un ecocardiograma por personal capacitado en CC. La resonancia magnética está adquiriendo un lugar cada vez más importante en el mundo.
No es raro comenzar evaluando una arritmia y llegar a la necesidad de realizar un nuevo cateterismo cardíaco. Siempre debemos despejar todas las causas primarias tratables antes de abocarnos solamente al tratamiento del ritmo.
La utilidad del estudio electrofisiológico en las bradiarritmias es muy limitada. La información derivada de los estudios no invasivos, en general es suficiente para la toma de decisiones terapéuticas. Escapan a esta generalización algunos casos límite para la indicación de un marcapasos y el estudio de algunos pacientes con síncope.
En pacientes con taquiarritmias la información que se obtiene del estudio electrofisiológico es de mayor utilidad. La mayoría de las veces precede al tratamiento con ablación en el mismo procedimiento. En otros casos sirve para hacer diagnóstico, estratificar riesgo y/o orientar un eventual tratamiento farmacológico.
En algunos casos se puede realizar el estudio hemodinámico invasivo y electrofisiológico en un mismo acto y para la conveniencia del paciente.
Tratamiento
Taquiarritmias supraventriculares
En el manejo farmacológico de pacientes con CC tenemos poca evidencia científica de buena calidad metodológica. La mayoría de las veces nos fundamentamos en la experiencia informada por centros de referencia, que no siempre es homogénea, en la extrapolación de resultados de otras poblaciones y en la experiencia del centro en que se asiste el paciente.
Para el tratamiento con fármacos antiarrítmicos es importante considerar los efectos adversos potenciales y las contraindicaciones que poseen algunos de estos en pacientes con cardiopatía estructural. También hay que considerar las acciones en otros sistemas eventualmente afectados, como amiodarona en paciente con patología respiratoria(24).
Las opciones disponibles y la respuesta a cada fármaco varían de acuerdo al tipo específico de taquicardia. Hay que tener en cuenta cuál es el sustrato de la arritmia y usar fármacos que actúen a ese nivel.
Cuando hay una vía accesoria podemos comenzar el tratamiento con betabloqueantes. Debería advertirse del riesgo de los betabloqueantes en caso de fibrilación auricular preexcitada. Pero sabemos que estos fármacos actúan fundamentalmente a nivel del nodo AV y no de la vía accesoria. Si con esto el paciente logra controlar los episodios es muy bueno, por su baja incidencia de efectos adversos. Pero es muy probable que debamos recurrir a fármacos del grupo I, como flecainida y propafenona, o del grupo III, como sotalol y amiodarona. Si la vía accesoria tiene conducción anterógrada –WPW– el uso de digoxina está formalmente contraindicado.
Cada vez hay más reportes respecto al uso de sotalol. Tendría menos efectos adversos a largo plazo que la amiodarona. Hay grupos que lo utilizan como primera elección en la TRIA(25).
Cuando queramos aumentar la tasa de bloqueo de una arritmia auricular permanente, o que no podemos evitar que ocurra, los betabloqueantes y la digoxina son de primera elección. Actúan primordialmente sobre el nodo AV y son bastante bien tolerados. Para la digoxina deberemos estar atentos a la función renal y dosificar su nivel en plasma.
En pacientes con corazones univentriculares el tratamiento farmacológico es, en general, poco eficaz. Los fármacos más utilizados son sotalol y amiodarona, pero siempre con mucha precaución. El inicio de sotalol se debe hacer con el paciente internado para controlar el QTc y su efecto pro arrítmico. En pacientes con tratamiento crónico con amiodarona es importante el examen periódico de la función tiroidea y hepática. Los fármacos del grupo IC se encuentran contraindicados en este grupo de pacientes.
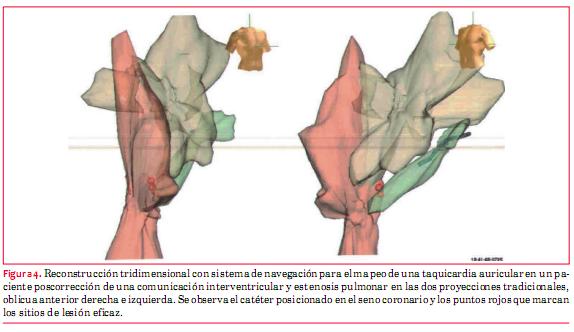
En los últimos años ha ganado lugar el tratamiento invasivo mediante catéteres. A los recursos técnicos con los que se contaba se han agregado los sistemas de navegación no radiológicos que ya están en nuestro medio (figura 4). Permiten trabajar sobre la imagen virtual de la cámara cardíaca que se quiere, localizar mejor las estructuras anatómicas, parches, cicatrices, ver en detalle los circuitos de la arritmia, elegir el punto más vulnerable y aumentar la probabilidad de ablación efectiva(27-29).
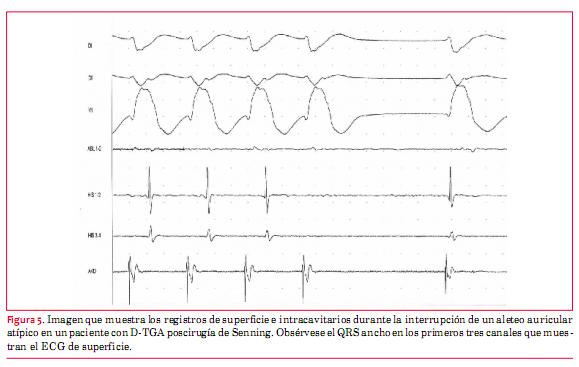
En los pacientes con D-TGA sometidos a cirugías de Senning o Mustard con flutter auricular, la ablación es una buena alternativa con una tasa de curación alta(30). En la figura 5 se observa la interrupción de un flutter durante la aplicación de radiofrecuencia. En pacientes con corazones univentriculares la efectividad es menor, ya que hay mayor limitación de accesos al tejido auricular y suelen tener más de un circuito. La tasa de recurrencia también es alta (figura 6).
Hay casos graves en los que la arritmia es el problema primario, no se logra controlar y se llega a la reintervención quirúrgica. También se puede intentar realizar la ablación con radiofrecuencia a cielo abierto durante la intervención. Hay casos de arritmias auriculares que no se pueden controlar o que bajo medicación se originan bradicardias en que la estrategia termina siendo ablación del nodo AV e implante de marcapasos definitivo(29,31).
Taquiarritmias ventriculares
Las arritmias ventriculares no complejas –extrasístoles aisladas o duplas– en general no requieren de tratamiento. Aunque actualmente sabemos que existen casos que requieren ser medicados e incluso realizar su ablación.
En los pacientes con taquicardia sostenida, espontánea o inducible durante un estudio electrofisiológico, se debe investigar la presencia de factores hemodinámicos, residuales de la cirugía o nuevos, pasibles de ser corregidos por cateterismo o una nueva cirugía. Luego de resuelta o descartada la intervención se deberá revalorar al paciente. Si consideramos que persiste un riesgo considerable de recurrencia y/o muerte súbita se tendrá que indicar un desfibrilador automático implantable (DAI)(2).
Algunas taquicardias ventriculares son fáciles de inducir, sostenidas y bien toleradas por el paciente. En estas resulta más atractivo intentar el tratamiento mediante ablación por radiofrecuencia(29). Esto puede ser para el tratamiento de inicio o indicarse en pacientes que ya tienen un DAI y están recibiendo muchas terapias apropiadas. Todavía no es claro que la ablación prevenga la muerte súbita, pero sí que mejoraría claramente la calidad de vida.
Los pacientes que presentan taquicardia ventricular sostenida y fibrilación ventricular sin causa reversible y/o paro cardíaco reanimado tienen indicación de DAI(15). En los corazones con corrección biventricular es posible la colocación de sistemas endocavitarios con umbrales de desfibrilación aceptables. En pacientes con corazones univentriculares o con cortocircuitos intracardíacos significativos se debe optar por sistemas epicárdicos y muchas veces aplicar técnicas innovadoras, como la utilización de catéteres con trayectos subcutáneos suturados al epicardio o el implante de catéteres endocavitarios por vía transmural. Ya existen DAI totalmente subcutáneos que tienen una aplicación obvia en estos pacientes, aunque no cuentan con la posibilidad de estimulación.
En casos de persistencia de arritmias complejas en las cuales se ha agotado la instancia de un tratamiento convencional médico-percutáneo y que además pueda poner en riesgo la vida del paciente estará indicado el trasplante cardíaco(32).
Bradiarritmias
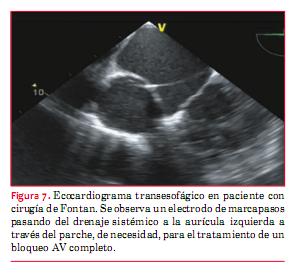
El tratamiento de las bradiarritmias sintomáticas en pacientes con CC es la estimulación cardíaca. Igual que para los DAI, dada la distorsión anatómica habitual luego de una cirugía, se debe analizar con detalle la vía y los sitios de implante de los dispositivos. Los pacientes con corazón univentricular posanastomosis cavopulmonar total carecen de acceso venoso al corazón, por lo cual se deben considerar distintas alternativas para el implante del marcapasos(19). Si se tiene la necesidad de dejar un electrodo por vía sistémica debemos saber que tiene riesgo de accidentes tromboembólicos y requerirá siempre anticoagulación crónica (figura 7). Por tal motivo, la vía epicárdica es la más utilizada aunque el resultado y la duración a largo plazo de los electrodos es inferior a los endocavitarios.
Dado que el implante de un sistema epicárdico requiere de esternotomía, en muchos centros, cuando deben abordar el mediastino, ya dejan electrodos conectados y abocados a un fácil acceso por si se necesitan en el futuro. Como alternativa a la vía epicárdica puede utilizarse la vía transatrial, colocando catéteres endocavitarios a través de la pared de la aurícula. Las indicaciones precisas de implante exceden a esta revisión y se remite al lector a las guías respectivas(33).
El creciente número de pacientes con CC que alcanzan la edad adulta determinan un aumento de la frecuencia de arritmias en esta población.
La frecuencia relativa de cada tipo de arritmia es distinta a la población general. Existe relación, aunque no es unívoca, entre los tipos de arritmias y la CC de base.
Existe una asociación entre la ocurrencia de arritmias y las alteraciones hemodinámicas y anatómicas. Cuando presenciamos unas debemos buscar siempre las otras.
El tratamiento farmacológico debe indicarse en el contexto clínico de cada paciente. Es la primera elección, pero de utilidad limitada y con efectos adversos significativos.
Los tratamientos invasivos están teniendo grandes avances en técnicas y resultados. Los pacientes con CC que deben ser tratados con ablación o con un implante presentan complejidades particulares y deben ser atendidos en centros con experiencia.
Bibliografía
1. Brickner ME, Hillis LD, Lange RA. Congenital heart disease in adults. First of two parts. N Engl J Med. 2000;342(4):256-63.
2. Khairy P, Van Hare GF, Balaji S, Berul CI, Cecchin F, et al. PACES/HRS Expert Consensus Statement on the Recognition and Management of Arrhythmias in Adult Congenital Heart Disease: Executive Summary: Developed in partnership between the Pediatric and Congenital Electrophysiology Society (PACES) and the Heart Rhythm Society (HRS). Endorsed by the governing bodies of PACES, HRS, the American College of Cardiology (ACC), the American Heart Association (AHA), the European Heart Rhythm Association (EHRA), the Canadian Heart Rhythm Society (CHRS), and the International Society for Adult Congenital Heart Disease (ISACHD). Heart Rhythm 2014; 11(10):e81-e101.
3. Chan DP, Van Hare GF, Mackall JA, Carlson MD, Waldo AL. Importance of atrial flutter isthmus in postoperative intra-atrial reentrant tachycardia. Circulation 2000;102(11):1283-9.
4. Kanter RJ, Papagiannis J, Carboni MP, Ungerleider RM, Sanders WE, Wharton JM. Radiofrequency catheter ablation of supraventricular tachycardia substrates after mustard and senning operations for d-transposition of the great arteries. J Am Coll Cardiol 2000; 35(2):428-41.
5. Peters NS, Somerville J. Arrhythmias after the Fontan procedure. Br Heart J 1992; 68(2):199-204.
6. Gelatt M, Hamilton RM, McCrindle BW, Gow RM, Williams WG, Trusler GA, et al. Risk factors for atrial tachyarrhythmias after the Fontan operation. J Am Coll Cardiol 1994; 24(7):1735-41.
7. Weipert J, Noebauer C, Schreiber C, Kostolny M, Zrenner B, Wacker A, et al. Occurrence and management of atrial arrhythmia after long-term Fontan circulation. J Thorac Cardiovasc Surg 2004;127(2):457-64.
8. Bink-Boelkens MTHE. Postoperative atrial septal defects. En: Balaji S, Gillette PC, Case CL, eds. Cardiac arrhythmias after surgery for congenital heart disease. London: Arnold, 2001.
9. Chiesa P, Cuesta A. Trastorno del ritmo postcierre del foramen oval con dispositivo Amplatzer. Rev Urug Cardiol 2012; 27:1-5.
10. Gatzoulis MA, Balaji S, Webber SA, Siu SC, Hokanson JS, Poile C, et al. Risk factors for arrhythmia and sudden cardiac death late after repair of tetralogy of Fallot: a multicentre study. Lancet 2000;356(9234):975-81.
11. Blaufox AD, Saul JP. Accessory-pathways mediated tachycardias. En: Walsh EP, Saul JP, Triedman JK, eds. Cardiac arrhythmias in children and young adults with congenital heart disease. Philadelphia: Lippincott Williams & Wilkins, 2001.
12. Levine JC, Walsh EP, Saul JP. Radiofrequency ablation of accessory pathways associated with congenital heart disease including heterotaxy syndrome. Am J Cardiol 1993;72(9):689-93.
13. Nollert G, Fischlein T, Bouterwek S, Böhmer C, Klinner W, Reichart B. Long-term survival in patients with repair of tetralogy of Fallot: 36-year follow-up of 490 survivors of the first year after surgical repair. J Am Coll Cardiol 1997;30(5):1374-83.
14. Murphy JG, Gersh BJ, Mair DD, Fuster V, McGoon MD, Ilstrup DM, et al. Long-term outcome in patients undergoing surgical repair of tetralogy of Fallot. N Engl J Med. 1993;329(9):593-9.
15. Khairy P, Harris L, Landzberg MJ, Viswanathan S, Barlow A, Gatzoulis MA, et al. Implantable cardioverter-defibrillators in tetralogy of Fallot. Circulation 2008; 117(3):363-70.
16. Silka MJ, Hardy BG, Menashe VD, Morris CD. A Population Based Prospective Evaluation of Risk of Sudden Cardiac Death After Operation for Common Congenital Heart Defects. J Am Coll Cardiol 1998; 32:245-51.
17. Kammeraad JA, van Deurzen CH, Sreeram N, Bink-Boelkens MT, Ottenkamp J, Helbing WA, et al. Predictors of sudden cardiac death after Mustard or Senning repair for transposition of the great arteries. J Am Coll Cardiol 2004;44(5):1095-102.
18. Kirklin JW, Barrat-Boyes BG. Complete transposition of the great arteries. En: Kirklin JW, Barrat-Boyes BG, eds. Cardiac Surgey. New York: Churchill Livingston, 1993.
19. Takahashi K, Cecchin F, Fortescue E, Berul CI, Alexander ME, Walsh EP, et al. Permanent atrial pacing lead implant route after Fontan operation. Pacing Clin Electrophysiol 2009;32(6):779-85.
20. Bordachar P, Zachary W, Ploux S, Labrousse L, Haissaguerre M, Thambo JB. Pathophysiology, clinical course, and management of congenital complete atrioventricular block. Heart Rhythm 2013; 10(5):760-6.
21. Anderson JB, Czosek RJ, Knilans TK, Meganathan K, Heaton P. Postoperative heart block in children with common forms of congenital heart disease: results from the KID Database. J Cardiovasc Electrophysiol 2012; 23(12):1349-54.
22. Ho SY, Anderson RH. Morphologic aspects. En: Balaji S, Gillette PC, Case CL, eds. Cardiac arrhythmias after surgery for congenital heart disease. London: Arnold,2001.
23. Warnes CA, Williams RG, Bashore TM, Child JS, Connolly HM, Dearani JA, et al. ACC/AHA 2008 guidelines for the management of adults with congenital heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Develop Guidelines on the Management of Adults With Congenital Heart Disease). Developed in Collaboration with the American Society of Echocardiography, Heart Rhythm Society, International Society for Adult Congenital Heart Disease, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol 2008;52(23):e143-263.
24. Villain E. Amiodarone as treatment for atrial tachycardias after surgery. Pacing Clin Electrophysiol 1997; 20(8 Pt 2):2130-2.
25. Beaufort-Krol GC, Bink-Boelkens MT. Sotalol for atrial tachycardias after surgery for congenital heart disease. Pacing Clin Electrophysiol 1997; 20(8 Pt 2):2125-9.
26. Marrone C, Galasso G, Piccolo R, de Leva F, Paladini R, Piscione F, et al. Antiplatelet versus anticoagulation therapy after extracardiac conduit Fontan: a systematic review and meta-analysis. Pediatr Cardiol 2011;32(1):32-9.
27. Walsh EP. Interventional electrophysiology in patients with congenital heart disease. Circulation 2007; 115:3224-34.
28. Giglia TM, Massicotte MP, Tweddell JS, Barst RJ, Bauman M, Erickson CC, et al. Prevention and treatment of thrombosis in pediatric and congenital heart disease: a scientific statement from the American Heart Association. Circulation 2013; 128(24):2622-703.
29. Gonska BD, Cao K, Raab J, Eigster G, Kreuzer H. Radiofrequency catheter ablation of right ventricular tachycardia late after repair of congenital heart defects. Circulation 1996; 94(8):1902-8.
30. Abello M, Moltedo JM, Fernandez N. Ablación bicameral de un aleteo auricular istmo dependiente en paciente con d-Transposición de las Grandes Arterias y cirugía de Senning. Rev Arg Cardiol 2006; 74:491-3.
31. Deal BJ, Mavroudis C, Backer CL, Buck SH, Johnsrude C. Comparison of anatomic isthmus block with the modified right atrial maze procedure for late atrial tachycardia in Fontan patients. Circulation 2002; 106(5):575-9.
32. Ceruti B, Chiesa P, Tambasco J, Anzíbar R, Gutiérrez C, Barboza S, et al. Trasplante cardíaco Experiencia de 15 años del Instituto de Cardiología Infantil. Rev Urug Cardiol 2012; 27(3): 273-285.
33. Epstein AE, DiMarco JP, Ellenbogen KA, Estes NA 3rd, Freedman RA, Gettes LS, et al. ACC/AHA/HRS 2008 Guidelines for device-based therapy of cardiac rhythm abnormalities: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the ACC/AHA/NASPE 2002 Guideline Update for Implantation of Cardiac Pacemakers and Antiarrhythmia Devices) developed in collaboration with the American Association for Thoracic Surgery and Society of Thoracic Surgeons. J Am Coll Cardiol. 2008; 51(21):e1-62.