Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.29 no.3 Montevideo dic. 2014
Almanac 2013: las Revistas de las Sociedades Nacionales presentan investigaciones seleccionadas que han determinado recientes avances en la cardiología clínica
Nuevos procedimientos intervencionistas cardíacos no coronarios
Pascal Meier1,2, Olaf Franzen3, Alexandra J. Lansky2
1. Yale-Programa de Investigación Cardiovascular de UCL, The Heart Hospital, University College London Hospitals UCLH, Londres, Reino Unido.
2. Departamento de Cardiología, Facultad de Medicina de Yale, New Haven, Connecticut, EEUU.
3. Departamento de Cardiología, Hospital Universitario Rigshopitalet, Copenhague, Dinamarca.
Correspondencia: Dr. Pascal Meier. Yale-Programa de Investigación Cardiovascular de UCL, The Heart Hospital, University College London Hospitals, UCLH16-18 Westmoreland Street, Londres W1G 8PH, RU. Correo electrónico: pascalmeier74@gmail.com
Recibido el 10 de junio de 2013.
Revisado el 27 de junio de 2013.
Aceptado el 30 de junio de 2013.
Este artículo fue publicado en Heart 2013;99:1309–1316. doi:10.1136/heartjnl-2013-304430, y es reproducido y traducido con autorización
Resumen
Las recientes innovaciones en el área de la cardiología intervencionista han ampliado drásticamente las opciones terapéuticas aplicables a los pacientes portadores de afecciones cardíacas. La cardiología intervencionista ya no queda limitada al tratamiento de las coronariopatías, sino que permite también tratar valvulopatías, prevenir accidentes cerebrovasculares, hipertensión, etcétera. Una de las principales opciones nuevas es el tratamiento percutáneo de la estenosis de válvula aórtica (implantación de la válvula aórtica transcatéter o percutánea); la valvulopatía aórtica es un problema bastante común en pacientes añosos, muchos de los cuales presentan un alto riesgo quirúrgico. De igual manera, la insuficiencia mitral a menudo se asocia con comorbilidades que determinan un alto riesgo quirúrgico. MitraClip es una promisoria alternativa percutánea que sustituiría la reparación o el reemplazo valvular quirúrgico. Otros procedimientos analizados en esta revisión son el cierre percutáneo de la orejuela de la aurícula izquierda como terapia no farmacológica para evitar accidentes cerebrovasculares y la denervación renal para la hipertensión resistente. Esta revisión explica los principios básicos de estos procedimientos, la evidencia clínica más importante, y también aporta datos clínicos recientes adicionales sobre cada uno de ellos.
Introducción
Luego de los trabajos pioneros de angioplastia con balón de Andreas Gruentzig, las intervenciones coronarias percutáneas pasaron a ser el puntal de la cardiología en las décadas siguientes(1); esto fue así hasta hace muy poco, cuando la cardiología adoptó innovaciones que pueden ser consideradas tan revolucionarias como la angioplastia de Gruentzig. Ante todo, en el desarrollo de las opciones de tratamiento percutáneo para la estenosis de la válvula aórtica. La implantación transcatéter de la válvula aórtica (TAVI) ha mejorado las opciones de tratamiento para los pacientes añosos con estenosis de la válvula aórtica. Otros desarrollos importantes son las opciones de tratamiento percutáneo para la insuficiencia mitral (IM) (MitraClip), la terapia no farmacológica para evitar la embolización cerebral en pacientes con fibrilación auricular (FA), tal como el cierre de la orejuela de la aurícula izquierda (OAI) y el cierre del foramen oval permeable y la denervación renal para tratar la hipertensión resistente.
La FA es una patología muy prevalente y constituye la principal causa de accidentes cerebrovasculares. El riesgo de presentar una FA en el curso de la vida es de aproximadamente 1 en 4(2). Dada la dificultad de detectar una FA paroxística, es probable que la verdadera prevalencia esté subestimada. Es probable que los pacientes con FA paroxística tengan un riesgo de accidente cerebrovascular parecido al de los pacientes con FA persistente(3).
La anticoagulación oral siempre ha sido el tratamiento de primera línea para evitar los accidentes cerebrovasculares, pero entraña riesgos importantes. La estrecha ventana terapéutica de la warfarina obliga a un equilibrio delicado entre la falta de eficacia y el riesgo muy elevado de sangrado, requiriendo por lo tanto exámenes de sangre frecuentes, además de sus numerosas interacciones con alimentos y medicamentos que tienen un importante impacto en la vida cotidiana de los pacientes. Hasta 40% de los pacientes con FA tienen contraindicaciones para la anticoagulación. Incluso en condiciones de estudios clínicos, una importante proporción de pacientes está recibiendo un tratamiento con warfarina o bien excesivo o insuficiente. En un estudio que incluyó a 41.900 pacientes con FA crónica, solo 70% de los pacientes tratados con warfarina mantenían ese tratamiento al año, destacando aun más las dificultades que plantea la anticoagulación.
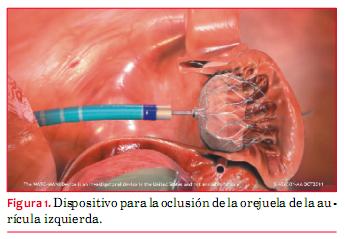
Entre los pacientes con FA no valvular, la gran mayoría de los trombos evolucionan a partir de la OAI. La OAI fibrilante es un callejón sin salida que crea las condiciones que favorecen la estasis sanguínea y la formación de trombos. Por lo tanto, uno podría esperar que la exclusión de la OAI de la circulación redujera el riesgo de accidente cerebrovascular. Se han desarrollado varios métodos: ligadura o amputación quirúrgica y oclusión con catéter percutáneo con dispositivos especialmente diseñados para la oclusión (figura 1).
La ligadura o amputación quirúrgica ha sido utilizada durante muchos años aun cuando existe muy poca evidencia en cuanto a su eficacia(5). Por supuesto que se realiza solo como una ampliación de otra operación (‘bystander’) en oportunidad, por ejemplo, de una cirugía válvular, pero no como un procedimiento independiente(6).
Los métodos percutáneos se han ido desarrollando desde 2002. Se han completado ya los estudios preliminares de dos sistemas específicamente diseñados para esta finalidad (oclusión percutánea transcatéter de la OAI [PLAATO] y sistemas Watchman) (7). Estos dispositivos se despliegan a través de un acceso venoso, pasando hacia la aurícula izquierda (AI) atravesando el tabique. Estos dispositivos han sido aprobados para su uso en la Comunidad Europea (CE) pero no están aprobados todavía para el uso clínico por la Administración de Alimentos y Medicamentos de EEUU (FDA).
Además de estos dos sistemas también se cuenta con el tapón cardíaco de Amplatzer y el Lariat (dispositivo con asa).
Sistema PLAATO
El sistema PLAATO era un dispositivo que se colocaba en la OAI mediante un catéter que atravesaba el septum. Tenía una armazón autoexpandible de nitinol cubierto por un revestimiento impermeable a la sangre, sellando así la OAI e impidiendo la formación o el desprendimiento de trombos. Sin embargo, durante el seguimiento hubo efectos adversos, por ejemplo, derrame pericárdico en ocho pacientes, dos accidentes cerebrovasculares, dos accidentes isquémicos pasajeros, y tres muertes no relacionadas con los procedimientos(8). El fabricante ha interrumpido el desarrollo del dispositivo PLAATO.
Dispositivo Watchman
El dispositivo Watchman también consiste en un dispositivo expandible que se despliega en la OAI utilizando un catéter transeptal. El dispositivo implantado tiene un marco de nitinol autoexpandible para fijarlo al interior de la OAI. A diferencia del dispositivo PLAATO, la malla del dispositivo Watchman es permeable a la sangre(9). Por esta razón, los pacientes necesitan profilaxis tromboembólica convencional con warfarina hasta que el dispositivo se haya endotelizado (por ejemplo, por lo menos 45 días después del implante), momento en el cual se realiza una ecocardiografía transesofágica para garantizar la endotelización. Además, todos los pacientes reciben tanto aspirina (81-325 mg) como clopidogrel (75 mg) diariamente durante seis meses.
El dispositivo Watchman fue evaluado en el estudio PROTECT FA (Watchman Left Atrial Appendage System for Embolic Protection in Patients with AF) en el que se distribuyó aleatoriamente a más de 700 pacientes con FA no valvular, con una relación 2 a 1, a recibir el dispositivo (con el esquema antitrombótico arriba descrito) o warfarina por un período prolongado (INR de 2,0 a 3,0) (10). El diseño del ensayo era de no inferioridad. Los criterios de inclusión permitían el ingreso de pacientes con FA paroxística, persistente, o permanente, y todos los pacientes tenían una puntuación CHADS2 ³1.
El ensayo confirmó la no inferioridad de la oclusión de la orejuela auricular comparado con la terapia warfarínica en lo que concierne al punto final primario compuesto de accidente cerebrovascular, embolia sistémica y muerte cardiovascular, con un cociente de riesgo de 0,62 (IC 95% 0,35 a 1,25)(11). Sin embargo, el punto final primario de seguridad evaluado (combinación de sangrado mayor, derrame pericárdico, accidente cerebrovascular relacionado con el procedimiento y embolización del dispositivo) estuvo aumentada en el grupo del dispositivo (7,4 vs 4,4 eventos cada 100 años-pacientes, respectivamente). La mayoría de los eventos del grupo del dispositivo fueron precoces. De estos, alrededor del 50% fueron derrames pericárdicos que necesitaron drenaje.
Dos registros ulteriores mostraron una mayor seguridad de este dispositivo, probablemente debido al efecto de la curva de aprendizaje. La tasa de complicaciones dentro de los siete días fue de 3,7% comparado con 7,7%, cifra observada en el ensayo aleatorizado inicial(11,12).
Oclusor septal de Amplatzer y tapón cardíaco de Amplatzer
El oclusor septal de Amplatzer utiliza una técnica más sencilla que la técnica PLAATO. En vez de recurrir a la anestesia general, como se hace en el procedimiento de PLAATO, a menudo se implanta bajo anestesia local. Se presentaron los resultados de una serie de casos en los que se estudiaron 16 pacientes a los que se colocó el oclusor septal de Amplatzer para cerrar la OAI bajo anestesia local sin guía ecocardiográfica(13). El tapón cardíaco de Amplatzer es otro dispositivo diseñado específicamente para el cierre de la OAI y está siendo estudiado en ensayos clínicos(14). Este dispositivo está hecho de nitinol y consiste en un disco que se coloca en la aurícula izquierda y un tapón distal conectado al disco por una cintura corta. El tapón distal contiene seis pares de pinchos para aumentar la estabilidad dentro de la orejuela. Este dispositivo es más corto que el dispositivo de Watchman y puede ser más ventajoso en individuos con orejuelas de morfología variable. Se han publicado datos de estudios en animales demostrando la falta de complicaciones de la colocación del dispositivo, alcanzando una oclusión completa de la orejuela a los 30 a 60 días(14,15).
El rol futuro de este procedimiento también dependerá de otras alternativas a la terapia warfarínica, como los nuevos anticoagulantes. Hasta ahora no existe una fuerte evidencia que sugiera que sean superiores a la warfarina, a excepción de rivaroxabán -que mostró un menor riesgo de sangrado- pero son una alternativa promisoria mucho más fácil de usar que la warfarina(16).
La actualización de las guías de la Sociedad Europea de Cardiología (ESC) para el manejo de la FA, publicada en 2012, concluye en una recomendación débil para el uso del cierre intervencionista de la OAI por vía percutánea en pacientes con alto riesgo de accidente cerebrovascular y contraindicaciones para anticoagulación a largo plazo(17). En conclusión, el cierre percutáneo de la OAI parece tan efectivo como la warfarina, según surge de un ensayo aleatorizado, pero entraña complicaciones en el período próximo al procedimiento (como derrame pericárdico).
El cierre percutáneo de OAI es una alternativa promisoria a la terapia warfarínica en pacientes con FA con un alto riesgo de accidente cerebrovascular. La información es escasa y el procedimiento debe limitarse a los pacientes que tengan contraindicaciones claras para warfarina.
Los nuevos anticoagulantes (por ejemplo, rivaroxabán) representan otra alternativa para los pacientes con una contraindicación para la warfarina.
Intervenciones sobre la válvula mitral
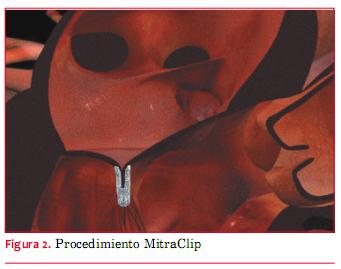
La prevalencia de la IM moderada o severa supera el 10% en mayores de 75 años y la evolución natural es a menudo fatal(18). No obstante ello, los pacientes con IM crónica severa a menudo sufren de otras comorbilidades que aumentan su riesgo al someterse a cirugía cardíaca. Urge desarrollar un abordaje percutáneo menos agresivo y son varios los que se han analizado. En la actualidad, el más promisorio es el sistema MitraClip (Abbott Laboratories, Abbott Park, Illinois, EEUU). Se basa en la técnica quirúrgica de suturas de Alfieri, una reparación de borde a borde (figura 2) (19).
La experiencia clínica inicial con MitraClip fue estudiada en seres humanos en el estudio fase I EVEREST (Endovascular Valve Edge-to-Edge Repair Study: Estudio de reparación valvular endovascular borde a borde) (21). El estudio incluyó a 27 pacientes. Catorce de los pacientes tuvieron una reducción de la IM £2+ a los seis meses. El estudio mostró que es un procedimiento promisorio para los pacientes con IM con alto riesgo para la cirugía convencional.
El ensayo fundamental ha sido el EVEREST II, que distribuyó aleatoriamente a 279 pacientes con una IM crónica moderadamente severa o severa (grado 3+ o 4+) a someterse ya sea a la colocación percutánea de MitraClip o cirugía de la válvula mitral en una relación 2:1(22). Si bien antes del alta del hospital la terapia percutánea fue menos efectiva para reducir la IM, las tasas de reducción de IM a los 12 y 24 meses fueron similares en ambos grupos. No obstante ello, la terapia percutánea resultó ser más segura, con una menor tasa de eventos adversos mayores a los 30 días. El estudio mostró una mejora clínica sostenida, evaluada por la calidad de vida, el grado de insuficiencia cardíaca y la función del ventrículo izquierdo.
El estudio EVEREST II no se concentró específicamente en pacientes de muy alto riesgo. La media de edad fue de 66 años, la media de la fracción de eyección fue de 60%, y fueron raras la comorbilidades mayores. En el estudio de alto riesgo (HRS) EVEREST II, sin embargo, los pacientes tuvieron IM severa (3-4+), una media de edad de 77 años, y una mortalidad quirúrgica estimada en ³12%(23). Más de 50% de estos pacientes habían sido sometidos a cirugía cardíaca previa. Se los comparó retrospectivamente con un grupo de pacientes que fueron estudiados al mismo tiempo pero que no fueron inscritos en el estudio EVEREST II. Estos pacientes habían sido tratados con terapia médica estándar.
Feldman y colaboradores (24) comunicaron los resultados clínicos del uso del clip en una cohorte de los primeros 107 pacientes, seguidos hasta tres años. Eran 55 pacientes tratados en el ensayo de factibilidad fase I EVEREST, y 52 pacientes tratados en el ensayo pivote EVEREST II que representaban la experiencia inicial pre-randomización. De los pacientes tratados con éxito, 66% alcanzaron el punto final primario de ausencia de muerte, cirugía de la válvula mitral, o IM >2+ a los 12 meses. La mayoría de los pacientes se mantenía vivo, libre de cirugía o de recurrencia de la IM incluso a tres años.
El dispositivo MitraClip ha recibido la aprobación de la CE y ya ha sido utilizado en miles de pacientes en todo el mundo(25,26). Hasta que sea aprobado por la FDA, en EEUU solo se puede acceder al clip ingresando a través del registro del estudio REALISM. Los pacientes asentados en este registro ‘de la vida real’ son asignados ya sea al brazo de alto riesgo o al brazo sin alto riesgo. Se les hace un seguimiento a 30 días, 6 meses y 12 meses.
Los resultados provisorios del estudio EVEREST II REALISM se presentaron en las sesiones científicas de la Sociedad para Angiografía e Intervenciones Cardiovasculares (SCAI) en 2011(27-29). En promedio, la edad de los pacientes en el registro fue de más de 70 años. El procedimiento MitraClip fue seguro, con una mortalidad a los 30 días de 3,8%(28). Al año, 83% de los pacientes en el grupo de alto riesgo tenían solo IM leve a moderada (1+ o 2+). Antes del procedimiento, las puntuaciones de calidad de vida fueron peores para la IM funcional que para la IM degenerativa(29), pero también tuvieron una significativa mejora después del procedimiento.
Un análisis de los primeros 100 pacientes en el registro MitraSwiss de Suiza mostró que la insuficiencia cardíaca congestiva previa al implante del clip y el antecedente de cirugía coronaria (CABG) fueron predictivos de malos resultados con el procedimiento MitraClip(26). Una reducción de IM a £2+ durante el procedimiento y un bajo grado de IM al alta predijeron una mejor supervivencia a mediano plazo. Gaemperli y colaboradores(30) constataron una mejora del perfil hemodinámico inmediatamente después del procedimiento. Esta mejora hemodinámica se asoció a un resultado favorable a mediano plazo.
En conclusión, el implante de MitraClip es inferior a la reparación quirúrgica de la válvula mitral para reducir el grado de IM, pero probablemente sea más seguro en los pacientes de más alto riesgo. Aunque la reducción de la IM es menor que con la cirugía, la mejora subjetiva de los síntomas es comparable. Los pacientes más adecuados son aquellos con alto riesgo quirúrgico y particularmente aquellos que presentan IM funcional. No queda claro cuál sería puntualmente el momento óptimo para el procedimiento, pero en los pacientes sometidos a cirugía los datos indican que probablemente sea mejor proceder cuanto antes(31). Esto tiene sentido, ya que la cirugía se ha hecho más segura, modificándose las consideraciones de riesgo/beneficio. Dado que el abordaje percutáneo ha seguido reduciendo el riesgo en torno al procedimiento, aquí también se debería aplicar la misma consideración.
Intervenciones de la válvula mitral
Puntos clave
- Los datos para el procedimiento del sistema de MitraClip son muy limitados y provienen fundamentalmente del ensayo EVEREST II.
- Si bien el ensayo EVEREST no incluyó pacientes de muy alto riesgo, el procedimiento debería limitarse a aquellos de alto riesgo quirúrgico debido al efecto limitado.
Intervenciones sobre la válvula aórtica
Las directrices europeas más recientes de 2012 recomiendan TAVI en los pacientes con EA sintomática severa a los que el ‘equipo cardíaco’ local (equipo multidisciplinario) considera inadecuados para cirugía convencional debido a comorbilidades severas. Entre los pacientes de alto riesgo que sean posibles candidatos para cirugía, la decisión debería individualizarse y analizarse en el seno de un ‘equipo cardíaco’. Los scores de riesgo podrían ayudar a tomar la decisión clínica. En esta situación se utiliza también a menudo el EuroSCORE logístico ³20%, que está muy bien establecido; se ha propuesto una puntuación ³20% para definir el alto riesgo. Sin embargo, generalmente sobreestima la mortalidad operatoria. No se contabilizan los factores como hipertensión pulmonar o disfunción del ventrículo derecho. Es probable que el más reciente EuroScore II sea más útil; otra posibilidad es usar la puntuación de la Sociedad de Cirujanos de Tórax (STS) con un valor ³10% que indica un alto riesgo (se utilizó un umbral ³8% en el ensayo PARTNER A). Tenemos que ser conscientes que aún no se ha establecido una puntuación de riesgo TAVI ‘perfecta’; los scores fueron desarrollados para pacientes sometidos a cirugía cardíaca, predominantemente CABG. Estas puntuaciones no consideran factores que son importantes cuando se debate la conveniencia de TAVI contra el RVA quirúrgico, como la fragilidad, aorta de porcelana, antecedentes de irradiación torácica o injertos de puentes coronarios permeables. Por lo tanto, la decisión se debe basar en un juicio clínico muy completo. Es importante destacar que actualmente se debe evitar el TAVI en pacientes con riesgo quirúrgico intermedio hasta que se disponga de más información para este grupo de pacientes, por ejemplo la que surja del estudio en curso SURTAVI (Surgery and Transcatheter Aortic Valve Implantation) (NCT01586910) (34).
Las directrices de 2012 del Colegio Americano de Cardiología (ACC) son muy parecidas y también abogan por la actuación de un equipo multidisciplinario para los pacientes de alto riesgo quirúrgico, definiendo ‘riesgo quirúrgico demasiado alto’ como un riesgo de muerte o de morbilidad irreversible estimado como ³50% a los 30 días(35). Aunque estas directrices sean muy recientes, al ir aumentando la experiencia en algunos países la indicación para TAVI va ampliándose. En ciertos centros seleccionados en Alemania, TAVI representa más de un tercio de todos los procedimientos de RVA. TAVI es un tratamiento costo-efectivo para aquellos pacientes que no son elegibles para RVA quirúrgico(36). En EEUU, la introducción de TAVI ha sido algo más lenta debido principalmente a razones regulatorias(35,37). Es interesante destacar que en la mayoría de los centros la introducción de TAVI se ha asociado también a un aumento de la actividad quirúrgica convencional de RVA(38,39). Actualmente hay dos válvulas de uso difundido y que tienen la aprobación de la FDA: la colocación por cateterismo de la válvula de Edwards Sapien expandible con balón (THV) (Edwards Lifesciences, Irvine, California, EEUU) y la válvula autoexpandible CoreValve (Medtronic Inc, Minneapolis, Minnesota, EEUU).
La mayoría de los equipos que realizan TAVI prefieren el abordaje transfemoral, ya que evita la manipulación quirúrgica del tórax y reduce el dolor posoperatorio(42). También es el método menos invasivo(43). Sin embargo, la analgesia epidural torácica realizada durante el TAVI transapical puede reducir significativamente el dolor y las complicaciones respiratorias que rodean el procedimiento(44).
La válvula de Edwards Sapien XT tiene un marco de cromo cobalto con montantes más finos y con una estructura más abierta(45). Un ensayo con 120 pacientes mostró que a corto plazo se comportaba igual que la válvula anterior de SAPIEN, pero se asoció con un riesgo tres veces menor de complicaciones vasculares mayores(46).
El ensayo PARTNER fue el primer estudio controlado, aleatorizado, prospectivo para TAVI. Su diseño incluyó dos brazos:
- PARTNER A distribuyó aleatoriamente a 699 pacientes de alto riesgo quirúrgico a someterse a TAVI o a RVA quirúrgico.
- PARTNER B distribuyó aleatoriamente a 358 pacientes inoperables a recibir TAVI o tratamiento médico estándar.
La mortalidad a los 30 días fue superior en los pacientes sometidos a TAVI que en quienes recibieron cuidados médicos estándar (5% vs 2,8%, p=0,41), pero menor para TAVI en aquellos sometidos a RVA a cirugía abierta (3,4% vs 6,5%, p=0,07) (47).
En la cohorte de PARTNER A, los pacientes sometidos a TAVI tuvieron una mayor incidencia de accidentes cerebrovasculares mayores (3,8% vs 2,1% a los 30 días; 5,1% vs 2,4% al año) y complicaciones vasculares mayores (11,0% vs 3,2% a los 30 días; 11,3% vs 3,5% al año). Los tratados con RVA quirúrgica tuvieron una mayor incidencia de sangrado mayor (19,5% vs 9,3% a los 30 días; 25,7% vs 14,7% al año) y nueva FA (16,0% vs 8,6% a los 30 días; 17,1% vs 12,1% al año).
Tanto el RVA quirúrgico como TAVI llevaron a una disminución de los gradientes de la válvula aórtica y a un aumento del área efectiva del orificio (AEO) (p <0,0001) los que se mantuvieron estables durante dos años. TAVI se acompañó de un índice AEO más elevado, una menor discordancia entre la prótesis y el paciente, y más insuficiencia aórtica (IA)(48) . Si bien la función del ventrículo derecho se reduce tras la RVA quirúrgica, ese efecto no se observa con TAVI(49,50).
Un estudio reciente ha demostrado que hay disfunción sistólica y diastólica pasajera dentro de las primeras 24 horas de un TAVI exitoso(51). Esto se acompañó de un aumento de los marcadores séricos de lesión y disfunción miocárdica, sugiriendo que la disfunción posterior al procedimiento es debida a atontamiento del miocardio y lesión del miocardio periprocedimiento.
La IA paravalvular que aparece después del procedimiento es más común luego de TAVI que después de cirugía(52,53). Hemos aprendido de la información de los ensayos PARTNER, confirmada por estudios ulteriores, que existe una asociación de fuga paravalvular pos TAVI y un aumento de la mortalidad. Según el registro alemán TAVI, la angiografía mostró aparición de una IA importante inmediatamente después de TAVI en 17,2% de los casos. Esta población consistía en 84% de sistemas CoreValve de Medtronic y 16% de válvulas Edwards Sapien. El riesgo mortalidad intrahospitalaria aumentó alrededor de 2,5 veces en pacientes con IA importante(52). Sin embargo, no queda claro si la IA es una causa de mortalidad o simplemente un marcador de pacientes de alto riesgo (calcificación severa, válvulas más cerradas). En este estudio, la IA fue un predictor independiente de mortalidad en un análisis ajustado, pero por supuesto que los ajustes rara vez logran eliminar por completo los elementos de confusión.
A la fecha se están realizando dos grandes estudios con el dispositivo Sapien XT: el estudio PARTNER II y el ensayo ARTE (Aspirin versus Aspirin and Clopidogrel Following Transcatheter Aortic Valve Implantation). Este último estudio está comparando la eficacia de la aspirina contra una combinación de aspirina y clopidogrel luego de TAVI para la prevención de eventos isquémicos mayores(45).
El estudio PARTNER II acaba de comenzar(45). Consiste en dos brazos: las cohortes A y B. La cohorte A tendrá 2.000 pacientes con una puntuación de riesgo STS ³4. Serán asignados aleatoriamente siguiendo una relación 1:1 a TAVI con la válvula Edwards Sapien XT o a RVA quirúrgico. Se hará una subestratificación de acuerdo a su coronariopatía. Los pacientes con coronariopatía serán asignados aleatoriamente en una relación 1:1 a TAVI más intervención coronaria percutánea versus RVA quirúrgica más CABG. Se hará una valoración detallada antes y después del procedimiento en todos los pacientes. También se recogerán datos para un subestudio de fragilidad. La cohorte B tendrá 500 pacientes inoperables que serán distribuidos aleatoriamente en una relación 1:1 a TAVI con los dispositivos Edwards Sapien THV y Edwards Sapien XT. Se compararán la seguridad y eficacia de los dos dispositivos. Se espera que el estudio termine en 2018.
Edwards Lifesciences (EEUU) ha desarrollado otras dos válvulas: las válvulas Centera y Sapien III. Recientemente han comenzado estudios, con los dos dispositivos, que se realizan por primera vez en el ser humano.
Aparte del dispositivo Sapien, el único otro dispositivo aprobado por la FDA es el CoreValve (Medtronic Inc, Minneapolis, Minnesota, EEUU). Consiste en valvas pericárdicas de cerdo montadas en un marco de nitinol autoexpandible. A diferencia de la válvula Sapien, que se puede implantar por vía anterógrada y retrógrada, no permite el implante anterógrado(54). Sin embargo, la ventaja es que utiliza un sistema de entrega de perfil más bajo de 18 French.
En el registro de evaluación multicéntrico expandido de Medtronic CoreValve se observó una alta tasa de éxito (97%) y una baja mortalidad del procedimiento (1,5%)(55). La mortalidad por todas las causas a los 30 días (incluyendo la debida a los procedimientos) también fue baja (8%). Estos beneficios se mantuvieron en el tiempo hasta el transcurso de un año(56). Ussia y colaboradores también comunicaron beneficios cardiovasculares clínicos y funcionales en un plazo de tres años. Una presentación reciente de los resultados del registro ADVANCE CoreValve reveló una tasa de mortalidad por todas las causas de 12,8% y una tasa de mortalidad cardíaca de 8,4% a los seis meses. Las tasas de accidentes cerebrovasculares fueron bajas (2,9% a los 30 días), en tanto que la tasa de implantación de marcapasos fue de 26,3%(45).
Esta tasa relativamente elevada de implantación de marcapasos a menudo se ve como una limitante del sistema CoreValve cuando se la compara con las tasas del sistema de Edwards Sapien y con la tasa del RVA quirúrgico. Un gran estudio de cohorte reciente que incluyó a 780 pacientes mostró que la necesidad de implantar marcapasos después del procedimiento era de 3,2%(57). Sin embargo, la necesidad de colocación de marcapasos para el sistema de CoreValve autoexpandible ha disminuido con el tiempo al ir mejorando la técnica y experiencia del operador. Las válvulas ahora se implantan en una posición más alta, lo que ha reducido significativamente los trastornos eléctricos.
Las imágenes de resonancia magnética nuclear (RMN) han demostrado múltiples infartos cerebrales pequeños (en 77% de los casos) luego de TAVI. La mayoría de las lesiones fueron silenciosas. Los accidentes cerebrovasculares clínicos se asociaron a un mayor número y volumen de infartos(58). El estudio SIMPLIFY TAVI (Transcatheter Aortic Valve Implantation Without Predilation) está investigando si el evitar la valvuloplastia con balón para dilatación previa de la válvula aórtica nativa reduce el riesgo de accidente cerebrovascular en el curso de un TAVI.
Se espera que el registro prospectivo CoreValve Advance II defina las maneras de reducir la necesidad de implante de marcapasos permanente.
También se ha probado TAVI con éxito en varias indicaciones aún no aprobadas (‘off label’), como en pacientes con válvulas bicuspídes, IM severa, reducción de la fracción de eyección del ventrículo izquierdo, y EA de bajo gradiente y bajo gasto(59).
Dispositivos de prevención de embolias
Se han descrito eventos adversos cerebrovasculares como complicaciones de TAVI. Además, en más de 90% de los pacientes se detectaron lesiones embólicas subclínicas luego de TAVI(60). Para encarar este problema se están desarrollando dispositivos antiembólicos específicos. La técnica Claret CE Pro System (Claret Medical, Inc, Santa Rosa, California, EEUU) tiene dos filtros para capturar cualquier detrito que circule por el tronco braquiocefálico y la arteria carótida primitiva. Naber y colAboradores(61) describieron el primer uso de este nuevo dispositivo en humanos en 40 pacientes sometidos a TAVI, mostrando evidencia de reducción de la carga de embolias cerebrales gracias al procedimiento.
El dispositivo de protección cerebral TriGuard (Keystone Heart, Israel, ex SMT R&D) funciona desviando los detritos en vez de recolectarlos. Un dispositivo similar es el deflector de émbolos Embrella (Edwards Lifesciences, Irvine, California, EEUU). Tanto Embrella como TriGuard tienen un escudo protector que desvía los émbolos, no permitiendo su llegada a las arterias cerebrales.
El estudio de factibilidad SMT FIM (primero en humanos) describió el uso del dispositivo SHEF en los primeros 15 pacientes(62). Se espera que el estudio DEFLECT I (SMT Embolic Deflection CE Mark) aporte más evidencias de la efectividad del dispositivo. Los primeros resultados se presentaron en EuroPCR, en mayo de 2013 en París, y muestran resultados promisorios. El volumen máximo total de la lesión en DEFLECT I fue 95% menor que el volumen máximo total de la lesión en los estudios comunicados (3,94 cm3 vs 70,3 cm3).
La experiencia en humanos con Embrella proviene de un estudio pequeño de cuatro pacientes con EA severa sometidos a valvuloplastia aórtica con balón o TAVI(63). No se observaron complicaciones del procedimiento. En el estudio piloto ProTAVI-C se analizó la seguridad del procedimiento, su factibilidad técnica, y la eficacia exploratoria del dispositivo Embrella en nueve centros que incluyeron a 54 pacientes. El uso del sistema del deflector Embrella durante TAVI fue factible y seguro, y el procedimiento dio lugar a complicaciones mínimas, sin comunicarse accidentes cerebrovasculares o deterioro de la función neurocognitiva relacionados con el procedimiento. Si bien hubo microembolización cerebral en todos los pacientes, es posible que haya una disminución del volumen de la lesión cerebral. Se está realizando un estudio aleatorizado fase 2 para medir cuál es la reducción del volumen de las nuevas lesiones cerebrales.
Puntos clave
Denervación renal
Aproximadamente 5%-10% de todos los pacientes hipertensos son resistentes al tratamiento médico, definido como presión arterial >140/90 mmHg o >130-139/80-85 mmHg en pacientes diabéticos, o >130/80 mmHg en pacientes con enfermedad renal crónica en presencia de ³3 antihipertensivos de diferentes clases, incluyendo un diurético, a la dosis máxima o la más alta tolerada. Sin embargo, es probable que la ‘resistencia’ sea a menudo debida a la falta de cumplimiento de las indicaciones. Por otro lado, la intolerancia al fármaco o los efectos colaterales no son raros y pueden representar un reto en el manejo médico de la presión arterial. La introducción de la ablación por radiofrecuencia con catéter de las fibras nerviosas simpáticas renales ofrece un enfoque nuevo muy promisorio.
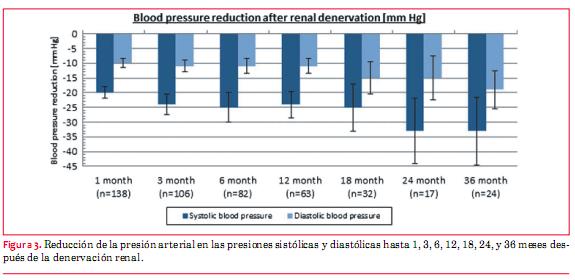
En 2009 se publicó un estudio preliminar de eficacia europeo – australiano, el Simplicity HTN-1, no aleatorizado; fue realizado en 50 pacientes con hipertensión resistente (a saber: presión arterial sistólica ³160 mmHg con tres o más medicaciones antihipertensivas, incluyendo un diurético) (64). Como controles se usaron cinco de los pacientes que no eran anatómicamente elegibles para el procedimiento de denervación. Después de este procedimiento de ablación por radiofrecuencia con catéter (Symplicity, Ardian Inc, Palo Alto, California, EEUU), la presión arterial de estos 45 pacientes cayó significativamente en un período de 12 meses (figura 3).
En el estudio Simplicity HTN-1 se estudió una cohorte ampliada de 153 pacientes con hipertensión resistente(65). Los pacientes fueron tratados con denervación simpática renal con catéter en 19 centros en Australia, Europa y EEUU. Mostraron una reducción importante y sostenida de la presión arterial durante un seguimiento ³2 años, sin que aparecieran eventos adversos de importancia. Simplicity HTN-1 fue un estudio de factibilidad y no incluyó un grupo control. El ensayo fue seguido de uno ulterior, el Simplicity HTN-2, en el que se distribuyó aleatoriamente a 106 pacientes a denervación renal o control(66). A los seis meses, la presión arterial en el grupo de tratamiento fue significativamente menor. Luego de la evaluación de los seis meses, se realizó un cruzamiento y se permitió una denervación renal en los pacientes del grupo control(67). En el grupo sometido a denervación renal inicial, la importante reducción de la presión arterial media observada a los seis meses (-32 mmHg) se mantenía aún a los 12 meses (-28 mmHg). A los seis meses, el grupo testigo había presentado un aumento de la presión arterial de 182,8 ± 16,3 a 190,0 ± 19,6 mmHg. Aquellos individuos dentro de este grupo control que fueron sometidos a denervación renal en su fase de cruzamiento tuvieron una importante caída de su presión arterial a los seis meses del procedimiento (-24 mmHg; p<0,001, para la diferencia con respecto a antes del procedimiento). Este hecho sustanció la seguridad y eficacia de la denervación renal mediante ablación controlada por radiofrecuencia.
El estudio Simplicity HTN-2 no brinda información sobre el control de la presión arterial de 24 horas. No se trataba de un estudio de diseño ciego. Estos aspectos metodológicos están siendo analizados en el estudio Simplicity HTN-3(67). Se trata de un ensayo multicéntrico, controlado, aleatorizado, de único ciego en el que se asignaba aleatoriamente a los pacientes a denervación renal bilateral con el catéter Simplicity o a un procedimiento de simulacro. Una de las variables secundarias importantes del estudio es el cambio de la presión arterial en 24 horas.
El dispositivo de denervación renal Simplicity también ha sido probado en otros grupos de pacientes, tales como en un estudio piloto de pacientes con hipertensión resistente y nefropatía moderada a severa (estadio 3 o 4) (68). Resultó seguro y eficaz. El estudio Simplicity HF actualmente está registrando a 40 pacientes para un estudio piloto con el fin de evaluar los efectos de la denervación renal en los pacientes con insuficiencia cardíaca. En el mundo real se espera que el registro Simplicity inscriba a 5.000 pacientes en 200 centros. El registro había contabilizado 617 pacientes hasta el 25 de mayo de 2013. Según los datos preliminares presentados en el EuroPCR 2013, ha habido caídas importantes en la presión arterial en el consultorio y la presión arterial de 24 horas. Estas reducciones, sin embargo, son menores que las registradas en los ensayos clínicos.
El catéter de denervación renal EnlighHTN con múltiples electrodos (St Jude Medical) fue probado en 46 pacientes que luego fueron seguidos hasta un año(70). La mayoría de los pacientes (80%) respondieron al tratamiento (tuvieron una reducción de por lo menos 10 mmHg de la presión arterial media). La reducción media de la presión arterial a los 12 meses fue de 27 mmHg. El dispositivo de múltiples electrodos reduce el tiempo de la denervación renal y también es menos doloroso para los pacientes. Otros dispositivos que utilizan un abordaje multimodal incluyen el dispositivo Covidien One-Shot y una modificación del dispositivo Simplicity, el dispositivo Spyral.
Actualmente se considera la denervación renal como una terapia adyuvante al tratamiento médico, no como un sustituto, ya que la cantidad promedio de los pacientes que reciben medicación antihipertensiva no ha declinado en los ensayos a pesar de la reducción de la presión arterial media luego de la denervación renal(70).
Si bien ha habido mucho entusiasmo sobre esta nueva modalidad de tratamiento para la hipertensión resistente, preocupa la constricción difusa de la arteria renal y el daño tisular en el sitio de la ablación, con edema y formación de trombos que pueden aparecer luego de la ablación del nervio renal(71). Por lo tanto es preciso hacer terapia antiplaquetaria durante el procedimiento. Aun cuando la denervación renal ha sido intentada en pacientes con nefropatía crónica(68), los pacientes con insuficiencia renal importante solo deberían tratarse en ensayos clínicos y seguirse sistemáticamente. Tampoco habría que intentarlo en arterias renales con anatomía inadecuada (diámetro <4 mm; longitud <20 mm; displasia fibromuscular; una importante estenosis de la arteria renal) o en casos de causas de hipertensión secundaria y tratable(72). También debemos ser conscientes de que no hay datos sobre el impacto de la denervación renal sobre los resultados clínicos en esta etapa. Por lo tanto, su uso se debe restringir a pacientes con hipertensión resistente severa y se lo debe considerar como una terapia adyuvante y no alternativa a los medicamentos antihipertensivos.
Denervación renal
Puntos clave
- La denervación renal es un abordaje promisorio para tratar la hipertensión resistente; su efecto en la reducción de la presión arterial es impactante, pero se necesitan más estudios para probar que esto se traduce en mejores resultados clínicos.
- Al igual que la TAVI, es probable que la indicación para este procedimiento se siga ampliando a hipertensión no resistente y a otras áreas tales como insuficiencia cardíaca y control de la frecuencia para FA, entre otros.
Conclusión
Si bien ha habido claramente un importante avance tecnológico en las intervenciones coronarias percutáneas(73), las nuevas opciones para tratar la enfermedad cardíaca no coronaria con técnicas de cateterismo son revolucionarias. Se han desarrollado varios de estos procedimientos para los pacientes de muy alto riesgo quirúrgico o pacientes ‘sin otra opción’, como es el caso de TAVI, pero se usan cada vez más en los pacientes de riesgo alto o inclusive intermedio, como una alternativa menos cruenta que la cirugía. Los rápidos avances tecnológicos, un mayor conocimiento y mejoras en la experiencia de los operadores llevarán a una mayor expansión de las indicaciones en estos procedimientos para los pacientes de menor riesgo y para su aplicación en otras indicaciones. La denervación renal, por ejemplo, puede mostrar beneficios en pacientes con insuficiencia cardíaca o para controlar la frecuencia en pacientes con FA.
Origen y revisión por colegas: por encargo; revisión externa arbitrada.
Bibliografía
1. Meier P, Timmis A. Almanac 2012: interventional cardiology. Anadolu Kardiyol Derg 2012;13:91–101.
2. Lloyd-Jones DM, Wang TJ, Leip EP, et al. Lifetime risk for development of atrial fibrillation: the Framingham Heart Study. Circulation 2004;110: 1042–6.
3. European Heart Rhythm Association, European Association for Cardio-Thoracic Surgery, Camm AJ, et al. Guidelines for the management of atrial fibrillation: the task force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010;31:2369–429.
4. Gallagher AM, Rietbrock S, Plumb J, et al. Initiation and persistence of warfarin or aspirin in patients with chronic atrial fibrillation in general practice: do the appropriate patients receive stroke prophylaxis? J Thromb Haemost 2008;6:1500–6.
5. Garcia-Fernandez MA, Perez-David E, Quiles J, et al. Role of left atrial appendage obliteration in stroke reduction in patients with mitral valve prosthesis: a transesophageal echocardiographic study. J Am Coll Cardiol 2003;42:1253–8.
6. MEMBERS WC, Bonow RO, Carabello BA, et al. 2008 Focused update incorporated into the ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 1998 Guidelines for the Management of Patients With Valvular Heart Disease): endorsed by the Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. Circulation 2008;118:e523–661.
7. Khattab AA, Meier B. Transcatheter left atrial appendage exclusion, gold or fool’s gold? Eur Heart J Suppl 2010;12:E35–40.
8. Sousa JE, Costa MA, Tuzcu EM, et al. New frontiers in interventional cardiology. Circulation 2005; 111:671–81.
9. Munkholm-Larsen S, Cao C, Yan TD, et al. Percutaneous atrial appendage occlusion for stroke prevention in patients with atrial fibrillation: a systematic review. Heart 2012;98:900–7.
10. Holmes DR, Reddy VY, Turi ZG, et al. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomised non-inferiority trial. Lancet 2009;374:534–42.
11. Reddy VY, Doshi SK, Sievert H, et al. Percutaneous left atrial appendage closure for stroke prophylaxis in patients with atrial fibrillation: 2.3-year follow-up of the PROTECT AF (Watchman Left Atrial Appendage System for Embolic Protection in Patients with Atrial Fibrillation) Trial. Circulation 2013;127:720–9.
12. Reddy VY, Holmes D, Doshi SK, et al. Safety of percutaneous left atrial appendage closure: results from the Watchman Left Atrial Appendage System for Embolic Protection in Patients with AF (PROTECT AF) clinical trial and the Continued Access Registry. Circulation 2011;123:417–24.
13. Massumi A, Chelu MG, Nazeri A, et al. Initial experience with a novel percutaneous left atrial appendage exclusion device in patients with atrial fibrillation, increased stroke risk, and contraindications to anticoagulation. Am J Cardiol 2013;111:869–73.
14. Viles-Gonzalez JF, Kar S, Douglas P, et al. The clinical impact of incomplete left atrial appendage closure with the Watchman Device in patients with atrial fibrillation: a PROTECT AF (Percutaneous Closure of the Left Atrial Appendage Versus Warfarin Therapy for Prevention of Stroke in Patients With Atrial Fibrillation) substudy. J Am Coll Cardiol 2012;59:923–9.
15. Bass JL. Transcatheter occlusion of the left atrial appendage–experimental testing of a new Amplatzer device. Catheter Cardiovasc Interv 2010;76:181–5.
16. Fox BD, Kahn SR, Langleben D, et al. Efficacy and safety of novel oral anticoagulants for treatment of acute venous thromboembolism: direct and adjusted indirect meta-analysis of randomised controlled trials. BMJ 2012;345:e7498.
17. Camm AJ, Lip GY, De Caterina R, et al. 2012 focused update of the ESC guidelines for the management of atrial fibrillation: an update of the 2010 ESC guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J 2012; 33:2719–47.
18. Iung B, Vahanian A. Degenerative calcific aortic stenosis: a natural history. Heart 2012;98:iv7–13.
19. Alfieri O, Denti P. Alfieri stitch and its impact on mitral clip. Eur J Cardiothorac Surg 2011;39:807–8.
20. Delgado V, Kapadia S, Marsan NA, et al. Multimodality imaging before, during, and after percutaneous mitral valve repair. Heart 2011;97:1704–14.
21. Feldman T, Wasserman HS, Herrmann HC, et al. Percutaneous mitral valve repair using the edge-to-edge technique: six-month results of the EVEREST phase I clinical trial. J Am Coll Cardiol 2005;46:2134–40.
22. Feldman T, Foster E, Glower DD, et al. Percutaneous repair or surgery for mitral regurgitation. N Engl J Med 2011;364:1395–406.
23. Whitlow PL, Feldman T, Pedersen WR, et al. Acute and 12-month results with catheter-based mitral valve leaflet repair: the EVEREST II (Endovascular Valve Edge-to-Edge Repair) high risk study. J Am Coll Cardiol 2012;59:130–9.
24. Feldman T, Kar S, Rinaldi M, et al. Percutaneous mitral repair with the MitraClip system: safety and midterm durability in the initial EVEREST (Endovascular Valve Edge-to-Edge REpair Study) cohort. J Am Coll Cardiol 2009;54:686–94.
25. Tamburino C, Ussia GP, Maisano F, et al. Percutaneous mitral valve repair with the MitraClip system: acute results from a real world setting. Eur Heart J 2010;31:1382–9.
26. Sürder D, Pedrazzini G, Gaemperli O, et al. Predictors for efficacy of percutaneous mitral valve repair using the MitraClip system: the results of the MitraSwiss registry. Heart 2013;99:1034–40.
27. Kar S, Rinaldi M, Lim DS, et al. EVEREST II REALISM: a continued access study to evaluate the safety and effectiveness of the MitraClip device: demographics and procedural outcomes. Society for Cardiovascular Angiography and Interventions (SCAI) 2011 Scientific Sessions; Baltimore, 2011.
28. Rinaldi MJ, Kar S, Lim DS, et al. EVEREST II REALISM: a continued access study to evaluate the safety and effectiveness of the MitraClip device: analysis of a 6 month patient cohort. Society for Cardiovascular Angiography and Interventions (SCAI) 2011 Scientific Sessions; Baltimore, 2011.
29. Sarkar K, Ussia GP, Cammalleri V, et al. Quality of life of high risk patients following percutaneous mitral valve repair with the MitraClip system. Society for Cardiovascular Angiography and Interventions (SCAI) 2011 Scientific Sessions; Baltimore, 2011.
30. Gaemperli O, Moccetti M, Surder D, et al. Acute haemodynamic changes after percutaneous mitral valve repair: relation to mid-term outcomes. Heart 2012;98:126–32.
31. Samad Z, Kaul P, Shaw LK, et al. Impact of early surgery on survival of patients with severe mitral regurgitation. Heart 2011;97:221–4.
32. Nkomo VT, Gardin JM, Skelton TN, et al. Burden of valvular heart diseases: a population-based study. Lancet 2006;368:1005–11.
33. Rosenhek R. Almanac 2011: valvular heart disease. The national society journals present selected research that has driven recent advances in clinical cardiology. Heart 2011;97:2007–17.
34. Sinning J-M, Werner N, Nickenig G, et al. Transcatheter aortic valve implantation: the evidence. Heart 2012;98:iv65–72.
35. Agnihotri A. 2012 ACCF/AATS/SCAI/STS expert consensus document on transcatheter aortic valve replacement: executive summary. J Thorac Cardiovasc Surg 2012;144:534–7.
36. Watt M, Mealing S, Eaton J, et al. Cost-effectiveness of transcatheter aortic valve replacement in patients ineligible for conventional aortic valve replacement. Heart 2012;98:370–6.
37. Binder RK, Webb JG. TAVI: from home-made prosthesis to global interventional phenomenon. Heart 2012;98:iv30–6.
38. Grant SW, Devbhandari MP, Grayson AD, et al. What is the impact of providing a transcatheter aortic valve implantation service on conventional aortic valve surgical activity: patient risk factors and outcomes in the first 2 years. Heart 2010;96:1633–7.
39. Malaisrie SC, Tuday E, Lapin B, et al. Transcatheter aortic valve implantation decreases the rate of unoperated aortic stenosis. Eur J Cardiothorac Surg 2011;40:43–8.
40. Thomas M, Schymik G, Walther T, et al. Thirty-day results of the SAPIEN aortic bioprosthesis European outcome (SOURCE) registry: a European registry of transcatheter aortic valve implantation using the Edwards SAPIEN Valve. Circulation 2010;122:62–9.
41. Thomas M, Schymik G, Walther T, et al. One-year outcomes of cohort 1 in the Edwards SAPIEN Aortic Bioprosthesis European Outcome (SOURCE) registry: the European registry of transcatheter aortic valve implantation using the Edwards SAPIEN valve. Circulation 2011; 124:425–33.
42. Dworakowski R, Wendler O. Optimal pain management after aortic valve implantation: an opportunity to improve outcomes after transapical access in the future? Heart 2012;98:1541–2.
43. Stortecky S, Buellesfeld L, Wenaweser P, et al. Transcatheter aortic valve implantation: the procedure. Heart 2012;98:iv44–51.
44. Amat-Santos IJ, Dumont E, Villeneuve J, et al. Effect of thoracic epidural analgesia on clinical outcomes following transapical transcatheter aortic valve implantation. Heart 2012;98:1583–90.
45. Bourantas CV, Farooq V, Onuma Y, et al. Transcatheter aortic valve implantation: new developments and upcoming clinical trials. EuroIntervention 2012;8:617–27.
46. Mussardo M, Latib A, Chieffo A, et al. Periprocedural and short-term outcomes of transfemoral transcatheter aortic valve implantation with the Sapien XT as compared with the Edwards Sapien valve. JACC Cardiovasc Interv 2011;4:743–50.
47. Svensson LG, Tuzcu M, Kapadia S, et al. A comprehensive review of the PARTNER trial. J Thorac Cardiovasc Surg 2013;145:S11–16.
48. Hahn RT, Pibarot P, Stewart WJ, et al. Comparison of transcatheter and surgical aortic valve replacement in severe aortic stenosis: a longitudinal study of echo parameters in cohort A of the PARTNER trial. J Am Coll Cardiol 2013;61:2514–21.
49. Kempny A, Diller G-P, Kaleschke G, et al. Impact of transcatheter aortic valve implantation or surgical aortic valve replacement on right ventricular function. Heart 2012;98:1299–304.
50. Mesa D, Castillo F, Ruiz Ortiz M, et al. Impact of transcatheter aortic valve implantation or surgical aortic valve replacement on right ventricular function. Heart 2013;99:286.
51. Dworakowski R, Wendler O, Bhan A, et al. Successful transcatheter aortic valve implantation (TAVI) is associated with transient left ventricular dysfunction. Heart 2012;98:1641–6.
52. Abdel-Wahab M, Zahn R, Horack M, et al. Aortic regurgitation after transcatheter aortic valve implantation: incidence and early outcome. Results from the German transcatheter aortic valve interventions registry. Heart 2011;97:899–906.
53. Gripari P, Ewe SH, Fusini L, et al. Intraoperative 2D and 3D transoesophageal echocardiographic predictors of aortic regurgitation after transcatheter aortic valve implantation. Heart 2012;98:1229–36.
54. Neragi-Miandoab S, Skripochnik E, Michler RE. Recently patented and widely used valves for transcatheter aortic valve implantation. Recent Pat Cardiovasc Drug Discov 2012;7:196–205.
55. Piazza N, Grube E, Gerckens U, et al. Procedural and 30-day outcomes following transcatheter aortic valve implantation using the third generation (18 Fr) corevalve revalving system: results from the multicentre, expanded evaluation registry 1-year following CE mark approval. EuroIntervention 2008; 4:242–9.
56. Tamburino C, Capodanno D, Ramondo A, et al. Incidence and predictors of early and late mortality after transcatheter aortic valve implantation in 663 patients with severe aortic stenosis. Circulation 2011;123:299–308.
57. Bagur R, Manazzoni JM, Dumont E, et al. Permanent pacemaker implantation following isolated aortic valve replacement in a large cohort of elderly patients with severe aortic stenosis. Heart 2011; 97:1687–94.
58. Fairbairn TA, Mather AN, Bijsterveld P, et al. Diffusion-weighted MRI determined cerebral embolic infarction following transcatheter aortic valve implantation: assessment of predictive risk factors and the relationship to subsequent health status. Heart 2012;98:18–23.
59. Prendergast BD, Naber CK, Popma JJ. Transatlantic perspectives on TAVI: from essential infrastructure and integration to expansion, research and development. Heart 2012;98:iv37–43.
60. Astarci P, Glineur D, Kefer J, et al. Magnetic resonance imaging evaluation of cerebral embolization during percutaneous aortic valve implantation: comparison of transfemoral and trans-apical approaches using Edwards Sapiens valve. Eur J Cardiothorac Surg 2011;40:475–9.
61. Naber CK, Ghanem A, Abizaid AA, et al. First-in-man use of a novel embolic protection device for patients undergoing transcatheter aortic valve implantation. EuroIntervention 2012;8:43–50.
62. Onsea K, Agostoni P, Samim M, et al. First-in-man experience with a new embolia deflection device in transcatheter aortic valve interventions. EuroIntervention 2012;8:51–6.
63. Nietlispach F, Wijesinghe N, Gurvitch R, et al. An embolic deflection device for aortic valve interventions. JACC Cardiovasc Interv 2010;3:1133–8.
64. Krum H, Schlaich M, Whitbourn R, et al. Catheter-based renal sympathetic denervation for resistant hypertension: a multicentre safety and proof-of-principle cohort study. Lancet 2009; 373:1275–81.
65. Investigators SH-. Catheter-based renal sympathetic denervation for resistant hypertension: durability of blood pressure reduction out to 24 months. Hipertensión 2011;57:911–17.
66. Esler MD, Krum H, Sobotka PA, et al. Renal sympathetic denervation in patients with treatment-resistant hypertension (the Symplicity HTN-2 trial): a randomised controlled trial. Lancet 2010;376:1903–9.
67. Esler MD, Krum H, Schlaich M, et al. Renal sympathetic denervation for treatment of drug-resistant hypertension: one-year results from the Symplicity HTN-2 randomized, controlled trial. Circulation 2012;126:2976–82.
68. Hering D, Mahfoud F, Walton AS, et al. Renal denervation in moderate to severe CKD. J Am Soc Nephrol 2012;23:1250–7.
69. Schofer J. REDUCE-HTN trial. EuroPCR. Paris, France: Euro PCR, 2013.
70. Worthley SG. EnligHTN-1: BP drops durable, safe at one year, as renal-denervation mania grows. EuroPCR. Paris, France: heartwire, 2013.
71. Templin C, Jaguszewski M, Ghadri JR, et al. Vascular lesions induced by renal nerve ablation as assessed by optical coherence tomography: pre- and post-procedural comparison with the Simplicity catheter system and the EnligHTN™ multi-electrode renal denervation catheter. Eur Heart J 2013 Apr 25. [Epub ahead of print] doi:10.1093/eurheartj/eht141
72. Ewen S, Ukena C, Böhm M, et al. Percutaneous renal denervation: new treatment option for resistant hypertension and more? Heart 2013.
73. Meier P, Timmis A. Almanac 2012: interventional cardiology: the national society journals present selected research that has driven recent advances in clinical cardiology. Heart 2012;98:1701–9.