Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.29 no.3 Montevideo dic. 2014
Almanac 2013: las Revistas de las Sociedades Nacionales presentan investigaciones seleccionadas que han determinado recientes avances
en la cardiología clínica
Síndromes coronarios agudos
Pascal Meier1,2, Alexandra J Lansky1, Andreas Baumbach3
1. División de Cardiología, Facultad de Medicina de Yale, New Haven, Connecticut, EEUU.
2. Yale-UCL Programa de Investigación Cardiovascular, The Heart Hospital, University College London Hospitals UCLH, Londres, Reino Unido.
3. División de Cardiología, Instituto del Corazón de Bristol, Bristol, Reino Unido.
Correspondencia: Dr. Pascal Meier, Yale-UCL Cardiovascular Research Programme, The Heart Hospital, University College London Hospitals UCLH, UCLH16-18 Westmoreland Street, London W1G 8PH, UK.
Correo electrónico: pascalmeier74@gmail.com
Recibido el 12 de julio de 2013
Aceptado el 24 de julio de 2013
Este artículo fue publicado en Acta Cardiol 2014;69(1):100-8 y es reproducido y traducido con autorización
Resumen
La placa coronaria inestable es la causa de base más común de síndromes coronarios agudos (SCA) y se puede manifestar como angina inestable, infarto sin elevación del segmento ST (SCASEST), e infarto con elevación del segmento ST (IAMCEST), pero también se puede manifestar como paro cardíaco súbito debido a taquiarritmias inducidas por isquemia. La mortalidad de los SCA ha disminuido significativamente en el curso de los últimos años, especialmente la debida a las manifestaciones más extremas de SCA, IAMCEST, y paro cardíaco. Es probable que esta tendencia continúe gracias a avances terapéuticos recientes, entre los que se incluyen nuevos agentes antiplaquetarios tales como prasugrel, ticagrelor y cangrelor.
Introducción
En EEUU cada año se internan casi 1,2 millones de pacientes por síndromes coronarios agudos (SCA) (1). Sin embargo, parecería que la proporción de SCA que presenta infarto miocárdico con elevación del segmento ST (IAMCEST) vendría disminuyendo(2,3). Solo podemos especular con respecto a las razones: entre las posibles explicaciones se incluyen la reducción del tabaquismo, la estructura etaria de la población (IAMCEST es más común en la mediana edad, mientras que la no elevación del segmento ST [SCASEST] ocurre más en los individuos añosos), y el más amplio uso de terapia con estatinas. En los últimos años ha habido una mejora importante de los resultados después de un IAMCEST en relación con la mortalidad, el shock cardiogénico y la insuficiencia cardíaca(1). Se han observado tendencias similares para otras manifestaciones del SCA, por ejemplo muerte súbita (MS)(4,5). Sorprendentemente, los resultados clínicos de SCASEST ahora parecen ser peores que para el IAMCEST. Sin embargo, esas cifras pueden ser engañosas y los resultados a corto plazo (intrahospitalarios) siguen siendo mejores para los SCASEST que para los IAMCEST, en tanto que la tasa de mortalidad a más largo plazo es más elevada para los SCASEST, pero esto probablemente sea en parte debido a la diferencia en edad y estructura del riesgo de las poblaciones que padecen IAMCEST y SCASEST: los pacientes con SCASEST tienden a ser más añosos y a menudo presentan enfermedad coronaria (CAD, por su sigla en inglés) de múltiples vasos (MV).
Una razón importante que explicaría los mejores resultados de los IAMCEST en las últimas décadas ha sido la creciente disponibilidad de servicios de intervención coronaria percutánea (PCI, por su sigla en inglés) primaria; todos ellos están continuamente tratando de mejorar sus resultados (tiempo puerta -balón). Entre las iniciativas se incluye la transmisión telemétrica de los electrocardiogramas desde los servicios de ambulancias y el adiestramiento de su personal en la interpretación del electrocardiograma (ECG). Más importante aún que el tiempo puerta-balón es, por supuesto, el tiempo total desde ‘la instalación de los síntomas hasta la insuflación del balón’. Los pacientes están mucho mejor informados sobre los síntomas de los ‘ataques al corazón’, y muchos servicios de ambulancia transfieren directamente a pacientes en los que se sospecha un IAMCEST a un servicio de PCI primaria en lugar de ir al hospital más cercano.
Intervención coronaria percutánea primaria
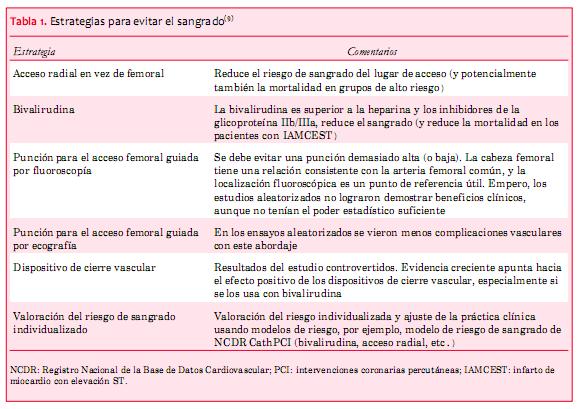
Con el paso de los años no solo ha aumentado la tasa de PCI primaria; los avances en las tecnologías de los dispositivos y la farmacología adyuvante también mejoraron las tasas de éxito de los procedimientos, por ejemplo la disponibilidad de stents convencionales y stents liberadores de fármacos de segunda generación, los dispositivos de aspiración de trombos y los tratamientos de anticoagulación y antiplaquetarios más seguros y eficaces periprocedimiento. Hay ensayos aleatorizados que demuestran que la aspiración de trombos mejora los resultados y actualmente es un manejo recomendado por las guías de PCI europeas y estadounidenses. Sin embargo, probablemente no habría que exagerar sus resultados. Un ensayo aleatorizado reciente a gran escala con 452 pacientes, INFUSE-AMI (Intracoronary Abciximab and Aspiration Thrombectomy in Patients with Large Anterior Myocardial Infarction) no logró demostrar el efecto de la aspiración manual de los trombos sobre el tamaño del infarto cuando se la usa junto con bivalirudina (y abciximab intracoronario)(6,7). Los inhibidores de la glicoproteína (Gp) IIb/IIIa por vía intravenosa son potentes inhibidores plaquetarios, tienen un efecto inmediato y ciertamente mejoran la resolución del trombo; es posible que reduzcan el tamaño del infarto(6), mientras que su efecto sobre los resultados clínicos es algo más discutible. La bivalirudina, un inhibidor directo de la trombina, que tiene efecto anticoagulante y probablemente también efectos antiplaquetarios (mediante la supresión de la activación de las plaquetas dependiente de la trombina(8)), puede ser utilizada como una alternativa de la heparina y los inhibidores de Gp IIb/IIIa; ha demostrado reducción del sangrado e inclusive reducción de la mortalidad en el ensayo HORIZON-AMI (Heparin plus a glycoprotein IIb/IIIa Inhibitor versus Bivalirudin Monotherapy and Paclitaxel-Eluting Stents versus Bare-Metal Stents in Acute Myocardial Infarction) (6). La reducción del sangrado se ha vuelto una meta clave en las PCI primarias, dado que su asociación con un aumento de la mortalidad está bien documentada (aunque no tan bien comprendida) (tabla 1).
Acceso radial versus femoral
Es creciente el uso de otra opción bastante elegante que puede reducir el sangrado; implica la vía radial en lugar del tradicional acceso femoral(9). Hay cada vez más información que indica que esto reduce el sangrado en general; algunos datos incluso sugieren que reduce la mortalidad cuando se utiliza ese acceso para la PCI primaria, pero este último efecto es discutible(10,11).
Un metaanálisis reciente de nueve estudios que involucraron a 2.977 pacientes con IAMCEST demostraron una reducción impresionante de casi el 50% de la mortalidad utilizando la vía radial (OR 0,53, IC 95% 0,33 a 0,84; p=0,008) (10). Aunque los autores concluyeron que en los pacientes con IAMCEST se debería preferir el abordaje radial, una editorial acompañante destacaba algunas limitaciones de estos datos(11). Algunos datos indican un impacto negativo de las PCI por vía radial. Baklanov y colaboradores(12) demostraron una mediana del tiempo de la puerta-balón más prolongada cuando la PCI se hace por vía radial. Otra comparación retrospectiva realizada por Cafri y colaboradores(13), sin embargo, mostró un tiempo de la puerta-balón similar, independientemente de la vía de acceso. Aun en los individuos añosos, donde hay una aterosclerosis más avanzada, el acceso radial no parece demorar la reperfusión, ya que no lleva a un aumento del tiempo de la puerta-balón (14). También ha habido preocupaciones en cuanto a que el acceso radial puede aumentar el riesgo de las complicaciones neurológicas, comparado con el acceso femoral. Sin embargo, en un análisis retrospectivo de la base de datos de la British Cardiovascular Intervention Society, conducido entre enero de 2006 y diciembre de 2010, Ratib y colaboradores(15) han demostrado que no hay una asociación significativa entre el uso del acceso radial y la aparición de complicaciones neurológicas.
En términos generales, la PCI por vía radial es ciertamente una técnica promisoria cuando la realiza un operador con experiencia. Sin embargo, pese a sus beneficios, su uso es altamente variable en los diferentes países. En Francia y Japón es la vía de acceso predominante(11). En el Reino Unido su uso aumentó casi cuatro veces de 17,2% en 2006 a 57% en 2011(16). EEUU tiene la tasa más baja de adopción de acceso radial para PCI a nivel mundial (solo uno de cada seis PCI) (17), aunque aun allí ha habido un aumento del uso del acceso radial. En el primer trimestre de 2007, 1,2% de las PCI se hicieron por abordaje radial; esa cifra aumentó a 16,1% en el tercer trimestre de 2012. Hay poca duda en cuanto a que el aumento del uso de la PCI por vía radial ha llevado a una reducción de las complicaciones en el sitio de acceso(12,16-18).
Si bien algunos datos indican que la vía radial puede reducir la mortalidad en pacientes con IAMCEST, esto no ha sido demostrado en SCASEST. En el ensayo RIVAL (Radial vs Femoral Access for Coronary Intervention), el mayor ensayo aleatorizado a la fecha sobre este tema, no hubo diferencias entre los principales resultados clínicos en pacientes con SCASEST(19). En una cohorte de pacientes con SCASEST de alto riesgo registrados en el ensayo EARLY-SCA (Early Glycoprotein IIb/IIIa Inhibition in non-ST-Segment Elevation Acute Coronary Syndrome), no hubo diferencia significativa en sangrado ni en resultados isquémicos, ya sea que se hubiera utilizado el acceso radial o el femoral(20).
Una declaración de consenso reciente de la Sociedad Europea de Cardiología (ESC) establece que se puede hacer un abordaje radial por defecto en la práctica de rutina en pacientes tanto estables como inestables(21). La ESC recomienda realizar la PCI por vía radial en pacientes con IAMCEST solo una vez que el operador se haya familiarizado con este abordaje en pacientes estables y procedimientos diagnósticos.
PCI de la lesión culpable
La cuestión de si es mejor tratar solo la lesión culpable o realizar una ‘revascularización completa’ sigue siendo un tema discutido. Uno podría argumentar a favor de cualquiera de las dos opciones: una estrategia de revascularización completa puede mejorar la perfusión miocárdica en general en la fase crucial inicial; pero, por otro lado, sabemos que las principales complicaciones adversas aumentan durante la PCI aguda, y esto también puede incidir en el resultado luego del tratamiento de lesiones no agudas y no culpables. Un estudio aleatorizado de 214 pacientes mostró que durante una media de seguimiento de 2,5 años la angioplastia únicamente del vaso culpable se asociaba con tasas de eventos adversos más elevados (50,0%) que cuando se realizaba en múltiples vasos (PCI MV) independientemente de la revascularización completa en un tiempo (23,1%) o una revascularización completa por etapas (20,0%)(22). Un informe reciente del registro Ibaraki Cardiovascular Assessment Study de Japón demostró una mortalidad significativamente más alta con la PCI de una lesión no culpable en el mismo acto que la lesión culpable que realizar solo la PCI de la lesión culpable(23). Por el contrario, los resultados del Registro Nacional Cardiovascular de la Base de Datos del Colegio Americano de Cardiología* (NCDR-CathPCI) mostró tasas de morbilidad y mortalidad similares ya fuera con PCI MV o de un único vaso(24). Si bien estos datos fueron contradictorios, la mayoría de los estudios no eran aleatorizados y deben ser interpretados con cautela. Un gran metaanálisis de 18 ensayos controlados aleatorizados (ECA), que incluye el ECA arriba mencionado, comprendió a 40.280 pacientes y mostró que la PCI en etapas se acompañaba de una menor mortalidad a corto y largo plazo comparado con la PCI del vaso responsable y la PCI MV(25). Por lo tanto, las guías actuales desalientan la realización de la PCI de múltiples vasos en caso de IAMCEST y sugiere que las lesiones no responsables deben hacerse en etapas(26,27). Sin embargo, si los pacientes con IAMCEST se presentan en shock cardiogénico o después de un SCA, deben ser considerados para una revascularización completa en un único tiempo.
* American College of Cardiology National Cardiovascular Database Registry.
El efecto tiempo
Las guías actuales de ESC recomiendan que los pacientes con IAMCEST sean transportados inmediatamente dentro de las primeras dos horas del inicio de los síntomas a un centro equipado para la realización de PCI, evitando cualquier demora(28). En la práctica clínica es muy difícil lograr esta meta de tiempo desde el inicio de los síntomas al balón(29). Se ha demostrado que las demoras del sistema se asocian con la mortalidad, con una mediana de seguimiento de 3,4 años en pacientes con IAMCEST tratados con PCI primaria(30). En un estudio más reciente, un menor tiempo desde el inicio de los síntomas hasta la insuflación del balón predijo una menor mortalidad en el largo plazo(31). Las mayores demoras en comenzar el tratamiento se observaron en mujeres, pacientes que viven en áreas rurales a más de 22 km del hospital, y cuando los pacientes ingresaban al departamento de emergencias del hospital en vez de ser transportados directamente por servicios médicos de emergencia (EMS). Los investigadores sugieren que si se generalizara más el uso de ambulancias/EMS se reducirían las demoras de tratamiento y la mortalidad asociada.
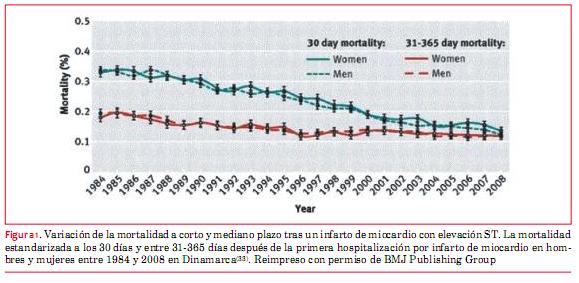
La duración de la estadía hospitalaria ha disminuido drásticamente con los años, lo que tiene un importante impacto sobre los gastos de atención médica y en la calidad de vida de los pacientes. La práctica actual varía ampliamente en los países y centros, y no queda claro si las altas tempranas del hospital son seguras(32). Es muy tranquilizador que pese a la continua reducción de la estadía hospitalaria, los resultados han mejorado significativamente (figura 1).
(33)
Hay dos nuevos estudios que demuestran que es seguro y factible dar de alta a los pacientes con IAMCEST de bajo riesgo dentro de los dos primeros días luego de una PCI primaria(34,35). Más de 40% de los pacientes con IAMCEST en uno de los estudios cumplieron con los criterios de alta temprana(34). Un alta temprana podría bajar considerablemente los costos sanitarios.
Con base en la literatura, propone los siguientes criterios para definir los pacientes de bajo riesgo para un alta temprana:
1. Edad <70 años.
2. Dolor breve hasta el intervalo de reperfusión (<4 horas).
3. PCI primaria no complicada con buen resultado (flujo TIMI [trombolisis en el infarto de miocardio] 3 y resolución rápida y completa de la elevación ST).
4. Fracción de eyección del ventrículo izquierdo >45% sin síntomas de insuficiencia cardíaca.
5. Ausencia de arritmias significativas durante las primeras 24 horas.
6. Paciente que colabora, adhiere al tratamiento y cuenta con apoyo social.
SCA sin elevación de ST
Predicción del riesgo
Es importante encontrar la manera de predecir correctamente el riesgo en los pacientes con SCA para la toma de decisiones clínicas, especialmente con respecto a la angiografía coronaria. Se están utilizando varios modelos de predicción de riesgo. GRACE (Global Registry of Acute Coronary Events) es uno de los scores utilizados más comúnmente. Recientemente se desarrolló mini GRACE (MG), un score de riesgo que excluye la creatinina, y la clasificación Killip del modelo de riesgo original GRACE de ocho factores. El score de riesgo mini GRACE ajustado (AMG, por su sigla en inglés) incluye la ‘prescripción de un diurético de asa durante la internación’ en lugar de la clase Killip y concentración de creatinina. Ambas puntuaciones de riesgo mostraron una buena exactitud en el Proyecto de Auditoría Nacional en la Isquemia Miocárdica (Myocardial Ischaemia National Audit Project (MINAP), donde el score de riesgo AMG funciona un poco mejor que el score de riesgo MG(36).
Los marcadores de laboratorio pueden ayudar a estratificar el riesgo. El valor máximo de troponina en pacientes que se presentan con SCASEST ha mostrado ser un predictor independiente de morbimortalidad hospitalaria(37). Entre los marcadores predictivos se incluyen la interleuquina 10, la mieloperoxidasa y el factor de crecimiento placentario(38).
Papel de la PCI en SCASEST y mejor momento para realizarla
Para los pacientes de riesgo de intermedio a alto hay una fuerte evidencia que apoya la angiografía de rutina más que el manejo conservador. Sin embargo, no queda claro cuál es el momento óptimo para realizar la angiografía coronaria. Si bien un abordaje temprano invasivo parece favorable, los estudios que investigan el efecto de la oportunidad utilizaron diferentes puntos de tiempo para la angiografía ‘temprana’ y diferida. En los pacientes de muy alto riesgo, tales como aquellos con angina refractaria, insuficiencia cardíaca severa, arritmias ventriculares potencialmente fatales o inestabilidad hemodinámica o un infarto de miocardio (IM) en evolución, está indicado un abordaje invasivo urgente. Para los pacientes que no pertenezcan a esta categoría de alto riesgo, no queda claro cuál sería el momento óptimo. No existe ningún beneficio claro para una estrategia invasiva temprana dentro de las primeras 24 horas con respecto a las variables evaluables clínicas ‘duras’, pero hay un número creciente de centros que adoptan una estrategia invasiva temprana dentro de las primeras 24 horas para los pacientes con riesgo de intermedio a alto. Es probable que un abordaje así sea razonable, ya que el actuar más temprano ciertamente ayuda a reducir la internación. Se deben considerar factores como la presencia de diabetes, función renal, función del ventrículo izquierdo, síntomas recurrentes, y revascularización previa, junto con el score TIMI o GRACE.
El concepto de la PCI guiada por imagenología intravascular ha evolucionado con el advenimiento de equipos como el ultrasonido intravascular (IVUS) y más recientemente la tomografía de coherencia óptica (OCT, por su sigla en inglés). Se puede usar de dos modos diferentes, ya sea para evaluación previa a la PCI, para comprender mejor las características de la placa coronaria (placa estable o inestable, diámetro y largo, carga del trombo, etcétera), o para valorar la expansión y aposición del stent después de una PCI. Las ventajas son obvias; a diferencia de la angiografía, que a veces se usa como herramienta a ojo, y que permite medir los diámetros luminales en unas pocas tomas ortogonales, el IVUS coronario ofrece una vista tomográfica. Asimismo, la resolución es mucho mejor que la de la angiografía.
El primer concepto, la valoración de las lesiones previo a una PCI, ha sido analizado en el estudio multicéntrico PROSPECT (Providing Regional Observations to Study Predictors of Events in the Coronary Tree)(39). Este estudio mostró que el IVUS es útil para definir las características de las placas vulnerables. Los fenotipos de más alto riesgo asociados con eventos cardíacos adversos mayores (MACE) de vasos no responsables incluyeron la presencia de fibroateromas de capa fina, carga de la placa >70%, y área mínima de la luz <4,0 mm. Sin embargo, estos datos no son suficientes para recomendar el uso de las características de las placas que surgen del IVUS para decidir si una lesión necesita ser tratada(40).
Mientras que IVUS se basa en el ultrasonido, la OCT se basa en la luz, que tiene una longitud de onda mucho más corta, y, por lo tanto, logra una resolución espacial diez veces mejor comparado con IVUS(41). Esto permite definir mejor las finas capas fibrosas y la extensión circunferencial de los núcleos necróticos. Ayuda a detectar otras características microestructurales como los cristales de colesterol, trombos, depósitos de calcio, placas fibrosas y placas ricas en lípidos(42). La OCT permite visualizar características no observables con IVUS, tales como los colgajos de la íntima y defectos de la íntima, distorsiones de la media, y aposición de los struts del stent.
Un estudio japonés que analizó la lesión responsable en los pacientes con IAM halló que la incidencia de las rupturas de la placa observadas por OCT fue significativamente más alta que la observada tanto por la angioscopía como por IVUS(43). La OCT también fue superior para detectar la erosión de la capa fibrosa y el fibroateroma con capa delgada; asimismo, podría estimar el espesor de la capa fibrosa.
Sin embargo, la profundidad de la penetración de la imagen se limita solo a unos pocos milímetros con esta nueva técnica(44). Por lo tanto, no logra dar una imagen de la adventicia y valorar la carga de la placa. Alfonso y colaboradores(45) propusieron el uso combinado de OCT e IVUS en pacientes con trombosis del stent. Como la longitud de la imagen fue más corta con OCT, sugerían corridas de OCT superpuestas para sortear el problema. El desafío de la OCT es que requiere tener un campo sin sangre para obtener las imágenes.
Como la OCT tiene una resolución superior al IVUS, discrimina claramente los struts del stent en áreas muy calcificadas que son difíciles de identificar con IVUS. La OCT posintervención también produce una imagen más nítida del límite entre la neoíntima y el trombo y ofrece un diagnóstico confiable de la reestenosis intrastent o neoaterosclerosis. En la práctica actual parecería que la OCT y el IVUS se complementan con sus respectivas ventajas y desventajas. Sin embargo, tenemos que ser conscientes de que los datos sobre los resultados clínicos son limitados y que estas técnicas aumentan los costos de los procedimientos.
Terapia antiplaquetaria
La aspirina sigue siendo la base de toda terapia antiplaquetaria. Sin embargo, la terapia dual antiplaquetaria con aspirina y un bloqueante del receptor P2Y12 es claramente más efectiva, siendo el clopidogrel el agente usado más comúnmente para este propósito en la actualidad. Sin embargo, los problemas con este tratamiento son la demora bastante larga hasta alcanzar la inhibición máxima plaquetaria y la alta tasa de malos respondedores(46). Un enfoque que ha sido probado repetidamente es la triple terapia antiplaquetaria usando cilostazol. Aunque los resultados de esta conducta han indicado un cierto beneficio, se usa raramente(47,48). Una razón para esto probablemente sea la aparición de la generación más nueva de los bloqueadores de los receptores P2Y12 como prasugrel, ticagrelor y cangrelor. Bloquean la unión de ADP al receptor plaquetario P2Y12, inhibiendo así la agregación plaquetaria.
Prasugrel: el ensayo TRITON-TIMI 38 fue una comparación cabeza a cabeza entre la aspirina y el prasugrel versus aspirina más clopidogrel en 13.608 pacientes con SCA con riesgo de moderado a alto sometidos a PCI. En la mayoría de los casos, el fármaco en estudio se administró luego de la angiografía coronaria. En el seguimiento a los 15 meses se redujeron los MACE (muerte cardiovascular, IM no fatal, o accidente cerebrovascular no fatal) con prasugrel (9,9% vs 12,1%; HR 0,81, IC 95% 0,73 a 0,90). Esta variable evaluable compuesta fue lograda fundamentalmente gracias a una reducción de los IM no fatales. Los sangrados mayores aumentaron algo con prasugrel (2,4% vs 1,8%; HR 1,32, IC 95% 1,3 a 1,68). El sangrado aumentó fundamentalmente en aquellos pacientes con antecedentes de accidente cerebrovascular o ataque isquémico transitorio, edad ³75 años o con un peso corporal £60 kg. El ensayo TRILOGY SCA analizó la acción de prasugrel comparado con clopidogrel en pacientes con SCASEST no sometidos a PCI. No hubo diferencias estadísticamente significativas en las tasas de MACE (13,9% vs 16,0%; HR 0,91, IC 95% 0,79 a 1,05).
Ticagrelor: a diferencia de clopidogrel y prasugrel, ticagrelor se une al receptor plaquetario P2Y12 de manera reversible. Este agente fue estudiado en el ensayo PLATO (18.624 pacientes) en pacientes con SCA, y también en aquellos no sometidos a PCI pero que recibían tratamiento médico. El tratamiento fue iniciado temprano, a una mediana de 5 horas después del ingreso al hospital. Este estudio mostró un riesgo reducido para MACE (definido como muerte cardiovascular, IM, o accidente cerebrovascular) en el brazo de ticagrelor (9,8% vs 11,7%, HR 0,84, IC 95% 0,77 a 0,92), y también hubo un riesgo reducido de mortalidad cardiovascular como una única variable evaluada. En términos generales no hubo una diferencia significativa en las tasas de sangrado mayor entre los grupos de ticagrelor y clopidogrel (11,6% vs 11,2%, respectivamente). Sin embargo, hubo un riesgo más alto de sangrado mayor relacionado con la cirugía no coronaria (4,5% vs 3,8%).
Cangrelor: a diferencia de los medicamentos arriba mencionados, cangrelor se administra por vía intravenosa. Se lo analizó contra placebo y contra clopidogrel. El ensayo CHAMPION- PLATFORM (control con placebo) fue interrumpido precozmente porque un análisis inicial mostró resultados decepcionantes. El ensayo CHAMPION- ICP (clopidogrel como comparador) tampoco logró mostrar un beneficio importante. El estudio más reciente y de mayor tamaño, el ensayo CHAMPION-PHOENIX, comparó cangrelor contra la precarga con 300-600 mg de clopidogrel. Este estudio no solo incluyó SCA sino también pacientes con CAD estable. Encontró una reducción del riesgo de eventos isquémicos (muerte, IM, revascularización por isquemia o trombosis del stent) en las primeras 48 horas sin un aumento del riesgo de sangrado mayor(49). Todavía no está claro cuál sería su papel en la práctica clínica en el contexto de contar con ticagrelor y prasugrel, y nunca ha sido comparado contra estos agentes.
Contándose ahora con más terapias antiplaquetarias y más potentes, puede ser difícil decidir qué agente usar y cuándo. Hoy día, la decisión habitualmente se basa en los factores clínicos y de riesgo; la farmacogenética también puede jugar un papel en orientar las terapias en el futuro(50).
El sangrado gastrointestinal (GI) es uno de los riesgos más comunes de una fuerte terapia antiplaquetaria. Por lo tanto, a menudo también se indican IBP. Es interesante ver que un estudio reciente halló que el sangrado GI bajo es más común que el sangrado GI alto en pacientes que están recibiendo IBP(51). Asimismo, el impacto de los IBP sobre el efecto del clopidogrel ha sido un tema de controversia durante un tiempo. Los estudios de laboratorio han sugerido que si se utilizan IBP, se podría estar reduciendo el efecto antiplaquetario. Sin embargo, los estudios que investigaron las variables evaluables clínicas han mostrado resultados contradictorios. Un examen sistemático reciente ofrece una muy buena reseña general, incluyendo 33 estudios, y concluye que los datos clínicos son sumamente contrastantes, pero que aun los estudios nuevos y mejor diseñados no muestran evidencias de un efecto adverso relevante del efecto de los IBP en los pacientes que reciben clopidogrel en cuanto a los resultados clínicos(52).
La muerte súbita (MS) es una presentación poco común, pero a menudo fatal de los SCA(53). Si bien hay otras razones para una MS, especialmente en pacientes más jóvenes, la causa más común de paros cardíacos por taquiarritmia en pacientes mayores de 40 años es la isquemia miocárdica(4,37) . La mayoría de estas muertes súbitas ocurren fuera del hospital (paro cardíaco extrahospitalario [OHCA, por su sigla en inglés]). La supervivencia de los pacientes con OHCA ha sido mala durante varias décadas, con un promedio <10% al alta hospitalaria, y puede ser incluso más baja, particularmente en áreas distantes. No obstante ello, en los últimos años la supervivencia ha aumentado, especialmente en las áreas metropolitanas. El servicio de ambulancias de Londres constató un aumento de las tasas de supervivencia, pasando de 12% a 32% entre 2007 y 2012(5).
No se puede más que especular sobre las razones de esta mejora, dado que son pocas las intervenciones aisladas que han realmente demostrado ser eficaces(54). Por consiguiente, es más probable que las mejoras observadas en la supervivencia sean debidas a la combinación de múltiples tratamientos eficaces. Las compresiones de pecho realizadas precozmente y la desfibrilación temprana son dos elementos de cambio indiscutidos(55). Es probable que la disponibilidad de desfibriladores automáticos públicos, los desfibriladores de los EMS y la sensibilización del público, y un aumento del número de legos entrenados en compresión torácica hayan jugado un papel importante(56).
Sin embargo, también resultan importantes elementos como la hipotermia terapéutica y una angiografía inmediata para definir y potencialmente tratar la causa de base(57,58). En un estudio observacional se evaluó a 9.971 pacientes con OHCA y sospecha de causa cardíaca en relación con el hospital al cual fueron referidos. Los pacientes tratados en hospitales con servicios de cardiología intervencionista las 24 horas tuvieron una mejor supervivencia (OR 1,40, IC 95% 1,12 a 1,74; p=0,003).
Las guías actuales recomiendan la realización de una angiografía en los pacientes inmediatamente después de una resucitación exitosa de un OHCA (recuperación de la circulación espontánea) en caso de elevaciones ST en el ECG posresucitación. Sin embargo, la exactitud de los ECG posteriores a una resucitación no quedan claros y no hay fundamentos como para recomendar una angiografía temprana en todos los pacientes mayores de 35-40 años, independientemente del ECG, si no hay una causa no cardíaca obvia.
Rehabilitación cardíaca tras un SCA
Si bien parece intuitivo que los programas de rehabilitación cardíaca son beneficiosos porque ofrecen un seguimiento cuidadoso, actividad física supervisada y orientaciones sobre cambios en el estilo de vida, la información clínica sobre sus efectos es controvertida. Muy recientemente, la rehabilitación cardíaca por SCA ha sido cuestionada nuevamente por el ECA multicéntrico de rehabilitación cardíaca integral en pacientes que han presentado un IM agudo (RAMIT: Rehabilitation After Myocardial Infarction Trial) (59). En este estudio, la rehabilitación cardíaca en los pacientes que han sufrido un IAM no incidió sobre la mortalidad o la morbilidad, la medicación cardíaca, los factores de riesgo o los cambios en el estilo de vida. Sin embargo, debemos ser conscientes de que el ensayo RAMIT era pequeño y si observamos la evidencia de una forma más completa, reuniendo todos los ECA disponibles, como en una revisión Cochrane (combinando 47 estudios), hay un efecto significativo aunque modesto sobre la mortalidad(60). Este metaanálisis no incluyó los hallazgos del ensayo RAMIT, que habrían reducido aun más el efecto estimado sobre la mortalidad por todas las causas de 13% a 11%(61). Es importante destacar que la revisión Cochrane se concentró en la rehabilitación basada en el ejercicio físico, siendo probable que la rehabilitación no basada en el ejercicio (educación del paciente) tenga poco efecto sobre la mortalidad después de un IM(62).
El problema de combinar resultados de muchos ensayos, por supuesto, es que esto no tiene en cuenta la ‘evolución’ de dichas intervenciones(63). Los resultados del estudio reciente OMEGA, un estudio de cohorte no aleatorizado, han demostrado que un programa de rehabilitación cardíaca completo a corto plazo tras un IAM agudo mejoraba el pronóstico de forma significativa al año(64). Los que asistieron a programas de rehabilitación tuvieron una mortalidad por todas las causas más baja que la de los que no asistieron, pero es difícil interpretar los datos sin una asignación de tratamiento aleatorizada. Hubo una relación dosis-respuesta importante; cuantas más sesiones cumplieran, menor la mortalidad por todas las causas. Sin embargo, quienes asistían a pocas sesiones tendían a ser fumadores, y al hacer los ajustes para las diferencias basales en la condición de tabaquismo esa asociación dosis-respuesta desapareció.
Conclusiones
Las opciones de tratamiento para los SCA han mejorado de manera importante en los últimos años, contribuyendo a mejoras notables de los resultados. Esto se aplica especialmente a los casos de IAMCEST, mientras que la mortalidad a largo plazo después de SCASEST sigue siendo considerable. Es probable que la muy reciente introducción de las terapias antiplaquetarias de tercera generación (prasugrel, ticagrelor) y la forma intravenosa más reciente, cangrelor, sigan mejorando los resultados clínicos después de un SCA. Estos agentes más potentes pueden aumentar los riesgos de sangrado, y considerando la asociación entre el sangrado y los resultados, las estrategias para evitar el sangrado periprocedimiento son importantes. Pueden incluir la angiografía por vía radial, el acceso femoral guiado por ultrasonido, y el uso de bivalirudina.
Colaboradores. PM redactó el manuscrito. AB, AJL y AB revisaron el manuscrito críticamente para el contenido verificando su contenido intelectual. Los tres autores hicieron grandes contribuciones a este trabajo y aprobaron la versión final.
Conflicto de intereses: ninguno.
Origen y revisión por pares: encargado, revisión interna por colegas.
Referencias
1. Members WG, Roger VL, Go AS, et al. Heart disease and stroke statistics.2012 update: a report from the American Heart Association. Circulation 2012; 125: e2–220.
2. Knight CJ, Timmis AD. Almanac 2011: acute coronary syndromes. The national society journals present selected research that has driven recent advances in clinical cardiology. Heart 2011;97:1820–7.
3. Yeh RW, Sidney S, Chandra M, et al. Population trends in the incidence and outcomes of acute myocardial infarction. N Engl J Med 2010;362:2155–65.
4. Nolan JP, Lyon RM, Sasson C, et al. Advances in the hospital management of patients following an out of hospital cardiac arrest. Heart 2012;98:1201–6.
5. Fothergill RT, Watson LR, Chamberlain D, et al. Increases in survival from out-of-hospital cardiac arrest: a five year study. Resuscitation 2013;84: 1089–92.
6. Stone GW, Maehara A, Witzenbichler B, et al. Intracoronary abciximab and aspiration thrombectomy in patients with large anterior myocardial infarction: the INFUSE-AMI randomized trial. JAMA 2012;307:1817–26.
7. Stone GW, Witzenbichler B, Guagliumi G, et al. Heparin plus a glycoprotein IIb/IIIa inhibitor versus bivalirudin monotherapy and paclitaxel-eluting stents versus bare-metal stents in acute myocardial infarction (HORIZONS-AMI): final 3-year results from a multicentre, randomised controlled trial. Lancet 2011;377:2193–204.
8. Kimmelstiel C, Zhang P, Kapur NK, et al. Bivalirudin is a dual inhibitor of thrombin and collagen-dependent platelet activation in patients undergoing percutaneous coronary intervention. Circ Cardiovasc Interv 2011;4:171–9.
9. Meier P, Frohlich GM, Lansky AJ. Bleeding complications in percutaneous coronary interventions. Cardiology 2013;125:213–16.
10. Mamas MA, Ratib K, Routledge H, et al. In?uence of access site selection on PCI-related adverse events in patients with STEMI: meta-analysis of randomised controlled trials. Heart 2012;98:303–11.
11. Meier P, Windecker S, Lansky AJ. Radial versus femoral access for primary percutaneous coronary intervention: is there a preferred route to the heart? Heart 2012;98:269–70.
12. Baklanov DV, Kaltenbach LA, Marso SP, et al. The prevalence and outcomes of transradial percutaneous coronary intervention for ST-segment elevation myocardial infarction: analysis from the National Cardiovascular Data Registry (2007 to 2011). J Am Coll Cardiol 2013;61:420–6.
13. Cafri C, Zahger D, Merkin M, et al. Efficacy of the radial approach for the performance of primary PCI for STEMI. J Invasive Cardiol 2013;25:150–3.
14. Secco GG, Marinucci L, Uguccioni L, et al. Transradial versus transfemoral approach for primary percutaneous coronary interventions in elderly patients. J Invasive Cardiol 2013;25:254–6.
15. Ratib K, Mamas MA, Routledge HC, et al. In?uence of access site choice on incidence of neurologic complications after percutaneous coronary intervention. Am Heart J 2013;165:317–24.
16. Ratib K, Routledge H, Mamas MA, et al. Trends in access site choice and PCI outcomes: insights from the UK national PCI dataset. Heart 2012;98: A28–A9.
17. Feldman DN, Swaminathan RV, Kaltenbach LA, et al. Adoption of radial access and comparison of outcomes to femoral access in percutaneous coronary intervention: an updated report from the National Cardiovascular Data Registry (2007–2012). Circulation 2013;127:2295–306.
18. De Luca G, Schaffer A, Wirianta J, et al. Comprehensive meta-analysis of radial vs femoral approach in primary angioplasty for STEMI. Int J Cardiol 2013 (Epub ahead of print).
19. Mehta SR, Jolly SS, Cairns J, et al. Effects of radial versus femoral artery access in patients with acute coronary syndromes with or without ST-segment elevation. J Am Coll Cardiol 2012;60:2490–9.
20. Klutstein MW, Westerhout CM, Armstrong PW, et al. Radial versus femoral access, bleeding and ischemic events in patients with non-ST-segment elevation acute coronary syndrome managed with an invasive strategy. Am Heart J 2013;165:583–90 e1.
21. Hamon M, Pristipino C, Di Mario C, et al. Consensus document on the radial approach in percutaneous cardiovascular interventions: position paper by the European Association of Percutaneous Cardiovascular Interventions and Working Groups on Acute Cardiac Care and Thrombosis of the European Society of Cardiology. EuroIntervention 2013;8: 1242–51.
22. Politi L, Sgura F, Rossi R, et al. A randomised trial of target-vessel versus multi-vessel revascularisation in ST-elevation myocardial infarction: major adverse cardiac events during long-term follow-up. Heart 2010;96:662–7.
23. Abe D, Sato A, Hoshi T, et al. Initial culprit-only versus initial multivessel percutaneous coronary intervention in patients with ST-segment elevation myocardial infarction: results from the Ibaraki Cardiovascular Assessment Study registry. Heart Vessels 2013 March 26th (Epub ahead of print).
24. Brener SJ, Milford-Beland S, Roe MT, et al. Culprit-only or multivessel revascularization in patients with acute coronary syndromes: an American College of Cardiology National Cardiovascular Database Registry report. Am Heart J 2008;155:140–6.
25. Vlaar PJ, Mahmoud KD, Holmes DR Jr, et al. Culprit vessel only versus multivessel and staged percutaneous coronary intervention for multivessel disease in patients presenting with ST-segment elevation myocardial infarction: a pairwise and network meta-analysis. J Am Coll Cardiol 2011;58:692–703.
26. Wijns W, Kolh P, Danchin N, et al. Guidelines on myocardial revascularization. Eur Heart J 2010;31: 2501–55.
27. Kushner FG, Hand M, Smith SC Jr, et al. 2009 focused updates: ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction (updating the 2004 guideline and 2007 focused update) and ACC/AHA/SCAI guidelines on percutaneous coronary intervention (updating the 2005 guideline and 2007 focused update): a report of the American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2009;54:2205–41.
28. Wijns W, Kolh P, Danchin N, et al. Guidelines on myocardial revascularization: the Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2010;31:2501–55.
29. Eagle KA, Nallamothu BK, Mehta RH, et al. Trends in acute reperfusion therapy for ST-segment elevation myocardial infarction from 1999 to 2006: we are getting better but we have got a long way to go. Eur Heart J 2008;29:609–17.
30. Terkelsen CJ, Sorensen JT, Maeng M, et al. System delay and mortality among patients with STEMI treated with primary percutaneous coronary intervention. JAMA 2010;304:763–71.
31. Rollando D, Puggioni E, Robotti S, et al. Symptom onset-to-balloon time and mortality in the first seven years after STEMI treated with primary percutaneous coronary intervention. Heart 2012;98:1738–42.
32. Khavandi A, Freeman P, Meier P. Discharge after primary angioplasty at 24 h: feasible and safe or a step too far? Cardiology 2013;125:176–9.
33. Schmidt M, Jacobsen JB, Lash TL, et al. 25 year trends in first time hospitalization for acute myocardial infarction, subsequent short and long term mortality, and the prognostic impact of sex and comorbidity: a Danish nationwide cohort study. BMJ 2012;344:e356.
34. Jones DA, Rathod KS, Howard JP, et al. Safety and feasibility of hospital discharge 2 days following primary percutaneous intervention for ST-segment elevation myocardial infarction. Heart 2012;98: 1722–7.
35. Noman A, Zaman AG, Schechter C, et al. Early discharge after primary percutaneous coronary intervention for ST-elevation myocardial infarction. Eur Heart J Acute Cardiovasc Care 2013 February 14th (epub ahead of print).
36. Simms AD, Reynolds S, Pieper K, et al. Evaluation of the NICE mini-GRACE risk scores for acute myocardial infarction using the Myocardial Ischaemia National Audit Project (MINAP) 2003–2009: National Institute for Cardiovascular Outcomes Research (NICOR). Heart 2012;99:35–40.
37. Jolly SS, Shenkman H, Brieger D, et al. Quantitative troponin and death, cardiogenic shock, cardiac arrest and new heart failure in patients with non-ST-segment elevation acute coronary syndromes (NSTE ACS): insights from the Global Registry of Acute Coronary Events. Heart 2011;97:197–202.
38. Oemrawsingh RM, Lenderink T, Akkerhuis KM, et al. Multimarker risk model containing troponin-T, interleukin 10, myeloperoxidase and placental growth factor predicts long-term cardiovascular risk after non-ST-segment elevation acute coronary syndrome. Heart 2011;97:1061–6.
39. Stone GW, Maehara A, Lansky AJ, et al. A prospective natural-history study of coronary atherosclerosis. N Engl J Med 2011;364:226–35.
40. Lodi-Junqueira L, de Sousa MR, da Paixao LC, et al. Does intravascular ultrasound provide clinical benefits for percutaneous coronary intervention with bare-metal stent implantation? A meta-analysis of randomized controlled trials. Syst Rev 2012;1:42.
41. Maehara A, Mintz GS, Weissman NJ. Advances in intravascular imaging. Circ Cardiovasc Interv 2009;2:482–90.
42. Yabushita H, Bouma BE, Houser SL, et al. Characterization of human atherosclerosis by optical coherence tomography. Circulation 2002;106: 1640–5.
43. Kubo T, Imanishi T, Takarada S, et al. Assessment of culprit lesion morphology in acute myocardial infarction: ability of optical coherence tomography compared with intravascular ultrasound and coronary angioscopy. J Am Coll Cardiol 2007;50:933–9.
44. Lindsay AC, Viceconte N, Di Mario C. Optical coherence tomography: has its time come? Heart 2011;97:1361–2.
45. Alfonso F, Dutary J, Paulo M, et al. Combined use of optical coherence tomography and intravascular ultrasound imaging in patients undergoing coronary interventions for stent thrombosis. Heart 2012;98:1213–20.
46. Sambu N, Radhakrishnan A, Dent H, et al. Personalised antiplatelet therapy in stent thrombosis: observations from the Clopidogrel Resistance in Stent Thrombosis (CREST) registry. Heart 2012; 98:706–11.
47. Park KW, Park JJ, Lee SP, et al. Cilostazol attenuates on-treatment platelet reactivity in patients with CYP2C19 loss of function alleles receiving dual antiplatelet therapy: a genetic substudy of the CILON-T randomised controlled trial. Heart 2012;97:641–7.
48. Tamhane U, Meier P, Chetcuti S, et al. Efficacy of cilostazol in reducing restenosis in patients undergoing contemporary stent based PCI: a meta-analysis of randomised controlled trials. EuroIntervention 2009;5:384–93.
49. Bhatt DL, Stone GW, Mahaffey KW, et al. Effect of platelet inhibition with cangrelor during PCI on ischemic events. N Engl J Med 2013;368:1303–13.
50. Verschuren JJ, Jukema JW. Pharmacogenetics of antiplatelet therapy: ready for clinical application? Heart 2011;97:1268–76.
51. Casado Arroyo R, Polo-Tomas M, Roncales MP, et al. Lower GI bleeding is more common than upper among patients on dual antiplatelet therapy: long-term follow-up of a cohort of patients commonly using PPI co-therapy. Heart 2012;98:718–23.
52. Focks JJ, Brouwer MA, van Oijen MG, et al. Concomitant use of clopidogrel and proton pump inhibitors: impact on platelet function and clinical outcome- a systematic review. Heart 2013;99:520–7.
53. Perkins GD, Brace SJ, Smythe M, et al. Out-of-hospital cardiac arrest: recent advances in resuscitation and effects on outcome. Heart 2011;98: 529–35.
54. Brooks SC, Bigham BL, Morrison LJ. Mechanical versus manual chest compressions for cardiac arrest. Cochrane Database Syst Rev 2011:CD007260, doi.10.1002/ 14651858.CD007260.pub2.
55. Meier P, Baker P, Jost D, et al. Chest compressions before defibrillation for out-of-hospital cardiac arrest: a meta-analysis of randomized controlled clinical trials. BMC Med 2010;8:52.
56. Adielsson A, Hollenberg J, Karlsson T, et al. Increase in survival and bystander CPR in out-of-hospital shockable arrhythmia: bystander CPR and female gender are predictors of improved outcome. Experiences from Sweden in an 18-year perspective. Heart 2011;97:1391–6.
57. Arrich J, Holzer M, Havel C, et al. Hypothermia for neuroprotection in adults after cardiopulmonary resuscitation. Cochrane Database Syst Rev 2012;(9): CD004128.
58. Stub D, Smith K, Bray JE, et al. Hospital characteristics are associated with patient outcomes following out-of-hospital cardiac arrest. Heart 2011; 97:1489–94.
59. West RR, Jones DA, Henderson AH. Rehabilitation after myocardial infarction trial (RAMIT): multi-centre randomised controlled trial of comprehensive cardiac rehabilitation in patients following acute myocardial infarction. Heart 2012;98:637–44.
60. Heran BS, Chen JM, Ebrahim S, et al. Exercise-based cardiac rehabilitation for coronary heart disease. Cochrane Database Syst Rev 2011:CD001800, doi.10.1002/ 14651858.CD001800.pub2.
61. Doherty P, Lewin R. The RAMIT trial, a pragmatic RCT of cardiac rehabilitation versus usual care: what does it tell us? Heart 2012;98:605–6.
62. Brown JP, Clark AM, Dalal H, et al. Patient education in the management of coronary heart disease. Cochrane Database Syst Rev 2011:CD008895.
63. Wood D. Is cardiac rehabilitation fit for purpose in the NHS: maybe not. Heart 2012;98:607–8.
64. Rauch B, Riemer T, Schwaab B, et al. Short-term comprehensive cardiac rehabilitation after AMI is associated with reduced 1-year mortality: results from the OMEGA study. Eur J Prev Cardiol 2013 doi: 10.1002/14651858.CD008895. pub2.
65. West RR, Henderson AH. Cardiac rehabilitation and exercise training. Heart 2013;99:753–4.