Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.29 no.3 Montevideo dic. 2014
Los pacientes con fibrilación auricular no se benefician del ácido acetilsalicílico
Sara Själander1, Anders Själander1, Peter J. Svensson2, Leif Friberg3
Este artículo fue publicado en Europace 2014; 16: 631-8, y es reproducido y traducido con autorización
1. Departamento de Salud Pública y Medicina Clínica, Universidad Umeå, S-90185 Umeå, Suecia.
2. Departamento para los trastornos de la coagulación, Universidad de Lund, S-20502 Malmö, Suecia.
3. Instituto Karolinska y Departamento de Cardiología, Hospital Universitario Danderyd, S-18288 Estocolmo, Suecia.
Correspondencia: Department of Internal Medicine, Sundsvall Hospital, SE-85643 Sundsvall, Sweden. E-mail: sara.sjalander@lvn.se
Recibido el 25 de junio de 2013; aceptado después de su revisión el 24 de setiembre de 2013; publicación en línea previa a la impresa: 24 de octubre de 2013.
Resumen
Objetivo: la anticoagulación oral es el tratamiento recomendado para la prevención del accidente cerebrovascular en pacientes con fibrilación auricular. Sin embargo, muchos pacientes reciben ácido acetilsalicílico (AAS) como monoterapia. Nuestro objetivo fue investigar si los pacientes con fibrilación auricular se beneficiaban del AAS como monoterapia para la prevención de accidente cerebrovascular.
Métodos y resultados: estudio retrospectivo de los pacientes con diagnóstico clínico de fibrilación auricular ingresados en el Registro Nacional Sueco de Pacientes entre el 1 de julio de 2005 y el 1 de enero de 2009, combinado con datos del Registro Nacional de Medicamentos Recetados. Las variables evaluables fueron accidente cerebrovascular isquémico, evento tromboembólico, hemorragia intracraneana, y sangrado mayor. La población en estudio consistió en 115.185 pacientes con fibrilación auricular, 58.671 de los cuales recibieron AAS como monoterapia y 56.514 no recibieron ningún tratamiento antitrombótico a nivel basal. La media de seguimiento fue de 1,5 años. El tratamiento con AAS se asoció a un mayor riesgo de presentar un accidente cerebrovascular isquémico y eventos tromboembólicos comparado con la ausencia de tratamiento antitrombótico.
Conclusión: el AAS como monoterapia en la prevención del accidente cerebrovascular provocado por fibrilación auricular no posee ningún efecto discernible de protección contra el accidente cerebrovascular, y puede incluso aumentar el riesgo de accidente cerebrovascular isquémico en pacientes añosos. Por lo tanto, nuestros datos avalan las nuevas recomendaciones de las guías europeas, en el sentido que no debería utilizarse el AAS como monoterapia en la prevención del accidente cerebrovascular provocado por la fibrilación auricular.
FIBRILACIÓN AURICULAR
ACCIDENTE CEREBROVASCULAR
ÁCIDO ACETILSALICÍLICO
Summary
Aims: Oral anticoagulation is the recommended treatment for stroke prevention in patients with atrial fibrillation. Notwithstanding, many patients are treated with acetylsalicylic acid (ASA) as monotherapy. Our objective was to investigate if atrial fibrillation patients benefit from ASA as monotherapy for stroke prevention.
Methods and results: retrospective study of patients with a clinical diagnosis of atrial fibrillation between 1 July 2005 and 1 January 2009 in the National Swedish Patient register, matched with data from the National Prescribed Drugs register. Endpoints were ischaemic stroke, thrombo-embolic event, intracranial haemorrhage, and major bleeding. The study population consisted of 115 185 patients with atrial fibrillation, of whom 58 671 were treated with ASA as monotherapy and 56 514 were without any antithrombotic treatment at baseline. Mean follow-up was 1.5 years. Treatment with ASA was associated with higher risk of ischaemic stroke and thrombo-embolic events compared with no antithrombotic treatment.
Conclusion: acetylsalicylic acid as monotherapy in stroke prevention of atrial fibrillation has no discernable protective effect against stroke, and may even increase the risk of ischaemic stroke in elderly patients. Thus, our data support the new European guidelines recommendation that ASA as monotherapy should not be used as stroke prevention in atrial fibrillation.
Key words:
ATRIAL FIBRILLATION
STROKE
ACETYLSALICYLIC ACID
Introducción
La fibrilación auricular (FA) es la más común de las arritmias cardíacas y una causa importante de accidente cerebrovascular(1,2). La anticoagulación oral es el tratamiento profiláctico recomendado para la mayoría de los pacientes bajo el argumento que confiere una reducción de 64% del riesgo de accidente cerebrovascular(3), mientras que el ácido acetilsalicílico (AAS) ha sido una opción para los pacientes de bajo riesgo o para los pacientes que no pueden recibir anticoagulantes orales. Sin embargo, el beneficio neto del AAS ha sido cuestionado en los últimos años, dado que se ha demostrado que el beneficio absoluto de la anticoagulación oral aumenta, mientras que el beneficio de los agentes antiplaquetarios parece disminuir con la edad(4). Paralelamente, la tasa de sangrados graves es la misma entre los pacientes que reciben anticoagulación oral y agentes antiplaquetarios en los individuos añosos (>80 años) (4). En la práctica clínica, sin embargo, el AAS sigue siendo ampliamente utilizado y a menudo se usa en los pacientes que tienen el mayor riesgo de accidente cerebrovascular: pacientes añosos y pacientes con muchos factores de riesgo de accidente cerebrovascular.
La finalidad de este estudio fue evaluar la prevalencia y el beneficio clínico neto del AAS como monoterapia para la prevención del accidente cerebrovascular provocado por FA.

Métodos
En Suecia, cada individuo tiene un único número de registro cívico, cuyos seis primeros dígitos corresponden a la fecha de nacimiento y el noveno dígito denota el sexo del individuo. Este número es constante durante toda la vida y es utilizado en todos los contactos con el sistema sanitario. Por lo tanto, los registros suecos permiten seguir los contactos de cada paciente con el sistema de salud, así como su adquisición de medicamentos en farmacias en el curso de los años aunque el paciente se mude a otra región. El acceso a la información en estos registros está estrictamente regulado para evitar cualquier violación a la integridad personal del individuo, y su identidad es sustituida por números anónimos antes de otorgar acceso a los datos con fines de investigación. El presente estudio fue aprobado por el comité de ética del Instituto Karolinska (EPN 2008/433-32).
La fecha índice fue definida como el primer episodio de FA en un paciente después del 1 de julio de 2005. Para los eventos que ocurren durante el seguimiento se excluyeron las dos primeras semanas después de la fecha índice, dado que es común que los pacientes sean transportados de una clínica a otra, o de un hospital a otro. En general, la aparición de diagnósticos de accidente cerebrovascular isquémico o hemorragia intracraneana dentro de los primeros días de ingreso al hospital están relacionados con la causa de internación y no responden a un nuevo evento. Por consiguiente, el conteo del tiempo en riesgo se inicia a los 14 días después de la fecha índice y los diagnósticos planteados durante estas dos semanas fueron considerados como comorbilidades y no como eventos durante el seguimiento.
El tratamiento antitrombótico en sí de cada paciente se obtuvo mediante el Registro de Medicamentos Recetados. Todas las farmacias en Suecia están obligadas a comunicar a este registro, en el que las compras de prescripciones se vinculan a cada paciente individual. Por consiguiente, se puede obtener información sobre fechas, dosis, y cantidades para cada prescripción entregada en Suecia. En Suecia se necesita receta para comprar anticoagulantes orales así como agentes antiplaquetarios (incluyendo AAS a dosis bajas). Se definió la medicación basal como un medicamento retirado de la farmacia entre los 100 días anteriores y las dos semanas después de la fecha índice. En este análisis no se tuvieron en cuenta ni la dosis de AAS ni la estabilidad de INR.
El riesgo de accidente cerebrovascular isquémico para cada paciente fue valorado con el esquema CHA2DS2-VASc(7). El riesgo de sangrado fue evaluado con el esquema HAS-BLED(8,9). Del Registro de Pacientes obtuvimos información sobre los diagnósticos incluidos en CHA2DS2-VASc y HAS-BLED, así como los diagnósticos de las complicaciones (eventos tromboembólicos y sangrados). La información sobre las complicaciones fatales se obtuvo del Registro Nacional de las Causas de Muerte.
Las variables evaluables fueron accidente cerebrovascular isquémico, evento tromboembólico (accidente cerebrovascular isquémico, accidente cerebrovascular inespecífico, ataque isquémico transitorio [AIT], y embolia sistémica), hemorragia intracraneana, y sangrado mayor (hemorragia intracraneana, sangrado gastrointestinal, y anemia secundaria al sangrado). Los códigos diagnósticos incluidos en el análisis se presentan en la tabla 1.
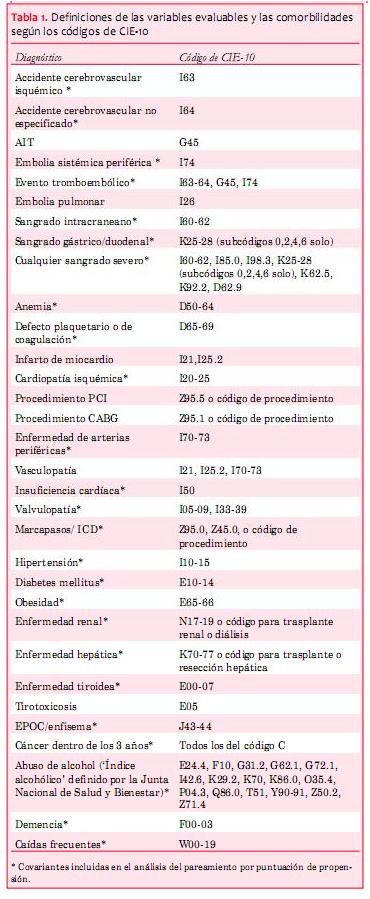
Los componentes en CHA2DS2-VASc fueron definidos como el diagnóstico de insuficiencia cardíaca, hipertensión, edad >75 en el momento de la inclusión, diabetes mellitus, accidente cerebrovascular isquémico previo (accidente cerebrovascular isquémico, accidente cerebrovascular no especificado, AIT, embolia sistémica), enfermedad vascular (infarto de miocardio previo, arteriopatía periférica), edad 65-74 años y sexo femenino. Utilizando la puntuación HAS-BLED, se dieron puntos para hipertensión, insuficiencia renal, enfermedad hepática, antecedente de sangrado severo, anemia, defecto plaquetario o de la coagulación, edad >65, índice alcohólico, y el uso de agentes antiplaquetarios (AAS, clopidogrel, ticlodipina, y heparinas de bajo peso molecular). No tuvimos información sobre el uso de antiinflamatorios no esteroideos, que a menudo se usan de manera intermitente y para los que no necesariamente se exige receta. Al no conocerse los valores de INR, no se pudo dar puntos por labilidad de INR.
Métodos estadísticos
Las características basales se presentaron de manera descriptiva y se analizaron las diferencias entre los grupos con pruebas t y de chi2. Se calculó la incidencia anualizada de accidentes cerebrovasculares como “eventos por 100 años en riesgo”, expresando el resultado en términos de porcentajes. La supervivencia se presenta gráficamente con el método de Kaplan-Meier y análisis univariado y multivariado mediante regresiones de Cox. En el análisis multivariado incluimos las comorbilidades y la medicación con asociación conocida a accidente cerebrovascular, sangrado, o mortalidad, presentadas en la tabla 1.
La puntuación de propensión para la probabilidad del tratamiento con AAS se estimó usando la regresión logística, en la que se usó la asignación de tratamiento como la variable de resultado y las covariables como predictores. Las covariables usadas se enumeran en la tabla 1. Luego de estimar la puntuación de propensión realizamos un pareamiento 1:1 con el pareamiento del vecino más cercano entre los pacientes tratados con AAS y los pacientes sin tratamiento antitrombótico. Se definió una calibración de 0,2. Luego del procedimiento de pareamiento examinamos si se había logrado alcanzar un balance de las covariables con el procedimiento de pareamiento o no. En este paso comparamos las diferencias medias normalizadas de las covariables; el equilibrio fue definido como las diferencias medias normalizadas de las covariables inferiores a 0,25 después del pareamiento. En la submuestra pareada comparamos la incidencia anualizada de todos los eventos entre pacientes tratados con AAS y pacientes sin tratamiento antitrombótico.
Resultados
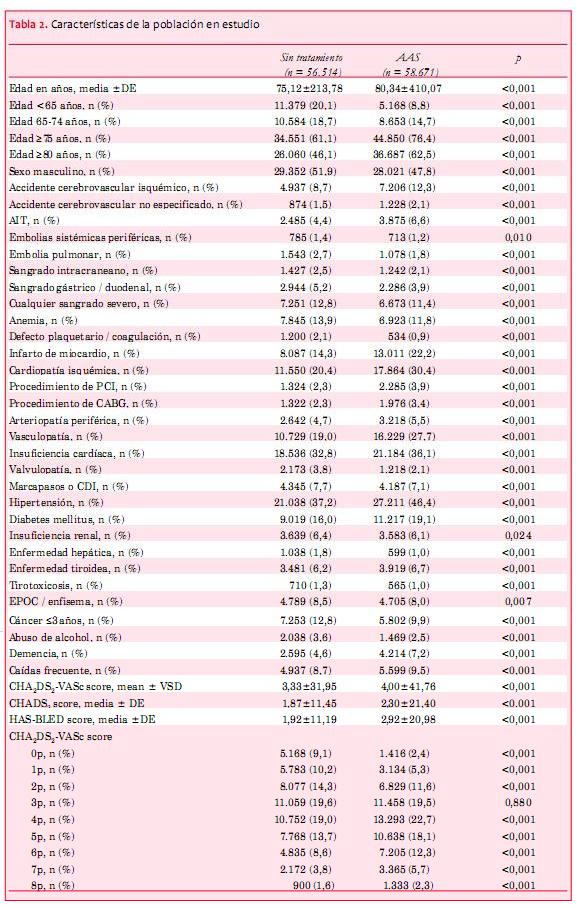
De 182.678 pacientes a los que se diagnosticó FA, 115.185 cumplían con nuestros criterios de inclusión (tratamiento con AAS o ausencia de tratamiento antitrombótico). Las características de base se muestran en la tabla 2.
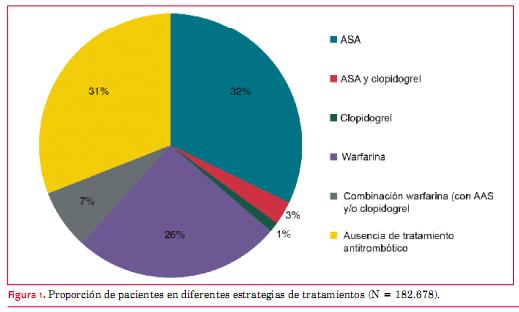
En general, los pacientes tratados con AAS tenían un mayor grado de comorbilidades, y, por consiguiente, tenían puntuaciones de CHA2DS2-VASc más elevadas que los pacientes que no recibían tratamiento antitrombótico. De los 182.678 pacientes con FA o aleteo auricular, 31% no recibieron ningún tratamiento para prevenir el accidente cerebrovascular, 33% fueron tratados con anticoagulación oral y 32% recibieron AAS como monoterapia (figura 1).
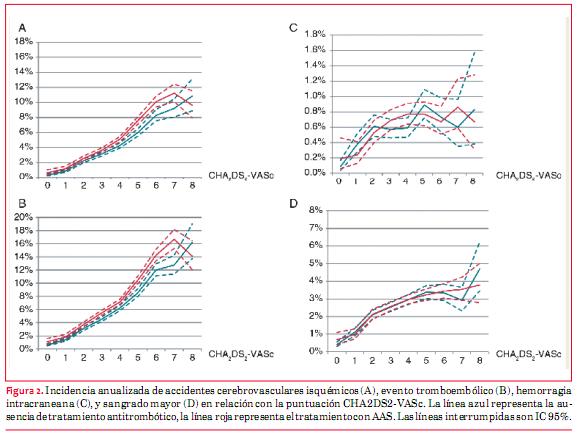
Los pacientes tratados con AAS no mostraron reducción de los accidentes cerebrovasculares isquémicos o de los eventos tromboembólicos, comparado con pacientes sin tratamiento antitrombótico, según surge de la puntuación de CHA2DS2- VASc (figura 2 A y B, tabla 3). Se vio una tendencia hacia una mayor incidencia de accidentes cerebrovasculares isquémicos y eventos tromboembólicos en pacientes tratados con AAS comparado con los que no recibieron tratamiento antitrombótico. Las tasas de hemorragia intracraneana o sangrado mayor fueron similares en los pacientes tratados con AAS y en pacientes sin terapia antitrombótica según la puntuación CHA2DS2-VASc (figura 2 C y D, tabla 3).
Accidentes cerebrovasculares isquémicos y eventos tromboembólicos
En el análisis multivariado hipertensión, diabetes mellitus, sexo femenino, hemorragia intracraneana previa, accidente cerebrovascular isquémico, AIT, y embolia sistémica periférica se asociaron con un aumento del riesgo de accidente cerebrovascular isquémico y eventos tromboembólicos en ambos grupos de estudio. Además, el sangrado severo, la enfermedad arterial periférica y enfermedad vascular se asociaron también con un aumento del riesgo de eventos tromboembólicos.
El riesgo de accidente cerebrovascular isquémico y eventos tromboembólicos fue más elevado en las mujeres que en los hombres, independientemente de si recibían tratamiento con AAS o ningún tratamiento. Por ejemplo, las mujeres tuvieron un riesgo de accidente cerebrovascular isquémico 38% mayor que los hombres [hazard ratio (HR) 1,38, IC 1,29-1,48] cuando se las trató con AAS y un riesgo de accidente cerebrovascular isquémico 46% mayor que los hombres (HR 1,46, IC 1,35-1,57) al no administrarse ningún tratamiento antitrombótico.
Los factores asociados con el riesgo de sangrado mayor fueron similares a los asociados con el riesgo de hemorragia intracraneana. El antecedente de hemorragia intracraneana y de sangrado severo se acompañó de un aumento del riesgo de una nueva hemorragia intracraneana o un nuevo sangrado severo tanto en pacientes tratados como no tratados.
Otros factores que mostraron una importante asociación con el aumento del riesgo de sangrado mayor en ambos grupos de estudio fueron los antecedentes de sangrado gástrico o duodenal, anemia, abuso de alcohol, cáncer (£3 años), enfermedad hepática, insuficiencia renal, e insuficiencia cardíaca.
El riesgo de hemorragia intracraneana en conjunción con el tratamiento con AAS fue menor en las mujeres que en los hombres (HR 0,75, IC 0,62- 0,89). Se observó también la misma tendencia en el grupo que no recibió tratamiento antitrombótico, pero sin significación estadística (HR 0,86, IC 0,71-1,03). El sexo femenino se asoció con un menor riesgo de la variable evaluable ‘cualquier sangrado’ en pacientes tratados con AAS. También se vio una tendencia hacia un menor riesgo de ‘cualquier sangrado’ en mujeres sin tratamiento antitrombótico, pero sin significación estadística.
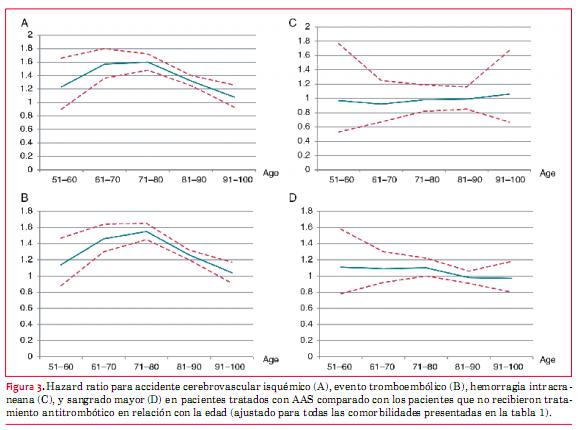
Aun después de los ajustes por cofactores, el riesgo de accidente cerebrovascular isquémico y eventos tromboembólicos pareció ser más alto en los pacientes tratados con AAS comparado con los pacientes sin tratamiento antitrombótico en todos los grupos etarios (figura 3 A y B). No se observó ninguna diferencia significativa para hemorragia intracraneana o sangrado mayor entre los pacientes que recibían y que no recibían tratamiento con AAS (figura 3 C y D).
Pareamiento por puntuación de propensión
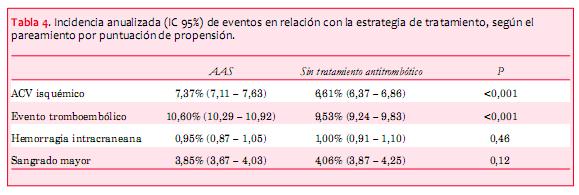
Para hacer los grupos lo más parecidos posibles en lo concerniente a las comorbilidades, calculamos la probabilidad de cada paciente de recibir tratamiento con AAS usando toda la información pertinente disponible. En este pareamiento por puntuación de propensión, se logró parear con éxito a 49.447 pacientes en cada grupo de estudio. Al comparar los individuos pareados en los dos grupos, encontramos que el tratamiento con AAS se acompañó de una mayor incidencia de accidentes cerebrovasculares y eventos tromboembólicos, comparado con la ausencia de tratamiento antitrombótico. No se encontró ninguna asociación entre el tratamiento con AAS y los sangrados intracraneales o los sangrados mayores (tabla 4).
Discusión
En esta población que consiste en 182.678 pacientes con FA, casi un tercio fue tratado con AAS como monoterapia. Según las nuevas recomendaciones de las guías europeas de 2012, ya no se recomienda el AAS como monoterapia para prevención del accidente cerebrovascular en la FA, con excepción de los pacientes que rechazan cualquier forma de anticoagulación oral y que no pueden tolerar una combinación de AAS y clopidogrel.
El tratamiento con AAS no se asoció con menos accidentes cerebrovasculares isquémicos o eventos tromboembólicos que si no se administraba tratamiento profiláctico. Por el contrario, el tratamiento con AAS se asoció con más accidentes cerebrovasculares isquémicos y eventos tromboembólicos que si no se daba ningún tratamiento antitrombótico. Esto se vio para la mayoría de los grupos etarios y franjas de CHA2DS2-VASc. El mayor riesgo con el tratamiento con AAS, comparado con la ausencia de tratamiento, se mantuvo después del ajuste para comorbilidades y pareamiento por puntuación de propensión.
El uso de AAS para profilaxis del accidente cerebrovascular en la FA se fundó en siete estudios controlados con placebo realizados desde 1989 a 2006(3,10-16). De estos, solo uno mostró significación estadística, pero el efecto protector fue modesto(11). Un metaanálisis basado en estos siete ensayos mostró que hubo una reducción del riesgo relativo de 22% (IC 6%-35%) con AAS comparado con placebo(3). Sin embargo, la reducción fundamentalmente se dio en los AIT y accidentes cerebrovasculares menores. Al contar solo los ‘accidentes cerebrovasculares discapacitantes’(10,11,13,14), el efecto protector se redujo a una cifra apenas clínicamente relevante: 13% (IC 18%-36 %). El ensayo más reciente, realizado en 2006, fue terminado precozmente dado que era improbable que el AAS alcanzara la superioridad comparado con la ausencia de tratamiento. El efecto del AAS fue negativo de forma insignificante en cuanto a la muerte cardiovascular, accidente isquémico sintomático, y AIT.
Recientemente se volvieron a analizar los datos provenientes de 12 estudios controlados con placebo en la base de datos de Atrial Fibrillation Investigators con el objetivo de determinar el efecto de la edad sobre la eficacia relativa de los anticoagulantes orales y AAS(4). Este estudio mostró que la eficacia del AAS para la protección contra el accidente cerebrovascular relacionado con la FA disminuyó con la edad y que el efecto protector era nulo a los 75 años y se hacía negativo no significativo por encima de esa edad. Considerando que la media de edad de las poblaciones suecas con FA es de 76 años, si bien nuestros hallazgos pueden parecer provocativos, de hecho están en línea con los hallazgos de los ensayos controlados con placebo que una vez constituyeron la base del tratamiento para una mayoría de pacientes con FA.
No solo parece que el AAS no tendría casi ningún valor como protector del accidente cerebrovascular isquémico, sino que además tiene efectos colaterales en la forma de aumento del riesgo de sangrado. Un metaanálisis ha demostrado una asociación entre el tratamiento con AAS y un aumento de la incidencia de sangrado gastrointestinal, sangrados mayores, y sangrados intracraneanos(17). En este estudio no pudimos confirmar ninguna asociación entre el tratamiento con AAS y un aumento de la incidencia de los eventos con sangrado.
Nuestros resultados sugieren que los pacientes con FA que no son adecuados para la anticoagulación oral pueden beneficiarse más de abstenerse del AAS que de usarlo.
Limitaciones
Los pacientes en nuestro estudio no habían sido distribuidos aleatoriamente a recibir AAS, o a no recibir ningún tratamiento profiláctico. A pesar de nuestros esfuerzos por ajustar los cofactores por medio de un pareamiento por puntuación de propensión y regresión de múltiples variables, reconocemos que es improbable que hayamos logrado ajustar por todo, lo que puede haber afectado el resultado. Sin embargo, nunca se realizará un estudio aleatorizado controlado con placebo que pudiera dar una respuesta sin ambigüedades a esta pregunta tan importante, dada la eficacia probada de los anticoagulantes orales para los pacientes con accidente cerebrovascular relacionado con FA.
El uso de información proveniente de registros tiene sus limitaciones, ya que depende de la exactitud del registro de diagnósticos. Los estudios de validación del registro de pacientes han demostrado que la mayoría de los diagnósticos tienen un alto valor predictivo-positivo(6). No se conoce el grado de subdiagnóstico y sería preciso determinar una pesquisa en la población. Es probable que algunas comorbilidades todavía no hayan recibido un código diagnóstico en los registros. Por lo tanto, los pacientes pueden haber recibido puntuaciones de riesgo más bajas que las que tendrían que haber recibido de haberse conocido todas las circunstancias.
Dado que la edad no es una variable continua en la estratificación de edad, así como en los sistemas de puntuación de riesgo, y como los pacientes tratados con AAS en general son de mayor edad que los pacientes que no reciben tratamiento antitrombótico, es de esperar que los pacientes tratados con AAS sean de mayor edad dentro de cada franja etaria. Por consiguiente, la estratificación etaria y la estratificación según los sistemas de puntuación de riesgo no pueden compensar completamente las diferencias de edad entre las dos estrategias de tratamiento diferentes. Sin embargo, los resultados fueron similares luego de parearlos por la puntuación de propensión en los que la edad se utilizó como una variable continua.
Conclusión
El AAS como monoterapia para la prevención de accidentes cerebrovasculares en la FA no tiene efecto protector discernible contra el accidente cerebrovascular e incluso puede aumentar el riesgo de accidente cerebrovascular isquémico en pacientes añosos. Por lo tanto, nuestros datos respaldan la recomendación de las nuevas guías europeas que señalan que no se debe usar AAS como monoterapia para la prevención de accidentes cerebrovasculares en la FA, a no ser que no haya otra alternativa(20).
Conflicto de interés: ninguno declarado.
Fuentes de financiación
Este trabajo fue apoyado por el Departamento de Salud Pública y Medicina Clínica de la Universidad Umeå y el Departamento de Investigación y Desarrollo, Consejo del Condado de Vasternorrland (LVNFOU216571 a A.S. y LVNFOU260131 a S.S.).
Referencias
1. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991;22:983–8.
2. Cairns JA, Connolly SJ. Non rheumatic atrial fibrillation. Risk of stroke and role of antithrombotic therapy. Circulation 1991;84:469–81.
3. Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have non valvular atrial fibrillation. Ann Intern Med 2007; 146:857–67.
4. van Walraven C, Hart RG, Connolly S, Austin PC, Mant J, Hobbs FD et al. Effect of age on stroke prevention therapy in patients with atrial fibrillation: the atrial fibrillation investigators. Stroke 2009;40:1410–6.
5. Serdén L. Kodningskvalitet i patientregistret—slutenva°rd 2008 (available in Swedish only; Validity of the National Hospital Discharge Registry in Sweden). June 2010. Available online at http://www.socialstyrelsen.se/publikationer2010/2010-6-27.
6. Ludvigsson JF, Andersson E, Ekbom A, Feychting M, Kim JL, Reuterwall C et al. External review and validation of the Swedish national inpatient register. BMC Public Health 2011;11:450.
7. Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the Euro Heart Survey on atrial fibrillation. Chest 2010; 137:263–72.
8. Pisters R, Lane DA, Nieuwlaat R, de Vos CB, Crijns HJ, Lip GY. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest 2010;138:1093–100.
9. Lip GY, Frison L, Halperin JL, Lane DA. Comparative validation of a novel risk score for predicting bleeding risk in anticoagulated patients with atrial fibrillation: the HAS-BLED (Hypertension, Abnormal Renal/Liver Function, Stroke, Bleeding History or Predisposition, Labile INR, Elderly, Drugs/ Alcohol Concomitantly) score. J Am Coll Cardiol 2011;57:173–80.
10. Petersen P, Boysen G, Godtfredsen J, Andersen ED, Andersen B. Placebo-controlled, randomised trial of warfarin and aspirin for prevention of thromboembolic complications in chronic atrial fibrillation. The Copenhagen AFASAK study. Lancet 1989;1:175–9.
11. No authors listed. Stroke prevention in Atrial Fibrillation Study. Final results. Circulation 1991;84: 527–39.
12. EAFT (European Atrial Fibrillation Trial) Study Group. Secondary prevention on non-rheumatic atrial fibrillation after transient ischaemic attack or minor stroke. Lancet 1993;342:1255–62.
13. Diener HC, Lowenthal A. Antiplatelet therapy to prevent stroke: risk of brain hemorrhage and efficacy in atrial fibrillation. J Neurol Sci 1997;153:112.
14. Posada IS, Barriales V. Alternate-day dosing of aspirin in atrial fibrillation. LASAF Pilot Study Group. Am HeartJ 1999;138(Pt 1):137–43.
15. Benavente O, Hart R, Koudstaal P, Laupacis A, McBride R. Antiplatelet therapy for preventing stroke in patients with atrial fibrillation and no previous history of stroke or transient ischemic attacks. Cochrane Database Syst Rev 2000;(2):CD001925.
16. Sato H, Ishikawa K, Kitabatake A, Ogawa S, Maruyama Y, Yokota Y, et al. Low-dose aspirin for prevention of stroke in low-risk patients with atrial fibrillation: Japan atrial fibrillation stroke trial. Stroke 2006;37:447–51.
17. McQuaid KR, Laine L. Systematic review and meta-analysis of adverse events of low-dose aspirin and clopidogrel in randomized controlled trials. Am J Med 2006; 119:624–38.
18. Poli D, Antonucci E, Testa S, Ageno W, Palareti G; on the behalf of FCSA (Italian Federation of Anticoagulation Clinics). Gender differences of bleeding and stroke risk in very old atrial fibrillation patients on VKA treatment: results of the EPICA study on the behalf of FCSA (Italian Federation of Anticoagulation Clinics). Thromb Res 2013; 131: 12–6.
19. Fang MC, Singer DE, Chang Y, Hylek EM, Henault LE, Jensvold NG, et al. Gender differences in the risk of ischemic stroke and peripheral embolism in atrial fibrillation, the AnTicoagulation and Risk factors In Atrial fibrillation (ATRIA) study. Circulation 2005;112:1687–91.
20. Camm AJ, Lip GY, De Caterina R, Savelieva I, Atar D, Hohnloser SH, et al. Focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Europace 2012;14:1385–413.