Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.29 no.2 Montevideo ago. 2014
Actualización en técnicas
Presión aórtica central y parámetros clínicos derivados de la onda del pulso: evaluación no invasiva en la práctica clínica
Importancia clínica y análisis de las bases metodológicas de los equipos disponibles para su evaluación
Dres. Yanina Zócalo1, Daniel Bia2
2. Doctor y Magíster en Ciencias Biológicas. Prof. Adj. Depto. Fisiología. Colaborador Calificado, Depto. Cardiología, Facultad de Medicina, UDELAR. Co-Director/Coordinador General, CUiiDARTE, UDELAR. Investigador Nivel 1, SNI. Investigador Grado 4, PEDECIBA.
Centro Universitario de Investigación, Innovación y Diagnóstico Arterial, UDELAR
Correspondencia: Dra. Yanina Zócalo. Depto. Fisiología, Facultad de Medicina, CUiiDARTE, UDELAR. General Flores 2125, CP: 11800, Montevideo,Uruguay. Correo electrónico: yana@fmed.edu.uy.
Recibido julio 12, 2014; aceptado julio 22, 2014
Presión aórtica central: aspectos básicos, clínicos y epidemiológicos 216
¿Qué es la presión aórtica central (PAC)? 216
¿Por qué difiere con la presión arterial periférica (PAP)? 216
¿Qué importancia clínica tiene evaluar la PAC? 217
PAC y valoración/clasificación de estados hipertensivos 217
PAC y valoración de tratamiento farmacológico 219
PAC, carga ventricular y predicción de riesgo 219
PAC y daño de órgano blanco subclínico 219
Presión aórtica central: aspectos técnicos y metodológicos 219
¿Cómo pueden clasificarse los abordajes y/o sistemas existentes para medir la PAC? 219
Método 1: obtención de PAC a partir de calibración de onda de presión o distensión carotídea 220
Método 2: obtención de PAC a partir de onda de presión periférica y funciones transferencia 221
Método 3: obtención de PAC a partir del análisis de la forma de onda de presión radial 223
Método 4: obtención de PAC a partir del tiempo de tránsito del pulso (intervalo QKD) 223
Método 5: obtención de PAC a partir de ondas periféricas y filtros de media móvil 223
Método 6: obtención de PAC usando presión suprasistólica braquial y ecuación propagatoria 223
Método 7: obtención de PAC mediante reflexiones/rigidez arterial (análisis multivariado) 223
Parámetros derivados de la onda del pulso: aspectos básicos, clínicos y epidemiológicos 224
¿Qué son los parámetros derivados de la onda del pulso (PDOP)? 224
¿Qué importancia clínica tiene evaluar PDOP? 224
¿Qué factores determinan los niveles de los PDOP? 224
¿En qué condiciones pueden encontrarse alterados los niveles de los PDOP? 224
¿Existen tratamientos o recomendaciones que mejoren los niveles de los PDOP? 224
Parámetros derivados de la onda del pulso: aspectos técnicos y metodológicos 224
¿Cómo pueden clasificarse los abordajes y/o sistemas existentes para medir PDOP? 224
Análisis de la forma de onda del pulso (Pulse Wave [Shape] Analysis, PWA) 224
Presión e índice de aumento 225
Índice de viabilidad subendocárdica y amplificación del pulso 226
Separación de ondas mediante análisis de impedancia 226
Índice y magnitud de reflexión 226
Separación de ondas mediante análisis de intensidad de onda 227
Intensidad y energía de onda 227
Presión reservorio y presión exceso 228
Niveles de referencia y normalidad para PAC y PDOP 229
Bibliografía 229

Presión aórtica central: aspectos básicos, clínicos y epidemiológicos
¿Qué es la presión aórtica central (PAC)?
Es la PA existente en la raíz aórtica (para la mayoría de los dispositivos de medición noinvasiva) o en el inicio de la arteria subclavia izquierda. Su medición solo es posible invasivamente, pero su determinación indirecta puede realizarse de forma noinvasiva.
¿Por qué difiere con la presión arterial periférica (PAP)?
La onda de PA generada en el circuito arterial por la eyección ventricular sufre una progresiva distorsión al alejarse del corazón (figura 1-A). En posición decúbito, la PA media (PAM) y la PA diastólica mínima (PAD) varían poco entre arterias centrales y periféricas, mientras que la PA sistólica (PAS) y de pulso (PP) aumentan hacia la periferia (figura 1-A). Este fenómeno (amplificación del pulso) se explica según la teoría clásica(1)por: (1) aumento en rigidez e impedancia local arterial hacia la periferia y (2) existencia de reflexiones que se suman a la onda de PA generada por la eyección (onda incidente), en diferentes momentos y/o con diferentes amplitudes, en arterias centrales y periféricas (figura 1-A). Si bien la teoría de propagación de ondas arteriales, que analiza las mismas como sumatoria de ondas sinusoidales puras que viajan hacia la periferia y viceversa (ondas reflejadas) ha sido la más aceptada para explicar cambios centro-periferia en las ondas del pulso, existen otras teorías (por ejemplo, análisis de intensidad de onda) que los explican mediante otros supuestos(2).
En cada eyección el volumen eyectado comprime la sangre aórticay genera ondas que se propagan por la sangre y pared vascular hacia la periferia (ondas incidentes). A medida que las arterias se hacen más rígidas y presentan mayor impedancia (por ejemplo, menor diámetro), la onda incidente se amplifica, generando una mayor PP en arterias periféricas(1). Además, en sitios con discontinuidades biomecánicas y/o geométricas (por ejemplo, bifurcaciones, arteriolas) se generan ondas reflejadas retrógradas que viajan hacia el corazón y otros lechos arteriales (figura 1-B). Las ondas de PA y flujo medidas son siempre el resultado de la suma de ondas incidentes y reflejadas (figura 1-B). Normalmente, en la raíz aórtica las reflexiones llegan al final de la eyección e inicio de la diástole (figura 1-B), mientras que en arterias periféricas la misma onda reflejada, proveniente de similares sitios, arriba más temprano (en plena sístole) generando aumento de la PAS periférica (figura 1-A).
Las diferencias entre PAC y PAP pueden modificarse en diferentes condiciones. Como ejemplo, al envejecer y en diversas patologías, la rigidez arterial (principalmente de arterias centrales) y/o el nivel de reflexión de ondas aumentan, causando mayores amplitudes de la onda incidente y reflejada, y mayor velocidad de propagación. Así, las ondas reflejadas arriban tempranamente, llegando a la aorta en la sístole del mismo latido, y determinando aumento de PP y PAS aórtica y presión ventricular (figura 1-C). Estos cambios arteriales no se distribuyen de manera homogénea en todas las arterias y no se desarrollan igualmente en todas las personas. Por ello, en un mismo individuo y/o entre individuos las diferencias entre PAC y PAP pueden variar en distintos momentos de su vida. Adicionalmente, las diferencias entre PAC y PAP dependen de factores como la altura, el sexo y el tratamiento farmacológico. Así, resulta evidente que no es posible inferir la PAC a partir de determinar la PAS y/o PAD periféricas debido principalmente a que no se conocería cómo las reflexiones estarían modificando la PAC en esa persona.
¿Qué importancia clínica tiene evaluar la PAC?
Resultados del estudio Conduit Artery Function Evaluation (CAFE) (2006) evidenciaron la necesidad de evaluar no invasivamente la PAC y/o de considerar las diferencias entre PAC y PAP para la adecuada selección de tratamiento, interpretación de resultados y evolución(3). El referido estudio, entre otros, evidenció diferencias en la evolución, asociadas a diferencias significativas en los efectos sobre la PAC (PAS y PP aórtica) de diferentes regímenes antihipertensivos cuyos efectos sobre la reducción de la PAP (humeral) fue similar. Además, se demostró la importancia de evaluar la PAC para el diagnóstico de hipertensión arterial (HTA), evaluación del tratamiento antihipertensivo y/o en la obtención de información pronóstica de pacientes hipertensos (potencial superioridad de la PAC, comparada con la PAP, para este fin). Resumiendo evidencias, la utilidad de la PAC puede dividirse en áreas: 1) PAC y valoración/clasificación de estados hipertensivos; 2) PAC y valoración de tratamiento farmacológico; 3) PAC, carga ventricular y predicción de riesgo, y 4) PAC y daño de órgano blanco.
PAC y valoración/clasificación de estados hipertensivos
Pacientes con valores de PAP óptimos, normales o normales altos, pueden presentar alteraciones en PAC. Considerando solo los valores de PAS se reportó que 32% de hombres y 10% de mujeres con PAS humeral normal se clasificarían como HTA estadio 1 en base a la PAS aórtica equivalente, beneficiándose de tratamiento(4). Considerado el grupo de PA normal alta, los porcentajes suben a 78% en hombres y a 63% en mujeres. Esto sugiere que para valores de PAP no extremos (ni óptimos, ni estadios mayores de HTA), medir la PAC (y no solo PAP) contribuiría a diagnosticar/clasificar más precisamente a sujetos con HTA(4).
Determinar la PAC sería de particular importancia en jóvenes con hipertensión sistólica aislada (HSA). Un aumento del volumen eyectado y/o precoz de rigidez arterial determinarían la HSA en jóvenes, existiendo autores que consideran que la HSA juvenil es una condición benigna (“artificial”) dada por un aumento exagerado de la amplificación aorto-humeral del pulso que determina PAS periférica elevada a pesar de PAC normal(5,6). El estudio HARVEST incluyó a jóvenes con HSA que se compararon con sujetos con HTA sisto-diastólica y con normotensos(7). Los sujetos con HSA se dividieron en dos grupos de acuerdo a si su PAC (en particular su PAS aórtica) estaba por encima o por debajo de la mediana poblacional (120,5 mmHg). Tras 9,5 años de seguimiento se desarrollaron niveles de HTA que requirieron tratamiento en 60% de las personas con HTA sisto-diastólica y en 50% de los sujetos con HSA y elevada PAC. En cambio, en sujetos con HSA y baja PAC el desarrollo de HTA que requirió tratamiento fue similar al de los normotensos (15,1% y 14,7%, respectivamente)(7).
En este contexto, la importancia clínica de conocer la PAC estaría sustentada por su capacidad para contribuir en identificar (diagnósticar) y/o caracterizar a pacientes con HTA o con mayor riesgo de desarrollarla(8), pudiendo repercutir directamente en el desarrollo de adecuadas estrategias de prevención/tratamiento.
PAC y valoración de tratamiento farmacológico
La falta de reducción de la PAC determinaría el elevado riesgo cardiovascular residual de pacientes con HTA, habiéndose propuesto determinar la PAC (además de la PAP) para evaluar debidamente el tratamiento antihipertensivo(8). A pesar de efectos similares sobre la PAP, algunos fármacos (por ejemplo, atenolol) determinarían menor caída de PAS y PP aórticas (comparados con otros antihipertensivos, por ejemplo, amlodipina), explicando esto su inferioridad en la prevención de accidentes cerebrovasculares y regresión de hipertrofia ventricular(3,9-11). Los efectos sobre la PAC de los diferentes tratamientos antihipertensivos (y las diferencias entre tratamientos) dependerían de sus acciones sobre la amplitud y el tiempo de arribo de ondas reflejadas, siendo los mecanismos involucrados dependientes del fármaco y tratamiento (corto vs largo plazo)(1,12).
La medición de la PAC contribuiría a la selección y evaluación del tratamiento así como a la comprensión de los fenómenos hemodinámicos que presenta el paciente(8).
PAC, carga ventricular y predicción de riesgo
La PAC podría ser predictora de eventos cardiovasculares, mortalidad cardiovascular y no cardiovascular(13-15), y sería mejor estimador de carga hemodinámica ventricular, circulación coronaria y cerebral, en comparación con la PAP (por estar la aorta más cerca del corazón y cerebro) (figura 1-C). Sin embargo, a pesar de que las bases fisiológicas lo apoyan, y de estudios que lo han demostrado(15,16), no existe consenso y aún se discute el valor pronóstico adicional y/o mayor obtenido con la PAC(17,18).
PAC y daño de órgano blanco subclínico
Existe asociación entre PAC y marcadores de daño de órgano blanco. La PAC ha mostrado asociación (mayor que la PAP) con la masa, hipertrofia y geometría concéntrica ventricular izquierda, función diastólica ventricular, espesor íntima-media carotídeo, filtrado glomerular y con el grado de aterosclerosis coronaria(19-21). La PP aórtica, comparada con la PAS y PP periférica, sería mejor predictor de presencia y grado de aterosclerosis coronaria(21).
Presión aórtica central: aspectos técnicos y metodológicos
¿Cómo pueden clasificarse los abordajes y/o sistemas existentes para medir la PAC?
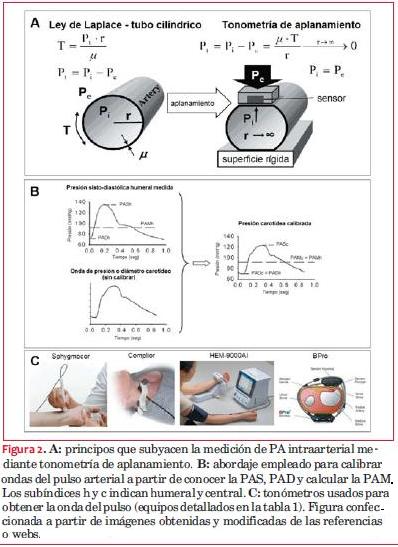
Los equipos para determinar no invasivamente la PAC emplean diferentes mecanismos (tabla 1): 1) Técnicas de medición (por ejemplo, tonometría de aplanamiento, ultrasonido). 2) Señales biológicas (por ejemplo, ondas de PA, de distensión arterial). 3) Análisis físico-matemáticos de señales (por ejemplo, dominio frecuencial vs temporal).4) Condiciones de registro (por ejemplo, consultorio vs ambulatoria). 5) Tiempo de registro: medición puntual vs largos períodos (tabla 1). Existen equipos que permiten obtener una forma de onda calibrada de PA central (por ejemplo, SphygmoCor), mientras que otros solo permiten cuantificar PAS aórtica sin obtener una onda temporal (por ejemplo, HEM9000AI) (tabla 1). Los abordajes más empleados para determinar la PAC son (tabla 1):
1. Recalibración de onda de PA carotídea (por ejemplo, Sphygmocor) o de distensión carotídea (por ejemplo, ProSound/Alpha-7).
2. Calibración de onda de PA periférica y empleo de funciones transferencia (por ejemplo, Mobil-O-graph, SphygmoCor).
3. Análisis de la forma de onda de PA radial (por ejemplo, HEM9000AI).
4. Determinación del tiempo de tránsito del pulso (intervalo QKD) (por ejemplo, Diasys Integra II).
5. Filtrado de señales del pulso arterial periférico mediante “filtros de media móvil” (por ejemplo, BPro+APulse).
6. Medición de señal de presión suprasistólica braquial y empleo de modelos propagatorios (por ejemplo, Arteriograph).
7. Ecuaciones multivariadas con índices de reflexión y rigidez arterial obtenidos por oscilometría humeral.
Método 1: obtención de PAC a partir de calibración de onda de presión o distensión carotídea
Se basan en obtener ondas carotídeas de PA o de distensión (diámetro) que en forma son prácticamente idénticas a la onda de PA aórtica. El método que “recalibra ondas de PA carotídeas” obtenidas por tonometría de aplanamiento (TA) fue propuesto por Kelly y colaboradores(22) basados en que (1) el registro por TA permite reconstruir adecuadamente la onda de presión intraarterial, (2) la forma de onda de PA carotídea y aórtica pueden considerarse idénticas(1,22), y (3) es posible calibrar la onda de PA carotídea usando valores de PAP obtenidos por esfigmomanometría convencional(1). Este abordaje lo emplean diversos equipos (por ejemplo, Sphygmocor, Complior) (tabla 1). El método que “recalibra ondas de distensión carotídeas” se basa en que la onda de diámetro y de PA de un segmento arterial son prácticamente idénticas y que pueden ser calibradas (usando modelos lineales o no lineales si se conoce la PAP periférica(23)). La onda de diámetro (y no solo sus valores máximos y mínimos) suele obtenerse mediante ultrasonido y el análisis directo de la señal (radiofrecuencia) o el procesamiento de imágenes adquiridas en modos B o M por softwares específicos. Ambos abordajes son adecuados, pero los primeros tienen una precisión 6 a 10 veces mayor(24). Este abordaje lo emplea el sistema Pro Sound/Alpha-7 (tabla 1).
Describiremos los principales aspectos de la TA y el abordaje de calibración de ondas del pulso más empleado.
Tonometría de aplanamiento: registro de la onda del pulso de presión arterial
Los tonómetros son sensores de presión direccionales que miden la presión de manera perpendicular a una superficie plana (o que ellos aplanan), razón que da nombre a la técnica. La ley de Laplace describe la relación entre la tensión parietal (T), presión transmural (PTM) y el radio de un tubo de pared fina. Cuando el tonómetro aplica una presión externa (Pe) aplanando el tubo, el radio de la curvatura parietal se hace “infinito” y la Pe es idéntica a la presión interna (Pi), siendo la presión registrada reflejo de la Pi (figura 2-A)(25). Para cumplirse esto: 1) la superficie aplanada debe cubrir totalmente el sensor, 2) la arteria debe ser superficial y debe “fijarse” en un tejido duro para ser correctamente aplanada y 3) el sensor no debe moverse al registrar(25). Lamentablemente, la TA permite “acercarse” a la presión intraarterial, pero no obtener su valor exacto por no cumplirse cabalmente con las condiciones descritas (por ejemplo, existe interposición de tejidos entre piel y arteria)(1). Sin embargo, la TA permite adecuadamente registrar la forma de onda del pulso(22,26). Por ello, más que medir directamente la PA, la técnica permite reconstruir la onda de PA, que luego se calibra.
Los tonómetros “arteriales” pueden dividirse en: (1) simples o únicos o (2) en arreglo o en conjunto (figura 2-C). Los primeros, manipulados por el operador, permiten registrar en diferentes arterias, siendo el registro operador-dependiente. Entre ellos están el “tipo lápiz” (por ejemplo, SphygmoCor) y el fijado con “pinzas” (por ejemplo, primer modelo, Complior) (figura 2-C). Los segundos incluyen sistemas servo-controlados de nivel de compresión y varios sensores apoyados en la zona de interés. El equipo selecciona para cada medición puntual el registro del sensor que obtiene la onda de mayor amplitud y reproducibilidad. Entre estos están el HEM-9000AI (sensores en un arco en el que se introduce la muñeca) y el BPro (sensores en “muñequera” portable) (figura 2-C).
Calibración de ondas del pulso: equiparación de presión diastólica mínima y presión arterial media
El abordaje más usado asume que en una persona en decúbito dorsal horizontal la PAD y PAM son iguales en todas las arterias. Así, y considerando como ejemplo ondas obtenidas por TA (registros en milivoltios, mV), al nivel medio (integral del área) y al mínimo de la onda registrada se le asigna, respectivamente, el valor (mmHg) de PAM calculado y de PAD medido en la arteria humeral por esfigmomanometría convencional. El valor de PAS que se adjudica a la onda medida resulta de la ecuación (lineal o no lineal) que relaciona mV y mmHg(1) (figura 2-B). Para minimizar errores se debería calcular la PAM como PAD+(0,4*PP) en vez de PAD+(0,3*PP).
Método 2: obtención de PAC a partir de onda de presión periférica y funciones transferencia
Se basa en obtener matemáticamente la onda de PA aórtica a partir del registro y calibración (método descrito) de la onda del pulso periférico (por ejemplo, humeral, radial, carotídea). Este abordaje lo emplean múltiples equipos que registran el pulso periférico por (tabla 1): 1) TA arterial radial (por ejemplo, Sphygmocor; HEM-9000AI); 2) oscilometría braquial tradicional o modificaciones que convierten los manguitos en sensores pletismográficos (por ejemplo, Mobil-O-Graph; BPLab+Vasotens) para obtener ondas de PA o volumen humerales; 3) medición suprasistólica o flujo cero (por ejemplo, Arteriograph, BPPlus) para obtener ondas de PAP, y 4) fotopletismografía (y otras técnicas) para registro de ondas del pulso digitales. A partir de la onda periférica, independientemente del tipo de registro, los sistemas obtienen la onda de PA aórtica usando funciones transferencia generalizadas (FTG), principalmente basadas en análisis en el dominio frecuencial.
Bases teóricas: función transferencia generalizada (dominio frecuencial)
A partir de la introducción de los conceptos generales (en los años 50), de ser propuestas para uso clínico(28), y de demostrarse su validez en diferentes condiciones (por ejemplo, cambios hemodinámicos agudos)(26), diferentes sistemas aplican FTG para determinar la forma de onda y niveles de PA aórtica (tabla 1).
Las FTG aplicadas para determinar la PAC se basan en el análisis armónico de una onda. Cada onda de PA (onda compleja) se asume conformada por múltiples ondas sinusoidales básicas (armónicos) de diferente frecuencia y amplitud que se suman con un desfase específico entre ellas para formar la onda de PA medida (figura 3-A). El primer armónico tendría una frecuencia igual a la fundamental, es decir, a la frecuencia cardíaca (FC) o frecuencia de la onda medida (por ejemplo,1 Hz, si FC=60 cpm, o 1,66 Hz si FC= 100 cpm, como en la figura). Los siguientes armónicos son múltiplos del fundamental (por ejemplo, 2 Hz, 3 Hz, etcétera, para FC=60 cpm, o 3,33 Hz, 5,0 Hz, etcétera, para FC=100 cpm). Así, se puede descomponer la onda en armónicos, o conociendo los armónicos reconstruir la onda medida. Para ello se debe conocer amplitud, frecuencia y tiempo en que debe sumarse cada armónico (desfases entre ellos) (figura 3-A)(1,25).
Mucho se discute aún acerca de las limitaciones del uso de FTG, métodos de registro, y el potencial valor de funciones transferencias individualizadas (FTI) como forma de obtener resultados más precisos.
Método 3: obtención de PAC a partir del análisis de la forma de onda de presión radial
Se basa en la observación empírica de que el valor de PA en el segundo pico (hombro) sistólico de la onda radial (rSBP2 o PASr_2), llamado “pico reflejado” por deberse al arribo de ondas de baja frecuencia reflejadas en la bifurcación aórtica, es prácticamente idéntico o correlaciona estrechamente con la PAS aórtica(25) (figura 3-C). Registrada la onda radial por TA, el rSBP2 se determina derivando la señal en el tiempo y detectando el tercer cruce del cero de la cuarta derivada de la onda radial. Este método solo cuantifica la PAS y PP aórtica, no permitiendo obtener la forma de onda aórtica y los parámetros derivados de ella. Este abordaje lo utiliza el equipo HEM-9000AI y es empleado secundariamente por otros sistemas (por ejemplo, Sphygmocor) (tabla 1). Basados en la similitud entre la onda de PA registrada en un dedo de la mano y en la arteria radial se propuso emplear un índice similar al descrito a partir del registro (no invasivo) y análisis del pulso digital(28).
Método 4: obtención de PAC a partir del tiempo de tránsito del pulso (intervalo QKD)
El tiempo de tránsito del pulso aorto-humeral, definido como la diferencia de tiempo entre la onda R del QRS (electrodo torácico de superficie) y el cuarto ruido de Korotkoff (sensor en brazalete para toma de PA) (figura 3-D), denominado QKD, fue propuesto como indicador de rigidez arterial (sistema Diasys Integra II) (tabla 1)(29). Recientemente se ha propuesto el QKD como base para cuantificar la PAS aórtica(30) a partir de una ecuación multivariada: PAS aórtica=105+(1,29*PAM braquial)– (0,39*FC)–(0,30*altura del sujeto)–(0,11*QKD), siendo la PAM braquial cuantificada con métodos no invasivos (PAM=PAD+(0,4*PP)(30). Últimamente los autores manifestaron que los coeficentes de esta ecuación fueron levemente modificados, no habiéndose detallado los cambios. Este abordaje es empleado por el sistema Diasys Integra II (tabla 1).
Método 5: obtención de PAC a partir de ondas periféricas y filtros de media móvil
Se basa en obtener una onda de PA periférica, y, tras calibrarla, aplicarle filtros pasabajo de tipo “media móvil” (de “n” puntos) para “alisar o suavizar” la onda tras eliminar sus componentes de mayor frecuencia, principales responsables de cambios abruptos en las ondas y asociados a ondas reflejadas(31) (figura 3-E). A partir de la onda medida, la nueva señal (onda) temporal que el filtro genera está formada por puntos (medias móviles), que resultan del promedio de “n” puntos de la señal original, siendo el nuevo valor máximo obtenido considerado representativo de la PAS aórtica. Los “n” puntos a promediar de la señal (onda) original dependen de la frecuencia de muestreo del sistema de adquisición y del sitio de registro(31,32) (por ejemplo, ondas obtenidas por TA radial y humeral, n=frecuencia de muestreo/4 y n/frecuencia de muestreo/6, respectivamente) (figura 3-E). Este método lo usa el sistema BPro a partir del registro de la onda radial por TA (tabla 1) y se ha comenzado a introducir para determinar PAS aórtica tras analizar la onda de PA braquial obtenida por oscilometría.
Método 6: obtención de PAC usando presión suprasistólica braquial y ecuación propagatoria
Usado por el sistema BPPlus (tabla 1), calcula la PA aórtica al inicio de la arteria subclavia izquierda mediante la técnica de “presión suprasistólica o flujo cero” arterial humeral, y teorías de propagación de ondas(33,34). En nuevos modelos estos sistemas registran la señal electrocardiográfica para emplear el QRS en el cálculo del tiempo de tránsito de los componentes de la onda del pulso. Tras determinar la PAS y PAD braquial, el manguito se infla por 10 segundos, 30 mmHg sobre la PAS registrada como forma de registrar pequeñas fluctuaciones producidas por las oscilaciones de PA intraarterial. El registro muestra tres ondas: 1) incidente (SS1; eyección ventricular); 2) reflejada “sistólica” (SS2; desde aorta abdominal), y 3) reflejada “diastólica”(SS3; proveniente de la circulación periférica) (figura 3-F).Registrar estas ondas temporales de presión braquial (Pt2; presión “al final del tubo”) y el cálculo del coeficiente de refexión (a) y del tiempo de propagación (dt) permiten cuantificar la PAC (Pt0, presión aórtica o “a la entrada del tubo”)(34):
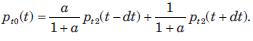
Método 7: obtención de PAC mediante reflexiones/rigidez arterial (análisis multivariado)
Determina la PAS aórtica usando un modelo predictivo multivariado basado en información proveniente del análisis de la onda del pulso humeral (oscilometría)(35,36). De la onda, utiliza información de: a) el segundo pico sistólico humeral (indica la intensidad de reflexiones); b) la presión diastólica inicial, y c) las áreas de la fase sistólica y diastólica de la onda del pulso (indicadores de rigidez arterial)(35,36).
Parámetros derivados de la onda del pulso: aspectos básicos, clínicos y epidemiológicos
Son parámetros derivados del análisis de la forma de onda del pulso arterial que describen el estado funcional del sistema arterial y caracterizan componentes de la poscarga ventricular. Existen tres principales abordajes teórico-prácticos que permiten determinar PDOP: 1) análisis de la forma de onda del pulso, 2) separación de ondas mediante análisis de impedancia y 3) separación de ondas mediante análisis de intensidad de onda.
¿Qué importancia clínica tiene evaluar PDOP?
Permite caracterizar fenómenos hemodinámicos, principalmente relacionados con la poscarga ventricular, las reflexiones de onda y el funcionamiento del sistema arterial, que no pueden evaluarse a partir de conocer únicamente el valor de PAS y/o PAD central y/o periférica.Entre los PDOP, el índice de aumento (AI) central (cAI) es el más estudiado/empleado. El cAI ha mostrado ser predictor independiente de: 1) riesgo cardiovascular, 2) enfermedad coronaria, 3) eventos cardiovasculares, 4) mortalidad cardiovascular o de cualquier causa(1) y 5) tolerancia al ejercicio (por ejemplo, pacientes con enfermedad coronaria)(37). Además, el cAI se relaciona a regresión de hipertrofia ventricular asociada a tratamientos antihipertensivos(38).
Otros parámetros, como la presión de aumento aórtica, la amplificación centro-periférica del pulso, el índice de viabilidad subendocárdica y más recientemente la “presión de exceso”, son predictores independientes de riesgo, de eventos cardiovasculares y/o mortalidad, aunque menos investigados/empleados que el cAI(1,39).
¿Qué factores determinan los niveles de los PDOP?
La forma de onda del pulso de PA aórtica o periférica y, por tanto, los PDOP, presentan determinantes hemodinámicos (por ejemplo, FC, PA, rigidez arterial, coeficentes de reflexión), y no hemodinámicos (por ejemplo, altura corporal). Al cuantificar PDOP es frecuente normalizarlos por estos determinantes (por ejemplo, cAI normalizado por FC).
¿En qué condiciones pueden encontrarse alterados los niveles de los PDOP?
Tras normalizar los niveles de PDOP por sus determinantes hemodinámicos, sus valores pueden estar alterados en toda aquella situación que asocie cambios en rigidez arterial y/o nivel de reflexión de ondas(1).
¿Existen tratamientos o recomendaciones que mejoren los niveles de los PDOP?
Sí. La modulación no farmacológica y farmacológica de los niveles de PA, de rigidez arterial y/o de los niveles de los coeficientes de reflexión periféricos han mostrado modificar beneficiosamente los PDOP, y estos cambios han asociado mejorías clínicas y pronósticas de los pacientes(1,38).
Parámetros derivados de la onda del pulso: aspectos técnicos y metodológicos
¿Cómo pueden clasificarse los abordajes y/o sistemas existentes para medir PDOP?
Se aplica para cuantificar PDOP todo lo descrito para determinar la onda y niveles de PAC en cuanto a técnicas de medición, señales medidas, análisis físico-matemáticos, etcétera (tabla 1).
Existen dos diferentes abordajes de análisis de la onda del pulso, empleados por sistemas comerciales, para cuantificar PDOP. El primero, considerado el “estándar oro” y más complejo teórica y técnicamente, requiere el registro simultáneo de ondas de PA y flujo (o velocidad) sanguíneo en un segmento arterial, para luego analizarlas (“análisis de separación de ondas”) y evaluar las reflexiones a partir de descomponer las ondas en suscomponentes “anterógrado” (incidente) y “retrógrado”. El “análisis de separación de ondas” puede hacerse en el dominio de la frecuencia (“análisis de impedancia”)(1) o del tiempo (“análisis de intensidad de onda”, AIO, en inglés Wave IntensityAnalisys, WIA)(2). El segundo, desarrollado para simplificar técnica y teóricamente el análisis, se basa en el análisis en el dominio del tiempo de la onda de PA, denominándose “análisis de forma de onda del pulso” (en inglés, Pulse Wave [Shape] Analysis, PWA)(1).
Análisis de la forma de onda del pulso (Pulse Wave [Shape] Analysis, PWA)
Permite cuantificar dos PDOP principales, la “presión de aumento” (en inglés, Augmented Pressure, AP) y el “índice de aumento” (AI), y otros parámetros adicionales. Puede aplicarse a cualquier onda de PA, medida o calculada.
Presión e índice de aumento
El arribo de una onda reflejada a la aorta ascendente puede ocurrir antes o después de que se alcance el máximo pico sistólico y determina al arribar una inflexión (pico adicional) en la onda de PA aórtica. Estos dos picos, identificables en la onda de PA aórtica (o periférica), se denominan P1 y P2, según el orden de aparición (figura 4-A). La “AP” evalúa la contribución neta (en mmHg) de la onda reflejada a la onda de PA medida, y se calcula como P2-P1 (figura 4-A). El “AI” (cAI en arterias centrales) evalúa la contribución relativa (%) de la onda reflejada a la onda de PA medida, y se calcula como AP/PP*100 (u ocasionalmente como P2/P1*100) (figura 4-A). Presión e índice de aumento pueden tener valores continuos entre un extremo de valores negativos (niños, ondas “C”) y un extremo de valores altamente positivos (ancianos, ondas “A”). Ambos parámetros pueden obtenerse de arterias centrales (por ejemplo, aorta, Sphygmocor; carótida, Complior) o periféricas (por ejemplo, radiales, HEM-9000AI; humerales, Arteriograph) (tabla 1). Estos últimos no reflejan directamente a los cuantificados en arterias centrales, siendo por ello menos empleados.
En adultos, como ejemplo, la AP y el cAI aumentan al reducirse la FC, y viceversa, dado que a menor FC la eyección se prolonga, aumentando la probabilidad de que las reflexiones arriben en sístole (figura 4-B, arriba)(40). Además, al elevarse la FC aumenta la amplificación centro-periférica del pulso por reducción de la PAS central (por el mecanismo descrito) y porque la onda pasa a estar conformada por armónicos de mayores frecuencias que son los más amplificados al propagarse (figura 3-C, ganancias). Además, a menor estatura, menor distancia entre la aorta y los sitios de reflexión, y consecuentemente mayor probabilidad de que las reflexiones arriben en sístole(1). Esto explica los relativamente elevados cAI existentes en niños muy pequeños (por ejemplo, menores 5 años), y en mujeres respecto de hombres (poblacionalmente los hombres tienen mayor estatura)(1). Elevaciones de la velocidad de propagación de la onda del pulso (rigidez arterial) debidas a elevación de la PA y/o de la rigidez intrínseca parietal (por ejemplo, envejecimiento, aterosclerosis), determinan aumento de AP y cAI(1) (figura 4-B, abajo). El aumento de resistencias vasculares periféricas incrementa la PA y eleva el coeficiente de reflexión periférico, determinando mayor amplitud y velocidad de propagación de ondas y mayor probabilidad de arribo de reflexiones en sístole. Por esto es que los PDOP se expresan frecuentemente como valores normalizados por sus determinantes (por ejemplo, cAI@75, expresado para FC=75 cpm).
Índice de viabilidad subendocárdica y amplificación del pulso
El índice de viabilidad subendocárdica o “de Buckberger” (Sub-endocardical viability ratio, SEVR)(1) es un PDOP basado en el sincronismo existente entre las ondas de PA aórtica y de presión ventricular izquierda. Es el cociente entre el área de la fase diastólica y sistólica de la onda de PAC, sin necesidad de calibrar estas últimas (figura 4-C). El SEVR describe la relación entre oferta (en términos de PA diastólica media, cabeza de perfusión coronaria) y demanda (en términos de niveles de PA sistólicos medios, determinantes de la poscarga ventricular) de aportes nutricios/respiratorios al músculo cardíaco. Arribos tempranos de ondas reflejadas y/o elevada rigidez arterial elevan las áreas sistólicas y reducen las diastólicas, reduciendo el SEVR. Por otra parte, en caso de sistemas que permiten obtener ondas del pulso periféricas (calibradas) y de PA centrales, es posible cuantificar la amplificación centro-periférica del pulso como PP periférica/PP central.
Diversos equipos (por ejemplo, Sphygmocor, Complior, Mobil-O-Graph) permiten calcular los PDOP descritos (tabla 1).
Separación de ondas mediante análisis de impedancia
Propuesto por N. Westerhof (1972), analiza las formas de onda de presión y flujo en el dominio frecuencial mediante análisis armónico de Fourier(41). Numerosas modificaciones del método original han sido propuestas, existiendo hoy día múltiples formas de realizarse este análisis. Fundamentalmente se basa en descomponer las ondas medidas de presión y velocidad sanguínea (o flujo) en una onda “incidente o anterógrada” y una “onda retrógrafa o reflejada”(figura 4-D). Para ello, requiere conocer el valor de impedancia característica (Zc) arterial; pudiéndose calcular de diversas formas (por ejemplo, “dominio temporal”: relación entre cambio de presión y flujo en la sístole temprana; “dominio frecuencial”: promedio de amplitudes (en el diagrama de impedancias) para armónicos de elevadas frecuencias(1). Un método alternativo implica descomponer la onda de presión y de flujo en sus armónicos constituyentes, y a la vez cada uno de estos en su componente anterógrado y retrógrado, para seguidamente cuantificar Zc a partir de relacionar los componentes anterógrados (o retrógrados) de cada armónico de presión y de flujo. Habiendo descompuesto las ondas de presión y de flujo en sus armónicos, y estos en sus componentes anterógrados y retrógrados, posteriormente es posible reconstruir la onda anterógrada y retrógrada general, sumando los armónicos anterógrados por un lado y los componentes retrógrados por otro.
Índice y magnitud de reflexión
Tras descomponer las ondas, la amplitud de las ondas incidente y reflejada, sus tiempos de arribo, etcétera, son de relevancia experimental y clínica. Adicionalmente, el nivel (grado) de reflexión de ondas puede cuantificarse como: a) “índice de reflexión” (RI): relación de amplitudes de la onda retógrada y la suma de onda retrógrada y anterógrada, y b) “magnitud de reflexión”: relación de amplitudes entre onda retrógrada (AOR) y anterógrada o incidente (AOI) (figura 4-D).
Un abordaje alternativo, que utiliza parcialmente la separación de ondas por análisis de impedancia, implica descomponer la onda de PA aórtica en su componente anterógrado y retrógrado a partir de asumir (¡no medir!): (1) forma de onda “triangular”del flujo y (2) determinada sincronía entre la onda de flujo asumida y la onda de PA obtenida (por ejemplo, base del triángulo ocupa toda la fase sistólica y pico coincide con pico sistólico provocado por arribo de reflexiones de onda(42)) (figura 4-D). Así, la descomposición de la onda de PA aórtica se obtiene siguiendo el análisis de impedancia, de manera de cuantificar el componente anterógrado (“forward”, f) y retrógrado (“backward”) de la onda de presión: Pf(t)=[Pm(t)+ZcF(t)]/2, Pb(t)=[Pm(t)-ZcF(t)]/2, siendo Pm(t) la presión medida en función del tiempo, F(t) el flujo triangular en función del tiempo, y siendo Zc (impedancia característica) obtenida como la relación presión/flujo al inicio de la eyección. Basados en la misma suposición, se ha propuesto determinar la velocidad de onda del pulso aórtica (rigidez arterial) a partir del retardo temporal entre la onda incidente y reflejada obtenidas por este análisis(43).
Abordajes como los descritos se incluyen en el sistema SphygmoCor (versión 8.2 y y 9.0), el cual descompone la onda aórtica obtenida a partir de la aplicación de una FTG al registro tonométrico de la arteria radial, o en el sistema Mobil-O-Graph, el cual, tras registrar la forma de onda humeral (esfigmomanometría), calibrarla y obtener la forma de onda aórtica (aplicación de una FTG), determina la presión de aumento, el cAIy cAI@75 (mediante análisis de forma de onda), la amplitud de la onda de presión anterógrada o incidente y de la retrógrada o reflejada (tras realizar separación de ondas), la magnitud de reflexión (%) y la velocidad de onda del pulso aórtica(44) (tabla 1).
Separación de ondas mediante análisis de intensidad de onda
Intensidad y energía de onda
Parker y Jones propusieron una alternativa para describir las ondas y su propagación por el sistema arterial basada en el “análisis de intensidad de onda” (AIO)(45). El AIO descompone las ondas de presión (P) y velocidad sanguínea (U) en infinitésimos frentes de onda sucesivos, y no como sumatorias de trenes de ondas sinusoidales, permitiendo el análisis del pulso en el dominio del tiempo (figura 5-A). La “intensidad de onda” (dI, W/m2) se define como el producto instantáneo de la variación en presión (dP) y en velocidad del flujo (dU) del frente de onda en función del tiempo: dI=dP*dU, y representa el flujo de energía por unidad de área transportado por la onda al propagarse.
La diferencia de intensidad es positiva y negativa para frentes de onda anterógrados y retrógrados, respectivamente, y en función de ser el dP>0 o dP<0, se describen ondas de compresión y descompresión (inicialmente llamadas de “expansión”), respectivamente. Si existen simultáneamente ondas anterógradas y retrógradas, la dI resultante es la suma algebraica de la intensidad de cada frente de onda que se intersecta en el sitio de medición, siendo el signo “neto” del dI indicador del frente dominante(45). En el AIO, el tiempo de arribo y la magnitud de la onda están dados por el inicio y magnitud del pico cuando la dI se representa en función del tiempo (t) (figura 5-B). Adicionalmente, ha demostrado ser útil para caracterizar una onda, cuantificar su integral (promedio temporal), como forma de que ondas de menor amplitud (más débiles) pero de mayor duración puedan ser valoradas e incluso consideradas. En estos casos, la “energía de la onda” (I; J/m2) representa una cantidad asociada al flujo de energía transportado por la onda, siendo generalmente mucho menor que la energía cinética y potencial total asociada a la onda.
Un ejemplo de AIO aplicado a mediciones realizadas en la aorta humana se muestra en la figura 5-B. El primer pico de dI (W1) corresponde a la compresión inicial (o aceleración) de frente de onda causada por la contracción ventricular, siendo este pico asociado al nivel de contractilidad ventricular(46). A mediados de la sístole hay un pequeño pico negativo que indica una reflexión dominante del frente de onda inicial provocado por la contracción. Esto es seguido por un segundo pico positivo que indica un frente de onda dominante hacia adelante al final de la sístole (W2), que por estar la presión y velocidad cayendo, representaría una “descompresión y desaceleración” de onda generada por la relajación ventricular (figura 5-B).
Por otra parte, conociendo la velocidad de propagación del pulso, la cual puede cuantificarse a partir de las señales de presión y velocidad de flujo por diferentes métodos (por ejemplo, método del UP-loop) y sumando separadamente los frentes de onda anterógrados y los frentes retrógrados, es posible descomponer las ondas medidas en su principal componente anterógrado y retrógrado, alcanzándose resultados similares a los brindados por el análisis de impedancia(47) (figura 4-D).
Recientemente se ha confirmado la utilidad clínica del AIO tanto por sus aspectos cuantitativos como cualitativos(46). El sistema ProSound/Alpha-7 (tabla 1) determina en un sitio arterial (por ejemplo, carótida) la señal de velocidad sanguínea (Doppler) y diámetro arterial (echo-tracking), y tras calibrar esta última con unidades de PA (mmHg), realiza el AIO y calcula diversos parámetros (por ejemplo, amplitudes y áreas de las ondas del diagrama de intensidades, diferencias temporales entre ondas).
Presión reservorio y presión exceso
La descomposición de ondas medidas en una única onda “anterógrada” y una única “retrógrada” evidenció problemas de la teoría de separación de ondas, sea que se aplique el análisis de impedancias o el AIO. Al respecto, si bien durante la sístole la separación parece razonable con una onda inicial compresiva anterógrada seguida por una onda reflejada-retrógrada, durante la diástole la única manera de explicar la reducción exponencial de la onda de presión mientras la velocidad sanguínea se mantiene cercana a cero, es que existan ondas incidentes y retrógradas simultáneas y de gran amplitud que se suman. Algo que no se evidencia por el AIO y que dio lugar a la actualmente conocida como “hipótesis de la onda-reservorio”(2). Esta hipótesis describe la onda de PA como compuesta por: (1) una onda “reservorio”, similar en cualquier arteria estudiada, generada por la expansión sistólica y retroceso diastólico de arterias elásticas, y relacionada con la complacencia arterial total y las resistencias periféricas, y (2) una onda que varía en función del segmento arterial, que es la diferencia entre la PA medida y la reservorio (figura 4-D). La onda-reservorio describe casi enteramente la caída diastólica de PA, haciendo evidente que a esta caída contribuyen muy poco, o nada, ondas reflejadas, siendo esto a la vez consistente con la baja o nula velocidad sanguínea registrada (figura 4-D). La presión-reservorio representa la “mínima carga o trabajo hidráulico” que el ventrículo debe realizar para proveer la onda de flujo en función de la carga arterial neta de esa persona. La “presión de exceso” representa el trabajo adicional, sobre el mínimo, que realiza el ventrículo o que se genera en cada segmento arterial. El concepto de “exceso” surge de la acústica, en la que la presión dada por ondas acústicas se define como “exceso” sobre la presión ambiente. Recientemente se evidenció que la integral de la presión de exceso de un período cardíaco es un potente indicador de eventos cardiovasculares (por ejemplo, stroke), a la vez que sus niveles permiten predecir el resultado de tratamientos farmacológicos(39).
Niveles de referencia y normalidad para PAC y PDOP
Si bien no se detallan, diversos grupos han trabajado para determinar niveles de referencia en función de sus particulares formas de medición de PAC y/o PDOP. En nuestro país, en CUiiDARTE, se han determinado valores de normalidad/referencia para población adulta y se encuentra en marcha el programa/proyecto para la generación de valores de referencia/normalidad para la población pediátrica.
Bibliografía
1. Nichols WW, O’Rourke MF, eds. McDonald’s blood flow in arteries: theoretical, experimental and clinical principles. 5th ed. London: Hodder Arnold; 2005.
2. Parker KH. An introduction to wave intensity analysis. Med Biol Eng Comput 2009;47(2):175-88.
3. Williams B, Lacy P, Thom S, Cruickshank K, Stanton A, Collier D, et al. Differential impact of blood pressure-lowering drugs on central aortic pressure and clinical outcomes: principal results of the Conduit Artery Function Evaluation (CAFE) study. Circulation 2006;113(9):1213-25.
4. Vergnaud A, Protogerou A, Blacher J, Safar M. From «optimal» to «borderline» blood pressure in subjects under chronic antihypertensive therapy. J Hypertens 2008;26(1):138-44.
5. McEniery CM, Yasmin, Wallace S, Maki-Petaja K, McDonnell B, Sharman J, et al. Increased stroke volume and aortic stiffness contribute to isolated systolic hypertension in young adults. Hypertension 2005;46(1):221-6.
6. O’Rourke M, Vjachopoulos C, Graham R. Spurious systolic hypertension in youth. Vasc Med 2000;5(3):141-5.
7. Hulsen H, Nijdam M, Bos W, Uiterwaal C, Oren A, Grobbee D, et al. Spurious systolic hypertension in young adults; prevalence of high brachial systolic blood pressure and low central pressure and its determinants. J Hypertens 2006;24(6):1027-32.
8. Saladini F, Santonastaso M, Mos L, Benetti E, Zanatta N, Maraglino G, et al. Isolated systolic hypertension of young-to-middle-age individuals implies a relatively low risk of developing hypertension needing treatment when central blood pressure is low. J Hypertens 2011;29(7):1311-9.
9. Safar M, Bjacher J, Protogerou A, Achimastos A. Arterial stiffness and central hemodynamics in treated hypertensive subjects according to brachial blood pressure classification. J Hypertens 2008; 26(1):130-7.
10. Boutouyrie P, Achouba A, Trunet P, Laurent S. Amlodipine-valsartan combination decreases central systolic blood pressure more effectively than the amlodipine-atenolol combination: the EXPLOR Study. Hypertension 2010;55(6):1314-22.
11. Oliveras A. Central blood pressure measurement. Research or clinical practice? Hipertens Riesgo Vasc 2012;29(1):2-6
12. Dhakam Z, Yasmin, McEniery C, Burton T, Brown M, Wilkinson I. A comparison of atenolol and nebivolol in isolated systolic hypertension. J Hypertens 2008;26(2):351-6.
13. Agabiti-Rosei E, Mancia G, O’Rourke M, Roman M, Safar M, SmulyanN H, et al. Central blood pressure measurements and antihypertensive therapy: a consensus document. Hypertension 2007;50(1):154-60.
14. Patvardhan E, Heffernan K, Ruan J, Hession M, Warner P, Karas R, et al. Augmentation index derived from peripheral arterial tonometry correlates with cardiovascular risk factors. Cardiol Res Pract 2011;2011:253758.
15. Vlachopoulos C, Aznaouridis K, O’Rourke MF, Safar ME, Baou K, Stefanadis C. Prediction of cardiovascular events and all-cause mortality with central haemodynamics: a systematic review and meta-analysis. Eur Heart J. 2010; 31(15): 1865-71.
16. Vlachopoulos C, Aznaouridis K, Stefanadis C. Prediction of cardiovascular events and all-cause mortality with arterial stiffness: a systematic review and meta-analysis. J Am Coll Cardiol 2010; 55(13): 1318-27.
17. Pini R, Cavallini MC, Palmieri V, Marchionni N, Di Bari M, Devereux RB, et al. Central but not brachial blood pressure predicts cardiovascular events in an unselected geriatric population: the ICARe Dicomano Study. J Am Coll Cardiol 2008;51(25):2432-9.
18. Williams B, Lacy P. Central haemodynamics and clinical outcomes: going beyond brachial blood pressure? Eur Heart J 2010;31(15):1819-22.
19. Dart A, Gatzka C, Kingwell B, Willson K, Cameron J, Liang Y, et al. blood pressure but not carotid arterial waveforms predict cardiovascular events in elderly female hypertensives. Hypertension 2006;47(4):785-90.
20. Mitchell G, Hwang S, Vasan R, Larson M, Pencina M, Hamburg N, et al. Arterial stiffness and cardiovascular events: the Framingham Heart Study. Circulation 2010;121(4):505-11.
21. Jankowski P, Kawecka-Jaszcz K, Czarnecka D, Brzozowska-Kiszka M, Styczkiewicz K, Styczkiewicz M, et al. Ascending aortic, but not brachial blood pressure-derived indices are related to coronary atherosclerosis. Atherosclerosis 2004;176 (1): 151-5.
22. Kelly R, Karamanoglu M, Gibbs H, Avolio A, O’Rourke M. Noninvasive carotid pressure wave registration as an indicator of ascending aortic pressure. J Vasc Med Biol 1989; 1:241-7.
23. Kips J, Vanmolkot F, Mahieu D, Vermeersch S, Fabry I, de Hoon J, et al. The use of diameter distension waveforms as an alternative for tonometric pressure to assess carotid blood pressure. Physiol Meas 2010;31(4):543-53.
24. Laurent S, Cockcroft J, Van Bortel L, Boutouyrie P, Giannattasio C, Hayoz D, et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J 2006;27(21):2588-605.
25. Miyashita H. Clinical Assessment of Central Blood Pressure. Curr Hypertens Rev 2012;8(2):80-90.
26. Chen-Huan C, Nevo E, Fetics B, Pak PH, Yin FC, Maughan WL, et al. Estimation of central aortic pressure waveform by mathematical transformation of radial tonometry pressure. Circulation 1997; 95(7): 1827-1836.
27. Karamanoglu M, O’Rourke MF, Avolio AP, Kelly RP. An analysis of the relationship between central aortic and peripheral upper limb pressure waves in man. Eur Heart J 1993; 14(2): 160-167.
28. Munir S, Guilcher A, Kamalesh T, Clapp B, Redwood S, Marber M, et al. Peripheral augmentation index defines the relationship between central and peripheral pulse pressure. Hypertension 2008; 51(1):112-8.
29. Gosse P, Guillo P, Ascher G, Clementy J. Assessment of arterial distensibility by monitoring the timing of Korotkoff sounds. Am J Hypertens 1994;7(3):228–33.
30. Cremer A, Codjo L, Butlin M, Papaioannou G, Yeim S, Jan E, et al. Determination of central blood pressure by a noninvasive method (brachial blood pressure and QKD interval): a noninvasive validation. J Hypertens 2013;31(9):1847-52.
31. Williams B, Lacy PS, Yan P, Hwee CN, Liang C, Ting CM. Development and validation of a novel method to derive central aortic systolic pressure from the radial pressure waveform using an n-point moving average method. J Am Coll Cardiol 2011; 57(8):951-61.
32. Shih YT, Cheng HM, Sung SH, Hu WC, Chen CH. Application of the N-point moving average method for brachial pressure waveform-derived estimation of central aortic systolic pressure. Hypertension 2014; 63(4):865-70.
33. Westerhof BE, Guelen I, Stok WJ, Wesseling KH, Spaan JA, Westerhof N, et al. Arterial pressure transfer characteristics: effects of travel time. Am J Physiol Heart Circ Physiol 2007;292(2): H800-7.
34. Stergiopulos N, Westerhof BE, Westerhof N. Physical basis of pressure transfer from periphery to aorta: a model-based study. Am J Physiol 1998;274(4 Pt 2):H1386-92.
35. Cheng HM, Wang KL, Chen YH, Lin SJ, Chen LC, Sung SH, et al. Estimation of central systolic blood pressure using an oscillometric blood pressure monitor. Hypertens Res 2010 Jun;33(6):592-9.
36. Sung SH, Cheng HM, Chuang SY, Shih YT, Wang KL, Chen YH, et al. Measurement of central systolic blood pressure by pulse volumen plethysmography with a noninvasive blood pressure monitor. Am J Hypertens 2012;25(5):542-8.
37. Kingwell B, Waddell T, Medley T, Cameron J, Dart A. Large artery stiffness predicts ischemic threshold in patients with coronary artery disease. J Am Coll Cardiol 2002;40(4):773-9.
38. Hashimoto J, Imai Y, O’Rourke M. Indices of pulse wave analysis are better predictors of left ventricular mass reduction than cuff pressure. Am J Hypertens 2007;20(4):378-84
39. Hametner B, Wassertheurer S, Hughes A, Parker K, Weber T, Eber B. Reservoir and excess pressures predict cardiovascular events in high-risk patients. Int J Cardiol 2014;171(1):31-6.
40. Wilkinson I, MacCallum H, Flint L, Cockcroft J, Newby D, Webb D. The influence of heart rate on augmentation index and central arterial pressure in humans. J Physiol 2000;525 Pt 1:263-70.
41. Westerhof N, Sipkema P, van den Bos GC, Elzinga G. Forward and backward waves in the arterial system. Cardiovasc Res 1972;6(6):648-56.
42. Westerhof B, Guelen I, Westerhof N, Karemaker J, Avolio A. Quantification ofwave reflection in the human aorta from pressure alone: a proof of principle. Hypertension 2006;48(4):595-601.
43. Qasem A, Avolio A. Determination of aortic pulse wave velocity from waveform decomposition of the central aortic pressure pulse. Hypertension 2008;51(2):188-95.
44. Weber T, Wassertheurer S, Rammer M, Haiden A, Hametner B, Eber B. Wave reflections, assessed with a novel method for pulse wave separation, are associated with end-organ damage and clinical outcomes. Hypertension 2012;60(2):534-41.
45. Parker K, Jones C. Forward and backward running waves in the arteries: analysis using the method of characteristics. J Biomech Eng 1990;112(3):322-6.
46. Sugawara M, Niki K, Ohte N, Okada T, Harada A. Clinical usefulness of wave intensity analysis. Med Biol Eng Comput 2009;47(2):197-206.
47. Hughes A, Parker K. Forward and backward waves in the arterial system: impedance or wave intensity analysis? Med Biol Eng Comput 2009;47(2):207-10.