Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.29 no.1 Montevideo abr. 2014
Actualización en técnicas
Rigidez arterial: evaluación no invasiva en la práctica clínica
Importancia clínica y análisis de las bases metodológicas de los equipos disponibles para su evaluación
Dres. Daniel Bia1, Yanina Zócalo2
1. Doctor y Magíster en Ciencias Biológicas. Prof. Adj. Depto. Fisiología y Colaborador Calificado, Depto. Cardiología, Facultad de Medicina. Co-Director/Coordinador General, CUiiDARTE, Universidad de la República. Investigador Nivel 1, Sistema Nacional de Investigadores. Investigador Grado 4, PEDECIBA.
2. Médica. Doctora en Ciencias Biomédicas. Prof. Adj. Depto. Fisiología y Colaborador Calificado, Depto. Cardiología, Facultad de Medicina. Directora Clínica, CUiiDARTE, Universidad de la República. Investigador Nivel 1, Sistema Nacional de Investigadores. Investigador Grado 3, PEDECIBA.
Centro Universitario de Investigación, Innovación y Diagnóstico Arterial, Universidad de la República.
Correspondencia: Dr. Daniel Bia. Depto. Fisiología, Facultad de Medicina, Universidad de la República. General Flores 2125, CP: 11800, Montevideo, Uruguay. Correo electrónico: dbia@fmed.edu.uy
Recibido marzo 9, aceptado marzo 26, 2014

Aspectos claves a recordar
- La RA es la “resistencia” arterial a deformarse ante los cambios en presión/flujo en cada latido. Elevada RA se asocia con elevada poscarga ventricular, erosión de la pared arterial, reducción de la perfusión tisular y daño microcirculatorio.
- La RA es: 1) predictor independiente de riesgo cardiovascular, aditivo y complementario a los abordajes de riesgo global (por ejemplo, score de Framingham); 2) predictor de mortalidad cardiovascular y por cualquier causa; 3) útil en la estratificación de riesgo cardiovascular individual y en la reclasificación de riesgo; 4) modificable terapéuticamente, y de ser mejorada, asocia mejor pronóstico; 5) biomarcador del estado de salud arterial, siendo indicador del “daño arterial acumulado”.
- Existen numerosas situaciones fisiológicas (por ejemplo, envejecimiento) y patológicas (por ejemplo, insuficiencia cardíaca) en las que puede encontrarse elevada la RA (tabla 1). A su vez, existen múltiples tratamientos farmacológicos y no farmacológicos que han mostrado reducir la RA (tabla 2).
- Los niveles de RA pueden ser influenciados por factores como la edad de la persona, sus niveles de presión arterial o frecuencia cardíaca, el territorio o segmento arterial evaluado; variables a considerar a la hora de evaluar los resultados de estudios de RA.
- Existen más de 20 equipos comercialmente disponibles para medir o calcular parámetros relacionados con la RA (tabla 3). Presentan importantes diferencias: a) “de consultorio” o “ambulatorios”; b) equipos para evaluar RA “global”, “regional” o “local”; c) equipos basados en análisis de tiempos de tránsito del pulso, en análisis de forma de onda, o de análisis de señales de diámetro/presión; d) arterias que evalúan, etcétera. En términos generales la información no puede extrapolarse entre equipos y/o parámetros.
- La evaluación de la RA regional y local, en ese orden, son las más ampliamente recomendadas a nivel mundial. Para evaluar la RA regional, la velocidad de la onda del pulso (VOP) carótido-femoral, medida bajo ciertas condiciones, es el parámetro considerado “estándar oro”.
- Los niveles de referencia/normalidad de diversos parámetros de RA se encuentran mundialmente bajo definición. En nuestro país existen niveles propuestos por el centro CUiiDARTE.
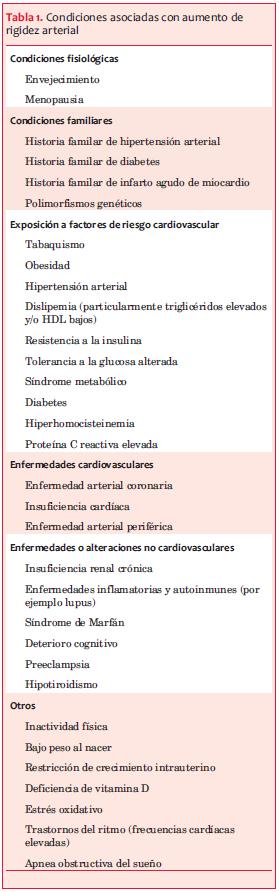

Aspectos básicos, clínicos y epidemiológicos (tabla)
¿Qué es la rigidez arterial (RA)?
La rigidez es la propiedad que caracteriza a un material, elemento o cuerpo, al relacionar las fuerzas que se le aplican con las deformaciones (o desplazamientos) resultantes(1). Podría decirse que la rigidez es la capacidad de soportar cargas o tensiones sin deformarse o desplazarse excesivamente. Al hablar de RA, nos referimos a la resistencia arterial a deformarse ante los cambios en presión/flujo en cada ciclo cardíaco.
¿Qué importancia clínica tiene evaluar la RA?
Clásicamente, la RA se ha concebido como un factor determinante de la presión arterial (PA) sistólica máxima (PAS), de la presión de pulso o diferencial (PP), y en menor medida de la poscarga ventricular. Sin embargo, en las últimas décadas se ha demostrado que la importancia clínica de la RA no se limita a su rol como determinante de condiciones hemodinámicas, sino que también es:
1. Predictor independiente de riesgo cardiovascular(2-4), aditivo y complementario a los abordajes de riesgo global (por ejemplo, score de Framingham)(5).
2. Predictor de mortalidad cardiovascular y mortalidad por cualquier causa(6-8).
3. Útil en la estratificación de riesgo cardiovascular individual y en la reclasificación de riesgo(9,10).
4. Modificable terapéuticamente(11) y de ser mejorada, asocia mejor pronóstico (en subpoblaciones específicas)(11).
5. Biomarcador del estado de salud arterial, siendo indicador del “daño arterial acumulado”, a diferencia de otras variables/parámetros (por ejemplo, PA, glicemia, lípidos sanguíneos) que pueden controlarse en pocas semanas de tratamiento, sin que ello se traduzca en mejora de las alteraciones arteriales (por ejemplo, lesiones ateroscleróticas, aumento de RA)(3,12).
¿Cuál es el rol fisiológico y/o fisiopatológico de la RA?
Las arterias cumplen dos interrelacionadas funciones: 1) ser conductos de baja resistencia que permiten que la sangre fluya por su interior sin “perder” los niveles medios de PA (energía), necesarios para “vencer” las resistencias vasculares periféricas (función de conducción); 2) amortiguar la elevada pulsatilidad en presión y flujo generada por la actividad ventricular (función de amortiguamiento), de manera de asegurar: a) flujo continuo (sisto-diastólico) de baja pulsatilidad en la microcirculación, b) reducción de la erosión que provocaría la pulsatilidad sobre la pared arterial, y c) reducida poscarga ventricular. Ambas funciones dependen de características geométricas arteriales (por ejemplo, diámetros) y de la viscoelasticidad de la pared arterial(1).
La viscoelasticidad, directamente relacionada con la RA, permite: (1) que en la eyección ventricular las arterias se distiendan, dejando fluir y a la vez almacenando un volumen sanguíneo; (2) que en la diástole ventricular las arterias, a manera de resortes elásticos, retornen gradualmente a su posición asegurando flujo sanguíneo continuo centro-periferia y manteniendo elevada la presión arterial diastólica (PAD; “cabeza” de presión que asegura la perfusión microcirculatoria)(1).
Elevada RA determina que la arteria no cumpla eficientemente estas funciones, determinando:
1. Aumento de la poscarga ventricular: el ventrículo eyecta contra un “tubo rígido” que no se distiende y que a su vez determina que las ondas reflejadas arriben a la raíz aórtica en plena eyección ventricular(13). Así, elevados niveles de RA se traducen en aumento de la presión máxima ventricular, y máxima y de fin de sístole aórtica, reducción de la PAD, aumento del consumo de oxígeno miocárdico y reducción de la perfusión subendocárdica, con el consecuente aumento del riesgo de eventos coronarios e hipertrofia ventricular(1).
2. Aumento de la erosión mecánica parietal por elevar la PP (por incremento de la PAS y reducción de la PAD). Elevada PP y/o PAS asocia riesgo aumentado de accidente cerebrovascular(1) .
3. Reducción de la perfusión tisular por generar bajos flujos sanguíneos diastólicos(1).
¿Qué factores determinan los niveles de RA?
Existen dos determinantes mayores y varios subdeterminantes. Dentro de los primeros están: 1) Geometría arterial: la RA depende de características geométricas como el área de sección transversal y el espesor parietal. Como ejemplo, una arteria será más rígida cuanto más cantidad de un material (por ejemplo, colágeno) tenga distribuido en sus paredes (mayor espesor)(1). 2) Características intraparietales (rigidez intrínseca): la RA depende de la rigidez de los constituyentes parietales, de sus cantidades absolutas y relativas y de su organización tridimensional(1). Fisiológicamente los principales determinantes intrínsecos son elastina, colágeno y músculo liso; en condiciones patológicas otros materiales comienzan a determinar la RA (por ejemplo, calcio).
Los determinantes principales son modulados por subdeterminantes: a) pasivos, como lo son la PA y la frecuencia cardíaca y b) activos, como la activación del músculo liso. Aumentos transitorios en la PA aumentan la RA por sobredistensión parietal (reclutamiento de colágeno)(1,14), mientras que incrementos crónicos de la PA resultan en aumento de la RA por el mecanismo mencionado y por remodelado parietal (por ejemplo, mayor síntesis de colágeno y mayor espesor)(1, 14). Por otra parte, una elevada frecuencia cardíaca resulta en aumento de la RA al impedir que la arteria retorne a su posición inicial y hacerla trabajar en un menor rango de deformaciones. Esto depende de las propiedades “viscosas” parietales que determinan que las arterias se resistan a rápidas deformaciones(14). La actividad del músculo liso parietal (regulada por factores mecánicos locales, flujo sanguíneo y control neurohumoral) modifica la rigidez del propio músculo, a la vez que determina cambios en la organización intraparietal que pueden modificar la rigidez intrínseca(1,15,16).
¿En qué condiciones puede encontrarse elevada la RA?
La RA puede aumentar (transitoria o permanentemente) en situaciones fisiológicas (por ejemplo, ejercicio, envejecimiento) y patológicas. La tabla 1 ejemplifica condiciones que asocian aumento de la RA.
¿Existen tratamientos o recomendaciones que mejoren los niveles de la RA?
Sí. La tabla 2 ilustra intervenciones no farmacológicas y farmacológicas que han mostrado modificar la RA, independientemente de sus efectos en los niveles de PA y/o frecuencia cardíaca.
Aspectos técnicos y metodológicos
¿Cómo pueden clasificarse los abordajes y/o sistemas existentes para medir la RA?
En la última década se han multiplicado las formas propuestas para medir la RA en la práctica clínica y numerosas empresas comercializan equipos para esos fines (tabla 3). Estos equipos aportan información muy diversa y valoran directa o indirectamente la RA de distintos sectores del sistema arterial. En función de esto último, los abordajes o equipos se destinan a evaluar: a) RA global, b) RA regional y/o c) RA local. Por otra parte, los equipos utilizan diferentes (tabla 3):
1. Técnicas de medición (por ejemplo, tonometría de aplanamiento, ultrasonido, mecanografía).
2. Señales biológicas (por ejemplo, ondas de presión, de flujo sanguíneo, de distensión arterial).
3. Análisis físico-matemáticos de las señales registradas(17) (por ejemplo, análisis del tiempo de tránsito del pulso, de la forma de onda del pulso, y/o medición directa de características geométricas y PA).
4. Condiciones de registro (por ejemplo, consultorio o ambulatoria).
5. Períodos analizados: los equipos que permiten el registro ambulatorio de RA, conjuntamente con el monitoreo ambulatorio de la PA, determinan (a) la RA para cada toma de PA (por ejemplo, Mobil-O Graph, Diasys Integra II) o (b) la RA promedio para el tiempo de registro (por ejemplo, 24 horas; índice ambulatorio de RA, AASI)(18). Si bien ha mostrado utilidad predictiva y asociación con la RA, dado que el AASI depende de múltiples factores (por ejemplo, frecuencia cardíaca, resistencias vasculares periféricas), no lo incluiremos como indicador de RA.
¿A qué corresponden los abordajes y parámetros que evalúan la RA global, regional o local?
En función del sitio, territorio o segmento considerado, los abordajes disponibles evalúan (tabla 3):
- RA total, global o sistémica: corresponde a un parámetro que “concentra” información relacionada con la RA de todo el sistema arterial (por ejemplo, complacencia arterial total, [CAT]).
- RA regional: corresponde a la RA de segmentos arteriales “largos” (por ejemplo, aorta); el parámetro indicador de RA regional más empleado es la velocidad de la onda del pulso (VOP).
- RA local: corresponde a la RA de anillos/segmentos arteriales “cortos” (por ejemplo, carótida). Como veremos existen múltiples parámetros para evaluar RA local (por ejemplo, distensibilidad, complacencia, índice b).
Si bien cada uno de estos abordajes presenta virtudes y limitaciones, los “regionales” y “locales” (en ese orden) son considerados “estándar oro” y son los más utilizados. Esto se explica por dos principales razones. Primero, los métodos regionales y locales permiten obtener parámetros de RA que han mostrado ser útiles marcadores de riesgo y pronóstico de mortalidad cardiovascular y global. Segundo, mientras los abordajes local y regional miden directamente propiedades arteriales relacionadas con la RA, los abordajes globales los calculan a partir de información medida o también calculada (por ejemplo a partir de las resistencias periféricas)(17). De esta manera, la RA global resulta de múltiples cálculos aumentando la posibilidad de potenciales errores(1).
¿Qué es la RA total, global o sistémica? ¿Cómo se cuantifica? ¿Qué equipos existen?
Bases teóricas de la RA global: modelos windkessel
La complacencia arterial total (CAT), indicador de RA (a mayor RA, menor CAT), es la relación entre un cambio de volumen (DV) en el sistema arterial y el resultante cambio en PA (DP). Podría calcularse directamente si pudiera inyectarse en el sistema un volumen de sangre conocido (sin que se “pierda” por la microcirculación) y determinar el cambio en la presión resultante. Dado que lo anterior no es posible, cuantificar la CAT ha sido un asunto complejo y ha requerido desarrollos matemáticos, siendo el principal el de los modelos windkessel que describiremos más adelante.
Si el ventrículo izquierdo eyectara al vacío, en lugar de enviar la sangre a un sistema de tubos (sistema arterial), su trabajo sería más sencillo y con menor gasto energético. Sin embargo, el ventrículo eyecta sangre hacia tubos que aseguran su llegada a los tejidos y que le imponen al ventrículo una “carga, resistencia o impedancia hidráulica” (impedancia del sistema arterial)(1). Entre los diferentes abordajes propuestos para caracterizar la impedancia arterial, los más usados se basan en analizar la “forma” de las ondas de presión y flujo obtenidas simultáneamente en la raíz aórtica(1). Esto se fundamenta en que las similitudes y/o diferencias entre las ondas de presión y flujo aórticas son determinadas por la impedancia arterial.
Un abordaje clásico para el análisis de la impedancia arterial supone considerar a una de las ondas registradas (presión o flujo) como “entrada del modelo”, y determinar cuál es la ecuación (fórmula matemática) que permite obtener la onda restante, considerada la “salida del modelo”. El método “prueba ecuaciones/valores”, hasta que a partir de la “onda de entrada” (por ejemplo flujo) se obtiene una “onda de salida o calculada” (onda de presión calculada), semejante a la “onda real o medida” (onda de presión medida). La ecuación y los parámetros que permiten obtener las menores diferencias entre la onda calculada y la medida definen la “ecuación de impedancia del sistema arterial”. Esta ecuación describe las variaciones dinámicas de la carga impuesta por el sistema arterial como un todo. Cabe señalar que la “mejor” de las ecuaciones para uso con fines diagnósticos es la que alcanza un adecuado equilibrio entre robustez físico-matemática para describir la relación presión-flujo, y capacidad de correlación de sus parámetros con propiedades arteriales reales.
Históricamente muchos investigadores han tratado de hallar la ecuación o el modelo que mejor describa la relación presión-flujo. Los abordajes más usados han utilizado modelos “de parámetros concentrados” que simplifican el análisis del sistema cardiovascular real (sistema distribuido), considerando elementos discretos que aproximan el comportamiento de los componentes distribuidos reales (bajo ciertas condiciones, limitaciones). Como ejemplo, modelan el sistema como si tuviera una única complacencia concentrada en un único sitio, en lugar de tener múltiples arterias que contribuyen a la complacencia total del sistema.
Dentro de estos modelos considerados quizá el primero fue el modelo windkessel (WK) de dos elementos (WK-2; O. Frank, 1899) (figura 1, A)(19). Windkessel en alemán significa cámara (reservorio) de aire, pero en fisiología arterial podemos traducirlo como “reservorio elástico”. En ese modelo, el sistema arterial es comparado con un sistema de mangueras para apagar incendios, en el cual el sistema de conducción (manguera) está unido al sistema de amortiguamiento (reservorio de aire), que amortigua las pulsaciones de flujo generadas por una bomba intermitente. El modelo considera (1) una resistencia (mangueras) vascular periférica (RVP) que se asume ubicada en pequeñas arterias y arteriolas y (2) una CAT, relacionada con la capacidad de almacenamiento arterial (reservorio, amortiguador) (figura 1, A).
La fortaleza del WK-2 radicó en que permite acercarse mucho a la ecuación que describe la relación entre ondas de presión y flujo durante las fases diastólicas o lentas del ciclo cardíaco. El modelo define que la constante de decaimiento (exponencial) de la onda de PA durante la diástole (t), cuando el flujo aórtico es cero es determinada por el producto entre CAT y RVP (t = RVP*CAT). Como veremos, utilizando esta ecuación es posible calcular la CAT (con equipos comercialmente disponibles), si obtenemos de manera no invasiva una onda de PA (para calcular t) y calculamos la RVP (por ejemplo, como el cociente entre PAM y gasto cardíaco, [GC])(19).
Diferentes autores realizaron modificaciones al WK-2 buscando mejorar la caracterización que el modelo permite hacer de la impedancia arterial y así “acercarse” lo más posible a reconstruir con precisión las fases “sistólicas” de las ondas de PA y/o flujo. Así, a partir del WK-2 se ha desarrollado:
1. El modelo WK de 3 elementos (WK-3)(20) (figura 1, A): suma la impedancia característica (Zc) como tercer elemento conectando en serie con los restantes (RVP y CAT). Puede interpretarse la Zc como la resistencia dinámica determinada por la aceleración de la columna líquida que debe de existir para poder eyectar, es decir, para que una “nueva masa de sangre” ingrese a la aorta durante la eyección temprana. La Zc es determinada por la relación entre la masa sanguínea y la complacencia aórtica proximal (Zc = velocidad de propagación*densidad sanguínea/ área de sección transversal arterial). El WK-3 permite reconstruir adecuadamente las fases sistólicas de las ondas de presión y/o flujo (carencia del WK-2), pero sobreestima la CAT y subestima la Zc (cuando los valores obtenidos por el modelo se comparan con datos experimentales)(21). A partir de su introducción, este modelo “acaparó” el interés científico académico, desplazando al WK-2. Igualmente, como veremos, por su sencillez y por reconstruir adecuadamente la fase diastólica el WK-2 se sigue empleando para calcular la CAT.
2. El modelo WK de 4 elementos (WK-4) (figura 1, A)(21) fue generado con la intención de reducir las diferencias que se veían entre los valores de CAT y Zc obtenidos por el WK-3 y experimentalmente. Para ello, se coloca en paralelo con la Zc la “inertancia” (L) o inercia del sistema arterial como un todo (suma de todas las inertancias locales del sistema). Así como Zc se asocia con propiedades inerciales a frecuencias intermedias o elevadas (fase sistólica), la inertancia se asocia con la inercia a bajas frecuencias (fase diastólica). A este último modelo se le han realizado cambios. A manera de ejemplo un WK-4 modificado integra RVP, L y dos elementos de complacencia; C1 o complacencia central y C2 o complacencia periférica(22). Este último modelo es usado por el equipo HD/PulseWave CR-2000 (tabla 3). La complejidad de su aplicación ha determinado que muchos autores aún se inclinen por utilizar el WK-3.
En suma, los modelos (o ecuaciones) WK-2, WK-3 y WK-4 permiten describir (con mayor o menor precisión) la relación entre ondas de presión y flujo, y, por lo tanto, han permitido caracterizar la impedancia del sistema arterial. La capacidad de los modelos para caracterizar la carga arterial puede analizarse comparando el diagrama de impedancia obtenido a partir de ondas de presión y flujo medidas con el obtenido empleando ondas reconstruidas (figura 1, A). A su vez, lo hacen mediante ecuaciones con parámetros que presentan correspondencia con características funcionales/estructurales del sistema arterial.
Métodos de cuantificación de la RA global: clasificación
Como dijimos, la CAT solo puede calcularse, no medirse, mediante abordajes que requieren conocer la onda de presión (o al menos PAS y PAD) junto con el GC o volumen de eyección y/o la onda de flujo aórtico. El WK-2 ha establecido la base de diferentes métodos para estimar la CAT. Los abordajes más empleados para determinar la CAT que se encuentran en la base de equipos comercialmente disponibles son:
1. Método de la constante de decaimiento de la PA diastólica o método de decaimiento (Decay time method).
2. Método de análisis del área de la PA diastólica o método del área (Area method).
3. Método de la reconstrucción de la PP o método de la PP (Pulse pressure method).
4. Método volumen eyectado/PP arterial o método SV/PP (Stroke volumen/PP method).
5. Método de cálculo con WK-3 y complacencia presión-dependiente.
6. Método de estimación de parámetros.
Los niveles de CAT obtenidos por los diferentes métodos no son “reales”, ni “intercambiables”. Como ejemplo, mientras el método SV/PP determina la CAT para niveles de PAM, el método del área lo hace para la PA diastólica media. Consecuentemente, dado que la CAT se reduce al elevarse la PA, se esperan menores niveles de CAT con el método SV/PP(23).
1. Método de constante de decaimiento de la presión diastólica (Decay time method)
Basado en el modelo (ecuación) WK, asume que en la raíz aórtica la PA diastólica (flujo=0 ml/min) cae exponencialmente con constante de decaimiento t = RVP*CAT(19) (figura 1, B). Esta relación puede comprenderse considerando que: a) elevada RVP determina un lento “vaciamiento” de la sangre acumulada a través de la microcirculación, y, por lo tanto, lenta caída de la PA diastólica (mayor t) y/o b) mayor CAT implica mayor acumulación de volumen sanguíneo en arterias, y, por lo tanto, caída de PA más lenta (mayor t). Formalmente, el método ajusta una exponencial a la porción diastólica de la onda de PA:
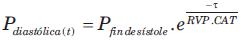
Así es posible calcular la CAT mediante: 1) obtención no invasiva de onda de PA, 2) determinación de t a partir de ajuste exponencial a la fase diastólica, 3) cálculo de RVP (RVP= PAM/GC), y 4) cálculo de CAT (CAT=t/RVP).
Este método lo emplea el equipo HD/PulseWave CR-2000 (tabla 3). A partir de ondas de PA radial (tonometría de aplanamiento) y usando un WK-4 modificado, el equipo busca el mejor ajuste para la fase de decaimiento diastólica de la PA. Obtenido el ajuste, e ingresando a la ecuación del modelo un valor de RVP (cociente PAM/GC; PAM es la integral de la onda de PA y GC es calculado mediante fórmula que considera el período eyectivo, edad, frecuencia cardíaca y el área de superficie corporal) se obtienen los valores de los restantes parámetros del WK-4: C1 (corresponde a CAT), C2 (corresponde a la complacencia arterial periférica), y L. El método asume que no hay diferencias en la caída exponencial de PA de la radial y de la aorta(24).
2. Método del análisis del área de la presión arterial diastólica (Area method)
Propuesto por Liu y colaboradores(25), estima t como la relación entre el área bajo la fase diastólica de la onda de PA y la diferencia de PA entre el inicio y el fin de la fase diastólica (figura 1, C). Obtenida la t por este abordaje, calcula la CAT de manera similar al método anterior:
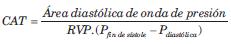
Este método permite incorporar una relación CAT-presión no-lineal y cuantificar la CAT a diferentes niveles de PA.
3. Método de la presión de pulso arterial
(Pulse pressure method)
Este método utiliza información de PAM, RVP y de la señal de flujo aórtica (por ejemplo, ecografía Doppler) como “entrada del modelo” para seguidamente calcular los valores de CAT que permiten obtener valores de PP idénticos (o muy similares) a los medidos (por ejemplo, tonometría de aplanamiento). Como vimos, si bien el WK-2 no permite describir adecuadamente la relación entre ondas de PA y flujo en sus fases sistólicas, sí permite una aceptable aproximación a los valores de PP (figura 1, D).
4. Método de relación volumen eyectado/presión de pulso (SV/PP method)
Propuesto por Remington y colaboradores(26) se basa en asumir que en una condición de “estado estable” o “flujo bloqueado”, en que no hay flujo a través de las RVP (RVP infinitas), el cambio en presión (PP) depende de cuán “distensible” es el sistema para alojar el volumen de eyección ventricular (SV). Por ello, calcula CAT como SV/PP. Sin embargo, es claro que: 1) parte del volumen es eyectado luego de haberse alcanzado la PAS y 2) parte del volumen eyectado circula a través de las RVP, sin quedar “almacenado” en la aorta(27). Si bien ha mostrado cierta correspondencia con otros métodos (por ejemplo, método del área)(23), sobreestima la CAT (hasta un 60%)(19), y su uso con fines diagnósticos se desaconseja.
Este método es usado por: (1) equipos de cardiografía de impedancia (por ejemplo, NICCOMO, BioZ ICG Monitor) que cuantifican el SV a partir de los cambios instantáneos en bioimpedancia torácica, (2) equipos (por ejemplo, Nexfin Co-Track) que a partir de la onda de PA en dedos de la mano (método de “clampeo de volumen”) derivan el flujo aórtico (usando modelos WK-3 y cálculo de áreas sistólicas)(28,29) y posteriormente integrando el área determinan el SV. La PA se mide mediante esfigmomanometría (tabla 3).
5. Método de cálculo con WK-3 y complacencia presión-dependiente
Se basa en un WK-3 y a diferencia de otros métodos asume la PA-dependencia de la CAT. Para ello, ingresa a la ecuación de cálculo el coeficiente b (coeficiente no lineal de la relación exponencial volumen-presión (P); V = a.ebP+c). Habitualmente b se asume igual a -0,01. La CAT puede calcularse para cualquier nivel de P a partir de las áreas sistólica y diastólica de la onda de P (19):
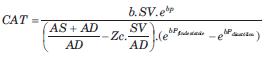
siendo AS y AD el área sistólica y diastólica de la onda de presión, respectivamente.
6. Método de estimación de parámetros
Basado en modelos WK-3 o WK-4, utiliza ondas medidas de presión y/o flujo para obtener los parámetros de los modelos (RVP, CAT y Zc, con o sin L). Optimiza los parámetros calculados comparando la onda de PA (o flujo) medida y la reconstruida usando el modelo o los diagramas de impedancia (figura 1, A). Aplicando este método se ha visto que el WK-3 sobreestima la CAT, por lo que se aconseja emplear el WK-4.
Este método lo emplean equipos (por ejemplo, Finapres, Nexfin CO-Trek)(28,29) (tabla 3), que determinan la onda de PA en un dedo (“método de clampeo de volumen”), y reconstruye matemáticamente la onda de la PA humeral y la de flujo existente en la raíz aórtica. Estos equipos difieren en la forma de reconstrucción de la onda de flujo, pero independientemente de ello cuantifican CAT, RVP y Zc al resolver la ecuación de impedancia.
Niveles de referencia y de corte para la RA global
Existen diversos grupos que han trabajado en determinar niveles de referencia en función de sus particulares formas de medición de la RA global, muchas veces como forma de sustento de sistemas disponibles comercialmente. No existen valores “consensuados” internacionalmente.
¿Qué es la RA regional? ¿Cómo se mide? ¿Qué equipos existen?
Bases teóricas de la RA regional: modelos propagativos; velocidad de onda del pulso
La RA regional es la rigidez “promedio” que caracteriza a un segmento arterial “largo” (por ejemplo, aorta tóraco-abdominal). Se habla de promedio porque el segmento aumenta su rigidez hacia la periferia.
La medición de la RA regional se basa en “modelos de propagación de ondas” en el sistema arterial. Estos modelos, más realísticos que los WK, consideran el sistema como (a) tubos distensibles viscoelásticos que finalizan en (b) elevadas resistencias (sitios de reflexión de ondas). Si el sistema arterial solo estuviera formado por tubos viscoelásticos, las ondas al propagarse irían reduciendo exponencialmente su amplitud hasta atenuarse completamente. Por el contrario, si la onda (de PA) se propaga en un tubo en el que existen sitios de reflexión se amplificará progresivamente, a la vez que le irá variando su forma. Esto es lo que ocurre en el sistema arterial en el que las ondas de PA aumentan su amplitud hacia la periferia (“amplificación del pulso”) y en todo momento la onda medida resulta de la integración instantánea de ondas que viajan del corazón a la periferia (incidentes) y ondas que lo hacen en sentido contrario (reflejadas). En el sistema cardiovascular, las ondas reflejadas se generan en sitios de bifurcación o ahusamiento arterial, de cambios en RA y en las RVP. Las reflexiones pueden modificarse variando sus determinantes (por ejemplo, la vasoconstricción arteriolar determina que las ondas reflejadas se generen más cerca del corazón y tengan mayor amplitud)(1). De todas maneras, es válido simplificar y asumir (como lo hacen varios equipos comerciales, por ejemplo, Arteriograph, PulseTrace DPA2) que existe un “gran sitio de reflexión de ondas” ubicado al final de la aorta abdominal(1) (tabla 3).
Estos modelos asumen que la velocidad de propagación de ondas (velocidad de la onda del pulso, [VOP]) en el segmento arterial tiene un valor finito (y no infinito como asumían los WK). Mediante la ecuación de Moens-Korteweg, de Bramwell-Hill o de Waterhammer, la VOP puede relacionarse con características estructurales y/o hemodinámicas (1):
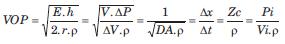
siendo E el módulo elástico circunferencial de la pared arterial, h y R el espesor y radio arterial, respectivamente, r la densidad del fluido (asumida como 1,05 g/cm3), DV el cambio de volumen (V), DP el cambio de PA, DA la distensibilidad arterial y Pi/Vi las relaciones entre presión y velocidad de flujo sanguíneo (en ausencia de reflexiones de ondas)(1). Así, la VOP está directamente relacionada con el módulo elástico parietal, es decir con su rigidez. Además, la VOP puede medirse como la relación entre la distancia recorrida (Dx) por las ondas del pulso y el tiempo que insumió el recorrido (Dt o tiempo de tránsito del pulso, TTP)(1). Independientemente de la forma de cuantificación, mayor VOP implica mayor RA.
Métodos de cuantificación de RA regional: clasificación
La evaluación de la RA regional mediante el análisis del TTP y/o de la VOP se considera el método no invasivo más simple, robusto y reproducible para el análisis de la RA regional, siendo considerado actualmente el “estándar oro” para esos fines(3). Si bien TTP y VOP pueden medirse en distintas regiones arteriales, con fines diagnósticos suele medirse a nivel aórtico. Esto se explica porque la aorta tóraco-abdominal es la arteria: a) responsable de cerca del 80% del amortiguamiento arterial; b) que al estar unida al ventrículo influencia directamente su función; c) más frecuentemente afectada por aumento de RA; d) su RA ha mostrado asociarse con riesgo cardiovascular y mortalidad cardiovascular y global (3).
Si bien son numerosos los abordajes (y equipos) para medir RA regional (tabla 3), los mismos se basan en tres metodologías principales:
1. Métodos pie-a-pie: determinan el tiempo de tránsito de ondas obtenidas en dos sitios arteriales separados por una distancia conocida (tabla 3). El registro de las ondas puede ser: (a) simultáneo (por ejemplo, Complior, Vascular Explorer) o (b) secuencial (por ejemplo, Sphygmocor, PulsePen).
2. Métodos corazón-pie: consideran el tiempo transcurrido entre la generación de la onda incidente (evaluada a partir de determinar la actividad cardíaca) y el tiempo de arribo de la onda a un sitio arterial distante (tabla 3). Entre estos métodos hay diferencias en la forma de determinar el inicio de la onda a nivel aórtico y/o la llegada a nivel periférico. Al respecto, los métodos descritos son:
a. QRS-Ruidos de Korotkoff humerales: intervalo QKD.
b. QRS-Pico de velocidad sanguínea humeral (Doppler): intervalo QPV.
c. QRS-Fonocardiograma-onda de PA periférica: índice vascular corazón-tobillo (CAVI).
d. ICG-Onda de presión periférica.
3. Métodos de análisis de la onda del pulso: existen diferentes abordajes. Fundamentalmente se basan en el análisis de la onda del pulso en un único sitio y en determinar el tiempo (“tiempo de retorno”) entre el arribo de la onda incidente y de las reflexiones (asumiendo distancia conocida al sitio principal de reflexión) (tabla 3). Otros se basan en su cuantificación a partir de la aplicación de modelos que permiten su determinación a partir de datos de la persona y del cálculo de parámetros hemodinámicos intermedios (por ejemplo, Zc) a partir del análisis de la onda del pulso y de su descomposición matemática en ondas incidentes y reflejadas. Los métodos difieren en la onda analizada:
a. Digital (por ejemplo, equipos PulseTrace DPA2, QHRV Arterial Vascular Assesment).
b. Humeral (por ejemplo, equipos Arteriograph, Vascular Explorer, BPLab-Vasotens).
c. Aórtica (reconstruida) (por ejemplo, equipo Mobil-O-Graph).
4. Otros métodos (por ejemplo, basados en imágenes obtenidas por resonancia magnética).
Cabe señalar que la mayoría de los equipos comercialmente disponibles no se han validado. Al respecto, de 23 equipos disponibles comercialmente para medir VOP, solo el 48% (11/23) había sido comparado con equipos validados y el 22% (5/23) contrastado con registros invasivos (30).
1. Métodos pie-a-pie para determinación de TTP o VOP
Son los más utilizados y considerados “estándar oro” para determinar la RA regional. Determinan la VOP como la relación entre la distancia (Dx) y el TTP (Dt) entre dos sitios de registro (VOP=Dx/Dt o TTP). Las variables (ondas) medidas difieren dependiendo del equipo considerado: presión mediante tonometría de aplanamiento (por ejemplo, SphygmoCor, PulsePen), velocidad sanguínea por Doppler (por ejemplo, PulseTrace), distensión arterial (por ejemplo, Complior), volumen arterial por pletismografía (por ejemplo, Vicorder) (tabla 3).
Independientemente de la onda registrada, los abordajes requieren (1) determinar el TTP, para lo cual emplean diferentes algoritmos, y (2) que el operador ingrese el Dx (medido o calculado).
- Determinación del tiempo de tránsito del pulso
Este método requiere que se detecten puntos singulares (similares) en las ondas para cuantificar el tiempo que transcurre entre que el punto “aparece” en la onda proximal y en la onda distal. Los puntos detectados están próximos al inicio de la onda, ya que en ese momento las ondas no son mayormente afectadas por cambios en frecuencia cardíaca, PA y reflexiones de onda. Si esto ocurriera, el TTP no solo dependería de la RA. Existen cuatro algoritmos principales (figura 2, A):
a. Método de las tangentes: ajusta una tangente al valor mínimo de fin de diástole y al punto de máxima aceleración del ascenso sistólico. La intersección entre ambas es el pie de onda. Es el algoritmo más utilizado.
b. Método de máxima aceleración (“maximal upstroke”): no detecta el pie, sino un punto cercano, correspondiente a la máxima aceleración sistólica de la onda.
c. Método de porcentaje de ascenso: el pie es un porcentaje “fijo” de la amplitud de la onda.
d. Método del mínimo: el pie es el mínimo valor de la onda antes de comenzar la fase sistólica. Su baja reproducibilidad ha determinado que su utilización se vea relegada.
Los valores VOP pueden variar sustancialmente en función del algoritmo usado(31,32).
Independientemente del algoritmo de detección de pie usado, en caso de registro simultáneo de las señales proximales y distales (por ejemplo, Complior) el TTP es el tiempo entre los pies de las ondas mientras que si el registro es secuencial (por ejemplo, Sphygmocor) el TTP es la resta del tiempo QRS/pie distal y QRS/pie proximal (figura 2, B).
- Determinación de distancias entre sitios de registro: velocidad del pulso carótido-femoral (cfVOP)
Medir el Dx entre dos sitios de registro en una arteria “recta” y “visible” sería sencillo, pero en la práctica se mide sobre la superficie corporal y sin saber realmente cuál es el trayecto arterial exacto. Distintas formas de medir el Dx han sido usadas, obteniéndose distintos niveles de VOP en función de cuál se considere (32-34).
Como fue mencionado, principalmente se evalúa la RA de la aorta tóraco-abdominal. Para ello, de manera ideal los métodos pie-a-pie deberían registrar la onda proximal y distal al inicio y fin de la aorta (aorta ascendente y abdominal distal, respectivamente). Por ser estos sitios de difícil acceso, habitualmente el registro proximal se realiza en carótida (por ejemplo, Sphygmocor, Complior) o subclavia (por ejemplo, PulseTrace PWV) y el distal en la femoral común (por ejemplo, Sphygmocor, Complior) o la aorta abdominal (por ejemplo, PulseTrace PWV). Por ello, la VOP aórtica suele llamarse carótido-femoral. Se proponen tres formas de medir Dx al registrar la VOP carótido-femoral (figura 2, C)(34):a. Distancia directa o carótido-femoral: distancia entre los sitios de registro, medida en línea recta, por el lateral del cuerpo; sobreestima la distancia real aórtica en 25%(34).
b. Distancia hueco supraesternal (hse)-femoral: resulta de restarle a la distancia directa la distancia hse-carótida. Subestima la distancia aórtica real en 10%(34).
c. Distancia sustraída: resulta de restarle a la distancia hse-femoral la hse-carótida. Se propuso considerando que esa sería la distancia que a la onda distal le resta recorrer una vez que la proximal arribó a la carótida. Subestima la distancia real en 29%(34).
Si bien se ha intentado alcanzar un consenso aún hay diferencias en los métodos de medición del Dx, limitando la determinación de valores de referencia generalizados para la VOP(34). Teniendo en cuenta: a) que todo abordaje que implique “restar” distancias aumenta la probabilidad de error, y b) resultados de estudios que compararon medición de Dx por distintos métodos con distancias aórticas medidas con resonancia magnética, se ha recomendado usar la distancia directa multiplicada por 0,8, y realizar los estudios en el hemicuerpo derecho. Este método sobreestima la medición en 0,4%(34,35).
- Determinación de distancias entre sitios de registro: velocidad del pulso brazo-tobillo (baVOP)
Buscando herramientas para evaluar la VOP en territorios sensiblemente afectados por la patología vascular, con baja operador-dependencia y sin necesidad de registrar en la zona inguinal (arteria femoral) se propuso evaluar la VOP brazo-tobillo (baVOP)(36). Existen diversos equipos (con mínimas diferencias entre ellos) para evaluar la baVOP (por ejemplo, VaSera 1500, VP-1000/2000 PWV/ABI, Vascular Explorer, PeriScope) (tabla 3).
Básicamente registran (1) señales de ECG (por ejemplo, electrodos en muñecas) y (2) PA y forma de onda del pulso en brazos y tobillos (manguitos de PA oscilométricos, adaptados para registros pletismográficos). Los equipos detectan ondas pletismográficas en ambos brazos y tobillos, y cuantifican la baVOP para cada hemicuerpo. Para ello, determinan el TTP como la diferencia temporal pie-a-pie entre onda braquial y tibial. Dependiendo del equipo, el Dx es: (a) la resta entre distancia hse-mitad de manguito en tobillo y hse-mitad de manguito en brazo (por ejemplo, Vascular Explorer) o (b) la distancia hse-mitad de manguito en tobillo (por ejemplo, VP-1000/2000 PWV/ABI).
2. Métodos corazón-pie para determinación de TTP o VOP
- Método QRS-Ruidos de Korotkoff humerales: intervalo QKD
Cuantifica el TTP como el Dt entre (a) la onda R del complejo QRS (electrodos de ECG en el tórax) y (b) el cuarto ruido de Korotkoff (detectado por sensor ubicado en el brazalete para toma de PA). Dicho TTP, el QKD (Q: complejo QRS, K: ruidos de Korotkoff, D: diástole), está inversamente relacionado con la RA(37) (figura 3, A).
Entre las limitantes del QKD está incluir el período preeyectivo (tiempo isovolumétrico ventricular), que depende de determinantes de la función ventricular (por ejemplo, frecuencia cardíaca, precarga). Por otra parte, evalúa el TTP e indirectamente la RA del territorio aorto-subclavio-humeral que no suele afectarse marcadamente por la patología cardiovascular. Como virtud, es operador-independiente y permite acercarse a la medición ambulatoria de la RA. Es usado por el equipo Diasys Integra II (tabla 3).
- Método QRS-Pico de velocidad sanguínea humeral (Doppler): intervalo QPV
Es un método sencillo que cuantifica el TTP como el Dt entre la onda R del QRS (electrodos en el tórax) y el pico de la onda de velocidad sanguínea humeral (Doppler). El TTP obtenido es el intervalo QPV (Q: QRS, PV: Peripherals blood velocity)(38).
- Método QRS-Fonocardiograma-onda de PA periférica: índice vascular corazón-tobillo (CAVI)
El índice CAVI se propuso como un índice de RA regional que se independiza de los niveles de PA del paciente (39,40). Se basa en desarrollos previos. Primero, en el método propuesto por Hasegawa (1970) para medir la VOP cardio-femoral usando mediciones de ruidos cardíacos y pulsos femorales, y en la más reciente medición de baVOP. Segundo, en el índice b (stiffness o b index) ampliamente empleado para evaluar RA local independizándose de la PA(41,42). Este índice describe la RA como:
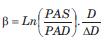
siendo Ln el logaritmo natural, D el diámetro inicial y DD la variación de diámetro arterial durante un latido. Tercero, en la ecuación de Bramwell y Hill:
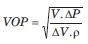
Asumiendo que las variaciones en volumen arterial son determinadas por variaciones en diámetro (y no en longitud), la ecuación se reescribe como:
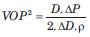
y despejando D/DD, como:
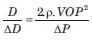
Esta igualdad puede sustituir el término D/DD del índice b, dando lugar al índice “b modificado” o CAVI:
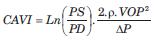
El CAVI informa sobre la RA aorto-fémoro-tibial. La instrumentación para su medición es similar a la de baVOP, adicionando el registro fonocardiográfico (figura 3, B).
Para el cálculo de VOP considera la distancia hse-mitad del manguito tibial. Como TTP, considera la suma de dos tiempos: a) el tiempo entre el primer ruido e inicio de onda braquial (Tb’), y (b) el Dt entre los pies de la onda braquial y tibial (Tba). Dado que es complejo determinar con precisión el primer ruido, Tb’ se asume similar al tiempo entre el segundo ruido y la inflexión (notch dicrótico) de fin de sístole en la onda braquial (tb). CAVI es medido por el equipo VaSera-1500 (tabla 3).
- Métodos ICG-onda de presión periférica
Estos métodos, principalmente usados para monitorización no invasiva de GC y distribución de agua intra-torácica, permiten calcular la VOP mediante: a) técnicas de cardiografía por impedancia (ICG) para determinar el inicio de la eyección, y b) pletismografía volumétrica para determinar el arribo de la onda del pulso a las arterias periféricas (por ejemplo, femoral; equipo NICCOMO)(43). Los cambios en volumen y en velocidades sanguíneas aórticas modifican la bioimpedancia que los tejidos torácicos imponen a corrientes alternas (por ejemplo, 1.5 mA; 85 kHz) inyectadas y sensadas desde electrodos posicionados en cuello y pared torácica, permitiendo determinar diferentes eventos. En particular puede determinarse con precisión el inicio de la eyección (punto b en diagrama de bioimpedancia) (figura 3, C). El TTP es el tiempo entre el inicio de la eyección y la detección del pie en la onda del pulso femoral. El Dx es la distancia entre hse y el punto medio del manguito femoral.
3. Métodos de análisis de la onda del pulso para determinación de TTP o VOP
- Análisis a partir de ondas digitales (fotopletismografía)
Estos métodos se basan en determinar la onda del pulso en dedos de la mano midiendo los cambios de volumen asociados a la onda del pulso (Digital Volume Pulse, DVP) mediante fotopletismografía. Esta se basa en la transmisión de luz infrarroja a través del dedo, la que será absorbida por los tejidos transluminados en forma directamente proporcional al volumen de sangre en su interior(44). Obtenida la onda del pulso, se puede identificar un primer componente de la onda (onda incidente) responsable de la amplitud sistólica total y un segundo y tercer componente determinados por ondas reflejadas desde sitios de reflexión ubicados en la bifurcación aórtica (figura 3, D). Aortas con mayor RA, por tener mayor VOP, determinan que el primer y segundo (o tercer) componente estén más próximos (menor tiempo de retorno o TTP). Analizando tiempos y amplitudes de las ondas pueden cuantificarse índices asociados con la VOP y los niveles de reflexión. Diversos equipos usan este abordaje (por ejemplo, QHRV Arterial Vascular Assesment, Pulse Trace PCA2) (tabla 3).
Si bien las ondas del pulso obtenidas en dedos de la mano mediante fotopletismografía y en arterias radiales mediante tonometría de aplanamiento tienen diferencias en sus formas, la información que contienen es similar (figura 3, D). Análisis mediante funciones transferencia demostraron que los principales accidentes asociados a las ondas incidentes y reflejadas son análogos en ambas ondas y bien detectados(45,46).
- Análisis a partir de ondas humerales
De manera similar a lo descrito, existen equipos (por ejemplo, Arteriograph, Vascular Explorer, BPLab Vasotens) que luego de obtener un registro de PA por métodos oscilométricos estándar, vuelven a insuflar al brazalete 35-40 mmHg por encima de la PAS y a determinar la forma de onda de PA braquial por una técnica “no auscultatoria y no oscilométrica”, que denominan “stop flow” porque se realiza con la arteria completamente ocluida por el brazalete. Cuantifican el TTP o Dt (“tiempo de retorno”) igual que el equipo anterior. Asumiendo que el sitio de reflexión está en la bifurcación aórtica, la distancia recorrida (Dx) se aproxima a dos veces la longitud de la aorta (hse - sínfisis pubiana) (figura 3, E).
- Análisis a partir de ondas aórticas reconstruidas
Otros autores han patentado el abordaje que implica obtener a partir del registro radial (tonometría de aplanamiento) la onda aórtica, y tras descomponerla en incidente y reflejada, calcular el TTP como la mitad del “tiempo de retorno” entre ambas ondas. Relacionando el TTP con la distancia aórtica (carótido-femoral) se puede arribar a la VOP aórtica(51).
4. Otros métodos
Se han propuesto diversos métodos para medir la VOP a partir de imágenes obtenidas por resonancia magnética(52). Entre los principales están: (a) cuantificación del tiempo de tránsito, (b) determinación del área de la señal de flujo, y (c) métodos de correlación cruzada(52). Si bien han mostrado buenos resultados y permiten acceder a arterias no superficiales, con precisión en la determinación de distancias, el elevado costo relativo del estudio, el tiempo que requiere, la limitada disponibilidad y accesibilidad, entre otros factores, han relegado dichos abordajes.
- Niveles de referencia y de corte para la velocidad de onda del pulso
No existen niveles de referencia para la VOP aceptados universalmente, debido, entre otros factores, a las diferencias en los niveles de VOP obtenidos al considerar diferentes abordajes, equipos, territorios, distancias, y algoritmos de detección de pie. Sin embargo, estudios clínicos y epidemiológicos han permitido determinar niveles de referencia para VOP carótido-femoral cuando es medida con “distancias directas” y el algoritmo de “intersección de tangentes”(53). En Uruguay se han determinado niveles de referencia por edad y PA, para diferentes abordajes, a partir de estudios poblacionales realizados en CUiiDARTE(32).
Por otra parte se han definido niveles de corte para VOP carótido-femoral. Al respecto, valores mayores a 10 m/s (obtenida por distancia directa*0,80 y algoritmo de intersección de tangentes) o a 12 m/s (distancia directa y algoritmo de intersección de tangentes) deben considerarse marcadores de daño de órgano blanco(34).
¿Qué es la rigidez arterial local? ¿Cómo se mide?
Asumiendo a las arterias como tubos cilíndricos (área transversal circular), la RA puede medirse localmente en un corto “segmento o anillo” arterial si se conoce la relación entre el cambio de PA en su interior y la distensión resultante (cambio de diámetro). Esta relación presión-diámetro informa de la rigidez del segmento “como un todo”, determinada por las características geométricas y parietales (rigidez intrínseca). Si se cuenta con información del espesor parietal, puede cuantificarse la relación tensión-deformación y así independizarse de factores geométricos para determinar la rigidez intrínseca parietal (por ejemplo, módulo elástico). Si bien lo ideal es cuantificar la relación instantánea presión-diámetro o tensión-deformación para el pulso arterial, para a partir de ellas cuantificar la RA, los parámetros más usados en la clínica solo emplean la relación entre los valores máximos y mínimos de las variables. Si bien eso implica asumir relaciones lineales o no lineales entre las variables, la información obtenida ha mostrado ser de valor(1).
Los abordajes descritos tienen la ventaja de (mayormente) no requerir usar modelos para cuantificar la RA. Sin embargo, dado que la medición requiere mayor experticia técnica y tiempo para su realización, estos métodos son menos empleados que los de medición de la RA regional.
Por basarse en registros con ultrasonido, la medición de la RA local se realiza en arterias superficiales, de manera de obtener adecuada resolución y detección de las paredes arteriales. Si bien se puede estudiar cualquier arteria superficial, las arterias carótidas y/o femorales son las más estudiadas en la clínica, permitendo acceder a información de valor diagnóstico y/o pronóstico(54). Métodos en desarrollo buscan determinar la RA local de arterias más profundas (por ejemplo, aorta) mediante análisis de imágenes obtenidas por resonancia magnética.
Métodos de cuantificación de la RA local: clasificación
1. Métodos de análisis de la relación presión-diámetro o tensión-deformación
Requieren la medición o cuantificación de los cambios en presión y diámetro en un segmento arterial. Esto se realiza de manera: 1) secuencial, registrando una variable (por ejemplo, diámetro con ultrasonido) y luego la otra (por ejemplo, presión con tonometría), o 2) registrando el diámetro y obteniendo una onda de presión “calculada” a partir de la señal de diámetro recalibrada
- Obtención de ondas de diámetro y/o distensión arterial
La onda de diámetro suele obtenerse a partir del ultrasonido y (1) del análisis directo de la señal (radio-frecuencia) (por ejemplo sistemas Wall Track System(55), NIUS02(56), ART-LAB, Esaote)(57), o (2) procesamiento de imágenes (videos) adquiridas en Modo-B o Modo-M (por ejemplo sistema CarotidStudio) (58). Ambos abordajes han mostrado ser adecuados para determinar ondas de diámetro y/o espesores arteriales con fines diagnósticos, pero los primeros presentan una precisión seis a diez veces mayor (3). La detección de diámetros (y espesores) requiere de softwares automatizados como forma de evitar la medición manual, que ha sido ampliamente desaconsejada por su subjetividad y elevada variabilidad intra e interobservador(58).
- Obtención de ondas de presión arterial
La obtención de la onda de PA puede realizarse de manera directa o indirecta, empleando tonometría de aplanamiento (por ejemplo, Sphygmocor)(1). La medición directa se hace sobre la propia arteria de interés (por ejemplo, carótida, femoral, radial). La indirecta se hace cuando la arteria de interés no es superficial (por ejemplo, raíz aórtica), y requiere que la onda de PA de interés se derive matemáticamente (funciones transferencia) a partir del registro directo de una onda periférica (por ejemplo, obtención de la onda aórtica a partir del registro radial)(1). Como se mencionó, otros métodos validados, menos usados, permiten obtener la onda de PA (por ejemplo, recalibración de la onda de diámetro)(59,60).
Una vez obtenidas, las ondas deben calibrarse con unidades clínicas de presión (mmHg). El abordaje más usado para ello asume que en una persona acostada los niveles de PAD y PAM son similares en todas las arterias. Así, y considerando como ejemplo las ondas obtenidas por tonometría que se encuentran en milivoltios (mV), al nivel medio (integral del área) y mínimo en mV de la onda registrada se le asignan el valor de PAM calculado (PAM= PAD+[PP/3]) y PAD medido, respectivamente, en la arteria braquial (esfigmomanometría).. El valor de PAS que se adjudicará a la onda medida resulta de la ecuación que relaciona los niveles en mV y en mmHg(1,59,60).
- ¿Qué parámetros evalúan la RA local a partir del registro de diámetro y presión?
2. Métodos de análisis de oscilaciones locales de presión arterial (oscilométricos)
Existen métodos incluidos en equipos comercialmente disponibles (por ejemplo, PeriScope) (tabla 3) que derivan información relacionada con la RA local a partir del registro y análisis de señales oscilométricas resultantes del uso de manguitos para medición de PA(61,62). Cuando los manguitos oscilométricos están inflados y ocluyendo la arteria (por ejemplo, braquial), continúan recibiendo “golpes” de las ondas de presión sanguínea. En esa condición de arteria colapsada (flujo detenido), los golpes hacen oscilar (variar) levemente la presión interna del manguito, obteniéndose ondas de oscilación de baja amplitud. Al desinflarse lentamente el manguito las ondas oscilatorias aumentan gradualmente su amplitud hasta alcanzar un pico y luego nuevamente se atenúan. Así, puede obtenerse un “perfil de oscilación” (oscilograma) durante el desinflado. Con la técnica oscilométrica y de manera simplificada estos perfiles son utilizados para determinar la PA. Al respecto: a) la PAM es la PA correspondiente en la máxima oscilación, b) la PAS corresponde a la PA en la que se cruza una línea horizontal correspondiente a las amplitudes oscilatorias basales y la pendiente de ascenso del oscilograma, y c) la PAD es la presión correspondiente al “centro de masa” de las oscilaciones entre la PAM y la mínima oscilación detectada al finalizar el desinflado.
Adicionalmente, los “perfiles de oscilación” se relacionan con la “compresibilidad” o RA local. Si una arteria tiene elevada RA, para un determinado cambio de PA el cambio en volumen será pequeño, traduciéndose esto en que la pared arterial “vibrará poco” y consecuentemente hará “oscilar” poco al manguito. En una arteria con RA normal el perfil de oscilación tiene forma de “campana”, mientras que en una arteria con elevada RA el perfil se aplana. El equipo PeriScope (tabla 3) cuantifica el “índice de rigidez” (ASI) como la resta entre la PA por encima y la PA por debajo de la PAM cuando las oscilaciones alcanzan 80% del máximo (figura 3, F).
Niveles de referencia y de corte para la RA local
Diversos grupos han trabajado para determinar niveles de referencia en función de sus particulares formas de medición de la RA local. No existen valores de consenso universal. En nuestro país, en CUiiDARTE, se han arribado a valores de normalidad-referencia para la población uruguaya(63).
Bibliografía
1. Nichols WW, O’Rourke MF, eds. McDonald’s Blood Flow in Arteries: Theoretical, Experimental and Clinical Principles. 5th ed. London: Hodder Arnold; 2005.
2. Willum-Hansen T, Staessen J, Torp-Pedersen C, Rasmussen S, Thijs L, Ibsen H, et al. Prognostic value of aortic pulse wave velocity as index of arterial stiffness in the general population. Circulation 2006;113(5):664-70.
3. Laurent S, Cockcroft J, Van Bortel L, Boutouyrie P, Giannattasio C, Hayoz D, et al. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J 2006; 27(21):2588-605.
4. Vlachopoulos C, Aznaouridis K, Stefanadis C. Prediction of cardiovascular events and all-cause mortality with arterial stiffness: a systematic review and meta-analysis. J Am Coll Cardiol 2010 30;55(13):1318-27.
5. Boutouyrie P, Vermersch S, Laurent S, Briet M. Cardiovascular risk assessment through target organ damage: role of carotid to femoral pulse wave velocity. Clin Exp Pharmacol Physiol 2008;35(4):530-3.
6. Arnett D, Evans G, Riley W. Arterial stiffness: a new cardiovascular risk factor? Am J Epidemiol 1994; 140(8):669–82.
7. Blacher J, Guerin AP, Pannier B, Marchais SJ, Safar ME, London GM. Impact of aortic stiffness on survival in end-stage renal disease. Circulation 1999; 99(18): 2434–9.
8. Laurent S, Boutouyrie P, Asmar R, Gautier I, Laloux B, Guize L, et al. Aortic stiffness is an independent predictor of all-cause and cardiovascular mortality in hypertensive patients. Hypertension 2001;37(5):1236-41.
9. Wang TJ. Assessing the role of circulating, genetic, and imaging biomarkers in cardiovascular risk prediction. Circulation 2011; 123(5): 551–565.
10. Mitchell GF, Hwang SJ, Vasan RS, Larson MG, Pencina MJ, Hamburg NM, et al. Arterial stiffness and cardiovascular events: the Framingham Heart Study. Circulation 2010 2;121(4):505-11.
11. Guerin AP, Blacher J, Pannier B, Marchais SJ, Safar ME, London GM. Impact of aortic stiffness attenuation on survival of patients in end-stage renal failure. Circulation 2001; 103(7):987-92.
12. Laurent S, Briet M, Boutouyrie P. Arterial stiffness as surrogate end point: needed clinical trials. Hypertension 2012;60(2):518-22.
13. Zócalo Y, Bia D, Farro I, Torrado J, Farro F, Armentano R, et al. Presión aórtica central y parámetros de reflexión de onda Importancia clínica y análisis de consistencias y discrepancias con niveles de presión periférica. Rev Urug Cardiol 2012; 27: 418-30.
14. Avolio A. Arterial Stiffness. Pulse 2013;1:14–28
15. Bia D, Aguirre I, Zócalo Y, Devera L, Cabrera Fischer E, Armentano R. Regional differences in viscosity, elasticity and wall buffering function in systemic arteries: pulse wave analysis of the arterial pressure-diameter relationship. Rev Esp Cardiol 2005;58(2):167-74.
16. Bia D, Zócalo Y, Armentano R, Camús J, de Forteza E, Cabrera E. The adventitia reduces left ventricular dynamic afterload via smooth muscle activation-dependent mechanisms. Rev Esp Cardiol 2007;60(5):501-9.
18. Li Y, Wang JG, Dolan E, Gao PJ, Guo HF, Nawrot T, et al. Ambulatory arterial stiffness index derived from 24-hour ambulatory blood pressure monitoring. Hypertension 2006 ;47(3):359-64.
19. Westerhof N, Lankhaar J, Westerhof B. The arterial Windkessel. Med Biol Eng Comput 2009;47(2):131-41.
20. Westerhof N, Elzinga G, Sipkema P. An artificial arterial system for pumping hearts. J Appl Physiol 1971; 31(5): 776–81.
21. Stergiopulos N, Westerhof BE, Westerhof N. Total arterial inertance as the fourth element of the windkessel model. Am J Physiol 1999; 276 (1Pt 2):81–8.
22. Finkelstein SM, Collins VR, Cohn JN. Arterial vascular compliance response to vasodilators by Fourier and pulse contour analysis. Hypertension 1988;12(4):380-7.
23. Chemla D, Hebert J, Coirault C, Zamani K, Suard I, Colin P, et al. Total arterial compliance estimated by stroke volume-to-aortic pulse pressure ratio in humans. Am J Physiol 1998; 274 (2 Pt 2):500–5.
24. Zimlichman R, Shargorodsky M, Boaz M, Duprez D, Rahn KH, Rizzoni D, et al. Determination of arterial compliance using blood pressure waveform analysis with the CR-2000 system: reliability, repeatability, and establishment of normal values for healthy European population—the seven European sites study (SESS). Am J Hypertens 2005;18(1): 65-71.
25. Liu Z, Brin K, Yin F. Estimation of total arterial compliance: an improved method and evaluation of current methods. Am J Physiol 1986; 251 (3 Pt 2): 588–600.
26. Remington JW, Nobach CR, Hamilton W, Gold J. Volume elasticity characteristics of the human aorta and the prediction of stroke volume from the pressure pulse. Am J Physiol 1948; 153(2): 198–308.
27. de Simone G, Roman M, Koren MJ, Mensah GA, Ganau A, Devereux RB. Stroke volume/pulse pressure ratio and cardiovascular risk in arterial hypertension. Hypertension 1999;33(3):800-5.
28. Bogert LW, van Lieshout JJ. Non-invasive pulsatile arterial pressure and stroke volume changes from the human finger. Exp Physiol 2005; 90(4):437-46.
29. Jansen J, Schreuder J, Mulier J, Smith N, Settels J, Wesseling K. A comparison of cardiac output derived from the arterial pressure wave against thermodilution in cardiac surgery patients. Br J Anaesth 2001;87(2):212-22.
30. Tromp W, Groothoff JW, Lilien MR, Raes AR, Offringa M, van der Lee J. Chapter 3: Clinimetric characteristics of instruments that measure pulse wave velocity in adults and children are poorly reported: a systematic review [monografía en Internet].Amsterdam: University of Amsterdam;2011 [consultado 9 Mar 2014]. Obtenido de: http://dare.uva.nl/document/342010
31. Millasseau S, Stewart A, Patel S, Redwood S, Chowienczyk P. Evaluation of carotid-femoral pulse wave velocity: influence of timing algorithm and heart rate. Hypertension 2005;45(2):222-6.
32. Farro I, Bia D, Zócalo Y, Torrado J, Farro F, Florio L, et al. Pulse wave velocity as marker of preclinical arterial disease: reference levels in a uruguayan population considering wave detection algorithms, path lengths, aging, and blood pressure. Int J Hypertens 2012;2012:169359. doi: 10.1155/2012/ 169359
33. Sugawara J, Hayashi K, Yokoi T, Tanaka H. Carotid-Femoral Pulse Wave Velocity: Impact of Different Arterial Path Length Measurements. Artery Res 2010;4(1):27-31.
34. Van Bortel LM, Laurent S, Boutouyrie P, Chowienczyk P, Cruickshank JK, De Backer T, et al. Expert consensus document on the measurement of aortic stiffness in daily practice using carotid-femoral pulse wave velocity. J Hypertens 2012;30(3):445-8.
35. Bossuyt J, Van De Velde S, Azermai M, Vermeersch SJ, De Backer TL, Devos DG, et al. Noninvasive assessment of carotid-femoral pulse wave velocity: the influence of body side and body contours. J Hypertens 2013;31(5):946-51.
36. Yamashina A, Tomiyama H, Takeda K, Tsuda H, Arai T, Hirose K, et al. Validity, reproducibility, and clinical significance of noninvasive brachial-ankle pulse wave velocity measurement. Hypertens Res 2002;25(3):359-64.
37. Gosse P, Guillo P, Ascher G, Clementy J. Assessment of arterial distensibility by monitoring the timing of Korotkoff sounds. Am J Hypertens 1994;7(3):228-33.
38. Lee M, Chu C, Lee K, Wu C, Su H, Lin S, et al. Validation of a new index for estimating arterial stiffness: measurement of the QPV interval by Doppler ultrasound. Clin Cardiol 2006 29(8):345-51.
39. Shirai K, Utino J, Otsuka K, Takata M. A novel blood pressure-independent arterial wall stiffness parameter; cardio-ankle vascular index (CAVI). J Atheroscler Thromb 2006;13(2):101-7.
40. Shirai K, Hiruta N, Song M, Kurosu T, Suzuki J, Tomaru T, et al. Cardio-ankle vascular index (CAVI) as a novel indicator of arterial stiffness: theory, evidence and perspectives. J Atheroscler Thromb 2011;18(11):924-38.
41. Hayashi K, Handa H, Nagasawa S, Okumura A, Moritake K. Stiffness and elastic behavior of human intracranial and extracranial arteries. J Biomech 1980;13(2):175-84.
42. Kawasaki T, Sasayama S, Yagi S, Asakawa T, Hirai T. Non-invasive assessment of the age related changes in stiffness of major branches of the human arteries. Cardiovasc Res 1987 Sep;21(9):678-87.
43. Xu D, Ryan KL, Rickards CA, Zhang G, Convertino VA, Mukkamala R. Improved pulse transit time estimation by system identification analysis of proximal and distal arterial waveforms. Am J Physiol Heart Circ Physiol 2011;301(4):H1389-95.
44. Millasseau SC, Ritter JM, Takazawa K, Chowienczyk PJ. Contour analysis of the photoplethysmographic pulse measured at the finger. J Hypertens 2006 (8);24:1449-56.
45. Chowienczyk P, Kelly R, MacCallum H, Millasseau S, Andersson T, Gosling R, et al. Photoplethysmographic assessment of pulse wave reflection: blunted response to endothelium-dependent beta2-adrenergic vasodilation in type II diabetes mellitus. J Am Coll Cardiol 1999;34(7):2007-14.
46. Millasseau SC, Kelly RP, Ritter JM, Chowienczyk PJ. Determination of age-related increases in large artery stiffness by digital pulse contour analysis. Clin Sci (Lond). 2002;103(4):371-7.
47. Wassertheurer S, Kropf J, Weber T, van der Giet M, Baulmann J, Ammer M, et al. A new oscillometric method for pulse wave analysis: comparison with a common tonometric method. J Hum Hypertens 2010;24(8):498-504.
48. Weber T, Wassertheurer S, Rammer M, Haiden A, Hametner B, Eber B. Wave reflections, assessed with a novel method for pulse wave separation, are associated with end-organ damage and clinical outcomes. Hypertension 2012;60(2):534-41.
49. Hametner B, Wassertheurer S, Kropf J, Mayer C, Eber B, Weber T. Oscillometric estimation of aortic pulse wave velocity: comparison with intra-aortic catheter measurements. Blood Press Monit 2013;18(3):173-6.
50. Luzardo L, Lujambio I, Sottolano M, da Rosa A, Thijs L, Noboa O, et al. 24-h ambulatory recording of aortic pulse wave velocity and central systolic augmentation: a feasibility study. Hypertens Res 2012;35(10):980-7.
51. Qasem A, Avolio A. Determination of aortic pulse wave velocity from waveform decomposition of the central aortic pressure pulse. Hypertension 2008;51(2):188-95.
52. Ibrahim el-SH, Johnson K, Miller A, Shaffer J, White R. Measuring aortic pulse wave velocity using high-field cardiovascular magnetic resonance: comparison of techniques. J Cardiovasc Magn Reson 2010;12(1):26.
53. Boutouyrie P, Vermeersch S. Reference Values for Arterial Stiffness’ Collaboration. Determinants of pulse wave velocity in healthy people and in the presence of cardiovascular risk factors: establishing normal and reference values. Eur Heart J 2010;31(19):2338-50.
54. van Sloten T, Schram M, van den Hurk K, Dekker J, Nijpels G, Henry R, et al. Local stiffness of the carotid and femoral artery is associated with incident cardiovascular events and all-cause mortality – The Hoorn Study –. J Am Coll Cardiol 2014 (En prensa).
55. Hoeks AP, Brands PJ, Smeets FA, Reneman RS. Assessment of the distensibility of superficial arteries. Ultrasound Med Biol 1990;16():121–128.
56. Tardy Y, Meister JJ, Perret F, Brunner HR, Arditi M. Non-invasive estimate of the mechanical properties of peripheral arteries from ultrasonic and photoplethysmographic measurements. Clin Phys Physiol Meas 1991;12(1):39–54.
57. Beaussier H, Masson I, Collin C, Bozec E, Laloux B, Calvet D, et al. Carotid plaque, arterial stiffness gradient, and remodeling in hypertension. Hypertension 2008;52(4):729-36.
58. Bianchini E, Bozec E, Gemignani V, Faita F, Giannarelli C, Ghiadoni L, et al. Assessment of carotid stiffness and intima-media thickness from ultrasound data: comparison between two methods. J Ultrasound Med 2010; 29(8):1169-75.
59. Vermeersch S, Rietzschel E, De Buyzere M, De Bacquer D, De Backer G, VanBortel L, et al. Determining carotid artery pressure from scaled diameter waveforms: comparison and validation of calibration techniques in 2026 subjects. Physiol Meas 2008;29(11):1267-80.
60. Kips J, Vanmolkot F, Mahieu D, Vermeersch S, Fabry I, de Hoon J, et al. The use of diameter distension waveforms as an alternative for tonometric pressure to assess carotid blood pressure. Physiol Meas 2010;31(4):543-53.
61. Komine H, Asai Y, Yokoi T, Yoshizawa M. Non-invasive assessment of arterial stiffness using oscillometric blood pressure measurement. Biomed Eng Online. 2012;11: 6. doi: 10.1186/1475- 925X-11-6.
62. Naidu M, Reddy B, Yashmaina S, Patnaik A, Rani P. Validity and reproducibility of arterial pulse wave velocity measurement using new device with oscillometric technique: a pilot study. Biomed Eng Online 2005;4:49. doi: 10.1186/1475-925X-4-49
63. Bia D, Zócalo Y, Farro I, Torrado J, Farro F, Florio L, et al. Age-Related Changes in Structural and Functional Vascular Parameters Used to Assess Arterial Aging, Subclinical Atherosclerosis, and Cardiovascular Risk in Uruguayan Adults: CUiiDARTE Project. Int J Hypertens 2011;2011:587303.
64. Karamanoglou M, O’Rourke MF, Avolio AP, Kelly RP. An analysis of the relationship between central aortic and peripheral upper limb pressure waves in man. Eur Heart J 1993;14(2):160-7.
65. Salvi P, Lio G, Labat C, Ricci E, Pannier B, Benetos A. Validation of a new non-invasive portable tonometer for determining arterial pressure wave and pulse wave velocity: the PulsePen device. J Hypertens 2004;22(12):2285-93.
66. Asmar R, Topouchian J, Pannier B, Benetos A, Safar M. Pulse wave velocity as endpoint in large-scale intervention trial. The Complior study. Scientific, Quality Control, Coordination and Investigation Committees of the Complior Study. J Hypertens 2001;19(4):813-8.
67. Jiang B, Liu B, McNeill KL, Chowienczyk PJ. Measurement of pulse wave velocity using pulse wave Doppler ultrasound: comparison with arterial tonometry. Ultrasound Med Biol 2008;34(3):509-12.
68. Millasseau S, Guigui F, Kelly R, Prasad K, Cockcroft J, Ritter J, et al. Non-invasive assessment of the digital volume pulse: comparison with the peripheral pressure pulse. Hypertension 2000; 36:952-6
69. Kracht D, Shroff R, Baig S, Doyon A, Jacobi C, Zeller R, et al. Validating a new oscillometric device for aortic pulse wave velocity measurements in children and adolescents. Am J Hypertens 2011;24(12):1294-9.
70. Müller J, Oberhoffer R, Barta C, Hulpke-Wette M, Hager A. Oscillometric carotid to femoral pulse wave velocity estimated with the Vicorder device. J Clin Hypertens (Greenwich) 2013;15(3):176-9.
71. Horváth I, Németh A, Lenkey Z, Alessandri N, Tufano F, Kis P, et al. Invasive validation of a new oscillometric device (Arteriograph) for measuring augmentation index, central blood pressure and aortic pulse wave velocity. J Hypertens 2010; 28(10):2068-75.
72. Nürnberger J, Michalski R, Türk T, Opazo Saez A, Witzke O, Kribben A. Can arterial stiffness parameters be measured in the sitting position? Hypertens Res 2011;34(2):202-8.
73. Ageenkova O, Purygina M. Central aortic blood pressure, augmentation index, and reflected wave transit time: reproducibility and repeatability of data obtained by oscillometry. Vasc Health Risk Manag 2011;7:649-56. doi: 10.2147/VHRM.S24877














