Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.28 no.3 Montevideo dic. 2013
Artículo de revisión
Angioplastia primaria en el infarto agudo de miocardio
Dres. Ignacio Batista1, Santiago Alonso2, Jorge Mayol3
1. Cardiólogo Intervencionista del Centro Cardiológico Americano - Sanatorio Americano. Asistente del Departamento de Cardiología. Hospital de Clínicas. UDELAR.
2. Cardiólogo Intervencionista del Centro Cardiológico Americano - Sanatorio Americano.
3. Cardiólogo Intervencionista, Co-Director del Servicio de Hemodinamia del Centro Cardiológico Americano. Sanatorio Americano.
Correspondencia: Dr. Jorge Mayol. Servicio de Hemodinamia e Intervencionismo Cardiovascular del Centro Cardiológico Americano. Sanatorio Americano. Isabelino Bosch 2466, Montevideo 11600, Uruguay.
Correo electrónico: mayol.jorge@gmail.com
Palabras clave:
INFARTO DEL MIOCARDIO-terapia
ANGIOPLASTIA-métodos
ANGIOPLASTIA-efectos adversos
REPERFUSIóN MIOCáRDICA
Key words:
MYOCARDIAL INFARCTION-therapy
ANGIOPLASTY-methods
ANGIOPLASTY-adverse effects
MYOCARDIAL REPERFUSION
Introducción
Las primeras experiencias sobre reperfusión en el infarto agudo de miocardio (IAM) en Uruguay datan del año 1983, con el uso de fibrinolíticos (FBL) sistémicos (1). Poco después, el Dr. Fausto Buitrón introdujo la angioplastia coronaria (ATC) y desde el inicio abordó a pacientes con IAM (2). Sin embargo, recién en el año 2006 se publicó una experiencia de alcance nacional con ATC en el IAM, con la aparición del Registro Nacional del Tratamiento Intervencionista del Infarto Agudo de Miocardio en Uruguay (RENATIA), impulsado por el Comité de Hemodinamia de la Sociedad Uruguaya de Cardiología(3,4). Este registro, presentado por primera vez en el Congreso Uruguayo de Cardiología del año 2003, fue un estudio observacional, multicéntrico y prospectivo, que contó con la participación de todos los centros de cardiología intervencionista del país, con el objetivo de valorar los resultados de la ATC primaria (ATC1ª) en Uruguay. Se ingresaron 306 pacientes cursando un IAM de < 12 horas, tratados con ATC1ª entre abril de 2001 y octubre de 2002, con seguimiento telefónico al año. El 50% de los mismos fueron pacientes derivados de hospitales sin capacidad para hemodinamia. Se comprobó una baja mortalidad intrahospitalaria (5%), a los 30 días (7%), y a los 6 meses (12%) en el global de pacientes, al igual que una tasa de eventos adversos similares a la de registros internacionales. Los resultados demostraron la factibilidad y seguridad de la ATC1ª en Uruguay, pero el número de pacientes que accedían a esta estrategia de reperfusión estaba por debajo de lo esperado.
Desde la descripción de la primera ATC en el IAM por el Dr. Geofrey Harzler, ya han transcurrido 30 años(5) y desde la elaboración de RENATIA más de 10, por lo que resulta oportuno actualizar la evidencia científica sobre esta terapéutica, sus indicaciones y resultados en los diferentes escenarios clínicos.
En el presente trabajo abordamos estos temas, quedando para una segunda entrega el análisis de la casuística de la ATC1ª en nuestro país en los últimos nueve años.
I. Las opciones de reperfusión en el IAM
El tratamiento de reperfusión coronaria tiene por objetivo la restauración del flujo coronario normal en la arteria responsable del infarto agudo de miocardio con elevación del ST (IAMcST). Esto puede alcanzarse mediante la intervención coronaria percutánea primaria o ATC1ª (6) o la terapia fibrinolítica y ambas estrategias mejoran los resultados clínicos en casi todos los grupos de pacientes. Respecto a los FBL, se ha demostrado que fallan en restablecer la permeabilidad de la arteria coronaria involucrada en un 20% a 45% de los casos, según el fármaco utilizado(7). Por otra parte, luego de una fibrinólisis exitosa, la reoclusión coronaria suele ocurrir precozmente en 5% a 10% de los pacientes y en forma tardía en 30% de los casos(8,9).
Por su lado, la ATC1ª obtiene tasas de éxito en la reperfusión significativamente más elevadas que los FBL, dado que alcanza a restablecer un flujo coronario normal (flujo TIMI grado 3) en más de 90% de los pacientes, comparándose a 50%-60% que se logra a los 60-90 minutos de administrados los FBL(10). Los estudios clínicos con la terapia fibrinolítica han demostrado que los beneficios de la reperfusión, como la mejoría en la sobrevida y en la función ventricular izquierda, tienen buena correlación con la restauración de un flujo coronario epicárdico normal (TIMI 3), pero no así con grados de flujo inferiores (TIMI 0, 1 y 2)(11-14).
La comparación entre ambas estrategias en escenarios clínicos semejantes, permite concluir que la ventaja de la estrategia de ATC1ª está dada por una reducción relativa de la mortalidad de 30% a los 30 días (5,3% frente a 7,4%; OR 0,70; IC95%, 0,58-0,84)(15). Cuando se la compara con los fibrinolíticos fibrinoespecíficos, como el alteplase acelerado, la ATC1ª también tiene ventaja dado que logra una reducción relativa de la mortalidad de 19% (5,5% frente a 6,8%; OR 0,81; IC95%, 0,64-1,0)(16), sin incremento del riesgo de sangrado cerebral(17).
Por lo tanto, la ATC1ª es la terapia de reperfusión de elección en la mayoría de los pacientes con IAMcST durante las 12 primeras horas de iniciados los síntomas, incluyendo al infarto con nuevo o presumiblemente nuevo bloqueo completo de rama izquierda o el infarto posterior. Así lo recomiendan las recientes guías de práctica clínica del Colegio Americano de Cardiología / Asociación Americana del Corazón del 2013 y las de la Sociedad Europea de Cardiología del 2012(18,19).
Sin embargo, dado que no todos las hospitales tienen la capacidad de realizar oportunamente una ATC1ª, en muchos pacientes es necesario tomar la decisión entre la administración de un fibrinolítico localmente o trasladarlo para una intervención percutánea primaria. Como el beneficio de la reperfusión, ya sea con ATC1ª o FBL, desciende rápidamente con el tiempo, la decisión por una de estas estrategias debe tomarse lo antes posible(8). Sobre la base de datos de ensayos aleatorizados, la ATC1ª se prefiere si se realiza de manera oportuna y por un operador experto(8-11). Sin embargo, la elección es más difícil cuando la intervención percutánea implica un traslado a otro hospital, principalmente cuando la consulta es dentro de las tres primeras horas del inicio de los síntomas (véase el algoritmo de la figura 6).
II. Definiendo una estrategia de reperfusión
Cuando se encuentra disponible en tiempos adecuados y cumpliendo con los estándares de calidad, la ATC1ª es la estrategia de reperfusión preferida para la mayoría de los pacientes con IAMcST. El procedimiento debe realizarse con rapidez, en un tiempo puerta-balón de menos de 90 minutos.
Como también hay circunstancias en que la reperfusión con terapia fibrinolítica es considerada una alternativa razonable, analizaremos los factores a tener en cuenta para una correcta toma de decisiones(13-15).
1. Demora vinculada con la ATC1ª
Los resultados alcanzados mediante ambos tratamientos (FBL y ATC1ª) empeoran en la medida que aumenta la demora en su inicio. Del mismo modo, el retraso para el inicio de la ATC1ª reduce el beneficio relativo de esta frente a los FBL. La siguiente terminología se emplea para definir los tiempos de tratamiento.
- Tiempo puerta-aguja: es el tiempo entre la presentación en el hospital o ambulancia (momento que se hace el diagnóstico de IAMcST) y la administración del tratamiento fibrinolítico.
- Tiempo puerta-balón: es el tiempo entre la presentación en el hospital o ambulancia y el momento en insuflar el primer balón durante la ATC.
- Retraso relacionado a la ATC1ª: es la diferencia entre el tiempo puerta-balón y el tiempo puerta-aguja. El retraso vinculado a la ATC1ª sobreestima el retardo a la reperfusión, ya que la reperfusión por ATC es inmediata mientras que la terapia fibrinolítica generalmente demora aproximadamente 30 minutos.
El impacto de la demora a la ATC1ª en la supervivencia ha sido valorado tanto en ensayos aleatorizados como en estudios observacionales. En la revisión del año 2003 de 23 ensayos aleatorizados de ATC1ª versus FBL (7.739 pacientes), la magnitud del beneficio en la supervivencia disminuyó a medida que el tiempo relacionado a la ATC1ª se incrementó. Cuando el retraso a la ATC1ª era mayor a 62 minutos, desaparecía la ventaja sobre la FBL(20). En 13 ensayos que evaluaron el criterio de valoración combinado (muerte, reinfarto o ictus) a las cuatro a seis semanas (4.946 pacientes) cada retardo adicional de 10 minutos en el tiempo puerta-balón, sobre el tiempo puerta-aguja, redujo el beneficio absoluto de la ATC1ª en 1,17%. Las dos estrategias se hacían equivalentes en relación con el criterio de valoración combinado cuando el retardo a ATC1ª alcanzaba 93 minutos (figura 1).
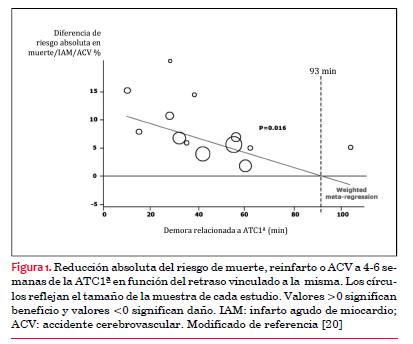
(20)
Sin embargo, en el mundo real las decisiones pueden ser mas difíciles, especialmente en centros asistenciales distantes a una sala de hemodinamia y carentes de programas de FBL, lo que obliga a traslados innecesarios para la reperfusión (tanto FBL como ATC1ª) agregando demoras perjudiciales. Esto preocupa particularmente en ciudades pequeñas del interior del país, donde se registran tiempos de consulta (dolor-puerta) más breves a los registrados en grandes ciudades, presentándose una buena cantidad de pacientes en “la hora de oro”.
Estas dificultades también se observan en países como Estaos Unidos, donde el retraso relacionado a ATC1ª es mayor al recomendado por las guías de práctica clínica o los observados en los ensayos clínicos(20-23). En un registro publicado en 2011, el 68% los pacientes trasladados para ATC1ª presentaron retrasos mayores a 90 minutos, con un tiempo medio puerta-balón de 161 minutos y un tiempo medio puerta-aguja de 35 minutos(23). El análisis multivariado no encontró ventaja alguna en mortalidad de la ATC1ª sobre la fibrinólisis cuando el retraso vinculado a ATC superaba los 120 minutos. Para los grupos de pacientes con retraso a ATC1ª de < 60 y de 60 a 90 minutos, la mortalidad hospitalaria favoreció a la ATC1ª (2,7 versus 7,4 y 3,6 versus 5,5%, respectivamente), mientras que las tasas fueron similares para el grupo de pacientes con retardo a ATC1ª > 90 minutos (5,7 versus 6,1%, respectivamente).
2. Factores vinculados al paciente
A pesar de los esfuerzos por identificar un modelo temporal único que guíe la selección de la mejor estrategia de reperfusión, (por ejemplo: diferencia puerta/balón - puerta/aguja > 60 minutos), hay estudios que muestran una gran variabilidad en la evolución clínica de los pacientes según algunas características que pueden modificar dicha selección. Factores como la edad, la duración de los síntomas o la topografía del IAM modulan el beneficio relativo de ambas estrategias(23).
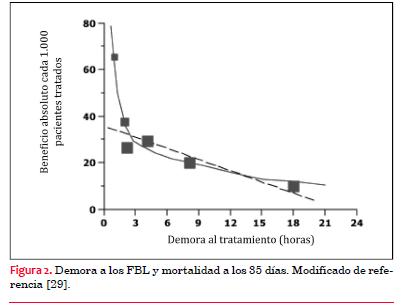
a) Cuanto menor es la duración de los síntomas, menos aceptables son las demoras en los traslados a ATC. Como demostró Boersma en 1996, el paso de las horas genera una mayor resistencia a la fibrinólisis (figura 2) reduciéndose progresivamente el beneficio en sobrevida. Luego de las dos horas de inicio de los síntomas, el beneficio con el tratamiento FBL se reduce aproximadamente en 1,6 vidas por 1.000 pacientes tratados por hora. Luego de tres horas la recuperación miocárdica y la reducción de la mortalidad son aun menos sensibles al tiempo. Por este motivo, los pacientes con más de tres horas de evolución y con un retraso estimado mayor de 60 minutos podrían ser tratados mediante una ATC1ª.
(29)
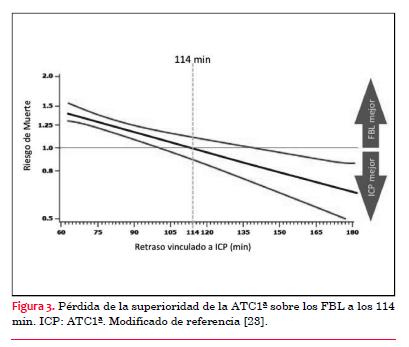
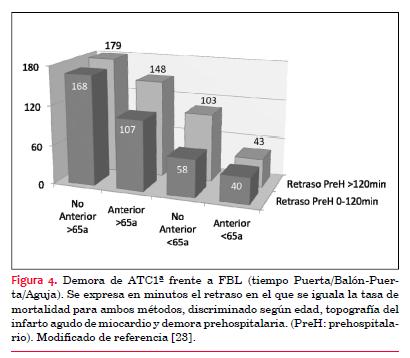
b) Cuanto más jóvenes son los pacientes, menos aceptable es la demora en el traslado a ATC1ª. El punto de “equilibrio” se produce a los 71 minutos de demora en los pacientes <65 años y a los 155 minutos en pacientes ³65 años (figura 3 y figura 4). Esto significa que con cualquier retraso relacionado a la ATC1ª mayor que estos valores, la probabilidad de supervivencia ya no sería mejor que con los FBL. Esto puede ser consecuencia de que la fibrinólisis tiene una mayor tasa de complicaciones en pacientes de edad avanzada.
(23)
(23)
c) Los infartos de topografía anterior pierden la ventaja de la ATC1ª con retrasos más cortos que los pacientes con infartos no anteriores (figura 4).
3. Factores no vinculados al paciente
Los factores no relacionados al paciente que parecen aumentar el retardo a la ATC1ª, son los tiempos de transferencia puerta a puerta y la presentación fuera de horarios normales de trabajo.
En el NRMI (National Registry of Myocardial Infarction), la mediana del tiempo de transferencia de puerta a puerta fue de 120 minutos, en lugar de los 30 minutos observado en los ensayos aleatorizados(24). También se evaluó la relación entre el momento de presentación de un paciente y la demora al tratamiento en 68.439 pacientes tratados por IAMcST con FBL o ATC1ª (25). Entre los pacientes que se presentan “fuera de hora” (días laborables entre 5 p.m. a 7 a.m. y fines de semana), hubo un aumento significativo en el tiempo a la ATC1ª (puerta-balón de 116 versus 95 minutos). El tiempo al FBL no varió (34 frente a 33 minutos). Los autores del estudio concluyen que los hospitales que proveen servicios de ATC1ª (365días/7días/24horas) deben comprometerse a ofrecer en forma permanente una igual celeridad en el abordaje de estos pacientes.
4. Tiempo desde el inicio de los síntomas
Comprender la relación temporal entre la aparición de los síntomas, la reperfusión, el rescate del miocardio y la mortalidad es fundamental para la selección de una estrategia de reperfusión adecuada(26-28).
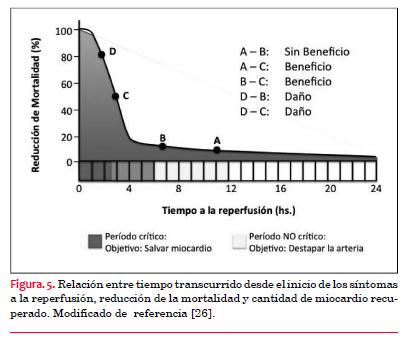
a) Las primeras tres horas
Los pacientes que se presentan £3 horas del inicio de los síntomas son quienes tienen la mejor oportunidad para la franca recuperación del miocardio y lograr una reducción significativa de la mortalidad. Gráficamente se agrupan en la parte inicial de la curva de sobrevida frente al tiempo de reperfusión (figura 5)(26,27,29). Esto ocurre porque la terapia fibrinolítica tiene la mayor eficacia en repermeabilizar la arteria relacionada con el infarto y porque la masa de miocardio aún viable es mayor. Cuando el tiempo desde el inicio de los síntomas es £3 horas y no se puede realizar ATC1ª dentro de los 90 minutos, el tratamiento con FBL tiene ventajas. Por otro lado, cuando la ATC1ª puede realizarse dentro de 90 minutos, esta puede restaurar el flujo normal en más de 90% de los pacientes mientras que los FBL lo logran aproximadamente en 50%.
(26)
Un paciente que consulta precozmente, pero tiene un retraso importante en la transferencia para la ATC1ª (mayor de 90 minutos), puede perder rápidamente la oportunidad de una reperfusión exitosa. El valor de la reperfusión precoz con FBL fue establecido por un metaanálisis de 22 ensayos que incluyó a 50.246 pacientes(29). El beneficio absoluto con la terapia fibrinolítica, en comparación con placebo o control, fue mayor en los pacientes tratados dentro de la primera hora de inicio de los síntomas. El mismo se reduce drásticamente y se mantiene plano en los pacientes tratados entre la primera y la segunda hora, la segunda a la tercera, y la tercera a la sexta hora.
La evidencia de una posible ventaja de la fibrinólisis sobre la ATC1ª en pacientes que consultan precozmente proviene del análisis de subgrupos de tres ensayos aleatorizados, dos de los cuales evaluaron la eficacia de la fibrinólisis prehospitalaria. Estos fueron el CAPTIM(30), el MITI(31) y el ASSENT-3(32), de los que se concluye que para los pacientes que se presentan dentro de las tres horas de aparición de los síntomas, la elección entre la terapia fibrinolítica y ATC1ª depende de la demora prevista para ATC1ª. Cuando el tiempo estimado entre la consulta inicial en un hospital con capacidad de ATC y el inflado del balón sea menos de 90 minutos, o cuando el retardo estimado entre la presentación en un hospital sin capacidad de ATC y el inflado del balón sea menor de 120 minutos, se recomienda ATC1ª(33-35). Estas recomendaciones coinciden con las realizadas por el Colegio Americano de Cardiología / Asociación Americana del Corazón (2013) y la Sociedad Europea de Cardiología (2012)(12,13).
b) Entre las tres y las doce horas
Aproximadamente la mitad de los pacientes con IAMcST se presentan con más de tres a cuatro horas del inicio de los síntomas, por lo que se ubican en la parte más plana de la curva de supervivencia versus tiempo-a-reperfusión(36). En este período hay una mayor eficacia de la ATC1ª y una reducción del riesgo de accidente cerebrovascular en comparación con FBL, a pesar de un mayor tiempo requerido para la transferencia. Este retraso al traslado a la ATC1ª debe ser <90 minutos y preferiblemente <60 minutos en la mayoría de los casos.
c) Presentación luego de las doce horas
Los registros sugieren que del 9 al 31% de los pacientes con IAMcST consultan luego de las 12 horas de aparecidos los síntomas (37,38). Es improbable que la terapia fibrinolítica administrada en este momento mejore los resultados, ya que el beneficio es pequeño y probablemente superado por los riesgos. Sin embargo, la ATC1ª puede ser beneficiosa en pacientes seleccionados. Se dispone de muy poca evidencia dado que la mayoría de estos pacientes fueron excluidos de los ensayos más importantes.
La indicación de ATC1ª tardía (entre 12 y 24 horas) se plantea de acuerdo a la presentación clínica. En los pacientes sintomáticos o inestables existe consenso sobre un posible beneficio de la ATC en base a opinión de expertos. Entre los pacientes asintomáticos existen estudios aleatorizados que muestran mejoría de la función ventricular izquierda o el área del infarto, pero no en parámetros de valoración clínicos(39 ). En estos pacientes asintomáticos de presentación tardía se sugiere realizar una angiografía coronaria dentro de las 24 horas y proceder a ATC solo si la lesión de la arteria culpable es subtotal o en las oclusiones totales con buena circulación colateral distal.
4 Situaciones clínicas en las que se prefiere ATC1ª
a) Diagnóstico dudoso de IAM
Algunos pacientes presentan signos y síntomas presuntivos pero no definitivos para el diagnóstico de IAMcST. Los ejemplos incluyen historias atípicas que pudieran sugerir una pericarditis o un electrocardiograma (ECG) no diagnóstico que debiera aclararse rápidamente para definir la indicación de una estrategia de reperfusión. Cuando no están disponibles estudios como la ecocardiografía o la angiografía coronaria sería necesaria la transferencia para coronariografía y una eventual ATC inmediata si estuviera indicada.
b) Alto riesgo de hemorragia asociada a los fibrinolíticos
La terapia FBL implica un mayor riesgo de sangrado comparado con la ATC1ª. La hemorragia intracraneal es el más grave de estos riesgos y se presenta en 0,7% de los pacientes tratados con fibrinolíticos(17,40). Los pacientes con contraindicaciones para FBL representan un grupo de alto riesgo y, aunque no hay datos específicos para esta población, parecen beneficiarse de la ATC1ª(37).
c) Pacientes de muy alto riesgo
Los beneficios de la ATC1ª sobre la fibrinólisis son aun mayores en los pacientes de muy alto riesgo y en el shock cardiogénico(41 ,42 ).
Este punto se definió en un análisis de 16 ensayos aleatorizados que comparan ATC1ª con FBL(43 ). Según este estudio, cuando el incremento en el riesgo de mortalidad basal asciende de 4,4% a 12,4%, es aceptable un mayor retardo a la ATC que iría de 43 a 200 minutos. Dentro de estos, los pacientes con shock cardiogénico representan una población especialmente grave en los que la ATC1ª es preferible a la fibrinólisis. Si en estos pacientes la ATC1ª no está disponible en menos de 120 minutos, hay evidencia de que pueden beneficiarse de la administración de FBL, la colocación de un balón de contrapulsación y su transferencia para ATC. Los FBL no deben retrasar los arreglos para la transferencia urgente a ATC(44).
III. Angioplastia pos FBL
1. Angioplastia coronaria de rescate por fracaso de FBL
El fracaso primario de la fibrinólisis, definida en los ensayos clínicos como la oclusión persistente de la arteria relacionada con el infarto (TIMI grado 0/1) mediante angiografía realizada a los 90 minutos posinfusión del fibrinolítico, oscila entre 40% y 50%(10,11). Debe sospecharse clínicamente por la persistencia del dolor, inestabilidad hemodinámica o una renivelación del segmento ST < 50%.
La angioplastia coronaria de rescate se define como aquella ATC realizada dentro de las 12 horas de la fibrinólisis fallida (fallo primario) en pacientes con evidencia de isquemia persistente o recurrente(19). La angiografía permite evaluar el flujo coronario TIMI así como el flujo microvascular medido por el blush miocárdico, que son predictores de sobrevida a largo plazo(45 ). Varios estudios clínicos randomizados (RESCUE, MERLIN, REACT) y un metaanálisis evaluaron el beneficio de la angioplastia de rescate(46-49 ). Esta se debería plantear precozmente cuando a los 45 a 60 minutos de la fibrinólisis no existen criterios clínicos de reperfusión.
Los pacientes que más se benefician de la ATC de rescate son los de mayor riesgo, aquellos con shock cardiogénico, hipotensión significativa, insuficiencia cardíaca grave, ECG con evidencia de una extensa zona amenazada (región anterior o inferior con compromiso de ventrículo derecho o infradesnivel del ST en región anterior) o flujo TIMI £ 2. (Indicación clase II, nivel de evidencia B). Por otra parte, el tratamiento conservador podría ser razonable en un paciente con un infarto inferior con mejoría de los síntomas a pesar de persistencia de la elevación del ST (18,19).
En suma, luego de una fibrinólisis fallida se recomienda la angioplastia de rescate en lugar de la repetición de fibrinólisis o el tratamiento conservador. Si la angioplastia de rescate no puede realizarse dentro de las 12 horas, se sugiere tratamiento conservador frente a repetir la fibrinólisis.
2. Angioplastia coronaria por reoclusión pos FBL
Después de la fibrinólisis aparentemente exitosa por criterios clínicos, la recurrencia temprana de isquemia o cambios del segmento ST se ha observado en 20% a 30% de los pacientes, la reoclusión coronaria trombótica en 5% a 15%, y el reinfarto en 3% a 5%(50) . En los estudios GUSTO I-II-III, TIMI e InTIME, el reinfarto ocurrió en 4,3% de los pacientes con una media de dos a cuatro días después de los fibrinolíticos y fue independiente del agente fibrinolítico utilizado(51 ). Estos pacientes tienen un peor pronóstico con una mayor mortalidad a los 30 días y al año; la mortalidad hospitalaria disminuye cuando se les realiza una angioplastia coronaria de rescate (23,6% en tratamiento médico conservador versus 5,2% con angioplastia de rescate) (52,53).
En suma, para los pacientes con evidencia de reoclusión después de la fibrinólisis exitosa, se sugiere la angioplastia coronaria en lugar del tratamiento conservador.
3. Angioplastia coronaria facilitada
Consiste en la angioplastia coronaria de la arteria causante del infarto en las 12 primeras horas, de forma rutinaria y planeada, en los pacientes tratados inicialmente con una terapia farmacológica dirigida a lograr la apertura arterial. Su objetivo es intentar lograr una recuperación del flujo a nivel de la arteria “culpable” antes de la llegada a la sala de hemodinamia y luego abrir la arteria (si no lo estaba), o eliminar la estenosis residual y asegurar la permeabilidad arterial a largo plazo.
Esta estrategia terapéutica se plantea en los centros hospitalarios en que el tiempo puerta-balón es mayor a 120 minutos. Se han probado planes de FBL a dosis completa o a la mitad, ya sea con o sin inhibidores de la glicoproteína IIb/IIIa. La estrategia de usar una dosis completa del fibrinolítico fue analizada en la década de 1980 (estudio TAMI I-II), época de la angioplastia coronaria con balón, no demostrándose que la angioplastia inmediata luego de rTPA ofreciera ventaja sobre una angioplastia electiva, incrementando los sangrados(54 ,55 ).
Estudios más recientes como el CAPITAL AMI y el ASSENT-4(56,57) que incluyeron la administración de terapia antiplaquetaria dual, el uso de catéteres de bajo perfil y stents coronarios, han revalorado la angioplastia facilitada. Estos estudios mostraron resultados adversos para la angioplastia facilitada en la mayoría de los subgrupos, incluyendo los pacientes precoces (síntomas < 2 horas) y los pacientes de alto riesgo, como aquellos con un IAM anterior o diabéticos. La evidencia que alertó sobre los perjuicios de la estrategia de ATC facilitada con FBL surgió del metaanálisis de Keeley en el que, si bien se observó un aumento significativo en el flujo inicial de TIMI 3 (42% versus 15%), también se comprobó un aumento en las tasas de mortalidad a corto plazo (6% versus 4%), reinfarto no fatal (4% versus 2%), revascularización urgente del vaso tratado (5% versus 1%), accidente cerebrovascular (1,6% versus 0,3%), y un aumento no significativo de hemorragias mayores (7% versus 5%)(58 ). Asimismo, la combinación de un inhibidor de la GP IIb/IIIa y la mitad de dosis de un agente fibrinolítico antes de la ATC (estudios FINESSE y BRAVE) se mostró ineficaz en comparación con GP IIb/IIIa en el momento de la ATC, por lo que no se recomienda(59). (figura 6)
En suma, la angioplastia facilitada sobre todo dentro de las primeras dos horas de la administración del FBL, no se debe realizar debido a un aumento significativo de la mortalidad y otros eventos adversos.
4. Estrategia fármaco-invasiva
Si bien la estrategia de ATC facilitada fue desalentada por un mayor índice de complicaciones en la década de 1990, luego del año 2000 se replanteó el estudio de la estrategia combinada (fármaco-invasiva) en el contexto de la disponibilidad de stents coronarios y modernos regímenes antiplaquetarios. Destacamos al respecto los estudios GRACIA-1 y 2, el registro FAST-MI, TRANSFER-AMI, NORDISTEMI y finalmente el metaanálisis de Borgia(60 -64). En estos estudios el tiempo entre los FBL y la intervención coronaria fue mayor de dos a tres horas, por lo que se evitó actuar inmediatamente después de los FBL, momento en que existe un estado protrombótico. En un metaanálisis publicado en 2010, la incidencia de muerte o reinfarto a los 30 días fue menor con la estrategia fármaco-invasiva (OR: 0,65, IC95%, 0,49-0,88), sin un aumento significativo de hemorragias graves (OR: 0,93, IC95%, 0,67-1,34) ni de accidente cerebrovascular (OR: 0,63, IC95%, 0,31-1,26; p=0,21). Los beneficios de una estrategia invasiva sistemática sobre la terapia estándar se mantuvieron a los 6-12 meses(64).
El último estudio publicado sobre la estrategia fármaco-invasiva es el STREAM, el cual incluyó a 1.892 pacientes con IAMcST con < 3 horas de inicio de los síntomas y que no podían someterse a una angioplastia coronaria primaria dentro de los 60 minutos. Se aleatorizaron a ATC1ª (grupo ATC1ª) o fibrinólisis con tenecteplase con doble antiagregación y enoxaparina, previo al traslado a coronariografía de urgencia y eventual ATC (grupo fármaco-invasivo). Si la fibrinólisis era exitosa, se trasladaba a un hospital con laboratorio de hemodinamia entre las 6 a 24 horas luego de la aleatorización, y si no era exitosa (90 minutos posfibrinólisis) se trasladaba de emergencia(65) . El criterio de valoración primario compuesto de muerte, shock, insuficiencia cardíaca congestiva o reinfarto a 30 días, fue de 12,4% en el grupo fármaco-invasivo y de 14,3% en el grupo de ATC1ª (RR grupo fibrinólisis 0,86, IC95%, 0,68-1,09, p=0,21) (figura 7). Del grupo que recibió fibrinólisis, 36,3% requirió traslado de emergencia (46,5% de estos pacientes tenían un flujo TIMI 0/1 en la arteria culpable) y el resto fue trasladado a ATC con una media de 17 horas (en este grupo el flujo TIMI 2 y 3 estaban presentes en 13,2% y 72,8% de los pacientes, respectivamente). Hubo un incremento leve en las hemorragias en el grupo fibrinólisis (0,5% versus 0,3%, p=0,45), no habiendo diferencia entre grupos en los sangrados no intracraneales. Los autores concluyen que la estrategia fármaco-invasiva permite obtener los mismos resultados que la ATC1ª (salvo un leve incremento del sangrado cerebro-vascular) a través de un procedimiento invasivo programado (en las primeras 24 horas) en más de 60% de los pacientes.
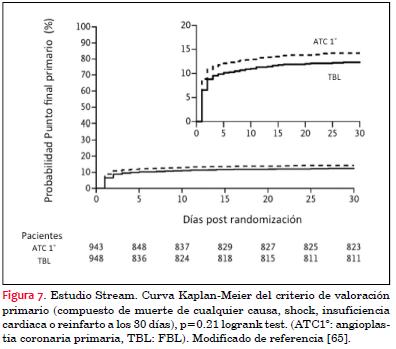
(65)
En suma, se recomienda la coronariografía diagnóstica y eventual angioplastia coronaria para los pacientes que reciben tratamiento fibrinolítico exitoso en un plazo de 2-3 a 24 horas, discriminados por grupos de riesgo:
- Para los pacientes de alto riesgo: IAM anterior, Killip Kimbal ³ 2, IAM inferior con compromiso del ventrículo derecho, presión arterial sistólica <100 mmHg, frecuencia cardíaca >100 cpm, la angiografía debe ser realizada tan pronto como sea posible luego de dos horas de la fibrinólisis.
- Para los pacientes que no tienen alto riesgo el momento óptimo de la angiografía de rutina y posible angioplastia coronaria no se ha determinado; se plantea que se debe realizar dentro de 3 a 24 horas (véase algoritmo de la figura 6). (19).
5. Angioplastia coronaria pos FBL en el shock cardiogénico
Otra indicación de angioplastia de urgencia luego de la fibrinólisis es el shock cardiogénico. El estudio SHOCK demostró el beneficio de la angiografía coronaria y revascularización de emergencia (ya sea con ATC o cirugía de revascularización miocárdica [CRM]) en comparación con la estabilización médica inmediata y revascularización tardía. El beneficio de la revascularización fue evidente a través de una ventana de tiempo muy amplia, hasta 54 horas después del IAM y 18 horas después de la aparición del shock, aunque debe realizarse tan pronto como sea posible (teoría de la espiral descendente de la isquemia que perpetúa al shock).
En comparación con la ATC1ª, la fibrinólisis por sí sola es relativamente ineficaz en pacientes con shock cardiogénico salvo que la presión de perfusión coronaria se incremente por vasopresores y/o con balón de contrapulsación intraaórtico. Por lo tanto, los pacientes ingresados en hospitales sin hemodinamia deben ser transferidos inmediatamente a un centro de atención terciaria con la intención de reperfusión precoz.
IV. Evolución de la técnica de la ATC en el IAMcST
1. Selección del acceso vascular
La selección del acceso vascular para la realización de la ATC1ª ha demostrado ser un aspecto importante, dado que es el sitio de sangrado más frecuente, pudiendo incidir en la tasa de mortalidad. Con el acceso femoral se ha comprobado una mayor tasa de complicaciones que con el acceso radial, habiéndose identificado varios predictores de sangrado: sexo femenino, edad avanzada, enfermedad renal crónica, anemia, uso del balón intraaórtico de contrapulsación, uso de inhibidores de GP IIb/IIIa y la administración de heparina de bajo peso en las 48 horas previas al procedimiento(67 ). El estudio RIVAL (STEMI), que comparó ambos tipos de accesos, no mostró una reducción significativa en el parámetro de valoración primario de muerte, IAM, accidente cerebro vascular y sangrado mayor no relacionado a CRM, pero con el abordaje radial mostró una disminución de las complicaciones vinculadas al acceso(68). El estudio italiano RIFLE-STEACS, en el que se incluyeron pacientes de mayor riesgo, realizado en hospitales de alto volumen y por operadores con gran experiencia en acceso radial, evidenció una disminución significativa del MACE (Mayor Acute Cardiac Events) con este acceso versus femoral (16,3% versus 21%, p=0,003), como también menor incidencia de hemorragia, de estancia hospitalaria y de muerte cardiovascular (5,2% versus 9,2%, p=0,02)(69 ).
Las últimas guías para el manejo de IAMcST de la Colegio Americano de Cardiología/Asociación Americana del Corazón y de la Sociedad Española de Cardiología realizan una recomendación de tipo IIa, nivel de evidencia B, para el uso del acceso radial por parte de operadores experimentados(18,19). En Uruguay, más de 90% de las ATC, incluidas las primarias, se realizan por acceso radial, lo que traduce una alta experiencia de los cardiólogos intervencionistas con este método, dando mayor seguridad a los pacientes.
En suma, la utilización del acceso radial para la ATC1ª por operadores experimentados se traducirá en un beneficio clínico para los pacientes.
2. Uso de stents convencionales (BMS) en el IAM
Uno de los avances más importantes en la práctica de la cardiología intervencionista ha sido la incorporación de los stents coronarios, introducidos en los años 80 por Sigwart, Roubin, Palmaz y Schatz, entre otros(70), siendo actualmente usados en forma rutinaria tanto en la enfermedad coronaria estable como en los síndromes coronarios agudos.
Los stents metálicos (BMS) fueron creados para superar las limitaciones del balón y disminuir sus complicaciones. Entre estas destacaba la reestenosis, que ocurría en 10% a 15% de los pacientes antes del alta(5,71 ), y 35%-40% a los seis meses(72 ,73 ) . La oclusión aguda de la arteria llevaba hasta a un 4% de los pacientes a CRM de emergencia.
Inicialmente, los stents se evitaban en el ambiente “protrombótico” del IAM y se utilizaban como medida de rescate frente al cierre agudo o disección de la arteria tratada. Dos estudios clásicos, BENEStent(74 ) y STRESS(75 ), fueron fundamentales para pasar de la angioplastia tradicional con balón al uso de stent como alternativa a la cirugía de bypass coronario fuera del ambiente del IAM. Sin embargo, en los primeros trabajos con stents, la trombosis intrastent (TS) era frecuente(76). Con el uso de la doble terapia antiplaquetaria se logró mejorar dichos resultados(77 -80).
Entre fines de la década de 1990 y principios del año 2000 fueron surgiendo estudios que mostraron el beneficio del BMS sobre el balón en el contexto del IAM (81-85). El CADILLAC (86) mostró que su uso en la ATC1ª tenía menor tasa de oclusión de la arteria vinculada al IAM (5,7% para BMS versus 11,3% para balón, p=0,01), mientras que la reestenosis en la angiografía de control fue también menor para BMS que para balón (22,2 versus 40,8%, p<0,001). Otros estudios, como el ADMIRAL (87) e ISAR-2 (88), ampliaron la evidencia científica, por lo que hoy día los BMS se utilizan en forma rutinaria en la ATC1ª. Si bien la mortalidad tuvo una tendencia a ser menor en la ATC1ª con stent(89), ensayos y metaanalisis más recientes(90,91) mostraron que los BMS no modificaron la mortalidad en forma estadísticamente significativa.
En suma, la utilización de BMS es técnicamente posible y segura en la gran mayoría de los casos de IAMcST sometidos a ATC1ª, disminuyendo a la mitad la necesidad de reintervenciones.
3. Uso de stents liberadores de drogas (DES) en el IAM
Fuera del contexto del IAM, la primera generación de DES liberadores de paclitaxel y sirolimus logró disminuir la necesidad de nueva revascularización del vaso tratado en 60% a 70%(92) . Sin embargo, en algunos ensayos estos stents se asociaron a un aumento de la trombosis muy tardía (luego del año), sin aumento de la mortalidad(92). En el registro SCAAR la mortalidad fue similar con DES o con BMS (RR 1,03, 95% IC 0,94-1,14)(93) .
Dado el ambiente protrombótico en los pacientes con IAM y la observación de un aumento de la trombosis tardía y muy tardía con el uso de stents(94) (0,5% de los pacientes)(95) , surgieron dudas sobre la eficacia y seguridad de los DES en este escenario clínico. Registros iniciales, un pequeño estudio aleatorizado unicéntrico(96) , y posteriormente dos grandes estudios randomizados (TYPHOON(97) y PASSION(98)) confirmaron la seguridad y eficacia de los DES en el IAM. Resultados de metaanálisis con mayor seguimiento mostraron resultados similares(99). Los DES de última generación que incorporan los fármacos biolimus A9, everolimus y zotarolimus utilizados en algunos ensayos, tienen un similar perfil de eficiencia y seguridad(100). El uso de everolimus (frente a sirolimus) mostró una disminución de la revascularización del vaso culpable, (5,7 versus 8,8, p=0,04) y menor incidencia de trombosis intrastent.
Actualmente, las guías de tratamiento del IAM recomiendan el uso de DES o BMS (clase I, nivel de evidencia A), estando los DES contraindicados en aquellos pacientes con elevado riesgo de sangrado o que no puedan cumplir con la doble antiagregación al menos por un año, dado el riesgo aumentado de TS(18).
En suma, el uso de DES en el IAM en comparación con los BMS, disminuye la tasa de reestenosis y reintervención. Los stents con everolimus parecen vincularse a menores eventos adversos.
4. Stent directo versus predilatación con balón
La técnica de implante del stent coronario en el IAM ha sido analizada en diversos estudios. Trabajos iniciales, como el PAMI y el CADILLAC, utilizaron la predilatación con balón, mientras otros(87,88,101) utilizaron el implante de stent directo planteando que también es esta una práctica segura.
Según estos y otros estudios más recientes(102) se mantiene la postura de que no existiría beneficio de la predilatación excepto en situaciones específicas. La estrategia de stent directo se utiliza principalmente cuando se logra visualizar la lesión en toda su extensión, con la teórica finalidad de reducir la tasa de embolización y “no-reflow”. Dentro de las ventajas potenciales se describe el menor daño endotelial al no utilizar el balón. Por otro lado, las situaciones en las cuales habría que considerar la predilatación con balón serían como “pretratamiento” de la lesión con anatomía compleja (lesiones tortuosas, anguladas o calcificadas) que pudieran dificultar el pasaje del stent. El implante directo del stent sobre lesiones calcificadas sin predilatar podría provocar subexpansión y mala aposición del stent, siendo fuertes predictores de TS, situación que se agravaría con el implante de DES.
En suma: no es posible hacer una recomendación general para el uso de stent en forma directa o con predilatación con balón, quedando esta decisión a criterio del cardiólogo intervencionista actuante y de acuerdo a las características particulares de cada paciente.
5. Tromboaspiración
En un intento de disminuir la carga trombótica intraluminal y las complicaciones asociadas a la angioplastia (embolia distal, fenómeno de “no-reflow”) en el IAM, se han desarrollado distintos sistemas de trombectomía o trombolisis mecánica. En los últimos años varios sistemas con resultados diversos se han utilizado para este propósito(103).
Estudios iniciales como el SAFER(104) (en puentes venosos) y X-amine(105) (en el IAM), mostraron cierto beneficio en mejorar el flujo coronario final y el diámetro final del vaso tratado(106). El X-amine obtuvo mayor renivelación del segmento ST usando el sistema X-Sizer. Otros estudios, como el EMERALD, que utilizó el sistema GuardWire, si bien logró rescatar material mascroscópico aspirado en el 73% de los casos, esto no se tradujo en mayor renivelación del segmento ST, menor tamaño del infarto o menor tasa de MACE (107). En 2005, el ensayo REMEDIA mostró que la realización de la tromboaspiración era posible y mejoraba la reperfusión tanto angiográfica como electrocardiográfica (renivelación del ST)(108). Un metaanálisis de 21 estudios randomizados (realizados entre 1990 y 2006) concluyó que el uso de dispositivos mecánicos para tromboaspirar en el IAM era eficaz en prevenir la embolización distal, logrando mejor perfusión miocárdica, pero sin mejorar la supervivencia(109).
En el mismo año, otro metaanálisis de estudios aleatorizados mostró mejor flujo TIMI 3 (87,1% versus 81,2%, p<0,0001), blush 3 (52,1% versus 31,7%, p<0,0001) y agregó a la evidencia una disminución de la mortalidad a 30 días con la tromboaspiración manual (1,7% versus 3,1%, p=0,04)(110). El seguimiento a dos años de la ATC aislada versus ATC con tromboaspiración manual (con el catéter Export), mostró que la incidencia de eventos cardíacos mayores fue de 13.7% versus 4,5% (p=0,038) y muerte cardíaca 6,8% versus 0% (p=0,012), constatándose una disminución de la muerte cardíaca con mejoría del blush y la renivelación del segmento ST(111). Los beneficios mostrados por los dispositivos de aspiración manual fueron incorporados en las últimas guías de práctica clínica, recomendándose el uso de tromboaspiración manual como indicación clase IIa, con un nivel de evidencia de tipo B(18).
En suma: si bien la evidencia disponible no es concluyente, hay consenso en que la tromboaspiración manual durante la ATC1ª es útil en la mayoría de los pacientes, al permitir mejorar el grado de perfusión coronaria implicando probablemente una mejoría de los resultados clínicos.
Bibliografía
1. Lluberas R, Buitrón F, Senra H. Fibrinolíticos por vía sistémica en el infarto agudo de miocardio. Rev Méd Urug 1986; 2(1): 85-9.
2. Buitrón F, Menéndez H, Lluberas R, Argón L, Senra H, Fronzutti A. Angioplastia transluminal coronaria. Resúmenes del 7º Congreso Uruguayo de Cardiología.
3. Comité de Hemodinamia de la Sociedad Uruguaya de Cardiología. Registro Nacional del Tratamiento Intervencionista del Infarto Agudo de Miocardio en Uruguay (RENATIA). Rev Urug Cardiol 2006; 21(3): 218-23.
4. Pardiñas C, Buitrón F, Duraìn A, Lluberas R, Artucio C, Díaz P, et al. National Registry Of Interventional Treatment Of Acute Myocardial Infarction In Uruguay (RENATIA): 30 day mortality results. Am J Cardiol 2002; 90(Suppl 6A): 186H.
5. Hartzler GO, Rutherford BD, McConahay DR, Johnson WL Jr, McCallister BD, Gura GM Jr, et al. Percutaneous transluminal coronary angioplasty with and without thrombolytic therapy for treatment of acute myocardial infarction. Am Heart J 1983; 106: 965-73.
6. Ratcliffe AT, Pepper C. Thrombolysis or primary angioplasty? Reperfusion therapy for myocardial infarction in the UK. Postgrad Med J 2008; 84(988): 73-7.
7. Grines CL. Should thrombolysis or primary angioplasty be the treatment of choice for acute myocardial infarction? Primary angioplasty—the strategy of choice. N Engl J Med 1996; 335(17): 1313-6; discussion 1316-7.
8. Meijer A, Verheugt FW, Werter CJ, Lie KI, van der Pol JM, van Eenige MJ. Aspirin versus coumadin in the prevention of reocclusion and recurrent ischemia after successful thrombolysis: a prospective placebo-controlled angiographic study. Results of the APRICOT Study. Circulation 1993; 87(5): 1524-30.
9. The effects of tissue plasminogen activator, streptokinase, or both on coronary-artery patency, ventricular function, and survival after acute myocardial infarction. The GUSTO Angiographic Investigators. N Engl J Med 1993; 329(22): 1615-22.
10. An international randomized trial comparing four thrombolytic strategies for acute myocardial infarction. The GUSTO investigators. N Engl J Med 1993; 329(10): 673-82.
11. Ross AM, Coyne KS, Moreyra E, Reiner JS, Greenhouse SW, Walker PL, et al. Extended mortality benefit of early postinfarction reperfusion. GUSTO-I Angiographic Investigators. Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries Trial. Circulation 1998; 97(16): 1549-56.
12. Vogt A, von Essen R, Tebbe U, Feuerer W, Appel KF, Neuhaus KL. Impact of early perfusion status of the infarct-related artery on short- term mortality after thrombolysis for acute myocardial infarction: retrospective analysis of four German multicenter studies. J Am Coll Cardiol 1993; 21(6): 1391-5.
13. Anderson JL, Karagounis LA, Becker LC, Sorensen SG, Menlove RL. TIMI perfusion grade 3 but not grade 2 results in improved outcome after thrombolysis for myocardial infarction. Ventriculographic, enzymatic, and electrocardiographic evidence from the TEAM-3 Study. Circulation 1993; 87(6): 1829-39.
14. Anderson JL, Karagounis LA, Califf RM. Metaanalysis of five reported studies on the relation of early coronary patency grades witk mortality and outcomes after acute myocardial infarction. Am J Cardiol 1996; 78(1): 1-8.
15. Keeley EC, Boura JA, Grines CL. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials. Lancet 2003; 361(9351):13-20.
16. Zijlstra F, Hoorntje JC, de Boer MJ, Reiffers S, Miedema K, Ottervanger JP, et al. Long-term benefit of primary angioplasty as compared with thrombolytic therapy for acute myocardial infarction. N Engl J Med 1999; 341(19):1413-9.
17. Huynh T, Cox JL, Massel D, Davies C, Hilbe J, Warnica W, et al. Predictors of intracranial hemorrhage with fibrinolytic therapy in unselected community patients: a report from the FASTRAK II project. Am Heart J 2004; 148(1):86-91.
18. O’Gara PT, Kushner FG, Ascheim DD, Casey DE Jr, Chung MK, de Lemos JA, et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2013; 127(4): e362-425.
19. Steg PG, James SK, Atar D, Badano LP, Blömstrom-Lundqvist C, Borger MA, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2012; 33(20):2569-619.
20. Nallamothu BK, Bates ER. Percutaneous coronary intervention versus fibrinolytic therapy in acute myocardial infarction: is timing (almost) everything? Am J Cardiol 2003; 92(7):824-6.
21. Brodie BR, Gersh BJ, Stuckey T, Witzenbichler B, Guagliumi G, Peruga JZ, et al. When is door-to-balloon time critical? Analysis from the HORIZONS-AMI (Harmonizing Outcomes with Revascularization and Stents in Acute Myocardial Infarction) and CADILLAC (Controlled Abciximab and Device Investigation to Lower Late Angioplasty Complications) trials. J Am Coll Cardiol 2010; 56(5):407-13.
22. Pinto DS, Frederick PD, Chakrabarti AK, Kirtane AJ, Ullman E, Dejam A, et al. Benefit of transferring ST-segment-elevation myocardial infarction patients for percutaneous coronary intervention compared with administration of onsite fibrinolytic declines as delays increase. Circulation 2011; 124(23):2512-21.
23. Pinto DS, Kirtane AJ, Nallamothu BK, Murphy SA, Cohen DJ, Laham RJ, et al. Hospital delays in reperfusion for ST-elevation myocardial infarction: implications when selecting a reperfusion strategy. Circulation 2006; 114(19):2019-25.
24. Nallamothu BK, Bates ER, Herrin J, Wang Y, Bradley EH, Krumholz HM, et al. Times to Treatment in Transfer Patients Undergoing Primary Percutaneous Coronary Intervention in the United States: National Registry of Myocardial Infarction (NRMI)-3/4 Analysis. Circulation 2005; 111(6):761-7.
25. Magid DJ, Wang Y, Herrin J, McNamara RL, Bradley EH, Curtis JP, et al. Relationship between time of day, day of week, timeliness of reperfusion, and in-hospital mortality for patients with acute ST-segment elevation myocardial infarction. JAMA 2005; 294(7):803-12.
26. Gersh BJ, Stone GW, White HD, Holmes DR Jr. Pharmacological facilitation of primary percutaneous coronary intervention for acute myocardial infarction: Is the slope of the curve the shape of the future?. JAMA 2005; 293(8):979-86.
27. Huber K, De Caterina R, Kristensen SD, Verheugt FW, Montalescot G, Maestro LB, et al. Pre-hospital reperfusion therapy: a strategy to improve therapeutic outcome in patients with ST-elevation myocardial infarction. Eur Heart J, 2005. 26(19): p. 2063-74. Eur Heart J 2005; 26(19):2063-74
28. Gersh BJ, Antman EM. Selection of the optimal reperfusion strategy for STEMI: does time matter? Eur Heart J 2006; 27(7):761-3
29. Boersma E, Maas AC, Deckers JW, Simoons ML. Early thrombolytic treatment in acute myocardial infarction: reappraisal of the golden hour. Lancet 1996; 348(9030):771-5.
30. Steg PG, Bonnefoy E, Chabaud S, Lapostolle F, Dubien PY, Cristofini P, et al. Impact of time to treatment on mortality after prehospital fibrinolysis or primary angioplasty: data from the CAPTIM randomized clinical trial. Circulation 2003; 108(23):2851-6.
31. Weaver WD, Cerqueira M, Hallstrom AP, Litwin PE, Martin JS, Kudenchuk PJ, et al. Prehospital-initiated vs hospital-initiated thrombolytic therapy. The Myocardial Infarction Triage and Intervention Trial. JAMA 1993; 270(10):1211-6.
32. Taher T, Fu Y, Wagner GS, Goodman SG, Fresco C, Granger CB, et al. Aborted myocardial infarction in patients with ST-segment elevation. Insights from the assessment of the safety and efficacy of a new thrombolytic regimen-3 trial electrocardiographic substudy. J Am Coll Cardiol 2004; 44(1):38-43.
33. Van de Werf F, Ardissino D, Betriu A, Cokkinos DV, Falk E, Fox KA, et al. Management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2003; 24(1):28-66.
34. Bassand JP, Danchin N, Filippatos G, Gitt A, Hamm C, Silber S, et al. Implementation of reperfusion therapy in acute myocardial infarction. A policy statement from the European Society of Cardiology. Eur Heart J 2005; 26(24):2733-41.
35. Henry TD, Unger BT, Sharkey SW, Lips DL, Pedersen WR, Madison JD, et al. Design of a standardized system for transfer of patients with ST-elevation myocardial infarction for percutaneous coronary intervention. Am Heart J 2005; 150(3):373-84.
36. McGinn AP, Rosamond WD, Goff DC Jr, Taylor HA, Miles JS, Chambless L. Trends in prehospital delay time and use of emergency medical services for acute myocardial infarction: Experience in 4 US communities from 1987-2000. Am Heart J 2005; 150(3):392-400.
37. Grzybowski M, Clements EA, Parsons L, Welch R, Tintinalli AT, Ross MA, et al. Mortality benefit of immediate revascularization of acute ST-segment elevation myocardial infarction in patients with contraindications to thrombolytic therapy: a propensity analysis. JAMA 2003; 290(14):1891-8.
38. Eagle KA, Goodman SG, Avezum A, Budaj A, Sullivan CM, López-Sendón J, et al. Practice variation and missed opportunities for reperfusion in ST-segment-elevation myocardial infarction: findings from the Global Registry of Acute Coronary Events (GRACE). Lancet 2002; 359(9304):373-7.
39. Elad Y, French WJ, Shavelle DM, Parsons LS, Sada MJ, Every NR. Primary angioplasty and selection bias inpatients presenting late (>12 h) after onset of chest pain and ST elevation myocardial infarction. J Am Coll Cardiol 2002; 39(5):826-33.
40. Gore JM, Granger CB, Simoons ML, Sloan MA, Weaver WD, White HD, et al. Stroke after thrombolysis. Mortality and functional outcomes in the GUSTO-I trial. Global Use of Strategies to Open Occluded Coronary Arteries. Circulation 1995; 92(10):2811-8.
41. Thune JJ, Hoefsten DE, Lindholm MG, Mortensen LS, Andersen HR, Nielsen TT, et al. Simple risk stratification at admission to identify patients with reduced mortality from primary angioplasty. Circulation 2005; 112(13):2017-21.
42. Kent DM, Schmid CH, Lau J, Selker HP. Is primary angioplasty for some as good as primary angioplasty for all? J Gen Intern Med 2002; 17(12):887-94.
43. Tarantini G, Razzolini R, Napodano M, Bilato C, Ramondo A, Iliceto S. Acceptable reperfusion delay to prefer primary angioplasty over fibrin-specific thrombolytic therapy is affected (mainly) by the patient’s mortality risk: 1 h does not fit all. Eur Heart J 2010; 31(6):676-83.
44. French JK, Feldman HA, Assmann SF, Sanborn T, Palmeri ST, Miller D, et al. Influence of thrombolytic therapy, with or without intra-aortic balloon counterpulsation, on 12-month survival in the SHOCK trial. Am Heart J 2003; 146(5):804-10.
45. Gibson CM, Cannon CP, Murphy SA, Marble SJ, Barron HV, Braunwald E. Relationship of the TIMI myocardial perfusion grades, flow grades, frame count, and percutaneous coronary intervention to long-term outcomes after thrombolytic administration in acute myocardial infarction. Circulation 2002; 105(16): 1909-13.
46. Sutton AG, Campbell PG, Graham R, Price DJ, Gray JC, Grech ED, et al. A randomized trial of rescue angioplasty versus a conservative approach for failed fibrinolysis in ST-segment elevation myocardial infarction: the Middlesbrough Early Revascularization to Limit INfarction (MERLIN) trial. J Am Coll Cardiol 2004; 44(2):287-96.
47. Ellis SG, da Silva ER, Heyndrickx G, Talley JD, Cernigliaro C, Steg G, et al. Randomized comparison of rescue angioplasty with conservative management of patients with early failure of thrombolysis for acute anterior myocardial infarction. Circulation 1994; 90(5):2280-4.
48. Gershlick AH, Stephens-Lloyd A, Hughes S, Abrams KR, Stevens SE, Uren NG, et al. Rescue angioplasty after failed thrombolytic therapy for acute myocardial infarction. N Engl J Med 2005; 353(26): 2758-68.
49. Wijeysundera HC, Vijayaraghavan R, Nallamothu BK, Foody JM, Krumholz HM, Phillips CO, et al. Rescue angioplasty or repeat fibrinolysis after failed fibrinolytic therapy for ST-segment myocardial infarction: a meta-analysis of randomized trials. J Am Coll Cardiol 2007; 49(4):422-30.
50. Langer A, Krucoff MW, Klootwijk P, Simoons ML, Granger CB, Barr A, et al. Prognostic significance of ST segment shift early after resolution of ST elevation in patients with myocardial infarction treated with thrombolytic therapy: the GUSTO-I ST Segment Monitoring Substudy. J Am Coll Cardiol 1998; 31(4):783-9.
51. Hudson MP, Granger CB, Topol EJ, Pieper KS, Armstrong PW, Barbash GI, et al. Early reinfarction after fibrinolysis: experience from the global utilization of streptokinase and tissue plasminogen activator (alteplase) for occluded coronary arteries (GUSTO I) and global use of strategies to open occluded coronary arteries (GUSTO III) trials. Circulation 2001; 104(11):1229-35.
52. Ohman EM, Califf RM, Topol EJ, Candela R, Abbottsmith C, Ellis S, et al. Consequences of reocclusion after successful reperfusion therapy in acute myocardial infarction. TAMI Study Group. Circulation 1990; 82(3):781-91.
53. Gibson CM, Karha J, Murphy SA, James D, Morrow DA, Cannon CP, et al. Early and long-term clinical outcomes associated with reinfarction following fibrinolytic administration in the Thrombolysis in Myocardial Infarction trials. J Am Coll Cardiol 2003; 42(1):7-16.
54. Topol EJ, Califf RM, George BS, Kereiakes DJ, Abbottsmith CW, Candela RJ, et al. A randomized trial of immediate versus delayed elective angioplasty after intravenous tissue plasminogen activator in acute myocardial infarction. N Engl J Med 1987; 317(10): 581-8.
55. Immediate vs delayed catheterization and angioplasty following thrombolytic therapy for acute myocardial infarction. TIMI II A results. The TIMI Research Group. JAMA 1988; 260(19):2849-58.
56. Le May MR, Wells GA, Labinaz M, Davies RF, Turek M, Leddy D, et al. Combined Angioplasty and Pharmacological Intervention Versus Thrombolysis Alone in Acute Myocardial Infarction (CAPITAL AMI Study). J Am Coll Cardiol 2005; 46(3):417-24.
57. Primary versus tenecteplase-facilitated percutaneous coronary intervention in patients with ST-segment elevation acute myocardial infarction (ASSENT-4 PCI): randomised trial. Lancet 2006; 367(9510):569-78.
58. Keeley EC, Boura JA, Grines CL. Comparison of primary and facilitated percutaneous coronary interventions for ST-elevation myocardial infarction: quantitative review of randomised trials. Lancet 2006; 367(9510):579-88.
59. Ellis SG, Tendera M, de Belder MA, van Boven AJ, Widimsky P, Janssens L, et al. Facilitated PCI in patients with ST-elevation myocardial infarction. N Engl J Med 2008; 358(21):2205-17.
60. Fernández-Avilés F, Alonso JJ, Peña G, Blanco J, Alonso-Briales J, López-Mesa J, et al. Primary angioplasty vs. early routine post-fibrinolysis angioplasty for acute myocardial infarction with ST-segment elevation: the GRACIA-2 non-inferiority, randomized, controlled trial. Eur Heart J 2007; 28(8):949-60.
61. Danchin N, Coste P, Ferrières J, Steg PG, Cottin Y, Blanchard D, et al. Comparison of thrombolysis followed by broad use of percutaneous coronary intervention with primary percutaneous coronary intervention for ST-segment-elevation acute myocardial infarction: data from the french registry on acute ST-elevation myocardial infarction (FAST-MI). Circulation 2008; 118(3):268-76.
62. Cantor WJ, Fitchett D, Borgundvaag B, Ducas J, Heffernan M, Cohen EA, et al. Routine early angioplasty after fibrinolysis for acute myocardial infarction. N Engl J Med 2009; 360(26):2705-18.
63. Bøhmer E, Hoffmann P, Abdelnoor M, Arnesen H, Halvorsen S. Efficacy and safety of immediate angioplasty versus ischemia-guided management after thrombolysis in acute myocardial infarction in areas with very long transfer distances results of the NORDISTEMI (NORwegian study on DIstrict treatment of ST-elevation myocardial infarction). J Am Coll Cardiol 2010; 55(2):102-10.
64. Borgia F, Goodman SG, Halvorsen S, Cantor WJ, Piscione F, Le May MR, et al. Early routine percutaneous coronary intervention after fibrinolysis vs. standard therapy in ST-segment elevation myocardial infarction: a meta-analysis. Eur Heart J 2010; 31(17): 2156-69.
65. Armstrong PW, Gershlick AH, Goldstein P, Wilcox R, Danays T, et al. Fibrinolysis or primary PCI in ST-segment elevation myocardial infarction. N Engl J Med 2013; 368(15):1379-87.
66. Hochman JS, Sleeper LA, Webb JG, Sanborn TA, White HD, Talley JD, et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N Engl J Med 1999; 341(9):625-34.
67. Nikolsky E, Mehran R, Dangas G, Fahy M, Na Y, Pocock SJ, Lincoff AM, et al. Development and validation of a prognostic risk score for major bleeding in patients undergoing percutaneous coronary intervention via the femoral approach. Eur Heart J 2007; 28(16):1936-45.
68. Jolly SS, Yusuf S, Cairns J, Niemelä K, Xavier D, Widimsky P, et al. Radial versus femoral access for coronary angiography and intervention in patients with acute coronary syndromes (RIVAL): a randomised, parallel group, multicentre trial. Lancet 2011; 377(9775): 1409-20.
69. Romagnoli E, Biondi-Zoccai G, Sciahbasi A, Politi L, Rigattieri S, Pendenza G, et al. Radial Versus Femoral Randomized Investigation in ST-Segment Elevation Acute Coronary SyndromeThe RIFLE-STEACS (Radial Versus Femoral Randomized Investigation in ST-Elevation Acute Coronary Syndrome) Study. J Am Coll Cardiol 2012; 60(24):2481-9.
70. Ellis S. Drug-eluting and bare metal stents. In: Topol EJ. Textbook of Interventional Cardiology. 5th ed. Philadelphia: Saunders, 2008.
71. Stone GW, Marsalese D, Brodie BR, Griffin JJ, Donohue B, Costantini C, et al. A prospective, randomized evaluation of prophylactic intraaortic balloon counterpulsation in high risk patients with acute myocardial infarction treated with primary angioplasty. Second Primary Angioplasty in Myocardial Infarction (PAMI-II) Trial Investigators. J Am Coll Cardiol 1997; 29(7):1459-67.
72. Brodie BR, Grines CL, Ivanhoe R, Knopf W, Taylor G, O’Keefe J, et al. Six-month clinical and angiographic follow-up after direct angioplasty for acute myocardial infarction. Final results from the Primary Angioplasty Registry. Circulation 1994; 90(1):156-62.
73. O’Neill WW, Weintraub R, Grines CL, Meany TB, Brodie BR, Friedman HZ, et al. A prospective, placebo-controlled, randomized trial of intravenous streptokinase and angioplasty versus lone angioplasty therapy of acute myocardial infarction. Circulation 1992; 86(6):1710-7.
74. Serruys PW, Strauss BH, Beatt KJ, Bertrand ME, Puel J, Rickards AF, et al. Angiographic follow-up after placement of a self-expanding coronary-artery stent. N Engl J Med 1991; 324(1):13-7.
75. Fischman DL, Leon MB, Baim DS, Schatz RA, Savage MP, Penn I, et al. A randomized comparison of coronary-stent placement and balloon angioplasty in the treatment of coronary artery disease. Stent Restenosis Study Investigators. N Engl J Med 1994; 331(8): 496-501.
76. Agrawal SK, Ho DS, Liu MW, Iyer S, Hearn JA, Cannon AD, et al. Predictors of thrombotic complications after placement of the flexible coil stent. Am J Cardiol 1994; 73(16):1216-9.
77. Barragan P, Sainsous J, Silvestri M, Bouvier JL, Comet B, Siméoni JB, et al. Ticlopidine and subcutaneous heparin as an alternative regimen following coronary stenting. Cathet Cardiovasc Diagn 1994; 32(2): 133-8.
78. Gregorini L, Marco J, Fajadet J, Bernies M, Cassagneau B, Brunel P, et al. Ticlopidine and aspirin pretreatment reduces coagulation and platelet activation during coronary dilation procedures. J Am Coll Cardiol 1997; 29(1):13-20.
79. Schömig A, Neumann FJ, Kastrati A, Schühlen H, Blasini R, Hadamitzky M, et al. A Randomized Comparison of Antiplatelet and Anticoagulant Therapy after the Placement of Coronary-Artery Stents. N Engl J Med 1996; 25;334(17):1084-9.
80. Randomised placebo-controlled and balloon-angioplasty-controlled trial to assess safety of coronary stenting with use of platelet glycoprotein-IIb/IIIa blockade. Lancet 1998; 352(9122):87-92.
81. Antoniucci D, Santoro GM, Bolognese L, Valenti R, Trapani M, Fazzini PF. A clinical trial comparing primary stenting of the infarct-related artery with optimal primary angioplasty for acute myocardial infarction: results from the Florence Randomized Elective Stenting in Acute Coronary Occlusions (FRESCO) trial. J Am Coll Cardiol 1998; 31(6):1234-9.
82. Rodríguez A, Bernardi V, Fernández M, Mauvecín C, Ayala F, Santaera O, et al. In-hospital and late results of coronary stents versus conventional balloon angioplasty in acute myocardial infarction (GRAMI trial). Gianturco-Roubin in Acute Myocardial Infarction. Am J Cardiol 1998; 81(11):1286-91.
83. Maillard L, Hamon M, Khalife K, Steg PG, Beygui F, Guermonprez JL, et al. A comparison of systematic stenting and conventional balloon angioplasty during primary percutaneous transluminal coronary angioplasty for acute myocardial infarction. STENTIM-2 Investigators. J Am Coll Cardiol 2000; 35(7):1729-36.
84. Suryapranata H, Ottervanger JP, Nibbering E, van ‘t Hof AW, Hoorntje JC, de Boer MJ, et al. Long term outcome and cost-effectiveness of stenting versus balloon angioplasty for acute myocardial infarction. Heart 2001; 85(6):667-71.
85. Scheller B, Hennen B, Severin-Kneib S, Ozbek C, Schieffer H, Markwirth T. Long-term follow-up of a randomized study of primary stenting versus angioplasty in acute myocardial infarction. Am J Med 2001; 110(1):1-6.
86. Stone GW, Grines CL, Cox DA, Garcia E, Tcheng JE, Griffin JJ, et al. Comparison of Angioplasty with Stenting, with or without Abciximab, in Acute Myocardial Infarction. N Engl J Med 2002; 346(13):957-66.
87. Montalescot G, Barragan P, Wittenberg O, Ecollan P, Elhadad S, Villain P, et al. Platelet glycoprotein IIb/IIIa inhibition with coronary stenting for acute myocardial infarction. N Engl J Med 2001; 344(25): 1895-903.
88. Neumann FJ, Kastrati A, Schmitt C, Blasini R, Hadamitzky M, Mehilli J, et al. Effect of glycoprotein IIb/IIIa receptor blockade with abciximab on clinical and angiographic restenosis rate after the placement of coronary stents following acute myocardial infarction. J Am Coll Cardiol 2000; 35(4):915-21.
89. Grines CL, Cox DA, Stone GW, Garcia E, Mattos LA, Giambartolomei A, et al. Coronary Angioplasty with or without Stent Implantation for Acute Myocardial Infarction. N Engl J Med 1999; 341(26):1949-56.
90. Suryapranata H, De Luca G, van ‘t Hof AW, Ottervanger JP, Hoorntje JC, Dambrink JH, et al. Is routine stenting for acute myocardial infarction superior to balloon angioplasty? A randomised comparison in a large cohort of unselected patients. Heart 2005; 91(5):641-5.
91. De Luca G, Suryapranata H, Stone GW, Antoniucci D, Biondi-Zoccai G, Kastrati A, et al. Coronary stenting versus balloon angioplasty for acute myocardial infarction: a meta-regression analysis of randomized trials. Int J Cardiol 2008 ;126(1):37-44.
92. Stettler C, Wandel S, Allemann S, Kastrati A, Morice MC, Schömig A, et al. Outcomes associated with drug-eluting and bare-metal stents: a collaborative network meta-analysis. Lancet 2007; 370(9591):937-48.
93. James S, Carlsson J, Lindb¨ack J, et al. Swedish Coronary Angiography and Angioplasty Registry (SCAAR) Group. Long-term outcomes with drug-eluting stents vs. bare-metal stents in Sweden: one additional year of follow-up. Congress European Society of Cardiology , Vienna . September 1-5, 2007.
94. McFadden EP, Stabile E, Regar E, Cheneau E, Ong AT, Kinnaird T, et al. Late thrombosis in drug-eluting coronary stents after discontinuation of antiplatelet therapy. Lancet 2004; 364(9444):1519-21.
95. Bavry AA, Kumbhani DJ, Helton TJ, Borek PP, Mood GR, Bhatt DL. Late thrombosis of drug-eluting stents: a meta-analysis of randomized clinical trials. Am J Med 2006; 119(12):1056-61.
96. Saia F, Lemos PA, Lee CH, Arampatzis CA, Hoye A, Degertekin M, et al. Sirolimus-eluting stent implantation in ST-elevation acute myocardial infarction: a clinical and angiographic study. Circulation 2003; 108(16):1927-9.
97. Spaulding C, Henry P, Teiger E, Beatt K, Bramucci E, Carrié D, et al. Sirolimus-Eluting versus Uncoated Stents in Acute Myocardial Infarction. N Engl J Med 2006; 355(11):1093-104.
98. Laarman GJ, Suttorp MJ, Dirksen MT, van Heerebeek L, Kiemeneij F, Slagboom T, et al. Paclitaxel-Eluting versus Uncoated Stents in Primary Percutaneous Coronary Intervention. N Engl J Med 2006; 355(11):1105-13.
99. De Luca G, Stone GW, Suryapranata H, Laarman GJ, Menichelli M, Kaiser C, et al. Efficacy and safety of drug-eluting stents in ST-segment elevation myocardial infarction: a meta-analysis of randomized trials. Int J Cardiol 2009; 133(2):213-22.
100. Sabate M, Cequier A, Iñiguez A, Serra A, Hernandez-Antolin R, Mainar V, et al. Everolimus-eluting stent versus bare-metal stent in ST-segment elevation myocardial infarction (EXAMINATION): 1 year results of a randomised controlled trial. Lancet 2012; 380(9852):1482-90.
101. Grines CL, Cox DA, Stone GW, Garcia E, Mattos LA, Giambartolomei A, et al. Coronary angioplasty with or without stent implantation for acute myocardial infarction. Stent Primary Angioplasty in Myocardial Infarction Study Group. N Engl J Med 1999; 341(26):1949-56.
102. Lozano I, López-Palop R, Pinar E, Saura D, Picó F, Valdés M. [Direct stenting without predilatation: influence of stent diameter on the immediate results]. Rev Esp Cardiol 2004; 57(1):81-4.
103. Man Fai Shiu. PCI in the presence of significant intraluminal thrombus. Essential Interventional Cardiology. Philadelphia: Saunders, 2008.
104. Baim DS, Wahr D, George B, Leon MB, Greenberg J, Cutlip DE, et al. Randomized trial of a distal embolic protection device during percutaneous intervention of saphenous vein aorto-coronary bypass grafts. Circulation 2002; 105(11):1285-90.
105. Lefèvre T, Garcia E, Reimers B, Lang I, di Mario C, Colombo A, et al. X-sizer for thrombectomy in acute myocardial infarction improves ST-segment resolution: results of the X-sizer in AMI for negligible embolization and optimal ST resolution (X AMINE ST) trial. J Am Coll Cardiol 2005; 46(2):246-52.
106. van ‘t Hof AW, Liem A, Suryapranata H, Hoorntje JC, de Boer MJ, Zijlstra F. Angiographic assessment of myocardial reperfusion in patients treated with primary angioplasty for acute myocardial infarction: myocardial blush grade. Zwolle Myocardial Infarction Study Group. Circulation 1998; 97(23):2302-6.
107. Stone GW, Webb J, Cox DA, Brodie BR, Qureshi M, Kalynych A, et al. Distal microcirculatory protection during percutaneous coronary intervention in acute ST-segment elevation myocardial infarction: a randomized controlled trial. JAMA 2005; 293(9):1063-72.
108. Galiuto L, Garramone B, Burzotta F, Lombardo A, Barchetta S, Rebuzzi AG, et al. Thrombus aspiration reduces microvascular obstruction after primary coronary intervention: a myocardial contrast echocardiography substudy of the REMEDIA Trial. J Am Coll Cardiol 2006; 48(7):1355-60.
109. De Luca G, Suryapranata H, Stone GW, Antoniucci D, Neumann FJ, Chiariello M. Adjunctive mechanical devices to prevent distal embolization in patients undergoing mechanical revascularization for acute myocardial infarction: a meta-analysis of randomized trials. Am Heart J 2007; 153(3):343-53.
110. De Luca G, Dudek D, Sardella G, Marino P, Chevalier B, Zijlstra F. Adjunctive manual thrombectomy improves myocardial perfusion and mortality in patients undergoing primary percutaneous coronary intervention for ST-elevation myocardial infarction: a meta-analysis of randomized trials. Eur Heart J 2008; 29(24):3002-10.
111. Sardella G, Mancone M, Canali E, Di Roma A, Benedetti G, Stio R, et al. Impact of thrombectomy with EXPort Catheter in Infarct-Related Artery during Primary Percutaneous Coronary Intervention (EXPIRA Trial) on cardiac death. Am J Cardiol 2010; 106(5): 624-9.