Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.28 no.3 Montevideo dic. 2013
Artículo de revisión
La curva parabólica (J) y el cerebro
Dr. Federico Rodríguez-Porcel1, Prof. Dr. José Biller2
1. Residente Departamento de Neurología.
2. Jefe del Departamento de Neurología.
Departamento de Neurología. Universidad de Loyola, Chicago.
Correspondencia: Dr. José Biller. Correo electrónico: jbiller@lumc.edu
Recibido agosto 9, 2013; aceptado setiembre 26, 2013.
Palabras clave:
PRESIóN ARTERIAL
FACTORES DE RIESGO
ACCIDENTE CEREBROVASCULAR
Key words:
ARTERIAL PRESSURE
RISK FACTORS
STROKE
Introducción
La relación entre la presión arterial (PA) y el riesgo de eventos cardiovasculares es continua, consistente e independiente a otros factores de riesgo (tabla 1) (1).
Autorregulación de la irrigación cerebral
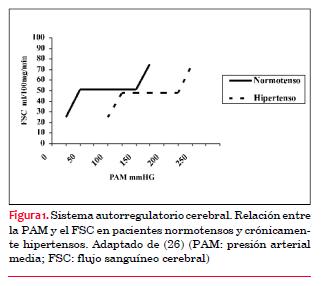
El flujo sanguíneo cerebral (FSC) está determinado por los siguientes factores: es directamente proporcional a la presión de perfusión cerebral (PPC) e inversamente proporcional a la resistencia vascular cerebral (RVC). Esto se traduciría en la siguiente ecuación FSC=PPC/RVC. A su vez, la PPC es definida como la PA media (PAM) menos la presión intracraneana (PIC). Cuando la autorregulación está preservada, ante un cambio de PPC, el FSC es mantenido por un cambio en la RVC. En sujetos normales, el sistema de autorregulación es más efectivo en la regulación del FSC cuando los valores de la PPC se hallan entre 60 y 150 mmHg(6) . Entre los factores que contribuyen a la variación del calibre de los vasos cerebrales se incluye el sistema nervioso autonómico simpático, el sistema renina-angiotensina y la tensión arterial de dióxido de carbono(7) . En individuos con hipertensión arterial crónica ambos márgenes de la función normal autorregulatoria están incrementados (figura 1). A diferencia del corazón, la perfusión del cerebro depende mayormente de la PA sistólica (PAS)(8) . En estudios con animales se ha podido demostrar que el mecanismo autorregulatorio puede verse afectado por la isquemia cerebral. Este concepto, sin embargo, no ha podido ser corroborado en humanos(9) . Figura 1
(26)
Manejo de la presión arterial en el ictus agudo
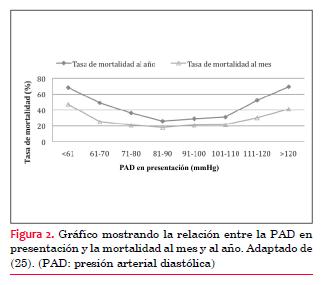
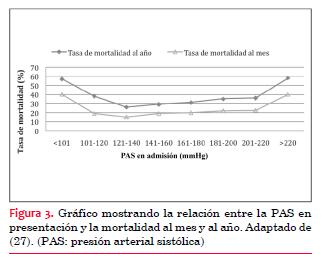
El 80% de los pacientes con ictus se presentan con la PA elevada(10) . Esto puede ser debido a hipertensión arterial crónica, respuesta simpática aguda u otros procesos secundarios al ictus. Generalmente, la PA tiende a bajar hasta 20/10 mmHg en los diez días subsiguientes. La relación entre la PA al momento de presentación clínica y la mortalidad puede representarse en forma de parábola (figuras 2 y 3) (11,12) . En el grupo que se presenta con PAS baja (< 120 mmHg) se ha visto mayor incidencia de falla cardíaca y enfermedad coronaria, y a su vez un mayor número de muertes asociadas a enfermedad coronaria. Por otra parte, el grupo con PAS > 200 mmHg tenía 50% más de probabilidades de tener otro ictus. Una PA más elevada causaría más edema cerebral, lo que llevaría a menor perfusión cerebral agravando la isquemia, lo que explicaría la mayor mortalidad de los pacientes que se presentaron con PA elevada. Esta relación en forma de parábola está presente también en sujetos con hipertensión previa, aunque con valores de PA más elevados. Esto se relaciona con la adaptación del sistema autorregulatorio de la musculatura vascular cerebral a la hipertensión crónica(13) . Figura 2 y 3
El manejo de la PA en el ictus agudo tiene varios puntos a considerar. El primero es qué pacientes se deberían considerar para el tratamiento de la PA. En varios estudios que han intentado responder a esta pregunta se ha notado consistentemente que aquellos pacientes con una mayor PA obtuvieron beneficios. Esto se evidencia en los ensayos CHHIPS y COSSACS, en donde la PAS estaba elevada (181 mmHg y 150 mmHg, respectivamente) y se registró una menor mortalidad en el primero y un mejor resultado funcional en el subgrupo de ictus isquémico en el segundo (14,15) . Aun así, hay algunos estudios en los que el tratamiento de la PA elevada mostró peores resultados que en el grupo placebo(16) o fue nocivo(17) .
La segunda pregunta sería cuándo empezar el tratamiento, ya que cuanto antes se empiece el tratamiento para la PA, parece estar asociado a resultados más favorables aun usando diferentes medicamentos. En el estudio IMAGES, la terapia se inició alrededor de siete horas del comienzo de los síntomas y mostró beneficio en el grupo con PA elevada(18) . El tratamiento con nimodipina oral dentro de las primeras 12 horas demostró beneficios, no fue así si se empezaba entre las 12-24 horas y tenía efecto negativo si se empezaba después de 24 horas(19). En el ensayo SCAST con candesartán, solamente el grupo que fue tratado en las primeras 6 horas mostró tener algún beneficio(20) . No todos los estudios han demostrado resultados beneficiosos(14,15,20), aunque se puede argumentar que no se detalla cuánto tiempo se demoró en llegar a la PA buscada.
Esto nos lleva a considerar cuál es la PA que se debería establecer como objetivo y cuál es el tiempo ideal para alcanzarla. Disminuir la PA de forma agresiva (disminución de la PAD > 25% o de la PAS > 20 mmHg) durante un ictus puede generar un episodio hipotensivo que empeore el pronóstico del paciente. Esto no solo se ha visto en la fase hiperaguda del ictus sino también dentro de las primeras 24 horas (21,22) . Una reducción de más de 20% en los primeros dos días fue asociada con un mayor índice de mortalidad y discapacidad(17). A su vez, en el estudio SCAST se demostró que una disminución de la PAS > 28 mmHg estaba significativamente asociada a peores resultados(16). Hay evidencia de que una reducción moderada de la PA puede ser segura y protectora. Una reducción en la PAS de 10 mmHg en las primeras 24 horas demostró disminución significativa de la mortalidad en el estudio CHHIPS. En el mismo estudio, una reducción de la PAS de 16 mmHg dentro de las primeras 4 horas resultó segura(14). Por todo ello se puede concluir que mientras la reducción de la PA sea moderada, el que la reducción se realice de forma rápida no parece nocivo.
No existe consenso respecto a qué fármacos son mejores para reducir la PA en estas situaciones, pero aquellos cuya dosis pueda ser ajustada parecen ser las mejores opciones. Labetalol y nicardipina aparecen como las mejores alternativas dentro de este grupo. La nimodipina tiene un efecto negativo cuando se administra por vía intravenosa, y el nitroprusiato de sodio debería ser evitado en casos en los que haya PIC elevada. El uso de lisinopril, como el de labetalol, se asoció a reducción de la mortalidad a los tres meses(14), mientras que el uso de candesartán posiblemente sea nocivo en estas situaciones(16).
Muchos estudios han demostrado que reducir la PA en el ictus es seguro en términos de deterioro neurológico y resultado funcional(14,15), incluso ante la existencia de estenosis carotídea(23) , no reduciendo la perfusión en la región infartada.
Manejo de la presión arterial como prevención secundaria de ictus
Cuando se considera el manejo de la PA en la prevención secundaria de ictus, la evidencia muestra que la relación entre la PA y el riesgo de ictus es lineal y no parabólica como en la situación aguda(7). El estudio PROGRESS mostró que el tratamiento antihipertensivo redujo el riesgo de recurrencia de ictus con disminución progresiva de la PA(24) , lo cual fue confirmado por otros estudios aleatorizados. En contraste con los adultos normales, aquellos que tienen comorbilidades como enfermedad coronaria, diabetes, insuficiencia renal o hipertrofia ventricular, varios estudios han documentado que PAD < 70 mmHg y PAS < 120 mmHg se asociaron a mayor morbilidad y mortalidad por causas cardiovasculares. Los niveles óptimos de PA en mayores de 65 años pueden diferir de los recomendados para adultos más jóvenes. Incluso algunos mayores de 85 años tienen mejores resultados que con el rango recomendado en más jóvenes, posiblemente debido a menor complacencia vascular. En los adultos mayores son frecuentes las fluctuaciones en la PA, que pueden llegar a ocasionar una disminución de más de 20% de la PA, lo cual ha sido asociado con hipoperfusión e ictus(24).
Conclusión
La evidencia para definir el tratamiento adecuado es limitada, pero ciertas conclusiones pueden ser derivadas de los estudios existentes. Debido a que la vasculatura cerebral tiene un delicado sistema autorregulatorio, la evidencia obtenida en síndromes coronarios no se puede aplicar al ictus agudo. Si bien hay cierta evidencia sobre el manejo apropiado de la PA en el ictus agudo, todavía son necesarios más estudios no solo para conocer los parámetros ideales de la PA objetivo, sino también el tiempo en el que se tendría que conseguir la misma, así como los fármacos que deberían emplearse para ello. Es importante destacar que en pacientes con vasculapatías crónicas los parámetros pueden variar.
Bibliografía
1. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL, et al. The Seventh report of the Joint National Committee on prevention, detection, evaluation, and treatment of high blood pressure: the JNC 7 report. JAMA 2003;289(19):2560-72.
2. Bangalore S, Messerli FH, Wun CC, Zuckerman AL, DeMicco D, Kostis JB, et al. J-curve revisited: an analysis of blood pressure and cardiovascular events in the treating to new targets (TNT) trial. Eur Heart J 2010;31(23):2897-908.
3. Kaplan NM. The diastolic J curve: alive and threatening. Hypertension 2011;58(5):751-3.
4. Messerli FH, Mancia G, Conti CR, Hewkin AC, Kupfer S, Champion A, et al. Dogma disputed: can aggressively lowering blood pressure in hypertensive patients with coronary artery disease be dangerous? Ann Intern Med 2006;144(12):884-93.
5. Dorresteijn JA, van der Graaf Y, Spiering W, Grobbee DE, Bots ML, Visseren FL. Relation between blood pressure and vascular events and mortality in patients with manifest vascular disease: J-curve revisited. Hypertension 2012;59(1):14-21.
6. Owens WB. Blood pressure control in acute cerebrovascular disease. J Clin Hypertension 2011;13(3): 205-11.
7. Chrysant SG. Current status of aggressive blood pressure control. World J Cardiol 2011 ;3(3):65-71.
8. Chrysant SG, Chrysant GS. Effectiveness of lowering blood pressure to prevent stroke versus to prevent coronary events. Am J Cardiol 2010;106(6): 825-9.
9. Jordan JD, Powers WJ. Cerebral autoregulation and acute ischemic stroke. Am J Hypertens 2012;25(9):946-50.
10. Aiyagari V, Gorelick PB. Management of blood pressure for acute and recurrent stroke. Stroke 2009;40(6):2251-6.
11. Leonardi-Bee J, Bath PM, Phillips SJ, Sandercock PA. Blood pressure and clinical outcomes in the International Stroke Trial. Stroke 2002; 33(5):1315-20.
12. Okumura K, Ohya Y, Maehara A, Wakugami K, Iseki K, Takishita S. Effects of blood pressure levels on case fatality after acute stroke. Hypertens 2005;23(6):1217.
13. Bath PM. How to manage blood pressure in acute stroke. J Hypertension 2005;23(6):1135.
14. Potter JF, Robinson TG, Ford GA, Mistri A, James M, Chernova J, et al. Controlling hypertension and hypotension immediately post-stroke (CHHIPS): a randomised, placebo-controlled, double-blind pilot trial. Lancet Neurol 2009;8(1):48-56.
15. Robinson TG, Potter JF, Ford GA, Bulpitt CJ, Chernova J, Jagger C, et al. Effects of antihypertensive treatment after acute stroke in the Continue or Stop Post-Stroke Antihypertensives Collaborative Study (COSSACS): a prospective, randomised, open, blinded-endpoint trial. Lancet Neurol 2010; 9(8):767-75.
16. Sandset EC, Bath PM, Boysen G, Jatuzis D, Kõrv J, Lüders S, et al. The angiotensin-receptor blocker candesartan for treatment of acute stroke (SCAST): a randomised, placebo-controlled, double-blind trial. Lancet 2011;377(9767):741-50
17. Ahmed N, Näsman P, Wahlgren NG. Effect of intravenous nimodipine on blood pressure and outcome after acute stroke. Stroke 2000;31(6):1250-5.
18. Muir KW, Lees KR, Ford I, Davis S. Magnesium for acute stroke: randomised controlled trial. Lancet 2004;363(9407):439-45.
19. Mohr JP, Orgogozo JM, Harrison MJG, Hennerici M, Wahlgren NG, Gelmers JH, et al. Meta-analysis of oral nimodipine trials in acute ischemic stroke. Cerebrovascular Diseases 1994;4(3): 197-203.
20. Sandset EC, Murray GD, Bath PMW, Kjeldsen SV, Berge E. Relation between change in blood pressure in acute stroke and risk of early adverse events and poor outcome. Stroke 2012;43(8):2108-14.
21. Wahlgren NG, MacMahon DG, de Keyser J, Indredavik B, Ryman T. Intravenous nimodipine West European stroke trial (INWEST) of nimodipine in the treatment of acute ischaemic stroke. Cerebrovascular Diseases 1994;4(3):204-10.
22. Oliveira-Filho J, Silva SC, Trabuco CC, Pedreira BB, Sousa EU, Bacellar A. Detrimental effect of blood pressure reduction in the first 24 hours of acute stroke onset. Neurology 2003;61(8): 1047-51.
23. Sare GM, Gray LJ, Wardlaw J, Chen C, Bath PMW. Is lowering blood pressure hazardous in patients with significant ipsilateral carotid stenosis and acute ischaemic stroke? Interim assessment in the efficacy of nitric oxide in stroke trial. Blood Press Monit 2009;14(1):20-5.
24. Arima H, Chalmers J, Woodward M, Anderson C, Rodgers A, Davis S, et al. Lower target blood pressures are safe and effective for the prevention of recurrent stroke: the PROGRESS trial. J Hypertens 2006;24(6):1201-8
25. Vokó Z, Bots ML, Hofman A, Koudstaal PJ, Witteman JC, Breteler MM. J-shaped relation between blood pressure and stroke in treated hypertensives. Hypertension 1999;34(6):1181-5.
26. Vemmos KN, Tsivgoulis G, Spengos K, Zakopoulos N, Synetos A, Manios E, et al. U-shaped relationship between mortality and admission blood pressure in patients with acute stroke. J Intern Med 2004;255(2):257-65.
27. Elliot W. Treatment of hypertension with cerebrovascular disease: what is the evidence? In: Biller J, Ferro JM, editors. Evidence based management of stroke. London: Cambridge Medicine, Castle Hill Barns;2011.