Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.28 no.2 Montevideo ago. 2013
Artículo seleccionado
Bloqueo aurículoventricular de alto grado que complica el infarto de miocardio con elevación ST en la era de la intervención coronaria percutánea primaria
Uffe Jakob Ortved Gang 1,2*, Anders Hvelplund1, Sune Pedersen1,
Allan Iversen1, Christian Jøns1, Steen Zabell Abildstrøm3, Jens Haarbo1,
Jan Skov Jensen1, y Poul Erik Bloch Thomsen1
Este artículo fue publicado en Europace 2012; 14: 1639–45, y es reproducido y traducido con autorización.
1. Departamento de Cardiología, Hospital Universitario Gentofte, Copenhague, Dinamarca.
2. Departamento de Medicina Interna, Hospital Universitario Glostrup, Nordre Ringvej 57, 2600 Glostrup, Copenhague, Dinamarca.
3. Departamento de Cardiología, Hospital Universitario Bispebjerg, Copenhague, Dinamarca
* Autor corresponsal: E-mail: dr.gang@dadlnet.dk
Publicado en nombre de la Sociedad Europea de Cardiología. Todos los derechos reservados.© The Author 2012. Por permisos, por favor, enviar correo electrónico a: journals.permissions@oup.com.
Europace (2012) 14, 1639–1645 doi:10.1093/europace/eus161
Recibido el 9 de marzo de 2012; aceptado después de su revisión el 18 de abril de 2012; publicación en línea previa a la impresión: 29 de mayo de 2012
Traducción: Dra. Trinidad Ott
Resumen
Finalidades: la intervención percutánea coronaria primaria (pPCI, por sus siglas en inglés) ha reemplazado la trombolisis como tratamiento de elección para el infarto de miocardo con elevación del segmento ST (STEMI por sus siglas en inglés). Sin embargo, la incidencia y la importancia pronóstica del bloqueo aurículoventricular de alto grado (BAV-AG) en pacientes con STEMI en la era de pPCI han sido poco estudiadas. El objetivo de este estudio fue evaluar la incidencia, los predictores y la importancia pronóstica of BAV-AG en pacientes con STEMI tratados con pPCI.
Métodos y resultados: este estudio incluyó 2073 pacientes con STEMI tratado con pPCI. Los pacientes fueron identificados a través de un registro hospitalario y el Registro Nacional de Pacientes de Dinamarca. Ambos registros se usaron también para establecer el diagnóstico de BAV-AG. La mortalidad por todas las causas fue la variable evaluable primaria. Durante un seguimiento con una mediana de 2,9 años [rango del intercuartil (IQR): 1,8–4,0] fallecieron 266 pacientes. Se documentó bloqueo aurículoventricular de alto grado en 67 (3,2%) pacientes, 25 de los cuales murieron. Entre los predictores independientes importantes de presentar BAV-AG, se incluyeron la oclusión de la arteria coronaria derecha, edad >65 años, género femenino, hipertensión, y diabetes. La tasa de mortalidad ajustada aumentó significativamente en pacientes con BAV-AG comparado con pacientes sin BAV-AG [cociente de riesgos instantáneos ¼ 3,14 (intervalo de confianza 95%: 2,04–4,84), P < 0,001]. Un análisis relevante 30 días después del STEMI mostró iguales tasas de mortalidad en los dos grupos.
Conclusión: la incidencia de BAV-AG en pacientes con STEMI tratado con pPCI se ha reducido comparado con los informes de la era trombolítica. Sin embargo, a pesar de esta mejora, en la era de pPCI el bloqueo AV de alto grado sigue siendo un marcador pronóstico severo. La tasa de mortalidad solo aumentó dentro de los primeros 30 días. Los pacientes con bloqueo aurículoventricular de alto grado que sobrevivieron más allá de este punto temporal tuvieron así un pronóstico igual al de los pacientes sin BAV-AG.
Palabras clave:
BLOQUEO AURíCULOVENTRICULAR
INFARTO DE MIOCARDIO
INTERVENCIóN PERCUTáNEA PRIMARIA
Summary
Aims: Primary percutaneous coronary intervention (pPCI) has replaced thrombolysis as treatment-of-choice for ST-segment elevation myocardial infarction (STEMI). However, the incidence and prognostic significance of high-degree atrioventricular block (HAVB) in STEMI patients in the pPCI era has been only sparsely investigated.
The objective of this study was to assess the incidence, predictors and prognostic significance of HAVB in STEMI patients treated with pPCI.
Methods and results: This study included 2073 STEMI patients treated with pPCI. The patients were identified through a hospital register and the Danish National Patient Register. Both registers were also used to establish the diagnosis of HAVB. All-cause mortality was the primary endpoint. During a median follow-up of 2.9 years [interquartile range (IQR) 1.8–4.0] 266 patients died. High-degree atrioventricular block was documented in 67 (3.2%) patients of whom 25 died. Significant independent predictors of HAVB included right coronary artery occlusion, age .65 years, female gender, hypertension, and diabetes. The adjusted mortality rate was significantly increased in patients with HAVB compared to patients without HAVB [hazard ratio = 3.14 (95% confidence interval 2.04–4.84), P < 0.001]. A landmark-analysis 30 days post-STEMI showed equal mortality rates in the two groups.
Conclusion: The incidence of HAVB in STEMI patients treated with pPCI has been reduced compared with reports from the thrombolytic era. However, despite this improvement high-degree AV block remains a severe prognostic marker in the pPCI era. The mortality rate was only increased within the first 30 days. High-degree atrioventricular block patients who survived beyond this time-point thus had a prognosis equal to patients without HAVB.
Keywords:
ATRIOVENTRICULAR BLOCK
MYOCARDIAL INFARCTION
PRIMARY PERCUTANEOUS INTERVENTION
Introducción
El bloqueo aurículoventricular de alto grado (BAV-AG por sus siglas en inglés) que complica el infarto agudo de miocardio (IAM) es conocido como un marcador de pronóstico ominoso que se asocia con un aumento de la tasa de mortalidad(1–8). Según los informes, la incidencia global de BAV-AG en pacientes con IAM es de 2%–13%, dependiendo del tipo de IAM estudiado y de la ubicación anatómica(1–6,9,10). Los pacientes con IAM inferior son considerablemente más propensos a presentar BAV-AG y su riesgo de presentar BAV-AG es de dos a cuatro veces mayor que el de los pacientes con IAM ubicación anterior(2,5,10). El infarto de miocardo con elevación del segmento ST (STEMI) también tienen un aumento del riesgo de BAV-AG comparado con pacientes no STEMI(6,9,10). Gracias a la mejora en las intervenciones terapéuticas para ambas fases, la aguda y la más tardía del IAM, en las últimas décadas se ha logrado disminuir la incidencia de BAV-AG en esta situación clínica(6,9). Se han identificado varias características clínicas y demográficas de los pacientes que predicen la aparición de BAV-AG en pacientes con IAM, incluyendo edad avanzada, sexo femenino, IAM inferior, antecedentes de IAM, tabaquismo, hipertensión, y diabetes(1,5,11).
Los estudios previos han demostrado las severas repercusiones clínicas del BAV-AG en pacientes con IAM tanto antes (10-19) como después (1–9) del inicio de la era trombolítica. Unos pocos estudios han incluido pacientes sometidos a intervención coronaria percutánea primaria (pPCI) pero ningún estudio se ha concentrado exclusivamente en las implicaciones de BAV-AG en pacientes sometidos a la pPCI recomendada por las guías para STEMI agudo(4,6,8,20). Dado que actualmente la mayoría de los pacientes con STEMI son tratados con pPCI, es importante aclarar si este abordaje terapéutico ha modificado la tasa y importancia pronóstica del desarrollo de BAV-AG luego de STEMI.
El propósito de este estudio fue describir las características de los pacientes que presentan BAV-AG, y valorar la incidencia y la importancia pronóstica de BAV-AG en una gran cohorte de pacientes consecutivos con STEMI tratados con pPCI.
¿Qué hay de nuevo?
- La incidencia del bloqueo auriculo-ventricular (BAV-AG) que complica el infarto de miocardo con elevación del segmento ST (STEMI) ha disminuido con la implementación de la intervención coronaria percutánea primaria (pPCI) como tratamiento de elección recomendado por las guías.
- La importancia pronóstica sumamente adversa de BAV-AG tras STEMI, aun si son tratados con la pPCI apropiada, no ha disminuido comparado con los informes de la era trombolítica.
- Hay varias características clínicas de los pacientes que predicen la aparición de BAV-AG en pacientes con STEMI tratados con pPCI. Entre ellas se encuentran la oclusión de la arteria coronaria derecha (ACD), edad > 65 años, género femenino, hipertensión, y diabetes.
Métodos
Pacientes y diseño del estudio
El estudio incluyó 2.073 ciudadanos daneses ingresados por STEMI para la realización de pPCI en nuestro centro cardíaco de atención terciaria en el Hospital Universitario Gentofte en Dinamarca en un período de 4 años. Los pacientes incluidos fueron identificados a través de un registro de hospital dedicado a los pacientes ingresados por síndrome coronario agudo. De acuerdo con las recomendaciones nacionales, los pacientes fueron hospitalizados durante un mínimo de 5 días luego de un STEMI. Como los pacientes podían ser transferidos a otros hospitales durante el curso de su estadía, se utilizó el Registro Danés de Pacientes para rastrear toda su internación.
Datos demográficos y datos clínicos de base
Los datos demográficos de base y los datos clínicos de todos los pacientes fueron recogidos de forma prospectiva en el momento del ingreso, y se los ingresaba en un registro del hospital diseñado específicamente para ese fin. La hipertensión, diabetes, e insuficiencia cardíaca congestiva se definieron en base al uso de la medicación destinada al tratamiento de esas enfermedades. La enfermedad de múltiples vasos fue definida como dos o más de dos arterias epicárdicas importantes con una estenosis >50%. Las lesiones tipo C fueron consideradas como lesiones complejas. El IAM recurrente fue definido como la reaparición de dolor torácico, combinado con un importante aumento de los biomarcadores cardíacos >5 días después del pPCI.
Los valores pico de los biomarcadores cardíacos fueron obtenidos de una base de datos regional. En el período de seguimiento del estudio, las guías y los ensayos de medición de los biomarcadores cardíacos del síndrome coronario agudo cambiaron más de una vez. Se utilizaron troponina-I, troponina-T, creatinquinasa MB, y combinaciones de las tres. Por lo tanto, la información sobre los pacientes incluidos fue heterogénea y no hubo ningún biomarcador que estuviera disponible durante todo el período del estudio.
La fracción de eyección del ventrículo izquierdo (FEVI) estimada mediante ecocardiografía transtorácica (ETT) se obtuvo de la base de datos de los estudios ecocardiográficos. Después de un STEMI, la fracción de eyección del ventrículo izquierdo se estima de rutina mediante ETT. Si las circunstancias clínicas así lo indican (pacientes hemodinámicamente estables) se la realiza inmediatamente. Por consiguiente, se dispuso de las estimaciones de la FEVI en pacientes que pertenecen al área de captación de los hospitales de la Universidad Gentofte, pacientes que tenían indicaciones para examen agudo y pacientes que pertenecían a otros hospitales que no pudieron transferirse antes del día 5 después del procedimiento de PCI.
Infarto de miocardo con elevación del segmento ST e intervención coronaria percutánea primaria
El infarto de miocardo con elevación del segmento ST fue definido como la presencia de dolor torácico durante >30 min, asociado con una elevación acumulada persistente del segmento ST >4 mm en por lo menos dos derivaciones contiguas precordiales de electrocardiograma (ECG), o >2 mm en dos o más derivaciones del ECG contiguas de miembros, o bloqueo de rama izquierda de reciente instalación.
La PCI primaria fue realizada de acuerdo a las guías de intervención contemporáneas(21).
Bloqueo aurículoventricular de alto grado
Para establecer el diagnóstico de BAV-AG durante la admisión, buscamos el registro del hospital arriba mencionado y el Registro Danés de Pacientes para los códigos ICD-10 de bloqueo AV, bradicardia, y código de procedimientos de implantación de electrodos de marcapasos transvenoso temporario y estimulación Zoll.
El bloqueo aurículoventricular de alto grado fue definido como bloqueo AV de segundo y tercer grado. Los registros médicos fueron obtenidos de los archivos del hospital y se los evaluó individualmente en todos los pacientes con un código compatible de diagnósticos o procedimientos en los registros. Los pacientes recibieron el diagnóstico final de BAV-AG si se disponía de la documentación del ECG, si la descripción de los procedimientos de los operadores de la pPCI contenía el diagnóstico o si el diagnóstico estaba directamente confirmado en la planilla clínica del médico de sala.
Variable evaluables
La mortalidad por todas las causas fue utilizada como variable evaluable primaria. La situación vital de todos los pacientes incluidos se obtuvo del Registro Danés de Identificación de Personas. El Registro Danés de Causas de Muerte se utilizó para identificar los códigos de diagnóstico de los eventos individuales de muerte. Posteriormente, las muertes fueron clasificadas como cardíacas, no cardíacas, o desconocidas. La muerte cardíaca fue examinada como una variable evaluable secundaria.
Estadística
Se compararon todas las características demográficas y clínicas a nivel basal para los pacientes con y sin BAV-AG, usando la prueba del chi cuadrado o el test exacto de Fisher.
Se aplicó un modelo de regresión logística de multivarianza para evaluar la asociación entre las características demográficas y clínicas basales y BAV-AG.
La probabilidad acumulada de la variable evaluable primaria en pacientes con y sin BAV-AG fue estimada por el método de Kaplan–Meier, y las pruebas de significación fueron realizadas usando una prueba de rangos logarítmicos. Se graficaron las estimaciones de la función de sobrevida para ilustrar el momento de la muerte. Se utilizó un abordaje similar para conducir un análisis de referencia al día 30 después de STEMI.
Realizamos un análisis de subgrupo para analizar si el bloqueo AV de segundo y tercer grado tenía los mismos efectos pronósticos. Se graficó el tiempo hasta la aparición del BAV-AG contra la probabilidad de mortalidad.
Se utilizó el análisis de regresión de peligros proporcionales de Univarianza de Cox para estimar el riesgo de muerte asociado con BAV-AG. Se ajustó un análisis de multivariable de Cox, incluyendo todas las caraccterísticas demográficas y clínicas de base. Además se incluyó el IAM recurrente como covarianza dependiente del tiempo. Se utilizó un modelo idéntico para estimar el riesgo de muerte cardíaca, la variable evaluable secundaria.
Los análisis de subgrupos, en cuanto a la influencia pronóstica y las modulaciones generales del modelo del nivel del pico de biomarcadores cardíacos post STEMI y FEVI se realizaron también mediante análisis de regresión de los riesgos proporcionales de Cox, incluyendo a todos los pacientes de los que se contara con mediciones. Se construyó un modelo para cada uno de los biomarcadores individuales y FEVI. Los modelos incluyeron las mismas covarianzas que en el modelo de multivarianza general arriba descrito.
Todos los análisis se realizaron usando SAS 9.1.3 (SAS Institute, Cary, NC, USA). Se consideró que los valores P bilaterales < 0,05 eran estadísticamente significativos.
Ética
Se obtuvieron las aprobaciones debidas del cómité de ética local, la Junta Danesa de Salud y la Agencia Danesa de Protección de Datos. Los autores tuvieron acceso pleno a los datos y se hacen responsables de su integridad. El estudio cumple con la declaración de Helsinki y todos los suplementos correspondientes.
Resultados
Bloqueo aurículoventricular de alto grado
De los 2073 pacientes, 67 (3,2%) presentaron BAV-AG durante el curso de la hospitalización. Cincuenta y seis de los eventos fueron bloqueos AV de tercer grado. De los 11 eventos de bloqueo AV de segundo grado, uno fue Mobitz tipo I, dos fueron Mobitz tipo II, cinco fueron bloqueos avanzados y tres no especificados. La vasta mayoría (91%) de los eventos BAV-AG ocurrieron dentro de las primeras 48 horas. En pacientes con lesiones causales en la ACD (n = 804), la incidencia de BAV-AG fue 7% (n = 53), mientras que la incidencia fue 1% (n = 9) en infartos de coronaria descendente anterior (DAI) (n = 928). De los cinco eventos restantes que implicaban BAV-AG, tres ocurrieron después de infartos en la arteria circunfleja izquierda, una en el tronco izquierdo y una en otro vaso.
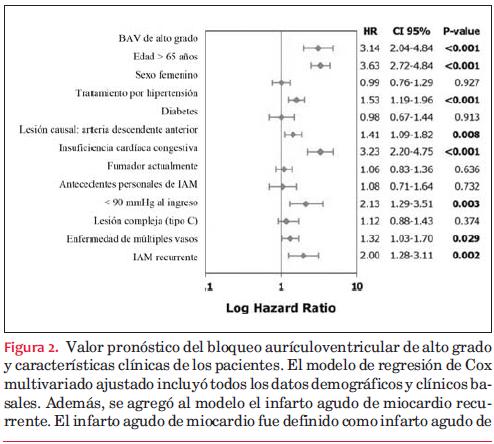
En la tabla 1 se presentan las características basales. El bloqueo aurículoventricular de alto grado fue más común en pacientes de edad más avanzada y mujeres. La diabetes, hipertensión, y la insuficiencia cardíaca congestiva también fueron significativamente más frecuentes en los pacientes con BAV-AG. La arteria coronaria derecha fue el vaso más a menudo responsable del IAM en los pacientes con BAV-AG. La arteria coronaria derecha como lesión responsable, edad >65 años, género femenino, hipertensión, y diabetes fueron hallados como predictores independientes de BAV-AG (tabla 2).
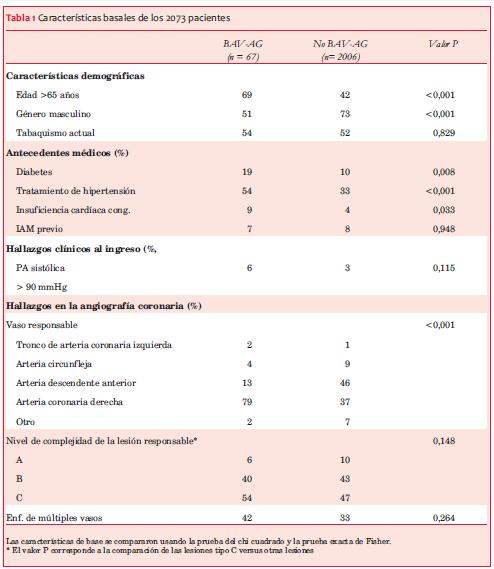
De los 67 pacientes que presentaron BAV-AG, a 53 se les implantó un sistema de estimulación temporario con posterioridad al evento. Tres pacientes presentaron taponamiento cardíaco luego de la colocación transitoria de un electrodo. Un evento fue fatal, otro requirió evacuación quirúrgica, y el último recibió un tratamiento conservador.
Mortalidad
En total fallecieron 266 pacientes durante una mediana de seguimiento de 2,9 años [rango de intercuartil (IQR) 1,8–4,0]. La muerte fue clasificada como de causa cardíaca en 144 pacientes, no cardíaca en 103 pacientes, y de causa desconocida en 19 pacientes. De los pacientes que murieron de causas cardíacas, 19 tenían BAV-AG.
De los 67 pacientes diagnosticados con BAV-AG, 25 pacientes fallecieron. La mediana del tiempo hasta la muerte en los pacientes con BAV-AG fue 1,5 días (IQR 0–9) mientras que fue 132 días (IQR 6–641) en los pacientes sin BAV-AG.
De los 98 pacientes con infartos de la ACD que fallecieron, 19 (20%) tuvieron BAV-AG. Entre los 131 pacientes con lesiones de la descendente anterior izquierda que fallecieron, 5 (4%) tenían BAV-AG.
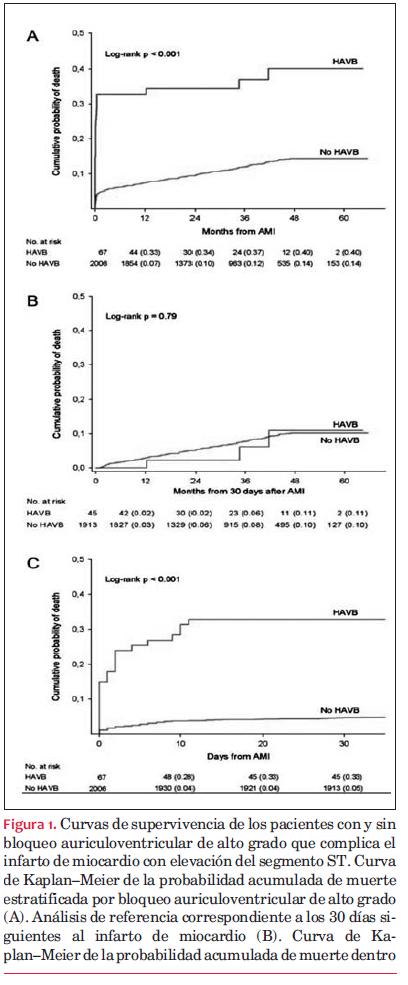
La figura 1 ilustra la probabilidad de supervivencia de pacientes con y sin BAV-AG. La tasa de mortalidad fue significativamente más elevada en los pacientes con BAV-AG (panel A). El análisis de referencia de supervivencia en pacientes vivos al día 30 post STEMI muestra que la tasa of mortalidad fue similar en los dos grupos (panel B). Dentro de los primeros 30 días siguientes a un STEMI, la probabilidad de muerte fue 33% en el grupo con BAV-AG, comparado con 5% en los pacientes sin BAV-AG (panel C). Los pacientes con bloqueo AV de tercer grado tuvieron una supervivencia significativamente reducida estimada similar al grupo BAV-AG general (44% versus 14%, rango logarítmico p <0,001) mientras que los pacientes con bloqueo AV de segundo grado no (27 vs. 15%, rango logarítmico p = 0,14).
En el análisis de regresión de univarianza de Cox, el cociente de riesgos instantáneos (hazard ratio) de muerte hallado fue 4,06 [intervalo de confianza 95% (IC) 2,69–6,14] en pacientes con BAV-AG comparado con los pacientes sin BAV-AG. Los resultados del análisis de regresión de univarianza de Cox se muestran en la figura 2. El modelo incluía todas las covarianzas enumeradas; el BAV-AG, la edad <65 años, y el tratamiento médico previo por hipertensión o insuficiencia cardíaca fueron significativamente más frecuentes en los pacientes que fallecieron. En el modelo de multivarianza se encontró que el bloqueo aurículoventricular de alto grado fue un predictor independiente de muerte con un cociente de riesgos instantáneos de 3,14 (IC 95%: 2,04–4,84). Con respecto a la variable evaluable secundaria muerte cardíaca, el BAV-AG también demostró ser un marcador pronóstico independiente con un cociente de riesgos instantáneos de 4,96 (IC 95%: 2,95–8,32).
En la tabla 3 se muestran los subanálisis de los subgrupos de pacientes con mediciones de biomarcadores cardíacos y FEVI. Tanto la troponina-I como FEVI resultaron ser pronósticos de mortalidad general. El bloqueo aurículoventricular de alto grado se mantuvo como un predictor independiente de muerte en los cuatro subanálisis. En los cuatro análisis la estimación de riesgo de BAV-AG sobre la mortalidad fue similar tal modelo general de multivarianza.
Discusión
Este estudio es, a nuestro entender, el primero que evalúa la incidencia y la importancia pronóstica de BAV-AG que complica el STEMI en la era de pPCI. En esta gran cohorte de pacientes con STEMI tratados de forma consecutiva en un centro de PCI de alto volumen, encontramos una reducción relativa de 40–60% de la incidencia global de BAV-AG que complica al STEMI, comparado con los informes de la era trombolítica. En particular, la aparición de BAV-AG pasados los primeros dos días del STEMI en pacientes tratados con pPCI se redujo hasta 10% en cifras absolutas. Sin embargo, a pesar de esta mejora, el BAV-AG sigue siendo un marcador pronóstico severo en la era de pPCI. Por consiguiente, los pacientes que se presentan con BAV-AG durante la hospitalización luego de un STEMI siguen teniendo una tasa de mortalidad significativamente elevada. La probabilidad de morir dentro del período de observación fue más de tres veces mayor en los pacientes con bloqueo aurículoventricular de alto grado comparado con los pacientes sin BAV-AG.
Incidencia
La incidencia de BAV-AG en este estudio fue 3,2% en total, lo que es de 2% a 4% menor que lo descrito en los estudios de pacientes con STEMI en la era trombolítica(2,5). Tanto Nguyen y colaboradores (6) como Harpaz y colaboradores(1) hallaron tasas de incidencia similares a las nuestras, o incluso más bajas. Sin embargo, estos estudios incluían pacientes sin STEMI que no presentan el mismo riesgo de BAV-AG.
Solo 9% de los eventos con BAV-AG ocurrieron después de 48 horas en nuestro estudio. Los informes de la era trombolítica demostraban tasas de incidencia de hasta 20%(2). Esto indica que como tratamiento de elección para STEMI el pPCI podría atenuar el riesgo de un BAV-AG de instalación tardía.
Aplin y colaboradores(2) comunicaron una incidencia de BAV-AG de 9,4% en pacientes con infartos inferiores y 2,5% en infartos anteriores, lo que es ligeramente superior a lo que hallamos nosotros, a saber: 7 y 1% en pacientes con lesiones causantes de ACD y descendente anterior izquierda, respectivamente.
Además de identificar a la ACD como lesión responsable, nuestro estudio identificó la edad <65 años, sexo femenino, tratamiento de la hipertensión, y diabetes como marcadores predictivos independientes de ocurrencia de BAV-AG. Esto está de acuerdo con estudios anteriores(5).
Nuestros resultados indican que la amplia mayoría de los eventos de BAV-AG después de STEMI tratados con pPCI son pasajeros. Solo seis (9%) pacientes requirieron implante de un marcapasos a permanencia antes del alta como consecuencia de BAV-AG persistente o recurrente. Esto coincide con los resultados de estudios previos y es congruente con las teorías fisiopatológicas de BAV-AG en condiciones de STEMI reciente(22–25).
Encontramos un 6% de riesgo de taponamiento cardíaco como complicación de la colocación temporaria de electrodos de estimulación. Esto enfatiza la necesidad de realizar una cuidadosa consideración al determinar la modalidad de estimulación de emergencia.
Etiología
Se piensa que la etiología del BAV-AG en casos de STEMI es multifactorial y depende de la ubicación de la lesión responsable. La arteria del nodo AV normalmente sale de la porción distal de la ACD(26). La circulación arterial colateral del nodo AV se nutre de las ramas septales de la porción proximal de la DAI. El bloqueo aurículoventricular de alto grado habitualmente está ubicado por encima del haz de His, si complica el STEMI con oclusión de la ACD, mientras que habitualmente está por debajo del haz de Hiss en las lesiones de la arteria coronaria descendente anterior izquierda. El tejido de conducción del nodo AV es resistente al daño permanente por isquemia, gracias al alto contenido de glucógeno intracelular, su aporte de sangre arterial rico y complejo, y la capacidad de absorción de nutrientes y oxígeno por difusión a partir de los sinusoides venosos circundantes(23). Sin embargo, se piensa que la agresión isquémica de un STEMI es suficiente para provocar una alteración pasajera de la función de las fibras de conducción. Solo en una minoría de casos, habitualmente cuando la lesión responsable es la arteria descendente anterior que ha producido un daño miocárdico extenso, el BAV-AG es provocado por el infarto y la necrosis del tejido de conducción. En general, se piensa que el BAV-AG es provocado por un aumento del tono parasimpático o la liberación local de potasio o adenosina, o una mezcla de todos los mecanismos arriba mencionados(27). Estas consideraciones mecanicistas nos ayudan a comprender el carácter pasajero de la mayoría de los acontecimientos que involucran BAV-AG, lo que también quedó de manifiesto en nuestro estudio.
En la era trombolítica, se mostró que la terapia trombolítica precipitaba la aparición de BAV-AG(1,8). Se sospecha que el efecto se origina porque la revascularización induce una elevación de la actividad vagal aferente, que a su vez induce un BAV-AG pasajero. No se sabe si este efecto se modifica cuando la reperfusión se obtiene gracias a la colocación de una prótesis intracoronaria.
Mortalidad
El bloqueo aurículoventricular de alto grado se asoció a un aumento significativo del riesgo, tanto de mortalidad global como de muerte cardíaca, independientemente de todos los otros factores confundentes clínicamente importantes bajo estudio. De manera consistente, se ha visto que el bloqueo aurículoventricular de alto grado marca una mortalidad a corto plazo adversa, mientras que el impacto a largo plazo es cuestionable(1–3,5,11). Esto concuerda con nuestros hallazgos. Entre pacientes con y sin BAV-AG se notó una diferencia pronunciada en la probabilidad de supervivencia aun después de 5 años. Sin embargo, la tasa de mortalidad fue similar en los dos grupos ya después de 30 días, y el análisis de referencia de los supervivientes a los 30 días no mostró diferencias en los desenlaces. Por ende, después de 30 días, los pacientes con BAV-AG tuvieron el mismo riesgo de muerte que el que se demostró en pacientes con STEMI que no presentaron BAV-AG.
Lo más probable es que las diferencias observadas en la mortalidad de los pacientes con BAV-AG en quienes la ACD y la descendente anterior son las lesiones responsables del STEMI reflejen una diferencia en la fisiopatología de base, como se analiza arriba. Aproximadamente 55% de los pacientes con BAV-AG asociado a la oclusión de la descendente anterior fallecieron, mientras que la cifra de muertes fue solo 36% en los pacientes que tuvieron oclusión de la ACD. La explicación más probable es que los infartos en los que la descendente anterior es la lesión responsable suelen ser más extensos.
Los subanálisis de los biomarcadores cardíacos como medidas sustitutas del tamaño del infarto, revelaron que la BAV-AG sigue acompañándose de un mayor riesgo de mortalidad. Asimismo, la estimación del impacto pronóstico de BAV-AG fue significativa y se mantuvo virtualmente inalterada en el subanálisis de la función ventricular izquierda posterior a STEMI valorada como FEVI mediante la ETT.
Implicaciones clínicas
Hay tres importantes implicaciones clínicas de nuestro estudio que es preciso enfatizar. En primer lugar, nuestros resultados avalan el uso de pPCI como tratamiento de elección para los pacientes con STEMI, ya que observamos una reducción notoria de la incidencia de BAV-AG usando este tratamiento. En segundo lugar, los pacientes con BAV-AG que complica el STEMI requiere una especial atención en el curso del ingreso del paciente, ya que desgraciadamente el impacto pronóstico del BAV-AG no se ha reducido comparado con la era trombolítica. En tercer lugar, parece que 30 días post STEMI las tasas de mortalidad de BAV-AG y pacientes sin BAV-AG son iguales, indicando que bien manejados, estos pacientes tienen el mismo pronóstico.
Limitaciones del estudio
Idealmente, la estimación de reducción de la incidencia de BAV-AG después de STEMI en la era de pPCI debería incluir un grupo control con pacientes con STEMI tratados con trombolisis en el mismo período en nuestro centro de procedimientos cruentos. Sin embargo, dado que la estrategia de reperfusión era uniforme en el período de estudio, a saber, siempre se usaba pPCI, ese tipo de estudio no es posible. Por ende, nuestro estudio se limita a comparar cohortes históricas.
Nuestro estudio contaba con información incompleta de la FEVI y los valores pico de los biomarcadores cardíacos, a los que se reconoce ampliamente como importantes marcadores de riesgo de mortalidad después de STEMI. Los análisis realizados sobre estos factores mostraron consistentemente que el BAV-AG fue un marcador pronóstico independiente significativo a pesar del ajuste por estos factores. La información de estas variables de todos los pacientes incluidos podría haber modificado nuestra estimación del impacto de BAV-AG después de un STEMI. Sin embargo, el análisis de multivarianza de Cox fue ajustado para un amplio número de covarianzas que predicen adversamente el desenlace de los pacientes después de un STEMI y a pesar de esto, el BAV-AG se mantuvo como un marcador pronóstico ominoso independiente.
Todos los registros tienen un riesgo intrínseco de subdeclaración, que en nuestro estudio podría llevar a la subestimación de la incidencia de BAV-AG. Sin embargo, los registros daneses tienen una validez única, y siendo el BAV-AG un evento clínicamente significativo, estimamos que es improbable que se omita su registro. Por ende, creemos que la influencia de la subdeclaración sería menor.
Conclusión
En 2073 pacientes consecutivos con STEMI tratados con pPCI, encontramos que se podía predecir el BAV-AG de manera independiente por factores como la edad >65 años, el sexo femenino, las oclusiones de la ACD, diabetes, e hipertensión. La incidencia del BAV-AG complicando STEMI se ha reducido en la era de las pPCI, comparado con la era trombolítica. Sin embargo, el pronóstico adverso a corto plazo asociado con BAV-AG se mantiene inalterado. Pasados los 30 primeros días después de un STEMI, el pronóstico es igual, independientemente de si el paciente presentó o no BAV-AG en la fase aguda.
Agradecimientos
Queremos agradecer a todos los operarios de PCI y médicos tratantes del Departamento de Cardiología del Hospital Universitario Gentofte de Copenhague.
Conflicto de interés: P.E.B.T. recibió becas de investigación y honorarios de conferencista de Boston Scientific, St Jude Medical, y Medtronic Inc. Ningún otro autor declaró posibles conflictos de interés.
Bibliografía
1. Harpaz D, Behar S, Gottlieb S, Boyko V, Kishon Y, Eldar M. Complete atrioventricular block complicating acute myocardial infarction in the thrombolytic era. SPRINT Study Group and the Israeli Thrombolytic Survey Group. Secondary Prevention Reinfarction Israeli Nifedipine Trial. J Am Coll Cardiol 1999;34:1721–8.
2. Aplin M, Engstrom T, Vejlstrup NG, Clemmensen P, Torp-Pedersen C, Kober. Prognostic importance of complete atrioventricular block complicating acute myocardial infarction. Am J Cardiol 2003;92:853–6.
3. Berger PB, Ruocco NA Jr, Ryan TJ, Frederick MM, Jacobs AK, Faxon DP. Incidence and prognostic implications of heart block complicating inferior myocardial infarction treated with thrombolytic therapy: results from TIMI II. J Am Coll Cardiol 1992; 20:533–40.
4. Clemmensen P, Bates ER, Califf RM, Hlatky MA, Aronson L, George BS, et al. Complete atrioventricular block complicating inferior wall acute myocardial infarction treated with reperfusion therapy. TAMI Study Group. Am J Cardiol 1991;67:225–30.
5. Meine TJ, Al-Khatib SM, Alexander JH, Granger CB, White HD, Kilaru R, et al. Incidence, predictors, and outcomes of high-degree atrioventricular block complicating acute myocardial infarction treated with thrombolytic therapy. Am Heart J 2005;149:670–4.
6. Nguyen HL, Lessard D, Spencer FA, Yarzebski J, Zevallos JC, Gore JM, et al. Thirty-year trends (1975–2005) in the magnitude and hospital death rates associated with complete heart block in patients with acute myocardial infarction: a population-based perspective. Am Heart J 2008;156:227–33.
7. Archbold RA, Sayer JW, Ray S, Wilkinson P, Ranjadayalan K, Timmis AD. Frequency and prognostic implications of conduction defects in acute myocardial infarction since the introduction of thrombolytic therapy. Eur Heart J 1998;19:893–8.
8. Rathore SS, Gersh BJ, Berger PB, Weinfurt KP, Oetgen WJ, Schulman KA, et al. Acute myocardial infarction complicated by heart block in the elderly: prevalence and outcomes. Am Heart J 2001;141:47–54.
9. Spencer FA, Jabbour S, Lessard D, Yarzebski J, Ravid S, Zaleskas V, et al. Two-decade-long trends (1975–1997) in the incidence, hospitalization, and long-term death rates associated with complete heart block complicating acute myocardial infarction: a community-wide perspective. Am Heart J 2003;145: 500–7.
10. Goldberg RJ, Zevallos JC, Yarzebski J, Alpert JS, Gore JM, Chen Z, et al. Prognosis of acute myocardial infarction complicated by complete heart block (theWorcester Heart Attack Study). Am J Cardiol 1992;69:1135–41.
11. Behar S, Zissman E, Zion M, Goldbourt U, Reicher-Reiss H, Shalev Y, et al. Complete atrioventricular block complicating inferior acute wall myocardial infarction: short- and long-term prognosis. Am Heart J 1993;125:1622–7.
12. Dubois C, Pierard LA, Smeets JP, Carlier J, Kulbertus HE. Long-term prognostic significance of atrioventricular block in inferior acute myocardial infarction. Eur Heart J 1989;10:816–20.
13. Feigl D, Ashkenazy J, Kishon Y. Early and late atrioventricular block in acute inferior myocardial infarction. J Am Coll Cardiol 1984;4:35–8.
14. Ginks WR, Sutton R, OhW, Leatham A. Long-term prognosis after acute anterior infarction with atrioventricular block. Br Heart J 1977;39: 186–9.
15. Haim M, Hod H, Kaplinsky E, Reicher-Reiss H, Barzilay J, Boyko V, et al. Frequency and prognostic significance of high-degree atrioventricular block in patients with a first non-Q-wave acute myocardial infarction. The SPRINT Study Group. Second Prevention Reinfarction Israeli Nifedipine Trial. Am J Cardiol 1997;79:674–6.
16. Kaul U, Hari Haran V, Malhotra A, Bhatia ML. Significance of advanced atrioventricular block in acute inferior myocardial infarction: a study based on ventricular function and Holter monitoring. Int J Cardiol 1986;11:187–93.
17. McDonald K, O’Sullivan JJ, Conroy RM, Robinson K, Mulcahy R. Heart block as a predictor of in-hospital death in both acute inferior and acute anterior myocardial infarction. Q J Med 1990;74: 277–82.
18. Nicod P, Gilpin E, Dittrich H, Polikar R, Henning H, Ross J Jr. Long-term outcome in patients with inferior myocardial infarction and complete atrioventricular block. J Am Coll Cardiol 1988;12:589–94.
19. Tans AC, Lie KI, Durrer D. Clinical setting and prognostic significance of high degree atrioventricular block in acute inferior myocardial infarction: a study of 144 patients. Am Heart J 1980;99:4–8.
20. Kushner FG, Hand M, Smith SC Jr, King SB III, Anderson JL, Antman EM, et al. 2009 Focused Updates: ACC/AHA Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction (Updating the 2004 Guideline and 2007 Focused Update) and ACC/AHA/SCAI Guidelines on Percutaneous Coronary Intervention (Updating the 2005 Guideline and 2007 Focused Update). A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2009;120:2271–306.
21. Silber S, Albertsson P, Aviles FF, Camici PG, Colombo A, Hamm C, et al. Guidelines for percutaneous coronary interventions. The Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology. Eur Heart J 2005; 26:804–47.
22. Goodfellow J, Walker PR. Reversal of atropine-resistant atrioventricular block with intravenous aminophylline in the early phase of inferior wall acute myocardial infarction following treatment with streptokinase. Eur Heart J 1995;16:862–5.
23. Waller BF, Gering LE, Branyas NA, Slack JD. Anatomy, histology, and pathology of the cardiac conduction system–Part V. Clin Cardiol 1993;16: 565–9.
24. Webb SW, Adgey AA, Pantridge JF. Autonomic disturbance at onset of acute myocardial infarction. Br Med J 1972;3:89–92.
25. Wesley RC Jr, Lerman BB, DiMarco JP, Berne RM, Belardinelli L. Mechanism of atropine-resistant atrioventricular block during inferior myocardial infarction: possible role of adenosine. J Am Coll Cardiol 1986;8:1232–4.
26. Van der Hauwaert LG, Stroobandt R, Verhaeghe L. Arterial blood supply of the atrioventricular node and main bundle. Br Heart J 1972;34:1045–51.
27. Simons GR, Sgarbossa E, Wagner G, Califf RM, Topol EJ, Natale A. Atrioventricular and intraventricular conduction disorders in acute myocardial infarction: a reappraisal in the thrombolytic era. Pacing Clin Electrophysiol 1998;21:2651–63.