Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
Print version ISSN 0797-0048On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.28 no.1 Montevideo Apr. 2013
Artículo de revisión
De la célula a la cabecera del paciente: algunas consideraciones fisiopatológicas sobre la estimulación cardíaca
Dr. Oswaldo Gutiérrez Sotelo1
1. Cardiólogo, electrofisiólogo.
Servicio de Cardiología, Hospital “Dr. Rafael A. Calderón Guardia”, San José, Costa Rica. Correspondencia: Dr. Oswaldo Gutiérrez Sotelo. CP 11011. Ap. Postal 471-1300, San José, Costa Rica. Correo electrónico: oswcr@hotmail.com
Conflictos de interés: el autor ha recibido apoyo financiero para actividades académicas de los representantes de las marcas Medtronic, Saint Jude Medical, Biotronik, Astra-Zeneca, Sanofi-Aventis, Abbott y Merck, Sharp & Dhome.
Recibido octubre 23, 2012; aceptado enero 15, 2013
Resumen
Se presentan algunos conceptos de fisiopatología miocárdica celular, que son susceptibles de modificar con estimulación cardíaca y que tienen aplicación clínica; con fines tanto diagnósticos como terapéuticos, tanto en bradiarritmias como taquiarritmias.
Palabras clave:
ESTIMULACIóN CARDíACA ARTIFICIAL
BRADICARDIA
ARRITMIAS CARDíACAS
Summary
Myocardial cell pathophysiology is presented as related to possible modification by electrical stimulation of the myocardium. The goal is a diagnostic and therapeutic clinical application such as is seen with bradyarrhythmias and tachyarrhythmias.
Key words:
CARDIAC PACING, ARTIFICIAL
BRADYCARDIA
ARRHYTHMIAS, CARDIAC
Introducción
Desde que los fisiólogos comprendieron que las fibras nerviosas y musculares eran tejidos que se podían estimular artificialmente con impulsos eléctricos desde un generador (excitabilidad), esta técnica surgió como una necesidad terapéutica para los pacientes que perdían la capacidad del miocardio para autogenerar sus propios impulsos (automatismo) (1). A pesar que el primer marcapasos totalmente implantable se colocó hace más de 50 años, sorprendentemente, el principio básico esencial de esa técnica no ha variado: un generador de impulsos y un cable conductor. En cambio, el constante desarrollo de materiales más resistentes y predecibles y de programas informáticos que optimizan la administración de los impulsos bajo diferentes desafíos fisiológicos, es admirable.
Asimismo, desde que se comenzó a comprender la fisiopatología de los mecanismos arritmogénicos, también la estimulación cardíaca (EC) ha desempeñado un rol diagnóstico y terapéutico decisivo; no solo en la prevención de taquiarritmias dependientes de bradicardia, sino en el diagnóstico y tratamiento de las que ocurren por mecanismo de reentrada (2), así como de las condiciones que comprometen la secuencia de los eventos eléctricos y mecánicos del miocardio. Además, la EC constituye una herramienta imprescindible durante los procedimientos de ablación por catéter.
Estimulación cardiaca antibradicardia
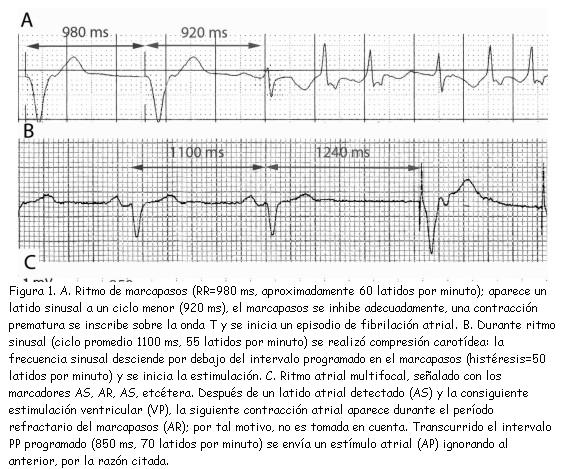
En los marcapasos, la función de detección (en inglés, sensing) es tan importante como la de estimulación, dado que es imprescindible evitar un conflicto entre los latidos estimulados y los propios del paciente, cuando existen. En ocasiones, puede ser desafiante hacer esta diferenciación, la cual debe partir siempre del principio del intervalo de tiempo programado en el marcapasos: cualquier evento propio que aparezca antes de completarse dicho intervalo, el marcapasos tiene que inhibirse y permitir que el paciente continúe con su ritmo propio (figura 1A). Recíprocamente, si el ritmo propio tiene un ciclo mayor que el programado, el marcapasos debe iniciar la estimulación (figura 1B). La excepción la constituye el período refractario programado en el marcapasos (3): de manera análoga a dicho período en la fibra miocárdica, cualquier evento propio del paciente que suceda durante este período, no será detectado ni reiniciará el intervalo programado en el marcapasos; este fenómeno es más comúnmente observado durante la estimulación atrial (figura 1C).
Estimulación antibradicardia como terapia antitaquicardia
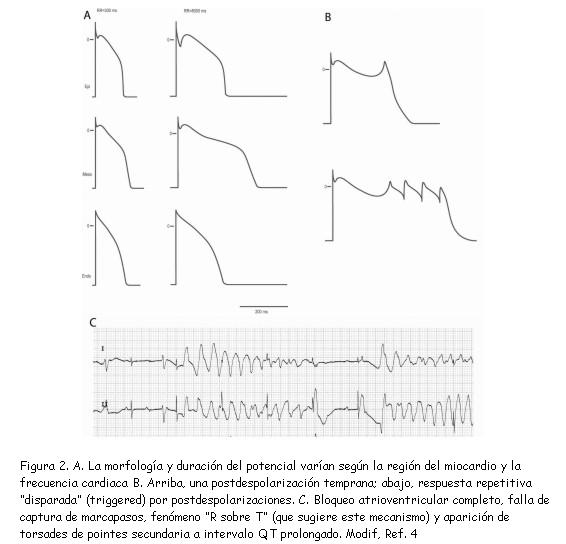
Fisiológicamente, existen variaciones discretas en la morfología y duración del potencial de acción entre epicardio, mesocardio y endocardio (figura 2A) (4). A medida que disminuye la frecuencia cardíaca, estas variaciones se hacen más marcadas (dispersión de la repolarización), lo que explica la prolongación proporcional del intervalo QT en el electrocardiograma (2,5). En situaciones patológicas como la bradicardia extrema o la presencia de corrientes iónicas anormales (canalopatías), dicha prolongación favorece la aparición de una postdespolarización (figura 2B) durante la fase 3 o 4 del potencial de acción: si el tejido está en período refractario relativo y esta alcanza el valor umbral, se producirá una nueva despolarización; y si el fenómeno se repite, se desencadena una taquiarritmia, por lo general taquicardia ventricular (TV) polimorfa asociada a intervalo QT prolongado (“torsades de pointes”). En consecuencia, esta puede prevenirse con fármacos cronotrópicos (isoproterenol, dopamina) o con EC a una frecuencia relativamente elevada. Este escenario se observa con cierta frecuencia en pacientes que ingresan a la sala de urgencias con bradicardia marcada debida a bloqueo atrioventricular completo y desarrollan torsades de pointes (figura 2C); es decir, presentan una taquiarritmia desencadenada por una bradiarritmia, que se debe tratar con EC.
Estimulación diagnóstica durante una taquicardia
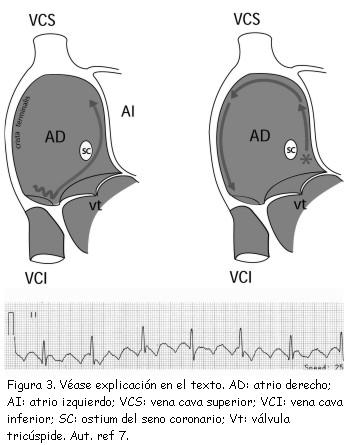
Existen diferentes maniobras de EC durante una taquicardia, supraventricular o ventricular, que permiten establecer el circuito anatómico y sugerir su mecanismo. Esta herramienta es especialmente útil en aquellas cuyo mecanismo es reentrada o movimiento circular (circus movement), que tiene como requisito indispensable para su perpetuación, la presencia de velocidades de conducción diferentes a lo largo del circuito de la taquicardia, usualmente determinadas por la presencia de barreras anatómicas o funcionales. De manera análoga al desencadenamiento espontáneo de diversas taquiarritmias por contracciones prematuras o “extrasístoles”, también mediante EC se administran “extraestímulos” a un intervalo de tiempo específico con el mismo fin. La EC también se utiliza para determinar el sitio crítico o indispensable dentro del circuito de reentrada e incluso, para determinar si un procedimiento de ablación ha sido exitoso. Por ejemplo, el flúter atrial típico recorre el atrio derecho en sentido antihorario y las zonas de conducción lenta, con respecto al resto de la cavidad, son la crista terminalis y el itsmo cavotricuspideo (figura 3, izquierda, flecha tortuosa); cuando el impulso abandona este “sitio de salida del circuito” –que es silente en el electrocardiograma–, se inicia la inscripción de la onda F del flúter, la cual es característicamente negativa en derivaciones inferiores, porque el primer lugar por el que el impulso asciende es el tabique interatrial (trazado de ritmo inferior). Cuando el flúter se trata con radiofrecuencia, se intenta bloquear la conducción a nivel del itsmo cavotricuspídeo, sin el cual no puede perpetuarse el movimiento circular. Para corroborar que se ha eliminado la conducción a ese nivel, se aplica estimulación cardiaca desde las cercanías del ostium del seno coronario (figura 3, derecha, asterisco) y se evalúa si la despolarización de la región más caudal de la pared libre del atrio derecho, cerca del anillo tricuspídeo, es la última en hacerlo; esto confirma que el impulso tiene que recorrer el tabique interatrial, techo, crista terminalis y pared libre del atrio derecho hasta llegar a ese punto. Si no se ha eliminado la conducción en el istmo completamente y todavía existe conducción a ese nivel, el impulso toma este camino más corto y despolariza esta región antes que el resto de estructuras del atrio derecho. Análogamente, se puede estimular desde este punto y corroborar que la zona del ostium del seno coronario sea la última en despolarizarse (6,7).
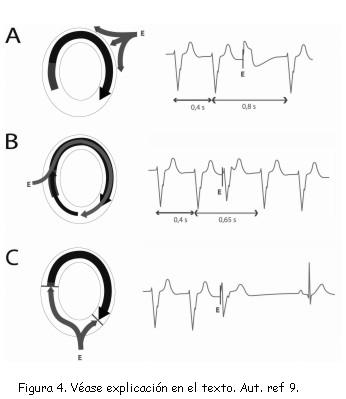
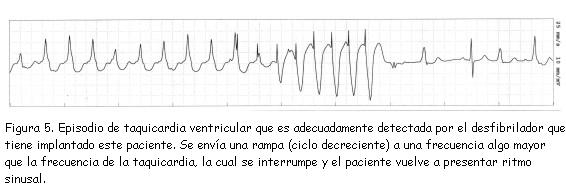
Mediante EC es posible interrumpir una taquicardia, de la misma forma como es posible inducirla. En la figura 4C, izquierda, un impulso aplicado “E” logra invadir el circuito de una TV, pero en forma antidrómica; es decir, en sentido contrario al de la taquicardia; al encontrarse con el frente de despolarización, ambos colisionan (líneas rojas) y se interrumpe súbitamente el movimiento circular (derecha). Este es el principio por el cual pueden terminarse, en forma indolora, ritmos cuyo mecanismo es reentrada, sea en el laboratorio de electrofisiología o como un modo de terapia incluido en los desfibriladores implantables; esta modalidad terapéutica evita la necesidad de administrar descargas de corriente directa por el dispositivo, lo cual significa una enorme diferencia para la calidad de vida del paciente y para la longevidad de la batería. Existen varias modalidades de EC antitaquicardia: las más utilizadas son la “ráfaga” o “salva” (burst), en la cual se administran varios estímulos continuos a una frecuencia fija; y la rampa (ramp), en la cual, se administran a una frecuencia creciente (o con ciclo decreciente, figura 5) (3,9).
En los pacientes con miocardiopatía dilatada y bloqueo de la rama izquierda del haz de His, existe un retardo contráctil de las regiones más distales (posterior y lateral) en comparación a las más proximales (tabique y región anterior) del ventrículo izquierdo (VI), debido a dicho trastorno de conducción; en especial, en aquellos cuya duración del complejo QRS es mayor de 150 ms. Entonces, surgen anomalías en la secuencia de los eventos eléctricos y mecánicos atrioventriculares, interventriculares e intraventriculares. Mediante EC, es posible restaurar la sincronía de tales eventos: se implanta un electrodo de estimulación epicárdico (a través del seno coronario) en la pared posterior o lateral del VI, lo que permite que el inicio de la contracción anteceda a los demás segmentos y en consecuencia, aumente el desempeño contráctil y por ende, la sintomatología y el pronóstico (10). Es importante tener en cuenta que los eventos mecánicos que siguen a la estimulación eléctrica toman un tiempo variable (acoplamiento excitación-contracción). Por ejemplo, si existe un retardo significativo de la conducción interatrial, la contracción del atrio izquierdo se iniciará tardíamente, cuando ya ha comenzado la contracción del VI; esto producirá una contracción atrial izquierda en presencia de la válvula mitral cerrada y por ende, onda “A” cañón en el pulso venoso, así como palpitaciones y disnea; es decir, “síndrome de marcapasos”. Además, la pérdida del aporte de la contracción atrial al gasto cardíaco en este tipo de pacientes inestables puede empeorar su condición clínica. Esta situación debe resolverse con una adecuada programación del momento oportuno de la contracción atrial, de la ventricular derecha y de la izquierda, para lo cual, se utilizan métodos de EC basados en las señales eléctricas intracardiacas o bien, en el flujo transmitral mediante ecocardiografía.
Conclusión
Desde su concepción, la EC es una herramienta diagnóstica y terapéutica que ha superado con creces al simple marcapasos de los años 50. El entendimiento de los fenómenos fisiológicos y fisiopatológicos, tanto en las bradiarritmias como en las taquiarritmias, ha permitido grandes avances en el uso de EC con fines diagnósticos y terapéuticos.
Bibliografía
1. Berne RL, Levy MN. Fisiología. Madrid: Harcourt Brace; 2003.
2. Rubart M, Zipes DP. Genesis of Cardiac Arrhythmias: Electrophysiologic Considerations. En: Bonow RO, Mann DL, Zipes DP, Libby P. Braunwald´s Heart Disease. A textbook of cardiovascular medicine. 9th ed. Philadelphia: Saunders; 2011.p.672-86.
3. Chiale P, Garro H, Pastori J, Sánchez RA, Selva HO. Marcapasos, resincronizadores y cardiodesfibriladores implantables. Fundamentos técnicos, indicaciones y manejo clínico.1ª ed. Buenos Aires: Editado por los autores; 2008.
4. Liu DW, Gintant GA, Antzelevitch C. Ionic bases for electrophysiological distinctions among epicardial, midmyocardial, and Endocardialmyocytes from the free wall of the canine left ventricle. Circ Res 1993;72:671-87.
5. Volders PG, Vos MA; Szabo B, Sipido KR, de Groot SHM, Gorgels AP, et al. Progress in the understanding of cardiac early afterdepolarizations and torsades de pointes: time to revise current concepts. Cardiovascular Research 2000; 46: 376–92.
6. Cosío FG, Pastor A, Núñez A, Magalhaes AP, Awamleh P. Flúter auricular: perspectiva clínica actual. Rev EspCardiol 2006;59:816-31.
7. Gutiérrez O. Aplicaciones de la estimulacióncardiaca: 50 años de aprendizaje. Rev Costarr Cardiol 2008; 10: 3-7.
8. Stevenson WG, Friedman PL, Sager PT; Saxon LA, Kocovic D, Harada T, et al. Exploring Postinfarction Reentrant Ventricular Tachycardia With Entrainment Mapping. J Am Coll Cardiol 1997;29:1180–9.
9. Gutiérrez O. Cardiodesfibriladores implantables. En: Gutiérrez O. Cómo interpretar electrocardiogramas de pacientes con marcapasos cardiacos. 1° ed. San José. Editado por el autor; 2012 p.135-139. .
10. Dickstein K, Vardas PE, Auricchio A, Daubert JC, Linde C, McMurray J, et al; ESC Committee for Practice Guidelines (CPG). An update of the 2008 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure and the 2007 ESC guidelines for cardiac and resynchronization therapy. Eur Heart J 2010; 31: 2677-87.