Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
Print version ISSN 0797-0048On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.28 no.1 Montevideo Apr. 2013
Artículo de revisión Insuficiencia valvular pulmonar en el posoperatorio alejado de tetralogía de Fallot
Daniel Felipe Guzzo de León
Insuficiencia valvular pulmonar en el posoperatorio alejado de tetralogía de Fallot.
Aporte del ecocardiograma transtorácico convencional para la toma de decisiones
Dr. Daniel Felipe Guzzo de León 1
1. Coordinador del Comité Docente de Cardiología Pediátrica. Facultad de Medicina. Universidad de la República. Montevideo, Uruguay.
Correspondencia: Coronel Alegre 1168/101. CP: 11300. Montevideo, Uruguay.
Correo electrónico: guzzo@adinet.com.uy
Recibido diciembre 11, 2012; aceptado febrero 19, 2013
Resumen
La insuficiencia valvular pulmonar constituye uno de los principales problemas en el posoperatorio alejado de tetralogía de Fallot, siendo su incidencia muy frecuente y dependiente de múltiples aspectos. En este trabajo se efectúa una revisión relacionada con la utilidad de la ecocardiografía transtorácica convencional como instrumento para la evaluación de los pacientes con insuficiencia valvular pulmonar en el posoperatorio alejado de la tetralogía de Fallot. Se exponen los principales conceptos fisiopatológicos de esta entidad y, en función de ellos, se presentan los parámetros ecocardiográficos más relevantes a tener en cuenta en la valoración de estos pacientes. Finalmente se consideran las pautas y la oportunidad para el reemplazo valvular pulmonar.
Palabras clave:
TETRALOGíA DE FALLOT-cirugía
INSUFICIENCIA DE LA VÁLVULA PULMONAR
CIRUGíA TORÁCICA-métodos
PROCEDIMIENTOS QUIRÚRGICOS OPERATORIOS -métodos
ECOCARDIOGRAFíA
ECOCARDIOGRAFíA TRIDIMENSIONAL
Summary
Pulmonary valve regurgitation is one of the main problems in the late post-op of Tetrallogy of Fallot, having a great incidence and depending on many aspects . In these paper a review is done considering the usefulness of conventional transtoracic ecocardiography as a tool to evaluate patients with pulmonary regurgitation.in the late post-op of Tetralogy of Fallot.
Main physiopathologic concepts about these entity are presented, and as a function of that, the most important ecocardiographic parameters to be considered evaluating these patients are also described. Finally guidelines on the opportunity for pulmonary valve replacement are considered.
Key words:
TETRALOGY OF FALLOT-surgery
PULMONARY VALVE INSUFICIENCY
THORACIC SURGERY-methods
SURGICAL PROCEDURES, OPERATIVE-methods
ECHOCARDIOGRAPHY
TRI-DIMENSIONAL ECHOCARDIOGRAPHY
Introducción
Una proporción cada vez mayor de estudios, tanto clínicos como de investigación básica, ponen en evidencia y jerarquizan la importancia del conocimiento fisiopatológico del ventrículo derecho (VD) y de la válvula pulmonar en el funcionamiento del corazón normal y en los corazones congénitamente malformados.
Por mucho tiempo se consideró como un hallazgo habitual y poco relevante que, en el posoperatorio de la cirugía correctiva de la tetralogía de Fallot, se documentase la presencia de incompetencia valvular pulmonar. Sin embargo, actualmente se sabe que en realidad la insuficiencia valvular pulmonar (IP) crónica conduce a dilatación y disfunción ventricular derecha, disminución de la capacidad para el ejercicio y riesgo de alteraciones del ritmo cardíaco y muerte súbita(1-6). Ya el grupo de Kirklin, en 1984, había demostrado que el 90% de los pacientes con insuficiencia nativa de la válvula pulmonar estaba libre de síntomas de insuficiencia cardíaca derecha a los 25 años de edad, pero que a los 50 años de edad menos del 50% lo estaba(7).
Mientras el VD mantiene conservada su función sistólica, la IP tiene una progresión clínica solapada y una larga fase compensada sin síntomas clínicos(1). Los síntomas clínicos son de aparición tardía y, cuando aparecen, habitualmente ya existe disfunción sistólica del VD y/o del ventrículo izquierdo (VI) y el daño puede ser irreversible(2,3,8). Además existe una estrecha correlación entre disfunción de uno y otro ventrículo, lo que sugiere una interacción ventrículo-ventricular desfavorable en este tipo de pacientes(8,9). Por todas estas razones, se requieren parámetros que permitan detectar tempranamente estos problemas y determinar la oportunidad del reemplazo valvular pulmonar.
Se admite que la resonancia nuclear magnética (RNM) es la técnica de elección para la cuantificación de IP, así como para la evaluación del tamaño del VD y su función sistólica(10-14); sin embargo, el ecocardiograma transtorácico (ETT), por su amplia disponibilidad, tiene su lugar en la valoración inicial de los pacientes para su seguimiento, para seleccionar cuáles de estos pacientes requerirán una RNM y para determinar la oportunidad de su realización. Debido a su disponibilidad todavía limitada en nuestras latitudes, no encararemos aquí el aporte de técnicas como la ecocardiografía tridimensional y otras técnicas de desarrollo relativamente reciente como strain, strain rate y speckle tracking. El cometido de esta revisión se centra en el aporte del ETT y de las técnicas Doppler, de amplia disponibilidad en la práctica clínica de rutina.
Fisiopatología de la insuficiencia valvular pulmonar
El primer punto a tener en cuenta es que no son extrapolables para la válvula pulmonar los conceptos aprendidos para la insuficiencia valvular aórtica. El lecho vascular pulmonar es de baja resistencia y está ubicado próximo al corazón. En cambio, el lecho vascular sistémico es de alta resistencia y se ubica lejos del ventrículo izquierdo (VI)(1). Este hecho es relevante porque de alguna manera, la baja resistencia del lecho vascular pulmonar y su proximidad al VD genera un efecto “válvula símil” para el gasto pulmonar(15) que limita la magnitud de la regurgitación valvular pulmonar. Puede decirse que la energía del VD es suficiente para vencer la baja resistencia del lecho vascular pulmonar, ubicada cercanamente, y de ese modo contener cierta proporción del retroceso del gasto pulmonar. Es por ello que pueden existir IP importantes, con fracciones de regurgitación inferiores a 40%. De hecho, una IP “libre” se asocia precisamente con fracciones de regurgitación en torno a 40% (entre 25% y 65%)(15). Otros factores también inciden en la magnitud de la IP como, por ejemplo, la presencia de parches transanulares amplios o estenosis pulmonar distal residual(16).
Se entiende por IP “libre” cuando no existe ningún efecto de válvula que limite la regurgitación(15). Se sabe además (concepto aprendido de la circulación de Fontan) que la energía del VI es suficiente para mantener la circulación pulmonar(1,15) y finalmente debe comprenderse que la complacencia del lecho vascular pulmonar por un lado y la del VD, por otro, juegan un rol determinante en la magnitud de la IP(15).
Aspectos de importancia que requieren evaluación
Considerando los conceptos previamente expuestos resulta, entonces, de importancia evaluar ecocardiográficamente los siguientes aspectos: 1) función sistólica y diastólica del VI; 2) resistencias pulmonares; 3) función sistólica y diastólica del VD; 4) magnitud de la obstrucción pulmonar residual si existe (infundibular, valvular y periférica); 5) magnitud de la IP; 6) magnitud de la insuficiencia tricuspídea (IT) si esta existe, y 7) remodelación de cavidades secundarias a la IP.
El cometido de este trabajo se centra en los puntos segundo, tercero, quinto y séptimo que exponemos a continuación.
Estimación de la resistencia vascular pulmonar
Mucho se ha investigado acerca de parámetros o índices que brinden información de la presión arterial pulmonar, impedancia, capacitancia y resistencia del lecho vascular pulmonar(17-28). Para la evaluación de la resistencia vascular pulmonar (RVP), la mayoría de estos parámetros resultan consumidores de tiempo o poco fiables y de hecho su uso ha sido sumamente restringido en la práctica. Sin embargo, la RVP constituye un parámetro relevante en la fisiopatología de varias afecciones cardiovasculares y condiciona significativamente la conducta clínica. Es por ello que intentamos seleccionar algún indicador que resulte útil para este cometido y de fácil adquisición.
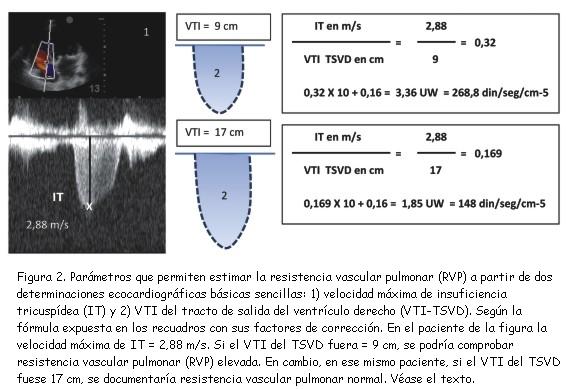
En la figura 1 A exponemos la fórmula que expresa la RVP. Ella se relaciona de modo directo con la diferencia de presiones entre arteria pulmonar y aurícula izquierda, y de modo inverso con el gasto pulmonar(19) de acuerdo a la ley de Ohm aplicada a los fluidos. Por eso la IT, que permite estimar la presión sistólica pulmonar, y el VTI del tracto de salida del ventrículo derecho (VTI-TSVD), que se relaciona con el gasto pulmonar, podrían ser usados como correlatos de diferencia de presiones y gasto pulmonar, respectivamente(19). Si la RVP se modifica, se producen cambios en la velocidad máxima de IT y el VTI-TSVD en direcciones opuestas. Considerando estos hechos, Abbas y colaboradores(18) evaluaron el comportamiento de estos parámetros ecocardiográficos, de fácil obtención en los estudios de rutina, y los relacionaron con medidas invasivas de RVP. La velocidad máxima de la IT (VmáxIT) en m/s y el VTI-TSVD en cm se relacionaron del modo que se expone en la figura 1 B. Los autores demostraron que esta relación se correlaciona adecuadamente con las medidas invasivas de RVP (r = 0,929; IC: 0,87 a 0,96). Con la fórmula corregida (Vmax.IT/VTI del TSVD x 10 + 0,16, figura 1B) se demuestran límites de confianza satisfactorios. Cuando el punto de corte se estableció en 0,2 se encontró 94% de especificidad y 70% de sensibilidad para definir RVP > a 2 unidades Wood (UW) (rango normal = 0,75 a 1,87 UW).
Supongamos, por ejemplo, la situación de un paciente con hipertensión arterial pulmonar (HAP) cuya Vmax.IT es 2,88 m/seg, lo que permite estimar un gradiente entre VD y AD de 33 mmHg (figura 2). Si el VTI-TSVD fuera igual a 9 cm, la RVP sería 3,36 UW, es decir, 268,8 dinas/seg/cm-5(*).
(*) dina/seg/cm-5 = UW x 80
En cambio, otro paciente con la misma presión sistólica arterial pulmonar, pero con un VTI-TSVD de 17 cm, su RVP sería normal (1,85 UW = 148 dinas/seg/cm-5).
Los autores proponen el término “presión pulmonar aumentada” para referirse al incremento de la presión arterial pulmonar sistólica e “hipertensión pulmonar” para aquellos pacientes que además tienen aumentada la RVP.
Función sistólica y diastólica del ventrículo derechoLa evaluación funcional del VD sigue configurando un desafío por su compleja morfología. No existe un modelo geométrico sencillo que permita calcular su volumen mediante ecocardiografía bidimensional. La ecocardiografía tridimensional puede jugar un rol importante al respecto, pero por el momento su uso no está disponible de modo generalizado. Además, la gruesa trabeculación del VD dificulta la definición del endocardio y finalmente su posición anterior hace complicada su visualización ecográfica(29). Por ello, cuando se evalúa su morfología por ecocardiografía bidimensional, es recomendable obtener varios enfoques desde diferentes proyecciones(23). No obstante estas dificultades, existen varios parámetros que permiten una estimación satisfactoria de la función ventricular derecha mediante ETT.
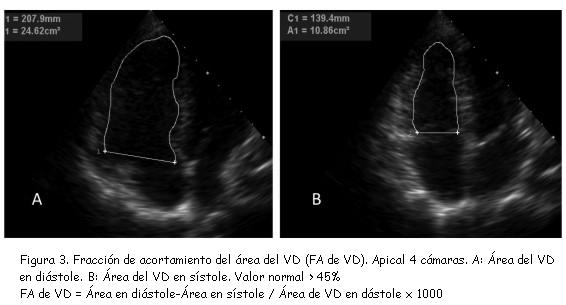
1) Fracción de acortamiento del área del ventrículo derecho
Este parámetro (figura 3) mostró excelente correlación (r = 0,80; p < 0,001) con estimaciones de la fracción de eyección del VD realizadas mediante RNM(30).
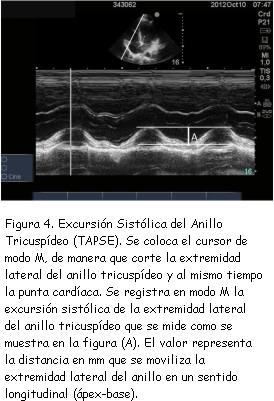
2) Excursión sistólica del anillo tricuspídeo
Como puede verse en la figura 4, este parámetro consiste en registrar en modo M el desplazamiento longitudinal de la extremidad lateral del anillo tricuspídeo. El valor normal es de 20 mm ± 2,8 mm. Desplazamientos menores a 17 mm son altamente específicos (aunque de baja sensibilidad)(31) para detectar disfunción sistólica del VD. Este parámetro ha demostrado buena correlación con estimaciones de la fracción de eyección llevadas a cabo mediante angiografía radioisotópica(32) y tiene valor predictivo de supervivencia en el contexto de HAP(33).
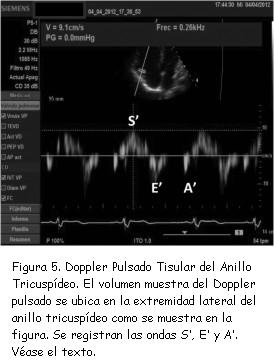
3) Doppler pulsado tisular del anillo tricuspídeo e índice de performance miocárdico (índice de Tei)
El Doppler pulsado tisular se obtiene ubicando el volumen muestra en la extremidad lateral del anillo tricuspídeo, como muestra la figura 5. Se obtiene el registro característico constituido por onda sistólica (S’) y dos ondas diastólicas E’ y A’, respectivamente.
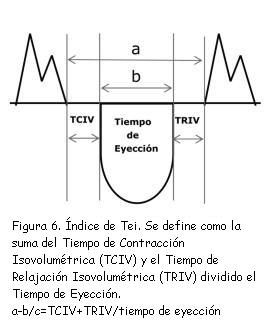
Para la evaluación de la función sistólica del VD tiene importancia la determinación de la velocidad de S´. El valor normal de esta medida debe ser superior a 12 cm/seg. Un valor inferior a 10 cm/seg es indicador de disfunción sistólica del VD(31).Este registro permite, además, obtener los parámetros necesarios para el cálculo del índice de Tei o índice de performance miocárdica(34) mediante Doppler tisular, a saber: tiempo de contracción isovolumétrica (TCIV); tiempo de relajación isovolumétrica (TRIV), y tiempo de eyección (Ey), figuras 6 y 7.
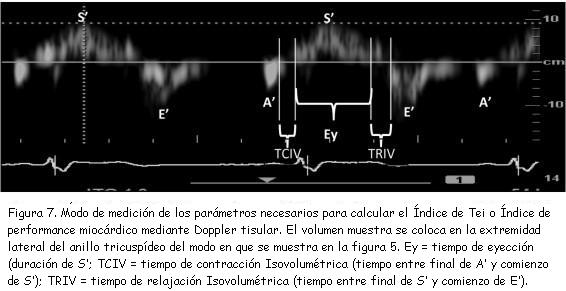
El índice de Tei o índice de performance miocárdica(34-36) es un parámetro de función global (sistólica y diastólica). Su valor normal para el VD debe ser menor de 0,28 ± 0,04, según Jurcut y colaboradores(37). Sin embargo, las guías de la Sociedad Americana de Ecocardiografía(38) admiten otros niveles de tolerancia considerando como límites máximos normales valores de 0,40 para la estimación del índice de Tei mediante Doppler pulsado y hasta 0,55 utilizando Doppler pulsado tisular. Si tenemos en cuenta los estudios de Grignola, Ginés y Guzzo(39,40) realizados en el Departamento de Fisiología de la Facultad de Medicina de Montevideo en corderos anestesiados, estos valores resultan demasiado prolongados. En efecto, los trabajos de Grignola y colaboradores(39,40) demuestran que prácticamente no existen períodos isométricos para el VD. Por lo tanto, necesariamente los índices de Tei normales tienen que ser muy cortos y tendientes a valores próximos a 0,00. De hecho, en estos trabajos realizados con corderos anestesiados, todos los índices de Tei estimados resultaron en torno a 0,06 ± 0,03 pero aumentan significativamente al elevar la poscarga de modo agudo, como, por ejemplo, en el contexto de hipertensión arterial pulmonar aguda. En estas circunstancias se logran valores de 0,31 ± 0,06. Las diferencias encontradas con las publicaciones mencionadas previamente(37,38) podrían deberse a las condiciones de experimentación (corderos anestesiados y a tórax abierto), pero el punto podría merecer una revisión antes de asumir como “normales” los valores señalados precedentemente.
El índice de Tei también puede estimarse mediante Doppler convencional, pero tiene el inconveniente respecto del Doppler tisular de que no todas las mediciones necesarias pueden obtenerse en un mismo ciclo cardíaco. En efecto, utilizando Doppler convencional deben efectuarse dos medidas separadas en diferentes ciclos a saber: 1) el registro del flujo diastólico de la válvula tricúspide, y 2) el registro del flujo sistólico en el tracto de salida del VD (ver esquema de la figura 7).
El Doppler pulsado tisular del anillo tricuspídeo también brinda información acerca de la función diastólica del VD. Normalmente, en reposo, la onda E’ del Doppler tisular (figuras 5 y 7) alcanza 14,5 +/- 3,5 cm/seg. Su relación respecto de la velocidad de la onda E del flujo diastólico tricuspídeo (E/E’) es un parámetro indicador de disfunción diastólica del VD. Una relación E/E’ > 6 indica disfunción diastólica del ventrículo derecho(37).
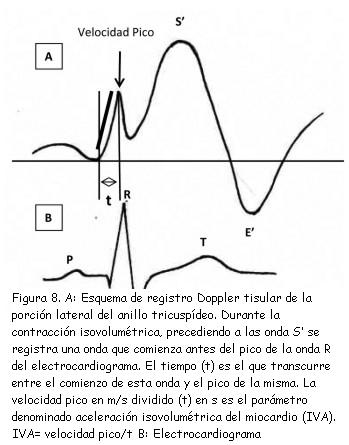
4) Aceleración isovolumétrica del miocardio
En el registro Doppler tisular de la porción lateral del anillo tricuspídeo durante el período isométrico, precediendo a la onda S’, se inscribe una onda que comienza antes del pico de la onda R del electrocardiograma (figura 8). La relación de la velocidad pico de esta onda en m/seg dividido por el intervalo de tiempo en segundos entre el comienzo de esta onda y su velocidad pico ha demostrado ser un índice de contractilidad del VD, independiente de condiciones de pre y poscarga(41). Su valor normal debe ser mayor de 1,2 m/s2(42).
Magnitud de la insuficiencia pulmonar residual
La RNM es el patrón de referencia para determinar la fracción de regurgitación pulmonar(9-13); sin embargo, el ecocardiograma convencional hace su aporte para la evaluación inicial del paciente y para seleccionar aquellos que requerirán una RNM.
Desde 1989 se conoce el método empírico de Nanda(43), basado principalmente en la magnitud del ancho del jet color de la regurgitación, pero también considerando hasta qué punto se introducía en el VD. En esencia se consideraba que si el ancho del jet color era mayor a 50% del ancho del tracto de salida del ventrículo derecho (TSVD), entonces la regurgitación era significativa (figura 9 A).
Más recientemente, Li, Davluoros, Kilner y colaboradores(44) demostraron que en adultos, un ancho del jet color de la regurgitación pulmonar de 0,98 cm correlaciona con fracciones de regurgitación de 24,5% en la RNM, con una sensibilidad y especificidad de 92% y 74%, respectivamente ( r = 0,72, p = 0,001).
Una forma empírica de evaluar la magnitud de la IP lo constituye el registro de flujo diastólico reverso en arteria pulmonar distal. Se supone que esto implica regurgitación pulmonar significativa.El método volumétrico permite calcular el volumen regurgitante y estimar la fracción de regurgitación mediante las fórmulas expuestas en la figura 9 B. De todos modos, cabe señalar que algunos estudios indican que resulta más confiable la estimación del volumen de regurgitación que la fracción de regurgitación para evaluar la sobrecarga volumétrica del VD(9).
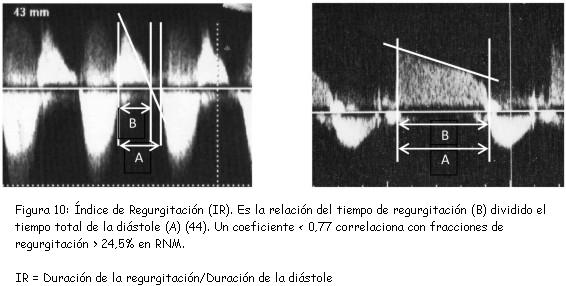
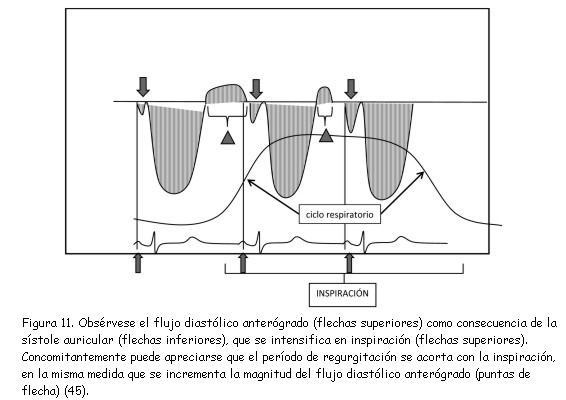
Li y colaboradores(44) también demostraron que la relación del tiempo de regurgitación pulmonar respecto de la duración de la diástole (índice de regurgitación pulmonar o IR) constituía un parámetro estimativo de la severidad de la regurgitación (figura 10). Un coeficiente inferior a 0,77 correlaciona con fracciones de regurgitación superiores a 24,5% obtenidas mediante RNM, con una sensibilidad de 100%, especificidad de 84,6%, y valor predictivo de 95%.La complacencia ventricular derecha juega un rol importante en la magnitud de la IP. El ETT también hace su aporte en este aspecto. En la figura 11 reproducimos un hallazgo descrito y evaluado por Gatzoulis y colaboradores(45).
Este hallazgo indica la existencia de una fisiología restrictiva del VD, que resulta de importancia a la hora de evaluar la repercusión funcional de la IP.
Aunque la fisiología restrictiva del VD implica una hemodinámica anormal, la misma limita la magnitud de la regurgitación. Los autores demuestran que este hallazgo se correlaciona con mejor tolerancia al ejercicio y mayor consumo máximo de oxígeno en el esfuerzo de los pacientes, quienes al mismo tiempo presentan menos cardiomegalia. En concordancia con esto, Carvalho y colaboradores(46) comprueban que los pacientes con mayor grado de IP residual logran menor duración total del ejercicio, menor frecuencia cardíaca máxima alcanzada y consumo de oxígeno máximo más bajo que los controles.
Evaluación de la remodelación de cavidades derechas
Cuanto mayor la IP, mayor sobrecarga volumétrica del VD. El diámetro telediastólico del VD medido en paraesternal eje largo correlaciona adecuadamente con estimaciones del volumen ventricular derecho efectuadas mediante RNM (r = 0,49; p = 0,001)(44). Estos autores demuestran que el grado de IP, así como su repercusión sobre las dimensiones cavitarias del VD, puede realizarse con ETT y por RNM con razonable concordancia entre ambas técnicas.
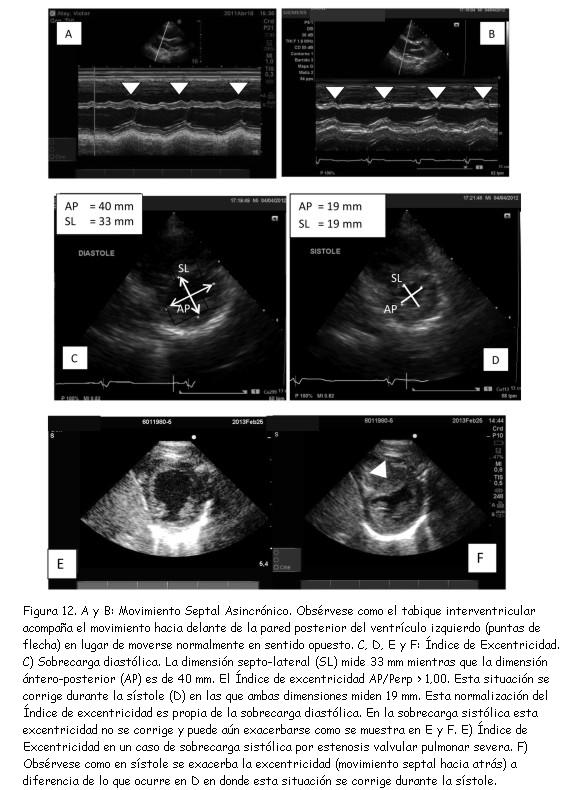
La repercusión de la sobrecarga ventricular derecha sobre la motilidad del septum interventricular constituye un hallazgo conocido. El movimiento septal asincrónico o “paradójico” es expresión de sobrecarga ventricular derecha tanto sistólica como diastólica (figuras 12 A y B).
En condiciones de carga normales, en la proyección parasternal eje corto a nivel de los músculos papilares, el eje ántero-posterior del VI y su perpendicular son iguales entre sí, ya que la cavidad presenta una forma circular tanto en diástole como en sístole. La relación entre estas dos dimensiones se conoce como índice de excentricidad (37,47,48).
Tanto la sobrecarga sistólica como la sobrecarga diastólica del VD alteran el índice de excentricidad. En ambas situaciones, el índice se torna mayor a 1,00, pero con la peculiaridad que en la sobrecarga diastólica esta situación tiende a corregirse en sístole (figura 12 D) mientras que si la sobrecarga es sistólica, esta relación no se modifica o puede exacerbarse durante la sístole (figura 12 E y F). El hallazgo es significativo porque estas distorsiones afectan la función diastólica del VI(47) por la interdependencia que existe entre ambos ventrículos.
Comentarios
Es posible afirmar, entonces, que el ETT brinda importante información en la evaluación del posoperatorio alejado de la cirugía correctiva de tetralogía de Fallot. Técnicas en desarrollo como la ecocardiografía tridimensional probablemente se transformen en el instrumento idóneo para la evaluación de esta situación clínica, pero, hasta el momento, el patrón de referencia sigue siendo la RNM(9-13). En nuestra opinión esta técnica debe realizarse en todo paciente con IP significativa con dilatación ventricular derecha. El motivo principal lo constituye la estimación del volumen ventricular derecho, de considerable importancia pronóstica en estos pacientes.
La falla ventricular izquierda favorece la IP porque aumenta la presión veno-capilar pulmonar y, como consecuencia, disminuye el efecto “válvula-símil” del lecho vascular pulmonar. En cambio, la falla ventricular derecha resulta contenedora(14) por aumento de la presión diastólica final del VD y porque disminuye su complacencia. Por ello, en la evaluación de estos pacientes resulta relevante la valoración de la función sistólica y diastólica de ambos ventrículos, que además tienen importante interdependencia entre ambos(8,16).
En el posoperatorio de la tetralogía de Fallot existen básicamente dos escenarios posibles: 1) el de la obstrucción pulmonar residual con grados variables de obstrucción, hipertrofia ventricular derecha y fisiología restrictiva, o bien 2) el de la IP con diversos grados de regurgitación y dilatación ventricular derecha. De acuerdo al conocimiento actual de este problema, el primero de estos escenarios parece ser el más conveniente. La estrategia quirúrgica adoptada puede determinar cuál de estos escenarios tendrá lugar. En un extremo, con IP “libre” y nula obstrucción residual, y, en el otro, con algún grado de obstrucción residual y niveles variables de incompetencia valvular pulmonar.
Las primeras estrategias quirúrgicas se inclinaban por la realización de ventriculotomías generosas y uso liberal de parche transanular. Esto conducía a IP “libre” y TSVD no contráctiles(7). Actualmente una estrategia quirúrgica conservadora se considera preferible porque disminuye la magnitud de la regurgitación, preserva la función del VD y disminuye la incidencia de arritmias(49-51). La oportunidad del reemplazo valvular pulmonar constituye el punto crucial en la atención de estos pacientes a largo plazo. El reemplazo oportuno permite rápida disminución del volumen y masa del VD, si su volumen diastólico antes de la cirugía no excede 150 ml/m2(52). Therrien y colaboradores(53) encuentran posibilidad de reversión de la dilatación del VD si se procede al reemplazo valvular antes que la cavidad exceda un volumen diastólico de 170 ml/m2 o un volumen sistólico de 85 ml/m2. De manera similar, Oosterhof y colaboradores(54) encuentran como punto de corte adecuado las dimensiones de 160 y 82 ml/m2 para los volúmenes diastólico y sistólico del VD, respectivamente. Estos autores concluyen que aun los pacientes con volúmenes muy elevados del VD y disfunción sistólica pueden disminuir significativamente la dilatación después del reemplazo valvular pulmonar. Sin embargo, otros autores sostienen que el reemplazo valvular pulmonar debe realizarse antes de que la función sistólica del VD se deteriore(55).
Alteraciones eléctricas
La presencia de flutter, fibrilación atrial o taquicardia ventricular implica la existencia de alteraciones hemodinámicas severas(56-58). Una duración de QRS superior a 180 mseg constituye un importante factor de riesgo para el desarrollo de taquicardia ventricular y muerte súbita (49,59). El bloqueo de rama derecha (BRD) detectado inmediatamente después de la cirugía se vincula al acto quirúrgico. El BRD que se produce tardíamente se vincula principalmente a la dilatación ventricular derecha y esta a la IP. Por lo tanto, el ensanchamiento progresivo del QRS en relación con una situación previa tiene mayor valor pronóstico que la magnitud del ensanchamiento en sí(49,57-59).
Indicaciones de sustitución valvular pulmonar
Las guías del American College of Cardiology (58) recomiendan el reemplazo valvular pulmonar cuando existe IP severa y síntomas o disminución del nivel de tolerancia al ejercicio (clase I/nivel de evidencia B) y consideran razonable el reemplazo valvular pulmonar (indicación clase IIa) en adultos con tetralogía de Fallot e IP severa con cualquiera de los siguientes hallazgos: a) moderada a severa disfunción ventricular derecha (nivel de evidencia B); b) moderada a severa dilatación del VD (nivel de evidencia B); c) desarrollo de arritmias atriales y/o ventriculares sintomáticas o sostenidas (nivel de evidencias C); d) moderada a severa incompetencia valvular tricuspídea (nivel de evidencia C).
Las guías europeas(59) señalan que en este contexto el reemplazo valvular pulmonar debe llevarse a cabo en el paciente sintomático con IP severa y/o estenosis pulmonar con presión sistólica del VD mayor de 60 mmHg (velocidad de regurgitación tricuspídea mayor de 3,5 m/s) (clase I/nivel de evidencia C) y sostienen que el reemplazo valvular pulmonar debe considerarse en los pacientes asintomáticos con IP severa y/o estenosis pulmonar, cuando por lo menos uno de los siguientes criterios está presente: a) disminución de la capacidad objetiva para el ejercicio; b) dilatación ventricular derecha progresiva; c) disfunción sistólica ventricular derecha progresiva; d) regurgitación tricuspídea progresiva de magnitud por lo menos moderada; e) obstrucción en el TSVD cuando la presión sistólica ventricular derecha supera 80 mmHg (velocidad de regurgitación tricuspídea superior a 4,3 m/s); f) arritmias atriales o ventriculares sostenidas (clase IIa/nivel de evidencia C).
En definitiva, en todo paciente con IP severa, cualquiera de las siguientes condiciones constituyen indicación para reemplazar la válvula pulmonar(49): 1) síntomas clínicos o disminución de la tolerancia para el ejercicio; 2) evidencias de disfunción ventricular derecha; 3) evidencias de dilatación ventricular derecha (170 ml/m2 en diástole o 85 ml/m2 en sístole), según este autor; 4) arritmias auriculares o ventriculares; 5) insuficiencia tricuspídea progresiva; 6) QRS prolongado (180 mseg)(49,54). La RNM y los estudios electrofisiológicos ayudan a determinar la oportunidad del reemplazo. Varios estudios abogan a favor del reemplazo valvular temprano y coinciden en que mejora el pronóstico en la medida que normaliza los volúmenes del VD, la función biventricular y mejora la tolerancia al ejercicio(50). Un metaanálisis publicado en el 2010(60) incluyó la revisión de 15 estudios seleccionados entre 305 publicaciones que evaluaban la evolución temprana y alejada del reemplazo quirúrgico de la válvula pulmonar en el posoperatorio de cirugía reparadora de tetralogía de Fallot. Se excluyeron trabajos de revisión, informes de casos aislados y también sustitución percutánea de la válvula pulmonar por carecer estos últimos de datos sobre evolución alejada. En conjunto este metaanálisis incluyó la evaluación pronóstica de un total de 736 pacientes a quienes se les sustituyó la válvula pulmonar. Se concluye que este procedimiento es de baja mortalidad temprana y tardía y se documenta disminución significativa de los volúmenes del VD. Sin embargo, no se producen cambios significativos en la fracción de eyección del VD ni en la duración del QRS. Tampoco está claro si el reemplazo valvular pulmonar reduce el riesgo de arritmias cardíacas o de muerte súbita(50).
Conclusiones
No contamos con datos oficiales de la incidencia de regurgitación valvular pulmonar (IP) en el posoperatorio alejado de cirugía correctiva de tetralogía de Fallot en pacientes operados en nuestro medio. En ese sentido, la revisión de datos procedentes del Fondo Nacional de Recursos (FNR) podría proporcionarnos información de gran importancia para conocer cuál es la situación. En términos generales se considera que la IP significativa es frecuente en el posoperatorio alejado de cirugía correctiva de tetralogía de Fallot(61,62). Resulta claro que la incidencia de la misma depende en parte de la técnica quirúrgica utilizada y de la época en que se realizó la cirugía, pero de todos modos la IP constituye uno de los principales problemas del posoperatorio de cirugía correctiva de tetralogía de Fallot(63). La incidencia documentada en la literatura resulta bastante variable, según diversos centros y autores, por las razones que comentábamos previamente, pero oscila entre 19% y 64%(64-66) y hasta 100% en algunas instituciones cuando la técnica empleada es parche transanular(67). Resulta dificultoso establecer la incidencia precisa porque algunos trabajos evalúan la magnitud de la incompetencia pulmonar en función de la dilatación del VD efectuando especulaciones respecto a la responsabilidad que le cabe a la misma en esta dilatación(68), pero reconocidos cirujanos, como Roger Mee, comentan al respecto de estos trabajos que además de la variables mencionadas existen otras causas de sobrecarga volumétrica del VD en la cirugía correctiva de tetralogía de Fallot, por ejemplo el efecto de sobrecarga que se produce como consecuencia del cierre quirúrgico del defecto septal ventricular(69). Comentarios adicionales al respecto pueden encontrarse en Murphy y Fuster(70,71). Sea como fuere, se admite que la incompetencia valvular pulmonar constituye un problema significativo en el posoperatorio alejado de la cirugía correctiva de tetralogía de Fallot(63). La IP crónica tiene un efecto perjudicial sobre la función del VD, la tolerancia al ejercicio y conduce a un riesgo aumentado de arritmias y muerte súbita(1). La severidad de la IP y su impacto sobre la función del VD puede ser evaluada cuantitativamente por RNM (por el momento patrón de referencia), pero también mediante ETT(1) de uso corriente en la evaluación clínica habitual de nuestros pacientes con importante correlación entre esta técnica y los datos aportados por la RNM(44).
Sin duda, la ecocardiografía tridimensional y técnicas de reciente desarrollo como strain, strain rate y speckle tracking imaging(72) probablemente adquieran un rol preponderante en la evaluación de estos pacientes, en la medida en que su disponibilidad sea más extendida y que estudios adecuadamente diseñados optimicen su utilidad.
Debe tenerse presente que un número cada vez mayor de adultos con valvulotomía previa, o reparación de tetralogía de Fallot, requerirán reemplazo valvular pulmonar electivo antes de que sobrevenga una disfunción ventricular derecha irreversible(1). Esta revisión nos permite concluir que independientemente de los avances que las técnicas de imagen han tenido en los últimos tiempos, la ETT convencional sigue siendo una herramienta útil para la evaluación rutinaria de estos pacientes. Múltiples estudios demuestran que los datos obtenidos por esta técnica se correlacionan satisfactoriamente con los procedimientos de referencia.
Bibliografía
1. Bouzas B, Kilner PJ, Gatzoulis MA. Pulmonary regurgitation: not a benign lesion. Eur Heart J 2005; 26:433-9.
2. Wessel HU, Cunningham WJ, Paul MH, Bastanier CK, Muster AJ, Idriss FS. Exercise performance in tetralogy of Fallot after intracardiac repair. J Thorac Cardiovasc Surg 1980; 80: 582–93.
3. Carvalho JS, Shinebourne EA, Busst C, Rigby ML, Redington AN. Exercise capacity after complete repair of tetralogy of Fallot: deleterious effects of residual pulmonary regurgitation. Br Heart J 1992; 67: 470–3.
4. Redington AN, Oldershaw PJ, Shinebourne EA, Rigby ML. A new technique for the assessment of pulmonary regurgitation and its application to the assessment of right ventricular function before and after repair of tetralogy of Fallot. Br Heart J 1988; 60:57–65.
5. Marie PY, Marcon F, Brunotte F, Briancon S, Danchin N, Worms AM, et al. Right ventricular overload and induced sustained ventricular tachycardia in operatively “repaired” tetralogy of Fallot. Am J Cardiol 1992; 69:785–9.
6. Gatzoulis MA, Balaji S, Webber SA, Siu SC, Hokanson JS, Poile C, et al. Risk factors for arrhythmia and sudden cardiac death late after repair of tetralogy of Fallot: a multicentre study. Lancet 2000; 356:975–81.
7. Shimizaki Y, Blacstone EH, Kirklin JW. The natural history of isolated congenital pulmonary valve incompetence: surgical implications. Thorac Cardiovascular Surg 1984; 32: 257-9.
8. Geva T, Sandweiss BM, Gauvreau K, Lock JE, Powell AJ. Factors associated with impaired clinical status in long-term survivors of tetralogy of Fallot repair evaluated by magnetic resonance imaging. J Am Coll Cardiol 2004; 43:1068–74.
9. Davlouros PA, Kilner PJ, Hornung TS, Li W, Francis JM, Moon JCC, et al. Right ventricular function in adults with repaired tetralogy of Fallot assessed with cardiovascular magnetic resonance imaging: detrimental role of right ventricular outflow aneurysms or akinesia and adverse right-to-left ventricular interaction. J Am Coll Cardiol 2002; 40: 2044–52.
10. Wald RM, Redington AN, Pereira A, Provost YL, Paul NS, Oechslin EN, et al. Refining the assessment of pulmonary regurgitation in adults after tetralogy of Fallot repair: should we be measuring regurgitant fraction or regurgitant volume? Eur Heart J 2009; 30: 356–61.
11. Grothues F, Moon JC, Bellenger NG, Smith GS, Klein HU, Pennell DJ. Interstudy reproducibility of right ventricular volumes, function, and mass with cardiovascular magnetic resonance. Am Heart J 2004; 147:218–23.
12. Rebergen SA, Chin JG, Ottenkamp J, van der Wall EE, de Roos A. Pulmonary regurgitation in the late postoperative follow-up of tetralogy of Fallot. Volumetric quantitation by nuclear magnetic resonance velocity mapping. Circulation 1993; 88: 2257–66.
13. Oosterhof T, Mulder BJ, Vliegen HW, de Roos A. Cardiovascular magnetic resonance in the follow-up of patients with corrected tetralogy of Fallot: a review. Am Heart J 2006; 151:265–72.
14. Therrien J, Gatzoulis M, Graham T, Bink-Boelkens M, Connelly M, Niwa K, et al. Canadian Cardiovascular Society Consensus Conference 2001 update: Recommendations for the management of adults with congenital heart disease—Part II. Can J Cardiol 2001; 17: 1029–50.
15. Kilner PJ. Pulmonary regurgitation in relation to pulmonary artery compliance and other variables. In: Redington AN, Van Arsdell GS, Anderson RH eds. Congenital heart diseases in the right heart. London: Springer–Verlag, 2009:247-50.
16. Ilbawi MN, Idriss FS, DeLeon SY, Muster AJ, Gidding SS, Berry TE, et al. Factors that exaggerate the deleterious effects of pulmonary insufficiency on the right ventricle after tetralogy repair. Surgical implications. J Thorac Cardiovasc Surg 1987;93:36–44.
17. Kilner PJ. Pulmonary resistance in cardiovascular context. Int J Cardiol. 2004; 97:3-6
18. Abbas AE, Fortuin FD, Schiller NB, Appleton CP, Moreno CA, Lester SJ. A simple method for noninvasive estimation of pulmonary vascular resistance. J Am Coll Cardiol 2003; 41:1021-7.
19. Okamoto M, Miyatake K, Kinoshita N, Sakakibara H, Nimura Y. Analysis of blood flow in pulmonary hypertension with the pulsed Doppler flowmeter combined with cross-sectional echocardiography. Br Heart J 1984; 51:407–15.
20. Hirschfeld S, Meyer R, Schwartz DC, Kofhagen J, Kaplan S. The echocardiographic assessment of pulmonary artery pressure and pulmonary vascular resistance. Circulation 1975; 52: 642–50.
21. Matsuda M, Sekiguchi T, Sugishita Y, Kuwako K, K Iida, Ito I. Reliability of non-invasive estimates of pulmonary hypertension by pulsed Doppler echocardiography. Br Heart J 1986; 56: 158–64.
22. Chan KL, Currie PJ, Seward JB, Hagler DJ, Mair DD, Tajik AJ. Comparison of three Doppler ultrasound methods in the prediction of pulmonary artery pressure. J Am Coll. Cardiol 1987; 9: 549–54.
23. Murata I, Sonoda M, Morita T, Nakamura F, Takenaka K, Nagai R. The clinical significance of reversed flow in the main pulmonary artery detected by Doppler color flow imaging. Chest 2000; 118: 336–41.
24. Riggs T, Hirschfeld S, Borkat G, Knoke J, Liebman J. Assessment of the pulmonary vascular bed by echocardiographic right ventricular systolic time intervals. Circulation 1978; 57: 939–47.
25. Scapellato F, Temporelli PL, Eleuteri E, Corrà U, Imparato A, Giannuzzi P. Accurate noninvasive estimation of pulmonary vascular resistance by Doppler echocardiography in patients with chronic failure heart failure. J Am Coll Cardiol 2001; 37: 1813–9.
26. Shandas R, Weinberg C, Ivy DD, Nicol E, DeGroff CG, Hertzberg J, et al. Development of a noninvasive ultrasound color M-mode means of estimating pulmonary vascular resistance in pediatric pulmonary hypertension: mathematical analysis, in vitro validation, and preliminary clinical studies. Circulation 2001; 104:908–13.
27. Tahara M, Tanaka H, Nakao S, Yoshimura H, Sakurai S, Tei C, et al. Hemodynamic determinants of pulmonary valve motion during systole in experimental pulmonary hypertension. Circulation 1981; 64 : 1249–55.
28. Ebeid MR, Ferrer PL, Robinson B, Weatherby N, Gelband H. Doppler echocardiographic evaluation of pulmonary vascular resistance in children with congenital heart disease. J Am Soc Echocardiogr 1996; 9: 822–31.
29. Davlouros PA, Niwa K, Webb G, Gatzoulis MA. The right ventricle in congenital heart disease. Heart 2006; 92: i27-i38
30. Anavekar NS, Gerson D, Skali H, Kwong RY, Yucel EK, Solomon SD. Two-dimensional assessment of right ventricular function: an Echocardiographic-MRI correlative study. Echocardiography 2007; 24: 452-6.
31. Mor-Avi V, Lang RM, Badano LP, Belohlavek M, Cardim NM, Derumeaux G, et al. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics: ASE/EAE Consensus Statement on Methodology and Indications: Endorsed by the Japanese Society of Echocardiography. J Am Soc Echocardiogr 2011; 24:277-313.
32. Ueti OM, Camargo EE, Ueti Ade A, de Lima-Filho EC, Nogueira EA, et al. Assessment of right ventricular function with Doppler echocardiographic indices derived from tricuspid annular motion: comparison with radionuclide angiography. Heart 2002; 88: 244-8.
33. Forfia PR, Fisher MR, Mathai SC, Housten-Harris T, Hemnes AR, Borlaug BA, et al. Tricuspid annular displacement predicts survival in pulmonary hypertension. Am J Respir Crit Care Med 2006; 174: 1034-41.
34. Tei C. New non-invasive index for combined systolic and diastolic ventricular function. J Cardiol 1995; 26:135-36.
35. Tei C, Dujardin KS, Hodge DO, Bailey KR, McGoon MD, Tajik AJ, et al. Doppler echocardiographic index for assessment of global right ventricular function. J Am Soc Echocardiogr 1996; 9: 838 – 46.
36. Tei C, Nishimura RA, Seward JB, Tajik AJ. Noninvasive Doppler-derived myocardial perfomance index: Correlation with simultaneous measurements of cardiac catheterization measurements. J Am Soc Echocardiogr 1997; 10: 169-78.
37. Jurcut R, Giusca S, La Gerche A, Vasile S, Ginghina C, Voigt J-U. The echocardiographic assessment of the right ventricle: what to do in 2010? Eur J Echocardiogr 2010;11:81-96.
38. Rudski LG, Lai WW, Afilalo J, Hua L, Handschumacher MD, Chandrasekaran K, et al. Guidelines for the echocardiographic assesment of the right heart in adults: A report from the American Society of Echiocardiography. Endosed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography. J Am Soc Echocardiogr 2010; 23: 685-713.
39. Ginés F, Grignola JC. Sincronización de la contracción del ventrículo derecho frente a un aumento agudo de su postcarga. “Izquierdización” del comportamiento mecánico del ventrículo derecho. Rev Esp Cardiol 2001; 54: 973-80.
40. Grignola JC, Ginés F. Guzzo D. Comparison of the Tei index with invasive measurments of right ventricular function. Int J Cardiol 2006; 113: 25 – 33.
41. Vogel M, Schmidt MR, Kristiansen SB, Cheung M, White PA, Sorensen K, et al. Validation of myocardial acceleration during Isovolumic contraction as a novel noninvasive index of right ventricular contractility comparison with ventricular pressure-volume relations in an animal model. Circulation 2002; 105:1693-9.
42. Haddad F, Hunt SA, Rosenthal DN, Murphy DJ. Right ventricular function in cardiovascular disease, Part I: Anatomy, physiology, aging, and functional assessment of the right ventricle. Circulation 2008; 117:1436-48.
43. D’Cruz IA. Conventional and Color Doppler Assessment of Right-Sided Lesions. In: Nanda NC. Doppler Echocardiograophy. 2nd. ed. Philadelphia: London, 1993: 145-59.
44. Li W, Davlouros PA, Kilner PJ, Pennell DJ, Gibson D, Henein MY, et al. Doppler-echocardiographic assessment of pulmonary regurgitation in adults with repaired tetralogy of Fallot: Comparison with cardiovascular magnetic resonance imaging. Am Heart J 2004; 147: 165-72.
45. Gatzoulis MA, Clark AL, Cullen S, Newman CGH, Redington AN. Right Ventricular Diastolic Function 15 to 35 Years After Repair of Tetralogy of Fallot. Restrictive Physiology Predicts Superior Exercise Performance. Circulation 1995; 91:1775-81.
46. Carvalho JS, Shinebourne EA, Busst C, Rigby ML, Redington AN. Exercise capacity after complete repair of tetralogy of Fallot: deleterious effects of residual pulmonary regurgitation. Br Heart J 1992; 67: 470–3.
47. Louie EK, Rich S, Levitsky S, Brundage BH. Doppler echocardiographic demonstration of the differential effects of right ventricular pressure and volume overload on left ventricular geometry and filling. J Am Coll Cardiol 1992; 19: 84-90.
48. King ME, Braun H, Goldblatt A, Liberthson R, Weyman AE. Interventricular septal configuration as a predictor of right ventricular systolic hypertension in children: a cross-sectional echocardiographic study. Circulation 1983; 68: 68-75.
49. Guleserian KJ. Adult Congenital Heart Disease: Surgical advances and options. Prog Cardiovasc Dis 2011; 53: 254–264
50. Stewart RD, Backer CL, Young L, Mavroudis C. Tetralogy of Fallot: Results of a pulmonary valve-sparing strategy. Ann Thorac Surg 2005; 80: 1431-1439.
51. Boni L, Garcia E, Galletti L, Pérez A, Herrera D, Ramos V, et al. Current strategies in tetralogy of Fallot repair: pulmonary valve sparing and evolution of right ventricle/left ventricle pressures ratio. Eur J Cardiothorac Surg 2009; 35:885-9.
52. Valsangiacomo ER, Hitendu HD, Kellenberger CJ, Dodge-Khatami A, Petre R, Berger F, et al. Remodelling of the right ventricle after early pulmonary valve replacement in children with repaired tetralogy of Fallot: assessment by cardiovascular magnetic resonance. Eur Heart J 2005; 26: 2721–7.
53. Therrien J, Provost Y, Merchant N, Williams W, Colman J, Webb G. Optimal timing for pulmonary valve replacement in adults after tetralogy of Fallot repair. Am J Cardiol 2005; 95: 779-82.
54. Oosterhof T, van Straten A, Vliegen HW, Meijboom FJ, van Dijk APJ, Spijkerboer AM, et al. Preoperative thresholds for pulmonary valve replacement in patients with corrected Tetralogy of Fallot using cardiovascular magnetic resonance. Circulation 2007;116:545-51.
55. Therrien J, Siu SC, McLaughlin PR, Liu PP, Williams WG, Webb GD. Pulmonary valve replacement in adults late after repair of tetralogy of Fallot: are we operating too late? J Am Coll Cardiol 2000; 36: 1670-5.
56. Harrison DA, Harris L, Siu SC, MacLoghlin CJ, Connelly MS, Webb GD, et al. Sustained ventricular tachycardia in adult patients late after repair of tetralogy of Fallot. J Am Coll Cardiol 1997; 30: 1368 –73.
57. Harrison DA, Siu SC, Hussain F, MacLoghlin CJ, Webb GD, Harris L. Sustained atrial arrhythmias in adults late after repair of tetralogy of Fallot. Am J Cardiol 2001; 87:584–5.
58. Warnes CA, Williams RG, Bashore TM, Child JS, Connolly HM, Dearani JA, et al. ACC/AHA 2008 Guidelines for the Management of Adults With Congenital Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Develop Guidelines on the Management of Adults With Congenital Heart Disease) Developed in Collaboration With the American Society of Echocardiography, Heart Rhythm Society, International Society for Adult Congenital Heart Disease, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol 2008; 52: e143 – e263.
59. Baumgartner H, Bonhoeffer P, De Groot NMS, de Haan F, Deanfield JE, Galie N, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010) The Task Force on the Management of Grown-up Congenital Heart Disease of the European Society of Cardiology (ESC) Endorsed by the Association for European Paediatric Cardiology (AEPC). Eur Heart J 2010; 31: 2915-57.
60. Cheung EW, Wong WH, Cheung YF. Meta-analysis of pulmonary valve replacement after operative repair of Tetralogy of Fallot. Am J Cardiol 2010;106 :552–7.
61. Martucci G, Therrien J. Timing and outcome of surgical pulmonary valve replacement. En: Redington AN, Van Arsdell GS, Anderson RH. Congenital diseases in right heart. London. Springer-Verlag , 2009:259.
62. Siwik ES, Erenberg F, Zahka KG, Goldmuntz E. Tetralogy of Fallot. En: Allen HD, Driscoll DJ, Shaddy RE, Feltes TF. Moss and Adams’ heart disease in infants, children, and adolescents: Including the fetus and young adults. 7th ed. Philadelphia (USA): Lippincott Williams and Wilkins, 2008.
63. Hoffman JIE. The natural and unnatural history of congenital heart disease. Chennai (India): John Wiley and Sons Ltd, 2009:412.
64. Faidutti B, Christenson JT, Beghetti M, Friedli B, Kalangos A. How to diminish reoperation rates after initial repair of tetralogy of Fallot? Ann Thorac Surg. 2002; 73:96–101.
65. Herman SG, Baselga P, Parnas Fernandez A, Alvarez C, Soto S, González A. Evolución de los pacientes con tetralogía de Fallot. Hospital del Niño Jesús de San Miguel de Tucumán. Análisis de la base de datos. Rev Fed Arg Cardiol 2007; 36: 87-93.
66. d’Udekem Y, Ovaert C, Grandjean F, Gerin V, Cailteux M, Shango-Lody P, et al. Tetralogy of Fallot: transannular and right ventricularpatching equally affect late functional status. Circulation. 2000; 102(19 suppl 3): III116–22.
67. Alexiou C, Chen Q, Galogavrou M, Gnanapragasam J, Salmon AP, Keeton BR, et al. Repair of tetralogy of Fallot in infancy with a transventricular or a transatrial approach. Eur J Cardiothorac Surg 2002; 22:174–83.
68. Fuster V, McGoon DC, Kennedy MA, Ritter DG, Kirklin JW. Long-term evaluation (12 to 22 years) of open heart surgery for tetralogy of Fallot. Am J Cardiol 1980; 46(4):635–42.
69. Bacha EA, Scheule AM, Zurakowski D, Erickson LC, Hung J, Lang P, et al. Long-term results after early primary repair of tetralogy of Fallot. J Thorac Cardiovasc Surg 2001; 122:154-161.
70. Murphy JG, Gersh BJ, Mair DD, Fuster V, McGoon MD, Ilstrup DM, et al. Long-term outcome in patients undergoing surgical repair of tetralogy of Fallot. N Engl J Med 1993; 329:593-9.
71. Fuster V, McGoon DC, Kennedy MA, Ritter DG, Kirklin JW. Long-term evaluation (12 to 22 years) of open heart surgery for tetralogy of Fallot. Am.J. Cardiol. 1980; 46: 635 642.
72. Yuman L, Ge S, Wang X, Lu Q, Xie M. Right ventricular global longitudinal systolic and diastolic function is diminished in patientswWith pulmonary arterial hypertension: A 2D ultrasound speckle tracking imaging (Abstract). Circulation 2009; 120:s387.