Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
Print version ISSN 0797-0048On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.28 no.1 Montevideo Apr. 2013
Artículo de revisión
Actualización en el diagnóstico y tratamiento del pseudoaneurisma cardíaco
Dres. Florencia Maglione 1, Lucía Florio 2, Sergio Burguez 3, Ramón Scola 4
1. Médico Ex Residente Cardiología Centro Cardiológico Americano.
2. Profesor Adjunto del Departamento de Cardiología Hospital de Clínicas. Cardiólogo Centro Cardiológico Americano.
3. Ex Profesor Adjunto del Departamento de Cardiología Hospital de Clínicas. Jefe Clínico Centro Cardiológico Americano.
4. Cirujano cardíaco. Jefe Quirúrgico Centro Cardiológico Americano
Trabajo realizado en el Centro Cardiológico Americano. Sanatorio Americano. FEMI – Montevideo.
Correspondencia: Florencia Maglione. Correo electrónico: flor2813@yahoo.com
Recibido diciembre 7, 2012; aceptado marzo 3, 2013
ANEURISMA FALSO
DIAGNóSTICO
Key words:
ANEURYSM, FALSE
DIAGNOSIS
Introducción
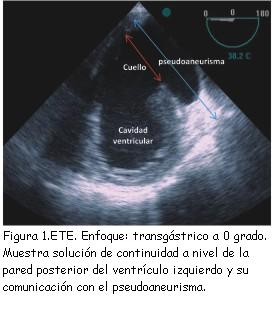
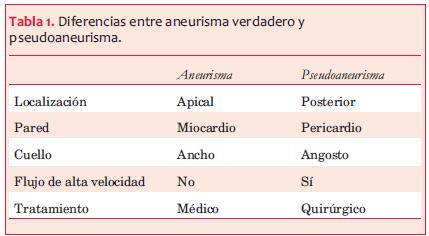
El pseudoaneurisma cardíaco es una entidad poco frecuente pero de gran relevancia clínica por su alta probabilidad de ruptura y de muerte. Se define esta entidad cuando existe una rotura incompleta de la pared del corazón donde el pericardio queda sellando dicha rotura y se desarrolla una neocavidad comunicada con la cavidad ventricular por un orificio estrecho(1) (figura 1). En contraste con los aneurismas verdaderos, que siempre contienen miocardio en su pared (tabla 1), la pared de los pseudoaneurismas está compuesta por pericardio y hematoma organizado, careciendo de los elementos de la pared ventricular original, miocardio y endocardio(1). Los trombos de la pared pueden ser antiguos o recientes, cuyas porciones superficiales pueden desprenderse y causar embolias sistémicas. El pseudoaneurisma cardíaco recibe parte del volumen sistólico ventricular en cada ciclo cardíaco.
La localización posterior e inferior son las más frecuentes; estas sugieren la presencia de un pseudoaneurisma y no de un aneurisma verdadero, ya que estos últimos muy pocas veces son posteriores. Se piensa que la explicación de que esta localización sea la más frecuente es que la rotura de la pared anterior suele ser fatal desde el inicio, sin tiempo a consolidar un pseudoaneurisma(2). En la serie de Gueron(3), la mitad de los pseudoaneurismas eran inferiores o posteriores y la otra mitad eran anteriores, laterales y apicales. Dos tercios correspondían a infartos inferiores y un tercio a infartos anteriores, a diferencia de los aneurismas verdaderos, mucho más frecuentes en los infartos anteriores. Sin embargo, la localización del pseudoaneurisma no es de ninguna manera un criterio para el diagnóstico.
Etiología
Suele ser una complicación del infarto agudo de miocardio (IAM) (55%), también puede presentarse como complicación de la cirugía cardíaca (33%)(4), posterior a una ventriculotomía o tras el reemplazo valvular mitral a nivel del anillo posterior, y tras el reemplazo valvular aórtico a nivel subaórtico(2). Los factores predisponentes poscirugía son la sutura del miocardio friable tras la ventriculotomía, la infección del material con que se refuerza la misma, la resección de la valva posterior de la mitral, la decalcificación del anillo aórtico, la incorrecta aposición de las prótesis valvulares que pueden quedar horadando la pared del ventrículo, la cirugía reparadora de la tetralogía de Fallot y la reconstrucción del ventrículo derecho(2). Otras etiologías menos frecuentes son el traumatismo torácico (7%)(5) y la endocarditis infecciosa (5%)(6). El proceso fisiopatológico que predispone a la ruptura de la pared ventricular en las diferentes etiologías son áreas de necrosis posinfarto, áreas instrumentadas en un acto quirúrgico y la formación de abscesos intramiocárdicos(1).
Historia natural. Diagnóstico clínico
El primer pseudoaneurisma cardíaco fue descrito en 1797 por Corvisart. Posteriormente, en 1967, Roberts y Morrow(7) describieron un pseudoaneurisma ventricular sintomático pos IAM, insuficiencia cardíaca clase funcional (CF) IV y elementos embólicos, siendo intervenido quirúrgicamente. El pseudoaneurisma fue reparado, pero el paciente falleció en tormenta eléctrica durante el intraoperatorio. Gueron y colaboradores(3) publicaron una serie de 23 pseudoaneurismas donde concluyeron que la ruptura es un cuadro fatal, por lo que una vez realizado el diagnóstico debe ser reparado quirúrgicamente. La ruptura del pseudoaneurisma suele ser sugerida por el desarrollo de un shock hipovolémico repentino que conduce con rapidez a la disociación electromecánica y a la muerte.
Existe una clasificación evolutiva del pseudoaneurisma según el momento en que se realiza el diagnóstico; se puede clasificar en agudo (diagnosticado hasta dos semanas posteriores al infarto), subagudo (entre las dos semanas y los tres meses) y crónico (posterior a los tres meses del infarto)(8,9). El pseudoaneurisma agudo tras el IAM es una entidad extremadamente inestable y con altísima mortalidad. Sin embargo, el pseudoaneurisma crónico usualmente es pausisintomático y es detectado accidentalmente en un estudio de imagen al realizar un ecocardiograma en el seguimiento del paciente(10).
La clínica no es específica y el diagnóstico rara vez es sugerido por signos físicos, hallazgos electrocardiográficos o radiológicos(11).
La historia natural de esta entidad no es bien conocida. El riesgo de ruptura es importante en los pseudoaneurismas grandes, pero incierto para los pequeños(8). En la serie de Fernando(12), donde se revisaron 30 pacientes con pseudoaneurismas ventriculares pos IAM, dos estaban asintomáticos al momento del diagnóstico y el resto se presentaron con insuficiencia cardíaca y angina. Otros síntomas pueden ser la presencia de arritmias ventriculares y la embolia sistémica de trombos desde el pseudoaneurisma(10,13). En el electrocardiograma se puede observar ondas Q patológicas o elevación persistente del segmento ST en el área del pseudoaneurisma(14).
En cuanto a las técnicas diagnósticas se pueden utilizar tanto técnicas invasivas como no invasivas. En las diferentes series se ha descrito el uso de la ventriculografía, la ecocardiografía y la resonancia nuclear magnética.
Frances y colaboradores(15) revisaron 290 pseudoaneurismas cardíacos extrayendo las características demográficas de la población, la forma de presentación y los estudios diagnósticos utilizados. La edad media de presentación fue de 60 años, dos tercios eran hombres. Los síntomas más frecuentes fueron insuficiencia cardíaca y dolor torácico; la muerte súbita fue la forma de presentación en 3% y aproximadamente 12% fueron un hallazgo en pacientes asintomáticos. La presencia de soplo cardíaco se encontró en más de dos tercios de los casos. La mayor parte de los pacientes tenían electrocardiogramas y radiografía de tórax anormales. La elevación del segmento ST se observó en 20%, mientras que alteraciones inespecíficas del ST se encontraron en el resto. Más de la mitad de los pacientes presentaban una silueta cardíaca aumentada en la radiografía de tórax. La etiología más frecuente fue el IAM y la localización la inferior. Un tercio de los pseudoaneurismas eran posquirúrgicos, posteriores al reemplazo valvular mitral. Una minoría fueron postraumáticos o posteriores a una endocarditis. Llama la atención que la ventriculografía fue el método diagnóstico más utilizado seguido de la ecocardiografía, esto puede deberse a que la revisión incluyó casos desde 1966 hasta 1997, sabiendo que los primeros reportes de pseudoaneurismas fueron diagnosticados por ventriculografía.
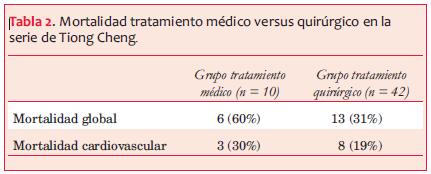
En la serie publicada por Tiong Cheng(2), con 52 pacientes, entre 1980 y 1996, la mitad fueron posquirúrgicos y la otra mitad pos IAM. El diagnóstico fue accidental en 25 pacientes, el resto se presentó con algunos de los siguientes síntomas: insuficiencia cardíaca, dolor torácico, síncope, arritmias ventriculares o embolias sistémicas. El diagnóstico inicial fue con ecocardiografía en la mayoría de los pacientes, también se utilizó la ventriculografía, la resonancia magnética y la tomografía computada. El tiempo medio entre el IAM o la cirugía cardíaca y el diagnóstico del pseudoaneurisma fue de nueve meses. El 81% recibió tratamiento quirúrgico, en el resto se optó por tratamiento médico debido a diferentes razones; asociación de otras comorbilidades, pequeños pseudoaneurismas y pacientes que se negaron a la cirugía (tabla 2). La mortalidad en este último grupo se relacionó más con la disfunción del ventrículo izquierdo que con una complicación del pseudoaneurisma. Tiong Cheng recomienda el tratamiento quirúrgico como el tratamiento de elección; sin embargo, en pacientes asintomáticos que tengan un elevado riesgo operatorio el tratamiento conservador puede ser considerado.
Diagnóstico ecocardiográfico
La ecocardiografía es una herramienta esencial en el diagnóstico del pseudoaneurisma. Ha sido la herramienta más estudiada en diagnosticar esta patología(16). El modo M, bidimensional y el Doppler son aplicables para llegar a un diagnóstico correcto de pseudoaneurisma ventricular(2,17). El uso de esta técnica de imagen no invasiva permite la detección de pseudoaneurismas asintomáticos pos IAM o posquirúrgicos(18). En 1975, Roelandt y colaboradores( 19) utilizaron el modo M para diagnosticar un pseudoaneurisma reconociendo un espacio libre de ecos en la pared posterior del ventrículo izquierdo. En 1980, Catherwood y colaboradores(13) utilizaron el eco bidimensional para comparar un pseudoaneurisma de un aneurisma verdadero y demostraron la cavidad globular del pseudoaneurisma y la discontinuidad del miocardio ventricular.
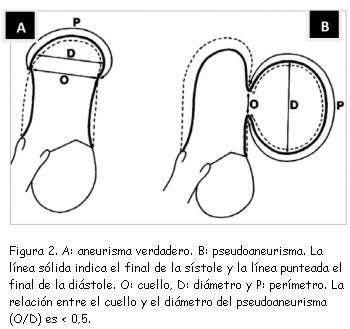
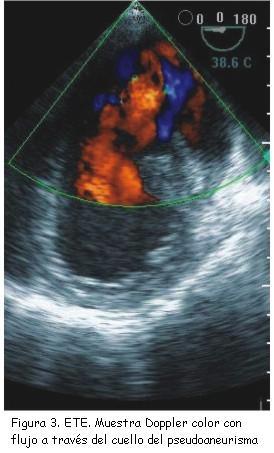
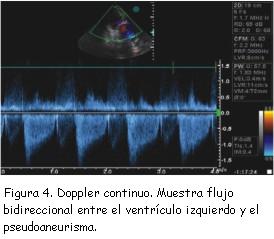
Un rasgo ecográfico típico del pseudoaneurisma es la estrechez de su cuello, con una correlación entre el diámetro del cuello y el diámetro máximo de la cavidad del pseudoaneurisma de menos de 0,5, valor muy reducido en comparación con el de la entrada más ancha del cuerpo del aneurisma verdadero (figura 2). No obstante esta característica no siempre resulta fiable (sensibilidad de apenas 60%)(18). Las imágenes de Doppler color y espectral ponen de manifiesto un característico flujo de entrada y salida hacia el pseudoaneurisma en la localización del desgarro (cuello del pseudoaneurisma) con un flujo anómalo turbulento en el interior del pseudoaneurisma (figura 3). El Doppler espectral muestra un flujo bidireccional: un flujo en la protosístole desde el ventrículo hacia el pseudoaneurisma y otro flujo en la protodiástole desde el pseudoaneurisma hacia el ventrículo (figura 4)(11,20,21). El Doppler color es superior al pulsado y al continuo para detectar el flujo dentro del pseudoaneurisma y para distinguir la discontinuidad del miocardio con el flujo a su través(20).
El modo bidimensional proporciona gran sensibilidad y especificidad diagnóstica identificando el cuello del pseudoaneurisma (sitio de ruptura), el saco aneurismático y su contenido(13). El modo M sugiere la presencia de un pseudoaneurisma posterior al mostrar un área libre de ecos detrás de la pared posterior del ventrículo izquierdo y la discontinuidad en la pared del miocardio en la zona del cuello del pseudoaneurisma. Sin embargo, este método tiene limitaciones al presentar zonas silentes donde pueden no observarse estas características como son la pared anterobasal y apical del ventrículo izquierdo, por lo que el eco bidimensional sería la técnica de mayor certeza diagnóstica acompañada del Doppler color para realizar el diagnóstico de pseudoaneurisma. La tabla 3 resume los criterios diagnósticos.

Resonancia nuclear magnética
La cardiorresonancia magnética (cardio-RM) se ha convertido en una técnica de gran utilidad práctica para el estudio de la cardiopatía isquémica y sus complicaciones. Las secuencias ultrarrápidas realizables en la actualidad con los equipos de última generación acortan de forma significativa la duración de los estudios y presentan imágenes de gran resolución. La técnica espín eco T1 permite visualizar las estructuras cardíacas en imágenes estáticas mediante cortes contiguos siguiendo los ejes anatómicos del corazón, lo que permite delinear de forma precisa el epicardio y el endocardio ventricular. La técnica gradiente eco se utiliza para estudios funcionales y dinámicos. Tanto las técnicas espín eco como gradiente eco son útiles para la identificación de los pseudoaneurismas ventriculares y la determinación de sus características anatómicas, facilitando la toma de decisión quirúrgica así como la planificación técnica de la misma. Además, la posibilidad de poder reproducir exactamente los mismos planos de corte en diferentes estudios permite la comparación pre y poscirugía(22-24); cabe destacar que la resonancia nuclear magnética diferencia con claridad el aneurisma verdadero del pseudoaneurisma proporcionando información anatómica sobre la conformación de ambas paredes(25), ya que tiene la capacidad de distinguir entre pericardio, trombos y miocardio según diferentes señales de intensidad, también visualiza la zona de desgarro miocárdico(10,14,26).
Ventriculografía
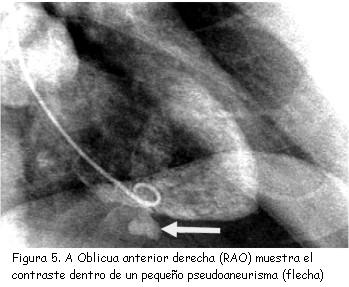
La ventriculografía ha dejado de utilizarse como método diagnóstico para la detección de pseudoaneurisma cardíaco con el devenir de los años debido a que es una técnica invasiva y con necesidad de exponer al paciente a radiación, además de realizar una carga extra de contraste. Hoy día, como hemos dicho anteriormente, la ecocardiografía y la resonancia nuclear magnética se han convertido en las técnicas diagnósticas por excelencia. Sin embargo, la coronariografía sigue realizándose de rutina para el diagnóstico de enfermedad coronaria en los pacientes con diagnóstico de pseudoaneurisma. Valora la necesidad de cirugía de revascularización miocárdica concomitante(29). Cuando se realiza la ventriculografía, esta puede evidenciar la interrupción del miocardio ventricular delimitando el cuello del pseudoaneurisma. Se puede observar que el contraste pasa desde la cavidad ventricular a la cavidad del pseudoaneurisma(10) (figura 5). Las imágenes dinámicas en cine ponen en evidencia la pulsatilidad del pseudoaneurisma ventricular, el cual habitualmente expande en sístole y colapsa en diástole; sin embargo, los pseudoaneurismas muy pequeños pueden colapsar durante la sístole al cerrarse el cuello del mismo con la contracción ventricular(30).
Tratamiento y pronósticoEl primer reporte de pseudoaneurisma reparado con éxito quirúrgicamente fue publicado por Smith y colaboradores(31), en 1957. El tratamiento quirúrgico es considerado el tratamiento de elección debido a que un pseudoaneurisma no tratado tiene un riesgo de 30% a 45% de ruptura. La mortalidad en los pacientes tratados quirúrgicamente ha mejorado con los años. La serie de Tiong Cheng, desde 1980 a 1996, como vimos previamente (tabla 2), describió una mortalidad global en los pacientes operados de 31% mientras que en el 2009, Gan Hui-li y Zhang Jian-qun reportaron una mortalidad de 23%. El pronóstico con tratamiento conservador sigue siendo pobre. Sin tratamiento quirúrgico la mayoría de los pseudoaneurismas se rompen y el paciente fallece por taponamiento cardíaco o colapso circulatorio(9).
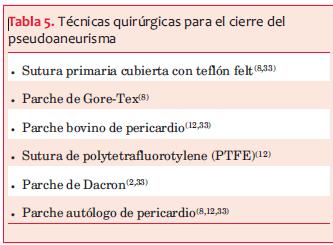
Como se mencionó previamente, el riesgo de ruptura en los grandes pseudoaneurismas es la complicación más temida(32); sin embargo, el riesgo de la reparación quirúrgica también es bien conocido. Existen diferentes técnicas quirúrgicas para el cierre del pseudoaneurisma (tabla 5).
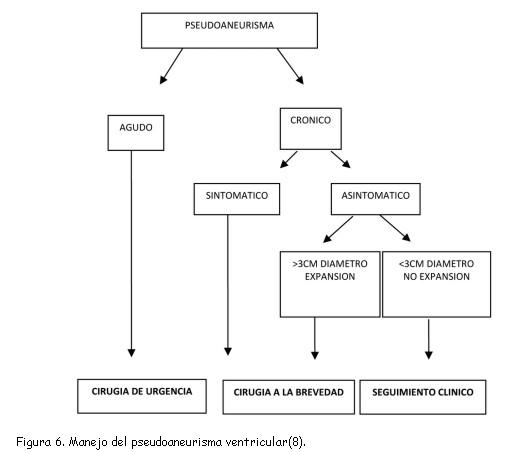
Frances y colaboradores(15), en su serie de 290 pacientes, observaron inestabilidad en los pseudoaneurismas agudos con una elevada mortalidad y, por otro lado, una relativa estabilidad en los pseudoaneurismas crónicos. El dilema está en la necesidad de intervenir quirúrgicamente los pseudoaneurismas crónicos debido a la incertidumbre en su evolución y al riesgo quirúrgico. Para algunas series, la decisión de intervenir sobre la de adoptar una conducta conservadora prevalece en pseudoaneurismas grandes o con crecimiento progresivo en el tiempo. Como es conocido, debido a la ley de Laplace, la dilatación del pseudoaneurisma trae un riesgo aumentado de ruptura, sin embargo los pseudoaneurismas pequeños y que se mantienen estables en el crecimiento tienen un curso más seguro. Un seguimiento regular con ecocardiografía o resonancia magnética es razonable en aquellos pacientes con pseudoaneurismas pequeños en donde no existe otra causa para la intervención quirúrgica (necesidad de revascularización o cirugía valvular concomitante); cualquier incremento en el tamaño es indicador de tratamiento quirúrgico (figura 6)(8,26). Otros autores han publicado(15) que el riesgo de ruptura es similar en pseudoaneurismas grandes como en pequeños. Esta discordancia se debe a que la historia natural del pseudoaneurisma no es bien conocida debido a que es una entidad poco prevalente.
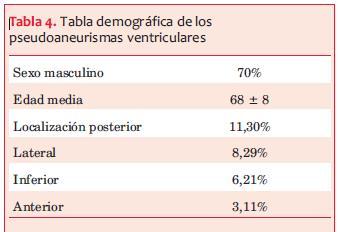
Fernando A y colaboradores(12) publicaron una serie de 30 pacientes con pseudoaneurismas pos IAM desde 1986 hasta 2002 (tabla 4). Las técnicas quirúrgicas utilizadas fueron sutura de polytetrafluorotylene (PTFE), parche de pericardio autólogo o bovino y parche de Dacron. En un paciente el saco del pseudoaneurisma no fue resecado y se utilizó para reforzar el parche en la zona del desgarro. Un procedimiento concomitante fue realizado en 21 pacientes: revascularización miocárdica y reparación o reemplazo valvular mitral.
Fedakar y colaboradores(33) revisaron las diferentes técnicas quirúrgicas en 22 pseudoaneurismas operados desde 1985 hasta 2008. Todos eran pseudoaneurismas pos IAM. La técnica diagnóstica más utilizada fue el ecocardiograma. El diámetro medio de los pseudoaneurismas fue de 5,0 ± 0,4 cm. La fracción de eyección promedio fue de 40%. Se realizó coronariografía en todos los pacientes encontrándose enfermedad de tres vasos, dos vasos y un vaso, realizándose la revascularización coronaria en quienes correspondía. Dentro de las técnicas para el cierre del pseudoaneurisma se utilizó la sutura primaria cubierta con teflón felt, el parche de Dacron y el parche autólogo de pericardio. Comparando la evolución de las diferentes técnicas quirúrgicas, la mortalidad en el grupo con parche de Dacron fue aproximadamente el doble que en las otras dos. La sobrevida global fue de 61,9 ± 41,4 meses. No se obtuvieron diferencias en cuanto a los sangrados y la fracción de eyección del ventrículo izquierdo (FEVI) entre los grupos. Para Fedakar y colaboradores, debido al riesgo de ruptura de los pseudoaneurismas, la cirugía está indicada para todos los pacientes luego de realizado el diagnóstico, a menos que el riesgo quirúrgico sea prohibitivo.
En relación con la mortalidad posoperatoria en las diferentes series no se asoció con dificultades técnicas, sino más bien se relacionó con la función ventricular disminuida(8).
Caso reporte
Paciente de 64 años, hombre. Antecedentes personales de IAM inferior no reperfundido seis meses previo. En la evolución presentó angor pos IAM realizándose coronariografía de urgencia. Evidencia lesión severa de arteria descendente anterior y de arteria circunfleja con buenos lechos distales; coronaria derecha con lesión severa proximal y ocluida distalmente. Electrocardiograma con secuela inferior. Ecocardiograma: aquinesia posteroinferior. Función sistólica disminuida en grado moderado (45%). Se realizó cirugía de revascularización miocárdica con by-pass mamario izquierdo a arteria descendente anterior y dos by-pass venosos, uno a arteria circunfleja y el otro a un marginal obtuso. No se revascularizó el territorio de la coronaria derecha por presentar secuela de infarto eléctrica y ecográfica. En la cirugía se confirmó el diagnóstico de necrosis miocárdica a nivel inferior observándose gran cicatriz de infarto con disquinesia a dicho nivel. Buena evolución posoperatoria, se otorgó el alta al séptimo día.
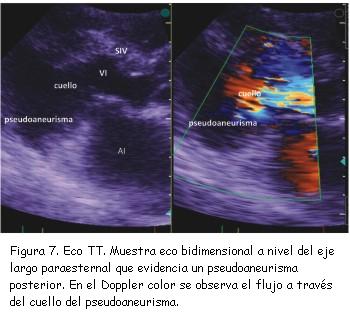
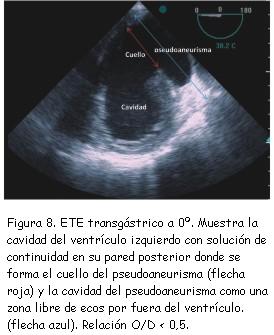
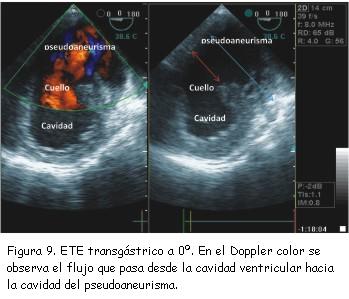
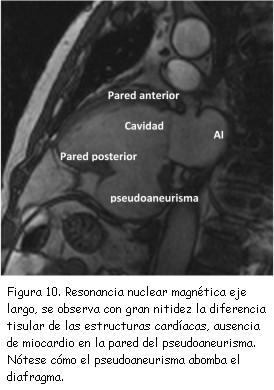
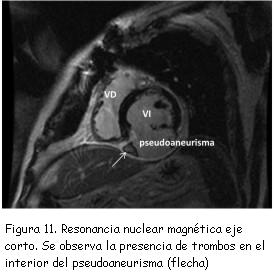
A los tres meses del alta se realizó nuevo ecocardiograma de control que constató pseudoaneurisma ventricular inferior con un cuello de 2,8 cm, una cavidad de 6 cm de diámetro, trombos en su interior y expansión en sístole (figura 7). Se completó el diagnóstico con un ecocardiograma transesofágico (figuras 8 y 9) y resonancia nuclear magnética (figuras 10 y 11). No se realizó nueva coronariografía debido a que el paciente se encontraba asintomático y el pseudoaneurisma se encontraba en la zona del infarto previo.
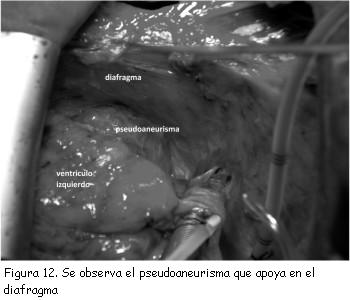
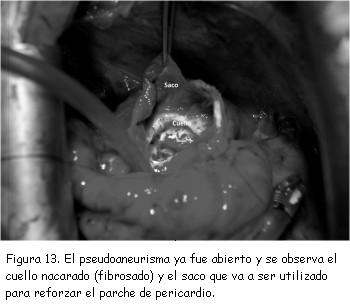
Se decidió realizar tratamiento quirúrgico. Se practicó reparación del pseudoaneurisma mediante plastia con parche de pericardio bovino, el saco del pseudoaneurisma no fue resecado y se utilizó para reforzar el parche de pericardio (figuras 12 y 13). La ecocardiografía transesofágica (ETE) intraoperatoria confirmó la continencia de la reparación. El tiempo de circulación extracorpórea fue de 100 minutos.
Como complicación, en el posoperatorio presentó disfunción neurológica difusa que mejoró con neurolépticos y complicaciones respiratorias: hemoneumotórax y neumonía basal izquierda a Pseudomona aeruginosa , recibió tratamiento antibiótico con una cefalosporina de tercera generación y un aminoglucósido acorde a la sensibilidad antibiótica.
Se le otorgó el alta al mes de la cirugía. Ecocardiograma prealta: reparación continente del pseudoaneurisma inferior; aquinesia posteroinferior. Función sistólica 40%. Ecocardiograma a los seis meses, sin cambios. Asintomático.
Conclusiones
El pseudoaneurisma cardíaco es una entidad poco prevalente, sin embargo de gran importancia clínica por el riesgo de ruptura y de muerte que conlleva. Algunos autores creen que el riesgo de ruptura es similar en pseudoaneurismas grandes y pequeños, otros afirman que existe diferencia entre aneurismas agudos y crónicos, siendo estos últimos de evolución más estable. La etiología más frecuente sigue siendo el infarto agudo de miocardio seguido de la cirugía cardíaca. La localización más frecuente es a nivel posteroinferior del ventrículo izquierdo. Puede presentarse con síntomas inespecíficos como insuficiencia cardíaca, dolor torácico o ser un hallazgo en un paciente asintomático. Existen diferentes técnicas diagnósticas, pero la ecocardiografía continúa siendo la técnica más utilizada, accesible, y con alta sensibilidad diagnóstica. El consenso general es que la cirugía está indicada una vez que se realiza el diagnóstico a menos que los riesgos quirúrgicos sean prohibitivos.
Bibliografía
1. Migliore RA, Piñeiro DJ. Evaluación de la estructura y de la función cardiaca. En: Piñeiro DJ, Bustamante Labarta MH, Guevara E, Migliore RA, Roisimblit JM. Ecocardiografía para la toma de decisiones clínicas. Buenos Aires: Panamericana:2005: 219-342.
2. Yeo TC, Malouf JF, Oh JK, Seward JB. Clinical Profile and Outcome in 52 Patients with Cardiac Pseudoaneurysm. Ann Intern Med 1998;128:299-305.
3. Gueron M, Wanderman KL, Hirsch M, Borman J. Pseudoaneurysm of the left ventricle after myocardial infarction. J Thorac Cardiovasc Surg 1975;69:736-42.
4. Watanabe A, Kazui T, Tsukamoto M, Komatsu S. Left ventricular pseudoaneurysm and intracardiac fistulas after replacement of mitral valve prosthesis. Ann Thorac Surg 1993;55:1236 –9.
5. Maselli D, Micalizzi E, Pizio R, Audo A, De Gasperis C. Posttraumatic left ventricular pseudoaneurysm due to intramyocardial dissecting hematoma. Ann Thorac Surg 1997; 64:830 –1.
6. Shackcloth MJ, Dihmis WC. Contained rupture of a myocardial abscess in the free wall of the left ventricle. Ann Thorac Surg 2001;72:617–9.
7. Roberts WC, Morrow AG. Pseudoaneurysm of the left ventricle: an unusual sequel of myocardial infarction and rupture of the heart. Am J Med 1967;43:639-44.
8. Prêtre R, Linka A, Jenni R, Turina MI. Surgical treatment of acquired left ventricular pseudoaneurysms. Ann Thorac Surg 2000;70:553-7.
9. Gan HL, Zhang JQ. Diagnosis and surgical treatment of post-infarction left ventricular pseudoaneurysm. Chin Med J (Engl) 2009;122(2):232-5.
10. Brown SL, Gropler RJ, Harris KM. Distinguishing Left Ventricular Aneurysm From Pseudoaneurysm: a review of the literature. Chest 1997;111:1403-9.
11. Roeland JR, Sutherland GR, Yoshida K, Yoshikawa J. Improved Diagnosis and Characterization of Left Ventricular Pseudoaneurysm by Doppler Color Flow Imaging. J Am Coll Cardiol 1988;12:807-1.
12. Atik FA, Navia JL, Vega PR, González-Stawinski GV, Alster JM, Gillinov AM, et.al. Surgical Treatment of Postinfarction Left Ventricular Pseudoaneurysm. Ann Thorac Surg 2007;83:526-31.
13. Catherwood E, Mintz GS, Kotler MN, Parry WR, Segal BL. Two-dimensional Echocardiographic Recognition of Left Ventricular Pseudoaneurysm. Circulation 1980, 62:294-303.
14. March KL, Sawada SG, Tarverm RD, Kesler KA, Armstrong WF. Current Concepts of Left Ventricular Pseudoaneurysm: Pathophysiology ,Therapy, and Diagnostic Imaging Methods. Clin. Cardiol 1989;12:531-40.
15. Frances C, Romero A, Grady D. Left Ventricular Pseudoaneurysm. J Am Coll Cardiol 1998;32:557– 61.
16. Roelandt J, Brand M, Vletter WB, Nauta J, Hugenholtz PG. Echocardiographic diagnosis of pseudoaneurysm of the left ventricle. Circulation 1975, 52:466-72.
17. Alam M, Rosman HS, Lewis JW, Brymer JF. Color Doppler Features of Left Ventricular Pseudoaneurysm. Chest 1989; 95:231-2.
18. Yeo TC, Malouf JF, Oh JK, Seward JB. Clinical profile autcome in 52 patients with cardiac psedoaneurysm. Ann Intern Med1998; 128:299-305.
19. Gagliardi J, Charask A, Higa C, Blanco P, Dini A, Tajer C, et al. Infarto agudo de miocardio en la República Argentina. Análisis comparativo en los últimos 18 años. Resultado de la encuesta SAC. Rev Argent Cardiol 2007;75:171-8.
20. Sutherland GR, Smyllie JH, Roeland JR. Advantages of colour flow imaging in the diagnosis of left ventricular pseudoaneurysm. Br Heart J 1989;61:59-64.
21. Lasorda DM, Dianzumba SB, Casaday FM, Joyner CR. Diagnosis of recurrent left ventricular pseudoaneurysm by echocardiography with color flow imaging. Clin Cardiol 1991;14: 431-4.
22. Jiménez Borreguero LJ, de Pablos Epalza L, Chillón Terrón MM. Introducción a los aspectos técnicos de la cardio-RM. En: Borreguero LJ, director. Resonancia magnética y corazón. Madrid: Sociedad Castellana de Cardiología;2001:1-10.
23. Carreras Costa F, Pons Lladó G. Estudio de la cardiopatía isquémica por cardio RM. En: Borreguero LJ, director. Resonancia magnética y corazón. Madrid: Sociedad Castellana de Cardiología; 2001:11-19.
24. Harrity P, Patel A, Bianco J, Subramanian R. Improved Diagnosis and Characterization of Postinfarction Left Ventricular Pseudoaneurysm by Cardiac Magnetic Resonance Imaging. Clin Cardiol 1991;14:603-6.
25. Ando S, Kadokami T, Momii H, Hironaga K, Kawamura N, Fukuyama T, et al. Left ventricular false-pseudo and pseudo aneurysm: serial observations by cardiac magnetic. Resonance imaging. The Japanese Society of Internal Medicine 2007;46:181-5.
26. Eren E, Bozbuga N, Toker ME, Keles C, Rabus MB, Yildirim O, et al. Surgical Treatment of Post-Infarction Left Ventricular Pseudoaneurysm. A Two-Decade Experience.Tex Heart Inst J 2007;34:47-51.
27. Chakraborty RN, Nicholson AA, Alamgir MF. Magnetic resonance images of left ventricular Pseudoaneurysm. Heart 1998;80:101–3.
28. ACCF/ACR/AHA/NASCI/SCMR 2010 Expert Consensus Document on Cardiovascular Magnetic Resonance: A report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents. J Am Coll Cardiol 2010;55:2614-62.
29. Csapo K, Voith L, Szuk T, Edes I, Kereiakes DJ. Postinfarction Left Ventricular Pseudoaneurysm. Clin Cardiol 1997; 20:898-903.
30. Ghersin E, Kerner A, Gruberg L, Bar-El Y, Abadi S, Engel A. Left ventricular pseudoaneurysm or diverticulum: differential diagnosis and dynamic evaluation by catheter left ventriculography and ECG-gated multidetector CT. Br J Radiol 2007; 80: e209–11.
31. Smith RC, Goldberg H, Bailey CP. Pseudoaneurysm of the left ventricle: diagnosis by direct cardioangiography; report of two cases successfully repaired. Surgery 1957;42:496-510.
32. Togni M, Hilfiker P, Follath F. Ruptured ventricular pseudoaneurysm. Heart 1998;80:97.
33. Fedakar A, Bugra O, Onk A, Mataraci I, Eren E, Zeybek R. Repair of left ventricular pseudoaneurysms. Asian Cardiovasc Thorac Ann 2010;18:39-43.