Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.27 no.3 Montevideo Dec. 2012
Revisión
Hipertensión arterial resistente o refractaria
Dr. Juan Alonso 1
1. Director de la Clínica Médica “C”. Hospital de Clínicas, Facultad de Medicina. Universidad de la República.
Palabras clave:HIPERTENSIÓN
PREVALENCIA
1. Introducción
Las cifras exactas de prevalencia de hipertensión arterial (HTA) resistente son desconocidas, pero el control de las cifras tensionales en la población hipertensa es pobre (1).
Las prevalencias de HTA refractaria en algunos estudios no diseñados específicamente para evaluarla fueron las siguientes: en ALLHAT (2,3) 27%, en CONVINCE (4) 18%, en VALUE (5), al menos 15%. Datos más recientes procedentes de España muestran sobre un total de 68.045 pacientes hipertensos, 12,2% de HTA refractaria (6). Dada la alta prevalencia de la HTA en la población general y las cifras mencionadas de prevalencia de HTA refractaria, esta se transforma en un problema médico frecuente.
La HTA secundaria es más frecuente en este grupo de pacientes pero, antes de considerar esta posibilidad se deben contestar un conjunto de preguntas.
Para esta publicación los términos HTA resistente o refractaria son intercambiables.
Los pacientes con HTA no controlada tienen una probabilidad mayor de lesión de órgano blanco y un mayor riesgo vascular que los pacientes con HTA controlada (7).
Si bien no hay estudios sobre el pronóstico de los individuos con HTA refractaria, los estudios poblacionales muestran que el daño de órgano blanco, el riesgo de infarto agudo de miocardio, de accidente cerebrovascular (ACV), de insuficiencia cardíaca y de insuficiencia renal, así como la mortalidad se relacionan con los niveles de presión arterial (PA) (7-10).
Si se suma a lo anterior las comorbilidades habitualmente presentes en los pacientes con HTA refractaria –obesidad, diabetes, insuficiencia renal– el pronóstico se vuelve ominoso (11).
3. ¿Es posible definir qué variables identifican a quienes tienen más probabilidad de tener HTA refractaria?
Algunas características de los pacientes hipertensos luego de las primeras consultas son capaces de predecir HTA refractaria (6,11-17). Estas son:
1. Pacientes añosos (>75 años).
2. Cifras basales de HTA muy elevadas.
3. Obesidad (índice de masa corporal [IMC] >30 kg/m2).
4. Alto consumo de sal.
5. Enfermedad renal crónica.
6. Diabetes.
7. Hipertrofia ventricular izquierda.
8. Afrodescendientes.
9. Sexo femenino.
De las condiciones antes mencionadas, datos del estudio Framingham y ALLHAT identificaron la edad, la hipertrofia ventricular izquierda, las cifras basales muy elevadas de presión arterial sistólica (PAS) y la obesidad como predictores de refractariedad para la HTA sistólica.
La obesidad y la edad tuvieron alto valor predictivo negativo para el control de la presión arterial diastólica (PAD).
En términos generales, el factor que predice mejor la refractariedad es la insuficiencia renal crónica, con un punto de corte de creatininemia de 1,5 mg/dL (13).
La PAS fue más dificil de controlar que la PAD; así en el estudio Framingham se logró control de la PAD en 90% de los pacientes, mientras que el control para la PAS se alcanzó en 49% de los mismos (12). Otros estudios reafirman el concepto anterior (13).
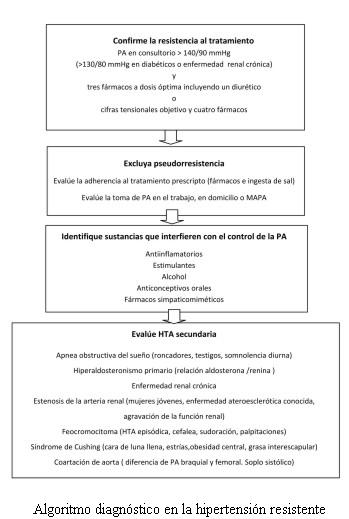
4. ¿Tiene el paciente efectivamente HTA refractaria?Según la definición de la American Heart Association (AHA) del año 2008 (15), deben ser considerados hipertensos refractarios o resistentes aquellos pacientes que no logran llegar a las cifras objetivo de PA con tres fármacos que incluyan un diurético. La definición contempla dos aspectos, por un lado las cifras de PA por encima de la cual el control no es el deseable y, por otro, el uso de tres fármacos.
Con respecto a las cifras objetivo de la PA, tradicionalmente son cifras menores de 140/90 mmHg para la población hipertensa en general y menores de 130/80 mmHg en los pacientes diabéticos, en los pacientes con insuficiencia renal o en pacientes con proteinuria igual o mayor de 300 mg en 24 horas. Es conveniente aclarar que las cifras objetivo para el control de la PA surgen de la publicación del 2008 de la AHA.
Sin embargo, parece oportuno recordar que la Revisión de las Guías Europeas para el manejo de la HTA (18), publicadas en 2009, sostienen que el objetivo tradicionalmente recomendado en diabetes, <130/80 mmHg, no es apoyado por los resultados de la evidencia de los ensayos y además han sido muy difíciles de conseguir en la mayoría de los pacientes. Se puede recomendar que en diabéticos, la PAS sea reducida por debajo de 140 mmHg, sin mencionar objetivos específicos que no están demostrados.
La misma guía hace recomendaciones sobre la PA objetivo en los muy ancianos, es decir por encima de los 80 años. En este grupo de pacientes se recomienda una PAS <150 mmHg, particularmente en pacientes con escasa comorbilidad fuera de la HTA. Es necesario recordar que la evidencia para esta recomendación surge del estudio HYVET, donde se reclutaron pacientes añosos que con la excepción de la HTA eran sanos. La aplicabilidad de estos datos a octogenarios más frágiles es incierta.
Con respecto a los tres fármacos:
1. Los tres fármacos deben ser de distinta clase y uno debe ser un diurético.
2. La dosis debe ser óptima, entendiendo por tal las dosis máximas toleradas.
3. Debe haber adherencia al tratamiento farmacológico por parte del paciente.
4. Debe haber adherencia al régimen hiposódico.
5. ¿Se trata de una HTA resistente verdadera o seudorresistente?
El diagnóstico de HTA resistente o refractaria debe diferenciarse de la “seudorresistencia” en donde hay una percepción errónea de que la HTA es verdaderamente resistente. Esta percepción errónea de la resistencia obedece a múltiples factores.
5.1 ¿Se ha tomado la PA en forma adecuada?
Los errores más frecuentes en la toma de la PA son los siguientes (10):
- Ausencia de reposo previo a la toma de PA; esta debe ser medida con el paciente sentado y tranquilo luego de 5 minutos de reposo.
- Posición del paciente sin la relajación suficiente y hablando mientras se toma la PA.
- Una sola toma en vez de dos o tres tomas y promediar los valores.
- Uso de manguito pequeño con respecto a la circunferencia del brazo (situación frecuente en los pacientes obesos). El uso de manguitos cortos o estrechos puede registrar valores falsamente elevados de PAS de 5 a 15 mmHg.
- Haber fumado en los últimos 15 a 30 minutos previos a la toma de PA. Esto puede elevar la PAS entre 5 a 20 mmHg.
5.2 ¿Existirá HTA de túnica blanca?
Si bien la HTA de túnica blanca fue descrita inicialmente para las cifras ligeramente aumentadas en consultorio a los efectos de confirmar o descartar el diagnóstico de hipertensión, adquiere mayor importancia como causa de la seudorresistencia.
Ciertos pacientes que aparentan tener HTA resistente tienen PA normal en domicilio. Este fenómeno ha sido atribuido a aumentos transitorios de la PA en consultorio. Esta situación en este grupo de pacientes se conoce como HTA resistente de túnica blanca (10). Se trata de una causa frecuente de seudohipertensión. Se puede sospechar esta situación cuando hay discordancia entre la magnitud de la HTA y la lesión del órgano blanco o cuando se induce hipotensión arterial tras ajustar la dosis de acuerdo a las cifras tomadas en consultorio (16).
En un estudio, un tercio de los pacientes con HTA aparentemente resistente tuvieron en el monitoreo ambulatorio un promedio menor de 130/85 mmHg (19). La frecuencia de la HTA de túnica blanca como causa de seudorresistencia varía entre 25% y 44% (6,17,19-22).
El monitoreo ambulatorio de la PA o la toma de PA en domicilio son herramientas útiles para descartar esta causa frecuente de seudorresistencia (17-22).
5.3 En un paciente añoso, ¿la maniobra de Osler es positiva?
La maniobra de Osler (23) hace referencia a la persistencia de la palpación de la arteria radial cuando se comprime con el manguito del esfigmomanómetro la arteria braquial por encima de la PAS. Se observa en los pacientes añosos y cuando está presente hace sospechar una causa de seudohipertensión. El hallazgo es debido a esclerosis y calcificación arterial, lo que determina que sea necesario un mayor nivel de PA para comprimir la arteria, que determina falsos registros elevados de de PA. No hay estudios de prevalencia, pero se la considera una causa rara. Si bien algunos autores sugieren la medida de presión intraarterial para confirmar el diagnóstico, la propuesta parece poco práctica (10).
Si se excluyen estas tres posibilidades se excluye el diagnóstico de seudohipertensión.
La tasa de adherencia al tratamiento farmacológico de la HTA es variable dependiendo de la población estudiada, clase de medicamentos, método utilizado para evaluar la adherencia y definición de adherencia (precoz versus tardía).
Se estima que solo 50% de los pacientes hipertensos tienen adherencia al tratamiento farmacológico (24).
Así, sobre 15.000 pacientes a cuatro años de seguimiento, 43% de ellos no recibía ningún fármaco antihipertensivo (25,26). Cuando hubo intervención para aumentar la tasa de adherencia, la misma ascendió a 80% (27).
Con respecto a la adherencia, los pacientes pueden ser catalogados como cumplidores, no cumplidores o parcialmente cumplidores (28). La tercera categoría de parcialmente cumplidores incluye aquellos pacientes que cumplen con la medicación pero no estrictamente como fue prescripta. Se incluyen en este último grupo los pacientes cumplidores parciales de túnica blanca. Se trata de pacientes que toman la medicación como fue prescripta días antes de la consulta. Esto puede determinar un aparente buen control de la PA (29).
En los últimos años ha habido interés en definir las ventajas y desventajas de un conjunto de herramientas o métodos para poder evaluar el grado de adherencia al tratamiento en los pacientes hipertensos. Estos métodos incluyen: el auto informe (30), dispositivos electrónicos para monitorizar la adherencia (31,32), consumo de comprimidos informados por la farmacia (33) y el recuento de comprimidos (34).
La no adherencia reconoce un conjunto de causas. El conocimiento, la responsabilidad, las creencias y la actitud del paciente participan en el no cumplimiento.
Sobre una cohorte de 1.500 pacientes, 20% no adherían al tratamiento siendo estos los argumentos para el no cumplimiento (35):
- Olvido: 46%.
- La PA se encontraba bajo control: 40%.
- No le gusta tomar la medicación: 33%.
- Aparición de efectos adversos: 30%.
- Control de la PA por otros métodos: 28%.
- Costos: 16%.
Otros factores también contribuyen a la no adherencia al tratamiento farmacológico: esquemas posológicos de una toma diaria versus tomas diarias múltiples, alteración de la calidad de vida por la aparición de efectos colaterales y la depresión.
7. ¿El paciente cumple con el régimen hiposódico?La magnitud del descenso de la PA restringiendo la ingesta de sal es variable en cada paciente y en diferentes momentos para un mismo paciente.
Las recomendaciones de ingesta de sal en los pacientes con HTA: <100 mEq de Na y menos de 85 mEq/día, de acuerdo al 7ª JNC y a la Sociedad Europea de HTA de 2007 respectivamente (1 g de NaCl contiene 17 mEq de Na, 1g de Na es igual a 44 mEq de Na) (36,37).
Un conjunto definido de pacientes con HTA son particularmente sensibles a la ingesta de sal: ancianos, afrodescendientes, obesos, con síndrome metabólico y con enfermedad renal crónica (38,39). Para este grupo de pacientes se recomienda que la ingesta no supere 1,5 g de Na/día (aproximadamente 66 mEq de Na y 4 g de NaCl) (37).
La no adherencia al régimen hiposódico constituye una causa frecuente de seudorrefractariedad. La amplia mayoría de los pacientes con HTA refractaria, en algunos estudios el 90%, tiene un exceso de ingesta de sal (10 g/día), lo que determina una expansión del volumen plasmático (40).
Del total de sal ingerida, 80% obedece a la agregada en el proceso de elaboración de la comida (41). De forma tal que la primera medida es la supresión del agregado de sal en la elaboración de los alimentos.
El paciente y el médico deben saber que la reducción del consumo de sal conduce no solo al descenso de la PA sino a una mejor respuesta a los fármacos usados en el tratamiento de la HTA (con excepción de los calcio-antagonistas), potencia el efecto antiproteinúrico de los inhibidores de la angiotensina, se asocian a un menor grado de hipopotasemia inducida por diuréticos así como a una disminución de la calciuria, y condicionan abatimientos en las tasas de infarto de miocardio, enfermedad coronaria, ACV y mortalidad (42).
Cabe preguntarse cuánto esperar que descienda la PA restringiendo la ingesta de sal en los pacientes con HTA refractaria. Cuando se comparó un régimen bajo en sal con un régimen rico en sal durante una semana, hubo una aumento de la PAS de 27 mmHg y de la PAD de 9,1 mmHg con alta ingesta de sal (43).
La mejor forma de evaluar el cumplimiento del régimen hiposódico es medir la natriuresis de 24 horas en ausencia de tratamiento diurético (11).
8. ¿Son adecuados el tipo y la dosis de diurético empleado?El control del volumen es clave en el tratamiento efectivo de la HTA refractaria puesto que la hipervolemia puede llegar a estar presente en 90% de los pacientes (11). De forma tal que es indispensable que el paciente esté recibiendo un diurético y que el tipo de diurético se ajuste al clearence de creatinina o a la creatininemia.
Se ha enfatizado, que el médico no suele identificar la enfermedad renal crónica que, por otra parte, es una de las causas más frecuentes de HTA secundaria (44).
Es recomendable sustituir las tiazidas por diuréticos de asa con clearence de creatinina <50 ml/min/1,73 m2 y hacer lo propio con la clortalidona si es <40 ml/min/1,73 m2. Si no se dispone del clearence de creatinina, una creatininemia ³ 1,5 mg/dL es el punto de corte para sustituir las tiazidas por un diurético de asa. Cuando se utiliza furosemide su administración se debe efectuar dos veces por día (10,15,18).
Si el paciente recibe tres fármacos para el tratamiento de la HTA pero no recibe diuréticos, o estos no se adecuan a la función renal, el paciente no está en HTA refractaria.
9. ¿La combinación de fármacos que el paciente viene recibiendo es la recomendada?Una estrategia útil es combinar fármacos de clase diferente, cada uno de los cuales tiene uno o más de los siguientes efectos: reducción de la sobrecarga de volumen (diuréticos y antagonistas de la aldosterona), reducción de la sobreactividad simpática (betabloqueantes), disminución de las resistencias vasculares (inhibidores de la enzima convertidora o bloqueantes de los receptores de angiotensina II), relajantes del músculo liso vascular (bloqueantes de los canales de calcio o alfa bloqueantes) (10).
Combinaciones razonables de tres fármacos serían:
- Un bloqueante del sistema renina angiotensina (IECA o ARA II) más un calcio antagonista y un diurético.
- Un betabloqueante más un calcio antagonista y un diurético.
¿Ha existido inercia médica?
Se entiende por tal la no modificación del esquema terapéutico que incluye la dosis de los fármacos prescriptos frente a cifras de PA elevadas en reiteradas visitas médicas, conociendo el médico los fármacos, las dosis y las recomendaciones o guías que apoyan la indicación.
Para algunos autores, cerca de 50% de los médicos no modifica la dosis de la medicación prescripta frente a niveles de PA que no llegan a las cifras objetivos (10,45).
¿El paciente recibe fármacos que interfieren con el control de la PA?
Se incluyen en este subcapítulo un conjunto de fármacos de uso frecuente en la práctica médica que interfieren con el buen control de la PA (15).
- Antiinflamatorios: los antiinflamatorios no esteroideos son de uso frecuente. Estos fármacos aumentan en promedio 5 mmHg la PA, pero esto varía considerablemente. Reducen el efecto de todos los fármacos antihipertensivos excepto los bloqueadores de los canales de calcio.
Los AINE reducen el flujo sanguíneo renal debido a la inhibición de la síntesis de prostaglandinas. Esto conduce a un aumento en la reabsorción renal de sodio y agua. El efecto es más pronunciado en aquellos pacientes con enfermedad renal crónica, añosos y diabéticos. Los inhibidores de la ciclooxigenasa 2 también perjudican el buen control de la PA. - Corticoides.
- Simpaticomiméticos: incluyendo descongestivos nasales, cocaína, drogas anorexígenas.
- Anticonceptivos orales.
- Antidepresivos.
- Eritropoyetina.
- Ciclofosfamida – tacrolimus.
- Alcohol: un consumo de alcohol >30 ml/ día eleva la PA, en oportunidades a valores de riesgo.
- Ginseng.
- Existe HTA asociada a hipopotasemia espontánea o inducida por dosis bajas de diuréticos.
- HTA severa: PAS >160 mmHg o PAD >100 mmHg o HTA resistente.
- HTA con incidentaloma suprarrenal.
- HTA e historia familiar de HTA o ACV por debajo de los 40 años.
- Todos los familiares de primer grado de pacientes con hiperaldosteronismo primario.
- Concentración plasmática de renina.
- Actividad de renina plasmática.
- Concentración plasmática de aldosterona.
- Relación aldosterona/concentración o actividad de renina plasmática.
- Carga oral diaria durante tres días de 5 g de Na y cuantificación de natriuria, creatininuria y aldosterona en orina de 24 horas en el tercer día del estudio. El test resulta positivo si la excreción de Na es > 200 mEq y la aldosterona > 12 mcg en orina de 24 horas.
- Carga de 2 litros de suero fisiológico en cuatro horas con el paciente en reposo en cama. Una concentración plasmática de aldosterona mayor de 12 ng/dL es diagnóstica de hiperaldosteronismo primario.
- HTA severa o resistente.
- Aumento agudo de la PA en un paciente con HTA conocida con cifras de PA estables.
- Inicio de la HTA antes de los 30 años en pacientes no obesos, caucásicos, sin historia familiar de hipertensión.
- HTA en fase acelerada: pacientes con HTA severa y signos de daño de órgano blanco tales como hemorragias en el fondo de ojo o edema de papila, falla cardíaca, disturbios neurológicos o insuficiencia renal.
- Comienzo de HTA severa (cifras de PA iguales o mayores de 180/120 después de los 55 años. Otros autores incluyen niveles de PA más bajo y edades más tempranas: cifras mayores de 160/100 mmHg antes de los 50 años en ausencia de antecedentes familiares.
- Elevación de la creatininemia en más de 50%, en la primera semana luego de iniciar tratamiento con inhibidores de la enzima de conversión o bloqueadores de los receptores de angiotensina II.
- HTA severa en pacientes por encima de los 50 años con evidencia de enfermedad vascular en otros territorios.
- HTA severa en pacientes con atrofia renal inexplicada o asimetría renal >1,5 cm.
- HTA severa con ingresos repetidos por insuficiencia cardíaca congestiva: flash pulmonary edema.
- Soplo sistólico-diastólico abdominal lateralizado. El hallazgo tiene una sensibilidad de 40% y especificidad de 99%. El soplo sistólico tiene más sensibilidad pero menor especificidad. La búsqueda del soplo incluye epigastrio y los cuatro cuadrantes del abdomen.
- HTA asociada a insuficiencia renal.
- HTA asociada a reciente agravación de la función renal de causa inexplicada.
- Sustituir la hidroclorotiazida por clortalidona. Si el clearence de creatinina es £30 ml/min/m2 se debe sustituir las tiazidas por un diurético de asa (furosemide o torasemida). Si se usa furosemide es recomendable administrarlo repartido en dos tomas.
- Si a pesar de lo anterior la PA no se controla, se sugiere añadir espironolactona a la dosis ya mencionada. Se debe monitorizar estrechamente el potasio sérico.
- Si aparecen efectos colaterales intolerables con la espironolactona, se sugiere cambiar a eplerenona o amiloride.
- En los pacientes que persisten hipertensos se sugiere añadir un betabloqueante con acción vasodilatadora.
- Como alternativa a lo anterior es posible añadir clonidina transdérmica.
- Si persiste la resistencia una opción es hidralazina para las mujeres y minoxidil para los hombres.
12. ¿Tiene el paciente HTA secundaria?
El análisis de todas las causas de la HTA secundaria desborda el objetivo de este capítulo.
La prevalencia de HTA secundaria es mayor en el grupo de pacientes con HTA refractaria. Una de las claves para la sospecha de HTA secundaria es justamente la HTA resistente (18,45,46).
Las causas frecuentes de HTA secundaria son la apnea obstructiva del sueño, la enfermedad renal crónica, el hiperaldosteronismo primario y la estenosis de la arteria renal (18,46).
Dentro de estas se enfatiza en las claves para su sospecha clínica así como los estudios iniciales.
Apnea obstructiva del sueño
La prevalencia de los trastornos del sueño es frecuente en la población general, estando presente en 24% de los hombres y en 9% de las mujeres (47). La prevalencia de apnea obstructiva del sueño en pacientes con HTA resistente asociada a obesidad es alta (96% y 65%) para hombres y mujeres, respectivamente (48), siendo mayor en paciente con HTA resistente (71%) cuando se la compara con HTA controlada (38%) (49). La severidad de la apnea se correlaciona con los niveles plasmáticos de aldosterona (50). El factor de riesgo más importante es la obesidad y algunas medidas relacionadas con lo anterior, como, por ejemplo, la circunferencia del cuello (51).
Cuando dos de los siguientes síntomas están presentes debe sospecharse apnea del sueño: obesidad o hipertensión, roncadores, somnolencia diurna o somnolencia durante la conducción de automotores (51).
Otros síntomas pueden estar presentes: sudoración nocturna, cefaleas, sueño intranquilo, insomnio de mantenimiento, lo que conduce a un despertar con la percepción de que el sueño no fue reparador, cansancio durante el día o consumo excesivo de cafeína, y dificultades en la concentración que pueden confundirse con depresión así como períodos de silencio durante el sueño seguidos de un ronquido intenso percibidos por quien duerme con el paciente.
Se ha descrito lo que se conoce como la circunferencia del cuello ajustada que predice la probabilidad de tener apnea obstructiva del sueño. Para lograr esta medida se suma a la circunferencia del cuello 4 puntos si el paciente tiene hipertensión, 3 puntos si es un roncador habitual y 3 puntos si tiene episodios de ahogo o jadeo en la noche. Una circunferencia del cuello ajustada igual o mayor de 43 cm predice una probabilidad intermedia y una mayor de 48 cm una probabilidad alta de apnea obstructiva del sueño (51).
Un índice de Mallampatti III o IV también aumenta el riesgo de apnea del sueño (para definir este índice de la vía aérea el paciente sentado debe abrir la boca y sacar la lengua sin decir “a”. I es cuando se puede ver el paladar blando, istmo de las fauces, úvula y pilares; II el paladar blando, istmo de las fauces, úvula y pilares; III paladar blando y base de la úvula; IV solo el paladar duro). El estudio que confirma el trastorno así como su severidad es la polisomnografía.
Hiperaldosteronismo primario
La prevalencia del hiperaldosteronismo primario en la HTA refractaria es de 10%. El mayor índice de sospecha es cuando la HTA se acompaña de hipopotasemia. Sin embargo, esta asociación solo estuvo presente aproximadamente en 50% de los pacientes (52). Por lo anterior resulta difícil diferenciarlo con la HTA esencial.
Las guías prácticas clínicas de la Sociedad de Endocrinología para la detección, el diagnóstico y tratamiento del hiperaldosteronismo primario recomiendan sospechar la enfermedad cuando (53):
En este grupo de pacientes se recomienda medir:
Las alteraciones del hiperaldosteronismo primario consisten en una concentración de renina plasmática indetectable, niveles séricos de aldosterona mayores de 15 ng/dL y relación concentración de aldosterona plasmática/concentración de renina plasmática igual o mayor de 20.
En principio las únicas drogas que deben ser suprimidas antes de estas pruebas son la espironolactona, la eplerenona y los inhibidores de la renina.
Dado que no todos los pacientes con relación aldosterona/renina plasmática elevada tienen hiperaldosteronismo primario se recomienda para la confirmación diagnóstica la realización de una prueba que demuestre una secreción anómala frente a la carga de sodio.
Los tests recomendados son:
Solamente cuando los estudios hormonológicos son diagnósticos de hiperaldosteronismo primario deberán realizarse estudios imagenológicos. El estudio de elección es la tomografía axial computarizada.
Enfermedad renal crónica
A medida que cae el filtrado glomerular la prevalencia de HTA aumenta, estando presente en 80% a 85% de los pacientes con enfermedad renal crónica (54).
Se trata de la causa de HTA secundaria más frecuente (10). Las afecciones responsables de la enfermedad renal crónica más comunes son la nefropatía diabética y la nefroangioesclerosis hipertensiva. Las manifestaciones principales incluyen el desarrollo de edema y nocturia, alteraciones en el sedimento urinario (proteinuria, cilindruria, celularidad aumentada) y elevación de la creatinina sérica.
Estenosis de la arteria renal
Su prevalencia es de 1% para las formas leves a moderadas de HTA; la misma aumenta en la HTA resistente (55). La causa más frecuente es la lesión aterosclerótica de las arterias renales y en los jóvenes, y particularmente en las mujeres, la displasia fibromuscular (56). La sospecha de HTA renovascular incluye claves para el diagnóstico de HTA secundaria a las que se suman claves más específicas para considerar HTA renovascular.
Las claves para HTA secundaria incluyen (10,15,18):
Las claves para HTA de origen renovascular son las siguientes (57,58):
Los estudios por imagen deben ser realizados si los hallazgos clínicos sugieren HTA secundaria, parece poco probable que el paciente tenga otra causa de HTA secundaria tales como enfermedad renal crónica, hiperaldosteronismo o feocromocitoma y si se planea una intervención en caso de que el paciente tenga una obstrucción significativa de la arteria renal.
Los estudios por imágenes son requeridos para establecer el diagnóstico.
Los métodos disponibles son la ecografía Doppler, la angiorresonancia y la angiotomografía de las arterias renales. Definir si el paciente tiene insuficiencia renal es clave para optar por la técnica más adecuada. Si hay insuficiencia renal el procedimiento de elección es el Doppler de las arterias renales. Si bien el contraste requerido para la angiotomografía de las arterias renales puede agravar la insuficiencia renal, se lo prefiere a la angiorresonancia puesto que el gadolinio es capaz de generar fibrosis sistémica nefrogénica.
Dentro de las causas de HTA secundaria poco frecuentes se encuentran el feocromocitoma, el hiperparatiroidismo, el hipertiroidismo, el hipotiroidismo y el síndrome de Cushing. Algunos datos claves se aportan en el algoritmo final de esta publicación.
13. Tratamiento de la HTA refractaria
Cuando se ha descartado seudohipertensión, se ha usado combinación de fármacos de distinta clase a la dosis máxima tolerada, el uso de diuréticos se ajustó a la función renal, el paciente adhiere al tratamiento higiénico, dietético y farmacológico y no consume sustancias que interfieren en el control de la PA, no hay inercia médica y se descartaron las causas de HTA secundaria, son posibles algunas estrategias para el tratamiento.
Estas estrategias de tratamiento pueden incluir medidas farmacológicas y no farmacológicas
Medidas farmacológicas
Existen pocos datos que evalúen la eficacia de los fármacos específicos a combinar en un régimen terapéutico de tres o más fármacos (15), y, en consecuencia, las recomendaciones pasan a ser empíricas o anecdóticas.
Espironolactona - eplerenona
Con números de pacientes distintos (76 y 1.411), dos estudios demostraron en pacientes con HTA resistente que la adición de espironolactona a dosis de 12,5-25 mg/día logró un descenso promedio de 25/12 mmHg y 21,9/9,5 mmHg, respectivamente. La respuesta no fue predicha por la concentración plasmática de aldosterona, aldosterona en orina de 24 horas, actividad de renina plasmática, sexo, edad, tabaquismo ni diabetes (59,60).
Un estudio reciente fue diseñado para determinar la eficacia de la adición de espironolactona 25 mg/día en el control de la PA en pacientes con HTA no controlada con tres fármacos que incluían un diurético. El estudio fue randomizado y doble ciego, controlado contra placebo, e incluyó a 117 pacientes. Al cabo de ocho semanas el grupo que recibió espironolactona mostró una caída de la PAS media diurna de 5,4 mmHg y nocturna de 8,6 mmHg. No se observó diferencias en la PA diastólica (61).
De acuerdo al algoritmo de la AHA del 2008 para el tratamiento de la HTA resistente, la adición de espironolactona o eplerenona a un régimen con tres fármacos de distinta clase, que incluye un diurético, se muestra como una opción razonable y debe ser considerada como la cuarta droga a emplear en los pacientes con HTA refractaria, particularmente si son obesos o con apnea obstructiva del sueño.
Se recomienda iniciar el tratamiento con 12,5 mg día de espironolactona. No parecería útil aumentar la dosis más allá de 50 mg/día. La ginecomastia, el dolor mamario y la disfunción eréctil son efectos colaterales potenciales.
La eplerenona, un bloqueante altamente selectivo de los receptores para mineralocorticoides, tiene menos efectos colaterales que la espironolactona. La razón es que comparado con espironolactona, eplerenona tiene una afinidad para los receptores de andrógenos y progesterona 1.000 y 100 veces menor, respectivamente, que la espironolactona. Se debe administrar cada 12 horas, comenzando con una dosis de 25 mg hasta 100 mg por día.
Un estudio de 52 pacientes obesos, con edad media de 62 años e HTA resistente, tratados previamente en promedio con 3,7 fármacos, evaluó el efecto de eplerenona a dosis de 50 a 100 mg por día sobre la PA. A las 12 semanas de administrada la droga, el descenso de la PA de consultorio fue de 17,6 mmHg para la PAS y de 7,9 mmHg para la PAD, y en el MAPA 12,2 y 6,0 mmHg para la PAS y PAD, respectivamente (62).
En los pacientes que comienzan el tratamiento con espirolactona o eplerenona debe monitorizarse el potasio sérico dado el riesgo de hiperpotasemia, particularmente si se encuentran tratados con EICA, ARA II y/o AINE.
Betabloqueantes con acción vasodilatadora: carvedilol, nebivolol, labetalol
En el tratamiento escalonado los betabloqueantes son una opción. Si decide usar un betabloqueante es preferible emplear aquellos con acción vasodilatadora: carvedilol, nebivolol o labetalol ya que pueden tener un mayor efecto hipotensor que los betabloqueantes tradicionales con menos efectos colaterales sobre todo cuando se utilizan a dosis altas (63).
En el algoritmo para el tratamiento de la HTA refractaria o resistente de la AHA del año 2008 (15) se sugiere la adición de un betabloqueante con acción vasodilatadora como cuarto fármaco, particularmente si el paciente no es obeso. En el tratamiento escalonado pueden ser adicionados si con los antagonistas de la aldosterona no se ha logrado el objetivo terapéutico.
Bloqueantes de los canales de calcio de acción prolongada
Un régimen propuesto es la indicación de diltiazem de acción prolongada o nifedipina GITS a un régimen de tres fármacos que incluye bloqueadores de los receptores de angiotensina II, diuréticos y bloqueadores de los canales del calcio. Esta combinación logra descenso de la PA con escasos efectos colaterales (64).
Mononitrato de isosorbide y sildenafil
En seis pacientes con HTA refractaria que mantuvieron su tratamiento, la adición de mononitrato de isosorbide 10 mg por vía oral más sildenafil 50 mg/día se obtuvo un descenso de la PA intraarterial de 26/18 mmHg comparado contra placebo. Estudios con mayor número de pacientes serán necesarios (65).
Viejos fármacos
Son aquellos con demostrado efecto hipotensor que pueden ser agregados al tratamiento tales como clonidina, alfa metildopa, minoxidil e hidralazina. Sin embargo, sus efectos colaterales limitan su indicación en la práctica clínica (15).
Recomendación final
A modo de resumen, en pacientes con HTA refractaria tratados con un diurético (hidroclotiazida) más un IECA o ARA II más un bloqueante de los canales de calcio de acción prolongada (amlodipina) que persisten con PA no controlada, parece prudente cumplir con las siguientes recomendaciones:
Tratamiento no farmacológico
Estimulación de los barorreceptores carotídeos (66)
La activación de los barorreceptores del seno carotídeo reduce la activación del simpático desde el sistema nervioso central y reduce la PA.
El procedimiento consiste en el implante mediante abordaje quirúrgico con el objetivo de exponer ambos senos carotídeos e implantar un estimulador (Rheos) sobre la adventicia carotídea. Los cables transcurren por vía subcutánea para conectarse con un generador de estímulos, el cual es colocado en el tejido subcutáneo en la cara anterior del tórax.
El Rheos Pivotal Trial evaluó el efecto de la estimulación carotídea sobre la PA en pacientes con HTA refractaria. Fue un estudio doble ciego, randomizado, prospectivo y multicéntrico, controlado contra placebo, que incluyó a 256 pacientes. Al mes del implante los pacientes fueron asignados a un grupo con estimulación del seno carotídeo inmediata o estimulación luego de los primeros seis meses. El seguimiento fue de 12 meses. El trabajo mostró que a los seis meses no hubo diferencia significativa en el descenso de la PA. En los que recibieron estimulación el porcentaje de pacientes que lograron tener PAS igual o menor de 140 mmHg fue mayor (42% versus 24%) que en los pacientes que no habían recibido estimulación. A los 12 meses en los pacientes que habían recibido estimulación el descenso medio de la PAS fue de 25 mmHg. Dentro del primer mes, 35% de los pacientes tuvo efectos colaterales adversos serios.
Son necesarios más estudios para definir la utilidad de esta nueva modalidad terapéutica.
Denervación renal simpática por radiofrecuencia (67,68)
La denervación simpática quirúrgica para el control de la PA data de 1953. Las complicaciones posoperatorias hicieron que dicha aproximación fuera abandonada. La inervación simpática es crucial para el inicio y el mantenimiento de la HTA y el eflujo simpático está aumentado en la HTA esencial. Las aferencias y las eferencias del simpático abordan al riñón a través de las arteriales renales, en el interior de la adventicia o inmediatamente por fuera y pueden ser alcanzados por la energía liberada por radiofrecuencia desde la luz arterial.
Por otra parte, estudios en animales demostraron que la energía liberada por radiofrecuencia lesionaba selectivamente las estructuras nerviosas con mínimo daño sobre las otras estructuras debido a ser los nervios más sensibles al calor.
De acuerdo a los principios anteriores se desarrolló la técnica de la ablación del simpático renal por radiofrecuencia por vía endoluminal.
El procedimiento se lleva a cabo a través de la introducción de un catéter por vía percutánea femoral que se conecta a un generador de radiofrecuencia. Se evitan de esta forma resecciones del simpático más amplias como las generadas por la cirugía con la consiguiente reducción de graves efectos adversos.
The Simplicity HTN 2 trial fue un estudio multicéntrico que reclutó 50 pacientes con HTA resistente definida para este estudio como cifras mayores de 160/90 mmHg que no se controlan con tres o más fármacos.
Los pacientes (106) fueron randomizados y asignados al tratamiento de denervación simpática renal por radiofrecuencia o al mantenimiento de las drogas que venían recibiendo. Al cabo de seis meses los pacientes randomizados al tratamiento de denervación descendieron su PA de 178/97 mmHg a 143/85 mmHg mientras que los que fueron randomizados a continuar con la medicación que recibían no tuvieron descenso de la PA. No hubo diferencias en la función renal en ambos grupos. Un paciente desarrolló un seudoaneurima de la femoral.
Los datos sobre el mantenimiento del descenso de la PA son limitados y no se extienden a más de dos años. Sobre 153 pacientes tratados por radiofrecuencia, en 64 pacientes la PA había descendido en promedio 23 mmHg para la PAS y 11mmHg para la PAD a los 12 meses de seguimiento. En 18 pacientes a 24 meses de seguimiento se observó un descenso de la PAS de 32 de 14 mmHg y de la PAD de 14 mmHg. En este tiempo de seguimiento, 97% no tuvo complicaciones. Las complicaciones reportadas fueron tres seudoaneurismas de la femoral y una disección de la arteria renal que se resolvieron sin secuelas. El número promedio de medicación antihipertensiva durante el seguimiento fue el mismo que al inicio del estudio (69).
Se ha publicado recientemente un trabajo cuyos resultados concluyen que este procedimiento es costo-efectivo y podría abatir mortalidad y eventos vasculares proyectados a diez años en pacientes con HTA refractaria cuando se lo compara con el tratamiento farmacológico (70).
Bibliografía
1. Hyman D, Pavlik V. Characteristics of patients with uncontrolled hypertension in the United States. N Engl J Med 2001;345:479–86.
2. The ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group. Major outcomes in high-risk hypertensive patients randomized to Angiotensin-convertingenzyme inhibitor or calcium channel blocker vs diuretic: the Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT). JAMA 2002;288:2981–97.
3. Cushman WC, Ford CE, Cutler JA, Margolis KR, Davis BR, Grimm RH, et al. Success and predictors of blood pressure control in diverse North American settings: the Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT). J Clin Hypertens (Greenwich) 2002;4:393–404.
4. Black HR, Elliott WJ, Grandits G, Grambsch P, Lucente T, White WB, et al. Principal results of the Controlled Onset Verapamil Investigation of Cardiovascular End Points (CONVINCE) trial. JAMA 2003;289:2073–82.
5. Julius S, Kjeldsen SE, Brunner H, Hansson L, Platt F, Ekman S, et al. VALUE trial: Long-term blood pressure trends in 12,449 patients with hypertension and high cardiovascular risk. Am J Hypertens 2003;16:544–8.
6. de la Sierra A, Segura J, Banegas JR, Gorostidi M, de la Cruz JJ, Armario P, et al. Clinical features of 8295 patients with resistant hypertension classified on the basis of ambulatory blood pressure monitoring. Hypertension 2011;57:898-902.
7. Cuspidi C, Macca G, Sampieri L, Michev I, Salerno M, Fusi V, et al. High prevalence of cardiac and extracardiacorgan damage in refractory hypertension. J Hypertens 2001;19:2063-70.
8. Fields LE, Burt VL, Cutler JA, Hughes J, Roccella Lewington S, Clarke R, et al. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet 2002;360:1903–13.
9. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL, et al. Seventh report of the Joint National Committee on prevention, detection, evaluation, and treatment of high blood pressure. Hypertension 2003;42:1206 –52.
10. Moser M, Setaro JF. Clinical practice. Resistant or difficult-to-control hypertension. N Engl J Med 2006;355:385–92.
11. Calhoun DA, Jones D, Textor S, Goff DC, Murphy TP, Toto RD, et al. Resistant hypertension: diagnosis, evaluation, and treatment. A scientific statement from the American Heart Association Professional Education Committee of the Council for High Blood Pressure Research. Circulation 2008;117: e510–26.
12. Lloyd-Jones DM, Evans JC, Larson MG, O’Donnell CJ, Rocella EJ, Levy D. Differential control of systolic and diastolic blood pressure: factors associated with lack of blood pressure control in the community. Hypertension 2000;36:594 –599.
13. Cushman WC, Ford CE, Cutler JA, Margolis KL, Davis BR, GrimmRH, et al. Success and predictors of blood pressure control in diverse NorthAmerican settings: theAntihypertensive and Lipid-Lowering andTreatment to Prevent Heart Attack Trial (ALLHAT). J Clin Hypertens 2002; 4:393– 404.
14. Lloyd-Jones DM, Evans JC, Larson MG, Levy D. Treatment and controlof hypertension in the community: a prospective analysis. Hypertension 2002;40:640–6.
15. Calhoun DA, Jones D, Textor S, Goff DC, Murphy TP, Toto RD, et al. Resistant hypertension: diagnosis, evaluation, and treatment. A scientific statement from the American Heart Association Professional Education Committee on the council for high blood pressure research. Hypertension 2008;51:1403-19.
16. Muxfeldt ES, Bloch KV, Nogueira Ada R, Salles GF. True resistant hypertension: is it possible to be recognized in the office? Am J Hypertens 2005;18(12 Pt 1):1534-40.
17. de la Sierra A, Banegas JR, Oliveras A, Gorostidi M, Segura J, de la Cruz JJ, et al. Clinical differences between resistant hypertensives and patients treated and controlled with three or less drugs. J Hypertens 2012;30:1211-6.
18. Mancia G, Laurent S, Agabiti-Rosei E , Ambrosioni E, Burnier M, Caulfield MJ, et al. Revisión de la guía Europea de manejo de hipertensión. J Hypertens 2009; 27:2121–58.
19. Veglio F, Rabbia F, Riva P, et al. Ambulatory blood pressure monitoring and clinical characteristics of the true and white-coat resistant hypertension. Clin Exp Hypertens 2001;23:203-11.
20. Brown MA, Buddle ML, Martin A. Is resistant hypertension really sistant? Am J Hypertens 2001;14:1263–9.
21. Thibonnier M. Ambulatory blood pressure monitoring: when is it warranted? Postgrad Med 1992; 91:263–74.
22. Pierdomenico SD, Lapenna D, Bucci A, Di Tommáso R, Di Máscio R, Manente BM, et al. A Cardiovascular outcome in treated hypertensive patients with responder, másked, false resistant, and true resistant hypertension. Am J Hypertens 2005;18:1422-8.
23. Messerli FH, Ventura HO, Amadeo C. Osler’s maneuver and Pseudo hyoertension. N Engl J Med 1985;312:1548-51.
24. Haynes RB, McDonald HP, Garg AX. Helping patients follow prescribed treatment: clinical applications. JAMA 200; 288:2880–3.
25. Conlin PR, Gerth WC, Fox J, Roehm JB, Boccuzzi SJ. Four-year persistence patterns among patients initiating therapy with the angiotensin II receptor antagonist losartan versus other antihypertensive drug classes. ClinTher 2001; 23:1999–2010.
26. Hamilton GA. Measuring adherence in a hypertension clinical trial. Eur J Cardiovasc Nurs 2003, 2:219–28.
27. Sackett DL, Haynes RB, Gibson ES, Hackett BC, Taylor DW, Roberts RS, et al. Randomised clinical trial of strategies for improving medication compliance in primary hypertension. Lancet 1975;1:1205–7.
28. Turpin R, Jungkind K, Salvucci L. The HEDIS performance NAVIGATOR for controlling high blood pressure: a resource to assist health plans and improve patient adherence. Dis Manag 2003, 6:43–51.
29. Burnier M, Santschi V, Favrat B, Brunner HR. Monitoring compliance in resistant hypertension: an important step in patient management. J Hypertens 2003;21(Suppl 2):S37–S42.
30. Morisky DE, Green W, Levine DM. Concurrent and predictive validity of a self-reported measure of medication adherence. Med Care 1986; 24:67–74.
31. Christensen DB, Williams B, Goldberg HI, Martin DP, Engelberg R, LoGerfo JP. Assessing compliance to antihypertensive medications using computer-based pharmacy records. Med Care 1997; 35:1164–70.
32. Hamilton GA. Measuring adherence in a hypertension clinical trial. Eur J Cardiovasc Nurs 200; 2:219–28.
33. Christensen DB, Williams B, Goldberg HI, Martin DP, Engelberg R, LoGerfo JP. Assessing compliance to antihypertensive medications using computer-based pharmacy records. Med Care 1997; 35:1164–70.
34. Hamilton GA. Measuring adherence in a hypertension clinical trial. Eur J Cardiovasc Nurs 2003; 2:219–28.
35. Krousel-Wood M, Thomas S, Muntner P, Morisky D. Medication adherence: a key factor in achieving blood pressure control and good clinical outcomes in hypertensive patients. Curr Opin Cardiol 2004; 19:357–62.
36. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL, et al. Seventh report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension 2003; 42:1206-52.
37. 2007 Guidelines for the Management of Arterial Hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens 2007; 25:1105-87. Fe de errata en: J Hypertens 2007;25(8):1749.
38. Obarzanek E, Proschan MA, Vollmer WM, Moore TJ, Sacks FM, Appel LJ, et al. Individual blood pressure responses to changes in salt intake: results from the DASH-Sodium trial. Hypertension 2003;42:459-67.
39. Chen J, Gu D, Huang J, Rao DC, Jaquish CE, Hixson JE, et al. Gen Salt Collaborative Research Group Metabolic syndrome and salt sensitivity of blood pressure in non-diabetic people in China: a dietary intervention study. Lancet 2009;373: 829-35.
40. Nishizaka MK, Pratt-Ubunama M, Zaman MA, Cofield S, Calhoun DA. Validity of plasma aldosterone-to-renin activity ratio in African American and white subjects with resistant hypertension. Am J Hypertens 2005;18:805–12.
41. Cappuccio FP, Capewell S, Lincoln P, McPherson K. Policy options to reduce population salt intake. BMJ 2011; 343:d4995. .
42. Bibbins-Domingo K, Chertow GM, Coxson PG, Moran A, Lightwood JM, Pletcher MJ, et al. Projected effect of dietary salt reductions on future cardiovascular disease. N Engl J Med 2010; 362:590-9.
43. Pimenta E, Gaddam KK, Oparil S, Aban I, Husain S, Dell’Italia LJ, et al. Effects of dietary sodium reduction on blood pressure in subjects with resistant hypertension: results from a randomized trial. Hypertension 2009;54:475-81.
44. Singer GM, Izhar M, Black HR. Goal-oriented hypertension management: ranslating clinical trials to practice. Hypertension 2002;40: 464–9.
45. Berlowitz DR, Ash AS, Hickey EC, Friedman RH, Glickman M, Kader B, et al. Inadequate management of blood pressure in a hypertensive population. N Engl J Med 1998;339:1957-63.
46. Setaro JF, Black HR. Refractory hypertension. N Engl J Med 1992; 327:543.
47. Young T, Palta M, Dempsey J, Skatrud J, Weber S, Badr S. The occurrence of sleep disordered breathing among middle-aged adults. N Engl J Med 1993;328:1230-5.
48. Logan AG, Perlikowski SM, Mente A, Tisler A, Tkacova R, Niroumand M, et al. High prevalence of unrecognized sleep apnoea in drug-resistant hypertension. J Hypertens 2001;19:2271-7.
49. Gonçalves SC, Martinez D, Gus M, de Abreu-Silva EO, Bertoluci C, Dutra I, et al. Obstructive sleep apnea and resistant hypertension: a case-control study.Chest 2007;132:1858-62.
50. Pratt-Ubunama MN, Nishizaka MK, Boedefeld RL, Cofield SS, Harding SM, Calhoun DA. Plasma aldosterone is related to severity of obstructive sleep apnea in subjects with resistant hypertension. Chest 2007;131:453.
51. Flemons WW. Clinical practice. Obstructive sleep apnea. N Engl J Med 2002; 347:498-504.
52. Douma S, Petidis K, Doumás M, Papaefthimiou P, Triantafyllou A, Kartali N, et al. Prevalence of primary hyperaldosteronism in resistant hypertension: a retrospective observational study. Lancet 2008;371:1921-6.
53. Funder JW, Carey RM, Fardella C, Gómez-Sánchez CE, Mantero F, Stowasser M, et al. Case detection, diagnosis, and treatment of patients with primary aldosteronism: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2008; 93:3266-81.
54. Whaley-Connell AT, Sowers JR, Stevens LA, McFarlane SI, Shlipak MG, Norris KC, et al. CKD in the United States: Kidney Early Evaluation Program (KEEP) and National Health and Nutrition Examination Survey (NHANES) 1999-2004. Am J Kidney Dis 2008; 51:S13-20.
55. Dworkin LD, Cooper CJ. Clinical practice. Renal-artery stenosis. N Engl J Med 2009; 361:1972-8.
56. Textor SC, Lerman L. Renovascular hypertension and ischemic nephropathy. Am J Hypertens 2010; 23:1159-8.
57. ACC/AHA 2005 Practice Guidelines for the management of patients with peripheral arterial disease (lower extremity, renal, mesenteric, and abdominal aortic): a collaborative report from the American Association for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Peripheral Arterial Disease): endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation; National Heart, Lung, and Blood Institute; Society for Vascular Nursing; TransAtlantic Inter-Society Consensus; and Vascular Disease Foundation. Circulation 2006; 113:e463-e654.
58. Dworkin LD, Cooper CJ. Clinical practice. Renal-artery stenosis. N Engl J Med 2009; 361:1972-8.
59. Nishizaka MK, Zaman MA, Calhoun DA. Efficacy of low-dosespironolactone in subjects with resistant hypertension. Am J Hypertens 2003;16: 925- 30.
60. Chapman N, Dobson J, Wilson S, Dahlöf B , Sever PS, Wedel H, et al. Effect of spironolactone onblood pressure in subjects with resistant hypertension. Hypertension 2007;49:839–45.
61. Václavík J, Sedlák R, Plachy M, Navrátil K, Plásek J, Jarkovsky J, et al. Addition of spironolactone in patients with resistant arterial hypertension (ASPIRANT): a randomized, double-blind, placebo-controlled trial. Hypertension 2011;57: 1069-75.
62. Calhoun DA, White WB. Effectiveness of the selective aldosterone blocker, eplerenone, in patients with resistant hypertension. J Am Soc Hypertens 2008;2:462-8.
63. Townsend RR, DiPette DJ, Goodman R, Blumfield D, Cronin R, Gradman A, et al. Combined alpha/beta-blockade versus beta 1-selective blockade in essential hypertension in black and white patients. Clin Pharmacol Ther 1990;48:665-75.
64. Gashti CN, Bakris GL. The role of calcium antagonists in chronickidney disease. Curr Opin Nephrol Hypertens 2004;13:155–61.
65. Oliver JJ, Hughes VE, Dear JW, Webb DJ. Clinical potential of combined organic nitrate and Pphosphodiesterase type 5 inhibitor in treatment-resistant hypertension. Hypertension 2010; 56:62-67.
66. Bisognano JD, Bakris G, Nadim MK, Sanchez L, Kroon AA, Schafer J, et al. Baroreflex activation therapy lowers blood pressure in patients with resistant hypertension: results from the double-blind, randomized, placebo-controlled rheos pivotal trial. J Am Coll Cardiol 2011;58:765-73.
67. Symplicity HTN-2 Investigators; Esler MD, Krum H, Sobotka PA, Schlaich MP, Schmieder RE, Böhm M. Renal sympathetic denervation in patients with treatment-resistant hypertension (The Symplicity HTN-2 Trial): a randomised controlled trial. Symplicity HTN-2 Investigators. Lancet 2010;376:1903-9.
68. Krum H, Schlaich M, Whitbourn R, Sobotka PA, Sadowski J, Bartus K, et al. Catheter-based renal sympathetic denervation for resistant hypertension: a multicentre safety and proof-of-principle cohort study.Lancet 2009;373:1275-81.
69. Symplicity HTN-1 Investigators. Catheter-based renal sympathetic denervation for resistant hypertension: durability of blood pressure reduction out to 24 months. Hypertension 2011;57:911-7.
70. Geisler BP, Egan BM, Cohen JT, Garner AM, Akehurst RL, Esler MD, et al. Cost-effectiveness and clinical effectiveness of catheter-based renal denervation for resistant hypertension. J Am Coll Cardiol 2012;60:1271-7.














