Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.27 no.3 Montevideo Dec. 2012
Artículo de revisión
Enfermedad hipertensiva del corazón
Dr. Horacio Vázquez Nosiglia 1
1. Médico cardiólogo Jefe del Servicio de Cardiología de la Asociación Española 1° de Socorros Mutuos
El incremento prolongado e incontrolado de la presión arterial genera un conjunto de alteraciones en el corazón y la circulación sistémica, que se abarcan bajo la definición de enfermedad hipertensiva del corazón o cardiopatía hipertensiva. Esas alteraciones incluyen trastornos estructurales del miocardio, de la geometría del ventrículo izquierdo, alteraciones de la estructura y función de los vasos coronarios y diferentes trastornos del ritmo y la conducción eléctrica. Sin embargo los límites de la cardiopatía hipertensiva son difíciles de establecer, pues en la génesis de estos trastornos interactúan otros factores no atribuibles al solo incremento de la presión arterial. Ello dificulta el análisis de esta entidad e incluso un buen conocimiento de su historia natural, pues en el terreno clínico se superpone con la enfermedad coronaria, la fibrilación auricular y las afecciones valvulares. El presente trabajo solo aborda los aspectos más específicos que relacionan la HTA con la enfermedad cardíaca.
Palabras clave:
HIPERTENSIÓN
FACTORES DE RIESGO
I. Hipertensión arterial y enfermedad cardíaca
La relación entre la hipertensión arterial (HTA) y la enfermedad cardíaca está bien establecida en términos epidemiológicos. La HTA es el factor etiológico más común entre los pacientes que se presentan con insuficiencia cardíaca, pues está presente en más de 50% de los casos en la población adulta y hasta en 68% cuando se considera una población de edad avanzada. La HTA duplica la posibilidad de desarrollar insuficiencia cardíaca en hombres y la triplica en mujeres. El riesgo de insuficiencia cardíaca se incrementa en forma continua con el aumento de las cifras tensionales y es evidente en todos los grupos etarios entre los 40 y los 70 años (1-3).
Dada la alta prevalencia de la HTA en nuestra población y de la enfermedad coronaria entre las enfermedades cardíacas, ambas coinciden con una gran frecuencia. La HTA es un fuerte factor de riesgo para enfermedad coronaria y su presencia multiplica por dos la posibilidad de padecerla, mientras que la posibilidad de tener un infarto de miocardio se multiplica por 6 en las personas hipertensas (2). Al mismo tiempo la presencia de HTA entre los pacientes con enfermedad coronaria es abrumadora. En una serie reportada recientemente en nuestro medio, 80% de los pacientes hospitalizados por enfermedad coronaria padecían HTA (4). Los infartos de miocardio no reconocidos clínicamente son más comunes entre personas hipertensas, comprendiendo hasta 35% de los mismos en hombres y 50% en mujeres (5). Por otro lado es bien conocida la existencia de enfermedad isquémica sintomática sin lesiones coronarias obstructivas en pacientes hipertensos, atribuibles a trastornos de la microcirculación y a la presencia de hipertrofia ventricular izquierda.
La HTA es un factor de riesgo potente para el desarrollo de fibrilación auricular, en particular si se asocia a hipertrofia ventricular izquierda. Asimismo, en ese contexto están incrementadas la incidencia de arritmias ventriculares y de muerte súbita (6).
II. Hipertensión arterial e hipertrofia ventricular izquierda
Un potente factor de riesgo vascular
El criterio esencial para la definición de la enfermedad cardíaca hipertensiva es la hipertrofia ventricular izquierda (HVI) en presencia de hipertensión arterial y en ausencia de otra causa que la explique. Sin embargo, la HVI está lejos de ser exclusivamente de causa hipertensiva y se encuentra presente en numerosas cardiopatías, en especial en la enfermedad valvular aórtica, y es el hecho central en la miocardiopatía hipertrófica.
En términos fisiopatológicos la HVI ha sido vista como un fenómeno compensatorio a la sobrecarga de presión del ventrículo izquierdo que, de acuerdo a la ley de Laplace, permitiría disminuir el stress parietal del mismo a través del incremento del grosor de la pared. Sin embargo, más que un mecanismo de compensación o alivio, la HVI es un mecanismo de enfermedad y tiene un riesgo implícito muy significativo. Hace más de 40 años el Framingham Heart Study demostró que el diagnóstico de HVI en el electrocardiograma implica un incremento de riesgo de 6 a 8 veces en la incidencia de infarto de miocardio, insuficiencia cardíaca o muerte súbita y el riesgo de morir se multiplica por tres (2,7). Pese a su valor pronóstico, el ECG es un método poco sensible para el diagnóstico de HVI y por ello detecta preferentemente los casos más severos. Sólo el 5 a 10% de los hipertensos no tratados tiene un ECG característico de HVI, aún con los criterios diagnósticos más precisos, como los de Lyon-Sokolow o Cornell.
En los últimos 25 años la ecocardiografía se ha convertido en la técnica usual para el diagnóstico de hipertrofia pues es altamente sensible, ofrece una aproximación cuantitativa, brinda datos sobre la geometría del ventrículo izquierdo y su evolución con el tratamiento de la enfermedad, por lo que tiene un alto valor pronóstico (8).
Masa ventricular izquierda
En términos cuantitativos la HVI debe expresarse en masa miocárdica del ventrículo izquierdo, en cuyo cálculo no sólo interviene el grosor de la pared sino también el volumen de la cavidad. La masa miocárdica puede calcularse por ecocardiografía modo M, bidimensional o 3 D, así como por resonancia nuclear magnética o tomografía computada.
El método que fue mas utilizado en los primeros trabajos fue la ecocardiografía modo M que, a esos efectos, ha sido complementada o sustituida en la práctica diaria por la ecocardiografía bidimensional. La fórmula habitual para calcular la masa ventricular izquierda en los trabajos de investigación sobre hipertensión es sencilla de aplicar. Sólo utiliza tres dimensiones lineales, que son: la dimensión diastólica de la cavidad del ventrículo izquierdo (DdVI), grosor septal en diástole (Sep d) y grosor de la pared posterior en diástole (PP d).
Masa VI (gramos) = 0,8 (1,04[(DdVI + Sep d +
PP d)3 - DdVI3] + 0,6
Esta fórmula asume que el grosor miocárdico es uniforme, de modo que sólo funciona bien cuando el ventrículo no tiene alteraciones groseras de su geometría, como ocurre en la mayoría de los pacientes hipertensos no complicados. Hay evidencia de que la masa miocárdica calculada por esta fórmula correlaciona razonablemente con los hallazgos necrópsicos (r = 0,90, p < 0,001), pese a que tiene importantes limitaciones pues al elevar al cubo las medidas obtenidas, los pequeños errores se magnifican (9-12).
Cuando la geometría del VI está distorsionada, otras fórmulas pueden evaluar mejor la masa miocárdica por ecocardiografía, pero son mas complejas, necesitan imágenes de alta calidad y obligan a obtener medidas más trabajosas que consumen tiempo. Por este motivo son poco utilizadas en la práctica clínica (13).
La masa cardíaca calculada debe personalizarse según las dimensiones corporales, para lo que se utiliza el índice de masa del ventrículo izquierdo (IMVI), según el cociente: masa VI/área de superficie corporal. Los valores considerados normales en las guías actuales son los menores a 115 g/m2 de superficie corporal para hombres y de 95 g/m2 de superficie corporal para mujeres (11,12).
El incremento del IMVI tiene un claro valor pronóstico según reportan diversos trabajos. En un estudio sobre 280 pacientes hipertensos, sin cardiopatía preexistente, seguidos durante 10 años, los que tenían un IMVI superior a 125 g/m2 en su eco inicial, tuvieron más del doble de eventos cardiovasculares (26% versus 12%, p=0,006) y una mortalidad cardiovascular y global abrumadoramente mayor (14% versus 1%, P < 0,001; 16% versus 2%, p = 0,001 respectivamente) (14). En el estudio Framingham, por cada 50 g/m2 de incremento en el IMVI, el riesgo de enfermedad cardiovascular a 4 años se multiplica por 1,57 en mujeres y 1,49 en varones, mientras que la mortalidad cardiovascular se multiplica por 2,12 en mujeres y 1,73 en varones (8).
Asimismo está claramente establecido que, entre sujetos con HTA esencial sin complicaciones previas, existe una relación lineal y continua entre IMVI y pronóstico cardiovascular en una amplia gama de valores. Esta relación directa se mantiene incluso por debajo de los valores considerados normales, y es independiente de otros factores de riesgo y también de la severidad de la HTA según el MAPA (15).
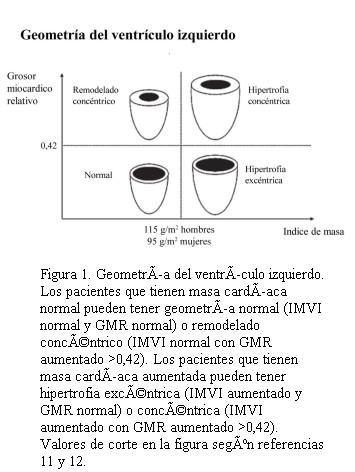
Geometría del ventrículo izquierdo
La morfología del ventrículo izquierdo ha sido clasificada de acuerdo a la relación que guarda el IMVI con las dimensiones de la cavidad pues, como fue descrito hace 50 años por Linzbach, hay pacientes en los que predomina el grosor de la pared (hipertrofia concéntrica) y otros en los que predomina la dilatación (hipertrofia excéntrica) (16).
El índice de grosor miocárdico relativo (GMR) permite evaluar la relación entre grosor parietal y diámetro cavitario. El mismo puede ser calculado según la fórmula: 2 PPd/DdVI, y los valores inferiores a 0,42 son considerados normales. Combinando el IMVI con el GMR se obtienen cuatro grupos de personas hipertensas de acuerdo a la geometría de su ventrículo izquierdo. Cuando ambos índices son normales no hay afección morfológica del VI, mientras que cuando el IMVI es normal pero el GMR está aumentado se habla de remodelación concéntrica, una afección incipiente donde no hay verdadera hipertrofia pues no hay incremento de masa, pero sí encontramos un ligero incremento del grosor parietal. Cuando el IMVI y el GMR están aumentados hablamos de hipertrofia concéntrica, mientras que si el IMVI está aumentado, pero el GMR es normal hablamos de hipertrofia excéntrica (figura 1) (10-12).
Entre 30% y 50% de los hipertensos tienen una geometría del VI anormal. Los patrones predominantes son el remodelado concéntrico y la hipertrofia excéntrica. El primero es más común cuando la población estudiada tiene cifras tensionales leve a moderadamente aumentadas y poca prevalencia de hipertrofia en el ECG, mientras que la hipertrofia excéntrica es predominante en poblaciones con cifras promedio mas altas y mayor prevalencia de hipertrofia en el ECG. La hipertrofia concéntrica es, en general, menos frecuente pero tiene el peor pronóstico cardiovascular (14).
En un estudio de 271 hipertensos no tratados, 35% tenía geometría anormal, que se distribuía como remodelado hipertrófico en 20%, hipertrofia excéntrica en el 9% e hipertrofia concéntrica en 6% (17). A diferencia de ello, en el estudio LIFE, en el cual todos los pacientes tenían signos de hipertrofia en el ECG, la alteración predominante fue la hipertrofia excéntrica en el 46% de los casos, seguido de la hipertrofia concéntrica en el 24% (18).
Es posible estratificar el riesgo de los pacientes hipertensos según el patrón de alteración geométrica del ventrículo izquierdo. En el ya citado estudio de Koren, con un seguimiento a 10 años, la hipertrofia concéntrica tuvo el peor significado pronóstico con 31% de eventos CV y 24% de mortalidad global, seguido de la hipertrofia excéntrica con 23% de eventos CV y 10% de mortalidad global. Por su parte el remodelado concéntrico tuvo 15% de eventos CV y 6% de mortalidad global, mientras que los pacientes con un VI normal tuvieron 11% de eventos CV y 1% de mortalidad, todas diferencias con alta significación estadística (14).
Por su parte Verdecchia y colaboradores confirmaron que el remodelado concéntrico, a pesar de no tener incremento de masa miocárdica, tiene un significado pronóstico adverso (19). Estudiaron pacientes con IMVI normal y GMR superior a 0,45 y los compararon con los hipertensos con un VI normal. En los pacientes con remodelado concéntrico se encontró una tasa de eventos CV de 2,39% por año contra 1,12% en pacientes con VI normal, incremento de riesgo de 2,56 (p<0,001), que resultó independiente de otros factores. Todo lleva a pensar que el remodelado concéntrico es una respuesta inicial del VI a la sobrecarga de presión, un primer escalón de la cardiopatía hipertensiva (19).
Este esquema de clasificación de la geometría del ventrículo izquierdo en la HTA tiene limitaciones, que se han hecho más evidentes al disponer de técnicas de imágenes más avanzadas. Estos criterios provienen de una época en que era difícil calcular confiablemente el volumen del VI, por lo que utiliza dimensiones lineales que simplifican el trabajo pero también empobrecen los resultados. Llama la atención que en una afección que impone una sobrecarga de presión, la hipertrofia excéntrica sea más común que la concéntrica. Ocurre que, mientras la hipertrofia concéntrica comprende un grupo bien definido, la hipertrofia excéntrica incluye pacientes heterogéneos, pues se agrupan los que tienen incremento del grosor de la pared y dilatación, con los que sólo tienen dilatación y aún los que tienen una especie de “magnificación” del corazón normal (“hipertrofia indeterminada”). Utilizando resonancia nuclear magnética, que permite calcular confiablemente volumen y masa del VI, recientemente se han propuesto clasificaciones más complejas que parecen ajustarse mejor al problema, definir mejor el pronóstico e identificar los grupos con mayor riesgo de evolucionar a la disfunción sistólica (16,20,21).
Variabilidad de la respuesta hipertrófica
Si bien la relación entre HTA y desarrollo de hipertrofia ventricular izquierda es evidente, existe una gran variabilidad individual en la respuesta, que sólo en parte se relaciona a la severidad, duración y rapidez de inicio de la enfermedad. El monitoreo ambulatorio de PA tiene mejor correlación con el grado de hipertrofia que los registros de consultorio y los que tienen hipertrofia concéntrica tienen cifras significativamente peores en el monitoreo ambulatorio (MAPA) que aquellos que muestran hipertrofia excéntrica. Sin embargo incluso el MAPA está lejos de ofrecer una explicación completa del grado de hipertrofia (22).
Diversos factores pueden explicar la variabilidad en la respuesta hipertrófica al estímulo de la HTA. En primer lugar hay factores demográficos que juegan un papel, pues está claramente establecido que los pacientes de raza negra tienen una prevalencia de HVI dos a tres veces mayor que otros grupos étnicos, con un claro predominio de la geometría concéntrica. También el sexo femenino y la edad avanzada son predisponentes para desarrollar hipertrofia concéntrica (23-25).
La presencia de enfermedades cardíacas asociadas, como la enfermedad coronaria o las valvulopatías, obviamente condicionan la respuesta hipertrófica y la distorsión geométrica del VI en el paciente hipertenso. Lo que no es tan obvio es que condiciones médicas frecuentemente asociadas a la HTA, como la obesidad y la diabetes, también incrementan la masa cardíaca, y han sido vinculadas tanto a geometría concéntrica como excéntrica. La activación del sistema renina-angiotensina-aldosterona también modula la respuesta hipertrófica, y los niveles elevados de renina están vinculados al incremento de la masa miocárdica.
A través de modelos multivariados que integran los factores de riesgo conocidos para condicionar HVI, solo se logra explicar entre 50% y 68% de la variabilidad en la respuesta hipertrófica. Ello sugiere que la respuesta individual está modulada por otros factores desconocidos, posiblemente de origen genético, pues está bien demostrada la susceptibilidad familiar para desarrollar hipertrofia (22).
Una mirada a la ultraestructura
Detrás de la hipertrofia miocárdica se desarrollan cambios estructurales complejos en la composición del miocardio, tanto en los elementos celulares como en la matriz extracelular.
Una acumulación exagerada de colágeno tipo I y tipo III, en el intersticio y rodeando las estructuras vasculares, es uno de los elementos fundamentales en los cambios estructurales del ventrículo izquierdo. En los pacientes con cardiopatía hipertensiva se ha demostrado un incremento significativo del volumen de colágeno, en comparación con normotensos. Este incremento está relacionado tanto a un aumento de la síntesis, por fibroblastos y miofibroblastos activados, como a una disminución de la degradación por las colagenasas (26).
Los estudios del grupo del Dr. Díez de la Universidad de Navarra, han mostrado que la calidad del colágeno está modificada, con alteraciones de su orientación espacial y su elasticidad. La consecuencia es la fibrosis, con afectación de las propiedades diastólicas y sistólicas. Existen distintos patrones de colágeno en pacientes con disfunción sistólica o diastólica, predominando en los primeros los depósitos perivasculares y de tipo cicatrizal, mientras que en los segundos predominan los depósitos misiales (entre las fibras musculares). Un aumento de la degradación del colágeno misial puede condicionar la dilatación y disfunción sistólica o, por el contrario, su incremento producir fibrosis intersticial densa y disfunción diastólica. Esto se puede medir a través del equilibrio de metaloproteinasas (MMP1 que degradan el colágeno) y de su inhibidor (TIMP1), en especímenes de biopsia miocárdica. Un incremento del cociente MMP1/TIMP1 puede también ser detectado en sangre venosa y se correlaciona con dilatación del ventrículo izquierdo y deterioro de la función ventricular (27,28).
Estos hechos abren un nuevo capítulo para la comprensión de la evolución de la enfermedad hipertensiva del corazón, para avanzar en su diagnóstico y para abrir también nuevas posibilidades de tratamiento.
III. Historia natural de la cardiopatía hipertensiva
Un paradigma cuestionado
La historia natural de la enfermedad cardíaca hipertensiva es mal conocida. Ello se debe por una parte a la superposición con la enfermedad coronaria, con la fibrilación auricular y otras alteraciones miocárdicas y valvulares. Por otra parte no existían hasta recientemente seguimientos prolongados en pacientes hipertensos enfocados en la incidencia, características y evolución de la enfermedad cardíaca.
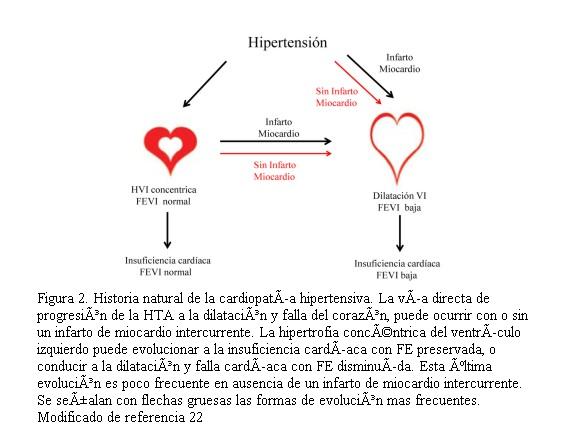
En las escuelas de medicina se ha enseñado durante muchos años un paradigma sencillo sobre la evolución de la HTA a la falla cardíaca. Según el mismo la sobrecarga de presión impuesta por la HTA conduce a la hipertrofia concéntrica del ventrículo izquierdo, que inicialmente tendría una finalidad protectora de la función sistólica al disminuir el estrés parietal. Tardíamente este mecanismo de compensación falla y la HTA conduce, sola o asociada a otras patologías, a la dilatación del ventrículo izquierdo y la insuficiencia cardíaca por disfunción sistólica. Sin embargo, como ha destacado Mark Drazner, este paradigma se basa en investigación sobre modelos experimentales y no tiene sustento en hallazgos clínicos. La realidad se ha mostrado bastante más compleja y hay al menos tres situaciones clínicas comunes que cuestionan ese esquema (22,29).
1. La hipertrofia concéntrica del ventrículo izquierdo puede asociarse a insuficiencia cardíaca en ausencia de dilatación y disfunción sistólica.
En los últimos 20 años ha surgido una evidencia incontrovertible de que cerca de la mitad de los pacientes con insuficiencia cardíaca no tienen deterioro significativo de la fracción de eyección (FE). La insuficiencia cardíaca con fracción de eyección preservada (ICFEP) está estrechamente relacionada a la HTA. Cuatro características clínicas diferencian epidemiológicamente esta entidad de la insuficiencia cardíaca con FE disminuída: 1) pacientes de mayor edad; 2) predominio en sexo femenino; 3) alta prevalencia de HTA; 4) menor prevalencia de enfermedad coronaria (30,31).
El envejecimiento de la población y la alta prevalencia de HTA en el grupo de mayor edad, sobre todo mujeres, parece ser la razón para que la ICFEP esté aumentando 1% por año, con previsiones de que se convertirá en el fenotipo más común de insuficiencia cardíaca en el próximo decenio. El pronóstico vital y funcional de la ICFEP es casi tan malo como el de la insuficiencia cardíaca con FE baja, aunque por tratarse de una población más añosa, ello puede deberse en parte a sus múltiples comorbilidades (32,33). A diferencia de la IC con FE disminuida, el diagnóstico de la ICFEP es complejo y su tratamiento, más que basado en la evidencia, es eminentemente empírico.
2. Hay pacientes hipertensos que nunca desarrollan hipertrofia concéntrica, sino que evolucionan directamente a la dilatación y disfunción sistólica
Tradicionalmente se pensaba que la HTA no llevaba a la dilatación de la cavidad y la falla ventricular izquierda directamente sino que debía transcurrir por una etapa de hipertrofia concéntrica previa, salvo en el caso de que mediara un infarto de miocardio. Sin embargo ello está en contradicción con la evidencia clínica ya descrita, en cuanto a que la hipertrofia excéntrica es tanto o más frecuente que la concéntrica entre pacientes hipertensos. Por otra parte hay evidencia en pacientes hipertensos jóvenes, sobre todo de raza negra, que evolucionan a una miocardiopatía dilatada con disfunción sistólica sin haber transcurrido por una geometría de hipertrofia concéntrica. No está claro el motivo de esta evolución, pero hay un grupo de pacientes que tienen una predisposición (posiblemente de origen genético), en los que la sobrecarga de presión no induce hipertrofia miocítica sino mas bien muerte celular, asociada en mayor o menor medida a alteraciones de la matriz extracelular que condicionan dilatación. La consecuencia es la evolución directa a la dilatación y la falla cardíaca por disfunción sistólica (22).
3. La evolución de la hipertrofia concéntrica a la dilatación y falla cardíaca por disfunción sistólica es poco común, salvo que medie un infarto de miocardio
La evidencia de experimentación animal que sustenta la evolución desde la hipertrofia concéntrica a la dilatación y falla del VI es abundante. Sin embargo la evidencia clínica que la demuestre es escasa, y se refiere más a la estenosis aórtica y la miocardiopatía hipertrófica que a la HTA. Estudios recientes con seguimientos ecocardiográficos de 5 a 7 años, han mostrado que este tránsito existe pero es poco común, salvo cuando media un infarto de miocardio intercurrente. Por otra parte, en la mayoría de los casos que evolucionan al deterioro de la FE, la hipertrofia precedente es excéntrica y no concéntrica (22,34,35).
Un estudio retrospectivo de la Ochsner Clinic muestra datos sobre más de 1.000 pacientes que tenían hipertrofia concéntrica del VI con FE normal en un ecocardiograma inicial, a los que se realizó un segundo estudio, por indicación de su médico, un promedio de 3 años después. 13% de los pacientes mostraban disminución significativa de la FE y de ellos 43% había tenido un infarto de miocardio en el período transcurrido entre los dos ecocardiogramas (36).
Se necesitan estudios prospectivos con seguimientos mayores de 10 años para conocer la historia natural que lleva de la HTA a la insuficiencia cardíaca, la frecuencia de cada una de los mecanismos referidos y su interacción con la enfermedad coronaria (figura 2).
De la disfunción diastólica a la ICFEP
La estrecha relación entre HTA y la ICFEP y las dificultades para diagnosticarla y tratarla, nos obligan a dedicar un breve capítulo al diagnóstico de esta entidad.
El aspecto fisiopatológico principal de la ICFEP es la alteración de la relajación y la disminución de la compliance del ventrículo izquierdo con compromiso de la reserva de función diastólica, lo que le impide aceptar un aumento del retorno venoso sin un sustantivo incremento de la presión diastólica final. Por este motivo se le asocia a disfunción diastólica y ha sido llamada “insuficiencia cardíaca diastólica”. Sin embargo FE normal no significa función sistólica normal, pues se han demostrado alteraciones en otros parámetros más sutiles, como la reducción de la velocidad de la contracción miocárdica en el Doppler tisular, la disminución del acortamiento longitudinal o alteraciones en el acoplamiento ventrículo-arterial. Asimismo están alterados el incremento de la contractilidad y la disminución del volumen sistólico final, que se observan normalmente con el ejercicio. Estos mecanismos se ven acentuados por la frecuente coexistencia de incompetencia cronotrópica o por la aparición de fibrilación auricular.
En el envejecimiento normal es casi constante algún grado de disfunción diastólica, lo que no debe confundirse con ICFEP, que es un síndrome clínico que debe obligatoriamente tener síntomas y/o signos de falla cardíaca. Se ha afirmado que la ICFEP asociada a hipertensión arterial es una forma exagerada de corazón del anciano, pero el problema es desentrañar los mecanismos por los cuales se transita de una cardiopatía hipertensiva con disfunción diastólica asintomática a la ICFEP sintomática (37).
Por lo antedicho resulta difícil establecer límites precisos al diagnóstico de ICFEP, sobre todo en los pacientes que tienen como síntoma predominante la disnea de esfuerzo limitante, sin signos objetivos concluyentes de insuficiencia cardíaca congestiva. Los dos criterios iniciales, síntomas o signos de insuficiencia cardíaca con FE normal, definen a la entidad, pero resultan poco específicos para identificarla en la práctica clínica. Por este motivo, las diferentes guías de diagnóstico propuestas recientemente destacan la necesidad de asociar evidencia paraclínica de presión diastólica final elevada o, en su lugar, alteraciones anatómicas cardíacas consistentes con llenado ventricular izquierdo anormal (38-40). Las dificultades en la evaluación no invasiva de las presiones de llenado han hecho revalorizar parámetros de fácil obtención que se correlacionan fuertemente con llenado anormal. El volumen de la aurícula izquierda y la hipertrofia del ventrículo izquierdo, en especial la geometría concéntrica, son aceptados como importantes marcadores de disfunción diastólica. Entre pacientes con hallazgos clínicos de IC y FE normal, la presencia de hipertrofia concéntrica asegura que alguna de las medidas del llenado diastólico estará alterada, por lo que se ha postulado que las mismas resultan redundantes (41).
Diagnóstico de ICFEP
Las medidas invasivas de las presiones de llenado del ventrículo izquierdo cumplen con las necesidades de precisión diagnóstica pero muy raramente están disponibles, por lo que en la práctica clínica debemos manejarnos con parámetros no invasivos. El estudio del llenado del ventrículo izquierdo con Doppler convencional ha recibido intensa atención desde hace mas de 30 años y se han descrito numerosos parámetros para estimar las alteraciones de la función diastólica y predecir las presiones de llenado (entre otros: relación de ondas E y A del llenado mitral, tiempo de relajación isovolumétrica, tiempo de desaceleración de la onda E mitral, relación entre la duración de onda auricular reversa en vena pulmonar y onda A mitral, velocidad de propagación del flujo mitral en M color). En el paciente con FE normal estos parámetros tienen importantes limitaciones pues varían con la edad del paciente, dependen de las condiciones de precarga del VI, varían con los trastornos del ritmo y de la frecuencia cardíaca, o muestran importante variabilidad interobservador, por lo que muchas veces tienen resultados contradictorios o inconsistentes.
En los últimos diez años el Doppler tisular ha ganado un lugar preponderante, pues tiene mucho menor dependencia de las condiciones de precarga que otros parámetros antes mencionados y es técnicamente sencillo de obtener. La medida con Doppler tisular de la velocidad diastólica temprana a nivel del anillo mitral (E’), combinado con la onda E del flujo mitral con doppler convencional (E), en el cociente E/E’, tiene una buena correlación con las presiones de llenado. Puede conceptualizarse que E’ representa la cantidad de sangre que entra al ventrículo izquierdo, mientras que E representa el gradiente necesario para que esta cantidad de sangre se movilice hacia el mismo. De este modo, un E/E’ elevado representa un alto gradiente para movilizar un pequeño volumen. Cuando la relación E/E’ es mayor de 15 las presiones de llenado están elevadas y cuando es menor de 8 las presiones de llenado son bajas. Los valores de E/E’ que están entre 8 y 15 caen en una zona gris, que no es suficiente evidencia de presión diastólica final elevada, por lo que debe complementarse con otras medidas no invasivas. La limitación mas evidente de E/E’ es que un valor superior a 15 es poco frecuente en la población de pacientes con ICFEP, por lo que, en la mayoría de los casos, se requieren parámetros adicionales (42).
Los péptidos natriuréticos auriculares (pro-BNP, BNP) se han convertido en un auxiliar valioso en el diagnóstico de insuficiencia cardíaca. Son producidos por el miocardio auricular y ventricular frente al estiramiento y sus niveles sanguíneos se correlacionan bien con los índices de relajación diastólica. Su utilidad ha sido destacada en pacientes con síntomas de insuficiencia cardíaca y disfunción diastólica del VI, pero su valor es menor en la disfunción diastólica preclínica. Son fuertemente recomendados para excluir ICFEP cuando su valor es normal, pero para fines diagnósticos hay una zona gris, de superposición de valores normales y patológicos, sobre todo en pacientes que solo se presentan con disnea de esfuerzo. Por este motivo, un nivel elevado de péptidos auriculares no se considera suficiente evidencia diagnóstica para ICFEP en forma aislada y debe ser siempre complementado por otras investigaciones no invasivas.
En 2007 se publicó un consenso de las asociaciones europeas de Insuficiencia Cardíaca y Ecocardiografía sobre el diagnóstico de ICFEP, que intenta integrar toda la información precedente (38). Establece un esquema diagnóstico (figura 3) en el que se exigen tres requerimientos: signos o síntomas de IC, FE superior a 50%, y evidencia, invasiva o no invasiva, de presiones de llenado elevadas. En cuanto a métodos no invasivos, el Doppler tisular está en primer lugar pues un E/E’ superior a 15 es suficiente para el diagnóstico. Cuando los valores “grises” de E/E’, entre 8 y 15, se asocian con un BNP superior a 200, son suficientes para establecer el diagnóstico. Complementariamente, un conjunto de parámetros son considerados válidos en una segunda línea, asociados a valores de E/E’ entre 8 y 15 o a un BNP superior a 200. Entre estos se incluyen tanto los provenientes del Doppler del flujo mitral y de venas pulmonares, como la evidencia ecocardiográfica de aumento de volumen del atrio izquierdo, del índice de masa del ventrículo izquierdo o la presencia de fibrilación auricular.
Figura 3. Diagnóstico no invasivo de insuficiencia cardÃaca con fracción de eyección preservada.
E: velocidad de flujo diastólico temprano válvula mitral; E’: velocidad diastólica temprana en doppler tisular; BNP: péptido natriurético auricular; E/A: cociente de velocidad diastólica temprana (E) y tardÃa (A) del flujo mitral; TD: tiempo de desaceleración de E; IMVI: Ãndice de masa del ventrÃculo izquierdo; Vol AI: Ãndice de volumen de aurÃcula izquierda; Ard: duración del flujo auricular reverso en venas pulmonares; Ad: duración de la onda A del flujo mitral. Modificado de referencia 38.
En 2009 se publicó una guía detallada de recomendaciones para la evaluación de la función diastólica del ventrículo izquierdo por ecocardiografía, suscrita conjuntamente por la “American Society of Echocardiography” y su par europea (39). También en esta guía el doppler tisular, a través del cociente E/E’, ocupa el lugar central para la estimación de las presiones de llenado en el paciente con FE preservada.
IV. Prevención y aspectos terapéuticos
Una cardiopatía prevenible
Cuando nos referimos al tratamiento de la enfermedad hipertensiva del corazón, el concepto más relevante es que existe la capacidad de prevenirla a través de un buen control de la presión arterial. Ello ha sido demostrado ampliamente en los estudios de medicación contra placebo. Por ejemplo en el estudio SHEP la incidencia de insuficiencia cardíaca a 4,5 años, entre pacientes hipertensos mayores de 60 años, se redujo a la mitad con el tratamiento (diurético inicial con betabloqueante como segunda droga), con un RR de 0,51; [CI] 0,37-0,71; P<0,001; necesitando tratar 48 pacientes para reducir un evento. Entre los que habían sufrido un infarto de miocardio el impacto del tratamiento fue mucho mayor, logrando reducir la IC en 80%, con un RR 0,19 [CI] 0,06-0,53; P=0,002; necesitando tratar solo 15 pacientes para reducir un evento (43). Un metaanálisis de 12 estudios que evaluaron la capacidad de prevenir falla cardíaca y cuatro que evaluaron prevención de HVI con el tratamiento, concluyó en 52% y 35% de reducción respectivamente (44).
En el más reciente estudio HYVET, realizado entre personas hipertensas mayores de 80 años, el tratamiento (diurético inicial asociado a inhibidor de enzima conversora como segunda droga) produjo una disminución en la incidencia de IC de 64% (95% CI, 42 a 78; P<0,001) (45).
Los fármacos que han mostrado mayor potencialidad en la prevención de la insuficiencia cardíaca son los diuréticos y, en una segunda línea, los antagonistas del sistema renina-angiotensina, lo que seguramente está vinculado a su demostrada capacidad de disminuír los síntomas de la misma.
¿Es posible la regresión de la hipertrofia ventricular izquierda?
La regresión de la HVI es posible con el tratamiento y, cuando se obtiene, significa un mejor pronóstico, conclusión a la cual llegaron dos metaanálisis realizados a principios de la década de los 90 (46,47). En 1998 Verdecchia demostró que los pacientes en los que la masa ventricular izquierda disminuía durante el tratamiento antihipertensivo, tenían una incidencia de eventos vasculares de 1,78% por año, mientras que en los que la masa ventricular izquierda aumentaba la incidencia era de 3,03% por año (p 0,029). La disminución de riesgo fue más clara entre los que tenían un IMVI basal superior a 125 g/m2, pues cuando obtenían reducción del mismo, la tasa de eventos era de 1,58% por año y cuando no la obtenían era de 6,27% por año (p 0,002). Este beneficio fue independiente de los registros de presión arterial, tanto de consultorio como del monitoreo ambulatorio, o del grado de reducción de la misma obtenida con el tratamiento (48).
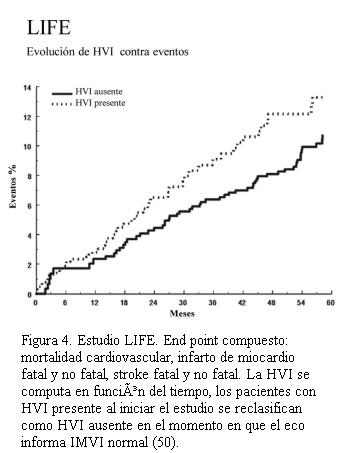
El estudio LIFE reclutó un grupo de más de 9000 pacientes hipertensos con signos de HVI en el ECG rigurosamente definidos. La mejoría del ECG durante el tratamiento estuvo asociada a un mejor pronóstico (49). Un subgrupo de más de 900 pacientes fue seguido con ecocardiograma anual durante un promedio de 4,8 años. Se demostró que el tratamiento agresivo de la HTA redujo la hipertrofia, tanto en geometría concéntrica como excéntrica, hasta el punto que al final del estudio el 52% de los pacientes tenían geometría normal. Entre los que tenían remodelado concéntrico el efecto fue aún más marcado, con un retorno a la normalidad superior a 80%. Asimismo el estudio LIFE demostró que conseguir la reducción del IMVI mejoraba el pronóstico, pues la ausencia de hipertrofia durante el tratamiento (valores de partición de 116 g/m2 en hombres y 104 g/m2 en mujeres) estuvo asociado con una disminución significativa de eventos vasculares y una reducción muy significativa de mortalidad cardiovascular (64% p< 0,004) y global (62% p<0,001) a lo largo del estudio (figura 4) (50-52).
¿Cual es el mejor fármaco para la reducción de la HVI?
Está suficientemente claro que la reducción de la hipertrofia ventricular izquierda durante el tratamiento antihipertensivo tiene efecto beneficioso. Cabe preguntarse si existen drogas que ofrezcan un efecto comparativamente superior para obtener este objetivo. El estudio LIFE comparó dos estrategias de tratamiento, una con el antagonista de angiotensina II (ARA II) losartán como primer fármaco y otra con un betabloqueante (BB) atenolol como primer fármaco. El efecto del losartán fue significativamente superior a través de los diferentes subgrupos (ambos sexos, mayores o menores de 65 años, distintos grados de hipertrofia) y también después del ajuste de múltiples variables. La reducción promedio del IMVI con losartán fue de 21,7 g/m2, contra 17,7 g/m2 con atenolol (p< 0,02)
Numerosos metaanálisis se han propuesto identificar comparativamente la capacidad de reducir hipertrofia para cada grupo farmacológico, con las dificultades inherentes a esta metodología que combina estudios a veces muy disímiles (46,47,53,54). Emerge una superioridad de los antagonistas del sistema renina-angiotensina (tanto IECA como ARA II) sobre los demás fármacos y una inferioridad de los BB respecto al resto. El más reciente metaanálisis fue publicado en 2009 y encontró, en la misma línea del estudio LIFE, que los ARA II disminuyen la masa miocárdica en promedio un 12,5%, contra 9,8% de los BB. Sin embargo las otras comparaciones pareadas de grupos farmacológicos no mostraron diferencias significativas. También los ARA II muestran superioridad cuando se comparan con el resto de las drogas en conjunto (incluyendo o no betabloqueantes) y los betabloqueantes se muestran inferiores cuando se comparan con el resto de los fármacos (55).
Vale la pena consignar que existe evidencia incipiente, clínica y experimental, de que los antagonistas del sistema renina angiotensina tienen propiedades para disminuír la fibrosis miocárdica. Existen trabajos con lisinopril y con losartan que demostraron disminución de la fibrosis y mejoría de la función diastólica, independientemente del nivel de control de la presión arterial y del grado de regresión de hipertrofia. Estos efectos no se demostraron para diuréticos tiazídicos ni antagonistas cálcicos. También existe alguna evidencia experimental a favor de la espironolactona (26).
V. En conclusión
La historia natural de la enfermedad hipertensiva del corazón es compleja y mal conocida, por su superposición con la enfermedad coronaria, la fibrilación auricular y la insuficiencia cardíaca. La hipertrofia ventricular izquierda es el hecho más característico de esta entidad y debe ser vista como un importante marcador de riesgo. Su precisa cuantificación, integrada con la geometría de la cavidad, tiene un incuestionable valor pronóstico.
El tránsito de la hipertrofia ventricular izquierda a la insuficiencia cardíaca es complejo y los conocimientos actuales desafían los paradigmas que manejábamos hasta hace algunos años. La insuficiencia cardíaca con función sistólica preservada está estrechamente vinculada a la hipertensión arterial en la edad avanzada y se encamina a convertirse en la forma más común de insuficiencia cardíaca. La identificación y tratamiento de esta entidad son un desafío abierto a los nuevos tiempos.
Finalmente la cardiopatía hipertensiva es una entidad prevenible y capaz de revertir con el tratamiento adecuado, lo cual tiene un demostrado beneficio pronóstico.
Bibliografía
1. Georgiopoulou VV, Kalogeropoulos AP, Raggi P, Butler G. Prevention, diagnosis and treatment of hypertensive heart disease. Cardiol Clin 2010;28: 675-91.
2. Levy D, Larson MG, Vasan RS, Kannel WB, Ho KK. The progression from hypertension to congestive heart failure. JAMA 1996;275:1557-62.
3. Lloyd-Jones D, Larson MG, Leip EP, Beiser A, D’Agostino RB, Kannel WB, et al. Lifetime risk for developing congestive heart failure: the Framingham Heart Study. Circulation 2002;106:3068- 72.
4. Vázquez H, Burdiat G, Alonso P, Sandoya E, Tejada J. Control del riesgo cardiovascular post internación en pacientes coronarios. Rev Urug Cardiol 2011; 26: 108-114.
5. Kannel WB, Dannenberg AL, Abbott RD. Unrecognized myocardial infarction and hypertension: the Framingham Study. Am Heart J 1985;109(3 Pt 1):581-5.
6. Kannel WB, Wolf PA, Benjamin EJ, Levy D. Prevalence, incidence, prognosis, and predisposing conditions for atrial fibrillation: population-based estimates. Am J Cardiol. 1998;82:2N-9N.
7. Kannel WB. Left ventricular hypertrophy as a risk factor: the Framingham experience. J Hypertens 1991;9(suppl 2):S3-S9.
8. Levy D, Anderson KM, Savage DD, Kannel WB, Christiansen JC, Castelli WP. Echocardiographically detected left ventricular hypertrophy: prevalence and risk factors. The Framingham Heart Study. Ann Intern Med 1988;108:7-13.
9. Devereux RB, Alonso DR, Lutas EM, Gottlieb GB, Campo E, Sachs I, et al. Echocardiographic assessment of left ventricular hypertrophy: comparison to necropsy findings. Am J Cardiol 1986;57:450-8.
10. Ganau A, Devereux RB, Roman MJ, de Simone G, Pickering TG, Saba PS, et.al. Patterns of left ventricular hypertrophy and geometric remodeling in essential hypertension. J Am Coll Cardiol 1992;19:1550-8.
11. Lang RM, Bierig M, Devereux RB, Flachskampf, Foster E, Pellikka PA, et al. Recommendations for chamber quantification. A report from the American Society of Echocardiography’s guidelines and standards committee and the chamber quantification writing group, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiology. J Am Soc Echocardiogr 2005; 18:1454-7.
12. Lang RM, Bierig M, Devereux RB, Flachskampf FA, Foster E, Pellikka PA, et al. Recommendations for chamber quantification. Eur J Echocardiography 2006;7:79-108.
13. Schiller NB, Shah PM, Crawford M, DeMaria A, Devereux R, Feigenbaum H, et al. Recommendations for quantitation of the left ventricle by two-dimensional echocardiography. American Society of Echocardiography Committee on Standards, Subcommittee on Quantitation of Two-Dimensional Echocardiograms. J Am Soc Echocardiogr 1989;2: 358e67.
14. Koren MJ, Devereux RB, Casale PN, Savage DD, Laragh JH. Relation of left ventricular mass and geometry to morbidity and mortality in uncomplicated essential hypertension. Ann Intern Med 1991;114:345-352.
15. Schillaci G, Verdecchia P, Porcellati C, Cuccurullo O, Cosco C, Perticone F. Continuous relation between left ventricular mass and cardiovascular risk in essential hypertension. Hypertension 2000;35: 580-6.
16. Gaasch WH, Zile MR. Left Ventricular Structural Remodeling in Health and Disease: With Special Emphasis on Volume, Mass, and Geometry. J Am Coll Cardiol 2011;58:1733-40.
17. Roman MJ, Pickering TG, Schwartz JE, Pini R, Devereux RB. Relation of arterial structure and function to left ventricular geometric patterns in hypertensive adults. J Am Coll Cardiol 1996;28:751- 6.
18. Gerdts E. Left ventricular structure in different types of chronic pressure overload. Eur Heart J 2008;10 (Suppl E): E23-E30.
19. Verdecchia P, Schillaci G, Borgioni C, Ciucci A, Battistelli M, Bartoccini C, et al. Adverse prognostic significance of concentric remodeling of the left ventricle in hypertensive patients with normal left ventricular mass. J Am Coll Cardiol 1995;25:871-8.
20. Khouri MG, Peshock RM, Ayers CR, de Lemos JA, Drazner MH. A four-tiered classification of left ventricular hypertrophy based on left ventricular geometry: the Dallas Heart Study. Circ Cardiovasc Imaging 2010;3:164 -71.
21. Chinali, M, Aurigemma GP. Refining Patterns of Left Ventricular Hypertrophy Using Cardiac MRI. “Brothe r, Can You Spare a Paradigm?” Circ Cardiovasc Imaging. 2010;3:129-31.
22. Drazner MH. The progression of hypertensive heart disease. Circulation 2011, 123:327-34.
23. Wang J, Chen W, Ruan L, Toprak A, Srinivasan SR, Berenson GS. Differential effect of elevated blood pressure on left ventricular geometry types in black and white young adults in a community (from the Bogalusa Heart Study). Am J Cardiol 2011; 107:717-22.
24. Rodriguez CJ, Diez-Roux AV, Moran A, Jin Z, Kronmal RA, Lima J, et al. Left ventricular mass and ventricular remodeling among Hispanic subgroups compared with non-Hispanic blacks and whites. J Am Coll Cardiol 2010;55:234-42.
25. Piro M, Della Bona R, Abbate A, Biasucci LM, Crea F. Sex-related differences in myocardial remodeling. J Am Coll Cardiol 2010;55: 1057-65.
26. Díez J, González A, López B, Querejeta R. Mechanisms of Disease: pathologic structural remodeling is more than adaptive hypertrophy in hypertensive heart disease. Science 2005;2:209-215.
27. López B, González A, Querejeta R, Larman M, Díez J. Alterations in the Pattern of Collagen Deposition May Contribute to the Deterioration of Systolic Function in Hypertensive Patients With Heart Failure. J Am Coll Cardiol 2006;48:89-96.
28. Ahmed SH, Clark LL, Pennington WR, Webb CS, Bonnema DD, Leonardi AH, et al. Matrix metalloproteinases/Tissue inhibitors of metalloproteinases. Relationship between changes in proteolytic determinants of matrix composition and structural, functional, and clinical manifestations of hypertensive heart disease. Circulation 2006;113:2089- 96.
29. Drazner MH. The Transition From Hypertrophy to Failure: How Certain Are We? Circulation 2005, 112:936-8.
30. Redfield MM, Jacobsen SJ, Burnett JC, Mahoney DW, Bailey KR, Rodeheffer RJ. Burden of systolic and diastolic ventricular dysfunction in the community. JAMA. 2003;289:194 -202.
31. Owan TE, Hodge DO, Herges RM, Jacobsen SJ, Roger VL, Redfield MM. Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med. 2006;355:251-9.
32. Bhatia RS, Tu JV, Lee DS, Austin PC, Fang J, Haduzi A, et al. Outcome of heart failure with preserved ejection fraction in a population-based study. N Engl J Med 2006;355:260 -9.
33 . Burkhoff D. Mortality in heart failure with preserved ejection fraction: an unacceptably high rate. Eur Heart J 2012;33:1718-20.
34. Rame JE, Ramilo M, Spencer N, Blewett C, Mehta SK, Dries DL, et al. Development of a depressed left ventricular ejection fraction in patients with left ventricular hypertrophy and a normal ejection fraction. Am J Cardiol 2004;93:234 -7.
35. Drazner MH, Rame JE, Marino EK, Gottdiener JS, Kitzman DW, Gardin JM, et al. Increased left ventricular mass is a risk factor for the development of a depressed left ventricular ejection fraction within five years: the Cardiovascular Health Study. J Am Coll Cardiol 2004;43:2207-15.
36. Milani RV, Drazner MH, Lavie CJ, Morin DP, Ventura HO. Progression from Concentric Left Ventricular Hypertrophy and Normal Ejection Fraction to Left Ventricular Dysfunction. Am J Cardiol 2011;108¬:992-6.
37. Borlaug BA, Paulus WJ. Heart failure with preserved ejection fraction: pathophysiology, diagnosis, and treatment. Eur Heart J 2011; 32: 670-9.
38. Paulus WJ, Tschope C, Sanderson JE, Rusconi C, Flachskampf FA, Rademakers FE, et al. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology. Eur Heart J 2007;28: 2539-50.
39. Nagueh SF, Appleton CP, Gillebert TC, Marino PN, Oh JK, Smiseth OA, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography. J Am Soc Echocardiogr 2009;22:107-33.
40. Gaasch WH, Little WC. Assessment of Left Ventricular Diastolic Function and Recognition of Diastolic Heart Failure. Circulation 2007;116:591-3.
41. Zile MR, Gaasch WH, Carroll JD, Feldman MD, Aurigemma GP, Schaer GL, et al. Heart failure with a normal ejection fraction: is measurement of diastolic function necessary to make the diagnosis of diastolic heart failure? Circulation 2001;104: 779-82.
42. Hatle L. How to diagnose diastolic heart failure a consensus statement. Eur Heart J 2007; 28: 2421-3.
43. Kostis JB, Davis BR, Cutler J, Grimm RH, Berge KG, Cohen JD, et al. Prevention of Heart Failure by Antihypertensive Drug Treatment in Older Persons With Isolated Systolic Hypertension. SHEP cooperative research group. JAMA 1997;278:212-6.
44. Moser M, Hebert PR. Prevention of disease progression, left ventricular hypertrophy and congestive heart failure in hypertension treatment trials. J Am Coll Cardiol 1996;27:1214-8.
45. Beckett NS, Peters R, Fletcher AE, Staessen JA, Liu L, Dumitrascu D, et al. Treatment of hypertension in patients 80 years of age or older. N Engl J Med 2008; 358:1887-1898.
46. Cruickshank JM, Lewis J, Moore V, Dodd C. Reversibility of left ventricular hypertrophy by differing types of antihypertensive therapy. J Hum Hypertens 1992;6:85-90.
47. Dahllöf B, Pennert K, Hansson L. Reversal of left ventricular hypertrophy in hypertensive patients: a meta-analysis of 109 treatment studies. Am J Hypertens 1992;5:95-110.
48. Verdecchia P, Schillaci G, Borgioni C, et al. Prognostic Significance of Serial Changes in Left Ventricular Mass in Essential Hypertension. Circulation 1998, 97:48-54.
49. Dahlöf B, Devereux RB, Julius S, Kjeldsen SE, Beevers G, de Faire U, et al. Characteristics of 9194 patients with left ventricular hypertrophy: the LIFE study. Hypertension 1998;32:989-97.
50. Devereux RB, Wachtell K, Gerdts E, Boman K, Nieminen MS, Papademetriou V, et al. Prognostic significance of left ventricular mass change during treatment of hypertension. JAMA 2004;292: 2350-6.
51. Gerdts E, Cramariuc D, Wachtell K, De Simone G, Dahlof B, Devereux RB. Impact of left ventricular geometry on prognosis in hypertensive patients with left ventricular hypertrophy (the LIFE study). Eur J Echocardiogr 2008;9:809-15.
52. Devereux RB, Wachtell K, Gerdts E, Boman K, Nieminen MS, Papademetriou V, et al. Prognostic significance of left ventricular mass change during treatment of hypertension. JAMA 2004;292: 2350-6.
53. Schmieder RE, Martus P, Klingbeil A. Reversal of left ventricular hypertrophy in essential hypertension: a meta-analysis of randomized double-blind studies. JAMA. 1996;275:1507-13.
54. Klingbeil AU, Schneider M, Martus P, Messerli FH, Schmieder RE. A meta-analysis of the effects of treatment on left ventricular mass in essential hypertension. Am J Med. 2003;115:41- 6.
55. Fagard RH, Celis H, Thijs L, Wouters S. Regression of Left Ventricular Mass by Antihypertensive Treatment: A Meta-Analysis of Randomized Comparative Studies. Hypertension 2009, 54:1084-91.