Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Revista Uruguaya de Cardiología
versão On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.27 no.1 Montevideo abr. 2012
Avances en cardiología nuclear: fusión de imágenes. SPECT/TC, PET/TC
Dr. Mario Beretta 1
1. Servicio de Medicina Nuclear. Asociación Española. Montevideo, Uruguay.
Correo electrónico: mberettab@gmail.com
Recibido marzo 28, 2011; aprobado marzo 12, 2012
Palabras clave:
MEDICINA NUCLEAR
IMAGEN DE PERFUSIÓN MIOCÁRDICA
TOMOGRAFÍA DE EMISIóN DE POSITRONES
TOMOGRAFÍA COMPUTADA MULTICORTE
Key words:
NUCLEAR MEDICINE
MYOCARDIAL PERFUSIóN IMAGING
POSITRON-EMISSION TOMOGRAPHY
MULTISLICE COMPUTED TOMOGRAPHY
Introducción
La introducción de la angiografía coronaria no invasiva por tomografía computada multicorte (angioTC), ha cambiado el campo de las imágenes cardiovasculares no invasivas. La angioTC proporciona por primera vez una visión de la anatomía del árbol coronario con una modalidad no invasiva. Esto permite el diagnóstico de la enfermedad coronaria (EC) en etapas más tempranas que las imágenes funcionales (1), lo cual tiene importantes implicancias tanto diagnósticas como pronósticas. Se han publicado numerosos estudios que muestran una alta precisión diagnóstica de la angioTC en la EC (2,3), por consiguiente se está incrementado su aplicación como “portero” para la aplicación de otras técnicas diagnósticas.
La asociación de la angioTC con las técnicas de perfusión miocárdica (PET, SPECT) surge naturalmente como la manera de evaluar la anatomía y su repercusión funcional, permitiendo un exhaustivo diagnóstico no invasivo de la EC.
Aunque el objetivo de este artículo es revisar la experiencia actualmente disponible de estas múltiples modalidades de imágenes, cuando el denominador común es el uso de radioisótopos, el desarrollo de equipos híbridos PET/TC y SPECT/TC que admiten el registro simultáneo de imágenes anatómicas y funcionales, nos obliga a dedicar algunos párrafos a los aspectos básicos y aplicaciones clínicas del la angioTC.
1. Angiocoronariografía con tomografía de múltiples cortes
1.1 Principios básicos
El principio básico de la tomografía computada (TC) es que un delgado haz de rayos X (Rx) en forma de abanico atraviesa el cuerpo en diferentes ángulos, permitiendo la generación de imágenes de cortes transaxiales. Los Rx emitidos son detectados en una matriz. Tanto el tubo de Rx como el detector giran alrededor del paciente separados por un ángulo de 180°. El haz de Rx emitidos, así como los detectados, son filtrados (colimados) para producir cortes muy delgados. Este proceso es digitalizado en elementos de visión llamados pixeles, cuya dimensión es conocida.
La información en escala de grises contenida en cada pixel es reconstruida de acuerdo al rango de atenuación del haz de Rx, usando una técnica estándar llamada “retroproyección filtrada”. Los valores de la escala de grises en las tomografías reconstruidas son definidos tomando como referencia el valor del agua en las denominadas unidades Hounsfield (HU). El aire atenúa los Rx menos que el agua y el hueso más que el agua, de modo que convencionalmente se asignó un valor de -1.000 HU para el aire, 0 HU para el agua y +1.000 HU para los huesos. Por lo tanto, en un rango de 2.000 valores en la escala de grises se pueden representar las diferentes densidades de los tejidos blandos y duros del cuerpo humano (4).
Los tomógrafos convencionales usados para imágenes cardiovasculares utilizan fuentes de Rx rotatorias y detectores estacionarios de forma circular (TC espiral o helicoidal) o un haz de electrones rotatorios (electron beam computed tomography [EBCT]).
La obtención de imágenes de calidad en un órgano en constante movimiento, como el corazón, exige a la vez resolución temporal y espacial. En términos prácticos, el tiempo de adquisición de imágenes debe ser suficientemente corto para obtener una resolución espacial adecuada (nitidez de la imagen), a lo cual también colabora la reducción al mínimo de los movimientos del órgano y el tórax (bradicardia y apnea durante la adquisición). Los tomógrafos de múltiples detectores (MDCT) utilizan un tubo de Rx que rota a alta velocidad y varias filas de detectores que también rotan, ampliando el plano de obtención de imágenes. El movimiento continuo de la camilla del paciente a través del plano de imagen permite obtener numerosos cortes en períodos muy breves con alta resolución espacial. Los tomógrafos de 64 detectores tienen una resolución temporal de 160 ms y consiguen cortes de menos de 1 mm de espesor (0,625 mm) o aun más finos si se utilizan 128 o 320 detectores (5).
La progresiva mejoría de la resolución temporal contribuye a la disminución de los artefactos de movimiento y permite un mejor rendimiento diagnóstico. Los algoritmos de reconstrucción, el uso de un mayor número de detectores y el sincronizado (gatillado) con el electrocardiograma (ECG) (6,7), han permitido la reconstrucción de imágenes volumétricas (3D) de alta calidad, tanto de las cavidades como del miocardio y las arterias coronarias.
1.2 Aplicaciones clínicas
Cuantificación de la carga aterosclerótica
La calcificación de la pared arterial esta asociada a la mayoría de las lesiones ateroscleróticas aunque es más frecuente encontrarlas en las lesiones avanzadas. La radiografía simple de tórax, la fluoroscopía, la coronariografía, el ultrasonido y la resonancia magnética pueden identificar el calcio en los vasos sanguíneos, pero solo la TC es capaz de cuantificarlo. Con este propósito inicialmente se utilizó la tecnología EBCT, que está siendo rápidamente desplazada por la tecnología multicorte MDCT. En cualquier caso debe asegurarse una baja dosis de radiación (1 mSv) pues, cuando el propósito exclusivo es el estudio de calcio, el mayor uso de esta aplicación es la detección en personas asintomáticas.
Ya que la calcificación arterial casi siempre representa aterosclerosis, la detección de calcio por TC es un método sensible pero no específico para el diagnóstico de EC obstructiva (8). La presencia de calcio en la pared arterial se define como una densidad mayor de 130 unidades Hounsefield. La extensión de la calcificación de las arterias coronarias es cuantificada usando el score de Agatson (calcium coronary score [CCS]) o el score del volumen de calcio (CVS). El score de Agatson está basado en el coeficiente de atenuación expresado en HU y en la extensión del área de los depósitos de calcio (figura 1) (9).
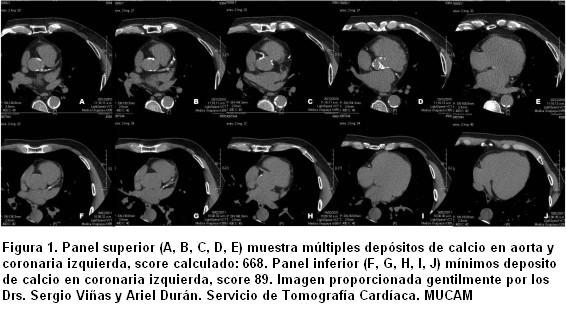
Varios estudios han mostrado que la presencia de calcio en las arterias coronarias detectado por TC, correlaciona con el hallazgo histológico de aterosclerosis y que el CCS está directamente relacionado con el total de la carga aterosclerótica presente en los vasos coronarios epicárdicos (10,11). Estos descubrimientos son concordantes con estudios que han comparado el calcio coronario con los hallazgos de la coronariografía demostrando que la EC significativa (lesiones > 50%) está casi universalmente asociada a la presencia de calcio en las arterias coronarias (12,13). En una gran serie de pacientes, solo 0,5% con un CCS normal tuvieron EC significativa (14). Estos resultados además señalan que la extensión del calcio coronario es un barómetro más preciso de EC obstructiva que la sola presencia de calcio (14,15). Existe consenso general en que un CCS mayor de 0 constituye un hallazgo positivo, pero cuando supera 100 implica un aumento de riesgo significativo y cuando supera 400 implica EC extensa y riesgo elevado. La medición del calcio coronario permite la detección de lesiones ateroscleróticas mucho tiempo antes de que sean hemodinamicamente significativas. Por el contrario, los estudios nucleares de perfusión miocárdica de estrés (así como las otras modalidades de estrés), requieren de estenosis fisiológicamente significativa antes de que sean objetivadas como anormales.
El CCS ha mostrado tener un importante significado pronóstico, aunque su mayor valor está limitado a la población con EC no diagnosticada (aterosclerosis subclínica). El CCS proporciona información adicional a los factores de riesgo tradicionales para predecir mortalidad total y eventos cardíacos mayores, los que se incrementan proporcionalmente a los valores de este indicador (9,16-18). Se ha propuesto un rol del CCS en el seguimiento de la aterosclerosis en pacientes asintomáticos. Algunos reportes sostienen que un CCS ³ 100 debe motivar una terapia antiaterosclerótica agresiva (9). La medición seriada del CCS en pacientes tratados con estatinas ha mostrado una disminución significativa de la progresión del mismo, comparado con un grupo control (19-22).
Identificación de estenosis coronaria
La seguridad y calidad diagnóstica de la angioTC es fuertemente dependiente de la resolución espacial, por lo que es muy importante la minimización de movimientos, una baja frecuencia cardíaca en el momento de la adquisición del estudio, la selección apropiada del instante del ciclo cardíaco en que se hace la reconstrucción y la calidad de contraste (23). Datos publicados con el uso de tomógrafos de cuatro cortes han reportado una sensibilidad entre 80% y 90% para los segmentos proximales de las arterias coronarias (24,25) sin embargo, el número de vasos no interpretables por artefactos que degradan las imágenes es alto, ya sea por movimiento (especialmente en la arteria coronaria derecha), depósitos de calcio, pequeño diámetro arterial o movimientos respiratorios. La introducción de tomógrafos más veloces permitió mejorar la resolución espacial y temporal, consiguiendo un mejor rendimiento diagnóstico (26,27). La mayoría de las publicaciones está de acuerdo en el alto valor predictivo negativo de la angioTC (alrededor de 97%) para los equipos de 16 cortes (24,25). La sensibilidad promedio para las lesiones de 50% en por lo menos una arteria coronaria es de 94% (rango de 75% a 100%), mientras que la especificidad es de 77% (rango de 49% a 100%) (28). Los valores predictivo positivo (VPP) y negativo (VPN) son 84% (rango 50%-100%) y 87% (rango 35%-100%), respectivamente y la precisión diagnóstica de 87% (rango 68%-100%).
Dos estudios multicéntricos (29,30) evaluaron la precisión diagnóstica de los equipos de 64 cortes y sus resultados confirman la solidez para visualizar el árbol coronario. El ACCURACY (The Assessment by Coronary Computed Tomographic Angiography of Individuals Undergoing Invasive Coronary Angiography) incluyó a 230 pacientes con una prevalencia de 25% de EC sometidos a angio-TC y cineangiocoronariografía (CACG). La sensibilidad, especificidad VPP y VPN para detectar estenosis ³ 50% fue de 95%, 83%, 64% y 99%, respectivamente, y para estenosis ³ 70% de 94%, 83%, 48% y 99%, respectivamente. El estudio también reportó que no había reducción en la sensibilidad y especificidad en personas obesas, en cambio en quienes tienen un score de calcio superior a 400, la especificidad se reduce significativamente. El estudio Cor-E (Coronary Artery Evaluation, Using 64 Row Multidetector Computed Tomography Angiography) estudió 291 pacientes con una prevalencia de EC de 56% y mostró evidencia adicional que es algo discordante al ACCURACY. El estudio excluyó a los pacientes que tenían un score de calcio ³ 600, reportando una sensibilidad de 85% para lesiones ³ 50% en por lo menos una arteria coronaria, lo cual fue sensiblemente menor que lo encontrado en el ACCURACY, mientras que la especificidad fue de 90% (más alta que lo reportado en el mismo estudio). El VPP y el VPN fueron de 91% y 83%, respectivamente, sorprendentemente diferentes.
Por otro lado, el problema de la angioTC es que los resultados están limitados a vasos relativamente grandes ³ 1,5 mm, pues la visualización no incluye los vasos más pequeños y sus ramas, lo cual disminuye su sensibilidad. Los objetos de alta densidad, como las placas de calcio coronario y los stents, limitan su capacidad para delinear el grado o la presencia de estenosis (31,32). Para fines clínicos una angioTC normal excluye la EC obstructiva y la necesidad de otras pruebas diagnósticas, catalogando al paciente como de bajo riesgo. Sin embargo, dado su menor VPP para definir la severidad de la estenosis y predecir la alteración del flujo coronario (33,34), una angioTC anormal puede provocar incertidumbre en la indicación de una coronariografía o un procedimiento de revascularización (35).
Limitaciones
La selección del paciente es un paso fundamental para la realización de una angioTC. Las siguientes son contraindicaciones relativas para el método: historia de alergias o alergia comprobada a los contrastes yodados y a otros medicamentos, insuficiencia renal (creatinina sérica > 1,5 mg/dl), fibrilación auricular, mieloma múltiple, hipertiroidismo, feocromocitoma e incapacidad para detener la respiración por 10 a 15 segundos (54). La calidad de la imagen está relacionada con la frecuencia cardíaca, por lo tanto es ideal una frecuencia cardíaca < 65 por minuto, por lo que en la práctica suele administrarse betabloqueantes antes de la realización del estudio.
2. Imágenes de fusión SPECT/TC y PET/TC
Por muchas décadas, la TC y la medicina nuclear se han desarrollado por caminos separados. Ambas técnicas tienen fortalezas diferentes: la TC ofrece imágenes cardíacas y de las arterias coronarias de alta resolución, mientras que las imágenes nucleares identifican anormalidades funcionales en la perfusión, el metabolismo y los receptores. La integración de las cámaras gamma de medicina nuclear con tomógrafos computados de múltiples detectores, tomografía de emisión de positrones (PET/TC) o de tomografía de emisión de fotones (SPECT/TC), proporcionan la oportunidad única de estudiar las anormalidades anatómicas y sus consecuencias fisiológicas en un solo procedimiento. En la evaluación de la EC conocida o sospechada, permite la detección y cuantificación de la carga y extensión de las placas ateromatosas calcificadas y no calcificadas de las arterias coronarias, así como la cuantificación de la reactividad vascular y la salud endotelial estudiando la resistencia al flujo que ofrece la estenosis coronaria y la identificación de miocardio viable.
2.1 Aplicaciones clínicas
Integración del score de calcio y los estudios de perfusión miocárdica
El interés de las estudios no invasivos está enfocado en el diagnóstico precoz en etapa subclínica de la EC, sobre todo en pacientes asintomáticos con el fin de mejorar la estratificación de riesgo. En las imágenes de SPECT la cuantificación de la isquemia es el elemento central para estratificar el riesgo. Un estudio (36) en 10.627 pacientes reveló que los pacientes sometidos a terapia médica como medida inicial tuvieron mayor sobrevida que aquellos que fueron revascularizados cuando tenían isquemia leve. Por el contrario, los pacientes revascularizados se beneficiaron con mejor sobrevida comparados con los tratados médicamente cuando la isquemia fue moderada o severa (> 10% de la masa ventricular), demostrada por SPECT. Estos hallazgos sugieren un nuevo paradigma: más que identificar pacientes en riesgo, la meta de los estudios de perfusión miocárdica (EPM) es convertirse en pruebas estratégicas para identificar a los pacientes que se beneficiarán de un procedimiento de revascularización.
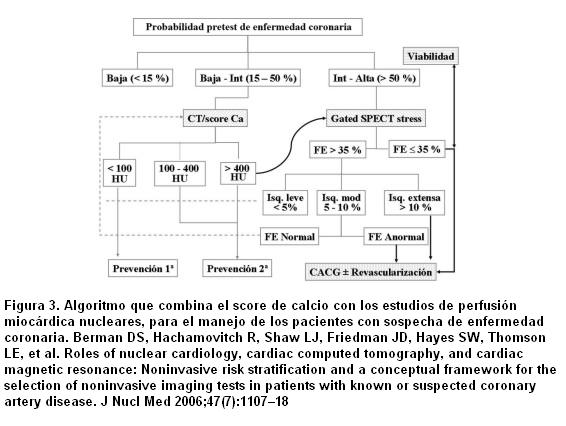
¿Cómo combinar los resultados de CCS y la SPECT (figura 3)? Varios estudios han comparado el CSS con los parámetros fisiológicos usados en los EPM (37-40). Estos reportes han proporcionado consistentes datos de que existe una relación lineal entre el CCS y las anormalidades en los EPM. En los pacientes con un CCS < 100 la tasa de eventos cardíacos es muy baja, lo que es coincidente con estudios angiográficos que muestran una baja probabilidad de EC significativa y una extremadamente baja probabilidad de incidencia de isquemia inducida en los estudios funcionales de estrés (promedio 2%), en este grupo de pacientes. Estos datos indican que los pacientes con un CCS < 100 no se benefician de un estudio de perfusión miocárdica. Han sido propuestas estrategias que utilizan un CCS umbral de > 400 para realizar los estudios de SPECT (37-39), basándose en que los pacientes con un alto CCS tienen una probabilidad intermedia de tener isquemia miocárdica silente. He y colaboradores (37) mostraron que los severos defectos de perfusión están confinados a los pacientes que tenían un CCS ³ 400. En el estudios de Berman y colaboradores (39), tres cuartas partes de los pacientes con isquemia tuvieron un CCS ³ 400. Estos resultados indican además que la probabilidad de detectar isquemia miocárdica mediante SPECT está fuertemente relacionada con el valor del CCS, esperándose que uno de cada tres o cuatro individuos con CCS ³ 400 tengan isquemia silente. Es notable que aproximadamente solo 10% de paciente sometidos a TC tienen un CCS ³ 400, lo que indica que solo una pequeña proporción requerirían EPM y que la probabilidad de encontrar un CCS alto con un SPECT normal es bastante rara. La evidencia actual sugiere que la estrategia de combinar el CCS y SPECT es más efectiva que la SPECT sola, para definir la necesidad de una terapia médica más agresiva (9).
Sin embargo aún se requiere mayor investigación, ya que entre los pacientes con EPM normal, existe un amplio rango de CCS (22% tenían CCS menor de 100, 56% tuvieron un CCS ³ 100 y 31% ³ 400) (39). Schepis y colaboradores (41) descubrieron que un CCS ³ 709 podría ser un valor de corte (cutoff) óptimo para detectar pacientes con EC obstructiva aun en presencia de EPM normales, lo que probablemente refleja “isquemia balanceada”. Con este umbral la combinación del CCS y los EPM mejoraría la sensibilidad para diagnosticar EC obstructiva sin una disminución significativa de la especificidad. Por el contrario, el CCS < 400 en pacientes sintomáticos y con probabilidad intermedia de EC puede ser menos efectivo para excluir la enfermedad, especialmente en sujetos jóvenes y mujeres. Schenker y colaboradores (42) estudiaron 621 pacientes con PET stress y CCS en el mismo procedimiento, su análisis de riesgo demostró un incremento de eventos mayores en los niveles de CCS altos, independientemente del grado de anormalidad en la perfusión. En efecto, la tasa anualizada de eventos en pacientes con PET de perfusión normal y CCS normal fue sustancialmente más baja que entre los que tenían un PET normal con un CCS ³ 1.000. Lo mismo sucedió con la tasa de eventos por año entre los pacientes con isquemia demostrada por la PET y CCS normal y los que tuvieron isquemia con un CCS ³ 1.000. Estos hallazgos sugieren que el añadir la información anatómica de la extensión de la aterosclerosis a los métodos nucleares convencionales suma información adicional en la estratificación del riesgo, pudiendo personalizar mejor las metas terapéuticas.
Estudio de las placas de ateroma
Ya que existe una marcada heterogeneidad en la composición de la placa aterosclerótica, sería clínicamente importante contar con herramientas de imagen no invasivas que permitan la caracterización de dichas placas para identificar el riesgo de complicación (erosión y ruptura). La PET/TC parece ser un método atractivo para estudiar estos fenómenos ya que permite fusionar la estructura (anatomía) a la función (biología) posibilitando la caracterización de la placa. Rudd y colaboradores (43) mostraron la relación entre la placa anatómica y la captación de 18F-flurodesoxiglucosa (FDG) como marcador de inflamación en pacientes sintomáticos. Ocho pacientes sintomáticos con ateromas carotídeos fueron estudiados con FDG, PET y CT simultáneamente, la captación de FDG fue 27% más alta en la lesión sintomática que en la lesión contralateral asintomática. Este estudio, aunque pequeño, prueba que es posible medir el grado de inflamación de las placas de ateroma in vivo mediante PET/TC.
Diagnóstico de enfermedad coronaria obstructiva
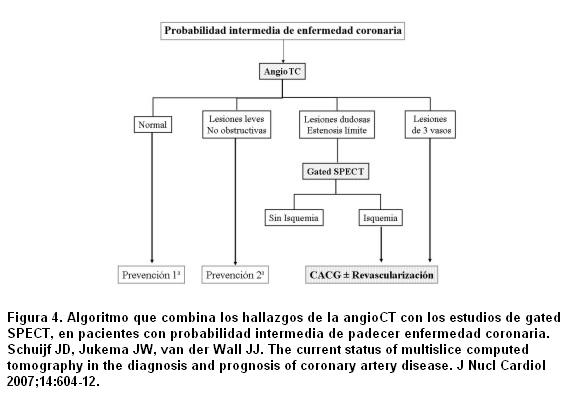
Como se discutió anteriormente la angioTC tiene una excelente sensibilidad diagnóstica en los territorios proximales de las arterias coronarias >1,5 mm y serias limitaciones para estudiar las ramas más pequeñas. Por lo tanto, las imágenes híbridas ofrecen una información superior sobre todo para identificar el “vaso culpable” (44-46). Por ejemplo, Rispler y colaboradores (46) reportaron una significativa mejoría en la especificidad (63% a 95%) y del VPP (31% a 77%) para detectar EC angiográficamente cuantificada en un grupo de 56 pacientes estudiados con SPECT/angioTC. Hallazgos similares fueron mostrados por Sato y colaboradores (47), quienes reportaron la precisión diagnóstica para detectar estenosis coronaria significativa combinando la angioTC de 64 cortes con la SPECT con 201Talio. En 130 pacientes compararon la angioTC sola versus la angioTC/SPECT, el análisis mostró un incremento significativo de la especificidad (de 80% a 92%) y del VPP (de 69% a 85%) sin cambios en la sensibilidad ni en el VPN. Estos resultados indican que la angioTC puede sobreestimar la estenosis coronaria y la combinación con la SPECT permite identificar los falsos positivos de la TC (48). La especificidad y el VPP son particularmente subóptimos en presencia de artefactos de movimiento o severas calcificaciones.
Por otro lado, la angioTC mejora la detección de la EC de múltiples vasos, la cual puede ser una debilidad de los EPM, ya que ayuda a categorizar las lesiones intermedias y los defectos dudosos en la perfusión, y en una tercera parte de los pacientes el análisis de las imágenes de fusión proporciona información adicional que no es obtenida individualmente usando ambos estudios por separado. Es interesante ver que los defectos de perfusión fueron raramente observados en vasos con artefactos de movimiento, pero fueron más frecuentes en vasos severamente calcificados (59%). Por lo tanto, un segmento no evaluable por calcificaciones debería ser sometido a más estudios por su alta probabilidad de obstrucción, mientras los segmentos con artefactos de movimiento (por ejemplo, la arteria coronaria derecha) son usualmente más “benignos” (47). Sato y colaboradores (47) también proponen una guía para la elección de las pruebas diagnósticas. En pacientes con sospecha de EC, pero con una probabilidad baja o intermedia pretest, con baja prevalencia de EC según sexo y edad, la angioTC puede ser de elección debido a su alto poder predictivo negativo (97% para su serie). En presencia de un resultado dudoso o estudio no valorable (artefactos o calcificaciones) los EPM pueden detectar el significado hemodinámico de las lesiones tomográficamente relevantes o identificar las lesiones que necesiten revascularización. En pacientes con probabilidad intermedia o alta pretest, con alta probabilidad de calcificaciones coronarias, puede anticiparse un VPP bajo de la angioTC. Por lo tanto, los EPM deben ser considerados de primera línea. La angioTC puede agregar información en presencia de EPM dudosos sugestivos de artefactos de atenuación o de enfermedad microvascular (49). Nótese que la combinación de angioTC/SPECT es un procedimiento muy útil para el diagnóstico inicial de EC, pero no debe usarse en forma rutinaria en todos los pacientes. Desde un punto de vista práctico es preferible usar una sola modalidad y solo si es necesario complementar con otras pruebas a fin de mejorar la efectividad, minimizar los costos y limitar la exposición a las radiaciones (48).
Una importante limitación en la interpretación de las imágenes híbridas (PET/TC y SPECT/TC) es la falta de un gold standard con el cual puedan ser comparadas. Como es conocido, los hallazgos de las técnicas angiográficas difieren significativamente de los resultados de la SPECT (50). Una estenosis angiográfica única (aun medida por métodos cuantitativos) es probablemente un pobre estándar para reflejar la fisiopatología y la severidad pronóstica de la EC, sobre todo cuando se trata de lesiones obstructivas borderline que pueden no reducir el flujo del vaso. Es por esto que la discordancia entre angioTC y SPECT son inevitables e inherentes a la naturaleza de estos métodos.
Tanto la PET/TC como la SPECT/TC son capaces de medir el CCS y evaluar la anatomía coronaria, pero además tienen la ventaja de cuantificar el flujo miocárdico, lo cual puede ser útil no solo para la enfermedad macrovascular sino también para estudiar la disfunción de la microcirculación (51), lo cual mejora la identificación de la enfermedad de múltiples vasos, sobre todo en individuos con varios factores de riesgo y sin evidencia de enfermedad en los vasos epicárdicos (52). Los estudios de PET/TC deben indicarse en pacientes seleccionados:
a) Pacientes con estudios de SPECT dudosos.
b) Individuos obesos. En muchos centros, y a fin de evitar procedimientos innecesarios, se aconseja realizar un PET/TC cuando el peso exceda los 120 kg.
c) Pacientes con limitación para realizar ergometría.
d) Cardiópatas conocidos (generalmente revascularizados y con ventrículos dilatados y portadores de necrosis) que por su complejidad anatómica sea necesario estudiar áreas específicas de isquemia o viabilidad.
e) En pacientes en los que existe una alta sospecha de EC y tengan un estudio de SPECT normal (53).
El uso de la PET puede verse limitado en pacientes con claustrofobia y obesidad mórbida, pues muchos equipos tienen una limitación de peso establecida por el fabricante.
2.2. Exposición a las radiaciones ionizantes
En los últimos años se ha puesto más atención a la exposición a las radiaciones experimentados por los pacientes que son sometidos a estudios cardiológicos tales como angioTC, SPECT, PET y coronariografía. Aunque el riesgo de cáncer asociado a las radiaciones por TC no ha sido adecuadamente analizado, recientes publicaciones han expresado su preocupación por los muchos estudios tomográficos que se realizan en Estados Unidos cada año (55,56). El tema no es trivial ya que desde 1992, el número deTC realizadas en Estados Unidos se ha cuadruplicado. Sólo en el 2007 se realizaron 72 millones de TC (57), producto de lo cual se estima que provocaría la muerte de 15.000 personas en los próximos 20 a 30 años. Otro estudio publicado en el NEJM (58), que incluyó a 952.420 individuos adultos entre 18 y 64 años que fueron seguidos por tres años, encontró que 69% se sometieron al menos a un estudio de imagen asociado a exposición a radiaciones. Aunque solo 21% se realizó una tomografía o una gammagrafía, este grupo recibió 75,4% de la dosis total efectiva. En este estudio se definió dosis de radiación alta los que recibieron más de 20-50 mSv (mili Sivert), muy alta más de 50 mSv. En estos rangos se ubicaron 18,6 y 1,9/1.000 pacientes por año, respectivamente, y la dosis efectiva acumulada se incrementó con la edad y fue más alta en mujeres.
Para Smith-Bindman y colaboradores (57), la dosis efectiva media de una angioTC de 64 cortes es de 22 mSv y de 31 mSv para una tomografía abdomino-pélvica. El riesgo estimado de cáncer fue de 1/270 para una mujer de 40 años sometida a una angioTC (para varones de la misma edad es de 1/600). El estudio ACIC (Advanced Cardiovascular Imaging Consortium) (59), que involucró a 40 hospitales implementando un programa de “buena práctica”, redujo la dosis de radiación de la angioTC de 21 a 10 mSv, sin afectar la calidad diagnóstica de las imágenes. Un método llamado modulación de dosis mediante ECG, que actualmente está disponible en la mayoría de los tomógrafos, disminuye la exposición durante la sístole provocando una reducción de entre 30% y 50% (la dosis efectiva con este método está en el orden de 7-11 mSv). Además, recientemente se ha introducido un protocolo “gatillado” o de step-and-shoot (paso y disparo) que reduce la radiación por encima de 80% llevando la dosis efectiva a 2,8 mSv (60). Esta técnica requiere de una frecuencia cardíaca baja y estable < 65 latidos/minuto y aporta menor exposición a la radiación comparada con la coronarografía por cateterismo (2,5-5 mSv) y con los estudios de SPECT (9-13 mSv si se usa 99mTc-sestamibi y para el 201Talio de 15-20 mSv).
En los estudios de SPECT, algunos grupos están proponiendo que se realice solo el estudio de estrés (stress only), particularmente en poblaciones de riesgo bajo a intermedio. Si el estudio de estrés es normal se cancela el estudio de reposo, dado que la realización del estudio de reposo no agrega valor pronóstico, pero su supresión permite reducir significativamente la dosis de radiofármaco (61).
Como era de esperar, las imágenes híbridas (SPECT/TC) exponen a una alta dosis de radiación, que se ha estimado en más de 40 mSv. Los nuevos protocolos de adquisición, con bajas dosis de radiación y gatillado, permitirán conseguir importantes reducciones de radiación sin afectar la calidad diagnóstica. Por otro lado, se debe seleccionar mejor a los pacientes para la indicación de estudios de imágenes con el fin de evitar la exposición innecesaria a radiaciones. Cuando se han alcanzado los 10 METS en una ergometría convencional, sin alteraciones isquémicas en el segmento ST, la probabilidad de EC extensa es baja, con una muy baja incidencia de defectos reversibles en el SPECT, que casi nunca comprometen más de 10% de la masa ventricular izquierda, por lo cual los estudios de imágenes no son necesarios (62-65).
2.3. Consideraciones de costo-efectividad
En cardiología, la opción de imagen es abundante y muchas veces redundante, por lo que su financiación está limitada por los servicios de salud y el aspecto costo-efectividad es crucial. Sin embargo, los estudios de costo-efectividad son escasos en estas técnicas emergentes.
El valor de la PET como herramienta de investigación y gold standard para otras técnicas de imagen no está en discusión, pero su costo y la aplicación clínica esta aún bajo observación, ya que la PET es más costosa que otros métodos no invasivos (66). Sin embargo, la PET tendría una superior precisión diagnóstica que disminuye los falsos positivos y negativos, por lo que su relación costo-efectividad sería superior a la ergometría, la SPECT o la coronariografía, aunque los estudios al respecto tienen más de una década (67,68). Merhige y colaboradores (69) más recientemente compararon la frecuencia de arteriografías diagnósticas, revascularización, costos y seguimiento clínico por un año de pacientes estudiados con PET contra un grupo de control interno y otro externo estudiados con SPECT, mostrando una reducción de los procedimientos invasivos cuando se usa PET versus SPECT, con menores costos y un resultado clínico similar. Parecidas consideraciones deben tenerse en cuenta para los estudios de viabilidad miocárdica con PET pues, aunque el costo del procedimiento diagnóstico puede ser alto, el riesgo y los costos de una cirugía evitable también son altos (66,70).
Uno de los principales beneficios del uso de la angioTC en emergencia es que el tiempo del diagnóstico y los costos pueden ser significativamente reducidos. La angioTC toma solo de 5 a 15 minutos por paciente y puede evitar la realización de otras pruebas (71). Savino y colaboradores (72) reportaron que el tiempo de hospitalización (p = 0,009) y el costo total (p < 0,001) se reducen significativamente cuando se aplica el protocolo de la “triple exclusión” (la angioTC en un solo procedimiento puede hacer el diagnóstico diferencial entre: embolismo pulmonar, disección aórtica y EC). Goldstein y colaboradores (73) reportaron en un estudio randomizado que la estrategia basada en la angioTC reduce el tiempo diagnóstico comparada con los protocolos tradicionales (3,4 horas versus 15,0 horas, p < 0,001) y permite además bajar los costos (U$S 1.586 versus U$S 1.872, p < 0,001). Hollander y colaboradores (74), en un estudio preliminar con 54 pacientes, encontraron que después de la angioTC, 85% fueron dados de alta y no tuvieron eventos cardiovasculares en los 30 días siguientes. Ellos concluyeron que, cuando se usa en el contexto clínico del dolor torácico y en pacientes de bajo riesgo, la angioTC puede ser segura y permite el alta de los pacientes con resultados negativos. Esta evidencia preliminar muestra que la angioTC puede disminuir el número de hospitalizaciones y, por consiguiente, bajar los costos en la clasificación de los pacientes con dolor torácico agudo en la emergencia.
3. Conclusiones
Las imágenes cardiológicas están transitando el camino de la multimodalidad, hecho nuevo y dinámico por su continuo desarrollo tecnológico y que está despertando un gran interés clínico. La utilización de las técnicas más apropiadas para cada paciente en diferentes contextos clínicos, con el mejor rendimiento diagnóstico, la menor exposición a radiaciones y una aceptable relación costo-efectividad es un enorme desafío.
Tradicionalmente las diferentes pruebas diagnósticas para la enfermedad coronaria (por ejemplo: tomografías, EPM, RNM, CACG) han estado en las manos de diferentes especialistas (radiólogos, médicos nucleares, cardiólogos hemodinamistas, ecocardiografistas, etcétera). Sin embargo, es previsible que el uso apropiado y complementario de las nuevas modalidades de imágenes requieran de la integración en equipos diagnósticos en donde colaboren los expertos en cada método. Para los próximos años se necesitarán nuevos planes para la formación de especialistas en estas nuevas herramientas diagnósticas y cursos de puesta al día para los especialistas tradicionales.
Bibliografía
1. van Werkhoven JM, Schuijf JD, Jukema JW, Kroft LJ, Stokkel MP, bbets-Schneider P, et al. Anatomic correlates of a normal perfusion scan using 64-slice computed tomographic coronary angiography. Am J Cardiol 2008; 101: 40-5.
2. Miller JM, Rochitte CE, Dewey M, Arbab-Zadeh A, Niinuma H, Gottlieb I, et al. Diagnostic performance of coronary angiography by 64-row CT. N Engl J Med 2008; 359: 2324-36.
3. Pundziute G, Schuijf JD, Jukema JW, Boersma E, de Roos A, van der Wall EE, et al. Prognostic value of multislice computed tomography coronary angiography in patients with known or suspected coronary artery disease. J Am Coll Cardiol 2007; 49: 62-70.
4. Budoff MJ, Cohen MC, Garcia MJ, Hodgson JMcB, Lima AC, Manning WJ, et al. ACC/AHA clinical competence statement on cardiac imaging with computed tomography and magnetic resonance: a report of the American College of Cardiology Foundation/American Heart association/American College of Physicians Task force on Clinical Competence (ACC/AHA Committee on CV Tomography). J Am Coll Cardiol 2005; 46: 383-402.
5. Graaf FR, Schuijf JD, van Velzen JE, Nucifora G, Kroft LJ, de Ross A, et al. Asessment of global left ventricular function and volumes with 320 row multidetector computed tomography: A comparison with 2D-echocardiography. J Nucl Cardiol 2010; 17: 225-31.
6. Ropers D, Baum U, Pohle K, Anders K, Ulzheimer S, Ohnesorge B, et al. Detection of coronary artery stenoses with thin-slice multi-detector row spiral computed tomography and multiplanar reconstruction. Circulation 2003; 107: 664-6.
7. Leta R, Carreras F, Alomar X, Monell J, García-Picart J, Augé JM, et al. [Non-invasive coronary angiography with 16 multidetector-row spiral computed tomography: a comparative study with invasive coronary angiography]. Rev Esp Cardiol 2004; 7: 217-24.
8. O’Rourke RA, Brundage BH, Froelicher VF, Greenland P, Grundy SM, Hachamovitch R, et al. American College of Cardiology/ American Heart Association Expert Consensus Document on electron-beam computed tomography for the diagnosis and prognosis of coronary artery disease. J Am Coll Cardiol 2000; 36: 326-40.
9. Shaw LJ, Berman DS, Bax JJ, Brown KA, Cohen MC, Hendel RC, et al. Computed tomographic imaging within nuclear cardiology. Information Statment. Approved November 2004. J Nucl Cardiol 2005; 12: 131-42.
10. Rumberger JA, Simons DB, Fitzpatrick LA, Sheedy PF, Schwartz RS. Coronary artery calcium area by electron-beam computed tomography and coronary atherosclerotic plaque area. A histopathologic correlative study. Circulation 1995; 92: 2157-62.
11. Sangiorgi G, Rumberger JA, Severson A, Edwards WD, Gregoire J, Fitzpatrick LA, et al. Arterial calcification and not lumen stenosis is highly correlated with atherosclerotic plaque burden in humans: A histologic study of 723 coronary artery segments using nondecalcifying methodology. J Am Coll Cardiol 1998; 31: 126-33.
12. Rumberger JA, Sheedy PF, Breen JF, Schwartz RS. Coronary calcium as determined by electron beam computed tomography, and coronary disease on arteriogram. Effect of patient’s sex on diagnosis. Circulation 1995; 91: 1363-7.
13. Schmermund A, Denktas AE, Rumberger JA, Christian TF, Sheedy PF 2nd, Bailey KR, et al. Independent and incremental value of coronary artery calcium for redicting the extent of angiographic coronary artery disease: comparison with cardiac risk factors and radionuclide perfusion imaging. J Am Coll Cardiol 1999; 34: 777-86.
14. Haberl R, Becker A, Leber A, Knez A, Becker C, Lang C, et al. Correlation of coronary calcification and angiographically documented stenoses in patients with suspected coronary artery disease: Results of 1.764 patients. J Am Coll Cardiol 2001; 37: 451-7.
15. Guerci AD, Spadaro LA, Goodman KJ, Lledo-Perez A, Newstein D, Lerner G, et al. Comparison of electron beam computed tomography scanning and conventional risk factor assessment for the prediction of angiographic coronary artery disease. J Am Coll Cardiol 1998; 32: 673-9.
16. Raggi P, Shaw LJ, Berman DS, Callister TQ. Prognostic value of coronary artery calcium screening in subjects with and without diabetes. J Am Coll Cardiol 2004; 43: 1663-9.
17. Greenland P, LaBree L, Azen SP, Doherty TM, Detrano RC. Coronary artery calcium score combined with Framingham score for risk prediction in asymptomatic individuals. JAMA 2004; 291: 210-5.
18. Shaw LJ, Raggi P, Schisterman E, Berman DS, Callister TQ. Prognostic value of cardiac risk factors and coronary artery calcium screening for all-cause mortality. Radiol 2003; 228: 826-33.
19. Budoff MJ, Lane KL, Bakhsheshi H, Mao S, Grassmann BO, Friedman BC, et al. Rates of progression of coronary calcium by electron beam tomography. Am J Cardiol 2000; 86: 8-11.
20. Hecht HS, Harman SM. Comparison of effectiveness of statin monotherapy versus statin and niacin combination therapy in primary prevention and effects on calcified plaque burden. Am J Cardiol 2003; 91: 348-51.
21. Callister TQ, Raggi P, Cooil B, Lippolis NJ, Russo DJ. Effect of HMG-CoA reductase inhibitors on coronary artery disease as assessed by electron-beam computed tomography. N Engl J Med 1998; 339: 1972-8.
22. Raggi P, Callister TQ, Shaw LJ. Progression of coronary artery calcium and risk of first myocardial infarction in patients receiving cholesterol-lowering therapy. Arterioscler Thromb Vasc Biol 2004; 24: 1272-7.
23. Schoepf UJ, Becker CR, Ohnesorge BM, Yucel EK. CT of coronary artery disease. Radiology 2004; 232: 18-37.
24. Achenbach S, Moshage W, Ropers D, Nossen J, Daniel WG. Value of electron-beam computed tomography for the noninvasive detection of high-grade coronary-artery stenoses and occlusions. N Engl J Med 1998; 339: 1964-71.
25. Kopp AF, Schroeder S, Kuettner A, Baumbach A, Georg C, Kuzo R, et al. Non-invasive coronary angiography with high resolution multidetector-row computed tomography. Results in 102 patients. Eur Heart J 2002; 23: 1714-25.
26. Nieman K, Cademartiri F, Lemos PA, Raaijmakers R, Pattynama PM, de Feyter PJ. Reliable noninvasive coronary angiography with fast submillimeter multislice spiral computed tomography. Circulation 2002; 106: 2051-4.
27. Ropers D, Baum U, Pohle K, Anders K, Ulzheimer S, Ohnesorge B, et al. Detection of coronary artery stenoses with thin-slice multi-detector row spiral computed tomography and multiplanar reconstruction. Circulation 2003; 107: 664-6.
28. Di Carli MF, Hachamovitch R. New technology for noninvasive evaluation of coronary artery disease. Circulation 2007; 115: 1464-80.
29. Budoff MJ, Dowe D, Jollis JG, Gitter M, Sutherland J, Halamert E, et al. Diagnostic performance of 64-multidetector row coronary computed tomographic angiography for evaluation of coronary artery stenosis in individuals without known coronary artery disease: Results from the prospective multicenter ACCURACY (Assessment by Coronary Computed Tomographic Angiography of Individuals Undergoing Invasive Coronary Angiography) trial. J Am Coll Cardiol 2008; 52: 1724-32.
30. Miller JM, Dewey M, Vavere AL, Rochitte CE, Niinuma H, Arbab-Zadeh A, et al. Coronary CT angiography using 64 detector rows: Methods and design of the multi-centre trial CORE- 64. Eur Radiol 2009; 19: 816-28.
31. Hoffmann U, Moselewski F, Cury RC, Ferencik M, Jang IK, Diaz LJ, et al. Predictive value of 16-slice multidetector spiral computed tomography to detect significant obstructive coronary artery disease in patients at high risk for coronary artery disease: Patient-versus segment-based analysis. Circulation 2004; 110: 2638-43.
32. Mollet NR, Cademartiri F, van Mieghem CA, Runza G, McFadden EP, Baks T, et al. High-resolution spiral computed tomography coronary angiography in patients referred for diagnostic conventional coronary angiography. Circulation 2005; 112: 2318-23.
33. Leber AW, Becker A, Knez A, von Ziegler F, Sirol M, Nikolaou K, et al. Accuracy of 64-slice computed tomography to classify and quantify plaque volumes in the proximal coronary system: A comparative study using intravascular ultrasound. J Am Coll Cardiol 2006; 47: 672-7.
34. Raff GL, Gallagher MJ, O’Neill WW, Goldstein JA. Diagnostic accuracy of noninvasive coronary angiography using 64-slice spiral computed tomography. J Am Coll Cardiol 2005; 46: 552-7.
35. Kaufmann PA, Di Carli MF. Hybrid SPECT/TC and PET/TC imaging: the next step in noninvasive cardiac imaging. Seimn Nucl Med 2009; 39: 341-7.
36. Hachamivich R, Hayes SW, friedman JD, Cohen I, Berman DS. Comparison of the short-term survival benefit associated with revascularization compared with medical therapy in patients with no prior coronary artery disease undergoing stress myocardial perfusion single photon emission computed tomography. Circulation 2003; 107: 2900-6.
37. He ZX, Hedrick TD, Pratt CM, Verani MS, Aquino V, Roberts R, et al. Severity of coronary artery calcification by electron beam computed tomography predicts silent myocardial ischemia. Circulation 2000; 101: 244-51.
38. Moser KW, O’Keefe JH, Bateman TM, McGhie IA. Coronary calcium screening in asymptomatic patients as a guide to risk factor modification and stress myocardial perfusion imaging. J Nucl Cardiol 2003; 10: 590-8.
39. Berman DS, Wong ND, Gransar H, Miranda-Peats R, Dahlbeck J, Hayes SW, et al. Hachamovitch R, Shaw L, Rozanski A. Relationship between stress-induced myocardial ischemia and atherosclerosis measured by coronary calcium tomography. J Am Coll Cardiol 2004; 44: 923-30.
40. Anand DJ, Lim E, Raval U, Lipkin D, Lahiri A. Prevalence of silent myocardial ischemia in asymptomatic individuals with subclinical atherosclerosis detected by electron beam tomography. J Nuc Cardiol 2004; 11: 450-7.
41. Schepis T, Gaemperli O, Koepfli P, Namdar M, Valenta I, Scheffel H, et al. Added value of coronary artery calcium score as an adjunct to gated SPECT for the evaluation of coronary artery disease in an intermediate-risk population. J Nucl Med 2007; 48: 1424-30.
42. Schenker MP, Dorbala S, Hong EC, Rybicki FJ, Hachamovitch R, Kwong RY, et al. Interrelation of coronary calcification, myocardial ischemia, and outcomes in patients with intermediate likelihood of coronary artery disease: A combined positron emission tomography/computed tomography study. Circulation 2008; 117: 1693-700.
43. Rudd JH, Warburton EA, Fryer TD, Jones HA, Clark JC, Antoun N, et al. Imaging atherosclerotic plaque inflammation with [18F]-fluorodeoxyglucose positron emission tomography. Circulation 2002; 105: 2708-11.
44. Gaemperli O, Schepis T, Valenta I, Husmann L, Scheffel H, Duerst V, et al. Cardiac image fusion from stand-alone SPECT and CT: Clinical experience. J Nucl Med 2007; 48: 696-703.
45. Namdar M, Hany TF, Koepfli P, Siegrist PT, Burger C, Wyss CA, et al. Integrated PET/TC for the assessment of coronary artery disease: A feasibility study. J Nucl Med 2005; 46: 930-5.
46. Rispler S, Keidar Z, Ghersin E, Roguin A, Soil A, Dragu R, et al. Integrated single-photon emisión computed tomography and computed tomography coronary angiography for the assessment of hemodynamically significant coronary artery lesions. J Am Coll Cardiol 2007; 49: 1059-67.
47. Sato A, Nozato T, Hikita H, Miyazaki S, Takahashi Y, Kuwahara T, et al. Incremental value of combining 64-slice computed tomography angiography with stress nuclear myocardial perfusion imaging to improve noninvasive detection of coronary artery disease. J Nucl Cardiol 2010; 17: 19-26.
48. Gaemperli O, Kaufmann PA. Multimodality cardiac imaging. J Nucl Cardiol 2010; 17: 4-7.
49. Abidov A, Gallagher MJ, Chinnaiyan KM, Mehta LS, Wegner JH, Raff GL. Clinical effectiveness of coronary computed tomographic angiography in the triage of patients to cardiac catheterization and revascularization after inconclusive stress testing: Results of a 2-year prospective trial. J Nucl Cardiol 2009; 16: 701-13.
50. Schuijf JD, Wijns W, Jukema JW, Atsma DE, de Roos A, Lamb HJ, et al. Relationship between noninvasive coronary angiography with multi-slice computed tomography and myocardial perfusion imaging. J Am Coll Cardiol 2006; 48: 2508-14.
51. Kaufmann PA, Camici PG. Myocardial blood flow measurement by PET: Technical aspects and clinical applications. J Nucl Med 2005; 46: 75-88.
52. Camici PG, Rimoldi OE. The clinical value of myocardial blood flow measurement. J Nucl Med 2009; 50: 1076-87.
53. Heller GV, Calnon D, Dorbala S. Recent advances in cardiac PET and PET/TC myocardial perfusion imaging. J Nucl Cardiol 2009; 16: 962-9.
54. Cury RC, Feutchner G, Pena CS, Janowitz WR, Katzen BT, Ziffer JA. Acute chest pain imaging i the emergency deparment with cardiac computed tomography angiography. J Nucl Cardiol 2008; 15: 564-75.
55. Einstein AJ, Henzlova MY, Rajagopalan S. Estimating risk of cancer associated with radiation exposure from 64-slice computed tomography coronary angiography. JAMA 2007; 298: 317-23.
56. Berrington de Gonzalez A, Mahest M, Kim P-Y, Bhargavan M, Lewis R, Mettler F, et al. Projected cancer risks from computed tomographic scans performed in the United States in 2007. Arch Intern Med 2009; 169: 2071-7.
57. Smith-Bindman R, Lipson J, Marcus R, Kim KP, Mahesh M, Gould R, et al. Radiation dose associated with common computed tomography examinations and the associated lifetime attributable risk of cancer. Arch Intern Med 2009; 169: 2078-86.
58. Fazel R, Krumholz HM, Wang W, Ross JS, Chen J, Ting HH, et al. Exposure to low-dose ionizing radiation from medical imaging procedures. N Engl J Med 2009; 361: 849-57.
59. Raff GL, Chinnaiyan KM, Share DA, Goraya TY, Kazerooni EA, Moscucci M, et al. Radiation dose from cardiac computed tomography before and after implementation of radiation dose-reduction techniques. JAMA 2009; 301: 2340-8.
60. Earls JP, Berman EL, Urban BA, Curry CA, Lane JL, Jennings RS, et al. Prospectively gated transverse coronary CT angiography versus retrospectively gated helical technique: Improved image quality and reduced radiation dose. Radiology 2008; 246: 742-53.
61. Chang SM, Nabi F, Xu J, Raza U, Mahmarian JJ. Normal stress-only versus standard stress/rest myocardial perfusion imaging: Similar patient mortality with reduced radiation exposure. J Am Coll Cardiol 2010; 55: 231-3.
62. Bourque JM, Holland BH, Watson DD, Beller GA. Achieving an exercise workload of > or = 10 metabolic equivalents predicts a very low risk of inducible ischemia: Does myocardial perfusion imaging have a role. J Am Coll Cardiol 2009; 54: 538-45.
63. Husmann L, Valenta I, Gaemperli O, Adda O, Treyer V, Wyss CA, et al. Feasibility of low-dose coronary CT angiography: First experience with prospective ECG-gating. Eur Heart J 2008; 29: 191-7.
64. Husmann L, Valenta I, Kaufmann PA. Coronary angiography with low dose computed tomography at 1.4 mSv [abstract]. Herz 2008; 33: 75.
65. Rybicki FJ, Otero HJ, Steigner ML, Vorobiof G, Nallamshetty L, Mitsouras D, et al. Initial evaluation of coronary images from 320-detector row computed tomography. Int J Cardiovasc Imaging 2008; 24: 535-46.
66. Bengel FM, Higuchi T, Jvadi MS, Lautamäki R. Cardiac positron Emision Tomography. J Am Coll Cardiol 2009; 54: 1-15.
67. Patterson RE, Eisner RL, Horowitz SF. Comparison of costeffectiveness and utility of exercise ECG, single photon emission computed tomography, positron emission tomography, and coronary angiography for diagnosis of coronary artery disease. Circulation 1995; 91: 54-65.
68. Gould KL, Goldstein RA, Mullani NA. Economic analysis of clinical positron emission tomography of the heart with rubidium-82. J Nucl Med 1989; 30: 707-17.
69. Merhige ME, Breen WJ, Shelton V, Houston T, D’Arcy BJ, Perna AF. Impact of myocardial perfusion imaging with PET and (82)Rb on downstream invasive procedure utilization, costs, and outcomes in coronary disease management. J Nucl Med 2007; 48: 1069-76.
70. Jacklin PB, Barrington SF, Roxburgh JC, Jackson G, Sariklis D, West PA, et al. Cost-effectiveness of preoperative positron emission tomography in ischemic heart disease. Ann Thorac Surg 2002; 73: 1403-9.
71. Hoffmann U, Pena AJ, Cury RC, Abbara S, Ferencik M, Moselewski F, et al. Cardiac CT in emergency department patients with acute chest pain. Radiographics 2006; 26: 963-78.
72. Savino G, Herzog C, Costello P, Schoepf UJ. 64 Slice cardiovascular CT in the emergency department: Concepts and first experiences. Radiol Med (Torino) 2006; 111: 481-96.
73. Goldstein JA, Gallagher MJ, O’Neill WW, Ross MA, O’Neil BJ, Raff GL. A randomized controlled trial of multi-slice coronary computed tomography for evaluation of acute chest pain patients. J Am Coll Cardiol 2007; 49: 863-71.














