Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.27 no.1 Montevideo abr. 2012
ARTÍCULO ORIGINAL
Terapia de resincronización cardíaca: importancia de los cambios vasculares periféricos en la reducción de la poscarga ventricular y mejora de la eficiencia ventricular
Dres. Yanina Zócalo1, Daniel Bia2, Gonzalo Varela3, Juan González-Moreno4,
Fernando Calleriza3, Ricardo Luis Armentano 5, Walter Reyes-Caorsi 6
1. Prof. Adjunto, Depto. Fisiología, Facultad de Medicina, Universidad de la República. Directora Clínica, Centro Universitario de Investigación, Innovación y Diagnóstico Arterial (CUiiDARTE). Investigador (Nivel 1), Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación. Investigador (Grado 3), PEDECIBA-Biología. Colaborador Calificado, Depto. Cardiología, Facultad de Medicina, Udelar.
2. Prof. Adjunto Depto. Fisiología, Facultad de Medicina, Universidad de la República. Co-Director, CUiiDARTE. Investigador (Nivel 1), Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación. Investigador (Grado 4), PEDECIBA-Biología. Colaborador Calificado, Depto. Cardiología, Facultad de Medicina, Udelar.
3. Médico, Servicio de Electrofisiología, Sanatorio Casa de Galicia.
4. Médico, Departamento de Cardiología, Sanatorio Casa de Galicia.
5. Prof. Agregado Depto. Fisiología, Facultad de Medicina, Universidad de la República (Udelar). Co-Director, CUiiDARTE. Investigador (Nivel 2), Sistema Nacional de Investigadores, Agencia Nacional de Investigación e Innovación. Investigador (Grado 5), PEDECIBA-Biología. Colaborador Calificado, Depto. Cardiología, Facultad de Medicina, Udelar.
6. Médico, Director del Servicio de Electrofisiología, Sanatorio Casa de Galicia.
Instituciones responsables: 1) Servicio de Electrofisiología, Sanatorio Casa de Galicia. Montevideo, Uruguay. 2) Centro Universitario de Investigación, Innovación y Diagnóstico Arterial (CUiiDARTE; www.cuiidarte.fmed.edu.uy), Udelar.
Correspondencia: Dr. Yanina Zócalo. Depto. Fisiología, Facultad de Medicina, Universidad de la República. General Flores 2125, CP: 11800. Correo electrónico: yana@fmed.edu.uy
Financiamiento: Agencia Nacional de Investigación e Innovación (ANII, Proyecto FCE-2007-638).
Recibido marzo 15, 2012; aprobado mayo 5, 2012
Resumen
Introducción: la terapia de resincronización cardíaca (TRC) asociaría cambios vasculares que contribuirían a explicar sus beneficios y a comprender las diferencias en la respuesta a la terapia. Sin embargo, actualmente la evaluación de los efectos y respuesta a la TRC se centra únicamente en la estimación de los cambios en la estructura-función ventricular.
Objetivo: 1) caracterizar los cambios en la poscarga y energética ventricular izquierda asociados a la TRC, y 2) analizar la importancia de los cambios vasculares periféricos en el desempeño ventricular postTRC.
Método: en 25 pacientes (14 hombres, 61±12 años) consecutivos derivados para TRC, se evaluaron parámetros estándar de estructura y función ventricular y arterial, antes y después de TRC. Se obtuvo la presión aórtica central, el gasto cardíaco (GC), la carga arterial neta, poscarga y sus determinantes.
Resultado: la TRC resultó en aumento del GC y la complacencia arterial, y en reducción de la resistencia vascular periférica (RVP), impedancia aórtica, diámetros y volúmenes ventriculares (p<0,05). La conjunción de cambios ventrículo-arteriales resultó en reducción de poscarga (-19%). Si no hubiera caída de la RVP, la poscarga aumentaría (~44-56%), con reducción de la eficiencia ventricular.
Conclusión: la TRC resulta en reducción de la poscarga por cambios en las diferentes componentes de carga. Los beneficios de la TRC en términos de desempeño ventricular y reducción de la poscarga se explican por cambios ventriculares y vasculares (simultáneos). La mejora ventricular con aumento del GC sin cambios vasculares periféricos asociados resultaría en detrimento de las condiciones de trabajo ventricular (aumento de poscarga).
Palabras clave:
ARTERIAS
BIOMECÁNICA
ELECTROFISIOLOGÍA CARDÍACA
INSUFICIENCIA CARDÍACA
RESISTENCIA VASCULAR PERIFÉRICA
TERAPIA DE RESINCRONIZACIÓN CARDÍACA
Summary
Introduction: cardiac resynchronization therapy (CRT) would associate vascular changes that could contribute to CRT’s benefits and to understand differences in patients’ capability to respond to the therapy. However, when evaluating CRT’s working mechanisms and defining responders or non-responders only structural-functional cardiac changes are considered.
Aims: 1) to evaluate CRT short-term effects on cardiac energetics and afterload, and 2) to analyze the meaning of the peripheral vascular changes in the ventricle performance after-CRT.
Methods: cardiac and aortic echographies were done in 25 patients (age: 61±12 years; 14 men) before and after CRT. Standard structural, functional parameters and dyssynchrony indices were evaluated. Central pressure was derived using a transfer function and the diameter calibration method. Calculus: cardiac output, afterload, net arterial load and its determinants (central and peripheral components).
Results: CRT resulted in an increase in cardiac output and arterial compliance, and in a reduction in peripheral vascular resistances, aortic impedance and ventricular volumes (p<0,05). The cardiac and vascular changes associated with CRT determined an afterload reduction (-19%). Without a reduction in peripheral vascular resistances, CRT would result in an afterload increase (~44-56%) and in a reduction in the ventricle efficiency.
Conclusion: early after CRT central and peripheral arterial biomechanics improved, with a reduction in net arterial load. Simultaneous ventricular and vascular changes explain CRT benefits. An enhanced ventricular performance and cardiac output without peripheral vascular changes would result in detrimental changes in the ventricle’s working conditions (increased afterload).
Key words:
ARTERIES
BIOMECHANICS
CARDIAC ELECTROPHYSIOLOGY
HEART FAILURE
VASCULAR PERIPHERAL RESISTANCE
CARDIAC RESYNCHRONIZATION THERAPY
Introducción
La terapia de resincronización cardíaca (TRC) ha mostrado ser una estrategia terapéutica eficaz y eficiente para un subgrupo de pacientes con insuficiencia cardíaca. Sin embargo, los mecanismos que explican los beneficios de la TRC, así como la falta de respuesta a la misma en algun
os pacientes, no se conocen completamente. El principal mecanismo de trabajo de la TRC sería la optimización del patrón de activación mecánica del ventrículo izquierdo (VI) y la mejora de su capacidad funcional intrínseca (1,2). Adicionalmente se ha propuesto que la TRC asociaría cambios arteriales que contribuirían a los efectos cardiovasculares beneficiosos y a explicar las diferencias interindividuales en la capacidad de respuesta a la TRC (3-5). La existencia de cambios vasculares asociados a la resincronización cardíaca se fundamentaría en que ventrículo y arterias trabajan en forma acoplada, de manera que las propiedades arteriales dependen del ventrículo, a la vez que la carga arterial es determinante del desempeño ventricular. Sin embargo, actualmente la evaluación de la respuesta a la TRC y de sus efectos beneficiosos se centra en el análisis de los cambios a nivel cardíaco, sin tener en cuenta las condiciones y los cambios en la carga arterial. La importancia y el significado de evaluar el comportamiento arterial en pacientes con insuficiencia cardiaca y con indicación de TRC resulta aun más evidente si se tiene en cuenta el rol del desacople de carga en el desarrollo y la progresión de la insuficiencia cardíaca.
Recientemente, nuestro grupo ha descrito que a corto plazo la TRC asocia mejora de la biomecánica arterial y del acoplamiento ventrículo-arterial (6). Resta analizar la importancia relativa de los cambios arteriales en los efectos cardiovasculares beneficiosos resultantes de la TRC.
En este contexto, los objetivos del presente trabajo fueron: 1) caracterizar los cambios en la poscarga y energética ventricular izquierda asociados a la TRC, y 2) analizar la importancia de los cambios vasculares periféricos en el desempeño ventricular postTRC.Basados en trabajos previos (7-9), nuestra hipótesis fue que la TRC podría determinar cambios tempranos en la poscarga ventricular, y sus determinantes aórticos y periféricos, resultando en una reducción de la carga arterial neta que contribuiría a los beneficios de la TRC. Los cambios vasculares periféricos, específicamente la reducción en la resistencia vascular periférica (RVP), serían fundamentales en la mejora de las condiciones de trabajo ventricular, que hace a los beneficios de la TRC, ya que determinarían que el ventrículo trabaje “descargado” (poscarga ventricular reducida).
Revisión de la literatura
En el presente artículo se presenta un trabajo interdisciplinario realizado por especialistas en electrofisiología y especialistas en hemodinámica experimental y biomecánica cardiovascular destinado a evaluar en forma no invasiva los efectos a corto plazo de la TRC sobre la poscarga ventricular y sus determinantes. A continuación se describen los fundamentos teóricos relacionados con el análisis hemodinámico y biomecánico realizado, los que deben tenerse en cuenta para la comprensión del abordaje propuesto y de los resultados presentados.Un desarrollo detallado de la teoría que subyace en nuestro análisis está fuera del alcance del artículo. Asimismo, importa remarcar que lo incluido en este apartado tiene las fortalezas y debilidades propias de cualquier abordaje que mediante modelos físico-matemáticos intente describir o caracterizar algo tan complejo como es la realidad. Más aún, teniendo en cuenta que nuestro objetivo fue generar un marco conceptual sólido pero suficientemente simple como para ser utilizado en la práctica clínica.
Poscarga o carga ventricular: definición y variables determinantes
La poscarga ventricular es el estrés (s) o tensión que desarrollan las paredes ventriculares durante la fase eyectiva, determinada por todas las fuerzas que se oponen a la eyección ventricular. En forma más exacta, a la vez que simple, el estrés (poscarga) puede definirse (y calcularse) considerando tres principales determinantes: 1) la presión que el ventrículo debe desarrollar durante la eyección, que de no existir alteraciones en la unión ventrículo-arterial, será similar a la presión aórtica durante la fase eyectiva, y 2) la relación entre el radio y el espesor parietal ventricular durante la fase eyectiva (ecuación 1):
Teniendo en cuenta lo anterior, resulta evidente que la poscarga ventricular no es constante sino que varía, siendo determinada instantáneamente por las tres variables descritas (presión, radio y espesor). En condiciones fisiológicas los mayores niveles de estrés, y por tanto de poscarga, se alcanzan al inicio de la eyección, cuando existe el mayor radio y menor espesor ventricular, un nivel de presión ventricular elevado e igual a la presión diastólica aórtica. En diversas situaciones los niveles de poscarga pueden variar y/o el momento en que se alcanza el máximo modificarse. Por ejemplo, en situaciones en que existen elevados niveles de rigidez arterial y/o de la resistencia vascular periférica, el arribo de las reflexiones de ondas a la raíz aórtica en plena fase eyectiva (en lugar de en la fase diastólica) puede determinar que el máximo nivel de poscarga se alcance en la parte media de la eyección.
Clasificación de los determinantes de la poscarga ventricular
Los determinantes de la poscarga pueden clasificarse en dos grupos principales como se muestra en la figura 1. Los determinantes intrínsecos o ventriculares están representados por factores geométricos ventriculares (espesor y radio ventricular). Para cualquier nivel de presión ventricular desarrollada, ventrículos con mayores espesores o menores radios, alcanzarán menores niveles de estrés durante la eyección y, consecuentemente, menor será la poscarga. En relación directa con nuestro trabajo, cambios geométricos (en volumen y/o espesor ventricular) asociados a la TRC modificarían el factor intrínseco de la poscarga.
Los determinantes extrínsecos o vasculares son en términos cuantitativos los principales determinantes de la oposición a la eyección ventricular. Ellos determinan, por diferentes mecanismos, los niveles de presión aórtica. Consecuentemente, al determinar indirectamente la presión que deberá desarrollar el ventrículo para poder eyectar, son determinantes del estrés ventricular durante la eyección.
Resistencia vascular sistémica o periférica
Entre los determinantes extrínsecos de la poscarga, la RVP representa el componente estático o estable, siendo responsable de cerca de 80%-90% del nivel de poscarga, mientras que el componente dinámico o pulsátil depende de las características geométricas, biomecánicas y propagatorias del sistema arterial. El término estático o estable refiere a que la RVP determina un nivel de oposición a la eyección que puede considerarse invariable (estable) durante la eyección. Más precisamente, la RVP es el principal determinante del nivel de presión arterial media (y diastólica) existente en el sistema vascular, nivel medio de presión en torno al cual trabaja el corazón en cada eyección. Una elevación de la RVP determina aumento en los niveles de presión arterial media y consecuentemente aumento de la poscarga. Asimismo, el nivel de RVP será indirectamente determinante del nivel de reflexión de ondas.
El componente dinámico de la poscarga depende principalmente de tres factores (10): 1) visco-elasticidad (o rigidez) arterial; 2) impedancia característica o local aórtica, y 3) velocidad de propagación y nivel de reflexión de la onda del pulso.
Visco-elasticidad arterial
En términos biomecánicos, un material con elevada respuesta visco-elástica (o para simplificar, elasticidad) requiere una elevada carga, fuerza o tensión para alcanzar un determinado nivel de deformación. Es decir, en contraposición a la forma coloquial en que su utiliza el término, un material con elevada respuesta elástica representa un material con elevada resistencia a la deformación (elevada rigidez). El reducido módulo elástico de la aorta, en comparación con el de otras arterias (11,12), le permite distenderse durante la eyección ventricular, almacenando volumen y permitiendo reducir la presión de pulso arterial y la carga soportada por la pared ventricular. Adicionalmente, a menor nivel de elasticidad (mayor complacencia o distensibilidad) mayor almacenamiento de volumen durante la eyección ventricular y, consecuentemente, más eficiente el rol de bomba sanguínea accesoria durante la relajación ventricular.
Aumentos en la rigidez arterial, como los observados en diversas situaciones patológicas o por el envejecimiento arterial, hacen que durante la eyección se generen mayores niveles de presión y, consecuentemente, sea mayor la presión que debe desarrollar el ventrículo para vencer la oposición a la eyección impuesta por el propio sistema arterial. Cambios en visco-elasticidad influencian la poscarga no solo por efecto local, sino también por modificar la velocidad de propagación de las ondas que viajan desde el corazón a la periferia y de los sitios periféricos de reflexión al corazón.
Cambios en la respuesta visco-elástica parietal pueden ser resultado de diferentes factores: 1) Cambios en la estructura o composición parietal (por ejemplo: remodelado arterial en la hipertensión arterial y/o vasculopatías específicas), 2) Cambios agudos pasivos, secundarios a variaciones de la presión y/o activos, por cambios en la activación del músculo liso vascular. Respecto a esto último, nuestro grupo ha trabajado en caracterizar los efectos de cambios en el tono o activación del músculo liso vascular en el comportamiento biomecánico arterial y en el análisis del significado y asociación de los cambios del músculo liso y la respuesta a terapéuticas cardiovasculares (13-16). Particularmente, cabe señalar que hemos observado que modificaciones en los patrones de flujo postTRC determinarían cambios biomecánicos en el sistema cardiovascular, asociados a variaciones en la activación del músculo liso vascular (6).
Impedancia característica aórtica
La impedancia característica aórtica (Zc) representa la impedancia (resistencia variable dinámica) aórtica al flujo sanguíneo si no existieran reflexiones de onda. La misma es conceptualmente determinada por la relación o cociente entre la visco-elasticidad (rigidez) arterial y el diámetro (o área de sección transversal) arterial (10,17), y es la principal determinante de la relación instantánea inicial (antes que arriben las reflexiones de ondas), y casi lineal, entre el flujo sanguíneo y la presión arterial durante la eyección ventricular (17). Una aorta (o tubo) con un determinado nivel de respuesta elástica presentará menor resistencia a la eyección (menor poscarga), cuanto mayor sea su diámetro o área de sección transversal. Por otra parte, para un mismo diámetro, la arteria con menor respuesta visco-elástica (menor rigidez) será la que presente menor impedancia al flujo.
Reflexiones de ondas
La velocidad de propagación y el nivel de reflexión periférica de la onda del pulso son importantes determinantes de la poscarga dinámica al establecer el momento en que se suman las ondas incidente y reflejada en la aorta ascendente y la amplitud de las ondas reflejadas. En cada eyección, el volumen que está siendo eyectado y comprime la sangre existente en la aorta genera ondas que se propagan por la sangre y pared vascular desde el corazón a la periferia (ondas incidentes) a través de las grandes, medianas y pequeñas arterias (figura 2). En sitios en los que las ondas incidentes encuentran discontinuidad en las propiedades mecánicas o geométricas del árbol arterial (por ejemplo, bifurcaciones, terminaciones arteriales, arteriolas) se generan ondas reflejadas o retrógradas que desde el sitio de reflexión viajan hacia el corazón y que arriban a la unión ventrículo-aórtica (figura 3). La existencia de ondas incidentes y reflejadas determina que en cualquier localización arterial las ondas de presión y flujo estén formadas por la suma de ondas incidentes y reflejadas (figura 3).
En condiciones fisiológicas en la aorta ascendente las reflexiones llegan al final de la eyección e inicio de la fase diastólica determinando un efecto beneficioso para la perfusión miocárdica (aumento de la presión diastólica aórtica) y sin afectar prácticamente la poscarga. Sin embargo, en situaciones en las que aumenta la velocidad de propagación (por ejemplo, estados con rigidez arterial aumentada) y/o en las que las ondas reflejadas presentan mayor amplitud (Ejemplo: estados con elevado coeficiente de reflexión, por aumento de las RVP), las ondas reflejadas arriban a la unión ventrículo-arterial en plena fase eyectiva, determinando aumento de la presión sistólica y por lo tanto de la poscarga (figura 3). En nuestro trabajo se analizaron los cambios en las reflexiones de ondas asociados a la TRC, cuantificando el coeficiente de reflexión periférico (G).
Finalmente cabe mencionar que la poscarga, o más precisamente la carga arterial neta impuesta al ventrículo puede analizarse mediante cuantificación de la elastancia arterial (EA). Esta depende de variables hemodinámicas y no es indicador de una propiedad arterial específica, sino un índice que integra los componentes estáticos y dinámicos de la carga arterial (18,19). Conociendo los determinantes de la carga arterial neta es posible cuantificar la EA, aunque esta generalmente se cuantifica como el cociente entre presión de fin de sístole ventricular (o arterial) y el volumen eyectado. Distintas combinaciones del componente resistivo y del comportamiento biomecánico de las grandes arterias podrían modificar la EA (20), a la vez que cambios en la resistencia y biomecánica arterial podrían resultar en cambios en el trabajo eyectivo, manteniendo constante la EA. Consecuentemente, una adecuada evaluación e interpretación de la carga arterial neta (y de sus cambios) requiere analizar separadamente sus componentes principales (18): Zc aórtica, RVP y complacencia total (CT) (10).
Trabajo y eficiencia ventricular
El trabajo es el producto de una fuerza aplicada sobre un elemento y el desplazamiento lineal (distancia o longitud) que se le impone al elemento. Fuerza es la presión aplicada a una superficie (F = presión * superficie). Consecuentemente, el trabajo puede definirse como el producto de la presión*superficie*distancia. En el caso del sistema ventrículo-arterial, el trabajo ventricular puede describirse como el producto de la presión desarrollada por el ventrículo y el volumen desplazado. Analizando esto en el gráfico presión-volumen ventricular (figura 4), vemos que el trabajo ventricular puede descomponerse en dos componentes: trabajo interno y trabajo externo. El trabajo externo o eyectivo es el desarrollado para lograr la eyección ventricular y, consecuentemente, considera la presión desarrollada para poder eyectar y el desplazamiento o cambio de volumen durante la eyección (volumen eyectado). Sin embargo, es claro que el ventrículo comienza a llenarse desde un determinado nivel de presión y de volumen que no es igual a 0. El nivel de presión y de volumen desarrollado por el ventrículo para estar “en posición”, como para comenzar a llenarse, se denomina trabajo interno o potencial, ya que no representa un gasto energético que se encuentre directamente asociado a cumplir su función eyectiva. La suma del trabajo o energía interna y externa representan el trabajo total. Cuanto mayor sea la proporción del trabajo (o energía) total utilizada para eyectar, más eficiente será el ventrículo desde el punto de vista energético (figura 4). Por otra parte, el gasto energético o el trabajo desarrollado por el ventrículo para vencer el componente estable de la poscarga es considerado un costo necesario y requisito ineludible para asegurar un flujo continuo en la microcirculación. Contrariamente, el gasto energético ventricular utilizado para generar o vencer las características dinámicas o pulsátiles de las grandes arterias se considera un costo o derroche energético resultante de la incapacidad ventricular para generar flujos continuos y estables en el sistema arterial (10). De todas maneras, el costo a pagar por tener un corazón pulsátil, incapaz de generar un flujo continuo, es mucho menor que el que se gastaría en términos energéticos si el corazón fuera una bomba continua. Además debe tenerse en cuenta que el costo adicional por tener un corazón pulsátil permite que el corazón al relajarse y no eyectar sea “autoperfundido por la sangre que eyectó”. De todas formas, es claro que elevadas pulsaciones generadas en cada eyección aumentan en forma ineficiente el trabajo y consumo de oxígeno ventricular. Consecuentemente, un nivel adecuado de flujo sanguíneo periférico regulado por las resistencias periféricas y ajustado a la tasa metabólica tisular debe ser asegurado, controlando y minimizando la poscarga dinámica y manteniendo la poscarga estática en niveles que no generen una desmedida oposición a la eyección (10).
Materiales y métodos
Pacientes y diseño experimental
Se incluyeron 25 pacientes (edad: 61±12 años; 14 hombres) que se encontraban en clase funcional III o IV de la New York Heart Association (NYHA) a pesar de tratamiento médico óptimo, con fracción de eyección del VI <35% (28%±7%, rango 14%-34%) y duración del complejo QRS >120 ms (139±20 ms), los que fueron derivados en forma consecutiva para implante de marcapaso con resincronizador. En ocho pacientes la etiología de la insuficiencia cardíaca era isquémica. El tratamiento farmacológico incluyó b-bloqueantes (n=21), inhibidores de la enzima de conversión o bloqueadores del receptor de angiotensina (n=18), diuréticos (n=14), espironolactona (n=13) y glucósidos cardíacos (n=6). No hubo modificación del tratamiento durante el período de seguimiento.
El estudio contó con la aprobación del Comité de Ética y se obtuvo consentimiento informado. El protocolo del estudio estuvo de acuerdo con la Declaración de Helsinki.
Registros y parámetros derivados
En todos los pacientes se realizó examen clínico y estudio ecográfico cardíaco y aórtico antes (pre TRC) y después (post TRC; 23±12 días) de la TRC. Los estudios cardíacos y vasculares se realizaron de acuerdo con recomendaciones internacionales (21-23). Los registros se obtuvieron en un ambiente tranquilo, luego de reposo en posición supina. Al inicio y finalización de los estudios se registró la presión arterial braquial (esfigmomanometría). El valor medio (coeficiente de variación <5%) fue usado en el análisis de los datos.
Evaluación ecocardiográfica: estructura y función ventricular y sincronía mecánica
Se cuantificaron parámetros estándar de estructura y función cardíaca. Los estudios ecocardiográficos se realizaron usando un sistema de imágenes comercial (Hewlett-Packard, Sonos 5500, Andover, MA, USA; transductor de 3,5 MHz). Luego de la optimización y estabilización de la señal (ajuste de filtros y ganancias) se cuantificó la fracción de eyección del VI mediante el método de detección automática de bordes (Hewlett-Packard, Sonos 5500, Andover, MA, USA). Durante el estudio ecográfico se registró el electrocardiograma.
Se evaluó la sincronía mecánica atrioventricular, intraventricular e interventricular, teniendo en cuenta las recomendaciones de la ASE (American Society of Echocardiography) (23). El retardo (desfase) tabique o septum-pared posterior se analizó usando ecografía modo M. Para ello, luego de obtener imágenes en vista paraesternal eje largo, el cursor del modo M se posicionó a nivel medioventricular. Posteriormente se determinó la diferencia temporal entre el pico del desplazamiento septal y el de la pared posterior. Una diferencia ³ 130 ms se consideró marcador de disincronía axial. La presencia de disincronía longitudinal se evaluó determinando la diferencia entre el tabique y la pared lateral en el tiempo inicio del QRS-velocidad sistólica pico en la región. Una diferencia ³ 100 ms se consideró indicador de disincronía. Para evaluar la presencia de disincronía interventricular se determinó la diferencia entre los ventrículos en el tiempo al inicio de la eyección, medido como tiempo entre QRS-inicio del flujo en el tracto de salida ventricular. Una diferencia ³ 40 ms se consideró marcadora de disincronía. Finalmente, la sincronía atrioventricular se evaluó como el porcentaje del ciclo cardíaco correspondiente al llenado (Doppler pulsado a nivel mitral). Un llenado <40% se consideró indicador de disincronía.
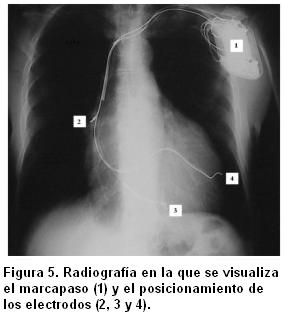
Los electrodos auricular y del ventrículo derecho se implantaron en forma convencional. El electrodo del VI se implantó vía subclavia y teniendo en cuenta los resultados de la evaluación de la sincronía mecánica antes de la TRC, siempre que fue posible el electrodo se posicionó de manera de estimular la región de mayor retraso (figura 5).
Evaluación de la función biomecánica arterial
La función biomecánica local aórtica se caracterizó mediante análisis del diámetro, velocidades de flujo sanguíneo y presión central aórtica. Para evaluar el diámetro se registraron videos (10 segundos) de la aorta ascendente visualizada en eje largo (ecografía modo B). Las imágenes del corte longitudinal de la aorta se analizaron off-line usando un algoritmo paso a paso aplicado a cada una de las imágenes digitizadas (región de interés aproximada: 2,0 cm por encima de la válvula aórtica) (14). El software de análisis permite obtener simultáneamente las señales temporales de diámetro arterial y de espesor arterial. La señal de velocidad del flujo sanguíneo aórtico (cinco latidos) se obtuvo usando Doppler continuo. Para el análisis se obtuvo un promedio de las señales de diámetro y flujo.
Como es sabido, comparada con la presión periférica (braquial), la presión central aórtica brinda información más precisa de la poscarga, tiene mayor valor pronóstico y daría una información más adecuada para el monitoreo de la eficacia terapéutica (10,21). Teniendo en cuenta lo anterior, en este trabajo se obtuvo la onda de presión central aórtica y sus niveles mediante el método de calibración de la onda de diámetro (24) y el uso de una función transferencia generalizada (FT) (25). En el primer caso, las ondas de diámetro aórtico se calibraron usando el método propuesto por Vermeersch y colaboradores (24), modificado del de Meinders and Hoeks (26). El método asume una relación exponencial entre diámetro y presión:
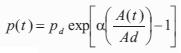
con
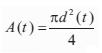
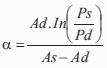
donde p(t) es la onda de presión, d(t) es el diámetro, A(t) el área de sección transversal arterial en función del tiempo, Pd y Ps son la presión de fin de diástole y sistólica pico, respectivamente, Ad y As el área de fin de diástole y sistólica pico, respectivamente, y a el coeficiente de rigidez parietal presión-independiente (26). Para usar la ecuación 2 para el cálculo de la onda de presión a partir de la onda de diámetro, los niveles de presión sistólica y diastólica deben obtenerse en el mismo sitio que el área de sección transversal. Si asumimos que en la posición decúbito la presión media y diastólica son constantes en las grandes arterias (10), el esquema iterativo puede usarse para determinar a basado en los niveles de presión media y diastólica braquial (24,26). Para ello, de acuerdo con Meinders y colaboradores (26) la presión media se calculó a partir del registro braquial como: pPAM = pPAD + (pPAS - pPAD)/3, donde pPAM, pPAD y pPAS, son presión arterial media, diastólica y sistólica, respectivamente. Luego de obtener la onda de presión central aórtica, la presión diastólica y de pulso se derivó de la onda de diámetro usando el modelo exponencial (cPASE, cPADE).
Para el segundo abordaje se aplicó un método basado en el uso de una función transferencia general (FT) (25). A partir de pPAS y pPAD se obtuvo la presión central sistólica (cPASFT) y diastólica (cPADFT) (25):
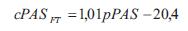
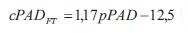
Poscarga ventricular, elastancia arterial y trabajo y eficiencia ventricular
La poscarga o estrés ventricular durante la eyección se cuantificó como:
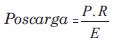
donde P es la presión sanguínea (en dinas/cm2 = mmHg*1.333,22), E (en cm) es el espesor ventricular, y R (en cm) el radio ventricular de fin de diástole, calculado a partir del volumen ventricular:
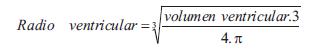
Mediante esta ecuación, utilizando la presión aórtica diastólica mínima, la sistólica máxima y la media, se cuantificó la poscarga ventricular de inicio de eyección, la poscarga ventricular máxima teórica y la poscarga ventricular media, respectivamente.
La elastancia arterial (EA) se calculó como:
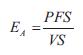
donde VS es el volumen sistólico y PFS la presión de fin de sístole (figura 5).
El GC se calculó como el producto del volumen sistólico y la frecuencia cardíaca (FC).El trabajo o energía externa ventricular (trabajo sistólico o eyectivo, WE), el trabajo o energía interna o potencial (WI), y la eficiencia mecánica se calcularon como (27,28):
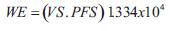
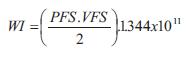
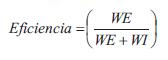
siendo 1.334 x 10-4 el factor para convertir mmHg/ml en Joules (28).
Determinantes de la carga arterial: propiedades vasculares centrales y periféricas
Para evaluar en forma integral los determinantes de la carga arterial cuantificamos parámetros arteriales biomecánicos y hemodinámicos, centrales y periféricos (21). Las propiedades locales de la aorta ascendente se cuantificaron en términos de Zc y complacencia del área de sección transversal (CA) (10). La Zc se calculó utilizando un método en el dominio temporal a partir de la relación instantánea del ascenso sistólico de presión y flujo por encima de los niveles diastólicos en la sístole temprana (17). La CA, índice usado en la práctica clínica, dado que se obtiene a partir de valores de presión y diámetro sistólicos y diastólicos (21), se calculó como:
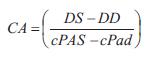
donde DS y DD son los diámetros internos sistólico y diastólico, respectivamente.
Las propiedades globales o sistémicas se cuantificaron en términos RVP, CT y G. La RVP se calculó como (6):
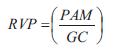
siendo PAM y GC la presión arterial media y el gasto cardiaco, respectivamente. La CT se calculó usando el método de presión de pulso (29) y G se calculó como ( ):
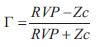
Análisis teórico: rol de los cambios vasculares y/o ventriculares en los cambios cardiovasculares post TRC
Para analizar el significado de los cambios vasculares periféricos (RVP) y/o de la geometría ventricular (espesor y/o radio) en los cambios en las condiciones de trabajo ventricular y beneficios cardiovasculares asociados a la TRC (evidenciados en términos de reducción de poscarga), se determinó el nivel de poscarga teóricamente esperado si el cambio observado en GC hubiese ocurrido con y sin modificaciones de RVP, espesor y/o radio ventricular.
Análisis estadístico
Los efectos a corto plazo de la TRC y los potenciales cambios resultantes del análisis teórico descrito se evaluaron comparando los datos obtenidos antes y después de la TRC, usando test de t de Student pareado. Los análisis estadísticos se realizaron usando SPSS 15.0 software (SPSS Inc., Chicago, IL, USA). Una p<0,05 se consideró estadísticamente significativa.
Resultados
Luego de la TRC mejoró la capacidad funcional de los pacientes, evaluada de acuerdo a la clase funcional de la NYHA (3,3±0,5 vs. 2,0±0,6 respectivamente). No hubo cambios significativos en la FC ni en la presión arterial asociados a la TRC (tabla 1).
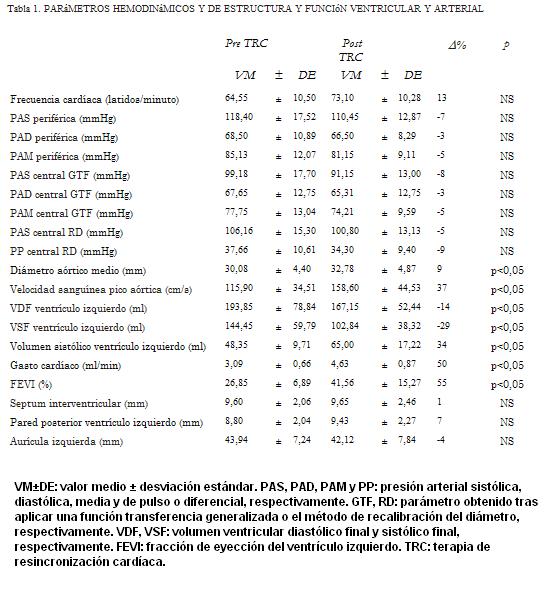
La TRC resultó en aumento de la fracción de eyección (FEVI) (p<0,05) (tabla 1). Definiendo la respuesta a la TRC como cambio en la FEVI ³ 15%, cuatro pacientes fueron no respondedores. Por otra parte, seis pacientes (24%) fueron no respondedores cuando la respuesta se analizó en términos de cambio en el volumen de fin de sístole (punto de corte: cambio en el volumen >15%) (23).
Considerando la disincronía mecánica intraventricular, el sitio de preferencia para implante del electrodo del VI fue una vena lateral o posterolateral. La mayoría de los electrodos se implantaron en la región basal-medioventricular posterior (48%) y lateral (40%). Por razones anatómicas y/o técnicas en los restantes casos (12%) el electrodo se posicionó en la región anterior.
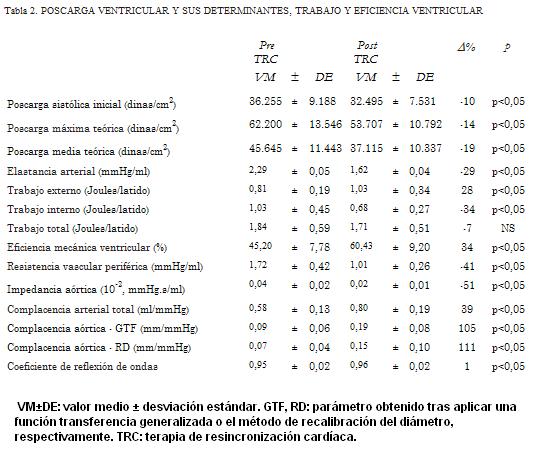
Parámetros ventrículo-arteriales pre TRC y post TRC
En el corto plazo luego de la TRC aumentó el diámetro aórtico (dilatación) (p<0,05), a pesar de la reducción (no significativa) de la presión que podría haber resultado en reducción presión-dependiente del diámetro (tabla 2). La TRC asoció aumento en el pico flujo aórtico (p<0,05) (tabla 1).
La TRC se asoció con reducción del volumen de fin de sístole y diastólico del VI (p<0,05) y aumento en el volumen sistólico (p<0,05) (tablas 1 y 2). El GC aumentó post TRC (p<0,05).
La mejora en el desempeño ventricular se evidenció al analizar el trabajo o energía y la eficiencia energética ventricular. La energía total no se modificó, pero una mayor proporción de la misma se usó para realizar trabajo externo con el consecuente aumento de la eficiencia (p<0,05) (tabla 2).
Propiedades arteriales biomecánicas y funcionales
La complacencia aórtica aumentó luego de la TRC, indicando reducción en la rigidez aórtica (p<0,05) y mejora en la función de amortiguamiento arterial. Adicionalmente se redujo la Zc (p<0,05), indicando reducción de la resistencia al flujo y mejora en la función de conducción aórtica (tabla 2).
La TRC asoció reducción en la RVP y aumento en la complacencia global (reducción de la rigidez global del sistema arterial) (p<0,05) (tabla 2). La interrelación entre el cambio central y el periférico en la impedancia al flujo sanguíneo resultó en reducción del coeficiente de reflexión (G) (p<0,05), indicando menor magnitud de las ondas reflejadas (tabla 2). Esto, junto a la reducción de la rigidez arterial determina que luego de la TRC haya menor contribución sistólica de las ondas reflejadas.
Cambios vasculares periféricos y geométricos ventriculares: rol en los cambios cardiovasculares post TRC
Al analizar las características de las condiciones de trabajo ventricular post TRC, en términos de cambios en la carga (poscarga) encontramos que de no haber reducción de la RVP, la mejora de la función ventricular (aumento del GC) se asociaría a aumento de la poscarga (44%), que sería aun mayor (56%) si tampoco hubiera cambios en la geometría ventricular. Por otra parte, si la RVP se redujera, pero no se modificaran los factores geométricos ventriculares, la poscarga ventricular se reduciría; si bien la reducción sería menor que la observada cuando la caída de la RVP post TRC se produce conjuntamente con cambios en la geometría ventricular (tabla 2).
Discusión
En este trabajo se evaluó en forma no invasiva los efectos a corto plazo de la TRC en la energética ventricular y en la carga arterial neta, descomponiéndola en sus principales determinantes estáticos y dinámicos. La caracterización de los cambios en poscarga y energética ventricular izquierda asociados a la TRC permitió analizar la importancia de los cambios vasculares periféricos en el desempeño ventricular post TRC.
Los principales hallazgos fueron:
- La TRC resultó en aumento de la eficiencia ventricular y reducción de la carga arterial (poscarga).
- Los cambios en la carga arterial post TRC resultaron de la reducción isobárica en los componentes estáticos y dinámicos, centrales y periféricos de la carga arterial.
- Los cambios en la RVP posibilitan que la mejora en la capacidad funcional ventricular asociada a la TRC ocurra en condiciones de trabajo (poscarga) y desempeño (eficiencia) ventricular optimizadas.
La mejora en la capacidad funcional ventricular post TRC, descrita previamente y observada en nuestro trabajo, no se asoció a aumento significativo en la energía o trabajo ventricular total por latido, sino a un aumento en la fracción de energía destinada a la movilización de sangre hacia el sistema arterial, principal objetivo de la función ventricular (tabla 2). Por lo tanto, puede decirse que a corto plazo la TRC resulta en una mejora de la función sistólica ventricular, con aumento simultáneo de la eficacia y eficiencia (mayor capacidad para realizar trabajo y mayor proporción de energía destinada al trabajo eyectivo). Los cambios en la capacidad funcional ventricular ocurrieron conjuntamente con cambios beneficiosos en la carga ventricular, ya que luego de la TRC se redujo la poscarga ventricular (el ventrículo fue “descargado”). En forma análoga a lo que ocurre con otras estrategias de tratamiento empleadas en sujetos con falla cardíaca (por ejemplo, balón de contrapulsación intraórtica (30), contrapulsación externa (31)), la reducción en la carga arterial post TRC fue resultado de cambios tanto en sus determinantes estáticos como dinámicos (centrales y periféricos). Específicamente, luego de la TRC se observaron cambios en la impedancia (Zc) y rigidez (CA) aórticas, RVP, complacencia total y G (tabla 2). La conjunción de cambios beneficiosos en la impedancia y rigidez de grandes arterias y en la resistencia vascular periférica, con la consecuente reducción de la resistencia al flujo sanguíneo, es de particular importancia en una enfermedad en la que el aumento en la capacidad de conducción y amortiguamiento arterial podría contribuir a mejorar el flujo sanguíneo regional y/o global (31). Importa señalar que en los cambios en RVP y complacencia total asociados a la TRC podrían contribuir a explicar el aumento en el GC (~47%), sin cambios significativos en la presión y FC. Más adelante se analizan los mecanismos que explicarían los cambios vasculares periféricos y el significado de los mismos en el contexto de los cambios cardiovasculares beneficiosos asociados a la TRC. Como fuera mencionado, las variaciones fisiológicas en la geometría y mecánica arterial son mediados fundamentalmente por cambios en presión, frecuencia cardiaca, tono del músculo liso y/o estructura vascular (por ejemplo: remodelado). Factores presión-independiente serían determinantes de los cambios vasculares observados en este trabajo post TRC, ya que las variaciones en presión fueron despreciables y el diámetro arterial aumentó, en lugar de reducirse, como se hubiera esperado si se consideraran los cambios en presión. El análisis isobárico permite establecer que luego de la TRC aumentó el diámetro aórtico y disminuyó la rigidez arterial. Asimismo, el análisis isométrico mostró reducción en la rigidez arterial.
El trabajo presentado no fue diseñado para evaluar los mecanismos que explican los cambios geométricos y biomecánicos, pero los resultados obtenidos sugieren que los mismos estarían relacionados con cambios en el tono del músculo liso vascular. Al respecto, los cambios geométricos (dilatación aórtica y periférica) y biomecánicos (reducción isobárica de la rigidez vascular) son consistentes con un patrón de relajación muscular lisa (8,9,16). Por otra parte, los cambios en las propiedades vasculares se asociaron a variaciones en el flujo sanguíneo. Como es sabido, un aumento en el flujo sanguíneo aumenta el estrés de cizallamiento en la pared arterial y, consecuentemente, determina relajación muscular lisa (relajación mediada por flujo), que resulta en dilatación y reducción de la rigidez arterial (10). En relación con lo anterior ha sido demostrado que el restablecimiento (o mejora) de las condiciones hemodinámicas podría resultar en cambios humorales (por ejemplo, reducción de la activación del sistema renina-angiotensina), parte de un círculo virtuoso de cambios cardiovasculares que podrían actuar modificando el tono muscular liso (con o sin dependencia de factores endoteliales) (32). Por otra parte, cabe señalar que se demostró que la TRC resulta en mejoría del balance simpato-vagal, con reducción de la actividad simpática periférica y mejora de la actividad simpática cardíaca (33-35). Los hallazgos descritos en relación con los cambios autonómicos y humorales podrían contribuir a la comprensión de nuestros resultados y son consistentes con la propuesta de la existencia de relajación muscular lisa en la base de los mismos. En particular, los hallazgos descritos y la existencia de relajación muscular lisa permitirían explicar los cambios vasculares periféricos (reducción de RVP) cuyo significado en los cambios cardiovasculares asociados a la TRC se analizó en este trabajo. Al respecto, considerando que el objetivo, los cambios primarios y el principal mecanismo de acción de la TRC son cambios en la capacidad funcional y el remodelado ventricular, en este trabajo nos propusimos analizar la contribución o rol de los cambios en la periferia vascular en la mejora del desempeño ventricular. El análisis realizado evidencia que los mayores beneficios en las condiciones de trabajo y desempeño ventricular se obtienen cuando los cambios en la función ventricular ocurren conjuntamente con cambios en RVP y geometría ventricular. Por el contrario, si no hubiera reducción de la RVP, los cambios en el desempeño ventricular asociados a la TRC ocurrirían con aumento de la carga (mayor poscarga) y menor eficiencia ventricular. Por lo tanto, la capacidad del sistema vascular de responder a la TRC (a los cambios cardíacos iniciales) sería factor determinante de los efectos beneficiosos de la TRC en el sistema cardiovascular. La importancia de los cambios vasculares es aun más evidente si se tiene en cuenta que en sujetos con falla cardíaca la poscarga ventricular está frecuentemente elevada (36,37), lo que en sí mismo representa un factor detrimental adicional para el corazón insuficiente.Teniendo en cuenta los resultados descritos, la evaluación de los cambios hemodinámicos, de la carga arterial neta y de sus determinantes, podría contribuir a comprender los mecanismos que subyacen a los cambios cardiovasculares asociados a la TRC y a las diferencias interindividuales en la capacidad de respuesta a la TRC. Adicionalmente, la evaluación vascular permitiría obtener información potencialmente útil para guiar el tratamiento de los pacientes antes y después de la TRC (por ejemplo, para maximizar estrategias de tratamiento dirigidas a modular la carga arterial) y en la selección de pacientes para TRC, particularmente en aquellas circunstancias en las que la indicación u oportunidad de la terapia podría ser discutida. En relación con lo anterior, encontramos que los cambios en la carga arterial post TRC se asociaron a los niveles de carga basal (pre TRC); de manera que cuanto peores las condiciones basales, mayores los cambios esperados post TRC (6). Para finalizar, cabe señalar que el abordaje no invasivo empleado para evaluar la carga arterial y sus determinantes podría aplicarse en la práctica clínica, ya que los parámetros evaluados brindan información precisa, a la vez que pueden obtenerse en forma rápida, sencilla y con bajo costo relativo (21).
Conclusión
En el corto plazo, la TRC se asocia a aumento de la eficiencia ventricular y reducción de la carga arterial (poscarga). Los cambios en la carga arterial resultan de la reducción isobárica de los componentes estáticos y dinámicos, centrales y periféricos. Los cambios en la RVP posibilitan que la mejora en la capacidad funcional ventricular asociada a la TRC ocurra en condiciones de trabajo (poscarga) y desempeño (eficiencia) ventricular optimizadas.
Agradecimiento
A las Sras. Estela Porto, Stella Domínguez y Lorena Papantonakis por su colaboración en la coordinación de los estudios. Al Sr. Elbio Agote por su asistencia durante el procesamiento de las señales ecocardiográficas.
Bibliografía
1. Kass DA. Pathophysiology of cardiac dyssynchrony and resynchronization. In: Kenneth A. Ellenbogen, Bruce L. Wilkoff, G. Neal Kay, editors. Device therapy for congestive heart failure. Philadelphia: Saunders, 2004: 27-46.
2. Leclercq C, Kass DA. Retiming the failing heart: principles and current clinical status of cardiac resynchronization. J Am Coll Cardiol 2002; 39: 194–201.
3. Berman A, Wokhlu A, Gilliam III F. Cardiac resynchronization therapy and ventriculo-arterial coupling: Improvements in left ventricular mechanics independent of vascular compliance. Heart Rhythm 2005; 2: S93.
4. Steendijk P, Tulner S, Bax J, Oemrawsingh PV, Bleeker GB, van Erven L, et al. Hemodynamic effects of long-term cardiac resynchronization therapy analysis by pressure-volume loops. Circulation 2006; 113: 1295-304.
5. Zanon F, Aggio S, Baracca E, Pastore G, Corbucci G, Boaretto G, et al. Ventricular-arterial coupling in patients with heart failure treated with cardiac resynchronization therapy: may we predict the long-term clinical response? Eur J Echocardiogr 2009; 10: 106-11.
6. Zócalo Y, Bia D, González-Moreno JB, Torrado J, Varela G, Calleriza F, et al. Cardiac resynchronization results in aortic blood flow-associated changes in the arterial load components: basal biomechanical conditions determine the load changes. Conf Proc IEEE Eng Med Biol Soc. 2009; 2009: 2843-7.
7. Armentano RL, Barra JG, Pessana FM, Craiem DO, Graf S, Bia Santana D, et al. Smart smooth muscle spring-dampers. Smooth muscle smart filtering helps to more efficiently protect the arterial wall. IEEE Eng Med Biol Mag 2007; 26: 62-70.
8. Bia D, Armentano R, Craiem D, Grignola J, Ginés F, Simon A, et al. Smooth muscle role on pulmonary arterial function during acute pulmonary hypertension in sheep. Acta Physiol Scand 2004; 181: 359-66.
9. Bia D, Zócalo Y, Armentano R, Camus J, Forteza E, Cabrera-Fischer E. Increased reversal and oscillatory shear stress cause smooth muscle contraction-dependent changes in sheep aortic dynamics: role in aortic balloon pump circulatory support. Acta Physiol (Oxf) 2008; 192: 487-503.
10. Nichols WW, O’Rourke M. Properties of the arterial wall: practice. In: W.W. Nichols & M. O’Rourke, editors. Mc Donald’s Blood Flow in Arteries: Theoretical, Experimental and Clinical Principles. London. Edward Arnold; 2005: 49-93.
11 . Bia D, Aguirre I, Zocalo Y, Devera L, Cabrera Fischer E, Armentano R. Regional differences in viscosity, elasticity and wall buffering function in systemic arteries: pulse wave analysis of the arterial pressure-diameter relationship. Rev Esp Cardiol 2005; 58: 167-74.
12. Valdez-Jasso D, Haider MA, Banks HT, Bia Santana D, Zócalo Germán Y, Armentano RL, et al. Analysis of viscoelastic wall properties in ovine arteries. IEEE Trans Biomed Eng 2009; 56: 210-9.
13. Bia D, Cabrera-Fischer EI, Zócalo Y, Armentano RL. The endothelium modulates the arterial wall mechanical response to intra-aortic balloon counterpulsation: in vivo studies. Artif Organs 2011; 35: 883-92.
14. Bia D, Zócalo Y, Armentano R, Laza S, Pérez H, Craiem D, et al. Non-invasive biomechanical evaluation of implanted human cryopreserved arterial homografts: comparison with pre-implanted cryografts and arteries from human donors and recipients. Ann Biomed Eng 2009; 37: 1273-86.
15. Bia D, Armentano RL, Grignola JC, Craiem D, Zocalo YA, Gines FF, et al. The vascular smooth muscle of great arteries: local control site of arterial buffering function? Rev Esp Cardiol 2003; 56: 1202-9.
16. Bia D, Barra JG, Grignola JC, Ginés FF, Armentano RL. Pulmonary artery smooth muscle activation attenuates arterial dysfunction during acute pulmonary hypertension. J Appl Physiol 2005; 98: 605-13.
17. Li JK. The arterial circulation. Physical principles and clinical applications. New Jersey, USA. Human Press Inc; 2000: 13-128.
18. Borlaug BA, Kass DA. Ventricular-vascular interaction in heart failure. Heart Fail Clin 2008; 4: 23-36.
19. Sunagawa K, Maughan WL, Burkhoff D, Sagawa K. Left ventricular interaction with arterial load studied in isolated canine ventricle. Am J Physiol Heart Circ Physiol 1983; 245: H773–H780.
20. Segers P, Stergiopulos N, Westerhof N. Relation of effective arterial elastance to arterial system properties. Am J Physiol Heart Circ Physiol 2002; 282: H1041–H1046.
21. Laurent S, Cockcroft J, Van Bortel L, Boutouyrie P, Giannattasio C, Hayoz D, et al. European Network for Non-invasive Investigation of Large Arteries. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J 2006; 27: 2588-2605.
22. Schiller NB, Shah PM, Crawford M, Demaria A, Devereux R, Feigenbaum H, et al. Recommendations for quantitation of the left ventricle by two-dimensional echocardiography. American Society of Echocardiography Committee on Standards, Subcommittee on Quantitation of Two-Dimensional Echocardiograms. J Am Soc Echocardiography 1989; 2: 358-67
23. Gorcsan J 3rd, Abraham T, Agler DA, Bax JJ, Derumeaux G, Grimm RA, et al. American Society of Echocardiography Dyssynchrony Writing Group. Echocardiography for cardiac resynchronization therapy: recommendations for performance and reporting. A report from the American Society of Echocardiography Dyssynchrony Writing Group endorsed by the Heart Rhythm Society. J Am Soc Echocardiogr 2008; 21: 191-213
24. Vermeersch SJ, Rietzschel ER, De Buyzere ML, De Bacquer D, De Backer G, Van Bortel LM, et al. Determining carotid artery pressure from scaled diameter waveforms: comparison and validation of calibration techniques in 2026 subjects. Physiol Meas 2008; 29: 1267-80.
25. Chen CH, Nevo E, Fetics B, Pak PH, Yin FC, Maughan WL, et al. Estimation of central aortic pressure waveform by mathematical transformation of radial tonometry pressure. Validation of generalized transfer function. Circulation 1997; 95: 1827-36.
26. Meinders JM, Hoeks AP. Simultaneous assessment of diameter and pressure waveforms in the carotid artery. Ultrasound Med Biol 2004; 30: 147-54.
27. Chantler PD, Lakatta EG, Najjar SS. Arterial-ventricular coupling: mechanisitics insights into cardiovascular performance at rest and during exercice. J Appl Physiol 2008; 105: 1342-51.
28. De Tombe PP, Jones S, Burkhoff D, Hunter WC, Kass DA. Ventricular stroke work and efficiency both remain nearly optimal despite altered vascular loading. Am J Physiol 1993; 264(6 Pt 2): H1817-1824.
29. Stergiopulos N, Meister JJ, Westerhof N. Simple and accurate way for estimating total and segmental arterial compliance: the pulse pressure method. Ann Biomed Eng 1994; 22: 392-7.
30 . Kim SY, Euler DE, Jacobs WR, Montoya A, Sullivan HJ, Lonchyna VA, et al. Arterial impedance in patients during intraaortic balloon counterpulsation. Ann Thorac Surg 1996; 61: 888-94.
31. Levenson J, Simon A, Megnien JL, Chironi G, Gariepy J, Pernollet MG, et al. Effects of enhanced external counterpulsation on carotid circulation in patients with coronary artery disease. Cardiology 2007; 108: 104-10.
32. Sinha AM, Breithardt OA. Are neurohumoral parameters predictive for the efficacy of cardiac resynchronization therapy? The role of natriuretic peptides. Herzschrittmacherther Elektrophysiol 2006; 17: I51-55.
33. Hamdan MH, Barbera S, Kowal RC, Page RL 2nd, Ramaswamy K, Joglar JA, et al. Effects of resynchronization therapy on sympathetic activity in patients with depressed ejection fraction and intraventricular conduction delay due to ischemic or idiopathic dilated cardiomyopathy. Am J Cardiol 2002; 89: 1047-51.
34. Najem B, Unger P, Preumont N, Jansens JL, Houssiere A, Pathak A, et al. Sympathetic control after cardiac resynchronization therapy: responders versus nonresponders. Am J Physiol Heart Circ Physiol 2006; 291: H2647-2652.
35. Burri H, Sunthorn H, Somsen A, Fleury E, Stettler C, Shah D, et al. Improvement in cardiac sympathetic nerve activity in responders to resynchronization therapy. Europace 2008; 10: 374-8.
36. Giannattasio C, Achilli F, Failla M, Capra A, Vincenzi A, Valagussa F, et al. Radial, carotid and aortic distensibility in congestive heart failure: effects of high-dose angiotensin-converting enzyme inhibitor or low-dose association with angiotensin type 1 receptor blockade. J Am Coll Cardiol 2002; 39: 1275-82.
37. Patrianakos AP, Parthenakis FI, Karakitsos D, Nyktari E, Vardas PE. Proximal aortic stiffness is related to left ventricular function and exercise capacity in patients with dilated cardiomyopathy. Eur J Echocardiogr 2009; 10: 425-32. Epub 2008 Nov28
38. London GM, Pannier B. Arterial functions: how to interpret the complex physiology. Nephrol Dial Transplant 2010; 25: 3815-23.













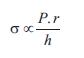 (ecuación 1)
(ecuación 1) 
 l
l