Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.26 no.3 Montevideo Dec. 2011
PRÁCTICA CLÍNICA
¿Qué deben saber los cardiólogos del tratamiento farmacológico para dejar de fumar?
GUSTAVO E ZABERT 1,2, CARLOS JIMÉNEZ RUIZ 3, IGNACIO ZABERT 4
1. Director Regional para Latinoamérica Global Bridges.
2. Profesor de la Cátedra de Medicina y Cirugía de la Facultad de Ciencias Médicas Universidad Nacional del Comahue. Neuquén, Argentina.
3. Coordinador Área de Tabaquismo. Sociedad Española de Neumología y Cirugía Torácica. SEPAR. Madrid, España.
4. Docente de la Cátedra de Fisiología de la Facultad de Ciencias Médicas Universidad Nacional del Comahue. Neuquén, Argentina.
Correspondencia: Gustavo E Zabert. Mtro. González 545 (8300). Neuquén, Argentina. Correo electrónico: gzabert@gmail.com
PALABRAS CLAVE:
TABAQUISMO
FACTORES DE RIESGO
CESE DEL TABAQUISMO
KEY WORDS:
SMOKING
RISK FACTORS
SMOKING CESSATION
RESUMEN
El consumo de tabaco constituye el principal factor de riesgo reversible en la enfermedad cardiovascular isquémica y dejar de fumar rápidamente disminuye el riesgo de eventos cardiovasculares y de muerte por esta causa. Las intervenciones conductuales han demostrado ser efectivas para dejar de fumar, y si a ello se suman fármacos, al menos se duplican las tasas de abstinencia medidas al año. Los fármacos con efectividad demostrada son la terapia de reemplazo nicotínico en todas sus formas farmacéuticas, el bupropión y la vareniclina. Estos fármacos han sido estudiados en pacientes con enfermedad cardiovascular estable y tienen similar efectividad que en la población general y un adecuado margen de seguridad, por lo que se recomienda su prescripción junto a la terapia conductual. No hay evidencia de mayor efectividad al asociar diferentes fármacos ni tampoco de diferentes perfiles de seguridad. La relación riesgo-beneficio de los posibles riesgos psiquiátricos y cardiovasculares reportados y los beneficios de abandonar el consumo benefician ampliamente el uso de estos fármacos en las indicaciones recomendadas.
INTRODUCCIÓN
El tabaco es el único producto de consumo legal que daña a todas las personas expuestas al mismo y que mata a la mitad de aquellos que lo consumen (1). Su uso está asociado con seis de las ocho primeras causas de muerte, todas ellas enfermedades crónicas no trasmisibles (ENT) (2). El incremento mundial de las ENT, particularmente de la enfermedad cardiovascular isquémica y cerebral (3), diabetes, cáncer y enfermedad pulmonar obstructiva crónica, plantea un desafío a escala global que amenaza a la población y que constituye una seria barrera para el desarrollo (2).
Se estima que actualmente existen 650 millones de fumadores, que 10% de la población mundial morirá por una enfermedad relacionada al tabaco y que 7 de cada 10 muertes ocurrirán en países de ingresos bajos o medianos (4,5). Actualmente solo 5% de la población mundial vive en países con políticas efectivas para reducir el consumo de tabaco (6).
El problema se considera de tal magnitud que el 19 y 20 de septiembre se llevó a cabo la Reunión de Alto Nivel de la Asamblea General de la Organización de las Naciones Unidas para considerar los desafíos planteados por las ENT y establecer acciones para su mejor control, de la misma manera que hace más de una década ocurrió con el sida.
En términos de política sanitaria el control del tabaco es la medida de prevención más importante y con mayor impacto (2) sobre las ENT, y a nivel individual dejar de fumar es la acción de salud de mayor beneficio para cualquier fumador.
El tabaquismo como problema de salud es una responsabilidad de la salud pública, pero la epidemia de consumo y sus devastadoras consecuencias ocurrieron (7,8) ante la mirada de la ciencia médica. Las respuestas sanitarias globales requeridas para atacar el problema demoraron más de 50 años en desarrollarse (6,9), encontrándose su implementación muy limitada a nivel de muchas naciones, como ocurre en Latinoamérica (10,11), con la excepción de algunos pocos países, como es el caso de Uruguay.
Al mismo tiempo es responsabilidad de cada médico en su accionar cotidiano combatir esta enfermedad (12), desde el momento que un sólido cuerpo de evidencia demuestra la relación causal entre el consumo de tabaco (8,13-17) y las enfermedades tabaco-dependientes (10-13), así como acerca de los beneficios que se obtienen al abandonar el consumo.
Las enfermedades cardiovasculares y cerebrovasculares son las principales causas de enfermedad y muerte en los fumadores y el consumo de tabaco incrementa el riesgo de sufrir estos eventos con una relación de dosis respuesta (18-21).
Aquellos países que han desarrollado acciones de control del tabaco observan en el corto plazo el impacto en la reducción de las consecuencias cardiovasculares (22-25). Estas acciones están ampliamente referidas en los documentos del Convenio Marco de Control del Tabaco (26) y MPOWER (6), pero sin lugar a dudas la intervención más rápida para evitar las enfermedades y muertes relacionadas al tabaco es que los fumadores alcancen la abstinencia (27).
Las enfermedades cardiovasculares, en particular aquellas asociadas con eventos vasculares (18), son en las que más rápido y mayor beneficio se obtiene al dejar de fumar (21,22) y al evitar la exposición al humo de tabaco ambiental (11,23-25). Un metaanálisis que resumió resultados de 20 estudios apropiados para este análisis, estimó en 36% la reducción de riesgo absoluto de morir por cualquier causa en enfermos con cardiopatía isquémica (RR 0,64; IC 95% 0,58-0,71) y una reducción similar en infarto de miocardio no fatal (RR 0,68; IC 95% 0,57-0,82) (28,29). Los riesgos del tabaquismo y su reducción luego de dejar de fumar fueron de similar magnitud en los estudios de cohortes de Framingham (30), de los médicos británicos (31), y de las enfermeras norteamericanas (20).
De acuerdo al estado actual del conocimiento, existe acuerdo en formular una recomendación clase I con nivel de evidencia tipo A en que los fumadores abandonen el consumo de tabaco como medida de prevención primaria de enfermedad cardiovascular y cerebral.
Si bien se argumenta que la mayoría de los fumadores que dejan de fumar lo logran sin recurrir a ayuda (32,33), la evidencia muestra que el tratamiento de ayuda conductual, aun cuando breve (34), aumenta en 2,5% la probabilidad absoluta de abstinencia al año y que a mayor intensidad de la misma es mayor su efectividad (34,35). Pero, además, existe evidencia científica que demuestra que la combinación de tratamiento farmacológico más asesoramiento psicológico incrementa aun más las posibilidades de éxito en un intento por dejar de fumar que la utilización de solo uno de estos tratamientos (36-39), dado que el consumo de tabaco está fuertemente condicionado por la adicción a la nicotina (40,41). Es así que en la actualidad se recomienda ofrecer al fumador conjuntamente estrategias de conducta y tratamiento farmacológico (42-44).
Sin duda, entonces, dejar de fumar es la medida más efectiva para evitar la muerte, así como para evitar tanto el primero como los subsiguientes eventos cardiovasculares y cerebrales isquémicos.
Por lo tanto, los profesionales de la medicina cardiovascular necesitan conocer la eficacia y seguridad de uso de los fármacos para dejar de fumar, para de esa forma poder ayudar a cesar el tabaquismo a sus pacientes con patología cardiovascular (45,46).
FÁRMACOS
Existen tres tipos de fármacos empleados en el tratamiento del tabaquismo: terapia de reemplazo nicotínico, bupropión y antagonistas parciales de los receptores nicotínicos.
TERAPIA DE REEMPLAZO NICOTíNICO
La nicotina es el componente del cigarrillo que determina un elevado grado de adicción, pues su llegada al cerebro, la que ocurre en pocos segundos luego de inhalar el humo del cigarrillo, determina una reacción de recompensa que hace muy difícil al fumador prescindir de ella. Esta forma de tratamiento se define como la administración de nicotina a un fumador que quiere dejar de serlo, por una vía distinta a la del consumo de un cigarrillo, en una cantidad que sea lo suficientemente alta como para evitarle el padecimiento de los síntomas del síndrome de abstinencia, pero en una cantidad que no sea tan alta como para provocarle dependencia (47). Al recibir la nicotina de esa forma se evitan que el fumador inhale los componentes tóxicos y carcinógenos que contiene el cigarrillo.
Diversos estudios clínicos y su metaanálisis muestran que la terapia de reemplazo nicotínico (TRN) aumenta las tasas de abstinencia, que disminuye el consumo de tabaco en las estrategias de tratamiento que consisten en reducir hasta dejar (48,49), y que es efectiva en la reducción del daño asociado al consumo de tabaco (50,51).
Ningún tipo de TRN está contraindicado en fumadores con enfermedad cardiovascular. En estudios realizados en individuos sanos que han utilizado chicle durante cinco años, no se ha podido demostrar ningún incremento de las enfermedades cardiovasculares. Tampoco se han encontrado evidencias de mayor riesgo de alteraciones en el electrocardiograma (ECG), arritmias, angina, o muerte súbita en enfermos cardiovasculares que han utilizado TRN en su proceso de deshabituación tabáquica (52). También se señala que la TRN tiene menor riesgo de producir infarto agudo de miocardio que el consumo de cigarrillos (53).
Hasta el momento se han probado diversas formas de TRN. En la tabla 1 se exponen las formas farmacéuticas de la TRN existentes en la actualidad y sus principales características, aunque no todas están disponibles en cada país. De ellas las más utilizadas son el chicle, el parche y las pastillas de nicotina. A continuación las comentaremos de forma resumida.
1.1. CHICLE DE NICOTINA
Se trata de una pieza de goma de mascar que contiene 2 o 4 mg de nicotina. Mediante la masticación, la nicotina es liberada al interior de la cavidad bucal y es absorbida a través de la mucosa geniana y alcanza la sangre y desde allí estimula los receptores nicotínicos de las membranas de las neuronas del área tegmental ventral del mesencefalo. De esta forma, el chicle ayuda a controlar los síntomas del síndrome de abstinencia en el fumador que esta dejando de fumar.
La última revisión Cochrane muestra que la odds ratio para la abstinencia utilizando chicles de nicotina es de 1,43 (95% IC: 1,33–1,53). Estas cifras son independientes de la duración de la terapia, de la intensidad de la ayuda psicológica que el paciente reciba y del contexto donde se ha realizado el programa de deshabituación. Existen pruebas suficientes para recomendar la utilización de chicles de 4 mg de nicotina en fumadores con alta dependencia física en comparación con los de 2 mg (nivel de evidencia: Ia, grado de la recomendación: A) (54,55).
El chicle es una forma de administración rápida de nicotina. Esta es una de sus características diferenciales. Por un lado puede ser utilizado de forma puntual con el objetivo de controlar situaciones de craving intenso, y por otro, puede ser administrado de forma pautada para conseguir continuos niveles de nicotinemia que ayudaran a que el fumador alivie sus síntomas del síndrome de abstinencia. La dosis de chicle debe ajustarse al grado de dependencia física del fumador. Para aquellos que consumen menos de 25 cigarrillos diarios o que encienden su primer cigarrillo después de los 30 minutos de levantarse, se recomienda la utilización de chicles de 2 mg a dosis de una pieza cada una o dos horas mientras que el sujeto este despierto. Por el contrario, en fumadores de 25 o más cigarrillos diarios o que consumen el primer cigarrillo antes de los 30 minutos, se utilizaran chicles de 4 mg de nicotina con similar pauta (54-56). La duración del tratamiento debe oscilar entre 8 y 12 semanas. Se recomienda la utilización de chicles durante 8 a 10 semanas en los fumadores menos dependientes y en los de mayor grado de dependencia es aconsejable prolongar el tratamiento hasta tres meses. Si bien es cierto que, en estos, la utilización de chicles puede llegar hasta los 6 a 12 meses. La dosis se irá reduciendo progresivamente a partir de las 4 a 8 semanas de tratamiento (54-56). Recientemente, y en base a ensayos clínicos previos, se ha recomendado que el chicle de nicotina también puede ser utilizado en fumadores que no quieren dejar de fumar pero que se muestran dispuestos a reducir el número de cigarrillos que consumen al día (57,59). Así, un metaanálisis que estudió un total de 2.767 fumadores que no querían dejar de fumar, pero que se mostraban dispuestos a reducir, encontró que aquellos que utilizaron TSN ( chicle de nicotina, inhalador de nicotina o parche) consiguieron reducir su consumo o dejar de fumar definitivamente a los seis meses de seguimiento en mayor cantidad que aquellos que utilizaron placebo (9% versus 5%) (60).
En la tabla 2 se especifican los efectos adversos y las contraindicaciones para este tipo de terapia (54-56).

1.2. PASTILLAS DE NICOTINA
Se trata de unas pastillas que contienen 1 ó 2 mg de nicotina. Su mecanismo de absorción, así como su farmacocinética, es similar a la del chicle de nicotina. La eficacia de esta forma de TSN ha sido comprobada en un estudio a doble ciego y controlado con placebo. Se detectó que los fumadores que utilizaron pastillas con nicotina tenían doble posibilidad de dejar de fumar que aquellos que utilizaron placebo (61). La dosis recomendada es de 1 a 2 pastillas cada hora mientras que el sujeto este despierto durante 6 a 8 semanas para reducir progresivamente hasta cumplir doce semanas de tratamiento.
1.3. PARCHE DE NICOTINA
El parche es un dispositivo cargado de nicotina dispuesto para liberarla a través de la piel cuando es adherido a la misma. Existen dos tipos de parches. Unos que liberan nicotina durante 24 horas y que deben ser utilizados durante todo el día y otros que la liberan durante 16 horas y que deben ser utilizados mientras que el sujeto está despierto.
Los diferentes tipos de parches de nicotina se diferencian por las distintas concentraciones de nicotina que tienen y que liberan, por su diferente tiempo de liberación y porque consiguen distintos niveles de nicotinemia.
El último metaanálisis demuestra que la odds ratio para la abstinencia con parches de nicotina comparada con los controles ha sido de 1,66 (IC 95% 1,53-1,81) (55). Estas cifras son independientes de la intensidad de la ayuda psicológica que el paciente reciba y del contexto donde se ha realizado el programa de deshabituación. Además ha sido demostrado que ocho semanas de tratamiento con parche es tan eficaz como tratamientos más prolongados y que no existe evidencia suficiente para recomendar la disminución progresiva de la dosis frente al cese brusco (54-56). Los parches de 24 horas son tan eficaces como los de 16 (nivel de evidencia: Ia; grado de la recomendación: A) (54,55).
El parche representa una forma de administración de nicotina lenta y progresiva. El sujeto coloca el parche en cualquier zona de su piel e, independientemente de lo que haga, obtendrá adecuados niveles de nicotina en su sangre. Por ello, es el tratamiento sustitutivo ideal en fumadores que quieren dejar de serlo, sin que sea necesaria una colaboración muy activa por su parte. Esta característica unida a su fácil utilización y a la escasez de efectos adversos que produce, lo convierten en una de las formas de TSN más utilizadas en el mercado de venta libre.
A continuación se exponen algunas pautas para una correcta utilización de los parches de nicotina (54-56):
- Deben ser utilizados en fumadores con dependencia física por la nicotina leve-moderada. En fumadores con dependencia severa (7 o más puntos en el test de Fagerström), utilizados por sí solos, no han demostrado incrementar el porcentaje de éxitos. En estos casos es muy recomendado la utilización concomitante de parches más chicles de nicotina.
- Es recomendable su utilización durante un periodo superior a 14 semanas y en combinación con chicles de nicotina en aquellos fumadores con alto grado de dependencia física por la nicotina o que fuman más de 20 cigarrillos al día o que han tenido fracasos previos en los que utilizaron TRN a dosis estándar.
- Deben ser utilizados a dosis altas durante las primeras 4-6 semanas. En el caso de parches de 16 horas, la dosis alta recomendada es la de 25 mg/día, esta se consigue con la utilización conjunta de un parche de 15 mg más otro de 10 mg. Para el parche de nicotina de 24 horas la dosis alta es la de 21 mg/día.
La tabla 3 muestra los efectos adversos y las contraindicaciones de los parches de nicotina.

BUPROPIÓN
El bupropión es el primer fármaco no nicotínico que ha demostrado efectividad para aumentar las tasas de cesación de tabaquismo y para disminuir los síntomas de abstinencia (62-64). En la tabla 4 se presentan las características principales del bupropión.
No se conoce con exactitud cuál es el mecanismo de acción de este fármaco. Se sabe que actúa a nivel del núcleo accumbens inhibiendo la recaptación neuronal de dopamina; este efecto explicaría la reducción del craving que los fumadores experimentan cuando lo utilizan. También inhibe la recaptación neuronal de noradrenalina en el núcleo ceruleus consiguiendo con ello una reducción significativa de la intensidad de los síntomas del síndrome de abstinencia a la nicotina (65). Recientes estudios in vitro han detectado que bupropión es un inhibidor funcional no competitivo de los receptores nicotínicos de acetilcolina. Esta actividad antinicotínica puede contribuir a su eficacia en el tratamiento de la dependencia nicotínica (66).
Un metaanálisis demostró que bupropión a dosis de 300 mg día durante un periodo de 7 semanas se asociaba con un incremento significativo de la abstinencia continua al final del tratamiento OR 2,71 (IC 95% 1,88-4,07) y a los doce meses de seguimiento OR 2,10 (IC 95% 1,62-2,73) (67). Recientemente, otro metaanálisis que evaluó la eficacia de bupropión en 19 ensayos clínicos encontró una OR 2,06 (IC 95% 1,77-2,40 (68) (nivel de evidencia: Ia; grado de la recomendación: A) (54,67,68).
Bupropión debe ser utilizado durante un periodo de 7 a 12 semanas a dosis de 300 mg diarios en dos tomas de 150 mg cada una. El tratamiento se iniciará de 7 a 15 días antes de abandonar definitivamente el consumo del tabaco. Durante la primera semana, el sujeto consumirá sólo un comprimido de 150 mg cada día y después de este periodo se incrementará la dosis a dos comprimidos de 150 mg. Conviene tomar un comprimido a primera hora de la mañana en el momento de levantarse y el segundo ocho horas después. En fumadores de 65 o más años de edad o con insuficiencia renal o hepática significativa o con bajo peso (menos de 45 kg) se recomienda bajar la dosis a la mitad (54,56).
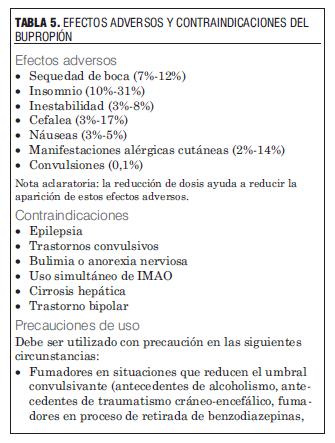
La tabla 5 muestra los principales efectos adversos y contraindicaciones de bupropión (54,56).
Utilización de bupropión en pacientes con enfermedad cardiovascular
Bupropión obtuvo tasas de abstinencia continua a los 12 meses de seguimiento significativamente más altas que el placebo, en un estudio que incluyó más de 600 fumadores con problemas cardiovasculares: 22% frente al 9%. Además no se encontró incremento de reacciones adversas en el grupo tratado con el fármaco en comparación con los que recibieron placebo (69). Un reciente estudio ha analizado la incidencia de muerte súbita en más de 9000 pacientes que han recibido bupropión. Se determinó que el cociente de incidencia no era significativo: OR 0,50 (IC 95% 0,12-2,5) (70).
AGONISTAS PARCIALES DE LOS RECEPTORES NICOTÍNICOS
Los agonistas parciales de los receptores nAChR constituyen un nuevo grupo de fármacos para la cesación tabáquica. El más destacado es la vareniclina, desarrollada a partir de la cisticina, un alcaloide natural que se encuentra en la acacia Cytisus laburnum.
La cisticina es usada ampliamente en Europa del este desde hace más de 40 años (71,72).
Ambos fármacos tienen alta afinidad para los receptores nicotínicos de acetilcolina (nAChR) en las neuronas, en particular los compuestos por subunidades a4 b2, impidiendo la unión de la nicotina al receptor y estimulándolo con efecto menor. Este mecanismo explica la reducción de la recompensa de la nicotina al fumar, y la disminución de los síntomas del síndrome de abstinencia y las urgencias, sin ser adictivo por no producir recompensa positiva (73).
La vareniclina es la única disponible comercialmente a nivel mundial y bajo estándares de eficacia y seguridad exigidos (74). Se encuentran en desarrollo nuevos fármacos de este grupo que aún requieren evaluaciones (75). En la tabla 6 se presentan las características principales de la vareniclina.
Vareniclina actúa como agonista parcial selectivo de los receptores nicotínicos a4 b2 de las neuronas del área tegmental ventral del mesencéfalo. Al ser agonista parcial cumple características comunes de los agonistas y de los antagonistas. Por ser un agonista tiene la capacidad de estimular el receptor nicotínico y por ello es capaz de controlar el craving y el síndrome de abstinencia. Pero, por ser un antagonista es capaz de bloquear los efectos que la nicotina produce sobre el receptor, la utilización de vareniclina en un fumador que está dejando de fumar facilita que las posibles recaídas no se acompañen de sensación placentera y recompensa, por lo tanto este fármaco ayuda a que una recaída no se convierta en fracaso (76,77).
Un reciente metaanálisis ha revisado 11 ensayos clínicos que analizaban la eficacia de vareniclina frente a placebo, bupropión e incluso TRN. Los resultados mostraron: a) que vareniclina a dosis de 1 mg dos veces al día es eficaz para dejar de fumar en comparación con placebo, RR 2,31 (IC 95% 2,01-2,66); b) que vareniclina a dosis de 1 mg una vez al día es eficaz para dejar de fumar en comparación con placebo, RR 2,09 (IC 95% 1,56-2,78); c) que vareniclina es significativamente más eficaz que bupropión para dejar de fumar, RR 1,52 ( 1,22-1,88), y d) que vareniclina no fue significativamente más eficaz que TRN para dejar de fumar (78).
Los efectos adversos que más frecuentemente han sido reportados en los diferentes estudios son la náusea y sueños anormales. De los dos, el más frecuente es la náusea, ocurriendo 29,4% en el grupo activo frente a 9,7% en el placebo (54). Si bien es cierto que la náusea es un efecto adverso relativamente común en los pacientes que utilizan vareniclina, también lo es que su intensidad es leve en la mayoría de los casos. En más del 70% de las ocasiones la náusea aparece sólo en los primeros días de tratamiento y desaparece espontáneamente sin necesidad de tratamiento. Es más, el índice de abandono de la medicación debido a este efecto adverso no es elevado: 2,3% frente a 0,4% con placebo (54).
En los últimos años han aparecido algunas advertencias de la FDA y de otros organismos regulatorios europeos que alertaban sobre el riesgo de que la utilización de vareniclina en sujetos sanos pudiera inducir cuadros depresivos, ideación suicida o incluso suicidio. Este aspecto ha sido detalladamente analizado en estudios muy recientes y se ha encontrado que vareniclina es seguro y que la aparición de este tipo de efectos adversos no es atribuible a la utilización de vareniclina. En este sentido merece destacarse el estudio de Gunnell y colaboradores sobre un total de más de 80.000 pacientes que habían utilizado para dejar de fumar TRN, bupropion o vareniclina. Se encontró que la frecuencia de aparición de este tipo de patologías no fue diferente para ninguno de los tres fármacos (79). En otro estudio, Tonstad y colaboradores estudiaron a todos los pacientes que habían recibido vareniclina y placebo en 10 ensayos clínicos aleatorizados. No se encontró que apareciesen más trastornos psiquiátricos en el grupo de sujetos que utilizó vareniclina en comparación con placebo (80).
Es de destacar la reciente aparición de un ensayo clínico en el que se ha valorado la eficacia y la seguridad de uso de citisina. Citisina es un extracto de las semillas de una planta, la Cytisus laborinum L que es un agonista parcial de los receptores nicotínicos a4 b2. Es decir tiene la misma actividad que vareniclina. Esa sustancia ha sido utilizada durante muchos años en los países del antiguo bloque soviético europeo como ayuda para dejar de fumar. Sólo existían algunas referencias poco científicas a su eficacia y seguridad de uso en este asunto. No obstante, recientemente ha aparecido un ensayo clínico en el que se muestra de forma fehaciente su eficacia a los 6 y 12 meses de seguimiento: 10,0% versus 7,3%, RR 2,9 (IC 95% 1,5-5,3) y 8,4% versus 2,4%, RR 3.4 (IC 95% 1,7-7,1), respectivamente. Lo más destacado de este fármaco es su precio. En el momento actual un tratamiento completo en Rusia cuesta U$S 6 y en Polonia U$S 15. Este hecho, junto con la eficacia y seguridad de uso de esta medicación, pueden hacer que este fármaco se convierta en un tratamiento ideal en muchos países, sobre todo en aquellos con bajos recursos económicos (81).
Eficacia y seguridad de uso de vareniclina en el tratamiento del tabaquismo de pacientes con enfermedad cardiovascular
Recientemente ha aparecido un metaanálisis que ha puesto de manifiesto que la utilización de vareniclina podría acarrear incremento del riesgo de eventos cardiovasculares tanto en fumadores sanos como en fumadores con patología cardiovascular (82). Dicho estudio ha recibido diversas críticas debidas a importantes errores metodológicos, procedentes de diferentes expertos y organismos regulatorios como la FDA y la EMA no lo ha tenido en cuenta las conclusiones de dicho estudio en sus recomendaciones (83-87). Además, se ha realizado un estudio en un total de 714 pacientes que padecían diversos tipos de patología cardiovascular estable: cardiopatia isquémica, insfuciencia cardíaca, etcétera. Se utilizó vareniclina a las dosis habituales y los resultados mostraron que aquellos sujetos que habían utilizado vareniclina mantenían cifras de abstinencia entre la 9 y la 52 semanas más altas que aquellos que habían utilizado placebo, OR: 3,1 (1,9-5,1). Este estudio demostró, también, la seguridad de uso de este fármaco en éste grupo de pacientes. Se encontró que 2,8% (10/355) de los pacientes tratados con vareniclina y 1,7% (6/359) de los que recibieron placebo habían sufrido algún evento cardiovascular. No existía diferencia significativa entre ambos: odds ratio 1,71 (IC 95% 0,61 a 4,74) (88).
CONCLUSIONES
Las drogas para el tratamiento farmacológico para dejar de fumar con efectividad demostrada (TRN, bupropión y vareniclina) han sido estudiadas en pacientes con enfermedad cardiovascular estable, demostrando similar efectividad que en la población general y con un adecuado margen de seguridad. Por ello se recomienda su prescripción junto a terapia conductual, para de esa forma aumentar la probabilidad de cesación entre los pacientes con patología cardiovascular.
BIBLIOGRAFÍA
1. Shafey O EM, Ross H, Mackay J. The Tobacco Atlas. 3rd. ed. Atlanta, GA: American Cancer Society; 2009.
2. Beaglehole R, Bonita R, Horton R, Adams C, Alleyne G, Asaria P. Priority actions for the non-communicable disease crisis. Lancet 2011; 377: 1438-47.
3. Ezzati M, Lopez AD. Regional, disease-specific patterns of smoking-attributable mortality in 2000. Tobacco Control 2004; 13: 388-395.
4. Peto R, Lopez AD, Boreham J, Thun M, Heath C Jr. Mortality from tobacco in developed countries: indirect estimation from national vital statistics. Lancet. 1992; 339: 1268-78.
5. Peto R, Lopez AD, Boreham J, Thun M, Heath C Jr, Doll R. Mortality from smoking worldwide. Br Med Bull 1996; 52: 12-21.
6. Organización Mundial de la Salud. MPOWER un plan para hacer retroceder la epidemia de tabaquismo [monografía en Internet]. Ginebra: OMS; 2008. Disponible en: http://www.who.int/tobacco/mpower/mpower_spanish.pdf (consultado 23/11/ 2011).
7. Doll R, Hill AB. Smoking and carcinoma of the lung; preliminary report. Br Med J 1950; 2: 739-48.
8. Doll R, Hill AB. The mortality of doctors in relation to their smoking habits: a preliminary report (Reprinted from Br Med J 1954; 26: 1451-5.
9. World Health Organization. WHO Framework Convention on Tobacco Control. Anex 1 WHA 56.1 [monografía en Internet]. Ginebra: WHO ; 2003. Disponible en: http://whqlibdoc.who.int/publications/2003/9241591013.pdf (consultado 13/11/ 2004).
10. Allemandi L, Schoj V, Gutkowoski P, Itchart L, Champagne B; Fundación Interamericana del Corazón.Convenio Marco para el Control del Tabaco: desafíos para América Latina y el Caribe. Reporte de la Sociedad Civil 2010 [monografía en Internet]. Buenos Aires: Fundación InterAmericana del Corazón; 2010. Disponible en: http://www.interamericanheart.org/ficmexico/2010/11/convenio-marco-para-el-control-del-tabaco-desafios-para-america-latina-y-el-caribe (consultado 07/11/2011).
11. Jimenez-Ruiz CA, Miranda JA, Hurt RD, Pinedo AR, Reina SS, Valero FC. Study of the impact of laws regulating tobacco consumption on the prevalence of passive smoking in Spain. The European Journal of Public Health 2008; 18: 622-5.
12. Tobacco Control [homepage on the Internet]. London: BMJ Publishing Group Ltd. Simpson D. Doctors and Tobacco: Medicine’s Big Challenge, Tobacco Control Resource Centre, 2000. Available from: http://www.tobacco-control.org/tcrc_Web_ Site/Pages_tcrc/Resources/tcrc_Publications/Publications_Other_Languages/English/English_DT_Publication-Main_Page.htm.
13. Doll R, Hill AB. Lung cancer and other causes of death in relation to smoking; a second report on the mortality of British doctors. Br Med J 1956; 2: 1071-81.
14. Doll R, Hill AB. Mortality in Relation to Smoking: Ten Years’ Observations of British Doctors. Br Med J 1964; 1: 1399-410.
15. Doll R, Peto R. Mortality in relation to smoking: 20 years’ observations on male British doctors. Br Med J1976; 2: 1525-36.
16. Doll R, Peto R. Cigarette smoking and bronchial carcinoma: dose and time relationships among regular smokers and lifelong non-smokers. J Epidemiol Community Health 1978; 32: 303-13.
17. Hammond EC, Horn D. The relationship between human smoking habits anddeath rates: a follow-up study of 187,766 men. JAMA 1954; 155: 1316-28.
18. Ambrose JA, Barua RS. The pathophysiology of cigarette smoking and cardiovascular disease. An update. J Am Coll Cardiol 2004; 43: 1731-7.
19. Doll R, Peto R, Boreham J, Sutherlandr I. Mortality in relation to smoking: 50 years’ observations on male British doctors. BMJ 2004; 328: 1519.
20. Kenfield SA, Stampfer MJ, Rosner BA, Colditz GA. Smoking and smoking cessation in relation to mortality in women. JAMA 2008; 299: 2037-47.
21. Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet 2004; 364: 937-52.
22. Unal B, Critchley JA, Capewell S. Modelling the decline in coronary heart disease deaths in England and Wales, 1981-2000: comparing contributions from primary prevention and secondary prevention. BMJ 2005; 331: 614.
23. Sandoya E, Sebrié E, Bianco E, Araújo O, Correa A, Davyt O, et al. Impacto de la prohibición de fumar en espacios cerrados sobre los ingresos por infarto agudo de miocardio en Uruguay. Rev Med Urug [serie en Internet]. 2010 Dic; 26(4): [aprox. 9p.]. Disponible en: http://www.rmu.org.uy/revista/26/4/2/es/3/ (consultado 14/11/11).
24. Meyers DG, Neuberger JS, He J. Cardiovascular Effect of Bans on Smoking in Public Places: A Systematic Review and Meta-Analysis. J Am Coll Cardiol 2009; 54: 1249-55.
25. Sargent RP, Shepard RM, Glantz SA. Reduced incidence of admissions for myocardial infarction associated with public smoking ban: before and after study. BMJ 2004; 328: 977-980.
26. Organización Mundial de la Salud. Directrices sobre la protección contra la exposición al humo de tabaco. Finalidad,objetivos y consideraciones principales.Ginebra: OMS; 2007.
27. Peto R, Lopez A. Future worldwide health effects of current smoking patterns. En: Koop C, Pearso CE, Schwars MR, Editors. Critical issues in global health San Fancisco: 2001, Wiley (Jossey-Bass); 2001.p.154-61.
28. Critchley JA, Capewell S. Abandono del hábito de fumar para la prevención secundaria de la cardiopatía coronaria [página en Internet].Oxford: The Cochrane Library; 2004. Disponible en: http://summaries.cochrane.org/es/CD003041/abandono-del-habito-de-fumar-para-la-prevencion-secundaria-de-la- cardiopatia-coronaria (consultado 15/11/ 2011).
29. Frey P, Waters DD, DeMico DA, Breazna A, Samuel L, Pipe A, et al. Impact of smoking on cardiovascular events in patients with coronary disease receiving contemporary medical therapy (from the Treating to New Targets [TNT] and the Incremental Decrease in End Points Through Aggressive Lipid Lowering [IDEAL] trials). Am J Cardiol 2011; 107: 145-50.
30. Sparrow D, Dawber TR. The influence of cigarette smoking on prognosis after a first myocardial infarction: a report from the Framingham study.J Chronic Dis 1978; 31: 425-32.
31. Doll R, Peto R, Boreham J, Sutherland I. Mortality from cancer in relation to smoking: 50 years observations on British doctors. Br J Cancer 2005; 92: 426-9.
32. Lee CW, Kahende J. Factors Associated With Successful Smoking Cessation in the United States, 2000. Am J Public Health 2007; 97: 1503-9.
33. Chapman S, Carter SM. Avoid health warnings on all tobacco products for just as long as we can: a history of Australian tobacco industry efforts to avoid, delay and dilute health warnings on cigarettes. Tob Control 2003; 12(Suppl 3): iii13-iii 22.
34. Silagy C. Consejo médico para dejar de fumar (Cochrane Review). The Cochrane Library, 2004(4).
35. Stead L, Lancaster T. Group behaviour therapy programmes for smoking cessation. The Cochrane Library 2004; 4.Oxford: Update Software. Obtenido de: http://cochrane.bvsalud.org [consultado 22/ 07/2011].
36. Eisenberg MJ, Filion KB, Yavin D, Délisle P, Mottillio S, Joseph L, et al. Pharmacotherapies for smoking cessation: a meta-analysis of randomized controlled trials. CMAJ2008; 179: 135-44.
37. Cahill K, Stead L, Lancaster T. Nicotine receptor partial agonists for smoking cessation. The Cochrane Library 2007; 1.Oxford Update Software Ltd. Obtenido de: http://cochrane.bvsalud.org [consultado 22/07/2011].
38. Hughes J, Stead L, Lancaster T. Antidepressants for smoking cessation. The Cochrane Library 2004; 4. Oxford: Update Software Ltd. Obtenido de: http://cochrane.bvsalud.org [consultado 22/07/ 2011].
39. Gourlay S, Stead L, Benowitz N. Clonidine for smoking cessation. The Cochrane Library 2004; 4.Oxford: Update Software Ltd. Obtenido de: http://cochrane.bvsalud.org [consultado 22/07/2011].
40. Benowitz NL. Nicotine Adiction. N Engl J Med 2010; 362: 2295-303.
41. Balfour DJK. The psychobiology of nicotine dependence. European Respiratory Review 2008; 17: 172-81.
42. Zabert G, Guerreros A, Smith R, Bianco E, Sandoval R, Morales E, et al. Actualizaciones latinoamericanas sobre prevención y tratamiento del tabaquismo. México; 2010.
43. Fiore MC, Jaén CR, Baker TB, Bailey WC, Benowitz NL, Curry SJ, et al. Treating Tobacco Use and Dependence: 2008 Update. U.S Department of Health and Human Services, Public Health Service; 2008.
44. Jiménez-Ruiz C, de Granda Orive JI, Solano Reina S, Carrión Valero F, Romero Palacios P, Barrueco Ferrero M; SEPAR. Recomendaciones para el tratamiento del tabaquismo. Arch Bronconeumol 2003; 39: 514-23.
45. Joseph AM, Fu SS. Smoking cessation for patients with cardiovascular disease: what is the best approach? Am J Cardiovasc Drugs 2003; 3: 339-49.
46. Joseph A, Fu SS. Safety issues in pharmacotherapy for smoking in patients with cardiovascular disease. Progr Cardiovasc Dis 2003; 45: 429-31.
47. Jiménez Ruiz CA, Solano Reina S, González de Vega JM, Ruiz Pardo M, Flórez Martín S, Ramos Pinedo A, et al. Normativa para el tratamiento del tabaquismo. Arch Bronconeumol 1999; 35: 499-506.
48. Jimenez-Ruiz CA, Fagerstrom KO, Iglesias Sanz B, Galán Parra MD. Reducción en el consumo del tabaco como paso previo a la cesación. Concepto. Razones que lo explican. Prev Tab 2006; 8(supl.1): 23-7.
49. Jimenez-Ruiz CA, Fargerstrom KO. Reducción hasta dejarlo: árbol de decisión. Prev Tab 2006; 8(Supl.1): 34-7.
50. Jimenez-Ruiz C, Solano S, Viteri SA, Ferrero MB, Torrecilla M, Mezquita MH. Harm reduction: a treatment approach for resistant smokers with tobacco-related symptoms. Respiration 2002; 69: 452-5.
51. Falba T, Jofre-Bonet M, Bush S, Duchovny N, Sindelar J. Reduction of quantity smoked predicts future cessation among older smokers. Addiction 2004; 99: 93-102.
52. Murray PR, Bailey W, Daniels K, Bjoruson WM, Kurnov R, Connett J, et al. Safety of nicotine policrilex gum used by 3094 participants in the lung health study. Chest 1996; 109: 438-45.
53. Joseph A, Norman S, Ferry L, Prochezke A, Westman E, Steel B, et al. The safety of transdermal nicotine as an aid to smoking cessation in patients with cardiac disease. N. Engl J Med 1996; 335: 1792-8.
54. Área de tabaquismo de Sociedad Española de Neumología y Cirugía Torácica (CEPAR). Guía de tratamiento del tabaquismo. Traducción al español de la actualización del año 2008 de la guía de tratamiento del tabaquismo del US.Deparment of Health and Human Service: CEPAR; 2009.
55. Stead LF, Perera R, Bullen C, Mant D, Lancaster T. Nicotine replacement therapy for smoking cessation. The Cochraene Library 2008; 1. Obtenido de: http://cochrane.bvsalud.org [consultado 22/ 07/2011].
56. Jiménez Ruiz CA, Riesco Miranda JA, Ramos Pinedo A, Barrueco Ferrero M, Solano Reina S, de Granda Orive JI, et al. Recomendaciones para el tratamiento farmacológico del tabaquismo. Propuesta de financiación. Arch Bronconeumol 2008; 44: 213–9.
57. Fiore M, Baker T. Treating Smokers in the Health Care Setting. N Engl J Med 2011; 365: 1222-31.
58. Jiménez Ruiz CA, Fagerström KO. Reducción hasta dejarlo: árbol de decisión. Prev Tab 2006; (Supl 1): 34-7.
59. Pisinger C, Vestbo J, Borch-Johnsen K, Jorgensen T. Smoking reduction intervention in a large population-based study. Prev Med 2005; 40: 112-8.
60. Moore D, Aveyard P, Connock M, Wang D, Fry-Smith A, Barton P. Effectiveness and safety of nicotine replacement therapy assisted reduction to stop smoking: systematic review and meta-analysis. BMJ 2009; 338: b1024-b1024.
61. Dautzenberg M. Multicentre controlled study with nicotine pills. SRNT European Conference, 3. Paris, 2001.
62. Lerman C, Shields PC, Wileyto EP, Audrain J, Hawk LH, Pinto A, et al. Effects of dopamine transporter and receptor polymorphins on smoking cessation in a bupropion clinical trial. Health Psychol 2003; 22: 541-8.
63. Cryan J, Bruijnzeel AW, Skjei KL, Markou A. Bupropion enhances brain reward function and reverses the affective and somatic aspects of nicotine withdrawal in the rat. Psychopharmacology (Berl)2003; 168: 347-58.
64. Fagerstrom KO, Jimenez-Ruiz CA. Pharmacological treatments for tobacco dependence. Eur Respir Rev 2008; 17: 192-8.
65. Balfour DJK. The pharmacology underlying pharmacotherapy for tobacco dependence: a focus on bupropión. Int J Clin Pract 2001; 56: 79-83.
66. Cryan JF, Bruijnzeel AW, Skjei KL, Markou A. Bupropion enhances brain reward function and reverses the affective and somatic aspects of nicotine withdrawal in the rat. Psychopharmacology (Berl)2003; 168: 347–58.
67. Jarvis M, Powell S, Marsh H. A meta-analysis of clinical studies confirms the effectiveness of bupropion SR in smoking cessation. Annual Conference of the Society for Research of Nicotine and Tobacco, 7. Seattle, 2001.
68. Hughes JR, Stead LF, Lancaster T. Antidepressants for smoking cessation. The Cochrane Library 2004; 4. Oxford: Update Software Ltd. Obtenido de: http://cochrane.bvsalud.org [consultado 22/07 /2011].
69. Tonstad S, Farsang D, Klaene G, Lewis K, Manolis A, Perrouchoud AP, et al. Bupropion SR for smoking cessation in smokers with cardiovascular disease: a multicentre, randomised study. Eur Heart J 2003; 24: 946-55.
70. Hubbar R, Lewis S, West J, Smith C, Godfrey C, Smeeth L, et al. Bupropion and the risk of sudden death: a self- controlled case series analyses using the Health Improvement Network. Thorax 2005; 60: 848-50.
71. Zatonski W, Cdzynska M, Tutka P, West R. An uncontrolled trial of cytisine (Tabex) for smoking cessation. Tob Control 2006; 15: 481-4.
72. Etter JF. Cytisine for smoking cessation: a literature review and meta-analysis. Arch Intern Med 2006; 166: 1553-9.
73. Rollema H, Hajós M, Seymour PA, Kozak R, Majchrzak MJ, Guanowsky V, et al. Preclinical pharmacology of the a4b2 nAChR partial agonist varenicline related to effects on reward, mood and cognition. Biochem Pharmacol 2009; 78: 813-14.
74. Zabert G. Vareniclina un nuevo agonista parcial del receptor nicotinico. Rev Argent Med Respir 2006; 3: 148-51.
75. Tonstad S, Holme I, Tonnesen P. Dianicline, a Novel alpha4 beta2 Nicotinic Acetylcholine Receptor Partial Agonist, for Smoking Cessation: A Randomized Placebo-Controlled Clinical Trial. Nicotine & Tobacco Research 2011; 13: 1-6.
76. Tapper A, Knney SL, Nashimi R. Nicotine activation of alpha4 receptors: sufficient for reward, tolerance, and sensitization. Science 2004; 306: 1029-32.
77. Zierler-Brown SL, Kyle JA. Oral varenicline for smoking cessation. Ann Pharmacother 2007; 41: 95-9.
78. Cahill K, Stead L, Lancaster T. Nicotine receptor partial agonist for smoking cessation. The Cochrane Library. Cochrane Database 2011; 2. Oxford : Update Software Ltd. Obtenido de: http://cochrane.bvsalud.org [consultado 22/07/2011].
79. Gunnell D, Irvine D, Wise L, Davies C, Martin RM. Varenicline and suicidal behaviour: a cohort study based on data from the General Practice Research Database. BMJ 2009; 339: b3805.
80. Tonstad S, Davies S, Flammer M, Russ C, Hughes J. Psychiatric adverse events in randomized, double-blind, placebo-controlled clinical trials of varenicline: a pooled analysis. Drug Saf 2010; 33: 289-301.
81. West R, Zatonsky W, Cedzynska M, Lewandowska D, Pazik J, Aveyard P, et al. Placebo-controlled Trial of Cytisine for smoking Cessation. N Engl J Med 2011; 365: 1193-200.
82. Singh S, Loke YK, Spangler JG, Furberg CD. Risk of serious adverse cardiovascular events associated with varenicline: a systematic review and meta-analysis. CAMJ 2011; 183: 1359-66.
83. Takagi H, Umemoto T. Varenicline: quantifying the risk. CMAJ 2011; 183: 1404.
84. Woods DJ, Caswell MD. Varenicline: quantifying the risk.CMAJ 2011; 183: 1404.
85. Jiménez Ruiz CA, Zabert G, Buljubasich D, Sandoya E. Lo que sabemos, lo que dudamos y lo que no sabemos. Prev Tab 2011; 13: 98-101.
86. European Medicines Agency. Science Medicines Health. European Medicines Agency confirms positive benefit-risk balance for Champix [página en Internet].London: EMA; c1995-2011. Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2011/07/news_detail_001314.jsp&mid=WC0b01ac058004d5c1&jsenabled=true (consultado 22/07/2011).
87. FDA U.S. FDA Drug Safety Communication: Chantix (varenicline) drug label now contains updated efficacy and safety information [página en Internet]: FDA; 2011. Disponible en: http://www.fda. gov/Drugs/DrugSafety/ucm264436.htm (consultado 22/07/2011).
88. Rigotti NA, Pipe AL, Benowitz NL, Arteaga C, Garza D, Tonstad S. Efficacy and safety of varenicline for smoking cessation in patients with cardiovascular disease: a randomized trial. Circulation 2010; 121: 221-9.