Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.26 no.3 Montevideo dic. 2011
REVISIÓN
Impacto del humo de segunda mano a nivel cardiovascular
DR. EDGARDO SANDOYA
Centro para la Investigación para la Epidemia de Tabaquismo (CIET), Montevideo.
PALABRAS CLAVE:
TABAQUISMO
CONTAMINACIÓN POR HUMO DE TABACO
FACTORES DE RIESGO
KEY WORDS:
SMOKING
TOBACCO SMOKE POLUTTION
RISK FACTORS
INTRODUCCIÓN
La primera afección que se vinculó al consumo de tabaco fue el cáncer de pulmón, una enfermedad muy poco frecuente antes de la comercialización masiva del cigarrillo (1). Dado que el humo de tabaco es su principal determinante, la asociación de esta patología con el tabaquismo activo inicialmente y con el tabaquismo pasivo posteriormente, fue relativamente sencilla de establecer (2). En la cardiopatía isquémica, por el contrario, confluyen diversos factores en su determinismo, lo que hizo que se demorase más tiempo en establecer que el tabaquismo causaba enfermedad coronaria (3). Una vez que quedó demostrada esta relación, se comprobó que el cigarrillo mataba a más gente por enfermedad cardiovascular que por cáncer de pulmón. Por su parte, la relación entre el tabaquismo pasivo o humo de segunda mano (HSM) y la enfermedad coronaria fue establecida luego que la acumulación de evidencia lo hiciera patente, lo que ocurrió hace unos 20 años (4).
El HSM ejerce su efecto deletéreo mediante dos componentes: la corriente lateral y la corriente central. La corriente lateral es la que emerge del extremo del cigarrillo y representa el 85% del total del efecto, mientras que la central, constituida por el humo inhalado y exhalado por el fumador, es responsable del 15% restante. Las diferencias entre ambas se deben, probablemente, a la menor temperatura y a una combustión menos completa del cigarrillo encendido. La concentración de las numerosas toxinas del humo de cigarrillo aumenta hasta 100 veces en la corriente lateral con respecto a la central (5).
Los efectos deletéreos del HSM son vehiculizados por micropartículas con un diámetro menor a 2,5 micras (PM2,5), las que transportan los más de 5.000 componentes tóxicos del humo de cigarrillo. Para tener idea de la pequeñez de su tamaño, téngase en cuenta que 24 de ellas colocadas lado a lado cabrían en un cabello humano, cuyo diámetro es de unas 60 micras. Al ser inhaladas estas partículas penetran profundamente en la vía respiratoria, alcanzando rápidamente a los aproximadamente 200 m2 de tejido alveolar.
MECANISMOS DEL DAñO
El HSM tiene marcado impacto negativo sobre el sistema cardiovascular, determinando daños de magnitud casi similares a los que afectan al fumador (6). Estos daños se producen por diversos mecanismos, los que se listan en la tabla 1.

ALTERACIóN DE LA FUNCIóN ENDOTELIAL
Luego de 15-30 minutos de exposición al HSM se produce una alteración de la función endotelial con reducción de la vasodilatación endotelio-dependiente (7,8); la que se observa tanto en no fumadores como en fumadores (9).
La exposición por 20 minutos al HSM se asocia con un aumento del nivel circulante de carcasas de células endoteliales, un indicador de daño del endotelio (10).
Estudios experimentales muestran que la exposición al HSM lleva a que las células tengan vacuolas anormales y grupos de microtúbulos dañados. A ello se suma la disrupción de los complejos de unión entre las células adyacentes con elevación de la superficie de las células endoteliales, lo que se traduce en un aumento de la permeabilidad vascular y de la ateroesclerosis. Además el tabaquismo pasivo altera el sistema de reparación del endotelio, lo que incrementa la patología arterial (11).
Cuando termina la exposición de largo tiempo al HSM la dilatación endotelio-dependiente muestra mejoría al cabo de un año, que se incrementa a los dos años, pero persiste cierto grado de deterioro en comparación con quienes nunca estuvieron expuestos (12).
AUMENTO DE LA RIGIDEZ ARTERIAL
Los individuos sanos, respirando durante una hora el HSM de 15 cigarrillos en un ambiente no ventilado, experimentan un aumento significativo de la rigidez aórtica (13). El 50% del aumento ocurre a los 15 minutos y alcanza una situación estable después de 30 minutos, observándose entonces un aumento de la presión arterial tanto a nivel braquial como aórtico. Estos cambios son más marcados que los observados cuando un no fumador fuma un único cigarrillo (14). Otro estudio mostró que la rigidez aórtica aumenta a los 4 minutos de tabaquismo pasivo, similar a los efectos observados en los fumadores activos (15).
Un estudio epidemiológico mostró aumento de la rigidez arterial asociado con exposición al HSM (16). En personas con índice de masa corporal (IMC) >27 kg/m2 expuestas al HSM hubo un aumento del índice de rigidez arterial de 12,2 a 20,7 (17).
ACTIVACIÓN PLAQUETARIA
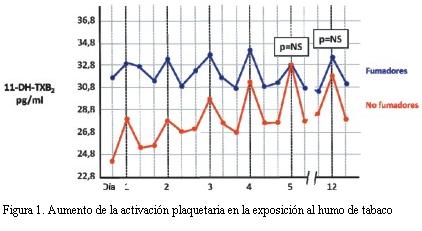
La exposición al HSM activa las plaquetas aumentando así la probabilidad de formación de trombos (18). Estas plaquetas activadas pueden, además de formar trombos, dañar el endotelio coronario facilitando el desarrollo y la progresión de las lesiones ateroscleróticas (19,20). La activación plaquetaria medida por la concentración plasmática de tromboxano está aumentada en los fumadores pasivos, llegando a alcanzar los niveles observados en los fumadores, como fuera demostrado entre individuos sanos (21). En dicha investigación fumadores y no fumadores se expusieron durante 60 minutos al humo de tabaco en una habitación cerrada de 18 m2, determinándose sus niveles de tromboxano (11-DH-TXB2) antes, durante y después de la exposición. En la figura 1 se aprecian los valores hallados, donde se observa que antes de la exposición la activación plaquetaria era más elevada en fumadores que en no fumadores y cómo se incrementaba la activación en unos y otros. Con el correr de los días los niveles de activación en los no fumadores fueron ascendiendo, hasta que luego de cinco días de exposición la activación plaquetaria fue similar en fumadores y no fumadores (p>0,05). A los 12 días, y luego de una semana sin haber estado expuestos al HSM, la activación plaquetaria siguió siendo similar entre fumadores y no fumadores (p>0,05), lo que muestra la persistencia del efecto deletéreo.
El fibrinógeno, un mediador de la activación plaquetaria, se halla elevado en los fumadores pasivos (6).
El aumento de la activación plaquetaria se asocia con mayor riesgo de enfermedad coronaria, aumentando marcadamente el riesgo de infarto agudo de miocardio (IAM) (22).
INFLAMACIóN, OXIDACIóN, LíPIDOS
La inflamación tiene un rol central en la patogénesis de la aterosclerosis (20), siendo uno de los precursores de la placa aterosclerótica (23). Los adultos y los niños expuestos al HSM tienen niveles elevados de diversos marcadores inflamatorios, tales como leucocitos, proteína C-reactiva, homocisteína y fibrinógeno (24,25). Las proteínas de fase aguda, otro marcador inflamatorio, están más elevadas en niños de hogares de fumadores que en los provenientes de hogares donde no hay fumadores (26). Asimismo se ha observado aumento de los neutrófilos y de la leucocitosis en no fumadores luego de tres horas de respirar HSM (27).
La exposición al HSM determina estrés oxidativo (28), el que obedece a los oxidantes que transportan las PM2,5 y a la liberación de radicales libres a partir de los neutrófilos activados. En los fumadores se produce una adaptación ante el estrés oxidativo, lo que se refleja en niveles elevados de enzimas antioxidantes (29). En los no fumadores no existe esta adaptación, por lo que el HSM dañaría el mecanismo antioxidante (30).
En presencia de radicales libres y estrés oxidativo aumentado, el colesterol LDL se convierte a LDL oxidado, determinando diversos efectos negativos en la pared arterial. A nivel experimental se ha visto que exposiciones breves al HSM aumentan de forma significativa la acumulación de lípidos en la pared arterial (31).
La aceleración en el desarrollo de la aterosclerosis no solo obedece a la alteración del colesterol LDL, sino que también es favorecida por el descenso del colesterol HDL (32), el que ocurre ante la exposición crónica al HSM así como también luego de la exposición aguda (33).
INESTABILIDAD DE LA PLACA
Los fumadores pasivos tienen mayor cantidad de lesiones coronarias que los no fumadores; un estudio realizado en esposas de fumadores encontró que existía mayor cantidad de lesiones coronarias cuando mayor era la cantidad de años fumados por sus esposos (34). El HSM aumenta la secreción de metaloproteinasas por las células endoteliales y del músculo liso, enzimas estas que contribuyen a debilitar la pared arterial, pudiendo provocar desestabilización y ruptura de las placas ateroscleróticas (35,36).
TAMAñO DEL INFARTO
El HSM aumenta el tamaño del IAM en los modelos experimentales de una forma dosis-dependiente (37). Un grupo de investigadores expuso a ratas durante seis semanas al HSM en una concentración similar a la observada en los bares, y luego indujo un IAM ligando la coronaria izquierda. La exposición de 180 horas determinó infartos del doble de tamaño que los observados en las ratas no expuestas. Otra investigación expuso a ratas preñadas, a ratas de cuatro semanas y a ratas adolescentes al HSM provocándose luego un IAM, observándose aumento del tamaño del infarto en todos los casos, lo que se asoció a cambios de tamaño, forma y grosor en los segmentos infartados y no infartados determinando remodelación ventricular izquierda (38).
IMPACTO SOBRE EL SISTEMA NERVIOSO AUTóNOMO
La variabilidad de la frecuencia cardíaca brinda información acerca de la propensión a desarrollar arritmias malignas y muerte cardiovascular. El tabaquismo pasivo estimula la actividad nerviosa simpática e inhibe los aferentes vagales al corazón (39), reduciendo la variabilidad de la frecuencia cardíaca, tal cual se observó en no fumadores al exponerse al HSM en el área de fumadores de un aeropuerto (40). Luego de dos horas de exposición hubo una reducción de 12% en la variabilidad de la frecuencia cardíaca, lo que se halla asociado a un aumento de la fibrilación y la taquicardia ventricular después de un IAM. En las dos horas siguientes a cesar la exposición al HSM la variabilidad volvió a sus niveles basales. La reducción en la variabilidad es probable que esté mediada por las PM2,5, las que determinan reducción del input parasimpático al corazón promoviendo así la aparición de arritmias fatales (41).
EFECTOS CLíNICOS DEL HUMO DE SEGUNDA MANO
El HSM determina tanto efectos agudos como efectos crónicos, los que se producen a nivel coronario y cerebrovascular.
ENFERMEDAD CORONARIA
Una investigación realizada entre 4.729 hombres seguidos durante 20 años mostró que el HSM aumenta el riesgo de enfermedad coronaria en 45%, que puede llegar hasta 57% ante mayores niveles de exposición al HSM (42). Un metaanálisis de 29 investigaciones epidemiológicas mostró que los no fumadores expuestos al HSM tienen aumento de enfermedad coronaria: odds ratio 31% (IC 95% 21-41) (9).
ACCIDENTE CEREBROVASCULAR
Se ha encontrado una asociación positiva entre la exposición al HSM y el riesgo de padecer un accidente cerebrovascular (ACV): odds ratio 1,82, IC 95% 1,34-2,49) (43). Un estudio llevado a cabo en EE.UU. en 19.000 no fumadores a los que se siguió durante 12 años mostró aumento de la mortalidad por ACV entre las mujeres expuestas al HSM: odds ratio 1,24 (IC 95% 1,03-1,40) (44).
EFECTOS AGUDOS
Estudios observacionales realizados en Oceanía y en Argentina sugirieron que la exposición al HSM aumentaba la incidencia de IAM (45,46). En el estudio argentino, el tabaquismo pasivo estuvo asociado a un aumento del IAM entre los no fumadores de ambos sexos.
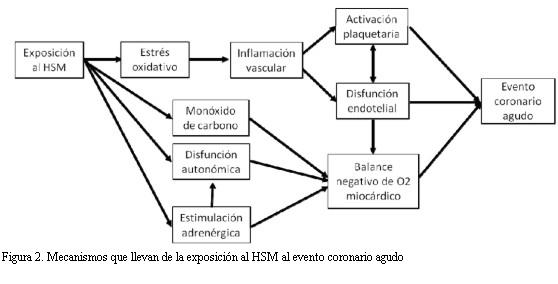
Los efectos agudos del HSM se desencadenan a partir de estrés oxidativo, estimulación adrenérgica, disfunción autonómica y aumento de la concentración de monóxido de carbono, todo lo que puede desencadenar un IAM mediante el proceso ilustrado en la figura 2, el que puede determinar un evento agudo en tan solo 30 minutos (47).
BENEFICIOS DE LA CESACIóN DE LA EXPOSICIóN AL HSM
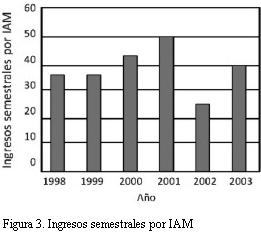
Una observación realizada en la ciudad de Helena (Montana, EE.UU.) planteó la hipótesis de que la prohibición de fumar en espacios cerrados se asociaría a una reducción de las internaciones por IAM (48). En el único hospital de esta ciudad se observó que en los seis meses que siguieron a la prohibición de fumar en espacios cerrados, implantada en junio de 2002, se redujeron los ingresos por IAM (figura 3). En diciembre de 2002 la prohibición fue levantada por orden judicial, observándose que en los seis meses siguientes los ingresos volvieron a incrementarse como puede apreciarse en la figura 3.
Luego de esta observación fueron llevadas a cabo varias investigaciones en diversas ciudades y regiones del hemisferio norte, las que mostraron resultados disímiles; pero un metaanálisis de todos los estudios existentes mostró una reducción de 17% del IAM luego de la prohibición de fumar en espacios cerrados (49).
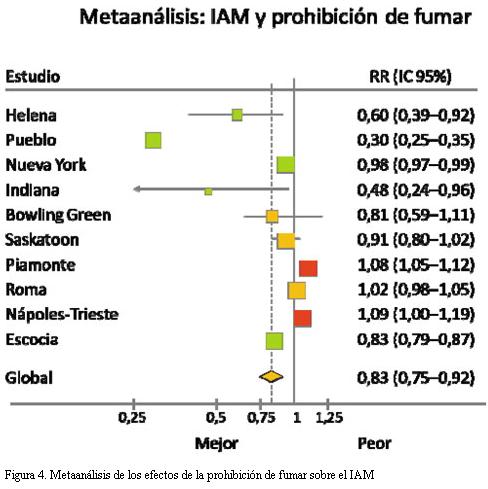
La prohibición de fumar en espacios cerrados, para tener impacto sobre la salud de los individuos, debe ser acatada por la población, por lo que los beneficios observados en un lugar no necesariamente pueden ser extrapolados a otro. En el metaanálisis de la figura 4 puede observarse que no en todos los casos hubo reducción del IAM.
Si bien el metaanálisis de todos los estudios muestra una reducción de 17% de los IAM, si se observa con detalle se puede apreciar que hubo varios estudios cuyo resultado no fue significativo (Bowling Green, Saskatoon y Roma) y otros donde se observó incremento de los eventos (Piamonte y Nápoles-Trieste). Esto podría obedecer a que en los dos primeros estudios (realizados en ciudades de EE.UU. y Canadá) antes de la prohibición de fumar era una práctica social extendida no fumar en espacios cerrados, mientras que el ligero aumento observado en los estudios italianos podría obedecer a un escaso acatamiento a la prohibición de fumar en espacios cerrados, aunque otros factores, como el tiempo de implementada la prohibición de fumar, pueden impactar sobre el resultado (49).
Por esa razón en Uruguay se realizó una investigación en la que se relevaron todos los pacientes ingresados por IAM entre marzo de 2004 y febrero de 2008 en 37 centros del país, comprobándose que en los dos años siguientes a la prohibición de fumar en espacios cerrados, establecida el 1º de marzo de 2006, hubo una reducción de 22% de los ingresos por IAM en relación a los dos años previos (50).
CONCLUSIÓN
El consumo de tabaco es la principal causa evitable de muerte y de enfermedad a escala mundial. El HSM determina múltiples alteraciones a nivel cardiovascular: alteración de la función endotelial, aumento de la rigidez arterial, activación plaquetaria, inflamación, aumento del estrés oxidativo, aumento de LDL, reducción del HDL, inestabilidad de la placa y alteración del sistema nervioso autónomo, todo lo que se asocia a riesgo aumentado de enfermedad coronaria, de ACV y de IAM. Este último puede desencadenarse con una exposición de tan solo 30 minutos al HSM.
La prohibición de fumar en espacios cerrados de uso público mejora la salud cardiovascular, determinando reducción de los IAM, algo que también ha sido verificado en nuestro país. Por tanto es muy importante que esta norma sea cumplida en todo momento en todo lugar cerrado de uso público, así como evitar la exposición al HSM dentro de hogares y automóviles, donde de forma involuntaria pueden verse afectados tanto adultos como niños.
BIBLIOGRAFíA
1. Glantz SA, Parmley WW. Passive smoking and heart disease. Epidemiology, physiology, and biochemistry. Circulation 1991; 83: 1-12.
2. Doll R, Hill AB. A study of the aetiology of carcinoma of the lung. Br Med J 1952; 2: 1271-86.
3. US Public Health Service. The Health Consequences of Smoking: Cardiovascular Disease: A Report of the Surgeon General. DHHS (PHS)84-50204, 1983.
4. Wells A. An estimate of adult mortality in the United States from passive smoking. Environ Int 1988; 14: 249-65.
5. Kritz H, Schmid P, Sinzinger H. Passive smoking and cardiovascular risk. Arch Intern Med 1995; 155: 1942-8.
6. Hirayama T. Nonsmoking wives of heavy smokers have a higher risk of lung cancer: A study from Japan. Br Med J 1981; 282: 183-5.
7. Glantz S, Parmley W. Even a little secondhand smoke is dangerous. JAMA 2001; 286: 462-3.
8. Kato M, Roberts-Thomson P, Phillips BG, Narkiewicz K, Haynes WG, et al. The effects of short-term passive smoke exposure on endothelium-dependent and independent vasodilation. J Hypertens 1999; 17: 1395-401.
9. Barnoya J, Glantz S. Cardiovascular Effects of Secondhand Smoke. Circulation 2005; 111: 2684-98.
10. Wells AJ. Passive smoking as a cause of heart disease. J Am Coll Cardiol 1994; 24: 546-54.
11. Lee TY, Gotlieb AI. Microfilaments and microtubules maintain endotelial integrity. Microsc Res Tech 2003; 60: 115–27.
12. Raitakari OT, Adams MR, McCredie RJ, Griffiths KA, Celermajer DS. Arterial endothelial dysfunction related to passive smoking is potentially reversible in healthy young adults. Ann Intern Med 1999; 130: 578-81.
13. Stefanadis C, Vlachopoulos C, Tsiamis E, Diamantopoulos L, Toutouzas K, Giatrakos N et al. Unfavorable effect of passive smoking on aortic function in men. Ann Intern Med 1998; 128: 426-34.
14. Mahmud A, Feely J. Effect of smoking on arterial stiffness and pulse pressure amplification. Hypertension 2003; 41: 183-7.
15. Stefanadis C, Tsiamis E, Vlachopoulos C, Stratos C, Toutouzas K, Pitsavos C, et al. Unfavorable effect of smoking on the elastic properties of the human aorta. Circulation 1997; 95: 31-8.
16. Mack WJ, Islam T, Lee Z, Selzer RH, Hodis HN. Environmental tobacco smoke and carotid arterial stiffness. Prev Med 2003; 37: 148-54.
17. Howard G, Burke GL, Szklo M, Tell G, Eckfeldt J, Evans G, et al. Active and passive smoking and are associated with increased carotid artery wall thickness: the Atherosclerosis Risk in Communities Study. Arch Intern Med 1994; 154: 1277-82.
18. Pittilo RM, Mackie IJ, Rowles PM, Machine SJ, Woolf N. Effects of cigarette smoking on the ultrastructure of rat thoracic aorta and its ability to produce prostacyclin. Thromb Haemost 1982; 48: 173-6.
19. Steinberg D, Parthasarathy S, Carew TE, Khoo JC, Witztum JL. Beyond cholesterol: modifications of low-density lipoprotein that increase its atherogenicity. New Engl J Med 1989; 320: 915-24.
20. Davis JW, Shelton L, Watanabe IS, Arnold J. Passive smoking affects endothelium and platelets. Arch Int Med 1989; 149: 386–9.
21. Schmid P, Karanikas G, Kritz H, Pirich C, Stamatopoulos Y, Peskar B, et al. Passive smoking and platelet thromboxane. Thromb Res 1996; 81: 451-60.
22. Elwood PC, Renaud S, Sharp DS, Beswick AD, O’Brien JR, Yarnell JWG. Ischemic heart disease and platelet aggregation: the Caerphilly Collaborative Heart Disease Study. Circulation 1991; 83: 38-44.
23. Shima M, Adachi M. Effects of environmental tobacco smoke on serum levels of acute phase proteins in schoolchildren. Prev Med 1996; 25: 617-24.
24. Nakata A, Tanigawa T, Araki S, Sakurai S, Iso H. Lymphocyte subpopulations among passive smokers. JAMA 2004; 291: 1699-700.
25. Panagiotakos DB, Pitsavos C, Chrysohoou C, Skoumas J, Masoura C, Toutouzas P, et al. Effect of exposure to secondhand smoke on markers of inflammation. Am J Med 2004; 116: 145-50.
26. Shima M, Adachi M. Effects of environmental tobacco smoke on serum levels of acute phase proteins in schoolchildren. Prev Med 1996; 25: 617-24.
27. Nakata A, Tanigawa T, Araki S, Sakurai S, Iso H. Lymphocyte subpopulations among passive smokers. JAMA 2004; 291: 1699-700.
28. Visioli F, Galli C, Plasmati E, Viappiani S, Hernandez A, Colombo C, et al. Olive phenol hydroxytyrosol prevents passive smoking-induced oxidative stress. Circulation 2000; 102: 2169-71.
29. McCusker K, Hoidal J. Selective increase of antioxidant enzyme activity in the alveolar macrophages from cigarette smokers and smoke-exposed hamsters. Am Rev Respir Dis 1990; 141: 678-82.
30. Otsuka R, Watanabe H, Hirata K, Tokai K, Muro T, Yoshiyama M, et al. Acute effects of passive smoking on the coronary circulation in healthy young adults. JAMA 2001; 286: 436-41.
31. Roberts KA, Rezai AA, Pinkerton KE, Rutledge JC. Effect of environmental tobacco smoke on LDL accumulation in the artery wall. Circulation 1996; 94: 2248-5.
32. Mizoue T, Ueda R, Hino Y, Yoshimura T. Workplace exposure to environmental tobacco smoke and high density lipoprotein colesterol among nonsmokers. Am J Epidemiol 1999; 150: 1068-72.
33. Moffatt RJ, Chelland SA, Pecott DL, Stamford BA. Acute exposure to environmental tobacco smoke reduces HDL-C and HDL2-C. Prev Med 2004; 38: 637-41.
34. He Y, Lam T, Li LS, Du R, Jia G, Huang J, et al. The number of stenotic coronary arteries is associated with the amount of passive smoking exposure. Atherosclerosis 1996; 127: 229-38.
35. Szmitko PE, Wang C-H, Weisel RD, de Almeida JR, Anderson TJ, Verma S. New markers of inflammation and endothelial cell activation: part I. Circulation 2003; 108: 1917-23.
36. Galis ZS, Khatri JJ. Matrix metalloproteinases in vascular remodeling and atherogenesis: the good, the bad, and the ugly. Circ Res 2002; 90: 251-62.
37. Zhu BQ, Sun YP, Sievers RE, Glantz SA, Parmley WW, Wolfe CL. Exposure to environmental tobacco smoke increases myocardial infarct size in rats. Circulation 1994; 89: 1282-90.
38. Zhu BQ, Sun YP, Sudhir K, Sievers RE, Browne AE, Gao L, et al. Effects of second-hand smoke and gender on infarct size of young rats exposed in utero and in the neonatal to adolescent period. J Am Coll Cardiol 1997; 30: 1878-85.
39. Hausberg M, Mark AL, Winniford MD, Brown RE, Somers VK. Sympathetic and vascular effects of short-term passive smoke exposure in healthy nonsmokers. Circulation 1997; 96: 282-7.
40. Pope CA, Eatough DJ, Gold DR, Pang Y, Nielsen KR, Nath P, et al. Acute exposure to environmental tobacco smoke and heart rate variability. Environ Health Perspect 2001; 109: 711-6.
41. Brook RD, Franklin B, Cascio W, Hong Y, Howard G, Lipsett M, et al. Air pollution and cardiovascular disease: a statement for healthcare professionals from the American Heart Association. Circulation 2004; 109: 2655-71.
42. Whincup PH, Gilg JA, Emberson JR, Jarvis MJ, Feyerabend C, Bryant A, et al. Passive smoking and risk of coronary heart disease and stroke: prospective study with cotinine measurement. BMJ 2004; 329: 200-5.
43. Bonita R, Duncan J, Truelsen T, Jackson RT, Beaglehole R. Passive smoking as well as active smoking increases the risk of acute stroke. Tobacco Control 1999; 8: 156-60.
44. Sandler DP, Comstock GW, Helsing KJ, Shore DL. Deaths from all causes in non-smokers who lived with smokers. Am J Public Health 1989; 79: 163-7.
45. McElduff P, Dobson AJ, Jackson R, Beaglehole R, Heller RF, Lay-Yee R. Coronary events and exposure to environmental tobacco smoke: a case–control study from Australia & New Zealand. Tob Control 1998; 7: 41-6.
46. Ciruzzi M, Pramparo P, Esteban O, Rozlosnik J, Tartaglione J, Abecasis B, et al. Case–control study of passive smoking at home and risk of acute myocardial infarction. Argentine FRICAS. J Am Coll Cardiol 1998; 31: 797-803.
47. Raupach T, Schafer K, Stavros K, Andreas S. Secondhand smoke as an acute threat for the cardiovascular system: a change in paradigm. Eur Heart J 2006; 27: 386-92.
48. Sargent RP, Shepard RM, Glantz SA. Reduced incidence of admissions for myocardial infarction associated with public smoking ban: before and after study. BMJ 2004; 328: 977-83.
49. Lightwood J, Glantz S. Declines in acute myocardial infarction after smoke-free laws and individual risk attributable to secondhand smoke. Circulation 2009; 120: 1373-9.
50. Sandoya E, Sebrié E, Bianco E, Araújo O, Correa A, Davyt O, et al. Impacto de la prohibición de fumar en espacios cerrados sobre los ingresos por infarto agudo de miocardio en Uruguay. Rev Med Urug 2010; 26: 206-15.