Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.25 no.2 Montevideo set. 2010
ARTÍCULO DE REVISIÓN
La apnea del sueño como factor de riesgo de enfermedad cardiovascular
DR. CARLOS E. ROMERO 1
1. Prof. de Cardiología. Facultad de Medicina, UdelaR.
Correo electrónico: romeroca@adinet.com.uy
Recibido julio 9, 2010; aceptado setiembre 4, 2010.
A propósito de la revisión de Arce y colaboradores (1) sobre apnea del sueño (AS) y fibrilación auricular, nos ha parecido oportuno revisar otros puntos de contacto entre los disturbios respiratorios del sueño, en particular la AS y las enfermedades cardiovasculares (ECV). Somos conscientes de que nuestra visión puede estar sesgada por nuestra formación exclusivamente cardiológica.
Este es un tema vigente: desde hace muchos años se conocen manifestaciones cardiovasculares del sueño y sus alteraciones, pero desde hace sólo 15 años se advierte la asociación entre la AS y las ECV, tal como surge del análisis de la tabla 1.
TABLA 1. NúMERO DE PUBLICACIONES REGISTRADAS EN PUBMED CON LAS EXPRESIONES SLEEP, SLEEP APNEA, CARDIOVASCULAR Y CARDIOVASCULAR DISEASE EN EL TíTULO.
Naturalmente, buena parte de las revisiones a las que hemos podido acceder son reiterativas. Entre los documentos más completos destacamos un Scientific Statement de la American Heart Association y el American College of Cardiology (SS/AHA/ACC) de 2008 que tiene precisamente por título Sleep Apnea and Cardiovascular Disease (2) y sendas publicaciones de los National Institutes of Health de EEUU (3,4).
Otra publicación destacable, de carácter más general es el Documento de Consenso Nacional sobre el Síndrome de Apneas-hipopneas del sueño, del Grupo Español de Sueño de setiembre de 2005 (5).
Todas las publicaciones mencionadas están disponibles a texto completo en Internet.
Definiciones
En la tabla 2 presentamos algunas definiciones corrientes.

Severidad
La tabla 3 muestra escalas de severidad habitualmente aceptadas.

Frecuencia
Datos publicados por Punjabi y colaboradores (6) acerca de la prevalencia de la AS en población general se presentan en la tabla 4. Se estima que en EEUU hay 15 millones de pacientes adultos con AOS. No disponemos de datos de nuestro país.
TABLA 4. PREVALENCIA DE APNEA DEL SUEñO EN DISTINTAS REGIONES DEL MUNDO.
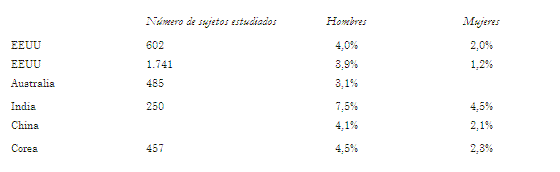
En el Wisconsin Sleep Cohort Study, un estudio poblacional con 602 personas estudiadas con polisomnografía, se encontró una prevalencia de AOS de 24% en hombres y 9% en mujeres de entre 30 y 60 años de edad (7).
Sintomatología
Los síntomas vinculados a la AS pueden ser nocturnos o diurnos, como muestra la tabla 5, tomada del Consenso Nacional Español (5).
TABLA 5. SíNTOMAS FRECUENTES EN LA APNEA DEL SUEñO.

En un estudio uruguayo que incluyó 519 pacientes referidos para estudio con polisomnografía, de los cuales 171 tuvieron un diagnóstico de AS, se encontraron entre estos últimos las siguientes presentaciones clínicas: somnolencia diurna excesiva, síntomas durante el sueño y síndrome de hipoventilación-obesidad. Entre los motivos de consulta poco frecuentes se destacan: paro cardiorrespiratorio, síncope, traumatismo encefálico vinculado a accidente de tránsito y complicación postanestésica (8). Entre estos pacientes había 137 hombres y 34 mujeres, conforme al reconocido predominio masculino entre los pacientes con AOS; el promedio del índice de masa corporal variaba, según la presentación clínica, entre 28.1 kg/m2 (en 53 pacientes con síntomas durante el sueño) y 47.5 kg/m2 (en 30 pacientes con hipoventilación-obesidad).
Diagnóstico
Las opciones diagnósticas que propone el SS/AHA/ACC son: cuestionarios, monitoreo Holter, oximetría durante la noche, polisomnografía en el domicilio/ambulatoria, polisomnografía nocturna intrahospitalaria.
Tratamiento
Las opciones terapéuticas que propone el mismo documento son: terapia posicional, pérdida de peso, evitar alcohol y sedantes, presión positiva continua en la vía aérea (CPAP, por su denominación en inglés continuous positive airway pressure), aplicaciones orales, cirugía (uvulopalatofaringoplastia, tonsilectomía, traqueostomía).
Mecanismos patogénicos de la enfermedad cardiovascular en la apnea del sueño
Diversos factores han sido incriminados, entre los cuales el más trascendente es la hipoxia intermitente, y sus consecuencias: hiperactividad simpática (que produce aumento de la frecuencia cardíaca y la presión arterial) (9), disfunción endotelial (10), estrés oxidativo (11), inflamación (12) y resistencia a la insulina (13). También se ha reconocido la presencia de alteraciones protrombóticas: activación plaquetaria, aumento del fibrinógeno (14), aumento del hematocrito (15) y la viscosidad de la sangre (16). De la misma forma a ciertos fenómenos mecánicos, tales como la exagerada negatividad de la presión intratorácica en los episodios de apnea-hipopnea, que puede llegar a los -65 mmHg, se les ha considerado responsables de gradientes transmurales exagerados en aurículas, ventrículos y aorta (17,18), y de inestabilidad autonómica y hemodinámica (19); esas condiciones pueden llevar a aumentos del estrés parietal, de la postcarga, del tamaño auricular, a disfunción ventricular diastólica (20) y dilatación aórtica, que podría favorecer la disección (21).
Enfermedades cardiovasculares en la apnea obstructiva del sueño
En todos los casos, la presencia de comorbilidades habituales en los pacientes con AOS hace difícil establecer una relación causal entre las ECV y la AOS.
La comprensión cabal de las asociaciones entre AOS y ECV requeriría conocer, para cada una de las ECV, por ejemplo la hipertensión arterial, cuál es la prevalencia de la AOS en los hipertensos, cómo la presencia de AOS afecta su pronóstico, si la severidad de la AOS tiene alguna influencia en la evolución de los hipertensos, si el tratamiento de la AOS mejora el pronóstico de los pacientes hipertensos con AOS, y recíprocamente cuál es la prevalencia de hipertensión arterial entre los pacientes con AOS, cómo la presencia de hipertensión arterial afecta el pronóstico de los pacientes con AOS, si la severidad de la hipertensión arterial tiene alguna influencia en la evolución de los pacientes con AOS y si el tratamiento de la hipertensión arterial mejora el pronóstico de los pacientes con ambas patologías. Toda esta información debería estar disponible para las distintas ECV y para los distintos factores de riesgo y sus combinaciones, en particular el síndrome metabólico, lo que obviamente no se ha logrado. Existe abundante información sobre la hipertensión arterial y la AOS (el documento de AHA/ACC incluye 51 fichas bibliográficas sobre el punto), pero faltan los grandes estudios randomizados que aporten evidencias concluyentes.
Han sido reconocidas asociaciones con diversas formas de ECV:
1. Hipertensión arterial
Cerca de 60% de los pacientes con AOS tienen hipertensión arterial (22) y 30% de los hipertensos tienen AS, muchas veces no diagnosticada (23), especialmente en aquellos hipertensos que no muestran el habitual descenso de la presión durante las horas de la noche (nondippers) (24); esta falta del descenso de la presión arterial ha sido atribuida a la hiperactividad simpática vinculada a la hipoxia durante los episodios apneicos.
El VII informe del Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure incluye a la AS como la primera causa identificable de hipertensión arterial (25). En pacientes con hipertensión arterial refractaria –hipertensión arterial persistente bajo tratamiento a dosis máximas con tres antihipertensivos– se ha reportado una prevalencia de AS en 83% de los casos (26).
Sin embargo, un artículo del Sleep Heart Health Study encontró que el riesgo de desarrollar hipertensión arterial en 2.470 pacientes con AOS sin hipertensión arterial al ingreso era en gran medida explicable por la presencia de obesidad como factor de riesgo asociado, aunque podría existir una relación independiente de la obesidad en pacientes con IAH > 30/hora (OR 1,51; IC 0,93-2,47) (27).
El tratamiento de la AOS ha determinado sólo modestos descensos de la presión arterial en hipertensos con AOS. Un metaanálisis que incluyó 587 pacientes mostró descensos no significativos de la presión arterial (1,38 mmHg en la sistólica y 1,52 mmHg en la diastólica) (28).
Tampoco se ha demostrado que el tratamiento de la hipertensión arterial mejore la AS de los pacientes con ambas patologías; por el contrario, en un reporte con cinco casos, se comunicó un empeoramiento de la AOS con el uso de inhibidores de la enzima conversora de la angiotensina o, por el contrario, una mejoría al suspenderlos, lo que se atribuyó a la tos y la inflamación orofaríngea que pueden producir estos fármacos (29).
2. Insuficiencia cardíaca
En un estudio de 450 pacientes con insuficiencia cardíaca referidos a estudio polisomnográfico se encontró que 134 (30%) no tenían disturbios respiratorios del sueño, 148 (33%) tenían ACS y 168 (37%) AOS (30). Esta alta prevalencia puede estar afectada por un sesgo en la indicación de los estudios. Análogamente, en otro estudio se encontró que 11 (55%) de 20 pacientes con insuficiencia cardíaca con función sistólica preservada tenían AS, sobre todo AOS (31).
Los pocos estudios acerca de la eficacia del tratamiento de la AOS con CPAP en pacientes con insuficiencia cardíaca han mostrado resultados contradictorios en cuanto a cambios en la fracción de eyección del ventrículo izquierdo. No hay datos firmes acerca de eventuales beneficios en la AS vinculados al tratamiento de la insuficiencia cardíaca en pacientes con ambas patologías.
3. Enfermedad cerebrovascular
Un estudio con polisomnografía de 132 pacientes en rehabilitación luego de un ataque cerebrovascular encontró que 23 tenían AOS, 28 ACS y 2 AS mixta, lo que representa una prevalencia global de 40% (32). En un seguimiento a 10 años de esos pacientes se encontró que quienes tenían AOS presentaron significativamente mayor mortalidad que los que no tenían AS (OR 1,76; IC 1,05-2,95). No se encontró que hubiera un mayor riesgo de muerte en los 28 pacientes con ACS.
Un artículo del Sleep Heart Health Study mostró una asociación entre el IAH y la incidencia de stroke isquémico, sobre todo en hombres, en un grupo de 5.422 personas sin historia de stroke. En un seguimiento de 8,7 años, los hombres con IAH en el cuartil superior (IAH>19/hora) tuvieron un HR ajustado de stroke de 2,86 (IC 1,1-7,4) (33).
4. Arritmias
Además de la asociación entre AS y fibrilación auricular, extensamente tratada en el artículo de Arce y colaboradores (1), se ha reportado la presencia durante la noche de otras arritmias –taquicardia ventricular no sostenida, paro sinusal, bloqueo auriculoventricular de 2º grado, y extrasístoles ventriculares frecuentes–, en hasta 50% de los pacientes con AOS (34).
En otro artículo del Sleep Heart Health Study, que incluyó 228 pacientes con AS y un IAH>30/hora y 338 pacientes sin AS (IAH < 5/hora), el riesgo de que los pacientes con AS presentaran taquicardia ventricular no sostenida fue más de tres veces mayor (OR 3,40; IC 1,03-11,20) y el de extrasistolía ventricular compleja casi el doble (OR 1,74; IC 1,11-2,74) del de los pacientes sin AS, luego de realizar ajustes por edad, sexo, presencia de enfermedad coronaria e índice de masa corporal (35).
Es interesante destacar que Gami y colaboradores encontraron en un estudio de 112 pacientes con AOS que fallecieron en forma súbita, que los pacientes con AOS tuvieron la mayor incidencia de muerte súbita durante la noche (46% de las muertes súbitas entre las horas 0 y 6 am), en contraste con lo que habitualmente sucede en la población general, en donde los episodios de muerte súbita predominan entre la hora 6 y el mediodía y sólo en 16% de los casos se producen durante la noche (36). Este comportamiento anómalo puede atribuirse, entre otros factores, a la hipoxemia, hiperactividad adrenérgica, elevación de la presión arterial e hiperagregabilidad plaquetaria presentes en los episodios de apnea.
5. Enfermedad coronaria
Los pacientes con AOS tienen mayor riesgo de enfermedad coronaria, y una peor evolución. Se ha reportado una prevalencia de AS en 142 pacientes con coronariopatía documentada que duplica a la prevalencia en 50 controles no coronarios (37). Esta diferencia resultó estadísticamente significativa aun después de ajustes según edad, índice de masa corporal, presencia de hipertensión arterial, diabetes y tabaquismo. Un estudio de pacientes anginosos con coronariopatía documentada mostró un OR de sufrir un infarto en la evolución de 2.0 (IC 1,0-3,8) en pacientes con AOS con un IAH>20/hora en comparación con pacientes sin AOS (38).
6. Hipertensión arterial pulmonar
Los pacientes con AOS tienen episodios nocturnos de aumento de la presión de la arteria pulmonar, consecuencia de la hiperreactividad vascular a la hipoxia. Un estudio de 220 pacientes consecutivos con AOS mostró una incidencia de 17% de pacientes con ligera elevación de la presión de arteria pulmonar (>20 mmHg), pero sólo dos tuvieron una presión >35 mmHg (39).
7. Enfermedad renal extrema
Entre 40% y 60% de los pacientes con enfermedad renal extrema tienen AS, en muchos casos mixta (40,41). La coexistencia de hipertensión arterial, hiperactividad simpática, hipoxemia nocturna e hipertrofia ventricular izquierda que presentan los pacientes con AOS aumenta el riesgo cardiovascular, primera causa de muerte de los pacientes con enfermedad renal extrema.
8. Disfunción eréctil
Se ha propuesto que la AOS podría asociarse a disfunción eréctil, teniendo en cuenta los posibles nexos entre ambas entidades: alteraciones neurales y hormonales y la disfunción endotelial. Esta posible vinculación no ha podido ser comprobada (42).
Un estudio brasileño mostró que el uso de sildenafil aumentó el IAH en pacientes con AOS, lo que se atribuyó a la congestión de la vía aérea, relajación muscular y vasodilatación pulmonar que produce el óxido nítrico (43).
9. Diabetes
En 1.387 pacientes participantes del estudio Wiscosin Sleep Cohort se encontró que 14,7% de los pacientes con IAH > 15 /hora tenían diabetes, pero sólo 2,8% entre quienes tenían un IAH < 5 /hora. No se encontró que un IAH elevado fuera predictor de nuevos casos de diabetes en seguimiento de cuatro años (44).
Otro artículo del Sleep Heart Health Study encontró asociación entre la glucemia alterada en ayunas, la intolerancia a la glucosa, la combinación de glucemia alterada en ayunas e intolerancia a la glucosa y diabetes oculta por un lado y un IAH > 10/hora por otro, en 2.588 pacientes sin diabetes conocida. Los respectivos OR ajustados por edad, sexo, raza, índice de masa corporal y medida de la cintura fueron 1,3, 1,2, 1,4 y 1,7 (todos significativos) (45).
10. Enfermedad vascular subclínica
Un estudio de 202 pacientes que habían sido sometidos a un estudio polisomnográfico en los tres años previos a la realización de una tomografía computada por rayos de electrones (EBCT por electron-beam computed tomography), la presencia de calcificaciones coronarias se asoció a la severidad de la AOS, valorada por el IAH (46).
En un estudio llevado a cabo en 40 pacientes con AOS y 24 controles se encontró que los pacientes con AOS tenían menor vasodilatación mediada por flujo, mayor espesor íntima-media y mayor rigidez aórtica (47).
En un artículo del Sleep Heart Health Study se encontró una asociación entre la presencia de placas carotídeas y el espesor íntima-media, por un lado, y el IAH, por otro, en 985 pacientes sin historia previa de enfermedad coronaria o stroke con estudios polisomnográfico y vasculares, de los cuales 396 (40%) tenían placas carotídeas. Sin embargo, esta asociación perdió significación estadística cuando se realizó el análisis multivariado teniendo en cuenta los otros factores de riesgo cardiovascular presentes en la muestra. En particular la prevalencia de placas carotídeas fue diez veces mayor en pacientes con IAH del cuartil superior comparada con la de los pacientes del cuartil inferior (OR no ajustado 10,7), pero esa relación descendió a 1,25 en el estudio multivariado (48).
11. Obesidad
La obesidad es la principal causa aislada de AOS. La reducción del peso puede disminuir el IAH, mejorar la eficiencia del sueño, disminuir los ronquidos y mejorar la oxigenación. La cirugía bariátrica es el tratamiento más eficaz de la AOS en casos de obesidad mórbida (49).
12. Cualquier enfermedad cardiovascular
El proyecto Sleep Heart Health Study, estudio multicéntrico implementado por el National Heart, Lung & Blood Institute de EE.UU., en curso desde 1994, con una producción científica abundante, de la cual ya hemos mostrado varios resultados, está analizando la evolución de 6.424 pacientes mayores de 40 años a quienes se realizó polisomnografía en sus domicilios. Uno de los estudios descriptivos de la población mostró una mediana de IAH de 4,4/hora; 16% tenían al menos una manifestación de ECV y el riesgo de presentarla aumentó con el incremento del IAH. En un análisis multivariado, y tomando como referencia el cuartil inferior de IAH, los pacientes del 2º cuartil tenían un OR de 0,8 (0,77-1,24), los del 3º 1,28 (1,02-1,61) y los del 4º 1,42 (1,13-1,78). Comparando el riesgo de presentar ECV específicas de los pacientes del 4º cuartil con respecto a los del cuartil inferior resultaron: OR (ajustados) para insuficiencia cardíaca 2,38 (1,22-4,62), para enfermedad cerebrovascular 1,58 (1,02-2,46), y para enfermedad coronaria 1,27 (0,99-1,62). La conclusión es que, en un análisis multivariado, grados leves a moderados de AS se asocian con modestos aumentos del riesgo de distintas expresiones de ECV (50).
Conclusiones
Traducimos las conclusiones de Parish: en base a la evidencia hasta ahora acumulada en la literatura, la AOS aparece como un importante factor de riesgo para el desarrollo de ECV. Claramente, se necesitan más estudios para conocer los mecanismos que puedan explicar esta relación y estudiar el efecto de tratamientos con CPAP o cirugía en la progresión de la ECV en pacientes con AOS. Los clínicos que atienden pacientes con ECV y cerebrovascular deberían estar atentos a estas asociaciones y tratar de identificar pacientes con AOS (51).
El documento de los Institutos Nacionales de Salud de EEUU termina con la siguiente conclusión (traducción nuestra): La AOS se asocia fuertemente con la incidencia y mala evolución de la hipertensión arterial, enfermedad coronaria, insuficiencia cardíaca y ataques cerebrovasculares. Además, la obesidad y la edad, ambas en aumento en la población general, son factores de riesgo tanto de AOS como de insuficiencia cardíaca. El tratamiento de la AOS revierte completamente sus consecuencias cardiovasculares (en el texto original: Treatment of OSA completely reverses its cardiovascular consequences). Por lo tanto, la AOS debe ser considerada un importante factor de riesgo cardiovascular modificable.
El SS/AHA/ACC concluye, entre otros aspectos, y tratando en conjunto la AOS y la ACS (traducción nuestra):
- En el contexto de las epidemias actuales de obesidad, hipertensión arterial, fibrilación auricular e insuficiencia cardíaca, es probable un aumento de la prevalencia y consecuencias de ambas formas de AS: AOS y ACS.
- Desafíos a superar:
- ausencia general de una educación estructurada sobre medicina del sueño en los programas de entrenamiento cardiovascular;
- obstáculos logísticos y económicos en el diagnóstico y tratamiento de la AS;
- comorbilidades frecuentes, incluyendo la obesidad, oscurecen un claro conocimiento de cualquier consecuencia cardiovascular atribuible a la AS en forma independiente;
- las opciones terapéuticas variadas, en general basadas en dispositivos, suelen no ser bien toleradas por los pacientes, especialmente en la ACS;
- ausencia de estudios longitudinales robustos de intervención que apunten a definir si el tratamiento de la AS confiere algún beneficio tangible en términos de eventos cardiovasculares.
- Pasos próximos importantes en el conocimiento y tratamiento de la AS, como forma de prevenir y mitigar las ACV, deben incluir la caracterización de los mecanismos fundamentales de la afección, identificar opciones terapéuticas económicas y mejor toleradas, confirmar si el tratamiento atenúa la morbimortalidad cardiovascular y definir metas terapéuticas apropiadas y beneficios costo efectivos del tratamiento.
Nuestras conclusiones:
- Existe una clara asociación entre AOS y ECV.
- Se han descrito mecanismos biológicamente plausibles por los cuales la AOS podría producir ECV.
- La AOS y las ECV comparten varios factores de riesgo o comorbilidades.
- El análisis multivariado de las asociaciones entre AOS y ECV reduce notablemente el rol de la AOS como predictor independiente de ECV.
- No obstante, ambas entidades afectan de tal forma la calidad y la expectativa de vida de los pacientes que las padecen, que ambas merecen ser tratadas, independientemente del hecho de que estén o no afectadas por una relación de “causa-efecto”.
- Diversos factores de riesgo/enfermedades vinculados a AOS y ECV (obesidad, hipertensión arterial, diabetes, hábitos higiénico-dietéticos inadecuados, envejecimiento poblacional, etc.) tienen prevalencia creciente en la sociedad actual, por lo cual es de temer un aumento de la AOS y las ECV, con un impacto notable en la salud de la población.
- Respetuosamente señalamos nuestra discrepancia con la aseveración del documento de los Institutos Nacionales de Salud de EEUU, en el sentido de que el tratamiento de la AOS revierte completamente sus consecuencias cardiovasculares; antes bien entendemos que ambas, AOS y ECV, deben ser integralmente tratadas, y que para tratar adecuadamente a sus pacientes, los médicos que asisten a enfermos con AOS deben tener en cuenta la posibilidad de que tengan ECV, e inversamente, quienes atienden pacientes con ECV deben estar atentos a que presenten AOS.
Enfermedades cardiovasculares en la apnea central del sueño
Aunque la consecuencia inmediata de los episodios apneicos sea la misma (hipoxia), los mecanismos que los producen son totalmente distintos en la AOS y en la ACS. En la primera existe un aumento de la resistencia de la vía aérea contra el cual luchan los músculos respiratorios; en la segunda hay una disminución o cese de la actividad de los músculos respiratorios de causa central –neurológica–. Igualmente, es concebible que la respuesta a la hipoxia sea diferente en uno y otro casos, dependiendo, entre otros posibles factores, de la forma de respuesta del sistema neurovegetativo.
Un elemento distintivo de la ACS es la presencia de episodios de respiración de Cheyne-Stokes, con un patrón respiratorio creciente-decreciente y apnea/hipopnea central entre los episodios.
La prevalencia de la ACS es menor que la de la AOS en población general. En base a los datos publicados sobre 4.872 personas del Sleep Heart Health Study y tomando como corte dos o más episodios de apnea/hora, pudimos calcular que el número de pacientes con AOS fue 11 veces mayor que el de los que presentaron ACS (29,8% versus 2,8%) (52).
La ACS tiene mayor prevalencia en hombres que en mujeres, y aparece sobre todo en pacientes añosos. Pueden coexistir en un mismo paciente AOS y ACS.
La ACS aparece vinculada a insuficiencia cardíaca, stroke y edad avanzada. La respiración de Cheyne-Stokes a insuficiencia cardíaca, disfunción ventricular izquierda, aun en ausencia de manifestaciones clínicas de insuficiencia cardíaca, trastornos neurológicos –incluyendo los neurovasculares– y demencia (2,52). Los pacientes diabéticos tienen mayor prevalencia de ACS que los no diabéticos (53).
Desde el punto de vista de la asociación de AS y ECV la diferencia fundamental entre la AOS y la ACS es que la primera -con mayor o menor grado de evidencia- es factor de riesgo de ECV incidente y de peor evolución de ECV conocida, en tanto que la central aparece fundamentalmente como un epifenómeno de la insuficiencia cardíaca y el enfoque terapéutico apunta a la optimización del tratamiento de ésta. No hay evidencias concluyentes acerca de los beneficios de la ventilación a presión positiva continua en estos pacientes.
Bibliografía
1. Arce M, Femenía F, Pérez Riera AR, Baranchuk A. Colisión de dos pandemias: Apnea del sueño y fibrilación auricular. Rev Urug Cardiol 2010; 2: 100-106.
2. Somers VK, White DP, Amin R, Abraham WT, Costa F, Culebras A, et al. Sleep apnea and cardiovascular disease: an American Heart Association/American College of Cardiology Foundation scientific statement from the American Heart Association Council for High Blood Pressure Research Professional Education Committee, Council on Clinical Cardiology, Stroke Council, and Council on Cardiovascular Nursing. Circulation 2008; 118: 1080-111.
3. Khayat R, Patt B, Hayes D Jr. Obstructive sleep apnea: the new cardiovascular disease. Part I: obstructive sleep apnea and the pathogenesis of vascular disease. Heart Fail Rev 2009; 14: 143-53.
4. Devulapally K, Pongonis R Jr, Khayat R. OSA: the new cardiovascular disease: Part II: overview of cardiovascular diseases associated with obstructive sleep apnea. Heart Fail Rev 2009; 14: 155-64.
5. http://www.aepap.org/pdf/sahs_completo.pdf. Accedido el 21 de junio de 2010.
6. Punjabi NM. The epidemiology of adult obstructive sleep apnea. Proc Am Thorac Soc 2008; 5: 136-43.
7. Young T, Palta M, Dempsey J, Skatrud J, Weber S, Badr S. The occurrence of sleep-disordered breathing among middle-aged adults. N Engl J Med 1993; 328: 1230-5.
8. Arcos JP, Muiño A, Lorenzo D. Síndrome de apneas del sueño de tipo obstructivo: hallazgos clínicos y fisiológicos. Rev Med Uruguay 1999; 15(2): 14-220.
9. Somers VK, Dyken ME, Mark AL, Abboud FM. Sympathetic-nerve activity during sleep in normal subjects. N Engl J Med 1993; 328: 303-7.
10. Ip MS, Tse HF, Lam B, Tsang KW, Lam WK. Endothelial function in obstructive sleep apnea and response to treatment. Am J Respir Crit Care Med 2004; 169: 348-53.
11. Prabhakar NR. Sleep apneas: an oxidative stress? Am J Respir Crit Care Med 2002; 165: 859-60.
12. Shamsuzzaman AS, Winnicki M, Lanfranchi P, Wolk R, Kara T, Accurso V, et al. Elevated C-reactive protein in patients with obstructive sleep apnea. Circulation 2002; 105: 2462-4.
13. Punjabi NM, Shahar E, Redline S, Gottlieb DJ, Givelber R, Resnick HE; Sleep Heart Health Study Investigators. Sleep-disordered breathing, glucose intolerance, and insulin resistance: the Sleep Heart Health Study. Am J Epidemiol 2004; 160: 521-30.
14. von Känel R, Loredo JS, Ancoli-Israel S, Mills PJ, Natarajan L, Dimsdale JE. Association between polysomnographic measures of disrupted sleep and prothrombotic factors. Chest 2007; 131: 733-9.
15. Hoffstein V, Herridge M, Mateika S, et al. Hematocrit levels in sleep apnea. Chest 1994; 106: 787-91.
16. Nobili L, Schiavi G, Bozano E, et al. Morning increase of whole blood viscosity in obstructive sleep apnea syndrome. Clin Hemorheol Microcirc 2000; 22: 21-7.
17. von Känel R, Dimsdale JE. Hemostatic alterations in patients with obstructive sleep apnea and the implications for cardiovascular disease. Chest 2003; 124: 1956-67.
18. Buda AJ, Pinsky MR, Ingels NB Jr, Daughters GT 2nd, Stinson EB, Alderman EL. Effect of intrathoracic pressure on left ventricular performance. N Engl J Med 1979; 301: 453-9.
19. Somers VK, Dyken ME, Skinner JL. Autonomic and hemodynamic responses and interactions during the Mueller maneuver in humans. J Auton Nerv Syst 1993; 44: 253-9.
20. Otto ME, Belohlavek M, Romero-Corral A, Gami AS, Gilman G, Svatikova A, et al. Comparison of cardiac structural and functional changes in obese otherwise healthy adults with versus without obstructive sleep apnea. Am J Cardiol 2007; 99: 1298-302.
21. Sampol G, Romero O, Salas A, Tovar JL, Lloberes P, Sagalés T, et al. Obstructive sleep apnea and thoracic aorta dissection. Am J Respir Crit Care Med 2003; 168: 1528-31.
22. Silverberg DS, Oksenberg A, Iaina A. Sleep-related breathing disorders as a major cause of essential hypertension: fact or fiction? Curr Opin Nephrol Hypertens 1998; 7: 353-7.
23. Fletcher EC, DeBehnke RD, Lovoi MS, Gorin AB. Undiagnosed sleep apnea in patients with essential hypertension. Ann Intern Med 1985; 103: 190-5.
24. Portaluppi F, Provini F, Cortelli P, Plazzi G, Bertozzi N, Manfredini R, et al. Undiagnosed sleep-disordered breathing among male nondippers with essential hypertension. J Hypertens 1997; 15: 1227-33.
25. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL Jr, et al; National Heart, Lung, and Blood Institute Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure; National High Blood Pressure Education Program Coordinating Committee. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA 2003; 289: 2560-72.
26. Logan AG, Perlikowski SM, Mente A, Tisler A, Tkacova R, Niroumand M, et al. High prevalence of unrecognized sleep apnoea in drug-resistant hypertension. J Hypertens 2001; 19: 2271-7.
27. O’Connor GT, Caffo B, Newman AB, Quan SF, Rapoport DM, Redline S, et al. Prospective study of sleep-disordered breathing and hypertension: the Sleep Heart Health Study. Am J Respir Crit Care Med 2009; 179: 1159-64.
28. Alajmi M, Mulgrew AT, Fox J, Davidson W, Schulzer M, Mak E, et al. Impact of continuous positive airway pressure therapy on blood pressure in patients with obstructive sleep apnea hypopnea: a meta-analysis of randomized controlled trials. Lung 2007; 185: 67-72.
29. Cicolin A, Mangiardi L, Mutani R, Bucca C. Angiotensin-converting enzyme inhibitors and obstructive sleep apnea. Mayo Clin Proc 2006; 81: 53-5.
30. Sin DD, Fitzgerald F, Parker JD, Newton G, Floras JS, Bradley TD. Risk factors for central and obstructive sleep apnea in 450 men and women with congestive heart failure. Am J Respir Crit Care Med 1999; 160: 1101-6.
31. Chan J, Sanderson J, Chan W, Lai C, Choy D, Ho A, et al. Prevalence of sleep-disordered breathing in diastolic heart failure. Chest 1997; 111: 1488-93.
32. Sahlin C, Sandberg O, Gustafson Y, Bucht G, Carlberg B, Stenlund H, et al. Obstructive sleep apnea is a risk factor for death in patients with stroke. Arch Intern Med 2008; 168: 297-301.
33. Redline S, Yenokyan G, Gottlieb DJ, Shahar E, O’Connor GT, Resnick HE, et al. Obstructive sleep apnea hypopnea and incident stroke: The Sleep Heart Health Study. Am J Respir Crit Care Med 2010 Mar 25. [Epub ahead of print]
34. Guilleminault C, Connolly SJ, Winkle RA. Cardiac arrhythmia and conduction disturbances during sleep in 400 patients with sleep apnea syndrome. Am J Cardiol 1983; 52: 490-4.
35. Mehra R, Benjamin EJ, Shahar E, Gottlieb DJ, Nawabit R, Kirchner HL, et al. Association of nocturnal arrhythmias with sleep-disordered breathing: The Sleep Heart Health Study. Am J Respir Crit Care Med 2006; 173: 910-6.
36. Gami AS, Howard DE, Olson EJ, Somers VK. Day-night pattern of sudden death in obstructive sleep apnea. N Engl J Med 2005; 352: 1206-14.
37. Mooe T, Rabben T, Wiklund U, Franklin KA, Eriksson P. Sleep-disordered breathing in men with coronary artery disease. Chest 1996; 109: 659-63.
38. Shafer H, Koehler U, Ewig S, Hosper E, Tasci S, Luderitz B. Obstructive sleep apnea as a risk marker in coronary artery disease. Cardiology 1999; 92: 79-84.
39. Chaouat A, Weitzenblum E, Krieger J, Oswald M, Kessler R. Pulmonary hemodynamics in the obstructive sleep apnea syndrome: results in 220 consecutive patients. Chest 1996; 109: 380-6.
40. Hanly P. Sleep apnea and daytime sleepiness in end-stage renal disease. Semin Dial. 2004; 17: 109-14.
41. Perl J, Unruh ML, Chan CT. Sleep disorders in end-stage renal disease: “markers of inadequate dialysis”? Kidney Int 2006; 70: 1687-93.
42. Arruda-Olson AM, Olson LJ, Nehra A, Somers VK. Sleep apnea and cardiovascular disease. Implications for understanding erectile dysfunction. Herz 2003; 28: 298-303.
43. Roizenblatt S, Guilleminault C, Poyares D, Cintra F, Kauati A, Tufik. A double-blind, placebo-controlled, crossover study of sildenafil in obstructive sleep apnea. Arch Intern Med 2006; 166: 1763-7.
44. Reichmuth KJ, Austin D, Skatrud JB, Young T. Association of sleep apnea and type II diabetes. A population-based study. Am J Respir Crit Care Med 2005; 172: 1590-5.
45. Seicean S, Kirchner HL, Gottlieb DJ, Punjabi NM, Resnick H, Sanders M, et al. Sleep-disordered breathing and impaired glucose metabolism in normal-weight and overweight/obese individuals: the Sleep Heart Health Study. Diabetes Care 2008; 31: 1001-6.
46. Sorajja D, Gami AS, Somers VK, Behrenbeck TR, García-Touchard A, López-Jiménez F. Independent association between obstructive sleep apnea and subclinical coronary artery disease. Chest 2008; 133: 927-33.
47. Tanriverdi H, Evrengul H, Kara CO, Kuru O, Tanriverdi S, Ozkurt S, et al. Aortic stiffness flow mediated dilatation and carotid intima-media thichkness in obstructive sleep apnea: non-invasive indicators of atherosclerosis. Respiration 2006; 73: 741-50.
48. Wattanakit K, Boland L, Punjabi NM, Shahar E. Relation of sleep-disordered breathing to carotid plaque and intima-media thickness. Atherosclerosis 2008; 197: 125-31.
49. Verse T. Bariatric surgery for obstructive sleep apnea. Chest 2005; 128: 485-7.
50. Shahar E, Whitney CW, Redline S, Lee ET, Newman AB, Nieto FJ, et al. Sleep-disordered breathing and cardiovascular disease. Cross-sectional results of the Sleep Heart Health Study. Am J Respir Crit Care Med 2001; 163: 19-25.
51. Parish JM, Somers VK. Obstructive sleep apnea and cardiovascular disease. Mayo Clin Proc 2004; 79: 1036-46.
52. Arcos JP, Baz, M, Lorenzo D. Respiración periódica y apneas del sueño centrales en pacientes con insuficiencia cardíaca: hallazgos clínicos y fisiológicos. Rev Urug Cardiol 2008; 23: 249-57.
53. Resnick HE, Redline S, Shahar E, Gilpin A, Newman A, Walter R, et al. Sleep Heart Health Study. Diabetes and sleep disturbances: findings from the Sleep Heart Health Study. Diabetes Care 2003; 26: 702-9.














