Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.25 no.1 Montevideo June 2010
CASOS CLÍNICOS
Primeras experiencias nacionales con el implante percutáneo de prótesis valvulares aórticas
Palabras clave:
PRÓTESIS VALVULARES CARDÍACAS
VÁLVULA AÓRTICA
ENFERMEDADES DE LAS VÁLVULAS CARDÍACAS
MEDICIÓN DE RIESGO
Key words:
HEART VALVE PROSTHESIS
AORTIC VALVE
HEART VALVE DISEASES
RISK ASSESSMENT
La esclerosis de la válvula aórtica está presente en más de 25% de los pacientes entre 65 y 74 años y 48% de los mayores de 84 años (1,2). La prevalencia de la estenosis aórtica (EA) calcificada aumenta con la edad, alcanzando entre 2% a 4 % en los mayores de 65 años (1,2).
Dada la mala evolución natural de los pacientes con EA sintomática, el tratamiento de elección es el reemplazo quirúrgico de la válvula, con el que se logran buenos resultados tanto a nivel internacional como nacional (3,4). En el candidato ideal, la mortalidad operatoria asociada al reemplazo valvular aórtico es de 4% (5). A medida que avanza la edad, los pacientes elevan su riesgo quirúrgico hasta alcanzar niveles prohibitivos, al asociar otras comorbilidades. Se estima que al menos 30% de los pacientes con EA severa no son remitidos para realizar el reemplazo quirúrgico por esta causa (6).
Estas limitaciones motivaron la búsqueda de una opción percutánea para el tratamiento de la EA. La valvuloplastia aórtica con balón en pacientes con EA calcificada/degenerativa está limitada por la elevada tasa de reestenosis temprana, así como otras complicaciones, sin aumento de la sobrevida (7). Esta intervención actualmente se reserva como procedimiento “puente” a la cirugía valvular o previa a una cirugía no cardíaca a realizar a breve plazo.
Dados los pobres resultados de la valvuloplastia con balón se continuaron las investigaciones que condujeron al desarrollo del reemplazo valvular aórtico percutáneo (RVAP). Este procedimiento consiste en sustituir la válvula nativa por una prótesis acoplada a un stent, que se coloca por vía vascular percutánea, por abordaje retrógrado. El primer RVAP en el ser humano se realizó en Francia, por el grupo de Alain Cribier en el año 2002, en un paciente con una condición clínica muy desfavorable (8). Posteriormente se ha perfeccionado la técnica y los dispositivos a implantar. En el año 2007, este grupo comunicó que en 200 pacientes con implante de prótesis de pericardio bovino la mortalidad a 30 días fue de 12% y sobrevida al año de 74% (9).
Recientemente se ha publicado una serie de 108 pacientes que corresponden a la experiencia inicial española con implante de prótesis aórtica autoexpandible CoreValve® (10). La tasa de éxito del procedimiento fue de 98,1%, se implantó marcapaso definitivo por bloqueo auriculoventricular en 35%. La mortalidad y el objetivo combinado de muerte, ictus, infarto de miocardio y conversión a cirugía a los 30 días fueron de 7,4% y 8,3%, respectivamente. La sobrevida estimada al año por Kaplan-Meier fue de 82,3%.
Al presente, el reemplazo quirúrgico de la válvula aórtica continúa siendo la indicación de elección de la EA sintomática. El reemplazo percutáneo se mantiene reservado para los pacientes de elevado riesgo quirúrgico; una expansión no controlada de su indicación debería ser evitada. En el futuro, si los resultados de los estudios en curso continúan siendo favorables, surgirán nuevas indicaciones para esta técnica.
El 9 de marzo de 2010 se realizaron en nuestro medio los dos primeros procedimientos de este tipo, con la tutoría del Dr. César Morís de la Tassa del Hospital Universitario Central de Asturias, Oviedo, España. Se presentan a continuación los dos casos clínicos.
BIBLIOGRAFÍA
1. Otto CM, Lind BK, Kitzman DW, Gersh BJ, Siscovick DS. Association of aortic-valve sclerosis with cardiovascular mortality and morbidity in the elderly. N Engl J Med 1999; 341: 142–7.
2. Stewart BF, Siscovick D, Lind BK, Gardin JM, Gottdiener JS, Smith VE, et al. Clinical factors associated with calcific aortic valve disease: cardiovascular health study. J Am Coll Cardiol 1997; 29: 630–634.
3. Kvidal P, Bergströn R, Hórte LG, Stahle E. Observed and relative survival after aortic valve replacement. J Am Coll Cardiol 2000; 35: 747-56.
4. Albornoz H, Morales M, Saona G, Perna A. Mortalidad a 30 días y factores de riesgo preoperatorios en la cirugía de reemplazo valvular aórtico. Rev Urug Cardiol 2009; 24: 171-9.
5. Edwards FH, Peterson ED, Coombs LP, DeLong ER, Jamieson WR, Shroyer ALW, et al. Prediction of operative mortality after valve replacement surgery. J Am Coll Cardiol 2001; 37: 885-92.
6. Iung B, Baron G, Butchart EG, Delahaye F, Gohlke-Barwolf C, Levang OW, et al. A prospective survey of patients with valvular heart disease in Europe: The Euro Heart Survey on Valvular Heart Disease. Euro Heart J 2003; 24: 1231-43.
7. McKay RG. The Mansfield scientific aortic valvuloplasty registry: overview of acute hemodynamic results and procedural complications. J Am Coll Cardiol. 1991; 17: 485-91.
8. Cribier A, Eltchaninoff H, Bash A, Borenstein N, Tron C, Bauer F, et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation 2002; 106:3006-8.
9. Cribier A, Zajarias A. Recambio valvular aórtico percutáneo: ¡el futuro ha llegado! Rev Esp Cardiol 2008; 61: 1123-5.
10. Avanzas P, Muñoz-García AJ, Segura J, Pan M, Alonso-Briales JH, Lozano I, et al. Implante percutáneo de la prótesis valvular aórtica autoexpandible CoreValve® en pacientes con estenosis aórtica severa: experiencia inicial en España. Rev Esp Cardiol 2010; 63: 141-8.
Primeras experiencias nacionales con el implante percutáneo de prótesis valvulares aórticas
Caso 1: Dres. Daniela Korytnicki, Daniel Mallo, Ricardo Lluberas y colaboradores
Caso 1
DRES. DANIELA KORYTNICKI, DANIEL MALLO, RICARDO LLUBERAS,
CAROLINA ARTUCIO, ÁLVARO BELTRÁN, ENRIQUE BESADA
Recibido abril 13, 2010; aceptado mayo 12, 2010.
CASO CLÍNICO
EF, 77 años, sexo masculino.
Antecedentes personales de arteriopatía carotídea a predominio izquierdo de grado moderado. Dislipémico. Hipertensión arterial sistémica.
Portador de cardiopatía isquémica revascularizado con cirugía en 1984, mediante puente venoso secuencial aorto–descendente posterior–marginales y otro puente venoso secuencial aorto – diagonal – descendente anterior. Es reintervenido quirúrgicamente en 1997 realizándose anastomosis mamaria interna izquierda–descendente anterior y puente venoso aislado aorto – póstero lateral de circunfleja y mediante angioplastia transluminal coronaria (ATC) del bypass venoso a descendente posterior en julio de ese año. A los cuatro meses se documenta restenosis con oclusión del puente venoso.
Se mantiene estable con tratamiento médico hasta el año 2006 en el que se realiza nueva cineangiocoronariografía (CACG) por estudios funcionales de alto riesgo y posterior ATC de coronaria derecha con colocación de stent liberador de fármaco TAXUS 2,5 x 16 mm y de circunfleja con microdriver 2,5 x 18 mm.
Evoluciona con angor y disnea de esfuerzo estable clase funcional II, hasta los últimos meses que progresan los síntomas hasta clase funcional III. En tratamiento con diuréticos, anticálcicos, betabloqueantes, ácido acetilsalicílico, clopidogrel, vastarel, nitratos y estatinas.
Al examen cardiovascular se destaca choque de punta en quinto espacio línea hemiclavicular, primer ruido normal, soplo eyectivo aórtico 5/6 mesotelesistólico con componente aórtico del segundo ruido disminuido y breve escape protodiastólico. Pulsos arteriales presentes y finos en todos los territorios.
Electrocardiograma: bradicardia sinusal de 45 cpm. Auriculograma y conducción AV normales. Hipertrofia ventricular izquierda, onda q no significativa en cara inferior.
Ecocardiograma transtorácico: contractilidad global y sectorial conservadas, hipertrofia ventricular izquierda. FEVI 56%. Aurícula izquierda levemente dilatada. Cavidades derechas normales. Estenosis valvular aórtica calcificada de grado severo con área 0,67 cm2, coeficiente de obstrucción 0,21, gradiente máximo transvalvular 89 mm Hg y medio 57 mm Hg, diámetro del anillo: 21 mm. Leve insuficiencia aórtica.
Log EuroSCORE (European System for Cardiac Operative Risk Evaluation): 11,07%.
Visto el caso en ateneo médico quirúrgico y en conjunto con el paciente, dado que fue intervenido con cirugía de revascularización miocárdica en dos oportunidades, se decide evaluar la factibilidad del implante percutáneo de válvula aórtica para lo cual se realizó angiotomografía de aorta y miembros inferiores con tomógrafo multicorte de 16 filas de detectores. Se realizaron reconstrucciones 3D de aorta toracoabdominal y estudio con contraste. Dicho estudio mostró aorta con múltiples calcificaciones parietales sobre todo en aorta ascendente próxima a la válvula y valvulares, en cayado y aorta abdominal, sin disección. Diámetro de aorta en su origen 31 mm, aorta ascendente 26 mm. Sin estenosis en arterias del cuello; aorta abdominal de calibre habitual; arterias ilíacas y femorales de calibre habitual y sin imágenes de estenosis. Diámetro del anillo: 24 mm, altura del sinus: 15.5 mm, diámetro de raíz de aorta: 30,0 mm, arteria femoral izquierda: 8,6 mm, arteria femoral derecha: 8,4 mm (figura 1).
Se realizó coronariografía con estudio hemodinámico y medidas aórticas que mostraron: oclusión en la unión de tercio proximal y medio de descendente anterior, lesión severa en el origen de fino ramo diagonal, restenosis moderada intrastent de circunfleja y origen de primer marginal obtuso de fino calibre, ATC con stent de coronaria derecha con resultado mantenido, oclusión de puentes venosos de aorta a marginales y coronaria derecha, puente venoso aorto-diagonal permeable y sin lesiones, anastomosis mamaria interna izquierda-descendente anterior permeable con buen flujo y sin lesiones. Medidas hemodinámicas: presión arterial 110/80 mm Hg, media 100 mm Hg, leve incremento de presión diastólica final de VI 200/20 mmHg, gradiente transvalvular aórtico pico 90, medio 55 mm Hg. Medidas aórticas: altura del seno de Valsalva: 17,5 mm, diámetro de raíz de aorta: 28 mm, arteria femoral izquierda 8,7 mm, arteria femoral derecha: 8,1 mm.
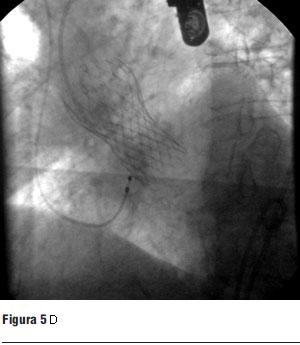
Dados los resultados de los estudios previos se entendió que el paciente era pasible de implante percutáneo de prótesis válvular aórtica autoexpandible CoreValve®. El 9 de marzo de 2010 se realizó el implante en el laboratorio de hemodinamia. Se realizó profilaxis con cefalosporinas. Previo al procedimiento se realizó anestesia general con IOT y ARM, colocación de sonda transesofágica de ecocardiograma, colocación de marcapaso transitorio en ventrículo derecho por vía subclavia izquierda, VVC y punción arterial femoral izquierda para introducción de catéter pigtail 6 F que sirvió para realizar aortograma, medir gradientes y controlar posicionamiento de prótesis valvular. Se colocó introductor arterial 18 F por punción femoral derecha y se realizó valvuloplastia aórtica con balón NUMED 25 x 4.0 mm con sobreestimulación simultánea a 180 cpm para evitar el desplazamiento del balón (figuras 2 y 3). A continuación se colocó la prótesis valvular aórtica CoreValve® Nº 29 a nivel del anillo valvular aórtico (figura 4). Se realizó control angiográfico y hemodinámico observándose mínima insuficiencia valvular aórtica y gradiente transvalvular de 30 mm (figura 5). Se cerró el orificio de punción arterial femoral derecha con Prostar XL®. El procedimiento se realizó con éxito clínico, angiográfico y hemodinámico. La figura 6 muestra los gradientes transvalvulares pre y postprocedimiento inmediato por ecocardiografía. Durante el mismo no hubo eventos ni complicaciones. En la evolución intrahospitalaria en CTI se constató sangrado en la zona de punción femoral derecha que requirió cierre definitivo con cirugía vascular. El 13 de marzo de 2010 se retiró el marcapaso transitorio, sin registrarse episodios de bloqueo auriculoventricular y es dado de alta de CTI a sala donde evoluciona estable. El 15 de marzo de 2010 se realizó ecocardiograma de control que mostró prótesis aórtica normofuncionante, gradiente máximo 20 mm Hg y medio 12 mm Hg y leve insuficiencia. El 16 de marzo de 2010 es dado de alta a domicilio en buenas condiciones. Se realizó control clínico a los 15 días permaneciendo estable bajo tratamiento con ácido acetilsalicílico, clopidogrel, betabloqueantes, trimetazidina y estatinas. A los 45 días del procedimiento el paciente permanece asintomático con igual tratamiento farmacológico y se controló con nuevo ecocardiograma que mostró: prótesis biológica en posición aórtica con sigmoideas normales, gradiente sistólico pico de 23 mmHg y medio de 13 mmHg, índice de obstrucción 0,43 y mínima insuficiencia perivalvular; leve hipertrofia ventricular izquierda con contractilidad global y segmentaria conservada.
Figura 1. Angiotomografía (AngioTC) de aorta y miembros inferiores. Las imágenes blancas en placas corresponden a calcificaciones.
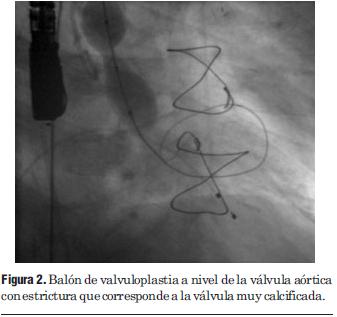
Figura 2. Balón de valvuloplastia a nivel de la válvula aórtica con estrictura que corresponde a la válvula muy calcificada.
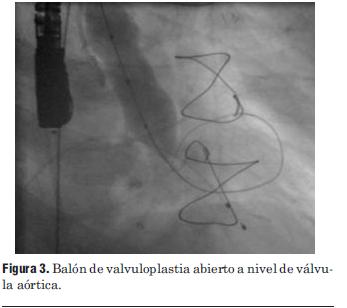
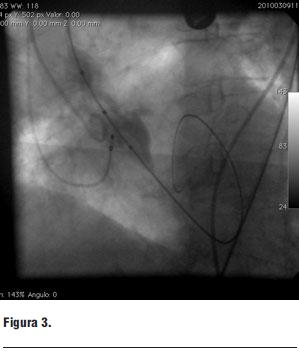
Figura 3. Balón de valvuloplastia abierto a nivel de válvula aórtica.
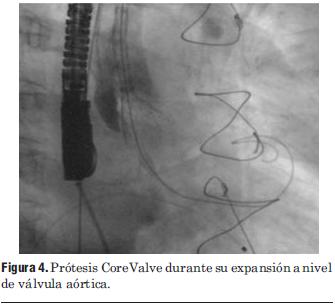
Figura 4. Prótesis CoreValve durante su expansión a nivel de válvula aórtica.
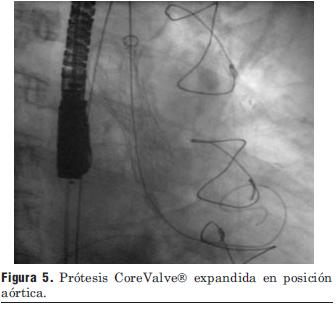
Figura 5. Prótesis CoreValve expandida en posición aórtica.
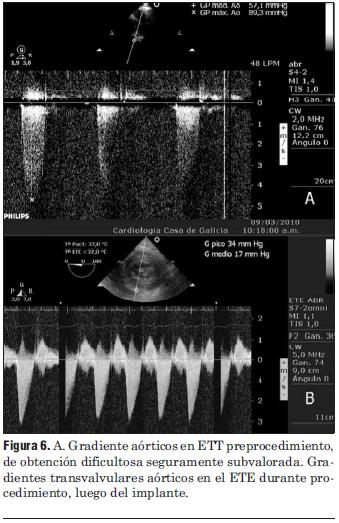
Figura 6. A. Gradiente aórticos en ETT preprocedimiento, de obtención dificultosa seguramente subvalorada. Gradientes transvalvulares aórticos en el ETE durante procedimiento, luego del implante.
DESCRIPCIÓN DEL DISPOSITIVO IMPLANTADO COREVALVE®
El dispositivo CoreValve ReValving System® consta de tres partes: 1) prótesis aórtica trivalva, de pericardio porcino, que va montada sobre stent autoexpandible de nitinol, en dos tamaños, para anillos aórticos entre 20 y 23 mm (prótesis pequeña, mide 26 mm en la porción insertada en el anillo nativo), y otra para anillos entre de 24 y 27 mm (prótesis grande, mide 29 mm en la porción insertada en el anillo nativo); 2) catéter liberador de 18 Fr; 3) dispositivo de carga (figura 7).
AGRADECIMIENTO
Agradecemos al Dr. César Morís de la Tassa, Área del Corazón, Hospital Universitario Central de Asturias, Oviedo, España por la tutoría realizada durante el procedimiento.
Primeras experiencias nacionales con el implante percutáneo de prótesis valvulares aórticas
Caso 2: Dres. Jorge Mayol, Pablo Vázquez, Tomás Dieste y colaboradores
Caso 2
DRES. JORGE MAYOL 1, PABLO VÁZQUEZ 1, TOMÁS DIESTE 1,
MARIANA DIESTE 2, SERGIO BURGUEZ 3, CÉSAR MORIS 4
1. Cardiólogo Intervencionista, Centro Cardiológico Americano.
2. Residente Cardiología, Hospital de Clínicas, Facultad de Medicina. Residente Cardiología, Centro Cardiológico Americano.
3. Coordinador Clínico y Ecocardiografista, Centro Cardiológico Americano.
4. Cardiólogo Intervencionista, Hospital Universitario Central de Asturias “Julián Clavería”, Oviedo, España. Experto en Core-Valve.
Recibido abril 19, 2010; aceptado mayo 12, 2010.
CASO CLÍNICO
Paciente de 88 años, autoválida, hipertensa tratada con IECA, que en el año 2007 comienza con disnea de esfuerzo y angor progresivos. En ese momento se constata soplo de estenosis valvular aórtica. El ECG muestra un ritmo sinusal de 80 cpm. Onda P normal. PR de 160 mseg. Eje +30, hipertrofia ventricular izquierda con trastornos secundarios de la repolarización. El ecocardiograma transtorácico evidencia una estenosis aórtica severa con un área de 0,5 cm2, gradiente máximo de 103 mmHg y medio de 58 mmHg, ventrículo izquierdo levemente dilatado con FEVI 43%.
La CACG no evidenció lesiones coronarias obstructivas significativas.
Valorada por el equipo de cirugía cardíaca se plantea que la paciente presenta un alto riesgo quirúrgico (Euroscore 18,8%), por lo que se resuelve continuar con tratamiento médico.
En el año 2009 se reconsidera la conducta dada la progresión de los síntomas con mayor deterioro de la clase funcional, con disnea y angor clase III-IV.
El nuevo ecocardiograma evidencia un área valvular aórtica de 0,32 cm2, un gradiente máximo de 92,4 mmHg y medio de 61,5 mmHg, con FEVI de 28%.
Se recalcula el riesgo quirúrgico, estimándose una mortalidad por Euroscore de 30,2% y por STS Score (Society of Thoracic Surgeons) de 26,5%.
Dado el alto riesgo quirúrgico se plantea el implante percutáneo de una válvula aórtica.
Se completan los estudios de factibilidad de implante protésico aórtico:
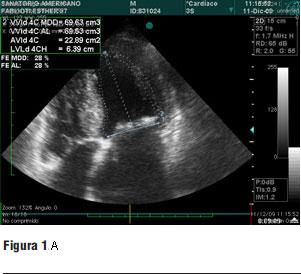
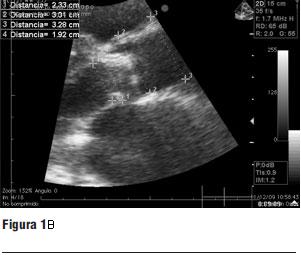
1. Ecocardiograma transtorácico y transesofágico (figura 1 a y b)
- FEVI: 28%.
- Gradiente pico: 92,4 mmHg.
- Gradiente medio: 61,5 mmHg.
- Anillo aórtico: 23 mm.
- Diámetro de aorta a 40 mm del anillo: 32,8 mm.
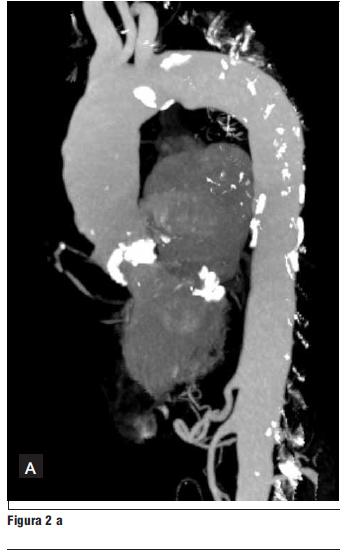
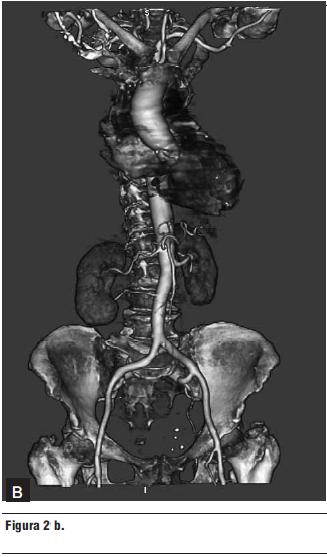
2. Tomografía computada multicorte (16 líneas) (figura 2 a y b).
- Válvula aórtica intensamente calcificada.
- Calcificación del anillo mitral.
- Múltiples placas calcificadas en la aorta torácica.
- Arterias ilíacas de buen diámetro, sin bucles.
- Diámetro de la arteria femoral derecha: 9,3 mm.
- Diámetro de la arteria femoral izquierda: 8,1 mm.
DESCRIPCIÓN DEL PROCEDIMIENTO.
El procedimiento se realizó en sala de hemodinamia, por parte del equipo de cardiología intervencionista junto al equipo de anestesia, de cirugía vascular “stand by” y ecocardiografista con monitorización transesofágica permanente.
Monitoreo hemodinámico, ecográfico y anestesia
Bajo anestesia general se coloca una vía venosa central y un cable de marcapaso 6 Fr con balón de protección en el ápex del ventrículo derecho. Monitorización de la presión arterial continua por vía radial izquierda.
Procedimiento 100% percutáneo
Doble abordaje por punción de ambas arterias femorales.
Primero el abordaje femoral izquierdo por punción convencional y colocación de un introductor 6 Fr de 11 cm de largo, para el uso de un catéter de Pigtail en la raíz de la aorta, como guía del implante.
La punción femoral derecha se realiza guiada por angiografía usando catéter Pigtail por vía contralateral. Se realiza la punción 5 cm por debajo del nacimiento de la arteria circunfleja, teniendo especial cuidado en puncionar solamente la cara anterior del vaso.
En este caso se utilizó un sistema de cierre por sutura percutáneo Prostar XL (Abbott, Abbott Park, Illinois) que se implanta en la femoral derecha antes de la inserción del introductor.
Valvuloplastia aórtica inicial
Sobre guía se pasa el introductor arterial de 18 Fr de 40 cm de largo.
Una vez traspuesto el plano valvular aórtico se coloca una guía de alto soporte en el ventrículo izquierdo.
Deslizamos un balón de 18 mm de diámetro que se insufla a nivel del plano valvular aórtico (figura 3).
Figura 3.
Durante la insuflación se estimula a 180 cpm para estabilizar el balón.
Implante de la prótesis aórtica
Fuera del paciente se prepara la prótesis valvular elegida, la cual es montada y envainada en el catéter de liberación. Para realizar esta maniobra se requiere el enfriando de la prótesis con suero a una temperatura entre 2ºC y 4ºC para su correcta manipulación.
Por presentar una medida del anillo aórtico de 23 mm, se seleccionó la prótesis de 26 mm, de acuerdo a las especificaciones de Core-Valve (figura 4).
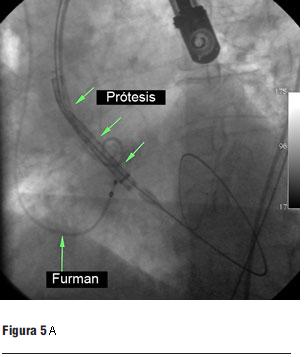
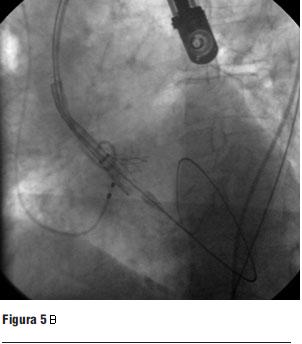
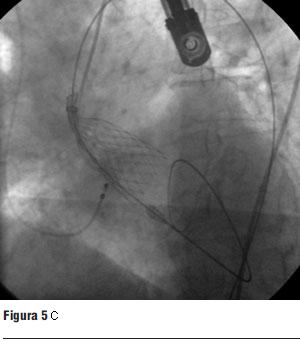
Luego de la valvuloplastia y en el menor tiempo posible se procedió al avance y posicionamiento de la válvula percutánea, con posterior liberación de la misma (figura 5 a, b, c y d).
Controles y postdilatación
Una vez autoexpandida se reiteraron las medidas hemodinámicas y ecocardiográficas. Comprobamos en forma inmediata la desaparición del gradiente transvalvular aórtico.
Inicialmente presentó una insuficiencia valvular periprotésica severa debido a una aposición incompleta de la válvula por la intensa calcificación. Se procedió a la postdilatación con un balón de 25 mm, lográndose una mejor coaptación de la válvula con el anillo, con disminución del grado de la insuficiencia a leve-moderada.
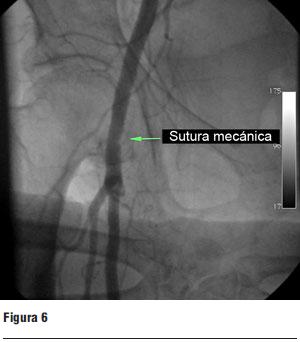
Luego del implante se retiró el introductor arterial y se cerró el orificio vascular mediante la sutura mecánica (Prostar) implantada previamente, comprobándose una hemostasis completa del sitio de abordaje (figura 6), dándose por finalizado el procedimiento.
POSTPROCEDIMIENTO
La paciente ingresó al CTI cardiológico bajo IOT y ARM, siendo extubada a las 24 horas del procedimiento. Por presentar bradicardia sinusal con un BAV de primer grado junto a BCRD y hemibloqueo anterior izquierdo se decide la colocación de un marcapaso definitivo.
El ecocardiograma a las 24 horas evidenció:
- Prótesis aórtica normofuncionante sin gradiente significativo e insuficiencia leve.
- FEVI: 45%.
La paciente fue dada de alta al quinto día en situación clínica estable a su Institución de origen.
AGRADECIMIENTO
Nuestro agradecimiento a los siguientes colegas, quienes también participaron en la discusión y asistencia del paciente, y que por las normas de publicación de la revista no pueden figurar como coautores: Juan Carlos Hiriart, Ramón Scola, Gustavo Vignolo, Ignacio Batista, Roberto Valiñas, Juan Del Campo, Juan Riva, Eduardo Kohn, Laura Pagliotti.