Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.24 no.3 Montevideo dic. 2009
CONSENSO
Consenso uruguayo de síndromes coronarios agudos sin elevación del segmento ST
Sociedad Uruguaya de Cardiología
Servicio de Cardiología, Departamento Clínico de Medicina, Hospital de Clínicas, Facultad de Medicina, UDELAR
L. Florio
M. Giambruno
GRUPO 1. DEFINICIóN
Coordinador:
G. Pereda
Miembros:
B. Baeuml
A. Fajardo
G. Guadalupe
C. Martínez
G. Pascal
G. Vega
GRUPO 2. MANEJO INICIAL Y ESTABILIZACIóN. TRATAMIENTO ANTIISQUéMICO
Coordinador
G. Junker
Miembros:
A. Bonino
V. Collazi
M. Dieste
J. Mallo
S. Mato
L. Moyano
A. Simeone
GRUPO 3 COMPLICACIONES Y TRATAMIENTO COADYUVANTE
Coordinador
P. Asadurian
Miembros
F. Berro
D. Loza
R. Mendiburu
O. Montes de Oca
J. Pontet
C. Rivas
S. Rossi
M. Sáez
GRUPO 4 PARACLíNICA
Coordinador
L. Oyhantçabal
Miembros
N. Blanchet
E. Cruz
R. Mila
G. Parma
P. Trujillo
A. Vanerio
G. Varela
G. Vignolo
GRUPO 5. TRATAMIENTO ANTIAGREGANTE Y ANTICOAGULANTE
Coordinador
V. Estragó
Miembros
J. Alonso
C. Bidegain
M. Chiarella
M. Díaz
J. Grignola
C. Guigou
N. Lluberas
R. Lluberas
A. Machado
F. Maglione
J. Martínez
L. Páez
G. Rodríguez
S. Tantesio
I. Taub
GRUPO 6. ESTRATIFICACIÓN DE RIESGO EN LA EVOLUCIÓN
Coordinador
P. Amonte
Miembros
S. Amonte
A. Báez
M. Bianchi
G. Galleno
V. Michelis
L. Ogliarusso
A. Rener
J. Terra
F. Torres
H. Vázquez
GRUPO 6. PRUEBAS FUNCIONALES
Coordinador
M. Beretta
Miembros
D. Imas
E. Nuñez
M. Stabilito
J. Terra
L. Vanerio
I. Vidal
GRUPO 7. INDICACIONES DE CATETERISMO CARDÍACO
Coordinador
P. Díaz
Miembros
A. Amodio
C. Artucio
E. Colombo
I. Duro
D. Korytnicki
J. López Mansillla
A. Martins
Á. Niggemeyer
C. Pardiñas
J. Silva
J. Terra
GRUPO 8. REVASCULARIZACIÓN
Coordinadores
J. Paganini
A. Tuzman
Miembros
F. Alagia
F. Buitrón
A. Cuesta
A. Durán
J. Estigarribia
A. Fronzutti
J. Gaspar
A. Lorenzo
O. Maldonado
D. Mallo
C. Panizza
J. Reinoso
P. Vázquez
A. Vicino
GRUPO 9. MANEJO AL ALTA HOSPITALARIA
Coordinador
G. Burdiat
Integrantes
J. Barreiro
C. Bermúdez
O. Díaz Arnesto
C. Marino
A. Rodríguez
E. Sandoya
M. Zabalza
COMITÉ DE REDACCIÓN
V. Estragó
F. Kuster
R. Lluberas
M. Valentini
H. Vázquez
1. Introducción
En el año 2002 la Sociedad Uruguaya de Cardiología realizó el primer Consenso de síndromes coronarios sin elevación del segmento ST (SCASEST).
Durante el año 2008 la Sociedad Uruguaya de Cardiología, en conjunto con el Servicio de Cardiología del Hospital de Clínicas, propusieron rever este Consenso, dado que se habían acumulado nuevas evidencias que imponían algunas modificaciones sustanciales.
De esta manera se realizó un llamado para la realización del Consenso, en el que participaron múltiples colegas de diferentes servicios universitarios (Servicio de Cirugía Cardíaca del Hospital de Clínicas, Departamento de Emergencia, Departamento Clínico de Medicina del Hospital de Clínicas, Servicios de Diagnóstico y Tratamiento Especializado) y extrauniversitarios del ámbito público y privado, de Montevideo y del interior.
A lo largo de sucesivas reuniones se canalizaron los aportes de los diferentes grupos y posteriormente un Comité de Redacción resumió los mismos en este documento final. Una vez aprobado por el plenario del Consenso, se difunde a través de esta publicación.
Este Consenso está dirigido a todos aquellos que tratan pacientes con síndromes coronarios agudos (SCA): médicos emergencistas, médicos generales, médicos de familia, internistas, intensivistas, cardiólogos, cirujanos cardíacos, residentes y practicantes internos.
Es encarado desde un punto de vista práctico, con una perspectiva de aportar en el manejo clínico diario de este tipo de pacientes. Se agregan las referencias bibliográficas que permiten profundizar el aspecto que se desee.
Por otra parte, para quien tenga interés de conocer el trabajo de los grupos, este material está libremente disponible en la Sociedad de Cardiología y en el Servicio de Cardiología del Hospital de Clínicas.
Se entendió adecuado formular las recomendaciones adicionándoles una calificación similar a la del primer Consenso:
- Clase I: casi siempre indicado.
- Clase II: puede estar indicado, pero no existe consenso unánime al respecto. A su vez esta clase puede ser:
- Clase IIa: es razonable y existe una opinión mayoritaria a favor.
- Clase IIb: puede ser útil pero es controversial.
- Clase III: generalmente no indicado.
Asimismo, se hace referencia al nivel de evidencia en que se basa la recomendación, para lo cual se emplean los siguientes criterios:
- A: evidencia sólida, proveniente de múltiples estudios randomizados.
- B: evidencia más débil, derivada de un solo estudio randomizado u otro tipo de estudios.
- C: opinión de expertos.
Cuando se formula una recomendación, ésta se hace siguiendo un patrón común incluyendo las siguientes palabras:
- Clase I: “se recomienda”.
- Clase IIa: “es razonable”.
- Clase IIb: “puede”.
- Clase III: “no se recomienda”.
Las recomendaciones se realizan teniendo en cuenta la realidad de nuestro medio, en cuanto a disponibilidad o uso corriente de las prácticas sugeridas. Sin embargo, el Consenso consideró necesario incorporar recomendaciones que, aunque no sean de práctica generalizada, el peso de la evidencia actual de su beneficio haga imprescindible su inclusión.
Es necesario destacar que todas las recomendaciones deben adaptarse a la realidad concreta del medio en que el médico se desempeña. No se pretende que estas pautas sean preceptos imperativos ni que el apartarse de las mismas se considere de por sí una mala práctica. Es parte del arte de la medicina el saber adecuar el conocimiento científico disponible a las circunstancias del medio en el que el médico actúa.
METODOLOGÍA EMPLEADA
Se tomó como base el primer Consenso Uruguayo de SCASEST, que fuera incorporado a la práctica clínica en los años anteriores, lo que demostró su eficacia.
Se formaron grupos de trabajo según la división de unidades temáticas de este primer Consenso, cada uno de los cuales revisó la bibliografía desde el año 2002 en adelante. Posteriormente estos grupos elaboraron una propuesta que fue discutida en sesiones plenarias del Consenso.
Finalmente, un Comité de Redacción elaboró el informe final, que debió ser refrendado por el plenario del Consenso.
La evidencia utilizada para formular las recomendaciones es la disponible en forma publicada hasta la fecha de reunión del plenario del Consenso en que se formó el Comité de Redacción (noviembre del 2008).
La bibliografía está planteada en forma concisa, sobre aquellos textos que a juicio del Comité Redactor, son imprescindibles. Se desarrolla al final de cada capítulo.
Para quienes deseen mayor información bibliográfica, ésta se encuentra disponible en los documentos de cada uno de los grupos.
2. Definición, diagnóstico y estratificación del riesgo inicial
2.1 DEFINICIóN
El mecanismo fisiopatológico del SCA es una complicación de placa de ateroma que consiste esencialmente en una rotura o erosión de la misma, con la consiguiente trombosis sobreagregada. Eventualmente puede ocurrir un espasmo asociado, que en el momento actual se considera de relevancia secundaria.
La isquemia generada en estas circunstancias puede provocar distintos grados de necrosis, o solo exponer el miocardio a riesgo. El quantum de necrosis y/o amenaza del mismo es la determinante de pronóstico más importante de estos síndromes y nos permite clasificarlos a través de expresiones clínicas y paraclínicas del mismo.
Los SCASEST constituyen un grupo de diferentes cuadros clínicos que tienen en común la angina de pecho, su presentación aguda y ausencia de sobreelevación persistente del segmento ST en el electrocardiograma (ECG).
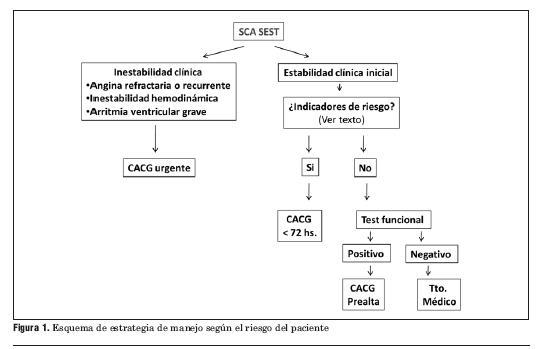
Este síndrome excluye el coronario agudo con elevación del segmento ST (SCACEST), de manejo diferente, donde es imperativo instaurar una estrategia de reperfusión de emergencia (figura 1).
Frente a un paciente con un SCA se impone la realización inmediata de un ECG. Este permite clasificar los SCA según tengan o no elevación del segmento ST.
El siguiente paso diagnóstico es la determinación de marcadores humorales de necrosis, de los cuales los más validados son las troponinas. Según estos sean negativos o positivos se definirá si existe o no un infarto en curso.
Habitualmente un SCASEST con marcadores humorales de necrosis constituye un infarto agudo de miocardio (IAM) sin elevación del segmento ST (IAMSEST) y un SCACEST con marcadores positivos de necrosis constituye un IAM con onda Q. Más frecuentemente la evolución del IAMSEST es de no constituir una onda Q, por lo que se denomina IAM no Q. Eventualmente puede suceder –tal como lo señalan las líneas punteadas de la figura 1– que un SCACEST derive en un IAM no Q y un SCASEST derive en un IAM con onda Q.
Figura 1. Clasificación de los síndromes coronarios agudos según ECG y troponinas
Las presentaciones clínicas características que pueden incluirse como SCA son las que se muestran en la tabla 1 (1,2).
TABLA 1. PRESENTACIóN CLíNICA DE LOS SCASEST
La angina de reposo prolongada de más de 20 minutos de duración es la forma de presentación habitual del IAM, aunque su diagnóstico debe ser corroborado por los marcadores de necrosis en el contexto de un SCASEST.
La angina de reciente comienzo se define como la que tiene menos de dos meses de evolución. Se considera incluida en los SCASEST cuando ésta es de alto grado de severidad [clase III o IV de la clasificación canadiense (3)].
El IAMSEST se caracteriza habitualmente por el cuadro doloroso anginoso prolongado y la presencia de marcadores de injuria miocárdica (TnT, TnI, mioglobina, CKMB).
El consenso está de acuerdo en los criterios de la definición universal de IAM (que incluye además situaciones clínicas diferentes como intervenciones coronarias percutáneas, cirugía de revascularización miocárdica) y que se desarrollan en el anexo 1 (4).
La presentación clínica inicial es habitualmente indistinguible entre un IAMSEST y una angina inestable, pues los diferencia la presencia de marcadores de necrosis positivos o negativos.
2.2 DIAGNÓSTICO
El dolor torácico es la presentación más frecuente de los SCA, aunque pueden presentarse también dolor epigástrico, malestar digestivo de aparición reciente, dolor torácico transfixiante o disnea creciente. La evaluación inicial enfrenta al médico al reto de confirmar el origen coronario del dolor y descartar otros diagnósticos diferenciales.
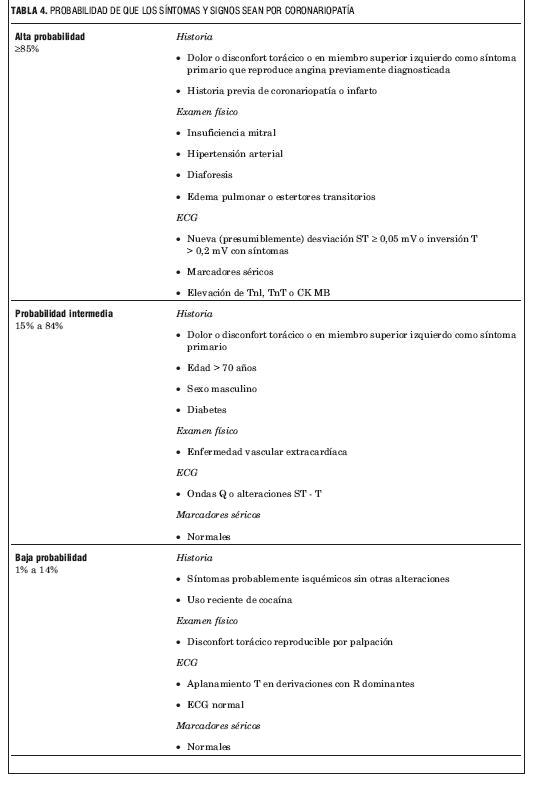
Apoyan el diagnóstico de angor las características clínicas (tabla 2) y la probabilidad de enfermedad coronaria (tabla 3); entre otros el análisis del dolor torácico es de capital importancia o la integración del ECG y marcadores séricos (tabla 4).
TABLA 2. CARACTERíSTICAS DEL DOLOR TORÁCICO
TABLA 3: PROBABILIDAD DE CORONARIOPATíA
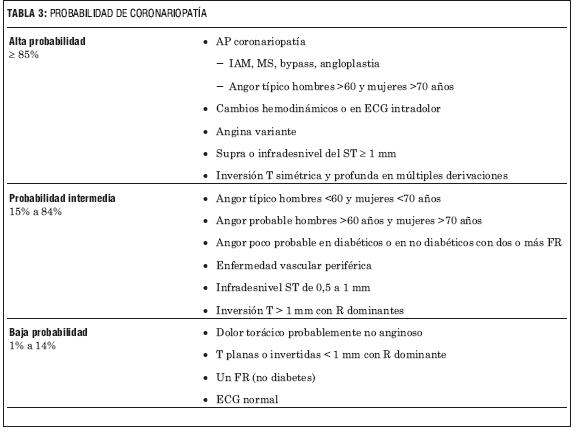
TABLA 4. PROBABILIDAD DE QUE LOS SíNTOMAS Y SIGNOS SEAN POR CORONARIOPATíA
Otro aspecto a considerar en el proceso diagnóstico es la pesquisa de causas que puedan desencadenar o exacerbar el SCASEST. Se detallan las más relevantes en la tabla 5.
TABLA 5
TABLA 6

En la evaluación diagnóstica inicial es fundamental la integración del cuadro clínico, los marcadores séricos y el ECG.
- Se recomienda determinar marcadores de injuria miocárdica, de preferencia troponina T o I. En caso de no disponer de las anteriores, la CKMB también es aceptable. Se recomienda tomar la primera muestra luego de 6 horas del inicio del dolor y reiterar 6 a 12 horas después en caso de que las primeras dosificaciones sean negativas (I, C).
Siguiendo los criterios de la definición universal de infarto de miocardio, al menos un valor debe estar sobre el percentil 99 del valor de referencia para diagnosticar un IAMSEST.
Los marcadores séricos de necrosis confirman el origen cardíaco, o el sufrimiento miocárdico en el cuadro clínico, y junto con la clínica y/o el ECG, el diagnóstico de infarto de miocardio.
La dosificación al ingreso puede acelerar el manejo del paciente cuando es positiva, como testimonio de que hubo otro evento en los días previos. Si existe certeza del tiempo de inicio del cuadro se recomienda extraer la primera muestra luego de las 6 horas. La evolución de los marcadores de necrosis se observa en la figura del anexo 1. Como puede apreciarse, una extracción muy precoz puede implicar que éstas sean negativas, aun en presencia de un infarto en curso.
La presencia de marcadores séricos de necrosis es un elemento de mal pronóstico en los SCASEST. Su negatividad no implica, por el contrario, buen pronóstico, pues el mismo depende además de otras variables (ver sección de evaluación de riesgo).
Por su elevada sensibilidad y especificidad se prefiere el uso de troponinas de las cuales la T es la más usada en nuestro medio. Su valor de corte es 0,01 ng/l, con mayor especificidad y certeza por encima de 0,1 ng/l.
Cuando se usa troponina I, el laboratorio debe proporcionar el valor de corte dado que varios tests son disponibles.
Deben también considerarse situaciones no coronarias que elevan los niveles de troponinas.
Varias enfermedades cardíacas elevan los marcadores séricos, por lo cual su elevación no implica la presencia de un SCA, y esto debe tenerse presente al momento de los diagnósticos diferenciales.
Existen falsos positivos de elevación de troponinas. Debe considerarse esta eventualidad particularmente cuando existe una elevación desmedida de las mismas con respecto al cuadro clínico. En este caso es útil la dosificación de CKMB.
Los pacientes con enfermedad renal terminal, especialmente los que están en tratamiento dialítico, pueden tener troponinas elevadas en situación basal, no conociéndose claramente por qué. Es de destacar que estos pacientes tienen alta prevalencia de enfermedad coronaria. En estas circunstancias es de mayor significación diagnóstica una curva con ascenso de las troponinas que una determinación aislada.
Ante la sospecha de un SCA perioperatorio se requiere una curva de troponinas similar a la situación anterior.
El Consenso considera de fundamental importancia valorar la información de los marcadores de necrosis en acuerdo con el cuadro clínico de sospecha de SCA.
- Se recomienda realizar un ECG dentro de los 10 minutos de contacto con el paciente (I, C).
- Se recomienda reiterar el ECG a las 6 y 24 horas, luego diario hasta el alta y cada vez que el paciente reitera síntomas (I, C).
- Si el ECG es normal o dudoso, se recomienda realizarlo seriado e incluir derivaciones V3R, V4R, V7 a V9 (I, C).
El ECG es el centro para la evaluación y el manejo de los pacientes con síndrome coronario. Permite su primera clasificación de crucial interés terapéutico, entre SCA con o sin elevación del segmento ST.
Nos brinda información sobre el vaso comprometido, valora el quantum isquémico y guía el tratamiento.
Para aumentar el rendimiento diagnóstico puede realizarse ECG de 18 derivaciones con inclusión de V3R-V4R-V5R y V7-V8-V9, especialmente cuando el mismo es normal, dado que los accidentes de la arteria circunfleja frecuentemente no tienen traducción electrocardiográfica en el ECG de 12 derivaciones.
En el SCASEST el ECG puede ser normal o sin cambios y presentar en la evolución criterios de alto riesgo; puede mostrar inversión de onda T o alteraciones del segmento ST, por lo cual debe repetirse seriadamente o cuando recurren los síntomas.
Un ECG completamente normal en un paciente con dolor torácico no es suficiente para excluir un SCA (1%-6% de estos eventualmente presentan IAM no Q y por lo menos 4% va a tener angina inestable).
Se sugiere la realización de ECG en los primeros 10 minutos de contacto con el paciente, a las 6 horas, a las 24 horas, frente a la recurrencia de síntomas y previo al alta.
Todo paciente hospitalizado debería contar con un ECG diario.
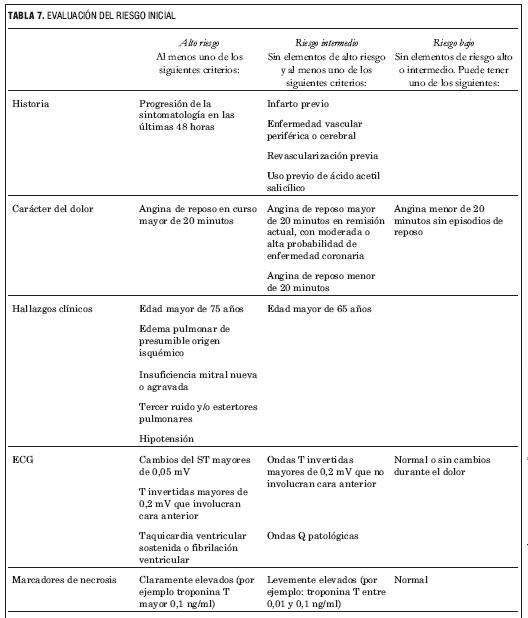
2.3 ESTRATIFICACIÓN DE RIESGO INICIAL
- En todo paciente en que se considera un SCASEST se recomienda utilizar algún tipo de estratificación de riesgo inicial (I, B).
Dado que los pacientes con SCASEST tienen un riesgo aumentado de evolucionar a la muerte o al IAM, una vez definido el diagnóstico debe estimarse la probabilidad de ocurrencia de dichos eventos.
En la estimación del riesgo se debe considerar siempre:
- Clínica de presentación.
- ECG.
- Marcadores biológicos: troponinas o CKMB.
La estimación del riesgo inicial se puede realizar considerando estos indicadores, tal como se esquematiza en la tabla 7.
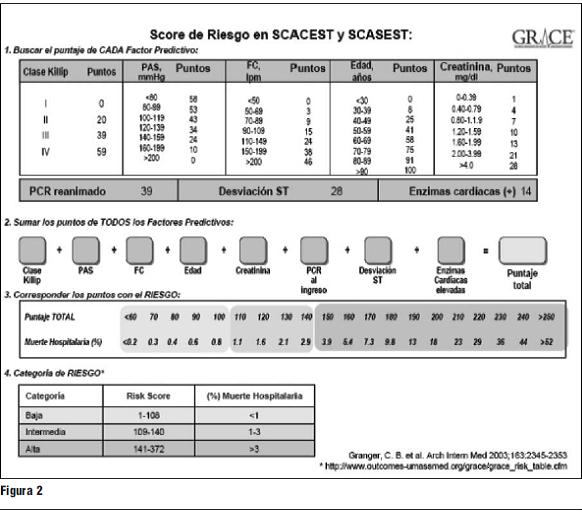
Actualmente, se ha generalizado el uso de diferentes tipos de score [TIMI (5), PURSUIT (6), GRACE (7)]. Estos scores tienen la virtud de poder estratificar el riesgo con mayor precisión, permiten hacer comparaciones de diferentes poblaciones y dado que pueden disponerse en un formato electrónico favorecen su generalización y el uso en un registro nacional.
El Consenso de SCASEST sugiere el uso del score GRACE. Este score predice mortalidad intrahospitalaria y a los seis meses. Su formato electrónico es un buen instrumento para usar en un registro nacional, que los participantes del Consenso alientan en su concreción. Está disponible en la siguiente dirección electrónica: http://www.outcomes-umassmed.org/grace/acs_risk/acs_risk_content.html
El uso de un modelo de estratificación no excluye el otro. Lo fundamental para el Consenso es que se realice una estimación del riesgo del paciente a la hora de la toma de decisiones. El modelo clásico de estratificación basado en los parámetros señalados más arriba y que fuera sugerido en el Consenso del año 2002 es práctico, no requiere de un ordenador y está avalado por nuestra práctica nacional.
BIBLIOGRAFÍA
1. Anderson JL, Adams CD, Antman EM, Bridges CR, Califf RM, Casey DE Jr, et.al. ACC/AHA 2007 guidelines for the management of patients with unstable angina/non–ST-elevation myocardial infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines for the Management of Patients With Unstable Angina/Non–ST-Elevation Myocardial Infarction): developed in collaboration with the American College of Emergency Physicians, American College of Physicians, Society for Academic Emergency Medicine, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons.J Am Coll Cardiol 2007;50:e1–157.
2. Bassand JP, Hamm CW, Ardissino D, Boersma E, Budaj A, Fernández-Avilés F, et al. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes.Task Force for Diagnosis and Treatment of Non-ST-Segment Elevation Acute Coronary Syndromes of European Society of Cardiology. Eur Heart J2007;28:1598-660.
3. Campeau L. Letter: grading of angina pectoris. Circulation 1976;54:522–3.
4. Thygesen K, Alpert JS, White HD; Joint ESC/ACCF/AHA/WHF Task Force for the Redefinition of Myocardial Infarction. Universal definition of myocardial infarction. J Am Coll Cardiol 2007;50:2173–95
5. Antman EM, Cohen M, Bernink PJ, McCabe CH, Horacek T, Papuchis G, et al. The TIMI risk score for unstable angina/non-ST elevation MI: A method for prognostication and therapeutic decision making. JAMA. 2000;284:835-42
6. Boersma E, Pieper KS, Steyerberg EW, Wilcox RG, Chan WC, Lee KL, et al. Predictors of outcome in patients with acute coronary syndromes without persistent STsegment elevation. Results from an international trial of 9461patients. The PURSUIT Investigators. Circulation 2000;101:2557–67
7. Granger CB, Goldberg RJ, Dabbous O, Pieper KS, Eagle KA, Cannon CP, et al. Predictors of hospital mortality in the global registry of acute coronary events Arch Intern Med 2003;163:2345-53
3. Manejo inicial
3.1 ÁREA DE MANEJO
El objetivo del manejo inicial es aliviar el dolor, la ansiedad y la isquemia y prevenir las complicaciones potenciales: IAM y muerte.
Para lograrlo, este manejo deberá ajustarse a la severidad de los síntomas y la estratificación del riesgo que se haya realizado. El área de manejo dependerá indudablemente de la estimación de estos parámetros.
En todos los casos debe participar un cardiólogo en la evaluación y en el tratamiento del paciente.
- Ante un paciente con dolor torácico de etiología desconocida se recomienda seguir las pautas del Primer Consenso Uruguayo de Dolor Torácico (I,C) (1).
La estimación del riesgo inicial una vez planteado el diagnóstico de SCASEST (ya sea por diagnóstico primario o porque se siguió el protocolo de dolor torácico) se recomienda que se realice en la puerta de emergencia, donde existen los medios adecuados para el diagnóstico y tratamiento inicial de estos pacientes (2).
- Se recomienda realizar la estimación del riesgo inicial en la puerta de emergencia (I, C).
El paciente con sospecha de SCA debe ser evaluado rápidamente. No debe olvidarse que en algunos casos de SCA el tratamiento implica una emergencia, en particular si se presenta con elevación del segmento ST (figura 1).
Ante un paciente con sospecha de que presenta un síndrome coronario agudo se recomienda administrar una dosis inicial de absorción rápida de ácido acetilsalicílico (AAS), salvo que exista contraindicación para su uso, dado el beneficio demostrado de este fármaco en este tipo de pacientes. Posteriormente se desarrollarán con mayor detalle las medidas antitrombóticas a plantearse.
- Se recomienda que el paciente con SCASEST de bajo riesgo se mantenga bajo supervisión médica en la puerta de emergencia (no requiriendo áreas de cuidados especializados) hasta un mínimo de 12 horas de estabilidad médica, con clínica y ECG sin cambios y marcadores de necrosis negativos (I,C).
- En los pacientes de bajo riesgo es razonable realizar un test funcional para detectar isquemia y estratificar el riesgo antes de darle el alta a domicilio. En caso de no disponibilidad en lo inmediato de este test funcional, es razonable realizarlo en forma ambulatoria antes de las 72 horas previo al alta definitiva del paciente (IIa, C).
La evaluación de un paciente con SCASEST de bajo riesgo pasa por ajustar esta estratificación de riesgo. Básicamente la misma se realiza por un test funcional que en lo posible sería adecuado realizarlo en el mismo momento en que consulta. De no ser posible, el paciente puede ser enviado a domicilio con la recomendación de hacerse un test funcional en las próximas 72 horas.
- Se recomienda que los pacientes con SCASEST de moderado o alto riesgo ingresen a un área con monitorización electrocardiográfica continua y capacidad de reanimación cardíaca inmediata (unidad cardiológica o cuidados intermedios o intensivos polivalente) (I, C).
- En los pacientes con necesidad de asistencia respiratoria mecánica, balón intraaórtico de contrapulsación o con severa inestabilidad hemodinámica o eléctrica se recomienda su ingreso en una unidad de cuidados intensivos cardiológicos o polivalente (I, C).
El área de manejo de los pacientes internados con SCASEST depende de su gravedad clínica. Se recomienda que todos estén en un ámbito donde sea posible la monitorización electrocardiográfica inicial, el tratamiento con fármacos endovenosos y la reanimación cardíaca en caso de necesidad. En los pacientes sin necesidad de asistencia respiratoria mecánica y sin arritmias o inestabilidad hemodinámica graves, el área adecuada de manejo es una unidad cardiológica o en su defecto una unidad de cuidados intermedios polivalente. Cuando existe alguna de estas condiciones, el área de internación adecuada es la unidad intensiva cardiológica o en su defecto polivalente.
3.2 TRATAMIENTO MéDICO INICIAL
El tratamiento inicial se señala en la tabla 1.
- Se recomienda indicar reposo en cama, con monitoreo ECG continuo, en todos los pacientes con SCASEST durante la etapa inicial (I, C).
- Se recomienda administrar oxígeno cuando la saturación sea menor a 90% (I, C).
- Es razonable administrar oxígeno en las primeras 6 horas a todos los pacientes portadores de SCASEST (IIa, C).
TABLA 1. MANEJO INICIAL DE LOS PACIENTES CON SCASEST
Tratamiento antiisquémico.
- Alivio del dolor (prioridad).
- Nitratos s/l; i/v.
- Reposo en cama.
- O2.
- Morfina (frente al angor persistente).
- Antiagregación plaquetaria; antitrombóticos.
- Betabloqueantes / Anticálcicos.
- IECA / ARA II.
- Estatinas.
- Balón de contrapulsación intraórtica (en la isquemia refractaria).
3.2.1 NITRATOS
- Se recomienda administrar nitratos por vía intravenosa (i/v) o sublingual (s/l) cuando el dolor anginoso está presente (son efectivos para el alivio del dolor agudo) (I, C).
- En el paciente con angor en curso se recomienda administrar nitratos si la presión arterial sistólica (PAS) es mayor a 90 mm Hg (I, C).
- No se recomienda administrar nitratos a los pacientes con SCASEST con PAS menor a 90 mm Hg o 30 mm Hg por debajo de la PAS basal del paciente, bradicardia menor a 50 cpm, taquicardia mayor a 100 cpm en ausencia de falla cardíaca sintomática o infarto del ventrículo derecho (III,C).
- Si el dolor no calma con tres comprimidos de nitratos s/l se recomienda iniciar nitroglicerina (NTG) i/v (I, C).
La NTG reduce el consumo de O2 miocárdico (MVO2) y aumenta la liberación de O2 al miocardio. Es un vasodilatador independiente del endotelio con efecto vascular periférico y vascular coronario. La dilatación del lecho venoso desciende la precarga, por lo tanto reduce la tensión parietal, con reducción del MVO2. Por mecanismo reflejo incrementa el aumento de la frecuencia cardíaca y contractilidad que contrarresta la reducción del MVO2 a menos que se administre el betabloqueante en forma concomitante (3-6).
La abrupta cesación de la NTG i/v ha sido asociada a exacerbación de cambios isquémicos en ECG, por lo cual se aconseja una gradual reducción de la dosis i/v (7).
Pensar en “IAM en curso” si el dolor no calma inicialmente con nitratos.
La ausencia de respuesta al tratamiento con nitratos debe hacer pensar fuertemente en que estamos frente a un IAM con elevación del segmento ST, con lo que esto implica desde el punto de vista terapéutico.
- Se recomienda administrar NTG i/v en las primeras 48 horas si está presente alguna de las siguientes situaciones clínicas:
- isquemia persistente;
- hipertensión arterial;
- insuficiencia cardíaca (I, B). - Si el paciente está sin síntomas por más de 24 horas se recomienda pasar a nitratos por v/o o parche cutáneo (I, C).
- Una vez estabilizado el paciente es razonable respetar el intervalo libre de los nitratos de 6 a 8 horas (IIa, C).
- No se recomienda administrar nitratos y NTG en quien recibió inhibidores de la 5-fosfodiesterasa (sildenafil, tadalafil) en las últimas 24 horas por riesgo de aumentar vasodilatación e hipotensión (8-10)(III, C).
3.2.2 MORFINA
- Es razonable administrar morfina si el dolor anginoso no calma con nitratos s/l o NTG i/v (11) (IIa, B).
El sulfato de morfina de 1 a 5 mg administrado i/v, si no existen contraindicaciones como hipotensión arterial o intolerancia, se puede repetir cada 5 a 30 minutos hasta liberar al paciente del dolor, con control de la presión arterial.
La morfina tiene un potente efecto analgésico, ansiolítico y hemodinámico, generando venodilatación y modesta reducción de la frecuencia cardíaca y de la PAS, reduciendo la demanda del consumo de O2 miocárdico, que es beneficioso para los pacientes con SCASEST.
La reacción adversa de la morfina es la exageración del efecto farmacológico causando hipotensión arterial en especial en pacientes con depleción de volumen y/o la terapia vasodilatadora conjunta.
Estas reacciones responden a la elevación de miembros inferiores o la reposición de volumen con suero fisiológico; cuando se acompañan de bradicardia se puede administrar atropina.
- Es razonable administrar morfina en pacientes con dolor en curso y contraindicación para uso de nitratos o NTG, por uso reciente de inhibidores de 5-fosfodiesterasa (sildenafil, tadalafil)
(IIa, C).
3.2.3 BETABLOQUEANTES
- Se recomienda iniciar betabloqueantes por v/o en las primeras 24 horas en los pacientes que no tengan:
- signos de falla cardíaca;
- gasto cardíaco bajo;
- riesgo incrementado de shock cardiogénico;
- otras contraindicaciones relativas como son:
- PR mayor de 0,24 s;
- BAV de 2o o 3er grado;
- Asma activa o hiperreactividad bronquial
(I, B).
El riesgo incrementado de shock cardiogénico se estima por varios parámetros. A mayor coexistencia de los mismos, mayor riesgo:
- edad mayor a 70 años;
- presión arterial menor a 110 mmHg;
- frecuencia cardíaca mayor a 120 cpm;
- mayor tiempo desde el inicio de los síntomas.
- Se recomiendan los betabloqueantes por v/o en todos los pacientes con SCASEST a menos que existan contraindicaciones. Se recomienda iniciarlos en los primeros días del evento si no se indicaron inicialmente y continuarlos en forma indefinida (I, B).
- En presencia de hipertensión arterial, el uso de betabloqueantes i/v es razonable en los pacientes que no tengan:
- signos de falla cardíaca;
- gasto cardíaco bajo;
- riesgo incrementado de shock cardiogénico;
- otras contraindicaciones relativas como:
- PR mayor de 0,24 s;
- BAV de 2o o 3er grado;
- asma activa o hiperreactividad bronquial
(IIa, B). - Los beta bloqueantes no se recomiendan en los pacientes con contraindicaciones para su uso como: signos de falla cardíaca, gasto bajo u otros factores de riesgo incrementado para shock cardiogénico (III, A).
- Es razonable que los pacientes que se recuperan de un SCASEST con falla cardíaca reciban terapia con betabloqueantes con un manejo tritado, gradual de la dosis de acuerdo a la respuesta clínica (IIa, B).
Los betabloqueantes han demostrado beneficio evidente en los SCASEST. Una revisión de los trabajos randomizados con estos fármacos muestra una reducción de la tasa de infarto de 13% (12).
El beneficio primario del betabloqueo es debido a la inhibición de los receptores beta1 adrenérgicos en un descenso del trabajo cardíaco y MVO2. El descenso de la frecuencia cardíaca también tiene un efecto favorable aumentando la duración de la diástole y optimizando el flujo coronario.
Los betabloqueadores sin actividad simpaticomimética son preferidos.
Los fármacos estudiados en SCA incluyen metoprolol, propranolol y atenolol; el carvedilol puede ser agregado a esta lista.
En los pacientes con falla cardíaca se considera que hay mayor beneficio con carvedilol (13-15).
3.2.4 CALCIOANTAGONISTAS
- Es razonable el uso de los calcioantagonistas (CA) no dihidropiridínicos (verapamil, diltiazem), como tratamiento inicial, en SCASEST con isquemia persistente o recurrente y contraindicaciones para betabloqueantes, en ausencia de elementos clínicos de disfunción ventricular izquierda u otras contraindicaciones para su uso (IIa, C).
La evidencia es mayor para el verapamil y diltiazem (16-19).
El uso de los CA en SCASEST está limitado al control de síntomas.
- Es razonable el uso de CA no dihidropiridínicos de acción prolongada (en ausencia de contraindicaciones), cuando hay isquemia recurrente, a pesar del tratamiento con betabloqueantes y nitritos (IIa, C).
Se recomienda cuidado cuando se combina betabloqueo y CA porque puede existir sinergismo entre ambos aumentando la depresión de la función ventricular izquierda, del nódulo sinusal y de la conducción por el nódulo aurículo-ventricular (20,21).
- Los CA dihidropiridínicos de rápida acción pueden ser considerados en los pacientes con SCASEST que presentan isquemia en curso y adecuado betabloqueo (IIb, B).
- No se recomiendan CA dihidropiridínicos de rápida acción en los pacientes con SCASEST en ausencia de betabloqueantes (III, A).
Los CA de liberación rápida dihidropiridinicos de corta acción (por ejemplo nifedipina) en ausencia de la terapia concomitante beta bloqueante deben evitarse por sus efectos adversos documentados (22-24).
El beneficio de los nuevos CA, amlodipina y felodipina, está siendo revisado y permanece no definido, por lo cual se sugiere cuidado en su uso cuando está ausente el betabloqueo (25-27).
3.2.5 INHIBIDORES DEL SISTEMA RENINA-ANGIOTENSINA-ALDOSTERONA
- Se recomienda administrar inhibidores de la enzima conversora de angiotensina (IECA) v/o en las primeras 24 horas de SCASEST en pacientes con congestión pulmonar o fracción de eyección del ventrículo izquierdo (FEVI) £ 40%, sin hipotensión o contraindicaciones conocidas (I, A).
- Es razonable administrar IECA v/o dentro de las primeras 24 horas de SCASEST en ausencia de congestión pulmonar o FEVI £ 40%, sin hipotensión u otras contraindicaciones (IIa, B).
Los IECA han demostrado disminución de la mortalidad en los pacientes con infarto de miocardio o que tienen infarto de miocardio reciente con disfunción sistólica del ventrículo izquierdo (28-30), en pacientes con diabetes y disfunción del ventrículo izquierdo (31), y en el amplio espectro de pacientes con enfermedad de las arterias coronarias con alto riesgo, aun teniendo función ventricular izquierda normal (32-35).
La revisión de la potencial inhibición de la acción del IECA por la aspirina muestra beneficio clínico del IECA asociado a la aspirina con una débil reducción de la acción del IECA (36).
- Se recomienda administrar antagonistas de los receptores de angiotensina (ARA II) v/o a los pacientes con SCASEST que son intolerantes a los IECA, con clínica o signos radiológicos de insuficiencia cardíaca, o FEVI £ 40% (I, A).
El bloqueador selectivo de los receptores de aldosterona (eplerenone) es razonable administrarlo en los pacientes SCASEST complicados con disfunción ventricular, con falla cardíaca congestiva.
En el estudio clínico EPHESUS el eplerenone reduce la mortalidad y morbilidad (37). Complementa los datos del estudio RALES en quienes el uso de la espironolactona reduce la morbilidad y mortalidad en pacientes con severa falla cardíaca, quienes estaban recibiendo diurético de asa (furosemide) y IECA. En esta población la mitad tenía una cardiopatía isquémica (38).
3.2.6 ESTATINAS
- Se recomienda iniciar estatinas independientemente del nivel basal de LDL en todos los pacientes con SCASEST desde el inicio del tratamiento, en ausencia de contraindicaciones
(I, A). - Las dosis iniciales de las estatinas se recomienda que sean altas, 20-80 mg de atorvastatina o 20 mg de simvastatina, o rosuvastatina 10-20 mg (I, A).
- Se recomienda administrar estatinas antes del alta si no se indicaron durante el manejo inicial (I, C).
Estudios observacionales: dos estudios clínicos randomizados (PROVE-IT TIMI 22 study, phase Z of the A to Z Trial), y metaanálisis soportan el tratamiento precoz e intensivo con hipolipemiantes después de un SCA (39-43).
Dada la mayor incidencia de miopatía que ocurre en el grupo de tratamiento agresivo y precoz se destaca la necesidad de seguimiento y control en esta población.
La iniciación de la terapia hipolipemiante antes del alta aumenta la complacencia a este tratamiento hipolipemiante a largo plazo (44-46).
3.2.7 ANTIINFLAMATORIOS NO ESTEROIDEOS
- Los antiinflamatorios no esteroideos COX-2-selectivos y no selectivos se recomienda que no sean administrados durante la hospitalización por SCASEST. Si estaban indicados previamente deberían ser discontinuados porque aumentan el riesgo de mortalidad, reinfarto, hipertensión arterial, falla cardíaca y rotura cardíaca con su uso (III, C).
Los antiinflamatorios no esteroideos han estado asociados con mayor riesgo cardiovascular y mortalidad. El HR y 95% CI de riesgo de muerte fue de 2,80 (2,41-3,25) para el rofecoxib; 2,57 (2,15-3,08) para el celecoxib, 1,50 (1,36-1,67) para el ibuprofen; 2,40 (2,09-2,80) para el diclofenac, y de 1,29 (1,16-1,43) para los otros antiinflamatorios no esteroideos (47).
El riesgo cardiovascular de estos agentes es proporcional al grado de selectividad COX-2.
3.3 MANEJO DE LAS COMPLICACIONES
3.3.1 INSUFICIENCIA CARDíACA
(VER CONSENSO DE INSUFICIENCIA CARDíACA)
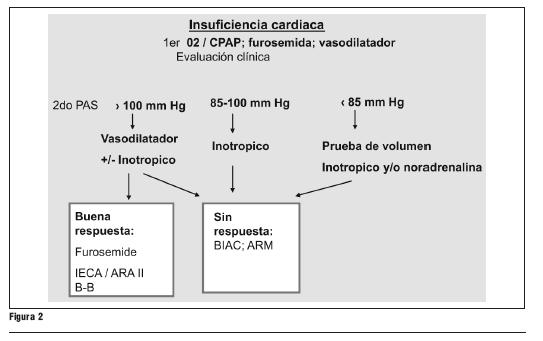
El balón intraaórtico de contrapulsación (BIAC) debe considerarse como un tratamiento de transición para la realización de coronariografía y posterior revascularización miocárdica en los pacientes con isquemia miocárdica refractaria al tratamiento médico completo, y/o inestabilidad hemodinámica.
- Es razonable el uso de BIAC en pacientes con angina refractaria o inestabilidad hemodinámica (IIa, C).
La colocación del BIAC puede ser útil en pacientes con isquemia recurrente, refractaria a pesar del tratamiento médico máximo, y en aquellos con inestabilidad hemodinámica antes de la coronariografía y de que la revascularización pueda ser completada. El uso del BIAC para la isquemia refractaria data desde hace más de 30 años. La inserción del balón ha sido satisfactoria en 97,7% de los pacientes y las complicaciones mayores han acontecido en 2,7% de los pacientes cuando la media de uso del BIAC fue de tres días (48).
La presencia de insuficiencia cardíaca impone el manejo que se plantea en la figura 1. Este incluye el uso de diuréticos, vasodilatadores, inotrópicos y eventualmente el uso de BIAC, de acuerdo a la gravedad de la situación.
- El uso de los inotrópicos y vasopresores i/v es razonable cuando existe insuficiencia cardíaca y/o elementos de gasto cardíaco bajo (IIa, B).
- En los pacientes con insuficiencia cardíaca refractaria es razonable el uso de monitorización hemodinámica con el catéter en arteria pulmonar (IIa, C).
- En los pacientes con inestabilidad hemodinámica que acontece al ingreso o en la evolución se recomienda la estrategia invasiva urgente (I, A).
- En los pacientes con inestabilidad hemodinámica, al ingreso o en la evolución es razonable implementar la estrategia invasiva urgente y considerar uso de BIAC (IIa, C).
La presencia de insuficiencia cardíaca implica un alto riesgo para el paciente y justifica una estrategia invasiva urgente como tratamiento fundamental. El uso de monitorización invasiva con catéter en arteria pulmonar y BIAC es razonable en el paciente con gran inestabilidad hemodinámica.
3.3.2 ARRITMIAS
Las pautas del manejo de las arritmias supraventriculares y BAV son similares en el SCASEST como en el SCACEST. Así también en el manejo de las arritmias ventriculares.
Las arritmias ventriculares tienen una incidencia de 2,1% a 2,6% en las sostenidas y hasta de 35% en las no sostenidas. Se presentan habitualmente en forma precoz, dentro de las primeras 48 horas (80% antes de las 12 horas).
La mortalidad por arritmias ventriculares es de 5 a 15 veces mayor, ocurriendo la mayoría en los primeros 30 días.
Los factores predictores de la fibrilación ventricular y taquicardia ventricular son las siguientes situaciones clínicas:
- Hipertensión arterial.
- Enfermedad pulmonar obstructiva crónica.
- Infarto de miocardio previo.
- Cambios del segmento ST al ingreso.
BIBLIOGRAFÍA
1. Sociedad Uruguaya de Cardiología. Primer Consenso Uruguayo de Dolor Torácico (monografía en línea). Montevideo: S.U.C; 2003. Disponible en: http://www.suc.org.uy/pdf/Consenso%20SUC-Dolor%20TX.pdf (Consultado 6/10/09).
2. Farkouh ME, Smars PA, Reeder GS, Reeder GS, Zinsmeister AR, Evans RW, et al. A clinical trial of a chest-pain observation unit for patients with unstable angina. ChestPain Evaluation in the Emergency Room (CHEER) Investigators. N Engl J Med 1998; 339: 1882-8.
3. Dellborg M, Gustafsson G, Swedberg K. Buccal versus intravenous nitroglycerin in unstable angina pectoris. Eur J Clin Pharmacol 1991; 41: 5-9.
4. Yusuf S, Collins R, MacMahon S, Peto R. Effect of intravenous nitrates on mortality in acute myocardial infarction: an overview of the randomised trials. Lancet 1988; 1: 1088–92.
5. ISIS-4 (Fourth International Study of Infarct Survival) Collaborative Group. ISIS-4: a randomised factorial trial assessing early oral captopril, oral mononitrate, and intravenous magnesium sulphate in 58,050 patients with suspected acute myocardial infarction. Lancet 1995; 345: 669-85.
6. Gruppo Italiano per lo Studio della Sopravvivenza nell’infarto Miocardico. GISSI-3: effects of lisinopril and transdermal glyceryl trinitrate singly and together on 6-week mortality and ventricular function after acute myocardial infarction. Lancet 1994; 343: 1115-22.
7. Figueras J, Lidon R, Cortadellas J. Rebound myocardial ischaemia following abrupt interruption of intravenous nitroglycerin infusion in patients with unstable angina at rest. Eur Heart J 1991; 12: 405-11.
8. Pfizer. Sildenafil package insert. (monogafía en línea). Lugar: Pfizer. Disponible en: http://pfizer.com/pfizer/download/uspi_viagra.pdf. (consultado 10/08/06).
9. Cheitlin MD, Hutter AM, Brindis RG, Ganz P, Kaul S, Russell RO, et al. ACC/AHA expert consensus document: use of sildenafil (Viagra) in patients with cardiovascular disease. American College of Cardiology/American Heart Association. J Am Coll Cardiol 1999; 33: 273-82.
10. Tadalafil package insert (monografía en línea). Disponible en: http://pi.lilly.com/us/cialispi.pdf. (consultado 10/08/06).
11. Meine TJ, Roe MT, Chen AY, Patel MR, Washam JB, Ohman EM, et al. Association of intravenous morphine use and outcomes in acute coronary syndromes: results from the CRUSADE Quality Improvement Initiative. Am Heart J 2005; 149: 1043-9.
12. Yusuf S, Witles J, Fiedman L. Overview of results of randomized clinical trials in heart disease. II: unstable angina, heart failure,primary prevention with aspirin and risk factors modification. JAMA 1988; 260: 2259-63.
13. Poole-Wilson PA, Swedberg K, Cleland JG, Di Lenarda A, Hanrath P, Komajda M, et al. Comparison of carvedilol and metoprolol on clinical outcomes in patients withchronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomised controlled trial. Lancet 2003; 362: 7-13.
14. Carlberg B, Samuelsson O, Lindholm LH. Atenolol in hypertension: is it a wise choice? Lancet 2004; 364: 1684-9.
15. Dahlof B, Sever PS, Poulter NR, Wedel H, Beever DG, Caulfield M, et al. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomized controlled trial. Lancet 2005; 366: 895-906.
16. Beevers DG, Sleight P. Short acting dihydropyridine (vasodilating) calcium channel blockers for hypertension: is there a risk? BMJ 1996; 312: 1143-5.
17. Opie LH. Pharmacologic options for treatment of ischemic heart disease. In: Smith TW, ed. Cardiovascular Therapeutics: A Companion to Braunwald’s Heart Disease. Philadelphia, PA: W.B.Saunders, 1996: 22-57.
18. Pepine CJ, Faich G, Makuch R. Verapamil use in patients with cardiovascular disease: an overview of randomized trials. Clin Cardiol 1998; 21: 633- 41.
19. The Danish Study Group on Verapamil in Myocardial Infarction. Verapamil in acute myocardial infarction. Eur Heart J 1984; 5: 516-28.
20. Gibson RS, Boden WE, Theroux P, Strauss HD, Pratt CM, Gheorghiade M, et al. Diltiazem and reinfarction in patients with non-Q-wave myocardial infarction. Results of a double-blind, randomized, multicenter trial. N Engl J Med 1986; 315: 423-9.
21. Hansen JF, Hagerup L, Sigurd B, Pedersen F, Mellemgaard K, Pedersen-Bjergaard O, et al. Cardiac event rates after acute myocardial infarction in patients treated with verapamil and trandolapril versus trandolapril alone. Danish Verapamil Infarction Trial (DAVIT) Study Group. Am J Cardiol 1997; 79: 738-41.
22. Furberg CD, Psaty BM, Meyer JV. Nifedipine: dose-related increase in mortality in patients with coronary heart disease. Circulation 1995; 92: 1326-31.
23. Lubsen J, Tijssen JG. Efficacy of nifedipine and metoprolol in the early treatment of unstable angina in the coronary care unit: findings from the Holland Interuniversity Nifedipine/metoprolol Trial (HINT). Am J Cardiol 1987; 60: 18A-25A.
24. Beevers DG, Sleight P. Short acting dihydropyridine (vasodilating) calcium channel blockers for hypertension: is there a risk? BMJ 1996; 312: 1143–5.
25. Boden WE, Krone RJ, Kleiger RE, Oakes D, Greenberg H, Dwyer EJ, et al. Electrocardiographic subset analysis of diltiazem administration on long-term outcome after acute myocardial infarction. The Multicenter Diltiazem Post.Infarction Trial Research Group.Am J Cardiol 1991; 67: 335-42.
26. Tijssen JG, Lubsen J. Nifedipine and metoprolol in unstable angina: findings from the Holland Interuniversity Nifedipine/metoprolol Trial (HINT). J Cardiovasc Pharmacol 1987; 10 Suppl 2: S15–24.
27. Held PH, Yusuf S, Furberg CD. Calcium channel blockers in acute myocardial infarction and unstable angina: an overview. BMJ 1989; 299: 1187–92.
28. Yusuf S, Pepine CJ, Garces C, Pouleur H, Salem D, Kostis J, et al. Effect of enalapril on myocardial infarction and unstable angina in patients with low ejection fractions.Lancet 1992; 340: 1173-8.
29. Rutherford JD, Pfeffer MA, Moye LA, Davis BR, Flaker GC, Kowey PR, et al. Effects of captopril on ischemic events after myocardial infarction: results of the Survival and Ventricular Enlargement trial. SAVE Investigators. Circulation 1994; 90: 1731-8.
30. ACE Inhibitor Myocardial Infarction Collaborative Group. Indications for ACE inhibitors in the early treatment of acute myocardial infarction: systematic overview of individual data from 100,000 patients in randomized trials. Circulation 1998; 97: 2202-12.
31. Gustafsson I, Torp-Pedersen C, Kober L, Gustafsson F, Hildebrandt P. Effect of the angiotensin-converting enzyme inhibitor trandolapril on mortality and morbidity in diabetic patients with left ventricular dysfunction after acute myocardial infarction. Trace Study Group.J Am Coll Cardiol 1999; 34: 83-9.
32. Yusuf S, Sleight P, Pogue J, Bosch J, Davies R, Dagenais G, Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. N Engl J Med 2000; 342: 145-53.
33. Buch P, Rasmussen S, Abildstrom SZ, Kober L, Carlsen J, Torp-Pedersen C. The long-term impact of the angiotensin-converting enzyme inhibitor trandolapril on mortality and hospital admissions in patients with left ventricular dysfunction after a myocardial infarction: follow-up to 12 years. Eur Heart J 2005; 26: 145-52.
34. Dagenais GR, Pogue J, Fox K, Simoons ML, Yusuf S. Angiotensinconverting-enzyme inhibitors in stable vascular disease without leftventricular systolic dysfunction or heart failure: a combined analysis of three trials. Lancet 2006; 368: 581-8.
35. Pitt B. ACE inhibitors for patients with vascular disease without left ventricular dysfunction—may they rest in PEACE? N Engl J Med2004; 351: 2115-7.
36. Teo KK, Yusuf S, Pfeffer M, Torp-Pedersen C, Kober L, Hall H, et al. Effects of long-term treatment with angiotensin-converting-enzyme inhibitors in the presence or absence of aspirin: a systematic review. Lancet 2002; 360: 1037-43 .
37. Pitt B, Remme W, Zannad F, Neaton J, Martìnez F, Roniker B, et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 348: 1309-21.
38. Pitt B, Zannad F, Remme WJ, Cody R, Castaigne A, Pèrez A, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med 1999; 341: 709-17.
39. de Lemos JA, Blazing MA, Wiviott SD, Lewis EF, Fox KA, White HD, et al. Early intensive vs a delayed conservative simvastatin strategy in patients with acute coronary syndromes: phase Z of the A to Z trial. JAMA 2004; 292: 1307-16.
40. Cannon CP, Braunwald E, McCabe CH, Rader DJ, Rouleau JL, Belder R, et al. Intensive versus moderate lipid lowering with statins after acute coronary syndromes.N Engl J Med 2004; 350: 1495-504.
41. Nissen SE, Nicholls SJ, Sipahi I, Libby P, Raichlen JS, Ballantyne CM, et al. Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial. JAMA 2006; 295: 1556-65.
42. Stenestrand U, Wallentin L; Swedish Register of Cardiac Intensive Care (RISKS-HIA). Early statin treatment following acute myocardial infarction and 1-year survival. JAMA 2001; 285: 430-6.
43. Briel M, Schwartz GG, Thompson PL, de Lemos JA, Blazing MA, Van ES GA, et al. Effects of early treatment with statins on short-term clinical outcomes in acute coronary syndromes: a meta-analysis of randomized controlled trials. JAMA 2006; 295: 2046-56.
44. Muhlestein JB, Horne BD, Bair TL, Li Q, Madsen TE, Pearson RR, et al. Usefulness of in-hospital prescription of statin agents after angiographic diagnosis of coronary artery disease in improving continued compliance and reduced mortality. Am J Cardiol 2001; 87: 257-61.
45. Fonarow GC, Gawlinski A, Moughrabi S, Tillisch JH. Improved treatment of coronary heart disease by implementation of a Cardiac Hospitalization Atherosclerosis Management Program (CHAMP). Am J Cardiol 2001; 87: 819-22.
46. Fonarow GC, Ballantyne CM. In-hospital initiation of lipidlowering therapy for patients with coronary heart disease: the time is now. Circulation 2001; 103: 2768-70.
47. Antman EM, Bennett JS, Daugherty A, Furberg C, Roberts H, Taubert KA. Use of nonsteroidal antiinflammatory drugs. An update for clinicians. A scientific statement from the American Heart Association. Circulation 2007; 115: 1634-42.
48. Stone GW, Ohman EM, Miller MF, Joseph DL, Christenson JT, Cohen M, et al. Contemporary utilization and outcomes of intra-aortic balloon counterpulsation in acute myocardial infarction: the benchmark registry. J Am Coll Cardiol 2003; 41: 1940-5.
4. Exámenes paraclínicos
4.1 PERFIL LIPíDICO
- Puede realizarse determinación de colesterol sérico dentro de las primeras 24 horas de inicio del cuadro (IIb, C).
El conocer los valores de colesterol tiene implicancias terapéuticas y pronósticas, ya que se trata de un factor de riesgo cardiovascular y de los valores hallados dependerá la estrategia terapéutica en el manejo de los lípidos.
Los valores del perfil lipídico disminuyen luego de las primeras 24 horas de iniciado el evento coronario agudo.
No cambia conductas pero permite conocer la presencia de dislipemia sin tratamiento.
Por otra parte, conocer los valores del perfil lipídico tiene un impacto psicológico en el inicio y la adherencia al tratamiento.
4.2 HEMOGRAMA Y GLICEMIA
- Se recomienda solicitar hemograma y glicemia a todos los pacientes al ingreso (I, B).
La hiperleucocitosis se asocia con incremento en la mortalidad a corto plazo (< 30 días del SCA), incremento en la mortalidad a largo plazo (> 30 días del evento), mayor falla cardíaca intrahospitalaria, mayor tamaño del infarto, menor FEVI al alta y mayor prevalencia de enfermedad multivaso.
La presencia de anemia se asocia con mayor mortalidad a 30 días, mayor mortalidad a largo plazo y falla cardíaca (OR 1,20 por g de Hb).
Según distintos datos, como los de un gran metaanálisis de registros y estudios clínicos que incluye a más de 30.000 pacientes, las hemorragias mayores se asocian a un aumento de cuatro veces el riesgo de muerte, cinco veces el riesgo de IAM recurrente y tres veces el riesgo de accidente cerebrovascular a los 30 días (1-4).
La presencia de hematocrito menor a 30% es indicación de transfusión.
La hemoglobina mayor a 17 g/dl es un elemento de mal pronóstico.
Tanto la hiperplaquetosis como la plaquetopenia se asocian a mal pronóstico.
La hiperplaquetosis determina mayor formación de trombos, es fuente de mediadores inflamatorios, así como marcador de inflamación sistémica.
La plaquetopenia se vincula a complicaciones:
- Trombocitopenia inducida por fármacos.
- Heparina.
- Inhibidores de la glicoproteína IIb-IIIa.
- Sepsis, coagulación intravascular diseminada, destrucción mecánica por BIAC, bypass cardiopulmonar.
La hiperglicemia al ingreso es un marcador de riesgo independiente (5). Se asocia a mayor mortalidad a corto plazo, siendo esta correlación más importante en pacientes no diabéticos.
Se atribuye su efecto deletéreo a varios factores:
- Estrés oxidativo.
- Disfunción endotelial.
- Efecto pro coagulante.
- Glicosilación no enzimática de proteínas plaquetarias.
- Amplificación de la inflamación.
- Supresión de la inmunidad.
- Toxicidad directa sobre miocitos.
- Efecto pro apoptótico.
- Bloquea el preacondicionamiento.
- Reduce la circulación colateral hacia la zona isquémica.
- Se recomienda realizar una valoración paraclínica de la función renal a todos los pacientes al ingreso (I, B).
Esto incluye la evaluación de azoemia, creatininemia y, de ser posible, evaluación del filtrado glomerular.
También se aconseja la realización de un ionograma.
Es aconsejable realizar cálculo del filtrado glomerular, ya sea por tabla de Levey o fórmula, por ser una mejor estimación del grado de disminución del mismo.
El deterioro de la función renal determina mayor mortalidad a largo plazo, mayor riesgo de sangrado, necesidad de ajuste de fármacos, mayor riesgo de nefropatía por contraste, necesidad de medidas de nefroprotección más agresivas.
4.4 RADIOGRAFíA DE TóRAX
- Se recomienda realizar a todos los pacientes en las primeras 24 horas del ingreso (I, C).
La radiografía de tórax complementa la anamnesis y el examen físico.
Nos permite valorar si existen elementos de insuficiencia cardíaca, cardiomegalia, plantear diagnósticos diferenciales, como, por ejemplo, una disección aórtica, evaluar el terreno y patologías asociadas.
4.5 ECOCARDIOGRAFíA
- Se recomienda realizar ecocardiograma en emergencia sólo ante la necesidad de descartar diagnósticos diferenciales, ante sospecha de complicaciones mecánicas o inestabilidad hemodinámica.
Se recomienda realizar a todos los demás ecocardiograma o alguna forma de valoración de la función ventricular durante la internación, idealmente dentro de las primeras 48 horas (I, C).
El ecocardiograma apoya el diagnóstico de isquemia como causa del dolor torácico (alteración de la contractilidad sectorial), aleja diagnósticos diferenciales (tromboembolismo pulmonar, pericarditis y disección de aorta).
Además valora elementos de gravedad como:
- Extensión de la isquemia.
- Complicaciones mecánicas y hemodinámicas.
- Valoración de cavidades.
- Función sistólica.
- Valoración de válvulas.
- Otras enfermedades miocárdicas asociadas.
4.6 MARCADORES BIOLÓGICOS (9-11)
- Puede dosificarse el péptido natriurético B (BNP) para estimar el riesgo (IIb, B).
Es un predictor de eventos adversos en SCA.
Su aumento es directamente proporcional a la magnitud de la isquemia.
Aún no hay datos precisos para su uso en el SCA.
Otros marcadores:
- PCR de alta sensibilidad (PCRhs).
- Mieloperoxidasa.
- CD 40.
- Multimarcador (troponinas + PCRhs + BNP).
Estos marcadores han sido motivo de amplia investigación en los últimos años. Sin embargo, al momento actual, no se les ha adjudicado un rol preciso en los pacientes portadores de SCASEST.
BIBLIOGRAFÍA
1. Rao SV, Eikelboom JW, Granger CB, Harrington RA, Califf RM, Bassand JP. Bleeding and blood transfusion issues in patients with non-ST-segment elevation acute coronary syndromes. Eur Heart J 2007; 28: 1193-204.
2. Eikelboom JW, Mehta SR, Anand SS, Xie C, Fox KA, Yusuf S. Adverse impact of bleeding on prognosis in patients with acute coronary syndromes. Circulation 2006; 114: 774-82.
3. Moscucci M, Fox KA, Cannon CP, Klein W, Lopez-Sendon J, Montalescot G, et al. Predictors of major bleeding in acute coronary syndromes: the Global Registry of Acute Coronary Events (GRACE). Eur Heart J 2003; 24: 1815-23.
4. Rao SV, O’Grady K, Pieper KS, Granger CB, Newby LK, Van de Werf F, et al. Impact of bleeding severity on clinical outcomes among patients with acute coronary syndromes. Am J Cardiol 2005; 96: 1200-6.
5. Malmberg K, Ryden L, Wedel H, Birkeland K, Bootsma A, Dickstein K, et al. Intense metabolic control by means of insulin in patients with diabetes mellitus and acute myocardial infarction (DIGAMI 2): effects on mortality and morbidity. Eur Heart J 2005; 26: 650-61.
6. Hasdai D, Behar S, Wallentin L, Danchin N, Gitt AK, Boersma E, et al. A prospective survey of the characteristics, treatments and outcomes of patients with acute coronary syndromes in Europe and the Mediterranean basin; the Euro Heart Survey of Acute Coronary Syndromes (Euro Heart Survey ACS). Eur Heart J 2002; 23: 1190-201.
7. Anavekar NS, McMurray JJ, Velazquez EJ, Solomon SD, Kober L, Rouleau JL, et al. Relation between renal dysfunction and cardiovascular outcomes after myocardial infarction. N Engl J Med 2004; 351: 1285-95.
8. Gruberg L, Beyar R, Bassand JP, Seabra-Gomes R, Fioretti P, Gottwik MG, et al. Renal insufficiency in patients undergoing percutaneous coronary intervention: results of the SHAKESPEARE Registry [Abstract]. J Am Coll Cardiol 2005; 45(Suppl 3 A).
9. Weber M, Bazzino O, Navarro Estrada JL, Fuselli JJ, Botto F, Perez de Arenaza D, et al. N-Terminal B-Type Natriuretic Peptide Assessment Provides Incremental Prognostic Information in Patients With Acute Coronary Syndromes and Normal Troponin T Values Upon Admission J am Coll Cardiol, 2008; 51: 1188-1195.
10. Galvani M, Ottani F, Oltrona I, Ardissino D, Gensini GF, Maggioni AP, et al. N-terminal probrain natriuretic peptide on admission has prognostic value across the whole spectrum of acute coronary syndromes. Circulation 2004; 110: 128-334.
11. James SK, Lindahl B, Siegbahn A, Stridsberg M, Venge P, Armstrong P, et al. N- terminal pro-brain natriuretic peptide and other risk markers for the separate prediction of mortality and subsequent myocardial infarction in patients with unstable coronary artery disease; a Global Utilization of Strategies To Open occluded arteries (GUSTO)- IV substudy. Circulation 2003; 108: 275-81.
5. Tratamiento antitrombótico
5.1 AGENTES ANTIPLAQUETARIOS
5.1.1. ÁCIDO ACETILSALICíLICO
- Se recomienda administrar ácido acetilsalicílico (AAS) a todos los pacientes tan pronto se realiza el diagnóstico de SCASEST y que no tengan contraindicación para recibirlo (I, A).
- Se recomienda una dosis inicial de AAS de 162 a 325 mg sin cubierta entérica para una absorción más rápida (I, A).
La dosis de mantenimiento depende del tratamiento realizado:
– Cuando se realiza tratamiento médico se indica AAS 75 a 100 mg/día en forma indefinida (I, A).
– Si se coloca stent metálico, administrar AAS 162 a 325 mg/día por un mes y luego 75 a 162 mg/día en forma indefinida (I, A).
– Si se coloca stent liberador de fármacos, AAS 162 a 325 mg/día por 3 a 6 meses y luego 75 a 162 mg/día de forma indefinida (I, A).
– Si existe alergia al AAS se recomienda clopidogrel 300 mg v/o carga seguido de 75 mg v/o día de por vida (I, A).
La aspirina inhibe irreversiblemente la COX-1 en las plaquetas y, de esta forma, limita la formación de tromboxano A2, con lo que se inhibe la agregación plaquetaria.
Reduce el riesgo de muerte de causa cardíaca y la incidencia de IAM entre 51% y 72%, lo que surge de una revisión sistemática de ensayos clínicos randomizados.
Existe sólida y numerosa evidencia que demuestra el efecto beneficioso del tratamiento con AAS en los distintos escenarios de los SCA (1-2). En cuanto a la dosis recomendada, los estudios han utilizado dosis desde 75 a 1.300 mg/día (3-4), demostrándose que si bien el beneficio persiste, con dosis mayores a 325 mg aumenta la probabilidad de efectos adversos, sobre todo gastrointestinales.
Por definición del tercer plenario este Consenso acepta las dosis de AAS marcadas en los trials pero se aconsejan las dosis adaptadas al vademécum nacional como figura en la tabla 1.

5.1.2 TIENOPIRIDINAS
- Se recomienda administrar clopidogrel en forma inmediata a todos los pacientes sin contraindicaciones, en dosis carga de 300 mg, seguida por 75 mg en forma diaria (I, A).
- Se recomienda mantener el clopidogrel a largo plazo en dosis de 75 mg diarios:
a) en pacientes sin stent durante un mes (I, A) e idealmente durante 12 meses (I, B);
b) en pacientes con STENT metálico durante un mes e idealmente durante 12 meses (I, B). En caso de riesgo de sangrado administrarlo un mínimo de dos semanas;
c) en pacientes con stent con fármacos, administrarlo al menos durante 12 meses (I, B). - En pacientes candidatos para estrategia invasiva/angioplastia transluminal coronaria (ATC), se recomienda usar una dosis carga de clopidogrel de 600 mg para alcanzar una inhibición más rápida de la función plaquetaria (I, B).
- En pacientes pretratados con clopidogrel que deban someterse a cirugía de derivación aortocoronaria, es razonable posponer la misma cinco días desde la interrupción del tratamiento con clopidogrel, cuando esto sea posible de acuerdo al cuadro clínico del paciente (IIA, C).
Las tienopiridinas son inhibidores del receptor plaquetario P2Y12, involucrado en la agregación plaquetaria mediada por la vía de activación del ADP.
Un solo estudio randomizado, controlado, doble ciego (Antiplatelet treatment with ticlopidine in unstable angina), mostró reducción en la incidencia combinada de infarto y/o muerte: 46% a los seis meses (5).
El estudio CLASSICS, que comparó ticlopidina con clopidogrel, mostró mejor tolerancia del clopidogrel con menor incidencia de reacciones adversas y mayor efectividad en la prevención de eventos isquémicos mayores (6).
Un metaanálisis de estudios randomizados y registros publicado en 2002, que comparó ticlopidina con clopidogrel luego de la colocación de stent, demostró el beneficio del clopidogrel sobre la ticlopidina en la prevención de eventos isquémicos mayores (7).
El estudio CURE evaluó el uso de clopidogrel en dosis carga de 300 mg y luego 75 mg durante la internación y los primeros meses de evolución, en conjunto con aspirina y heparina. Mostró reducción en la incidencia de IAM y recurrencia isquémica en forma precoz durante la etapa hospitalaria, tanto frente al tratamiento médico como invasivo. No tuvo impacto sobre la mortalidad (8).
El tratamiento de 1.000 pacientes durante una media de nueve meses previno aproximadamente 28 eventos mayores en 23 pacientes, con el costo de tres hemorragias con peligro para la vida y tres transfusiones.
El estudio CURE mostró también un aumento del doble en la probabilidad de sangrado en los pacientes que se sometían a cirugía cardíaca y que estaban en tratamiento con clopidogrel. De este estudio surge la indicación de suspender el clopidogrel cinco días antes de la cirugía cardíaca siempre que el cuadro clínico lo permita. Asimismo, si se sospechan o se conocen de antemano lesiones quirúrgicas se recomienda no administrar clopidogrel.
El PCI-CURE mostró una reducción del evento combinado: muerte, infarto o revascularización de urgencia en pacientes pretratados con clopidogrel a 30 días y a largo plazo sometidos a intervención percutánea (9).
El estudio CREDO aboga a favor de la utilización de tratamiento prolongado (un año) con clopidogrel en el contexto de las intervenciones percutáneas (10).
El estudio ARMYDA-2 (11) comparó en forma randomizada el uso de 600 mg de clopidogrel versus 300 mg en angioplastia electiva. El efecto antiplaquetario se logra a las 2 horas con la dosis de 600 mg, más rápido que con la de 300 mg. Mostró una incidencia de muerte, IAM y revascularización de urgencia a 30 días de 4% con la dosis de 600 mg versus 12% para la dosis de 300 mg (p=0,04) (11).
Ningún gran estudio clínico ha probado el uso de dosis carga de clopidogrel de 600 mg antres de la realización de ATC en el contexto de SCASEST. Debemos esperar los resultados de los ensayos clínicos en marcha para valorar la evidencia de riesgo-beneficio con el uso de estas dosis de clopidogrel. Las recomendaciones actuales se basan en la experiencia de su uso en otros contextos clínicos.
5.1.3 INHIBIDORES DE LA GLICOPROTEíNA IIB/IIIA
- Es razonable el uso de inhibidores de la glicoproteína IIB/IIIA (GP IIB/IIIA):
a) Previo a cineangiocoronariografía (CACG) en pacientes con SCASEST de alto riesgo (angina recurrente, inestabilidad hemodinámica, troponinas positivas o cambios ECG dinámicos) y que serán sometidos a estrategia invasiva temprana:
– GP IIB-IIIA (eptifibatide o tirofiban) asociados a AAS y heparina (I,A);
– GP IIB-IIIA (eptifibatide o tirofiban) asociados a AAS, heparina y clopidogrel (IIa,B). - B) En contexto de ATC en SCASEST:
– GP IIB-IIIA (abciximab o eptifibatide) si no fueron iniciados previo a CACG, asociados a AAS, heparina y clopidogrel (IIa,A). - Para todos los pacientes con SCASEST (incluidos los de bajo riesgo) se recomienda anticoagulación asociada a antiagregación plaquetaria (I, A).
- Se recomienda monitorizar la heparina no fraccionada (HNF) manteniendo el KPTT entre 1,5 y 2,5 veces del valor inicial o entre 50 y 70 seg (I, B).
- Se recomienda continuar con HBPM sobre HNF cuando se ha comenzado con HBPM previo a un procedimiento invasivo.
Si la última dosis de HBPM fue 8 horas antes del procedimiento no es necesario realizar otra dosis; si la última dosis fue entre 8 y 12 horas antes del procedimiento se recomienda agregar enoxaheparina 0,3 mg/kg en bolo en el momento del procedimiento (I, B). - Para los pacientes con una estrategia conservadora precoz o invasiva tardía se recomienda fondaparinux sobre enoxaheparina (I, A).
- Para pacientes tratados con fondaparinux que van a ir a CACG se recomienda agregar un bolo de HNF (50-70 U/kg) antes del procedimiento (I, B).
- En los pacientes que van a estrategia invasiva temprana se recomienda:
– En una estrategia invasiva urgente debe iniciarse inmediatamente el tratamiento con HNF (I, C), o enoxaparina (IIa, B) o bivalirudina (I, B).
– Cuando se utilicen inhibidores de la glicoproteína IIb/IIa, se recomienda como primera elección HNF sobre HBPM o fondaparinux (I, B).
Es preferible el tirofiban y el eptifibatide al abciximab como tratamiento inicial, excepto cuando se conoce la anatomía coronaria y se planea ATC en las próximas 24 horas.
En este contexto es preferible el abciximab y eptfibatide al tirofiban. Los estudios clínicos realizados previos al anterior consenso, sustentan su indicación.
Abciximab: EPIC, EPILOG, EPISTENT, CAPTURE, GUSTO IV, ACS.
Eptifibatide: IMPACT II, ESPIRIT, PURSUIT.
Tirofiban: RESTORE, PRISM, PRISM-PLUS.
A la luz de los resultados del estudio GUSTO IV surge la recomendación de desaconsejar la utilización de abciximab como tratamiento cuando no se conoce la anatomía coronaria (25).
El estudio TARGET mostró mayor eficacia a seis meses del abciximab comparado con el tirofiban en el contexto de ATC. Sin embargo, al año esta diferencia con respecto al end point primario no fue significativa. Este último resultado justificaría su uso en el contexto de ATC dado que es el fármaco con mayor disponibilidad en nuestro medio (27,28).
Nueva evidencia
La mayoría de los estudios con inhibidores de GP IIB-IIIA se realizaron en la era preclopidogrel.
El estudio ISAR-REACT (29) incluyó 2.159 pacientes a los que se les realizó ATC en forma electiva (pacientes de riesgo intermedio y bajo). Se randomizaron doble ciego a abciximab y placebo. Todos los pacientes fueron tratados con clopidogrel 600 mg al menos dos horas antes del procedimiento. El end point primario fue muerte, IAM y revascularización urgente a los 30 días. Este estudio no mostró beneficio clínico de la combinación de dosis carga de 600 mg de clopidogrel con abciximab en pacientes con SCASEST de riesgo intermedio y bajo.
El estudio ISAR-REACT 2 (30,31) fue diseñado para evaluar el beneficio de la administración de abciximab más clopidogrel en pacientes con SCASEST de alto riesgo que iban a ser sometidos a ATC. Los pacientes se randomizaron a recibir abciximab más heparina no fraccionada o placebo. Todos los pacientes recibieron dosis carga de 600 mg de clopidogrel y 500 mg de AAS. El end point primario fue muerte, IAM y revascularización urgente a los 30 días. Este estudio demostró que en pacientes con SCASEST de alto riesgo que serán sometidos a ATC, el abciximab reduce el riesgo de efectos adversos luego de recibir una dosis carga de clopidogrel de 600 mg. Este beneficio parecería estar confinado a los pacientes con troponinas elevadas.
Estos estudios sugieren que podría haber beneficio con la asociación de clopidogrel e inhibidores GP IIB-IIIA en pacientes con SCASEST de mayor riesgo.
Se obtendrán más datos con el estudio EARLY ACS (32) que se está desarrollando.
5.2 HEPARINAS
La indicación del tipo de anticoagulación dependerá de la estrategia de tratamiento inicial.
No se recomienda en términos generales monitorizar la heparina de bajo peso molecular (HBPM), midiendo niveles séricos de factor anti Xa.
En pacientes con contraindicación relativa (insuficiencia renal, obesos, embarazadas, ancianos), disminuir la dosis 30%-50%. En insuficiencia renal avanzada no administrar HBPM. Considerar monitorizar factor anti Xa en situaciones muy especiales.
Hay diversos estudios que en forma global muestran el beneficio de la heparina no fraccionada asociada a AAS en cuanto a la reducción de eventos (35-38). La dosis recomendada de heparina no fraccionada es un bolo de 60-70 U/kg (máximo 5.000 U) y una infusión inicial de 12-15 U/kg/h (máximo 1.000 U/h). El KPTT recomendado es entre 1,5 a 2,5 veces el valor inicial o de 50 a 70 seg. En cuanto al nivel terapéutico de anticoagulación, el estudio TIMI IIIB mostró que el rango de seguridad era KPTT entre 45 y 60 seg. Además, mostró que niveles superiores a 80 seg no eran beneficiosos. El estudio GUSTO II-b (39) mostró que con dosis de heparina no fraccionada de 60 U/kg en bolo seguidas de 12 U/kg/h se obtenía en mayor proporción el KPTT objetivo entre 50 y 70 seg. El control del KPTT debe ser seriado (idealmente cada seis horas) hasta lograr una estabilización del mismo en dos medidas consecutivas. Posteriormente se puede realizar un control diario. La evidencia que sustenta esta recomendación surge de los estudios mencionados.
Un cambio en la situación clínica del paciente (por ejemplo: angina recurrente, hemorragia, hipotensión no explicable) hace necesario un control del KPTT y el ajuste de la infusión si se justifica. Se recomienda un plan de administración de heparina no fraccionada según se indica en la tabla 2.

- Debido a los distintos tipos de fraccionamiento y producción industrial, las HBPM tienen variaciones en sus propiedades físicas y químicas, actividad biológica y diferencias farmacológicas (actividades antifactor Xa y anti factor IIa, relación anti Xa/anti IIa, potencia antitrombótica y capacidad para liberar el TFPI endotelial) que pueden afectar la equivalencia del producto en término de dosis.
- La WHO y la FDA en 1993 y la ACCP en 1998, enunciaron que las HBPM son fármacos con individualidad propia que no deben usarse indistintamente, por lo que las evidencias de eficacia clínica demostrada para uno no deben ser extrapolados a otros. Tal como se enunció previamente, no hay estudios relevantes sobre diferencias entre las diversas HBPM, siendo la más estudiada la enoxaparina.
- Sangrado activo o riesgo de hemorragia mayor.
- Recuento plaquetario <100.000 elementos/ml.
- Antecedentes de hipersensibilidad a la heparina.
- Insuficiencia renal severa con un clearance de creatinina <30 ml/min.
- En caso de necesidad de neutralización de HNF se utilizará sulfato de protamina 50 mg cada 100 U de heparina. Debe considerarse sólo la dosis de heparina que ha sido infundida en las últimas horas, puesto que la vida media es de aproximadamente una hora cuando se utiliza endovenosa. La administración debe ser lenta (uno a tres minutos) para evitar la hipotensión o bradicardia e hipertensión pulmonar.
- En caso de necesidad de neutralización de la HBPM deben seguirse las recomendaciones suministradas por el laboratorio fabricante. En el caso de enoxaparina, por cada 1 mg del fármaco, administrar 1 mg de protamina en las primeras ocho horas siguientes a la administración de éste, sabiendo que la acción antifactor Xa no se puede inactivar totalmente (recomendación no testada clínicamente).
- La trombocitopenia inducida por heparina es mediada por anticuerpos. Aparece típicamente entre los 5 y 14 días de iniciado el tratamiento. Puede provocar trombosis arterial o venosa. Se diagnostica en base a la disminución en más de 50% del recuento plaquetario o presencia de lesiones en sitios de punción, más la formación de anticuerpos. La sospecha de este síndrome requiere la suspensión de la administración de heparina y consulta urgente con especialista para su estudio y tratamiento, y el uso de terapia antitrombótica alternativa (inhibidores directos de la trombina: bivalirudina, etcétera, monitoreado por KPTT).
- Los predictores independientes de sangrado mayor según el registro GRACE (45) son: edad avanzada, sexo femenino, historia previa de sangrados, insuficiencia renal, uso de inhibidores IIb/IIIa.
- Fondaparinux no es inferior a enoxaparina en su end point primario de muerte, IAM o isquemia refractaria.
- Se observó menor incidencia de sangrado mayor en el grupo tratado con fondaparinux comparado con enoxaparina.
- La reducción del sangrado que acompaña al uso de fondaparinux se asocia a menor mortalidad y morbilidad a largo plazo.
- Hubo un aumento estadísticamente significativo del riesgo de formación de trombos en el catéter durante el procedimiento con fondaparinux.
- Los inhibidores directos de la trombina (IDT) se unen directamente al factor IIa (trombina) e inhiben la conversión de fibrinógeno en fibrina.
- El principio activo es la hirudina (extracto de la hoja de Hirudo medicinalis).
- Los IDT disponibles son: hirudina, argatroban y bivalirudina.
- No se unen a proteínas plasmáticas, por lo que su efecto anticoagulante es más predecible.
- Prolongan el kPTT y el TCA.
- Eliminación renal.
- En todo paciente en que se considera un SCASEST se recomienda utilizar algún tipo de estratificación de riesgo en la evolución (I, B).
- Pacientes con alto riesgo inicial (ver sección 2.3).
- Pacientes con score de riesgo GRACE (u otro como score TIMI) elevado.
- Mayores de 75 años.
- Diabéticos.
- Insuficiencia renal con clearance menor de 60 ml/min/1,73 m2.
- Pacientes que presenten uno de estos elementos en su evolución hospitalaria:
- dolor reiterado luego de un período de acalmia;
- angina refractaria al tratamiento convencional;
- angina postinfarto;
- angina clase III o IV;
- angina con hipotensión arterial (PAS < 30 mm Hg a la habitual);
- insuficiencia cardíaca;
- arritmias ventriculares graves (taquicardia ventricular y fibrilación ventricular);
- cambios dinámicos de ST (³ 0,5 mm), o de la onda T especialmente en cara anterior;
- cualquier aumento de troponinas o CK MB.
- Se recomienda que el paciente portador de un SCASEST tenga estimada la función ventricular (I, C).
- Se recomienda realizar pruebas funcionales de isquemia en:
– Pacientes de bajo riesgo inicial que han estado libres de isquemia o falla cardíaca en las últimas 12-24 horas (I, C).
– Pacientes de riesgo intermedio en que se haya optado por una estrategia invasiva selectiva, que hayan estado libres de isquemia o falla cardíaca en las últimas 12-24 horas (I, C). - En los pacientes de bajo riesgo o de riesgo intermedio en los que se optó por una estrategia invasiva selectiva se recomienda una prueba ergométrica graduada, siempre y cuando estén en condiciones de ejercitar y su ECG basal sea apropiado (ausencia de anomalías de ST, bloqueo de rama, hipertrofia ventricular izquierda, defecto de conducción intraventricular, ritmo de marcapasos, preexcitación o efecto de digoxina) (I, C).
- Se recomienda derivar a los pacientes de riesgo bajo a tratamiento médico sin indicarse cateterismo cardíaco (I, B).
- Se recomienda evaluar a los pacientes de riesgo alto mediante angiografía coronaria antes del alta (I, B).
- En los pacientes de riesgo intermedio es razonable realizar un estudio adicional de isquemia objetivada por imágenes o alternativamente evaluarlos mediante angiografía coronaria (IIa, C).
- El estudio funcional de isquemia objetivada por imágenes, inducida por esfuerzo:
Se recomienda en pacientes en condiciones de ejercitar con un ECG basal que impide una correcta interpretación del ECG de esfuerzo (infradesnivel de ST mayor de 1 mm, hipertrofia ventricular izquierda, bloqueo de rama, defecto de conducción intraventricular, preexcitación o digoxina) (I, B) (1).
Es razonable realizarlo en pacientes con prueba ergométrica graduada convencional inconcluyente o de riesgo intermedio (IIa, C). - El estudio funcional de isquemia objetivada por imágenes, inducida por estrés farmacológico (dipiridamol o dobutamina):
Se recomienda en pacientes incapacitados para realizar ejercicio por limitaciones físicas (artritis, amputación, enfermedad vascular periférica severa, enfermedad pulmonar severa, debilidad general) (I, B) (1).
La HBPM tiene ventajas sobre la HNF: su administración es subcutánea, no requiere de controles de laboratorio, relación dosis-efecto antitrombótico más predecible y tiene menor incidencia de trombocitopenia. De las HBPM, la enoxaheparina es la que ha sido más ampliamente estudiada, por lo cual el Consenso recomienda preferentemente la enoxaparina. Es de destacar, sin embargo, que no hay información de peso publicada de estudios comparativos entre las diferentes HBPM. En ensayos donde la estrategia invasiva no fue estimulada y la tasa de revascularización fue baja, la enoxaparina mostró reducción significativa de la combinación de muerte, infarto y recurrencia del angor con o sin necesidad de revascularización de urgencia en relación con HNF, con un modesto aumento del riesgo de complicaciones hemorrágicas menores. [ESSENCE (40) y TIMI 11B (41)]. El estudio SYNERGY (42) incluyó 10.027 pacientes de alto riesgo, sometidos a evaluación invasiva y revascularización precoces. No hubo diferencias de muerte o infarto de miocardio a los 30 días entre la enoxaparina y la HNF. La enoxaparina determinó un aumento de sangrados, con diferencia estadística para sangrados mayores según la clasificación TIMI, pero sin significación estadística para sangrados severos según la clasificación GUSTO y necesidad de transfusiones. Estos resultados pueden deberse al cruce de las heparinas, dado que por el diseño del estudio, 2/3 de los pacientes ya habían recibido algún tipo de heparina previo a la randomización y luego de la misma tuvieron que continuar con la misma o cruzar. En forma general, la continuación fue beneficiosa pero el cruce a otra heparina se asoció con un riesgo mayor de sangrado y menores beneficios. Petersen (43) realizó un metaanálisis de seis ensayos clínicos randomizados comparando eficacia y riesgo de sangrados de enoxaheparina versus HNF (EESENCE, TIMI-11B, ACUTE-II, INTERACT, A to Z y SYNERGY). Este metaanálisis mostró una reducción significativa en el punto combinado de muerte o infarto de miocardio a favor de la enoxaparina, sin diferencias significativas, en mortalidad a 30 días, ni en la necesidad de transfusión o sangrados mayores a los siete días de la randomización.
La dosis recomendada de enoxaparina es 1 mg/kg subcutáneo cada 12 horas, pudiendo ser precedido de una dosis carga de 30 mg en bolo endovenoso. Otra HBPM que puede ser utilizada es la dalteparina, en dosis de 120 UI/kg (máximo 10.000 UI) cada 12 horas. La tercera HBPM disponible es la nadroparina, en dosis de 0,1 ml/10 kg (86 UI/kg) cada 12 horas.
Diferencias entre las HBPM
La duración del tratamiento con heparina (tanto no fraccionada como de bajo peso molecular) no está claramente definido. Debido a que la prolongación del tratamiento no aumenta la protección contra la recurrencia de eventos isquémicos, pero sí aumenta el riesgo de sangrados, si el paciente recibió tratamiento conservador se recomienda discontinuar el tratamiento anticoagulante al alta hospitalaria (recomendación I, B) (dos a siete días en tanto el paciente esté estable). Si el paciente será sometido a un procedimiento de revascularización precoz es razonable mantener la heparina hasta 24 horas de realizado dicho procedimiento (recomendación Iia, C). Continuar el tratamiento luego de la etapa hospitalaria no ha mostrado beneficios en el estudio TIMI 11B (41).
Se han realizado estudios referidos a HBPM administrada en forma prolongada en SCASEST. No hay evidencia actual que justifique su uso sistemático. El estudio FRISC II (44) analizó los efectos de la dalteparina durante tres meses luego de la fase aguda. Se observó una reducción de muerte, infarto de miocardio o necesidad de revascularización a tres meses en el grupo de dalteparina. Este beneficio se limitó a los pacientes que tuvieron un manejo no intervencionista y que tuvieron troponina T elevada.
A la luz de estos resultados la administración prolongada de HBPM podría estar justificada en pacientes de alto riesgo que por algún motivo son tratados en forma no invasiva o en los que se difiere una intervención (recomendación IIb, B).
Las contraindicaciones para la administración de heparina son:
Se recomienda control diario (por lo menos los cinco primeros días) del hematocrito y/o hemoglobina y recuento plaquetario dada la posibilidad de trombocitopenia inducida por la heparina. En cuanto a las complicaciones por administración de heparina se realizan las siguientes recomendaciones:
5.3 INHIBIDORES DIRECTOS DEL FACTOR XA
El fondaparinux es un inhibidor selectivo del factor Xa, un pentasacárido sintético obtenido de la secuencia de HNF que se une a la trombina.
Tiene 100% de biodisponibilidad por vía subcutánea con una vida media de 17 horas, siendo su eliminación renal.
Por este motivo está contraindicada en pacientes con clearance de creatinina menor a 30 ml/min.
No requiere monitorización y no induce trombocitopenia.
La dosis en SCA es de 2,5 mg s/c día.
El OASIS 5 (The Fifth Organization to Assess Strategies in Acute Ischemic Syndromes Investigators) (46,47), es un estudio multicéntrico, multinacional, doble ciego, doble simulación, que incluyó 20.078 pacientes. Fueron randomizados a recibir enoxaparina y fondaparinux con el objetivo de valorar eficacia y seguridad en pacientes con SCASEST.
Concluye:
5.4 INHIBIDORES DIRECTOS DE LA TROMBINA
El uso de hirudina como fármaco de primera línea se ha asociado a un aumento de los sangrados. (Direct trombine inhibitor trialists Collaborative Group; OASIS 2) (52). Por tanto, no ha sido aprobado su uso en SCASEST.
La bivalirudina es un anticoagulante sintético con los mismos principios que la hirudina.
El ACUITY (53) fue un estudio randomizado doble ciego que incluyó 13.819 pacientes con SCASEST de moderado y alto riesgo que se sometían a estrategia invasiva. Randomizó en tres ramas: enoxaparina o HNF más inhibidor de la GP IIb-IIIa; bivalirudina más inhibidor GP IIb-IIIa o bivalirudina sola. La bivalirudina sola resultó en una significativa reducción de los sangrados por cualquier causa. En cuanto al end point isquémico (muerte, IAM, revascularización) no presentó diferencias con las otras dos ramas.
El estudio ACUITY concluye que la bivalirudina sola usada en SCASEST en los que se realizó una estrategia invasiva temprana, resultó en una significativa reducción de los sangrados por cualquier causa, sin diferencias en el end point isquémico.
5.5 ANTICOAGULANTES ORALES
El uso de anticoagulantes orales en la etapa hospitalaria y a largo plazo no se justifica, excepto cuando hay indicación de los mismos por otros motivos (por ejemplo: fibrilación auricular crónica, prótesis valvulares mecánicas).
Cuando el paciente ya está en tratamiento con warfarina, se recomienda suspender el mismo y pasar a antiagregación plaquetaria más heparina (si el INR es menor de 2,5) como el resto de pacientes con SCASEST.
Se han realizado varios estudios comparativos entre AAS solo o combinado con anticoagulantes orales. Analizados globalmente estos estudios no han demostrado reducción significativa en la incidencia de mortalidad, infarto o accidente vascular encefálico, con un incremento del riesgo de sangrado que es mayor cuanto más enérgica es la anticoagulación (54-57).
BIBLIOGRAFÍA
1. Lewis HD Jr, Davis JW, Archibald DG, Stenke WE, -Smitherman TC, Doherty, et al. Protective effects of aspirin against acute myocardial infarction and death in men with unstable angina. Results of a Veterans Administration Cooperative Study. N Engl J Med 1983; 309: 396-403.
2. Theroux P, Ouimet H, McCans J, Latour JG, Joly P, Levy G, et al. Aspirin, heparin, or both to treat acute unstable angina. N Engl J Med 1988; 319: 1105-1111.
3. Cairns JA, Gent M, Singer J, Finnie KJ, Froggatt GM, Holder DA, et al. Aspirin, sulfinpyrazone, or both in unstable angina. Results of a Canadian multicenter trial. N Engl J Med 1985; 313: 1369-1375.
4. The RISK Group. Risk of myocardial infarction and death during treatment with low dose aspirin and intravenous heparin in men with unstable coronary artery disease.Lancet 1990; 336: 827-830.
5. Balsano F, Rizzon P, Violi F, Scrutinio D, Cimminiello C, Aguglia F, et al. Antiplatelet treatment with ticlopidine in unstable angina. A controlled multicenter clinical trial. The Studio della Ticlopidina nell’Angina Instabile Group. Circulation. 1990; 82: 17-26.
6. Bertrand ME, Rupprecht HJ, Urban P, Gershlick AH; CLASSICS Investigators. Double-blind study of the safety of clopidogrel with and without a loading dose in combination with aspirin compared with ticlopidine in combination with aspirin after coronary stenting: the clopidogrel aspirin stent international cooperative study (CLASSICS). Circulation. 2000; 102: 624-9.
7. Bhatt DL, Bertrand ME, Berger PB, L’Allier PL, Moussa I, Moses JW, et al. Meta-analysis of randomized and registry comparisons of ticlopidine with clopidogrel after stenting. J Am Coll Cardiol. 2002; 39: 9-14.
8. The Clopidogrel in Unstable Angina to Prevent Recurrent Events Trial Investigator. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-Segment elevation. N Engl J Med 200; 345: 494-502.
9. Mehta S, Yusuf S, Peters R, Bertrand ME, Lewis BS, Natarajan MK, et al. Effects of pretreatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronary intervention: the PCI-CURE study. Lancet 2001; 358: 527-533.
10. Steinhubl SR, Berger PB, Mann JT, Fry ET, DeLago A, Wilmer C, et al. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA 2002; 288: 2411-20.
11. Patti G, Colonna G, Pasceri V, Pepe LL, Montinaro A, Di Sciascio G. Randomized trial of high loading dose of clopidogrel for reduction of periprocedural myocardial infarction in patients undergoing coronary intervention: results from the ARMYDA-2 (Antiplatelet therapy for Reduction of MYocardial Damage during Angioplasty) study. Circulation 2005; 111: 2099-106.
12. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet. 1996; 348: 1329-39.
13. Bhatt DL, Fox KA, Hacke W, Berger PB, Black HR, Boden WE, et al. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N Engl J Med. 2006; 354: 1706-17.
14. Kandzari DE, Berger PB, Kastrati A, Steinhubl SR, Mehilli J, Dotzer F, et al. Influence of treatment duration with a 600-mg dose of clopidogrel before percutaneous coronary revascularization. J Am Coll Cardiol. 2004; 44: 2133-6.
15. Hochholzer W, Trenk D, Bestehorn HP, Fischer B, Valina CM, Ferenc M, et al. Impact of the degree of peri-interventional platelet inhibition after loading with clopidogrel on early clinical outcome of elective coronary stent placement. J Am Coll Cardiol 2006; 48: 1742-50.
16. Steinhubl SR, Berger PB, Mann JT, Fry ET, DeLago A, Wilmer C, et al. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA. 2002; 288: 2411-20.
17. Szuk T, Gyongyosi M, Homorodi N, Kristof E, Kiraly C, Edes IF, et al. Effect of timing of clopidogrel administration on 30- day clinical outcomes: 300-mg loading dose immediately after coronary stenting versus pretreatment 6 to 24 h before stenting in a large unselected patient cohort. Am Heart J 2007; 153: 289- 95.
18. Harrington RA, Becker RC, Cannon CP, Gutterman D, Lincoff AM, Popma JJ, et al. Antithrombotic Therapy for NonST-Segment Elevation Acute Coronary Syndromes: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008; 133(Suppl 6): S670-S707.
19. Becker RC, Meade TW, Berger PB, Ezekowitz M, O’Connor CM, Vorchheimer DA, et al. The Primary and Secondary Prevention of Coronary Artery Disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition).CHEST 2008; 133: 776-814.
20. Alexander D, Ou FS, Roe MT, Pollack CV , Ohman EM, Cannon CP, et al. Use of and in hospital outcomes after early clopidogrel therapy in patients not undergoing an early invasive strategy for treatment of non-ST-segment elevation myocardial infarction: results from Can Rapid risk stratification of Unstable angina patients Suppress Adverse outcomes with Early implementation of the American College of Cardiology/American Heart Association guidelines (CRUSADE). Am Heart J 2008; 156: 606-12 .
21. Barker CM, Price MJ. Antiplatelet therapy in acute coronary syndromes Curr Cardiol Rep 2008; 10: 327-33.
22. Talbert RL. Overview of advances in cardiovascular disease treatment and prevention: the evolving role of antiplatelet therapy. Am J Health Syst Pharm. 2008 Jul 1; 65(13 Suppl 5): S1-5.
23. Maltais S, Perrault LP, Do QB. Effect of clopidogrel on bleeding and transfusions after off-pump coronary artery bypass graft surgery: impact of discontinuation prior to surgery. Eur J Cardiothorac Surg 2008; 34: 127-31.
24. Patti G, Nusca A, Mangiacapra F, Gatto L, D’Ambrosio A, Di Sciascio G. Point-of-care measurement of clopidogrel responsiveness predicts clinical outcome in patients undergoing percutaneous coronary intervention results of the ARMYDA-PRO (Antiplatelet therapy for Reduction of MYocardial Damage during Angioplasty-Platelet Reactivity Predicts Outcome) study. J Am Coll Cardiol 2008; 52: 1128-33.
25. Simoons ML; GUSTO IV-ACS Investigators. Effect of glycoprotein IIb/IIIa receptor blocker abciximab on outcome in patients with acute coronary syndromes without early coronary revascularisation: the GUSTO IV-ACS andomised trial. Lancet 2001; 357: 1915-24.
26. Topol EJ, Moliterno DJ, Herrmann HC, Powers ER, Grines CL, Cohen DJ, et al. Comparison of two platelet glycoprotein IIb/IIIa inhibitors, tirofiban and abciximab, for the prevention of ischemic events with percutaneous coronary revascularization. N Engl J Med 2001; 344: 1888-94.
27. Chan AW, Moliterno DJ, Berger PB, Stone GW, DiBattiste PM, Yakubov SL, et al. Triple antiplatelet therapy during percutaneous coronary intervention is associated with improved out-comes including one-year survival: results from the Do Tirofiban and ReoProGive Similar Efficacy Outcome Trial (TARGET). J Am Coll Cardiol 2003; 42: 1188-95.
28. Moliterno D, Yakubov S, DiBattiste P,Herrmann H, Stone G, Macaya C, et al. Outcomes at 6 months for the direct comparison of tirofiban and abciximab during percutaneous coronary revascularisation with stent placement: the TARGET follow-up study. Lancet 2002; 360: 355-60.
29. Kandzari DE, Berger PB, Kastrati A, Steinhubl SR, Mehilli J, Dotzer F, et al. influence of treatment duration with a 600-mg dose of clopidogrel before percutaneous coronary revascularization.J Am Coll Cardiol 2004; 44: 2133-6.
30. Kastrati A, Mehilli J, Neumann FJ, Dotzer F, ten Berg J, Bollwein H, et al. Abciximab in patients with acute coronary syndromes undergoing percutaneous coronary intervention after clopidogrel pretreatment: the ISAR-REACT 2 randomized trial. JAMA 2006; 295: 1531-8 .
31. Ndrepepa G, Kastrati A, Mehilli J, Neumann FJ, ten Berg J, Bruskina O, et al. One-year clinical outcomes with abciximab vs. placebo in patients with non-ST-segment elevation acute coronary syndromes undergoing percutaneous coronary intervention after pre-treatment with clopidogrel: results of the ISAR-REACT 2 randomized trial. Eur Heart J 2008; 29: 455-61 .
32. Giugliano RP, Newby LK, Harrington RA, Gibson CM, Van de Werf F, Armstrong P, et al. The early glycoprotein IIb/IIIa inhibition in non-ST-segment elevation acute coronary syndrome (EARLY ACS) trial: a randomized placebo-controlled trial evaluating the clinical benefits of early front-loaded eptifibatide in the treatment of patients with non-ST-segment elevation acute coronary syndrome—study design and rationale. Am Heart J 2005; 149: 994-1002.
33. Boersma E, Harrington RA, Moliterno DJ, White H, Théroux P, Van de Werf F, et al. Platelet glycoprotein IIb/IIIa inhibitors in acute coronary syndromes: a metaanalysis of all major randomized clinical trials. Lancet 2002; 359: 189-98.
34. White HD, Ohman EM, Lincoff AM, Bertrand ME, Colombo A, McLaurin BT, et al. Safety and efficacy of bivalirudin with and without glycoprotein IIb/IIIa inhibitors in patients with acute coronary syndromes undergoing percutaneous coronary intervention 1-year results from the ACUITY (Acute Catheterization and Urgent Intervention Triage strategY) trial. J Am Coll Cardiol 2008; 52: 807-14.
35. Theroux P, Ouimet H, McCans J, Latour JG, Joly P, Levy G, et al. Aspirin, heparin, or both to treat acute unstable angina. N Engl J Med 1988; 319: 1105-11.
36. RISC Group. Risk of myocardial infarction and death during treatment with low dose aspirin and intravenous heparin in men with unstable coronary artery disease. Lancet 1990; 336: 827-30.
37. Cohen M, Adams PC, Parry G, Xiong J, Chamberlain D, Wieczorek I, et al. Combination antithrombotic therapy in unstable rest angina and non-Q-wave infarction in nonprior aspirin users: primary end points analysis from the ATACS trial. Circulation 1994; 89: 81-8.
38. Gurfinkel EP, Manos EJ, Mejail RI, Cerda MA, Duronto EA, Garcia CN, et al. Low molecular weight heparin versus regular heparin or aspirin in the treatment of unstable angina and silent ischemia. J Am Coll Cardiol 1995; 26: 313-8.
39. Global Use of Strategies to Open Occluded Coronary. Arteries (GUSTO) IIb Investigators. A comparison of recombinant hirudin with heparin for the treatment of acute coronary syndromes. N Engl J Med 1996; 335: 775-82.
40. Mark DB, Cowper PA, Berkowitz SD, Davidson-Ray L, De Leone ER, Turpie AG, et al. Economic assessment of low-molecular-weight heparin (enoxaparin) versus unfractionated heparin in acute coronary syndrome patients: results from the ESSENCE randomized trial; efficacy and safety of subcutaneous enoxaparin in non-Q wave coronary events [unstable angina or non-Q-wave myocardial infarction]. Circulation 1998; 97: 1702-7.
41. Antman E, Mc Cabe CH, Gunfinkel EP, Turpie AG, Bernink PJ, Salein D, et al. Enoxaparin prevents death and cardiac ischemic events in unstable angina, non-Q wave MI: results of the TIMI 11B Trial. Circulation 1999; 100: 1593–601.
42. Ferguson JJ, Califf RM, Antman EM, Cohen M, Grines CL, Goodman S, et al. Enoxaparin vs unfractionated heparin in high-risk patients with non-STsegment elevation acute coronary syndromes managed with an intended early invasive strategy: primary results of the SYNERGY randomized trial. JAMA 2004; 292: 45-54.
43. Petersen JL, Mahaffey KW, Hasselblad V, Antman EM, Cohen M, Goodman SG, et al. Efficacy and bleeding complications among patients randomized to enoxaparin or unfractionated heparin for antithrombin therapy in non-ST-segment elevation acute coronary syndromes: a systematic overview. JAMA 2004; 292: 89-96.
44. Fragmin Fast Revascularisation during InStability in Coronary Artery Disease (FRISC II) Investigators. Long-term low-molecular-mass heparin in unstable coronary-artery disease: FRISC II prospective randomised multicentre study. Lancet 1999; 354: 701-7.
45. Moscucci M, Fox KA, Cannon CP, Klein W, Lopez-Sendon J, Montalescot G, et al. Predictors of major bleeding in acute coronary syndromes: the Global Registry of Acute Coronary Events (GRACE). Eur Heart J 2003; 24: 1815-23.
46. MICHELANGELO OASIS 5 Steering Committee; Mehta SR, Yusuf S, Granger CB, Wallentin L, Peters RJ, Bassand JP, et al. Design and rationale of the MICHELANGELO. Organization to Assess Strategies in Acute Ischemic Syndromes (OASIS)-5 trial program evaluating fondaparinux, a synthetic factor Xa inhibitor,in patients with non-ST-segment elevation acute coronary syndromes. Am Heart J 2005; 150: 1107.
47. Yusuf S, Mehta SR, Chrolavicius S, Afzal R, Granger CB, Budaj A, et al. Efficacy and safety of fondaparinux compared to enoxaparin in 20,078 patients with acute coronary syndromes without ST segment elevation. The OASIS (Organization to Assess Strategies in Acute Ischemic Syndromes)-5 Investigators. N Engl J Med 2006; 354: 1464-76.
48. Van Horn SE, Maniu CV. Management of non–ST-Segment Elevation Myocardial Infarction. Med Clin North Am 2007; 91: 683-700.
49. Bassand J P, Hamm CW, Ardissino D, Boersma E, Budaj E, Fernández-Avilés F, et al. Guidelines for the diagnosis and treatment of non ST elevation acute coronary syndromes: the task force for diagnosis and treatment of non-ST segment elevation acute coronary syndromes of European Society of Cardiology. Eur Heart J 2007; 2: 1598-1660.
50. ACC/AHA 2007 Guidelines for the management of patients with unstable angina/non–ST-elevation myocardial infarction. Executive summary. A report of the American College (writing committee to revise the 2002 guidelines for the management of patients with unstable angina/non-ST-elevation myocardial infarction). J Am Coll Cardiol 2007; 50: 652-726.
51. Harrington RA, Becker RC, Cannon CP, Gutterman D, Lincoff AM, Popma JJ, et al. Antithrombotic Therapy for Non–ST-Segment Elevation Acute Coronary Syndromes: American College of Chest physicians evidence-based clinical practice guidelines (8th edition). Chest 2008; 133(Suppl 6)S670-S707.
52. Organisation to Assess Strategies for Ischemic Syndromes (OASIS-2) Investigators. Effects of recombinant hirudin (lepirudin) compared with heparin on death, myocardial infarction, refractory angina, and revascularisation procedures in patients with acute myocardial ischaemia without ST elevation: a randomised trial. Lancet 1999; 353: 429-438.
53. Stone GW, White HD, Ohman EM, Bertrand ME, Lincoff AM, McLaurin BT, et al. Bivalirudin in patients with acute coronary syndromes undergoing percutaneous coronary intervention: a subgroup analysis from the Acute Catheterization and Urgent Intervention Triage strategy (ACUITY) trial. Lancet 2007; 369: 907-19.
54. Cohen M, Adams PC, Parry G, Xiong J, Chamberlain D, Wieczorek I, et al. Combination antithrombotic therapy in unstable r est angina and non-Q-wave infarction in nonprior aspirin users: primary end points analysis from the ATACS trial. Circulation 1994; 89: 81-8.
55. Organization to Assess Strategies for Ischemic Syndromes (OASIS-2) Investigators. Effects of recombinant hirudin (lepirudin) compared with heparin on death, myocardial infarction, refractory angina, and revascularisation procedures in patients with acute myocardial ischemia without ST elevation: a randomized trial. Lancet 1999; 353: 429-38.
56. Coumadin Aspirin Reinfarction Study (CARS) Investigators. Randomised double-blind trial of fixed low-dose warfarin with aspirin after myocardial infarction. Lancet 1997; 350: 389-96.
57. Fiore L, Ezekowitz M, Brophy M, Lu D, Sacco J, Peduzzi P. Department of Veterans Affairs Cooperative Studies Program Clinical Trial Comparing Combined Warfarin and Aspirin With Aspirin Alone in Survivors of Acute Myocardial Infarction: Primary Results ofthe CHAMP Study. Circulation 2002; 105: 557-63.
6. Estratificación en la evolución
La estratificación de riesgo debe hacerse en todo paciente en su evolución. Los pacientes pueden tener elementos predictores de eventos mayores como muerte o infarto que corresponde investigar.
La mayoría de los pacientes se estabilizan con el tratamiento médico inicial. En algunos casos esto no sucede y debe actuarse en consecuencia, adoptándose conductas invasivas inmediatas. En el caso de que el paciente responda al tratamiento, se deberán considerar diferentes marcadores clínicos y paraclínicos que revelen un riesgo elevado.
Se consideran pacientes de alto riesgo:
El manejo de estos pacientes de alto riesgo es habitualmente invasivo, aunque esta conducta debe individualizarse para cada situación. Por ejemplo, en los pacientes de 75 años deben evaluarse las comorbilidades y el posible beneficio que pueda tener un tratamiento de revascularización. Lo mismo debe plantearse para pacientes con insuficiencia renal o diabéticos.
Se consideran pacientes de bajo riesgo a aquellos que no repiten angor en las últimas 48 horas, sin cambios en ECG y sin alteración humoral, con score GRACE (u otro como score TIMI) de bajo riesgo.
En estos pacientes corresponde realizar un estudio ecocardiográfico y un test funcional de detección de isquemia. Si se comprueban marcadores de riesgo (ver estudios no invasivos sección 7.2) debe actuarse en consecuencia, con una conducta invasiva.
Se consideran pacientes de riesgo intermedio los que no tienen indicadores de riesgo alto ni bajo, con un score GRACE (u otro como score TIMI) intermedio.
En estos pacientes se plantean dos opciones. Una conducta puede ser una estrategia invasiva previa al alta. La otra es una estrategia conservadora (o mejor llamada por el Consenso invasiva selectiva) con tratamiento médico completo y realización de evaluación funcional. De acuerdo al resultado de esta evaluación se procederá o no a un estudio invasivo posterior.
BIBLIOGRAFíA
1. ACC/AHA 2007 guidelines for the management of patients with unstable angina/non–ST-elevation myocardial infarction. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines for the Management of Patients With Unstable Angina/Non–ST-Elevation Myocardial Infarction). J Am Coll Cardiol 2007; 50: e1-157.
2. European Society of Cardiology. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes: the task force for diagnosis and treatment of non-ST-segment elevation acute coronary syndromes of European Society of Cardiology. Eur Heart J 2007; 28: 1598-660.
3. Granger CB, Goldberg RJ, Dabbous O, Pieper KS, Eagle KA, Cannon CP, et al. Predictors of hospital mortality in the global registry of acute coronary events Arch Intern Med 2003; 163: 2345-53.
4. Sociedad Uruguaya de Cardiología. Primer Consenso Uruguayo de Dolor Torácico (monografía en línea). Montevideo: S.U.C; 2003. Disponible en: http://www.suc.org.uy/pdf/Consenso%20SUC-Dolor%20TX.pdf . (consultado 13/10/09).
7. Estudios no invasivos
El manejo de los pacientes con SCASEST requiere estratificación permanente. Mucha información pronóstica de valor deriva de la evaluación inicial y durante los primeros días de manejo.
En muchos casos la evaluación mediante estudios no invasivos provee información suplementaria muy valiosa para la toma de decisiones. Los pacientes que tienen indicación de cateterismo cardíaco según la evaluación clínica inicial no serán sometidos previamente a estudios no invasivos para detección de isquemia. Es de destacar que estos estudios están contraindicados en los pacientes de alto riesgo inicial.
7.1 EVALUACIÓN DE LA FUNCIÓN VENTRICULAR
El método más disponible es el ecocardiograma. Las consideraciones sobre el mismo se desarrollan en la sección 4.5
7.2 ESTUDIOS NO INVASIVOS PARA LA DETECCIÓN DE ISQUEMIA
Los objetivos de los tests funcionales son: detectar la presencia de isquemia y estimar el pronóstico del paciente. En cuanto a evaluación pronóstica, permitirán separar los pacientes con riesgo alto (mortalidad superior a 3% anual), riesgo intermedio (mortalidad anual entre 1% y 3%) y riesgo bajo (mortalidad anual inferior a 1%). La tabla 1 muestra los criterios que permiten estratificar el riesgo según resultados de cada test (1).
TABLA 1. ESTRATIFICACIóN DE RIESGO POR MéTODOS NO INVASIVOS (5)

Los estudios no invasivos disponibles comprenden la prueba ergométrica graduada, los estudios de perfusión miocárdica por cardiología nuclear y la ecocardiografía de estrés. La elección del método debe tener en cuenta las características del paciente, los recursos disponibles y la experiencia de cada centro.
7.2.1 PRUEBA ERGOMÉTRICA GRADUADA
Por su simplicidad, bajo costo y difusión, el método que se recomienda primariamente es la prueba ergométrica.
No es posible entrar aquí en detalles sobre la interpretación de las pruebas de estrés. Baste decir que la provocación de isquemia con baja carga o un score ergométrico elevado (por ejemplo, el score de Duke, explicado en el anexo), implica obstrucción coronaria severa con alto riesgo de eventos o incidencia de angina severa luego del alta (2).
Con el resultado de la prueba a la vista se plantearán diferentes estrategias.
7.2.2 ESTUDIOS PARA DETECCIóN DE ISQUEMIA OBJETIVADA POR IMÁGENES
Estos estudios pueden realizarse por ecocardiografía o por cardiología nuclear. El test a utilizar dependerá de las disponibilidades y experiencia de cada centro (3,4).
Una de las ventajas más destacadas que tienen este tipo de exámenes por imágenes es que permiten detectar con mayor seguridad la topografía y la magnitud de la isquemia. Esto representa una información muy valiosa a la hora de definir el riesgo y decidir una eventual revascularización. En la tabla 1 se resumen los criterios que permiten estratificar el riesgo según los resultados de cada prueba.
BIBLIOGRAFíA
1. ACC/AHA 2007 guidelines for the management of patients with unstable angina/non–ST-elevation myocardial infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines for the Management of Patients With Unstable Angina/Non–ST-Elevation Myocardial Infarction). J Am Coll Cardiol 2007; 50: e1-157.
2. Gibbons RJ, Balady GJ, Bricker JT, Chaitman BR, Fletcher GF, Froelicher VF, et al. ACC/AHA 2002 guideline update for exercise testing: summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Update the 1997 Exercise Testing Guidelines). Circulation 2002; 106: 1883-92.
3. Cheitlin MD, Armstrong WF, Aurigemma GP, Beller GA, Bierman FZ, Davis JL, et al. ACC/AHA/ASE 2003 guideline update for the clinical application of echocardiography: summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASE Committee to Update the 1997 Guidelines for the Clinical Application of Echocardiography). Circulation 2003; 108: 1146–62.
4. Klocke FJ, Baird MG, Lorell BH, Bateman TM, Messer JV, Berman DS, et al. ACC/AHA/ASNC guidelines for the clinical use of cardiac radionuclide imaging—executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASNC Committee to Revise the 1995 Guidelines for the Clinical Use of Cardiac Radionuclide Imaging). Circulation 2003; 108: 1404-18.
5. Gibbons RJ, Abrams J, Chatterjee K, Daley J, Deedwania P, Douglas JS, et al. ACC/AHA 2002 guideline update for the management of patients with chronic stable angina. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Update the 1999 Guidelines for the Management of Patients With Chronic Stable Angina)(monografía en línea). 2002. Disponible en: www.acc.org/qualityandscience/clinical/statements.htm (consultado 14/10/09).
6. SharirT, Germano G, Kavanagh PB, Lai S, Cohen I, Lewin HC, et al. Incremental prognostic value of post-stress left ventricular ejection and volume by gated myocardial perfusion single photon emission computed tomography. Circulation 1999; 1001035-42.
7. Mannting F, Zabrodina YV, Dass C . Significance of increased right ventricular uptake on 99mTc-sestamibi SPECT in patients with coronary artery disease. J Nucl Med 1999; 40: 889-94.
8.Indicación de cineangiocoronariografía
La estrategia en pacientes con SCASEST puede ser invasiva precoz o invasiva selectiva. La primera implica una realización sistemática de CACG y revascularización según su resultado y está planteada en los pacientes que tienen alto riesgo de eventos clínicos. La estrategia invasiva selectiva se plantea en pacientes sin elementos de alto riesgo. En estos pacientes se realiza un tratamiento médico inicial y se derivan a CACG a los que presentan isquemia espontánea o inducida en un test funcional (1,2).
- Se recomienda una estrategia invasiva precoz con CACG de urgencia en pacientes de alto riesgo con los siguientes elementos de inestabilidad clínica:
– Inestabilidad hemodinámica manifestada por hipotensión arterial < de 90 mm Hg de PAS, elementos de bajo gasto cardíaco o edema pulmonar.
– Arritmia ventricular grave: taquicardia ventricular no sostenida, taquicardia ventricular sostenida, fibrilación ventricular.
– Angina refractaria o recurrente que persiste a pesar de tratamiento médico máximo (I, B).
En los pacientes que presentan criterios de inestabilidad clínica que pongan en riesgo su sobrevida debe plantearse una CACG inmediata y eventual revascularización. Esta situación no es habitual, pues la mayoría de los pacientes pueden estabilizarse clínicamente con tratamiento médico correctamente instituido.
- Se recomienda indicar una estrategia invasiva precoz con realización de CACG a los pacientes con alto riesgo de eventos clínicos que estén estabilizados con el tratamiento médico inicial
(I, A).
En los pacientes inicialmente estabilizados se justifica una estrategia invasiva precoz ante el hallazgo de indicadores de alto riesgo de eventos. Esta conducta está basada en numerosos ensayos de estrategia en los SCASEST.
Los estudios más antiguos, en la era en que los stents y los fármacos antitrombóticos adjuntos modernos no eran utilizados, no mostraron superioridad de la estrategia invasiva sobre la conservadora en sus objetivos clínicos principales (3-5).
Los resultados más importantes de los estudios más recientes se muestran en la tabla 1.
En el más reciente metaanálisis de los estudios de estrategia (11), en siete estudios que incluyeron 8.375 pacientes, en una media de seguimiento de dos años se constató una incidencia de muerte de 4,9% en la rama invasiva versus 6,5% en la conservadora (RR: 0,75, IC 95%: 0,63-0,90, p=0,001). La incidencia de infarto no fatal fue de 7,6% en la rama invasiva versus 9,1% en la conservadora (RR = 0,83, IC 95% 0,72-0,96, p=0,012). A una media de 13 meses de seguimiento también hubo una reducción de la tasa de rehospitalización por angina inestable (RR=0,69, IC 95% 0,65-0,74, p<0,0001).
Como se observa en la mayoría de los estudios por separado como en su metaanálisis global, la estrategia invasiva precoz fue más eficaz que la conservadora en el manejo de los SCASEST.
Sin embargo, hay evidencia que esto es específicamente cierto en los pacientes de mayor riesgo. En los estudios FRISC II y TACTICS los pacientes especialmente beneficiados con la estrategia invasiva precoz fueron aquellos con niveles elevados de troponinas. En los estudios TIMI IIIB y TACTICS además se mostró que aquellos pacientes con un score de riesgo alto se beneficiaron netamente de la estrategia invasiva, mientras que en los pacientes de score bajo esta estrategia pudo ser deletérea en relación con una estrategia conservadora.
- En pacientes con alto riesgo de eventos clínicos estabilizados con tratamiento médico inicial es razonable que la CACG se realice en las primeras 72 horas (IIa, B).
Con respecto al momento de realizar la intervención, los estudios de estrategia han tenido tiempos diferentes, desde muy tempranos como el TACTICS a más tardíos como el FRISC II.
El registro CRUSADE (12), en un total de 56.352 pacientes, no mostró diferencias significativas en la tasa de muerte o infarto o ambos combinados entre una población intervenida tardíamente (46 horas) y una más precoz (23 horas).
El estudio ISAR-COOL (13), un ensayo randomizado de 410 pacientes, comparó dos estrategias: una muy precoz, con intervención en menos de seis horas previo tratamiento con heparina, AAS, clopidogrel y tirofiban versus una más tardía con intervención a los tres a cinco días. Hubo una reducción significativa de la tasa de muerte e infarto combinada en la rama precoz, destacándose que esta diferencia fue especialmente determinada por la ocurrencia de eventos en la espera del cateterismo. El mensaje de este estudio es que si el paciente es tratado con medidas antitrombóticas enérgicas, que incluya inhibidores de la glucoproteína IIb-IIIa, el tratamiento precoz a pocas horas del ingreso es seguro y ahorra eventos mayores en relación con una espera de “enfriamiento” del paciente.
El estudio ELISA (14) en 210 pacientes comparó una estrategia temprana (6 horas a la angiografía) sin tirofiban versus una estrategia diferida (50 horas a la angiografía) que incluyó tratamiento con tirofiban. En este caso el tratamiento previo con inhibidores de la glucoproteína IIb-IIIa redundó en una reducción de la liberación de lactato deshidrogenasa a las 48 horas (end point principal). Este estudio muestra entonces cómo el tratamiento previo con inhibidores de la glucoproteína IIb-IIIa protegió al paciente durante la intervención.
El estudio CRUSADE Quality Improvement Initiative (15) investigó el uso de la estrategia invasiva precoz en menos de 48 horas en 17.926 pacientes de alto riesgo en 248 hospitales de Estados Unidos. El 45% de estos pacientes fueron tratados con una estrategia invasiva precoz y comparativamente con los pacientes tratados más tardíamente la mortalidad hospitalaria ajustada fue menor (2,5% versus 3,7%, p<0,01).
La evidencia muestra entonces que una estrategia invasiva muy precoz en los pacientes de altor riesgo con SCASEST es segura y es eficaz, reduciendo eventos mayores (mortalidad e infarto). Sin embargo, esta conducta muy precoz debe acompañarse con medidas antitrombóticas enérgicas, especialmente el uso de inhibidores de la glucoproteína IIb-IIIa.
En relación con el momento de la realización de la CACG, el Consenso recomienda que sea efectuada en las primeras 72 horas.
La estrategia invasiva muy temprana en pacientes de alto riesgo, incluso en las primeras 24 horas de evolución, deviene en buena parte de estudios randomizados con amplio uso de inhibidores de la glucoproteína IIb-IIIa, que en nuestro medio son escasamente indicados por su costo.
Aun sin el uso de estos fármacos, la ausencia de evidencia que sostenga un período de enfriamiento hace que el Consenso proponga la indicación de este período de 72 horas para la realización del estudio invasivo (IIa,B).
Los indicadores de alto riesgo son múltiples y en algunos casos controvertidos. A la hora de decidir una estrategia invasiva, la presencia de estos indicadores debe ser contextualizada siempre en la perspectiva clínica concreta del paciente. No necesariamente todos los pacientes que tengan los indicadores de riesgo que se señalan seguidamente deben ser manejados con una estrategia invasiva, pues su encare debe definirse en el entorno clínico específico del paciente.
El Consenso recomienda considerar la aplicación de una estrategia invasiva precoz ante la presencia de los siguientes indicadores de riesgo:
- Pacientes con alto riesgo inicial (ver sección 2.3).
- Pacientes con score de riesgo GRACE (u otro como score TIMI) intermedio a alto.
- FEVI < 40%.
- IAM previo.
- Cirugía de revascularización miocárdica previa.
- Angioplastia coronaria en los seis meses previos.
- Diabéticos.
- Insuficiencia renal con clearance menor de 60 ml/min/1,73 m2.
- Pacientes que presenten uno de estos elementos en su evolución hospitalaria:
- Dolor reiterado luego de un período de acalmia.
- Angina refractaria al tratamiento convencional.
- Angina postinfarto.
- Angina clase III o IV.
- Angina con hipotensión arterial (PAS< 30 mm Hg a la habitual).
- Insuficiencia cardíaca.
- Arritmias ventriculares graves (taquicardia ventricular y fibrilación ventricular).
- Cambios dinámicos de ST (³ 0,5 mm), o de la onda T especialmente en cara anterior.
- Cualquier aumento de troponinas o CK MB.
- Puede considerarse una estrategia invasiva selectiva en pacientes de alto riesgo con troponinas positivas, inicialmente estabilizados (IIb, B).
Esta recomendación está basada en los resultados del estudio ICTUS, que mostró en pacientes con troponinas positivas con SCASEST que no había diferencias significativas en el end point combinado principal entre una estrategia invasiva precoz y una invasiva selectiva. El hecho de que en otros varios estudios randomizados de estrategia la rama invasiva precoz haya demostrado mayor eficacia, hace que esta recomendación sea IIb.
- En los pacientes sin elementos de alto riesgo de eventos clínicos en los que se aplicó una estrategia invasiva selectiva, se recomienda realizar CACG en aquellos que tengan isquemia espontánea o inducida en test no invasivo (I, A).
Los pacientes en los que se optó por una estrategia invasiva selectiva por no tener indicadores de riesgo, deben ser evaluados clínicamente y de mantenerse estables realizarse test funcional. La presencia de isquemia, ya sea espontánea o inducida por el test no invasivo, determina la realización posterior de una CACG.
- No se recomienda indicar una estrategia invasiva precoz en:
a) pacientes de bajo riesgo;
b) pacientes con importantes comorbilidades;
c) pacientes renuentes a cualquier tipo de revascularización (III, C).
Dada la importancia creciente que se adjudica al daño renal eventual en la realización de estudio angiográfico, el Consenso considera oportuno realizar recomendaciones básicas de nefroprotección en pacientes que se deriven a estos estudios.
- Se recomienda tomar medidas de nefroprotección en todo paciente que será sometido a CACG (I, A).
Es conocido el efecto deletéreo sobre la función renal del contraste, por lo que deberían ser tomadas las medidas correspondientes para prevenir el daño renal. Esto es especialmente relevante en los pacientes de alto riesgo de nefropatía inducida por el contraste:
a) Creatininemia > 1,5 mg/dl.
b) Diabetes.
c) Insuficiencia cardíaca severa (clase III-IV NYHA).
d) Deshidratación.
e) Hipotensión prolongada que requiera inotrópicos o BIAC, o ambos
f) Edad > 75 años.
g) Uso de fármacos nefrotóxicos (por ejemplo: antiinflamatorios no esteroideos, diuréticos de asa).
h) Utilización de alto volumen de contraste (>5 ml/kg/creatininemia en mg/dl).
Las medidas preventivas de nefroprotección incluyen (16):
a) Administrar el menor volumen posible de contraste (volumen sugerido máximo: 5 ml/kg/creatininemia en mg/dl).
b) Asegurarse un buen estado de hidratación del paciente antes y después del procedimiento. Por ejemplo: suero salino a 0,9% 100 ml/hora comenzando en lo posible cuatro horas antes del procedimiento y continuando hasta 12-24 horas después del mismo, especialmente en los pacientes de alto riesgo de nefropatía inducida por contraste.
c) Evitar los contrastes de alta osmolaridad, prefiriéndose los de baja osmolaridad o los isosmolares, especialmente en los pacientes de alto riesgo de nefropatía inducida por contraste.
d) Evitar en lo posible los fármacos potencialmente nefrotóxicos en las últimas 48 horas antes del procedimiento (por ejemplo diuréticos de asa y antiinflamatorios no esteroideos).
Figura 1
BIBLIOGRAFÍA
1. Anderson JL, Adams CD, Antman EM, Bridges CR, Califf RM, Casey DE Jr, et al. ACC/AHA 2007 guidelines for the management of patients with unstable angina/non–ST-elevation myocardial infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines for the Management of Patients With Unstable Angina/Non–ST-Elevation Myocardial Infarction): developed in collaboration with the American College of Emergency Physicians, American College of Physicians, Society for Academic Emergency Medicine, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol 2007; 50: e1-157.
2. Bassand JP, Hamm CW, Ardissino D, Boersma E, Budaj A, Fernández-Avilés F, et al. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes.Task Force for Diagnosis and Treatment of Non-ST-Segment Elevation Acute Coronary Syndromes of European Society of Cardiology. Eur Heart J 2007; 28: 1598-660.
3. The TIMI IIIB Investigators. Effects of tissue plasminogen activator and a comparison of early invasive and conservative strategies in unstable angina and non-Q-wave myocardial infarction. Results of the TIMI IIIB Trial. Thrombolysis in Myocardial Ischemia. Circulation. 1994; 89: 1545-56.
4. Boden WE, O’Rourke RA, Crawford MH, Blaustein AS, Deedwania PC, Zoble RG, et al. Outcomes in patients with acute non-Q-wave myocardial infarction randomly assigned to an invasive as compared with a conservative management strategy. Veterans Affairs Non-Q-Wave Infarction Strategies in Hospital (VANQWISH) Trial Investigators. N Engl J Med 1998; 338: 1785-92.
5. McCullough PA, O’Neill WW, Graham M, Stomel RJ, Rogers F, David S, et al. A prospective randomized trial of triage angiography in acute coronary syndromes ineligible for thrombolytic therapy. Results of the medicine versus angiography in thrombolytic exclusion (MATE) trial. J Am Coll Cardiol 1998; 32: 596-605.
6. Wallentin L, Lagerqvist B, Husted S, Kontny F, Ståhle E, Swahn E. Outcome at 1 year after an invasive compared with a non-invasive strategy in unstable coronary-artery disease: the FRISC II invasive randomised trial. FRISC II Investigators. Fast Revascularisation during Instability in Coronary artery disease. Lancet 2000; 356: 9 -16.
7. Cannon CP, Weintraub WS, Demopoulos LA, Vicari R, Frey MJ, Lakkis N, et al. Comparison of early invasive and conservative strategies in patients with unstable coronary syndromes treated with the glycoprotein IIb/IIIa inhibitor tirofiban. N Engl J Med 2001; 344: 1879-87.
8. Spacek R, Widimský P, Straka Z, Jiresová E, Dvorák J, Polásek R, et al. Value of first day angiography/angioplasty in evolving Non-ST segment elevation myocardial infarction: an open multicenter randomized trial. The VINO Study. Eur Heart J 2002; 23: 230-8.
9. Fox KA, Poole-Wilson PA, Henderson RA, Clayton TC, Chamberlain DA, Shaw TR, et al. Interventional versus conservative treatment for patients with unstable angina or non-ST-elevation myocardial infarction: the British Heart Foundation RITA 3 randomised trial. Randomized Intervention Trial of unstable Angina. Lancet. 2002; 360: 743-51.
10. de Winter RJ, Windhausen F, Cornel JH, Dunselman PH, Janus CL, Bendermacher PE, et al. Early invasive versus selectively invasive management for acute coronary syndromes. N Engl J Med 2005; 353: 1095-104.
11. Bavry AA, Kumbhani DJ, Rassi AN, Bhatt DL, Askari AT. Benefit of early invasive therapy in acute coronary syndromes a meta-analysis of contemporary randomized clinical trials. J Am Coll Cardiol 2006; 48: 1319-25.
12. Ryan JW, Peterson ED, Chen AY, Roe MT, Ohman EM, Cannon CP, et al. Optimal timing of intervention in non-ST-segment elevation acute coronary syndromes: insights from the CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress ADverse outcomes with Early implementation of the ACC/AHA guidelines) Registry.Circulation 2005; 112: 3049-57.
13. Neumann FJ, Kastrati A, Pogatsa-Murray G, Mehilli J, Bollwein H, Bestehorn HP, et al. Evaluation of prolonged antithrombotic pretreatment (“cooling-off” strategy) before intervention in patients with unstable coronary syndromes: a randomized controlled trial. JAMA 2003; 290: 1593-9.
14. van’t Hof AW, de Vries ST, Dambrink JH, Miedema K, Suryapranata H, Hoorntje JC, et al. A comparison of two invasive strategies in patients with non-ST elevation acute coronary syndromes: results of the Early or Late Intervention in unStable Angina (ELISA) pilot study: 2b/3a upstream therapy and acute coronary syndromes. Eur Heart J 2003; 24: 1401-5.
15. Bhatt DL, Roe MT, Peterson ED, Li Y, Chen AY, Harrington RA, et al. Utilization of early invasive management strategies for high-risk patients with non-ST-segment elevation acute coronary syndromes: results from the CRUSADE Quality Improvement Initiative. JAMA 2004; 292: 2096-104.
16. Lluberas R, Durán A, Mallo D, Artucio C, Gaspar J, Vázquez P, et al. Guías sobre medios de contraste que incluye protección renal (monografía en línea). SOLACI. Disponible en: URL: http://www.solaci.org/ (Consultado 22/10/08).
9. Alternativas de revascularización
El objetivo global de la revascularización miocárdica en estos pacientes es mejorar el pronóstico vital, aliviar los síntomas, prevenir las complicaciones isquémicas y mejorar la capacidad funcional.
Los criterios de selección de la estrategia de revascularización son los mismos en los SCASEST que en la angina estable. Los hallazgos de los grandes registros de pacientes de cardiopatía isquémica sugieren que el modo de presentación tiene poca relación con la subsecuente estrategia de revascularización (1-5).
Esto no afectó la sobrevida a tres o cinco años, según la presentación fuera de angina estable o inestable (6).
El manejo de estos pacientes incluye habitualmente la revascularización por vía percutánea o quirúrgica. La selección del tipo de procedimiento depende de criterios clínicos, de la experiencia del operador, y la extensión de la enfermedad coronaria. Sobre la base de los hallazgos anatómicos por angiografía, el grado de revascularización completa, la evaluación de aspectos de comorbilidad (Euroscore), estado clínico del paciente, función del ventrículo izquierdo (VI), expectativa de vida y cantidad de miocardio en riesgo se decide el tipo de revascularización por ATC o cirugía de revascularización miocárdica (CRM).
Desde el punto de vista anatómico 30%-38% de los pacientes con síndrome coronario agudo sin elevación del ST presentarán enfermedad de un solo vaso, 44%-59% enfermedad multivaso y la incidencia de estenosis significativa de tronco de coronaria izquierda (TCI) varía entre 4% y 8% de los casos. Además, entre 10% y 15% presentarán arterias coronarias sin lesiones angiográficamente significativas (7).
Habitualmente, junto a los hallazgos en el ECG y a eventuales resultados de estudios no invasivos previos (alteraciones en la motilidad ventricular sectorial o evidencias de zonas de miocardio hipoperfundidas), la angiografía coronaria permite definir la o las lesiones de una o más arterias responsables del cuadro clínico. Dichos hallazgos pueden incluir lesiones complejas, ulceradas, calcificadas, excéntricas, de bordes irregulares, con defecto de llenado (compatibles con presencia de trombo endoluminal) (8,9). En ocasiones tales hallazgos involucran más de un vaso o no están presentes, lo que dificulta identificar el o los vasos culpables (10).
9.1 ATC VERSUS CRM
En un gran número de pacientes los hallazgos angiográficos son suficientes para definir el tipo de revascularización. Sin embargo, existen muchos casos en que ambos métodos (ATC o CRM) son alternativas válidas. Estos pacientes, básicamente, son pacientes con enfermedad multivaso tratables por ambos métodos en los cuales, al momento de decidir la forma de revascularización, hay que considerar: el riesgo global de eventos coronarios de continuar con tratamiento médico, los eventuales beneficios de la revascularización, la severidad de los síntomas, la probabilidad de éxito técnico de la ATC o la CRM, la presencia o no de comorbilidad asociada y riesgos del procedimiento, la experiencia del operador y la preferencia del paciente (11,12).
Se han realizado estudios aleatorizados que compararon los resultados de los dos tipos de revascularización. A modo de resumen, de los ensayos comparativos de ambos métodos (los dos válidos), se puede esquematizar:
a) Menor mortalidad inicial con la ATC.
b) Igual mortalidad en la evolución que lleva a que no haya diferencias significativas entre ambos métodos globalmente.
c) Mayor recurrencia de síntomas y necesidad de nuevas revascularizaciones en el grupo de ATC.
Es de destacar que la morbimortalidad de los procedimientos de revascularización miocárdica es mayor en estos pacientes que en los pacientes estables. Sin embargo, el beneficio que logran, especialmente en el paciente de alto riesgo, justifica su utilización.
La estrategia global puede ser resumida en la figura 1.
9.2 MOMENTO DE LA REVASCULARIZACIÓN
Tal como fue planteado en el capítulo de indicación de coronariografía, los pacientes con gran inestabilidad clínica (angina refractaria o recurrente con tratamiento completo, con inestabilidad hemodinámica o arritmias ventriculares graves), deben ser manejados con una estrategia invasiva de urgencia y revascularizados consecuentemente.
Los pacientes que respondan al tratamiento médico y que presentan criterios de riesgo deben ser orientados a una estrategia invasiva precoz, con coronariografía y revascularización cuando la anatomía lo justifique.
En relación con el momento para la revascularización de estos pacientes, los primeros datos sobre ATC en pacientes con angina inestable mostraron una incidencia superior de eventos en aquellos que eran intervenidos muy precozmente, resultados que han variado en la actualidad con el surgimiento de nuevos y más potentes fármacos antiplaquetarios como el clopidogrel y los inhibidores de las glucoproteína IIb-IIIa, poniendo nuevamente en vigencia el concepto de intervención precoz.
Según la evidencia más reciente [ELISA (13), ISAR_COOL (14)], parecería ser que aún el régimen antitrombótico más agresivo no lograría evitar la acumulación de eventos (los cuales aparecían en grado significativamente mayor mientras los pacientes esperaban la intervención) mientras no se resuelva mediante una intervención el componente obstructivo de la placa.
De esta forma, al definir el momento de intervención en los pacientes con SCASEST, se podría afirmar que: a) no habría beneficio alguno en “enfriar” el cuadro clínico solo con heparina; b) los bloqueadores IIb-IIIa tampoco logran por sí solos detener la acumulación de eventos que se produce durante los primeros días, obteniéndose su mayor beneficio cuando se los asocia a la ATC, y c) la estrategia invasiva precoz parece ser segura y beneficiosa asociada a un intenso plan antiagregante y antitrombótico.
En el capítulo de indicación de coronariografía ya se planteó que el Consenso sugiere que en nuestro país la indicación más razonable es plantear un intervalo no mayor de 72 horas para realizar la coronariografía y eventual angioplastia coronaria.
Existe una correlación entre la revascularización miocárdica quirúrgica y la oportunidad quirúrgica entre aquellos con infarto reciente. Luego de los siete primeros días el riesgo se iguala a la población general. En aquellos pacientes con infarto no transmural el riesgo es máximo en las seis primeras horas y luego desciende, normalizándose parcialmente a los tres días y definitivamente a la semana; en los infartos transmurales el período de alto riesgo quirúrgico en vez de ser seis horas es de 72 horas (15,16). En la angina inestable, depende de las características de la misma. Normalmente se benefician de un tratamiento quirúrgico precoz.
9.3 INTERVENCIÓN CORONARIA PERCUTáNEA
El uso de la ATC como opción de revascularización coronaria en los pacientes que ingresan con diagnóstico de SCASEST ha presentado un sostenido incremento en su indicación debido a su elevada tasa de éxito angiográfico y el bajo índice de complicaciones (17).
La utilización de los stents coronarios y la administración concomitante de fármacos antitrombóticos y antiagregantes plaquetarias contemporáneos (bloqueadores IIb-IIIa, clopidogrel) ha disminuido dramáticamente la oclusión aguda y subaguda post ATC así como la reestenosis alejada. La tasa de complicaciones por sangrado en el sitio de punción ha sido controlada con el uso dispositivos de cierre en casos de abordaje femoral así como la utilización de la vía de acceso radial.
La elección de la vía de abordaje depende, en caso de no existir contraindicaciones para su uso, de la preferencia y experiencia del operador.
El uso de stents liberadores de droga (SLD) parece tener la misma efectividad en disminuir la reestenosis en pacientes con SCASEST que en pacientes con cuadros clínicos estables como se ha demostrado a partir de análisis de subgrupos en estudios randomizados y de los datos de la práctica clínica (real world).
Asimismo, aunque existe mayor incidencia de trombosis aguda y subaguda del stent en pacientes que cursan SCASEST cuando se las compara con pacientes que cursan cuadros estables, el uso de SLD no parece presentar mayor riesgo de trombosis intrastent. Datos recientes sugieren mantener el tratamiento antiplaquetario doble por un año cuando se coloca un SLD independientemente del tipo que sea.
Es aconsejable utilizar un stent metálico en pacientes en los que se van a realizar intervenciones quirúrgicas extracardíacas que puedan requerir la interrupción del tratamiento antiplaquetario en el primer año después de implantarlo.
La elección del tipo de stent (común o liberador de fármaco) debe basarse en la evaluación individual del beneficio y el riesgo potencial.
9.4 CIRUGíA DE REVASCULARIZACIÓN MIOCÁRDICA
El 10% de los pacientes con SCASEST serán sometidos a CRM durante la fase de hospitalización inicial.
Se ha demostrado que en estos pacientes con riesgo intermedio o alto definido por enfermedad del TCI, con compromiso de los tres vasos coronarios principales, disfunción del VI o diabetes, tienen un beneficio en la cirugía precoz.
Al igual que con la ATC, la CRM en el contexto de SCA se asocia con un incremento significativo en la incidencia de muerte hospitalaria (4,6%-9%), especialmente en pacientes con angina severa.
En estudios controlados realizados con pacientes estabilizados con tratamiento médico, la mortalidad quirúrgica se ubica en 1% a 3% (18,19).
Los estudios prospectivos randomizados llevados a cabo entre la cirugía y la angioplastia con balón y stents metálicos, no han mostrado diferencias en cuanto a mortalidad e infarto, pero sí han mostrado incidencia aumentada de necesidad de revascularización de la angioplastia versus cirugía en pacientes con enfermedad de dos y tres vasos.
En el metaanálisis publicado recientemente sobre cuatro estudios randomizados (20) comparando cirugía versus ATC con stent en pacientes portadores de enfermedad coronaria multivaso (ARTS, ERACI II, SoS trial y MASS II) no se evidenciaron diferencias significativas en sobrevida a cinco años, aun cuando la necesidad de revascularización fue significativamente superior en los pacientes con angioplastia que con cirugía. No hay a la fecha de la realización de este Consenso información a largo plazo randomizada de cirugía versus stent con fármacos.
En el BARI (21) (CRM versus ATC con balón) a diez años en el subgrupo de pacientes con diabetes tratada se halló una significativa mejor sobrevida entre aquellos con revascularización quirúrgica versus ATC. Estos resultados se vieron confirmados por el CABRI (22) y los estudios de la Universidad de Emory (23). También se ha demostrado que en el grupo de pacientes con fracción de eyección ventricular disminuida se ha demostrado superior sobrevida a largo plazo con la revascularización quirúrgica.
En cuanto a los pacientes que presentan lesión severa de TCI, se mantiene la opción quirúrgica como la más adecuada (24-26).
La ATC de TCI “no protegido” puede ser una alternativa razonable en lesiones aisladas de TCI, que no comprometan la bifurcación y/o que no son candidatos quirúrgicos por severa comorbilidad.
9.5 RECOMENDACIONES SOBRE MÉTODOS
DE REVASCULARIZACIÓN (SEGÚN TIPO DE INDICACIÓN Y NIVEL DE EVIDENCIA) EN LOS SCASEST
TIPO I
- La ATC precoz se recomienda en pacientes con criterios de alto riesgo, baja comorbilidad, que presenten lesiones coronarias pasibles de corregirse con ATC (nivel de evidencia: A).
- La ATC o CRM se recomienda en pacientes con lesiones severas de uno o dos vasos con o sin compromiso de DA proximal, pero con una extensa área de miocardio viable en riesgo o elementos de alto riesgo en estudio no invasivo (nivel de evidencia: B).
- La CRM se recomienda en pacientes con lesiones severas de dos vasos, con compromiso de DA proximal y deterioro de la FEVI o isquemia demostrada en estudio no invasivo (nivel de evidencia: A).
- Se recomienda ATC o CRM en pacientes con enfermedad multivaso, con anatomía favorable, con función ventricular normal y ausencia de diabetes (nivel de evidencia: A).
- Se recomienda CRM en pacientes multiarteriales con deterioro de la FEVI (nivel de evidencia: A).
- Se recomienda CRM en pacientes con lesiones severas de TCI (> 50%) (nivel de evidencia: A).
- Se recomienda CRM en pacientes con isquemia en curso y escasa respuesta al tratamiento médico óptimo y con anatomía no favorable para ATC (nivel de evidencia: B).
TIPO II A
- La ATC es razonable para lesiones de puentes venosos (focales o múltiples), con mala respuesta al tratamiento médico óptimo y malos candidatos para nueva CRM (nivel de evidencia: C).
- La ATC o CRM es razonable en pacientes con lesiones severas de uno o dos vasos con o sin compromiso de DA proximal, pero con una moderada área de miocardio viable en riesgo o isquemia demostrada en estudio no invasivo (nivel de evidencia: B).
- La ATC o CRM es razonable en comparación con el tratamiento médico óptimo en pacientes con enfermedad de un vaso con compromiso significativo de DA proximal (nivel de evidencia: B).
- La ATC es razonable en pacientes con lesión severa de TCI (>50%) que sean malos candidatos para CRM o que requieran una intervención de emergencia por inestabilidad hemodinámica (nivel de evidencia: B).
- La CRM con el uso de arteria mamaria interna en pacientes diabéticos con enfermedad multivaso es razonable y puede ser más beneficiosa que la ATC (nivel de evidencia: B).
- Una nueva CRM es razonable en pacientes con enfermedad difusa de puente venoso safeno, particularmente si revasculariza la DA (nivel de evidencia: C).
TIPO II B
- Puede ser considerada la ATC en pacientes bajo tratamiento médico que presenten enfermedad de dos o tres vasos, con compromiso de DA proximal, diabéticos tratados, con deterioro de la FEVI y anatomía pasible de realizar ATC (nivel de evidencia: B).
- Puede ser considerada la CRM en pacientes con enfermedad de uno o dos vasos, sin compromiso de DA proximal, con una modesta área de miocardio isquémico cuando la ATC no es óptima o posible (nivel de evidencia: B).
TIPO III
- No está recomendada ATC o CRM en pacientes con lesiones de uno o dos vasos, sin compromiso de DA proximal, asintomáticos o con síntomas no atribuibles a isquemia miocárdica y que no presentan isquemia demostrada en tests funcionales (nivel de evidencia: C).
- En ausencia de elementos de alto riesgo la ATC no está recomendada en pacientes con enfermedad de uno o múltiples vasos, sin tratamiento médico previo y que presenten una o más de estas condiciones:
a) Sólo una pequeña área de miocardio en riesgo (nivel de evidencia: C).
b) Todas las lesiones o la lesión culpable a dilatar con baja probabilidad angiográfica de éxito (nivel de evidencia: C).
c) Procedimiento con alta morbimortalidad (nivel de evidencia: C).
d) Lesiones no significativas (estenosis < 50% ) (nivel de evidencia: C).
e) Lesión severa de TCI en buen candidato quirúrgico (nivel de evidencia: C). - La ATC no está recomendada en pacientes estables con vaso relacionado a un infarto persistentemente ocluido luego de un SCASEST (nivel de evidencia: B).
BIBLIOGRAFÍA
1. Libby P. Current concepts of the pathogenesis of the acute coronary syndromes Circulation 2001; 104: 365-372.
2. Davies MJ. The pathophysiology of acute coronary syndromes. Heart 2000; 83: 361-366.
3. DeWood MA, Stifter WF, Simpson CS, Spores J, Eugster GS, Judge TP, et al. Coronary arteriographic findings soon after non-Q-wave myocardial infarction N Engl J Med 1986; 315: 417-423.
4. Braunwald E, Mark DB, Jones RH, et al. Unstable Angina: Diagnosis and Management. 3-1-1994; AHCPR Publication No. 94-0602: 1–154. Citado en: ACC/ AHA 2007 guidelines for the management of patients with unstable angina/ non ST elevation myocardial infarction: executive summary. Circulation 2007; 116: p.868.
5. Theroux P, Fuster V. Acute coronary syndromes: unstable angina and non-Q-wave myocardial infarction Circulation 1998; 97: 1195-206.
6. Hannan EL, Racz MJ, McCallister BD, Ryan TJ, Arani DT, Isom OW, et al. A comparison of three-year survival after coronary artery bypass graft surgery and percutaneous transluminal coronary angioplasty. J Am Coll Cardiol 1999; 33: 63-72.
7. Alison HW, Russell RO Jr, Mantle JA, Kouchoukos NT, Moraski RE, Rackley CE. Coronary anatomy and arteriography in patients with unstable angina pectoris. Am J Cardiol 1978; 41: 204-9.
8. Ambrose JA, Winters SL, Arora RR, Haft JI, Goldstein J, Rentrop KP, et al. Coronary angiographic morphology in myocardial infarction: a link between the pathogenesis of unstable angina and myocardial infarction. J Am Coll Cardiol 1985; 6: 1233-8.
9. Gorlin R, Fuster V, Ambrose JA. Anatomic-physiologic links between acute coronary syndromes. Circulation 1986; 74: 6-9.
10. Rioufol G, Finet G, Ginon I, André-Fouët X, Rossi R, Vialle E, et al. Multiple atherosclerotic plaque rupture in acute coronary syndrome: a three-vessel intravascular ultrasound study. Circulation 2002; 106: 804-8.
11. Anderson JL, Adams CD, Antman EM, Bridges CR, Califf RM, Casey DE Jr, et al. ACC/AHA 2007 guidelines for the management of patients with unstable angina/non–ST-elevation myocardial infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines for the Management of Patients With Unstable Angina/Non–ST-Elevation Myocardial Infarction): developed in collaboration with the American College of Emergency Physicians, American College of Physicians, Society for Academic Emergency Medicine, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol 2007; 50: e1-157.
12. Bassand JP, Hamm CW, Ardissino D, Boersma E, Budaj A, Fernández-Avilés F, et al. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes. Task Force for Diagnosis and Treatment of Non-ST-Segment Elevation Acute Coronary Syndromes of European Society of Cardiology. Eur Heart J 2007; 28: 1598-660.
13. van’t Hof AW, de Vries ST, Dambrink JH, Miedema K, Suryapranata H, Hoorntje JC, et al. A comparison of two invasive strategies in patients with non-ST elevation acute coronary syndromes: results of the Early or Late Intervention in unStable Angina (ELISA) pilot study: 2b/3a upstream therapy and acute coronary syndromes. Eur Heart J 2003; 24: 1401-5.
14. Neumann FJ, Kastrati A, Pogatsa-Murray G, Mehilli J, Bollwein H, Bestehorn HP, et al. Evaluation of prolonged antithrombotic pretreatment (“cooling-off” strategy) before intervention in patients with unstable coronary syndromes: a randomized controlled trial. JAMA 2003; 290: 1593-9.
15. Lee DC, Oz MC, Weinberg AD, Lin SX, Ting W. Optimal timing of revascularization: Transmural versus nontransmural acute myocardial infarction. Ann Thorac Surg 2001; 72: 1197-202.
16. Lee DC, Oz MC, Weinberg AD, Ting W. Appropriate timing of surgical intervention after transmural acute myocardial infarction. J Thorac Cardiovasc Surg 2003; 125: 115-9.
17. Anderson JL, Adams CD, Antman EM et al, Bridges CR, Califf RM, Casey DE Jr, et al. ACC/AHA 2007 guidelines for the management of patients with unstable angina/non-ST-Elevation myocardial infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines for the Management of Patients With Unstable Angina/Non-ST-Elevation Myocardial Infarction) developed in collaboration with the American College of Emergency Physicians, the Society for Cardiovascular Angiography and Interventions, and the Society of Thoracic Surgeons endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation and the Society for Academic Emergency Medicine. J Am Coll Cardiol 2007; 50: e1-e157.
18. FRISC II Investigators. Invasive compared with non-invasive treatment in unstable coronary-artery disease: FRISC II prospective randomised multicentre study. FRagmin and Fast Revascularisation during InStability in Coronary artery disease Investigators. Lancet 1999; 354: 708-15.
19. Fox Ka, Poole-Wilson PA, Henderson RA, Clayton TC, Chamberlain DA, Shaw TR, et al. Interventional versus conservative treatment for patients with unstable angina or non-ST-elevation myocardial infarction: the British Heart Foundation RITA 3 randomized trial. Randomized Intervention Trial of unstable Angina. Lancet 2002; 360: 743-51.
20. Daema n J, Boersma E, Flather M, Booth J, Stables R, Rodríguez A, et al. Long term and efficacy of percutaneous coronary intervention with stanting and coronary artery bypass surgery for multivessel coronary artery disease: a meta-analysis with 5 year patient-level data from the ARTS, ERACI II, MASS II, and SoS trials. Circulation 2008; 118: 1146-54.
21. BARI Investigators. The final 10-year follow-up results from the BARI randomized Trial. J Am Coll Cardiol 2007; 49: 1600-6.
22. CABRI trial participants. First-year results of CABRI (Coronary angioplasty versus bypass revascularization investigation). Lancet 1995; 346: 1179-1184.
23. King SB, Lembo NJ, Weintraub WS, Kosinski AS, Barnhart HX, Kutner MH, et al. A randomized trial comparing coronary angioplasty with coronary bypass surgery. Emory angioplasty versus surgery trial (EAST). N Engl J Med 1994; 331: 1044-1050.
24. Taggart DP, Kaul S, Boden WE, Ferguson TB, Guyton RA, Mack MJ, et al. Revascularization for unprotected left main stem coronary artery stenosis stenting or surgery. J Am Coll Cardiol 2008; 51: 885-892 .
25. Hannan EL, Racz MJ, Walford G, Jones RH, Ryan TJ, Bennett E, et al. Long-Term Outcomes of Coronary-Artery Bypass Grafting versus Stent Implantation. N Engl J Med; 2005 352: 2174-83.
26. Hannan EL, Wu C, Walford G, Culliford AT, Gold JP, Smith CR, et al. Drug-Eluting Stents vs. Coronary-Artery Bypass Grafting in Multivessel Coronary Disease. N Engl J Med 2008; 358: 331-41.
10. Recomendaciones al alta hospitalaria
Luego de una fase inicial, los pacientes con SCASEST presentan un alto riego de recurrencias de episodios isquémicos, por lo que es de primordial importancia la implementación de medidas de prevención secundaria (PS).
El correcto control de los factores de riesgo (FR) así como la implementación de programas de rehabilitación cardiovascular (RHCV), lamentablemente infrautilizados, han demostrado que mejoran la evolución clínica a largo plazo con una menor incidencia de nuevos eventos.
El rol del médico tratante es asegurarse no solo del correcto tratamiento farmacológico, sino aconsejar sobre estilos de vida saludables para mejorar la calidad de vida futura. El objetivo es optimizar el control de los síntomas, minimizar los riesgos de infarto y muerte.
No se discute en la actualidad que esta estrategia es prioritaria, pero en este capítulo los estudios farmacológicos en diseños aleatorizados han obtenido un mayor protagonismo en detrimento de las recomendaciones sobre los cambios en el estilo de vida, menos propicios para ser analizados en este tipo de estudios.
No es la finalidad de este Consenso realizar una revisión detallada sobre las medidas de PS, ampliamente difundidas, haciéndose hincapié en aquellos objetivos de vital importancia en los cuales hay que ser más incisivos, sin descuidar que el control de los FR íntimamente relacionados entre sí reducirá el riego cardiovascular total (1-4).
En la siguiente tabla se resumen las recomendaciones para PS y manejo de la medicación.
DECÁLOGO A TENER EN CUENTA EN EL MANEJO A LARGO PLAZO
1. Evaluar la evolución clínica y presencia de síntomas (I, C).
2. Controlar la medicación: indicaciones, posología, ajustes de dosis y efectos colaterales (I, C).
3. Enfatizar en el control de los factores de riesgo (I, C).
4. Controlar la clase funcional, función ventricular y posible presencia de arritmias con PEG, ecocardiograma y eventual Holter, sobre todo en pacientes con FEVI< 40% (I, C).
5. Evaluar siempre el estado psicosocial y su eventual derivación a un médico especialista (I, C).
6. Aconsejar al paciente y su familia sobre la realización de tareas domiciliarias, vuelta al trabajo, actividad sexual, conducción de vehículos, viajes y actividad física (I, C).
7. Brindar apoyo social y familiar y recomendar la integración a grupos de RHCV (I, C).
8. Dependiendo de la severidad de la afección padecida y su solución, la vuelta al trabajo se recomendará entre dos y cuatro semanas luego del alta si el paciente está estable, pero deberá considerarse en cada caso particular (I, C).
9. El reinicio de la actividad sexual dependerá de la estratificación del riesgo cardiovascular y su estabilidad, pudiendo recomendarse después de la primera semana del alta, aunque se debe considerar cada caso individual (I, C).
10. Valoración de la paraclínica: perfil lipídico, enzimograma hepático, función renal, glicemia y/o HbA1c, ionograma. Su frecuencia dependerá del logro de los objetivos, presencia de síntomas y de la intolerancia o efectos secundarios de los fármacos (I, C).
BIBLIOGRAFÍA
1. De Backer G, Ambrosioni E, Borch-Johnsen K, Brotons C, Clifkova R, Dallongeville J, et al. European guidelines on cardiovascular disease prevention in clinical practice. Third Joint Task Force of European and Other Societies on Cardiovascular Disease Prevention in Clinical Practice. Eur Heart J. 2003; 24: 1601-10.
2. Smith SC, Allen J, Blair SN, Bonow RO, Brass LM, Fonarow GC, et al. AHA/ACC Guidelines for secondary prevention for patients with coronary and other atherosclerotic vascular disease: 2006 update: endorsed by the National Heart, Lung and Blood Institute. Circulation 2006; 113: 2363-72.
3. Iestra JA, Kromhout D, Van der Schouw YT, Grobbee DE, Boshuisen HC, Van Staveren WA. Effect size estimated of lyfestyle and dietary changes on all-cause mortality in coronary artery disease patients: a systematic review. Circulation 2005; 112: 924-34.
4. Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F, et al. Effect of potencially modificable risk factors associated with myocardial infarction in 52 countries (The INTERHEART Study): case-control study. Lancet 2004; 364: 937-52.
5. US Department of Health and Human Services. The Health Cosequences of Smoking: A Report of the Surgeon General. Washington, DC: Centers for Disease Control and Prevention, National Center for Chronic Disease Prevention, Office on Smoking and Health; May 27, 2004. Obtenido de: http://www.surgeongeneral.gov/library/smokingconsequences. (consultado15/10/2008).
6. Fiore Mc, Jaén C, Baker TB. Guía Norteamericana sobre Tabaquismo 2008. Páginas 144-149. Obtenido de: http://www.ahrq.gov/path/tobacco.htm#Clinic. (consultado: 21/10/08).
7. Baiabe H, Barlow D, Bullen C. Guía Neozelandeza sobre Tabaquismo 2008. Pacific Islands Heatbeat, Nacional Heart Foundation of N.Z., K. Beverley Smokefree Mental Health Services, University ok Auckland. Obtenido de: http://www.moh.govt.nz. (consultado: 21/10/08).
8. Schoj V, Tambussi A. Guía Argentina de Tabaquismo. Obtenido de http://www.msal.gov.ar. (consultado 21/10/08).
9. Klein S, Burke LE, Bray GA, Allison DS, Pi-Sunyer X, Hong Y, et al. American Council on Nutrition, Physical Activity and Metabolism. Clinical implications of obesity with specific focus on cardiovascular disease: a statement for professionals from the American Heart Association Council on Nutrition, Physical Activity and Metabolism: endorsed by the American College of Cardiology Foundation. Circulation 2004; 110: 2952-67.
10. Balady GJ, Williams MA, Ades PA, Bitner V, Cosmos P, Foody JM, et al. Core components of Cardiac Rehabilitation/Secondary Prevention Programs: 2007 Update. A Scientific Statement from AHA Exercise, Cardiac Rehabilitation an Prevention Committee, the Council on Clinical Cardiology and the American Association of Cardiovascular and Pulmonary Rehabilitation. Circulation 2007; 115: 2675-82.
11. Bassand JP, Hamm CW, Ardissino D, Boersma E, Budaj, A, Fernández-Avilés F, et al. Guía de Práctica Clínica para el diagnóstico y tratamiento del Síndrome Coronario Agudo Sin Elevación del segmento ST. Grupo de trabajo para el diagnóstico y tratamiento del síndrome coronario agudo sin elevación del segmento ST de la Sociedad Europea de Cardiología. Rev Esp Cardiol. 2007; 60: 1070e1-e80.
12. Mancia G, De Bakey G, Dominiczack A, Cifkova R, Fagard R, Germano G, et al. Guidelines for the Management of Arterial Hypertension: Task Forceo f the European Society of Hypertension (ESH) and the European Society of Cardiology (ESC). J Hipertension 2007; 25: 1105-187.
13. Laurent S, Cockoft J, Van Bortel L, Boutouyrie P, Giannattasio C, Hayoz D, et al. Expert Consensus Document on Arterial Stifness: Methodological Issues and Clinical Applications. On behalf of the European Network for Non Invasive Investigation on Large Arteries. Eur Heart J 2006; 27: 2588-605.
14. Williams SB, Lacy PS, Thom SM, Cruickshank K, Stanton A, Collier D, et al. Differential impact of blood pressure-lowering drug on central aortic pressure and clinical outcomes. Principal Results of the Conduit Artery Function Evaluation (CAFE) Study. Circulation 2006; 113: 1213-25.
15. Heart Protection Study Collaborative Group. MCR/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20.536 high-risk individuals: a randomised placebo-controlled trial. Lancet 2002; 360: 7-22.
16. LaRosa JC, Grundy SM, Waters DD, Shear C, Barter P, Fruchart JC, et al. Treating to New Targets (TNT) Investigators. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med. 2005; 352: 1425-35.
17. Hulten E, Jackson JL, Douglas K, George S, Villines TC. The effect of early, intensive statin therapy on acute coronary syndrome: a meta-analysis of randomized controlled trials. Arch Intern Med. 2006; 166: 1814-21.
18. Grundy SM, Cleeman JI, Merz CN Jr, Brewer HB, Clark LT, Hunninghake DB, et al. National Heart, Lung, and Blood Institute; American College of Cardiology Foundation; American Heart Association. Implications of recent trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation 2004; 110: 227-239.
19. Cholesterol Treatment Trialists’ (CTT) Collaborators. Eficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90 056 patients in 14 randomised trials of statins. Lancet 2005; 366: 1267-78.
20. Henkin Y. Re-Evaluating Therapeutic Target Goals for Statin-Treated Patients: Time for Revolutionary Changes. J Am Coll Cardiol 2008; 52: 633-5.
21. Barter PJ, Ballantyne CM, Carmena R, Castro Cabezas M, Chapman MJ, Couture P, et al. Apo B versus Cholesterol in estimating cardiovascular risk and guiding therapy: report thirty-person/ten-country panel. J Int Med 2006; 259: 247-58.
22. Ryden L, Standl E, Bartnik M, Van der Berghe G, Betteridge J, De Boer MJ, et al. Guidelines on diabetes, pre-diabetes and cardiovascular disease; executive summary: The Task force on Diabetes and cardiovascular Disease of the European Society of Cardiology (ESC) and the European Association for the Study of Diabetes (EASD). Eur Heart J. 2007; 28: 88-136.
23. American Diabetes Association. Standards of medical care in Diabetes. Diabetes Care 2004; 27 (suppl 1): S15-S35.
24. American Association for Cardiovascular and Pulmonary Rehabilitation. Guidelines for Cardiac Rehabilitation and Secondary Prevention programs. 4th ed. Champaign, III: Human Kinetics Publisher, 2004.
25. Sociedad Uruguaya de Cardiología. Guía Práctica de Prevención Cardiovascular [monografía en línea] Montevideo; SUC; Nov. 2007. Disponible en: http://www.suc.org.uy. (consultado: 21/10/08).
26. Oldridge NB, Guyat GH, Fischer ME. Cardiac Rehabilitation after myocardial infaction. Combined experience of randomized clinical trials. JAMA 1988; 260: 945-50.
27. O’Connor GT, Buring JE, Yusuf S, Goldhaber SZ, Olmestead EM, Paffenbarger RS, et al. An overview of randomized trials with exercise after myocardial infarction. Circulation 1989; 80: 234-44.
28. Taylor R, Brown A, Ebrahim S, Joliffe J, Thompson D, Oldridge NB. Exercise-based rehabilitation for patients with coronary heart disease: systematic review and meta-analysis of randomized controlled trials. Am J Med. 2004; 116: 682-92.
29. American Association of Cardiovascular and Pulmonary Rehabilitation. Clinical Practice Guideline. Quick Reference Guide for Clinicians Nº 17, Cardiac Rehabilitation and Secondary Prevention Programs. 3rd ed. Human Kinetics Publisher,1999.
30. Borg GA. Psychophysical bases of perceived exertion. Med Sci Sports Exerc 1982; 14: 337-81.
31. Burdiat G. Seguridad y eficacia de un programa de rehabilitación cardíaca con pacientes de alto riesgo en un medio hospitalario. Rev Urug Cardiol 2008; 23: 150-6.
32. Thomas RJ, King M, Lui K, Oldridge NB, Piña IL, Spertus J, et al. AACVPR/ACC/AHA 2007 Performance measures on cardiac rehabilitation for referral to and delivery of cardiac rehabilitation/secondary prevention services. Circulation 2007; 116: 1611-4.
33. Pollock ML, Franklin BA, Balady GJ, Chaitman BL, Fleg JL, Fletcher B, et al. Resistance Exercise in Individuals with and Without Cardiovascular Disease: Benefits, Rationale, Safety and Prescription. An Advisory from the Committee on Exercise, Rehabilitation and Prevention, Council on Clinical Cardiology, AHA. Circulation 2000; 101: 828-33.
34. Berkman LF, Blumenthal J, Burg M, Carney RM, Catellier D, Cowan MJ, et al. Enhancing Recovery in Coronary Heart Disease Patients Investigators (ENRICHD). Effets of treating depression and low perceived social support on clinical events after myocardial infarction: the ENRICHD Randomized Trial. JAMA. 2003: 289; 3106-16.
35. Antiplaquelet Trialist’ Collaboration. Collaborative overview of randomised trials antiplaquelet therapy-I: prevention of death,myocardial infarction, and stroke by prolonged antiplaquelet therapy in various categories of patients. BMJ 1994; 308: 81-106.
36. Peters RJ, Mehta SR, Fox KA, Zhao F, Lewis BS, Kupecky SL, et al. Effects of aspirin dose when used alone or in combination with clopidogrel in patients with acute coronary syndromes: observations from the Clopidogrel in Unstable angina to Prevent Recurrent Events (CURE) study. Circulation 2003; 108: 1682-7.
37. Yusuf S, Wittes J, Friedman L. Overview of results of randomized clinical trials in heart disease. II. Unstable angina, heart failure, primary prevention with aspirin, and risk factor modification. JAMA 1988; 260: 2259-63.
38. López Sendón J, Swedlberg K, Mc Murray J, Tamargo J, Maggioni AP, Dargie H, et al. Expert consensus on betaadrenergic receptor blockers. Eur Heart J. 2004; 25: 1341-62.
39. Dargie HJ. Effect of carvedilol on outcome after myocardial infarction in patients with left-ventricular dysfunction: the CAPRICORN randomised trial. Lancet 2001; 537: 1385-90.
40. Poole-Wilson PA, Swedberg K, Cleland JG, Di Lenarda A, Hanrath P, Komajda M, et al. Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomised controlled trial. Lancet; 2003; 362: 7-13.
41. CIBIS-II Investigators and Committees. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet 1999; 353: 9-13.
42. Yusuf S, Pepine CJ, Garces C, Pouleour H, Salem D, Kostis, et al. Effect of enalapril on myocardial infarction and unstable angina in patients with low ejection fractions. Lancet 1992; 340: 1173-8.
43. The Acute Infaction Ramipril Efficacy (AIRE) Study Investigators. Effect of Ramipril on mortality and morbidity of survivors of acute myocardial infaction with clinical evidences of heart failure. Lancet 1993; 342: 821-8.
44. Yusuf S, Sleight P, Pogue J, Bosch J, Davies R, Dagenais G. Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. N Engl J Med 2000; 342: 145.
45. Teo KK, Yusuf S, Pfeffer M, Torp-Pedersen C, Kober L, Hall A, et al. Effects on long-term treatment with angiotensin-converting-enzime inhibitors in the presence or absence of aspirin: a systematic review. Lancet 2002; 360: 1037-43.
46. Pfeffer MA, Mc Murray JJ, Velazquez Ej, Rouleau JL, Kober L, Maggioni AP, et al. Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both. N Engl J Med 2003; 349: 1893-90.
47. Fox KM. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (The EUROPA Study). Lancet 2003; 362; 782-8.
48. Degenais GR, Pogue J, Fox K, Simoons ML, Yusuf S. Angiotensin-converting-enzyme inhibitors in stable vascular disease without left ventricular systolic dysfunction or heart failure: a combined analysis of three trials. Lancet 2006; 368: 581-8.
49. Braunwald E, Antman EM, Beasley JW, Califf RM, Cheitlin MD, Hochman JS, et al. ACC/AHA, Committee on the Management of Patients with Unstable Angina. ACC/AHA 2002 Guideline update for the management of patients with unstable angina and non-ST-segment elevation myocardial infaction-Summary article. J Am Coll Cardiol. 2002; 40: 1366-74.
50. Harper SA, Fukuda K, Uyeki TM, Cox NJ, Bridges CB; Advisory Committee on Immunization Practices (ACIP), Prevention (CDC). Prevention and control of influenza. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2005; 54(RR-8): 1-40.Erratum in: MMWR Morb Mortal Wkly Rep 2005; 54: 750. Citado en: Smith CS, SC, Allen J, Blair SN, Bonow RO, Brass LM, Fonarow GC, et al. AHA/ACC Guidelines for Secondary Prevention for Patients with Coronary and other Atherosclerotic Vascular Disease. Circulation 2006; 113: 2366.
Anexo 1. Definición universal de infarto agudo de miocardio (1)
TIPOS DE INFARTO DE ACUERDO AL TIPO O SITUACIóN CLíNICA
Tipo 1
IAM espontáneo debido a isquemia miocárdica por una lesión coronaria secundaria a erosión y/o ruptura, fisura o disección de una placa aterosclerótica.
Tipo 2
IAM secundario a isquemia debido a un disbalance entre la oferta y demanda de oxígeno. Por ejemplo: espasmo coronario, embolia coronaria, anemia, arritmias, hipertensión o hipotensión arterial.
Tipo 3
Muerte súbita cardíaca que involucra paro cardíaco, a veces con síntomas previos de isquemia miocárdica y acompañado por probable nueva elevación del segmento ST y/o nuevo bloqueo de rama izquierda y/o evidencia de trombo fresco en la cinecoronariografía y/o autopsia, pero que no hubo elevación de biomarcadores dado que el paciente falleció antes de poder extraerse las muestras o fueron extraídas muy precoces.
Tipo 4a
IAM asociado con angioplastia transluminal coronaria
Tipo 4b
IAM asociado a trombosis del stent documentado por cinecoronariografía o autopsia
Tipo 5
IAM asociado con cirugía de revascularización miocárdica
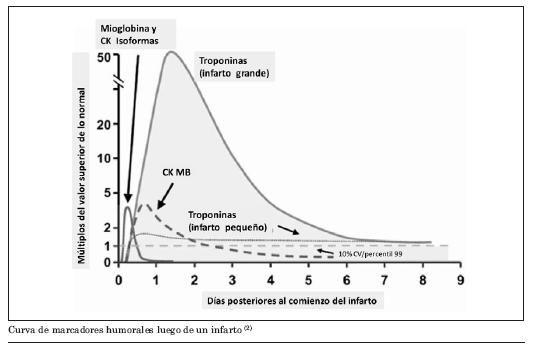
Figura 1. Curva de marcadores humorales luego de un infarto (2)
De acuerdo al tamaño
Necrosis mínima
<10% pequeño
10 -30% moderado
>30% grande
Score de Duke
La ecuación para calcular el score de Duke es :
Score de Duke= tiempo de ejercicio (en minutos) – (5 x desviación del segmento ST en mm) – (4 x angina al esfuerzo)
Puntuación del angor: 0 = no hay angina; 1 = si la angina no es limitante; 2 = si la angina es limitante del esfuerzo.
BIBLIOGRAFÍA
1. Thygesen K, Alpert JS, White HD; Joint ESC/ACCF/AHA/WHF Task Force for the Redefinition of Myocardial Infarction. Universal definition of myocardial infarction. J Am Coll Cardiol 2007;50: 2173–95.
2. Shapiro BP, Jaffe AS. Cardiac biomarkers. In: Murphy JG, Lloyd MA, editors. Mayo Clinic Cardiology: Concise Textbook. 3rd ed. Rochester, MN: Mayo Clinic Scientific Press and New York: Informa Healthcare USA, 2007: 773–80.
Anexo 2. Complicaciones de los SCASEST
Grupo 3. Coordinador: P. Asadurian. Miembros: F.Berro, D. Loza, R. Mendiburu,
O. Montes de Oca, J. Pontet, C. Rivas, S. Rossi, M. Saez
El Comité de Redacción del Consenso consideró que el ítem de trastornos del ritmo e insuficiencia cardíaca como complicaciones de los SCASEST tal como lo había presentado el grupo respectivo excedía los marcos del objetivo del mismo, que ha sido dar una herramienta práctica y concisa sobre el manejo de los SCASEST en sus aspectos más habituales.
Por ello resolvió no incluirlo en el cuerpo del Consenso en forma íntegra, sino en un resumen práctico que se desarrolla en la sección 3.3. Sin embargo, dado la importancia del tema, este Comité de Redacción consideró que era razonable presentarlo a modo de anexo.
A) TRASTORNOS DEL RITMO
Los trastornos del ritmo son menos frecuentes que en los SCACEST pero los ingresos por SCASEST cuadriplican a los primeros. En el caso de arritmias supraventriculares y BAV, no hay estudios recientes que modifiquen su tratamiento.
Las arritmias ventriculares constituyen aproximadamente la tercera o cuarta parte que en SCACEST, siendo su frecuencia del 2,1 al 2,6 % para las sostenidas (1,3) y hasta de 35% para las no sostenidas pero complejas cuando se realizó Holter al ingreso en pacientes con FEVI mayor del 40% (2).
Se presentaron habitualmente en forma precoz, dentro de las primeras 48 horas (80% antes de las 12 horas) cuando se sometió al paciente a una terapia invasiva precoz con posterior revascularización (3) y con una mediana de tiempo de 78 horas cuando no se realizó CACG temprana en todos los casos (1).
Se plantea que la fisiopatología de las arritmias ventriculares en estos síndromes sería una interacción entre inflamación, disbalance electrolítico e isquemia, sobre todo agregada a una cicatriz de infarto previa favoreciendo mecanismos de reentrada y de automatismo anormal (3).
Los scores de riesgo utilizados habitualmente no sirven para predecir la ocurrencia de arritmias ventriculares graves.
En el mayor de los estudios publicados, que involucraron a 26.416 pacientes con arritmias ventriculares intrahospitalarias sostenidas, tomados del GUSTO II b, PURSUIT, PARAGON A y B, se identificaron predictores independientes de fibrilación ventricular que incluyeron hipertensión arterial, enfermedad pulmonar obstructiva crónica, infarto de miocardio previo y cambios del segmento ST al ingreso. Excepto hipertensión arterial, todos las demás también lo fueron para taquicardia ventricular intrahospitalaria (1). En otro de los trabajos, la leucocitosis elevada al ingreso fue el único predictor luego de un análisis multivariado (3).
El pronóstico de las arritmias ventriculares en los pacientes con SCASEST es desconocido (1), existen pocos estudios clínicos randomizados al respecto. A pesar de los adelantos en el tratamiento de estos pacientes, estas arritmias están asociadas a mayor mortalidad precoz (intrahospitalaria) y alejada (6 meses) (1,2) siendo de 5 a 15 veces mayor, ocurriendo la mayoría en los primeros 30 días (1), Incluso al excluir pacientes con insuficiencia cardíaca, shock cardiogénico y aquellos que fallecieron precozmente antes de las primeras 24 horas del ingreso.
Si bien la mejor terapia es incierta, éstos pacientes con arritmias ventriculares sostenidas se beneficiarían de un tratamiento más agresivo tempranamente, que incluya el uso de betabloqueantes y la revascularización precoz en los casos que estén indicados.
RECOMENDACIONES
ARRITMIAS VENTRICULARES
I) Fibrilación ventricular
- 1. En la fibrilación ventricular o taquicardia ventricular sin pulso se recomienda choque eléctrico no sincronizado con energía inicial de 200 J (monofásico) o 150 J (bifásico); si no es exitoso, segundo choque de 200-300 J (monofásico) o 200 J (bifásico), y si es necesario un tercero de 360 J (monofásico) o 200J (bifásico) (I, B).
- 2. En la fibrilación ventricular o taquicardia ventricular sin pulso refractarias a la desfibrilación es razonable administrar amiodarona 300 mg o 5 mg/kg i/v en bolo seguido de nuevo choque eléctrico no sincronizado (recomendación IIa, B), y corregir disturbios electrolíticos (potasio >4,0 meq/l y magnesio >2,0 mg/dl) y ácido base (IIa, C).
- 3. En pacientes con fibrilación ventricular o taquicardia ventricular sin pulso refractarias a la desfibrilación se puede administrar lidocaína 1 mg/kg hasta un máximo de 100 mg i/v en bolo, que puede repetirse 0,5 mg/kg hasta 50 mg i/v a los 5 min. si es necesario, seguido de nuevo choque eléctrico (IIb, B).
- 4. En pacientes post reversión de fibrilación ventricular o taquicardia ventricular sin pulso puede indicarse: a) infusión de amiodarona 1 mg/min. por 6 horas y luego 0,5 mg/min por 18 horas (recomendación IIb, B).
b) Infusión de lidocaína 1-4 mg/min por 24-48 horas (recomendación IIb, B). - 5. en pacientes con extrasistolía ventricular compleja en las primeras 24-48 horas (frecuente, polimorfa, duplas, taquicardia ventricular no sostenida) es razonable:
a) Optimizar tratamiento betabloqueante (recomendación IIa, B).
b) Administrar lidocaína profiláctica 1 mg/kg hasta un máximo de 100 mg i/v en bolo, seguida de goteo 1-4 mg/min (recomendación IIa, B). - 6. Puede considerarse lidocaína profiláctica en las primeras 24 horas para prevenir una fibrilación ventricular o taquicardia ventricular:
- en pacientes que no reciben tratamiento de reperfusión (IIb, B).
- en pacientes con monitorización electrocardiográfica no confiable (recomendación IIb, C).
- cuando no hay un desfibrilador disponible (recomendación IIb, C).
La FV requiere una rápida reversión con choque eléctrico. Actualmente se prefiere la cardioversión bifásica.
La lidocaína, cuando es administrada en forma apropiada, ha demostrado disminuir significativamente la incidencia de fibrilación ventricular primaria. Sin embargo, su uso profiláctico fue desaconsejado en las Guías de IAM ACC/AHA de 1996 y cayó en desuso desde ese momento. La información considerada para incluir a la lidocaína como indicación clase III, fue fundamentalmente el metanálisis de MacMahon y colaboradores, a pesar de que los propios autores concluyen que el número de eventos reportados es muy bajo, el seguimiento corto, no disponen de datos completos sobre las causas de muerte, y que no es posible definir si el uso de lidocaína es beneficioso o peligroso. Se consideró también un metanálisis de Hine y colaboradores que analizó 6 estudios publicados entre 1970 y 1973 con el uso de diferentes protocolos de lidocaína profiláctica. Ninguno de estos estudios individualmente mostró un efecto perjudicial del uso de lidocaína, pero el análisis en conjunto sí lo mostró; sin embargo es de notar que la mortalidad al alta hospitalaria no fue diferente y que las causas de muerte no fueron analizadas. Finalmente, se consideraron otros dos estudios, de Teo y colaboradores y DeSilva y colaboradores, que no mostraron aumento de la mortalidad con el uso de lidocaína profiláctica, por el contrario este último ensayo mostró un beneficio.
En suma, podemos afirmar que la evidencia actual en relación al uso profiláctico de lidocaína muestra: 1) previene la FV primaria; 2) cuando es administrada apropiadamente no aumenta la incidencia de bradiarritmias; 3) no existe evidencia concluyente de que aumente la mortalidad. Es en este sentido entonces que parece adecuado admitir su uso en situaciones particulares.
II) Taquicardia ventricular
- 1) Se recomienda tratar a la taquicardia ventricular polimórfica sostenida (mayor de 30 segundos o colapso hemodinámico) igual que la fibrilación ventricular o taquicardia ventricular sin pulso: choque eléctrico no sincronizado con energía inicial de 200 J (monofásico) o 150 J (bifásico); si no es exitoso, segundo choque de 200-300J (monofásico) o 200J (bifásico), y si es necesario un tercero de 360 J (monofásico) o 200 J (bifásico) (recomendación I, B).
- 2) Se recomienda tratar a la taquicardia ventricular monomorfa sostenida asociada con angor, edema pulmonar o hipotensión (presión arterial sistólica menor 90 mmHg) con choque eléctrico sincronizado inicial de 100 J (monofásico, bifásico). Si no es exitoso aumentar la energía de los choques subsiguientes. Utilizar anestesia breve siempre que lo permita la situación hemodinámica (recomendación I, B).
- 3) Se recomienda tratar a la taquicardia ventricular monomorfa sostenida no asociada con angor, edema pulmonar o hipotensión (presión arterial sistólica menor de 90 mmHg) con:
a) Cardioversión sincronizada de inicio 50J (monofásico, bifásico), previo anestesia (recomendación I, B).
b) Amiodarona 150 mg i/v o 5 mg/kg i/v en 10 min, que se puede repetir a los 10-15 min si es necesario (seguido de cardioversión eléctrica si no revierte) (recomendación I, B). - 4) En la taquicardia ventricular monomorfa sostenida sin repercusión hemodinámica se puede administrar lidocaína 1 mg/kg hasta un máximo de 100 mg i/v en bolo, que se puede repetir 0,5 mg/kg hasta un máximo de 50 mg i/v si es necesario (seguido de cardioversión eléctrica si no revierte) (recomendación IIb, B).
- 5) En la taquicardia ventricular polimorfa refractaria es razonable:
a) Corregir disionías y alteraciones ácido base (recomendación IIa, C).
b) Betabloqueantes i/v si no hay contraindicaciones (recomendación IIa, B).
c) Amiodarona 1 mg/min por 6 horas y luego 0,5 mg/min por 18 horas (recomendación IIa, B).
d) Considerar balón de contrapulsación y/o revascularización de urgencia (recomendación IIa, B).
e) Si bradicardia < 60 pm o QT largo: suspender fármacos que prolongan el QT (amiodarona) y valorar colocación de marcapaso transitorio (recomendación IIa, C). - 6) Post reversión de taquicardia ventricular sin pulso se puede indicar:
a) Infusión de amiodarona 1 mg/min i/v por 6 horas y 0,5 mg/min i/v por 18 horas por 24 48 horas (recomendación IIb, B).
b) Infusión de lidocaína 1-4 mg/min i/v por 24 48 horas (recomendación IIb, B).
III) Extrasistolía ventricular
- 1) No se recomienda tratar las extrasístoles ventriculares no complejas (recomendación III, A).
- 2) No se recomienda tratar los ritmos idioventriculares acelerados y ritmos de la unión acelerados (recomendación III, C).
INSUFICIENCIA CARDíACA
La insuficiencia cardíaca (IC) es un síndrome clínico caracterizado por: 1) signos y síntomas de sobrecarga hídrica en los vasos sanguíneos y en el intersticio, que incluyen: dificultad respiratoria, estertores pulmonares y edemas; 2) manifestaciones de perfusión tisular inadecuada, en los que interviene una progresiva activación de los sistemas neuroendocrinos (4).
Fisiopatología
Su mecanismo básico es el incremento de la presión de llenado del VI que puede ocurrir por disfunción sistólica yo diastólica, a la que puede asociarse una insuficiencia mitral aguda (5).
El incremento de la presión capilar lleva a la redistribución de fluidos desde el espacio intravascular al extravascular,(intersticio pulmonar y alvéolos), produciendo edema pulmonar.
La disminución del volumen sistólico y del gasto cardíaco desencadenan la respuesta neurohumoral que consta de: a) la activación del sistema renina-angiotensina-aldosterona, dando lugar a vasoconstricción renal y sistémica, a través de la angiotensina II, y b) la activación del sistema nervioso simpático con incremento de la vasoconstricción por aumento de la liberación de noradrenalina y aumento de la secreción de aldosterona. Adicionalmente, la angiotensina II tiene efecto deletéreo directo sobre el miocito y contribuye a la disfunción endotelial. El aumento del tono simpático tiene como efecto favorable la disminución de la capacitancia del lecho venoso y la redistribución de la volemia. Sin embargo, el aumento de la resistencia vascular compromete también al sector arterial, aumentando la postcarga, con la consiguiente reducción del volumen sistólico. Esto constituye uno de los motivos por los que los mecanismos neurohumorales pueden ser nocivos más que compensadores (4).
DIAGNóSTICO
Es clínico, caracterizado por disnea, taquicardia de reposo, tercer ruido y estertores pulmonares, junto a elementos de hipoperfusion tisular periférica, tales como piel fría y sudorosa, agitación psicomotriz, oligoanuria, relleno capilar lento y livideces en miembros.
La determinación de la fracción de eyección del VI por ecocardiografia Doppler es fundamental en el manejo de la IC, permite objetivar la motilidad regional, cuantificando el número de segmentos comprometidos y descarta complicaciones mecánicas (recomendación I, C). Una FEVI menor del 40% asociada a signos y síntomas sugestivos, establecen diagnostico de disfunción VI sistólica.
La radiografía (Rx) de tórax, nos permite conocer el tamaño de la silueta cardíaca, reconocer elementos de congestión venosa pulmonar y descartar asimismo, diagnósticos diferenciales (recomendación I, C).
Se realizarán exámenes de laboratorio, que no podrán diferir la estrategia invasiva urgente.
El hemograma es de utilidad para descartar una anemia concomitante. La disminución de la disponibilidad de oxígeno determinada por esta, genera una situación de hiperdinamia circulatoria que puede provocar falla ventricular izquierda.
El ionograma nos permite identificar disionías presentes y guiarnos en su corrección.
La función renal debe ser valorada con la azoemia y creatininemia.
Una gasometría arterial nos permite conocer la saturación arterial de oxígeno y guiarnos en la instalación de medidas inmediatas y en escala, para su corrección.
Tratamiento
Está dirigido a reducir la morbimortalidad, mejorar síntomas y la calidad de vida.
Las medidas inmediatas ante la congestión pulmonar deben ser elevar la oxigenación tisular y reducir la precarga, interviniendo de esta forma, en las alteraciones hemodinámicas presentes, alcanzando un volumen sistólico adecuado. Todas las medidas que se implementen, serán progresivas y no deben diferir la estrategia invasiva urgente.
Se recomienda que los pacientes sean trasladados e internados en Unidades Coronarias o de Cuidados Intensivos, bajo monitoreo electrocardiográfico continuo y para disponer del rápido tratamiento de arritmias ventriculares graves (recomendación I, C).
Se recomienda que los pacientes reciban oxigenoterapia suplementaria con máscara de flujo libre facial o nasal, a razón de 6-10 l/min) (recomendación I, B) .
Se recomienda una ventilación mecánica precoz, con uso de presión positiva en la espiración (PEEP), cuando no se logre una presión arterial de oxígeno mayor de 60 mm de Hg, o una saturación arterial de oxígeno mayor de 90%, o elementos de hipoperfusión tisular periférica, para lograr un aumento de la capacidad residual funcional y disminución del trabajo respiratorio (recomendación I,B) (6,7).
Se recomienda suministrar en pacientes con congestión pulmonar, dilución de morfina intravenosa, 3-4 mg en 30 segundos, por sus acciones conocidas de venodilatación, mejoría de la disnea subjetiva y de la agitación psicomotriz (recomendación I,C) (6,7).
Los diuréticos tienen un lugar principal en el tratamiento de la IC, ya que apuntan al manejo de la congestión pulmonar y retención hídrica, aumentando la excreción urinaria de sodio y disminuyendo los signos de retención de fluidos. Los diuréticos de asa, tales como la furosemide, son de elección y la dosis debe ajustarse de acuerdo a la respuesta de cada paciente. El manejo mediante bolo e infusión continua produce una eliminación hídrica sostenida (recomendación I,C).
El uso de nitratos mejora la congestión pulmonar , sin aumentar el consumo de oxígeno y optimizando la circulación coronaria. Tienen su indicación en la IC en las primeras 24-48 horas del evento coronario agudo , y luego de este plazo, ante isquemia recurrente o disfunción ventricular persistente. Su efecto beneficioso se debe a la venodilatación sistémica, logrando reducir las demandas de oxígeno y con la mejora del flujo sanguíneo coronario. Su rango de dosis va desde la presentación oral de 5 mg en forma sublingual cada 10minutos, no superando los 15 mg, o en perfusión continua a dosis de 20 mg/min hasta 200 mg/min. Su uso esta condicionado por el descenso de la PAS no permitiendo descensos por debajo de 90 mmHg, ni bradicardia menor de 50 mmHg (recomendación I, B).
El nitroprusiato de sodio tiene su indicación cuando existe IC con aumento de la postcarga, debido a HTA generalmente refractaria al tratamiento con nitroglicerina y diuréticos, así como ante insuficiencia mitral aguda (recomendación I,C).
Los IECA están recomendados en las primeras 24 horas, ante IC o FEVI menor del 40% (recomendación I, A).
Se deben iniciar a dosis bajas, con incrementos progresivos, y utilizando fármacos de vida media corta, tales como el captopril a dosis de 6,25 mg/día en más. Su indicación estará condicionada en presencia de PAS menor a 100 mmHg , insuficiencia renal significativa con cifras de creatinina mayor de 3 mg/dl, hiperpotasemia mayor de 5,5 meq/L, estenosis bilateral de las arterias renales, y antecedentes de alergia a los IECA.
Los bloqueantes de los receptores de angiotensina II (ARA II) comparten igual indicación que los IECA, por lo que son una alternativa terapéutica (recomendación I, A). Valsartán y candesartán han demostrado eficacia en esta recomendación.
En la etapa evolutiva de la IC, aquellos pacientes que ya reciben IECA, presentan una FEVI menor del 40% o diabetes, se recomienda que reciban agentes bloqueantes de la aldosterona,como la espironolactona, a dosis progresivas desde 25 mg/día en más (recomendación I,A). Su beneficio se debe a la antagonizacion de los efectos neurohumorales, miocárdicos y vasculares de la aldosterona, tales como retención urinaria de sodio y pérdida de potasio y magnesio, estimulación del sistema nervioso simpático e inhibición del sistema parasimpático.
La digoxina no se recomienda en la etapa de estabilización precoz de la IC. Se recomienda indicarla si existe IC severa, o cuando persisten los síntomas, a pesar del uso de IECA y diuréticos (recomendación I, A). No es conveniente emplear dosis carga, ya que el riesgo de intoxicación es mayor.
Los betabloqueantes tienen su indicación una vez superada la etapa aguda de la IC (recomendación I, A). Podrán indicarse luego de un período de estabilidad clínica bajo tratamiento con diuréticos e IECA, dado que su efecto inotrópico negativo puede anteceder a los efectos favorables, vinculados principalmente al bloqueo neurohormonal. Los BB que han demostrado eficacia en el tratamiento de la IC sistólica son: carvedilol, metoprolol y bisoprolol.
La anticoagulacion con heparina de bajo peso molecular tienen indicación en la fase aguda, asociada a la comodidad de su administración subcutánea y ausencia de necesidad de controles (recomendación I, C).
Con las dosis que se utilizan en la práctica clínica, 1 mg/kg 2 veces al día, la monitorización de la actividad anti Xa no es necesaria, excepto en poblaciones especiales (6).
Ante una congestión pulmonar refractaria, es razonable colocar un catéter en la arteria pulmonar que puede aportar información útil para su manejo (Recomendacion II a,C).
La IC puede presentarse con distintos patrones. De acuerdo con el patrón hemodinámico que predomine, así será congestión pulmonar con o sin bajo gasto cardíaco (GC) y estos, cursar con PAS conservada o no (8).
Los pacientes con congestión pulmonar y con GC conservado (grupo II de Forrester) recibirán diuréticos y vasodilatadores. Aquellos con congestión pulmonar y bajo GC (grupo IV de Forrester) se los manejará de acuerdo a la PAS. Aquellos con PAS mayor de 100 mmHg recibirán vasodilatadores y diuréticos, mientras que lo que cursen con PAS menor de 90 mmHg, pueden evolucionar al shock cardiogénico y es recomendable la colocación de IABC y el uso de inotrópicos con acción alfa predominante (7,8).
La dobutamina en dosis de 2-20 mg/kg/min esta indicada cuando la PAS es mayor de 90 mmHg y hay elementos predominantes de congestión pulmonar (5).
La dopamina en dosis de 5-15 g/kg/min está indicada cuando la PAS es menor de 90 mmHg y hay elementos predominantes de hipoperfusión periférica (5).
La norepinefrina está indicada en dosis de 0,5-30 mg/min cuando la PAS es menor de 70 mmHg (5).
El levosimendan, inotrópico calcio dependiente y con acción vasodilatadora, mejora el bajo gasto y la IC.
La milrinona, inhibidor de la fosfodiesterasa III, tiene efecto inotrópico y vasodilatador.
El BIAC es muy eficaz en el mantenimiento de la condición hemodinámica del paciente, pues mantiene la perfusión periférica y por otra parte favorece la perfusión coronaria.
La CACG debe planificarse lo antes posible(estrategia invasiva urgente) en pacientes con angina severa, persistente o recurrente, con o sin cambios dinámicos del ST, con arritmias mayores o inestabilidad hemodinámica, en el momento del ingreso (5).
BIBLIOGRAFíA
1. Al-Khatib SM, Granger CB, Huang Y, Lee KL, Califf RM, Simoons ML, et al. Sustained ventricular arrhythmias among patients with acute coronary syndromes with no st-segment elevation. incidence, predictors, and outcomes. Circulation 2002; 106: 309-12.
2. Rahimi K, Watzlawek S, Thielel H, Secknus MA, Hayerizadeh BF, Niebauer J, et al. Incidence, time course, and predictors of early malignant ventricular arrhythmias after non-ST-segment elevation myocardial infarction in patients with early invasive treatment. Eur Heart J 2006; 27: 1706–11.
3. Lanza GA, Cianflone D, Rebuzzi AG, Angeloni G, Sestito A, Ciriello G; the Stratificazione Prognostica dell’Angina Instabile Study. Prognostic value of ventricular arrhythmias and heart rate variability in patients with unstable angina. Heart 2006.
4. Sociedad Uruguaya de Cardiología. Segundo Consenso Uruguayo de Insuficiencia Cardíaca. 2000.
5. Sociedad Uruguaya de Cardiología. Consenso Uruguayo de manejo del IAM con elevación del ST. 2005.
6. Guía de práctica clínica de la Sociedad Europea de Cardiologia: SCASEST. 2007
7. Guía de manejo y tratamiento de los sindromes coronarios agudos. Actualización 2006. Comité de cardiopatía isquémica de la Federación Argentina de Cardiología.
8. Guías Europeas de Insuficiencia Cardíaca Aguda 2005. ¿Qué aportan de nuevo?
9. Cáceres S, Montes de Oca O. Revista actualizaciones en Cardiología. Centro Cardiológico Americano. Vol.IV. No.1(4-18).
Abreviaturas utilizadas
AAS: ácido acetil salicílico
ACC: American College of Cardiology
AHA: American Heart Association
ARA-II: antagonistas de los receptores de aldosterona
ARM: asistencia respiratoria mecánica
ATC: angioplastia transluminal coronaria
BAV: bloqueo aurículo-ventricular
BB: beta-bloqueantes
BIAC: balón intraaórtico de contrapulsación
BNP: péptido natriurético B
CA: calcioantagonistas
CACG: cineangiocoronariografía
cpm: ciclos por minuto
CV: cardiovascular
CK MB: creatinfosfoquinasa MB
CRM: cirugía de revascularización miocárdica
ECG: electrocardiograma
DA: descendente anterior
DM: diabetes mellitus
FC: frecuencia cardíaca
FEVI: fracción de eyección del ventrículo izquierdo
FR: factores de riesgo
GC: gasto cardíaco
GP IIB/IIIA: inhibidores de la glicoproteína IIB/IIIA
HbA1c: hemoglobina glicosilada
HBPM: heparina de bajo peso molecular
HFN: heparina no fraccionada
HTA: hipertensión arterial
IAM: infarto agudo de miocardio
IAMSEST: infarto agudo de miocardio sin elevación del segmento ST
IDT: inhibidores directos de la trombina
IECA: inhibidores de la enzima de conversión de la angiotensina
IC: insuficiencia cardíaca
IMC: índice de masa corporal
MS: muerte súbita
MVO2: consumo de oxígeno miocárdico
NYHA: New York Heart Association
O2: oxígeno
PAS: presión arterial sistólica
PCR: paro cardiorespiratorio
PCRhs: proteína C reactiva de alta sensibilidad
PEG: prueba ergométrica graduada
PS: prevención secundaria
NTG: nitroglicerina
RAA: renina-angiotensina-aldosterona
RHCV: rehabilitación cardiovascular
SCA: síndromes coronarios agudos
SCACEST: síndrome coronario agudo con elevación del segmento ST
SCASEST: síndrome coronario agudo sin elevación del segmento ST
SLD: stent liberador de drogas
TCI: tronco de coronaria izquierda
TM: tratamiento médico
TnI: troponina I
TnT: troponina T
UDT: unidad de dolor torácico
VI: ventrículo izquierdo
La realización del presente consenso ha sido posible gracias a una contribución incondicional para educación de GlaxoSmithKline