Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión impresa ISSN 0797-0048versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.24 no.1 Montevideo mayo 2009
ARTÍCULO ORIGINAL
Desproporción prótesis-paciente en la cirugía de sustitución valvular aórtica y mortalidad quirúrgica
DRES. ZULY CORTELLEZZI 1, VERÓNICA GONZáLEZ 1, LEONARDO GONZÁLEZ 2, ALEJANDRO HEUER 2,
ÁLVARO BELTRÁN 3, JORGE POUSO 4, NICOLÁS RUSSO 5, FABIO GUTIÉRREZ 6, DANIEL BIGALLI 7
1. Posgrado de Cardiología, becario del Centro Cardiovascular Casa de Galicia.
2. Cirujano Cardíaco de CICU.
3. Cardiólogo ecocardiografista. Servicio de Cardiología Casa de Galicia.
4. Jefe de Estadística del Departamento de Cardiología de Casa de Galicia.
5. Coordinador de Insuficiencia Cardíaca y Trasplante de CICU.
6. Cirujano Cardíaco de CICU. Profesor Adjunto Cirugía Cardíaca, Hospital de Clínicas, Facultad de Medicina, Universidad de la República.
7. Cirujano Cardíaco, Jefe de Cirugía Cardíaca de CICU.
Centro de Investigación Cardiovascular Uruguayo (CICU). Casa de Galicia.
Correspondencia: Dra. Zuly Cortellezzi. Correo electrónico: zulycortellezzi@gmail.com
Recibido febrero 13, 2009; aceptado abril 17, 2009
RESUMEN
La incidencia de desproporción prótesis-paciente (DPP), expresada como área del orificio efectivo indexada (AOEI), varía entre 19%-70% y su efecto sobre la morbimortalidad es controvertido. Esto es de interés debido a la frecuencia del procedimiento.
Objetivo: determinar la incidencia acumulada de DPP y mortalidad quirúrgica en pacientes elegidos para cirugía de sustitución valvular aórtica (CSVA).
Material y método: entre enero de 2004 y junio de 2007 se realizaron 131 CSVA en portadores de estenosis aórtica. Caso incidente de DPP: si AOEI < 0,85 cm2/m2; moderada, entre 0,85- 0,65 y severa < 0,65. En 13 (9,9%) no fue posible determinar el área del orificio efectivo (AOE). La mortalidad quirúrgica se considera según la Society of Thoracic Surgeons (EE.UU.). Las incidencias acumuladas (IC95%) se calcularon estratificadas por severidad de la DPP. La asociación DPP - mortalidad quirúrgica se exploró por probabilidad exacta.
Resultado: la incidencia acumulada de DPP fue 41/118 (34,7%, IC95%: 26%-44%), moderada en 26/118 pacientes (22,0%, IC95%: 15%-31%) y severa en 15/118 (12,7%, IC95%: 7%-20%). En todos, la mortalidad quirúrgica fue 10/131 (7,6%, IC95%: 4%-14%), y en los que se estimó DPP fue 9/118 (7,6%, IC95%: 4%-14%). En los pacientes sin DPP fue 6/77 (7,8%, IC95%: 3%-17%) similar a los con DPP que fue 3/41 (7,3%, IC95%: 2%-20%), p=1. En la DPP moderada la mortalidad quirúrgica fue 1/26 (3,8% IC95%: 1%-19%) y en DPP severa 2/15 (13%, IC95%: 2%-40%).
Conclusión: más del 30% de los pacientes con CSVA tuvieron DPP, siendo severa en 13%. No se encontró asociación entre DPP y mortalidad quirúrgica.
PALABRAS CLAVE:
CIRUGÍA DE SUSTITUCIÓN VALVULAR AÓRTICA
DESPROPORCIÓN PRÓTESIS-PACIENTE
INCIDENCIA
MORTALIDAD QUIRÚRGICA
SUMMARY
The incidence of prosthesis-patient mismatch (PPM) expressed as the indexed effective orifice area (IEOA) varies between 19%-70% and its effect on morbidity and mortality is controversial. This is of interest because the frequency of the procedure.
Objective: determine cumulative incidence of PPM and surgical mortality in patients selected for aortic valve replacement surgery (AVRS).
Material and method: between January 2004 and June 2007, 131 surgeries for aortic stenosis were done. PPM incident case if AOEI <0,85 cm2/m2; moderate between 0,85-0,65 and severe <0,65. In 13 (9,9%) was not possible to determine EOA. Surgical mortality is considered as the Society of Thoracic Surgeons, USA. The cumulative incidence (95% CI) were calculated stratified by severity of the PPM. The association PPM - surgical mortality was explored by exact test.
Results: The cumulative incidence of PPM was 41/118 (34,7%, 95% CI: 26%-44%), moderate in 26/118 patients (22,0%, 95% CI: 15%-31%) and severe in 15/118 (12,7 %, 95% CI: 7%-20%). In all the surgical mortality was 10/131 (7,6%, 95% CI: 4%-14%), and the PPM was estimated to be 9 / 118 (7,6%, 95% CI: 4%-14%). In patients without PPM was 6 / 77 (7,8%, 95% CI: 3%-17%) similar to the PPM which was 3 / 41 (7,3%, 95% CI: 2%-20%), p=1. In the PPM moderate surgical mortality was 1/26 (3,8%, 95% CI: 1%-19%) and severe PPM 2/15 (13%, 95% CI: 2%-40%).
Conclusion: more than 30% of patients with AVRS had PPM, being severe in 13%. No association was found between PPM and surgical mortality.
KEY WORDS:
AORTIC VALVE REPLACEMENT SURGERY
PROSTHESIS-PATIENT MISMATCH
INCIDENCE
SURGICAL MORTALITY
INTRODUCCIÓN
La desproporción prótesis paciente (DPP) es un concepto introducido en 1978 en los casos de sustitución valvular aórtica y mitral (1). A pesar de haber sido definido hace 30 años, es hoy un tema emergente dentro de la cirugía cardíaca. Esto posiblemente sea debido a un aumento en el número de procedimientos quirúrgicos valvulares y a la controversia que aún existe con respecto a su significado clínico y su efecto sobre la supervivencia postoperatoria (2). Mientras algunos autores han divulgado que no tendría ningún impacto significativo sobre la mortalidad postoperatoria (3,4), otros lo consideran un predictor independiente de mortalidad (5-7).
Rahimtoola (1) definió la DPP cuando el área efectiva de una prótesis, después de su inserción en un paciente, es menor a la de la válvula humana normal.
La DPP es un concepto que inicialmente fue estimado a partir de medidas estáticas, in vitro, de la prótesis, pero posteriormente se han utilizando los gradientes transvalvulares obtenidos por ecocardiografía (in vivo) o de modelos hidrodinámicos (in vitro) para calcularla, estableciendo así un concepto dinámico de área efectiva. Este concepto ha mostrando una mejor correlación con el área efectiva real, dado que la consecuencia de la DPP es fundamentalmente hemodinámica, determinando gradientes transvalvulares significativos a pesar de un funcionamiento normal de la prótesis (8-11).
Con respecto a la incidencia de DPP, si consideramos los estudios pioneros sobre el tema (9,12), varía entre 19%-70%, lo que podría corresponder a las diferencias en las definiciones empleadas. Por ejemplo, si el criterio es el tamaño protésico, algunos utilizan el establecido por el fabricante, otros el área geométrica interna y otros el área del orificio efectivo (AOE), medidas sobre las cuales, además, no existe estandarización de los diferentes tamaños y modelos comerciales. En estudios más recientes, donde se utiliza el AOE para el cálculo de la DPP y valores de corte similares para establecer el significado clínico, se describe una incidencia de DPP entre 25% y 50% (6,13,14), siendo la publicada en la región cercana a 30% (15-17).
El objetivo de este trabajo es determinar la incidencia acumulada de DPP y la mortalidad quirúrgica en una población de pacientes sometidos a cirugía de sustitución valvular aórtica de elección.
MATERIAL Y MÉTODO
Se realizó un estudio observacional utilizando la base de datos empleada por el servicio (SUMMIT, The Society of Thoracic Surgeons-STS) (18), cuya información se recogió en forma prospectiva durante la internación del paciente y hasta el alta quirúrgica.
Se incluyeron todos los pacientes sometidos a primera cirugía de sustitución valvular aórtica, de elección, aislada o combinada con cirugía de revascularización miocárdica (CRM), en el período comprendido entre enero de 2004 y junio de 2007. Se excluyeron aquellos pacientes con procedimiento quirúrgico sobre otra válvula o con insuficiencia valvular aórtica moderada a severa, o ambas (18). Este criterio fue adoptado debido a que el anillo aórtico de los pacientes con estenosis valvular que asocian insuficiencia significativa es mayor, admitiendo válvulas de mayor tamaño (1,12-14).
La DPP fue definida como la razón entre el AOE de la prótesis utilizada y la superficie corporal del paciente, expresada en cm2/m2 (1). La desproporción se consideró como severa cuando el AOE indexada (AOEI) fue £ 0,65 cm2/m2, moderada cuando era >0,65 y <0,85, y clínicamente no significativa o leve cuando era ³ a 0,85. Se utilizaron estas tres categorías según lo definido en publicaciones previas (5,6,12).
En nuestro trabajo el AOE in vivo para la mayoría de los modelos y tamaños protésicos implantados se obtuvo de la bibliografía (19). Para algunos tamaños en cinco modelos valvulares (Hancock II, ATS, Medtronic, Pericarbon More y Mitroflow) no se ha divulgado este valor, por lo cual se utilizó el obtenido por ecuación de continuidad a partir de la realización, en nuestro servicio, de un ecocardiograma a pacientes con dicha prótesis. Como condición previa el paciente debía estar asintomático, su prótesis valvular ser normofuncionante y presentar gradientes transvalvulares normales.
Respecto al tamaño corporal, el estimador más aceptado es la superficie corporal, en cuyo cálculo intervienen peso y talla, siendo solamente el primero un factor modificable. Dado que la superficie corporal es el denominador en el cálculo de la DPP y que depende fuertemente del peso del paciente, cualquier variación de éste incidirá en la DPP.
Se consideró como caso incidente al paciente que luego de realizada la cirugía de sustitución valvular aórtica (CSVA) su AOEI era < 0,85 cm2/m2 (comprendiendo los casos de DPP moderada y severa).
La mortalidad quirúrgica considerada fue la establecida por el SUMMIT (18), que comprende las muertes por cualquier causa dentro de los 30 días luego de la cirugía si el paciente fue dado de alta, o dentro de cualquier intervalo si el paciente continúa internado.
En el período del estudio se realizaron un total de 891 cirugías, de estas 342 fueron cirugías valvulares aisladas o combinadas con CRM, de las cuales 235 fueron valvulares aórticas y de ellas, 131 cumplían los criterios de inclusión. En 13 pacientes (9,9%) no se pudo determinar el AOE de la prótesis utilizada, debido a que hubo pacientes que no se presentaron para la realización de la ecocardiografía y más de un paciente presentaba el mismo modelo y tamaño protésico.
CONSIDERACIONES ESTADÍSTICAS
Se determinó la incidencia acumulada de DPP en todos los pacientes incluidos a través de la proporción entre los casos incidentes de DPP y el total de las cirugías consideradas. Del mismo modo se calculó la incidencia acumulada de muerte quirúrgica.
En ambas incidencias acumuladas se calculó el IC95% según la cuadrática de Fleiss estratificada por severidad de DPP.
La asociación entre DPP y mortalidad quirúrgica se exploró por la prueba de Fisher a dos colas, alfa= 0,05.
RESULTADOS
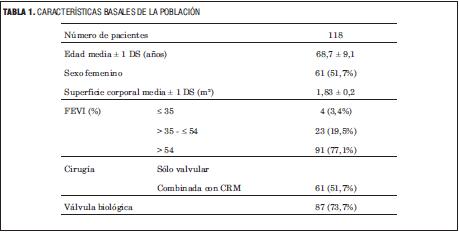
En la tabla 1 se muestran las características basales de la población estudiada.
INCIDENCIA ACUMULADA DE DPP
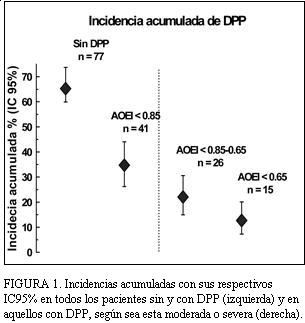
La incidencia acumulada de DPP fue de 41/118 pacientes (34,7%, IC95%: 26%-44%), siendo moderada en 26/118 pacientes (22,0%, IC95%: 15%-31%) y severa en 15/118 (12,7%, IC95%: 7%-20%) (figura 1).
FIGURA 1. Incidencias acumuladas con sus respectivos IC95% en todos los pacientes sin y con DPP (izquierda) y en aquellos con DPP, según sea esta moderada o severa (derecha).
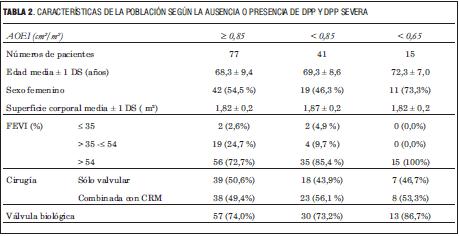
En la tabla 2 se representan las características de la población según la ausencia o presencia de DPP y DPP severo.
En la tabla 3 se representa la distribución de las válvulas biológicas según el número declarado por el fabricante y la ausencia o presencia de DPP.
MORTALIDAD QUIRúRGICA
La mortalidad quirúrgica en todos los pacientes fue de 10/131 (7,6%, IC95%: 4%-14%) y en aquellos con estimación de la DPP fue 9/118 (7,6%, IC95%: 4%-14%). En los pacientes sin DPP fue de 6/77 (7,8%, IC95%: 3%-17%) (figura 2), similar a los con DPP que fue de 3/41 (7,3%, IC95%: 2%-205), p=1. En la DPP moderada la mortalidad quirúrgica fue 1/26 (3,8%, IC95%: 1%-19%) y en DPP severa 2/15 (13%, IC95%: 2%-40%). Cinco pacientes murieron en un plazo entre 1 y 30 días y los restantes entre 31 y 111 días. Las causas de muerte fueron: cardíaca (en dos pacientes sin DPP y uno con DPP severa), infecciosa (en un paciente sin DPP, uno con DPP moderada y uno con DPP severa), neurológica (en dos pacientes sin DPP) y fallo multiorgánico (en un paciente sin DPP). Todas las muertes se produjeron durante la internación.
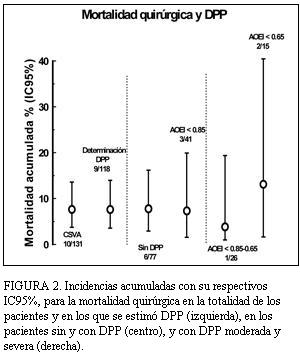
FIGURA 2. Incidencias acumuladas con su respectivos IC95%, para la mortalidad quirúrgica en la totalidad de los pacientes y en los que se estimó DPP (izquierda), en los pacientes sin y con DPP (centro), y con DPP moderada y severa (derecha).
DISCUSIÓN
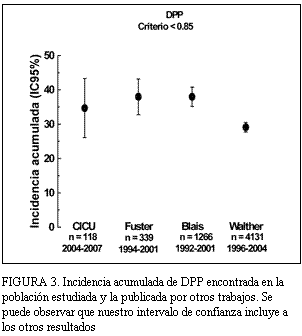
En la población estudiada, la incidencia acumulada de DPP fue de casi 35%, similar a la publicada por otros (figura 3). Sin embargo, para la DPP severa fue sensiblemente mayor (figura 4), sobre todo en relación a los trabajos que incluyeron gran número de pacientes (5,6). Analizando estos resultados, la incidencia global parece ser independiente de los criterios utilizados, pero no la incidencia de DPP severa, lo que puede corresponder, por un lado, a la gran variabilidad entre los valores de AOE publicados y utilizados en los diferentes estudios. Además, en la mayoría de los trabajos se utilizó el AOE calculado por ecocardiografia, pero para algunos tipos de prótesis, en el trabajo de Walther (6) y para todas, en el trabajo de Fuster, se utilizó el AOE calculada in vitro, declarada por el fabricante, la cual es algo mayor a la calculada in vivo (8,12). Por otro lado, los estudios presentan diversos períodos de realización. Como consecuencia, diferentes perfiles de los pacientes incluidos, existiendo cada vez un número mayor de sujetos añosos intervenidos, secundario seguramente a mejoras en las técnicas quirúrgicas empleadas. Los pacientes de mayor edad y del sexo femenino presentan habitualmente un anillo aórtico más calcificado o pequeño, o ambos, admitiendo válvulas de menor tamaño (4,13,20) además, en la mayoría de estos pacientes se utilizan prótesis biológicas, que por razones estructurales ofrecen un AOE menor que las prótesis mecánicas (excepto para las bioprótesis sin soporte) (6,14). Esto nos lleva a plantear una probable mayor incidencia de DPP con el pasar de los años, secundaria a la mayor edad de los pacientes intervenidos y, además, como ya fue planteado por Walther, a un aumento constante en la utilización de válvulas biológicas con una disminución concomitante del uso de prótesis mecánicas. En nuestra población se observó una tendencia a un mayor uso de prótesis biológicas, y dentro de estas las de menor tamaño, con una mayor proporción de añosos y de sexo femenino entre los pacientes con DPP severa (tablas 2 y 3). En contraposición con esto, en el estudio de Blais (5), en más de un tercio de los pacientes se utilizó prótesis biológica sin soporte (stentless), lo cual, como se expresa en varios trabajos (17,21-24), es una estrategia utilizada para evitar la DPP en pacientes con anillo aórtico más pequeño.
FIGURA 3. Incidencia acumulada de DPP encontrada en la población estudiada y la publicada por otros trabajos. Se puede observar que nuestro intervalo de confianza incluye a los otros resultados.
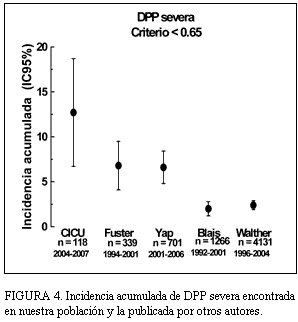
FIGURA 4. Incidencia acumulada de DPP severa encontrada en nuestra población y la publicada por otros autores.
Por último, deben tenerse en cuenta los diferentes criterios de inclusión utilizados en los estudios. Por ejemplo, la inclusión de pacientes con doble lesión aórtica, sobre todo cuando la insuficiencia es moderada a severa (5,6,20) permite la inserción de prótesis de mayor tamaño, dado que el anillo aórtico es mayor. En nuestro trabajo se excluyó esta clase de pacientes lo que podría explicar, en parte, la mayor incidencia de DPP en comparación con los recién mencionados.
Nuestra mortalidad quirúrgica, que coincide con la mortalidad hospitalaria, no mostró diferencias significativas entre los pacientes con y sin DPP siendo la incidencia acumulada de mortalidad en los pacientes con DPP similar a la publicada por Blais, pero la mitad de la encontrada por Walther (tabla 4).
Con respecto a la mortalidad de los pacientes con DPP severa, encontramos una incidencia similar a la publicada por otros (14,20) pero la mitad de la encontrada por Blais. Es importante destacar que los trabajos con menor incidencia de DPP severo son también los que mostraron mayor incidencia acumulada de mortalidad (5,6). Si analizamos este punto en varios trabajos, encontramos que el grupo de pacientes con DPP severa presentó mayor número de cirugía de urgencias (5,6) y/o CRM concomitante (5), variables que influyen en la mayor mortalidad de los pacientes. En nuestro trabajo sólo se incluyeron cirugías de elección, la concomitancia de CRM no fue diferente en el grupo con y sin DPP y todos los pacientes con DPP severa presentaban fracción de eyección del ventrículo izquierdo (FEVI) normal. Como analizamos, existen diferentes criterios de inclusión entre los estudios, lo que no nos permite extraer mayores conclusiones.
LIMITACIONES
Una de las más importantes limitaciones universales del estudio de este tema es la falta de estandarización entre los modelos y tamaños valvulares. Además, para algunos modelos y tamaños utilizados en nuestra población no se contaba con datos publicados sobre el AOE in vivo.
Particularmente, nuestro estudio se afecta en parte por el escaso número de pacientes incluidos, que responde directamente al número de cirugías/año de nuestro servicio, lo que naturalmente limita el alcance de las conclusiones. Por ejemplo, para demostrar que la DPP presenta una mayor incidencia en el sexo femenino, necesitaríamos incluir las cirugías de aproximadamente 40 años, en cambio para demostrar lo mismo en los pacientes con DPP severa, por probabilidad exacta, necesitaríamos al menos el doble de los pacientes incluidos.
Por último, el seguimiento de los pacientes fue a corto plazo, no investigándose la repercusión de la DPP a mediano y largo plazo.
CONCLUSIóN
Más del 30% de los pacientes con CSVA tuvieron DPP, siendo severa en 13%. No se comprobaron en esta población diferencias significativas de mortalidad quirúrgica respecto a la presencia o ausencia de DPP.
BIBLIOGRAFíA
1. Rahimtoola SH. The problem of valve prosthesis-patient mismatch. Circulation 1978; 58: 20-4.
2. Blackstone EH, Cosgrove DM, Jamieson WR, Birkmeyer NJ, Lemmer JH, Miller DC, et al. Prosthesis size and long-term survival after aortic valve replacement. J Thorac Cardiovasc Surg 2003; 126: 783-93.
3. Hanayama N, Christakis GT, Mallidi HR, Joyner C, Fremes S, Morgan C, et al. Patient-prosthesis mismatch is rare after aortic valve replacement: valve size may be irrelevant. Ann Thorac Surg 2002; 73: 1822-9.
4. Howell NJ; Keogh B, Barnet V, Bonser R, Graham T, Rooney S, et al. Patient-prosthesis mismatch does not affect survival following aortic valve replacement. Eur J Cardiothorac Surg 2006; 30: 10-4.
5. Blais C, Dumesnil JG, Baillot R, Simard S, Doyle D, Pibarot P. Impact of prosthesis-patient mismatch on short-term mortality after aortic valve replacement. Circulation 2003; 108: 983-8.
6. Walther T, Rastan A, Falk V, Lehmann S, Garbade J, Funkat A, et al. Patient prosthesis mismatch affects short and long-term outcomes after aortic valve replacement. Eur J Cardiothorac Surg 2006; 30: 15-9.
7. Rao V, Jamieson WRE, Ivanov J, Armstrong S, David TE. Prosthesis-patient mismatch affects survival after aortic valve replacement. Circulation 2000; 102(Suppl 3): III5-III9.
8. Dumesnil JG, Honos GN, Lemieux M, Beauchemin J. Validation and applications of indexed aortic prosthetic valve areas calculated by Doppler echocardiography. J Am Coll Cardiol 1990; 16: 637-43.
9. Dumesnil JG, Yoganathan AP. Valve prosthesis hemodynamics and the problem of high transprosthetic pressure gradients. Eur J Cardiothorac Surg 1992; 6: S34-S38.
10. Pibarot P, Dumesnil JG. Patient-prosthesis mismatch and the predictive use of indexed effective orifice area: is it relevant? Cardiac Surg Today 2003; 1: 43-51.
11. Muneretto C, Bisleri G, Negri A, Manfredi J. The concept of patient-prosthesis mismatch. J Heart Valve Dis 2004; 13: S59-S62.
12. Pibarot P, Dumesnil JG. Hemodynamic and clinical impact of prosthesis-patient mismatch in the aortic valve position and its prevention. J Am Coll Cardiol 2000; 36: 1131-41.
13. Tasca G, Mhagna Z, Perotti S, Berra P, Sabatini T, Amaducci A, et al. Impact of prosthesis-patient mismatch on cardiac events and midterm mortality after aortic valve replacement in patients with pure aortic stenosis. Circulation 2006; 113: 570-6.
14. Fuster RG, Montero J, Albarova OG, Hornero F, Cánovas S, Bueno M, et al. Patient-prosthesis mismatch in aortic valve replacement: really tolerable? Eur J Cardiothorac Surg 2005; 27: 441-9.
15. Rubio M, Borracci R. El ajuste en base al peso ideal en pacientes con sobrepeso y reemplazo valvular aórtico. Rev Argent Cardiol 2005; 73: 90-5.
16. Castro L J, Aradi JM, Fischer AL, Gaudiani VA. Routine enlargement of the small aortic root: a preventive strategy to minimize mismatch. Ann Thorac Surg 2002; 74: 31-6.
17. Borracci R, Rubio M, Bozzone M. Nomograma para determinar el tipo y tamaño mínimo de prótesis valvular que previene el mismatch aórtico. Rev Argent Cardiol 2005; 73: 96-101.
18. STS Adult Cardiac Database. Definition of terms. 2.41. [Base de Datos en Internet] : Society of Thoracic Surgeons. Disponible en: http: //www.sts.org/file/CoreDef241Book.pdf (Consultado 10/02/09)
19. Rosenhek R, Binder T, Maurer G, Baumgartner H. Normal values for Doppler echocardiographic assessment of heart valve prostheses. J Am Soc Echocardiogr 2003; 16: 1116-27.
20. Yap CH, Mohajeri M, Yii M. Prosthesis-patient mismatch is associated with aortic valve replacement. Heart, Lung and Circulation 2007; 16: 260-4.
21. Ennker J, Rosendahl U, Albert A, Dumlu E, Ennker IC, Florath I. Stentless bioprostheses in small aortic roots: impact of patient-prosthesis mismatch on survival and quality of life. J Heart Valve Dis 2005; 14: 523-30.
22. Borger MA, Carson SM, Ivanov J, Rao V, Scully HE, Feindel CM, et al. Stentless aortic valves are hemodynamically superior to stented valves during mid-term follow-up: a large retrospective study. Ann Thorac Surg 2005; 80: 2180-5.
23. Petracek MR. Assessing options for the small aortic root. J Heart Valve Dis 2002; 11(Suppl. 1): S50-S55.
24. Walther T, Falk V, Diegeler A, Gummert J, Autschbach R, Mohr FW. Stentless valve replacement in the small aortic root. Cardiovasc Surg 1997; 5: 229-34.