Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.23 no.3 Montevideo Dec. 2008
TRABAJO ORIGINAL
Respiración periódica y apneas del sueño centrales en pacientes con insuficiencia cardíaca: hallazgos clínicos y fisiológicos
JOSÉ P. ARCOS 1, MANUEL BAZ 2, DANIEL LORENZO 3
CON LA ASISTENCIA TÉCNICA DE LILIÁN CHIAPPELLA 4 Y NANCY OTAÑO 5
1. Profesor Agregado del Instituto de Neumología, Laboratorio de Función Respiratoria, Hospital de Clínicas, Facultad de Medicina, Universidad de la República.
2. Asistente del Centro de Tratamiento Intensivo, Hospital de Clínicas, Facultad de Medicina, Universidad de la República.
3. Investigador del Instituto de Investigaciones Biológicas Clemente Estable.
4. Licenciada en Neurofisiología, Hospital de Clínicas, Facultad de Medicina, Universidad de la República.
5. Licenciada en Neumocardiología, Hospital de Clínicas, Facultad de Medicina, Universidad de la República.
Estudio realizado en el Hospital de Clínicas, Facultad de Medicina, Universidad de la República, financiado en parte por CONYCIT, Fondo Clemente Estable.
Correspondencia: José P. Arcos, Laboratorio de Función Respiratoria, Hospital de Clínicas, Facultad de Medicina, Universidad de la República. Av. Italia s/n, Montevideo. Correo electrónico: jparcos@hc.edu.uy
Recibido julio, 4, 2008; aceptado agosto, 4, 2008
RESUMEN
Introducción: los trastornos respiratorios del sueño son frecuentes en la población general y en especial entre los pacientes con insuficiencia cardíaca severa. La ocurrencia de respiración periódica de Cheyne-Stokes con apneas centrales (RPCS-AC) durante el sueño, agrava el pronóstico y aumenta significativamente la mortalidad a corto plazo. El objetivo de este estudio fue determinar la prevalencia de este trastorno y las características clínico-fisiológicas de los pacientes en nuestro medio.
Material y método: se estudiaron 35 pacientes con insuficiencia cardíaca, sin respiración periódica en vigilia, a los que se les realizó polisomnografía, ecocardiograma, espirometría, gasometría arterial y evaluación de los resultados funcionales del sueño.
Resultados: se diagnosticó RPCS-AC en 13 pacientes (37%). Los pacientes con RPCS-AC tuvieron un sueño significativamente más fragmentado (ID/h = 32,9 ± 19,4 versus 15,8 ± 14,3, p <0,001); más tiempo en sueño superficial (S1-2 = 77,4 ± 20,1% versus 63,0 ± 16,7%, p = 0,029); menos tiempo en sueño paradojal (REM = 9,9 ± 6,3% versus 16,6 ± 9,8%, p = 0,035) y mayor tiempo en hipoxia severa durante el sueño (TA<90% = 28,4 ± 29,0% versus 2,4 ± 4,7%, p = 0,008). No existieron diferencias en la función cardíaca, el ECG, la espirometría, los gases en sangre en vigilia, ni en las repercusiones funcionales del sueño.
Conclusiones: la RPCS-AC es un trastorno frecuente en la insuficiencia cardíaca avanzada que determina repercusiones adversas sobre la estructura del sueño y la oxigenación arterial.
PALABRAS CLAVE:
APNEA DEL SUEÑO CENTRAL
INSUFICIENCIA CARDÍACA
TRASTORNOS RESPIRATORIOS
SUMMARY
Introduction: sleep breathing disorders are common in general population and particularly among patients with severe heart failure. The occurrence of Cheyne Stokes periodic breathing with central apneas (RPCS-AC) during sleep, worsens the prognosis and significantly increases short term mortality. The objective of this study was to determine the prevalence of this disorder and the clinic-physiological features of patients in our hospital.
Methods: thirty-five consecutive patients with heart failure, without periodic respiration during wakefulness were studied with polisomnography, echocardiogram, spirometry, arterial blood gases and functional outcomes of sleep.
Results: thirteen patients were diagnosed with RPCS-AC (37%). Patients with RPCS-AC had significantly more fragmented sleep (ID)/h = 32,9 ± 19,4 versus 15,8 ± 14,3, p<0,001); more time in superficial sleep (S1-2 = 77,4 ± 20,1% versus 63,0 ± 16,7%, p = 0,029); less time in paradoxical sleep (REM = 9,9 ± 6,3% versus 16,6 ± 9,8%, p = 0,035) and more time in severe hypoxia during sleep (TA<90% = 28,4 ± 29,0% versus 2,4 ± 4,7%, p = 0,008). There were no differences in cardiac function, EGG, spirometry, arterial blood gases during wakefulness, neither in sleep functional outcomes.
Conclusions: RPCS-AC is a frequent disorder in advanced heart failure patients, that causes adverse consequences on sleep structure and arterial oxygenation.
KEY WORDS:
SLEEP BREATHING DISORDERS
CENTRAL SLEEP APNEA
HEART FAILURE
INTRODUCCIóN
La insuficiencia cardíaca es un estado fisiopatológico con alta prevalencia en la población general. En nuestro país se estima en 17/1.000 de los pacientes asistidos (1). Es una entidad de elevada mortalidad con un promedio de sobrevida, al momento del diagnóstico, de cinco años (2). Los trastornos respiratorios del sueño son también muy frecuentes en los adultos (3). En particular, en pacientes con insuficiencia cardíaca en etapas avanzadas se observan apneas de mecanismo central por abolición del impulso neuromuscular inspiratorio (4), que se diferencian claramente de las apneas de mecanismo obstructivo por colapso de la vía aérea orofaríngea. Este trastorno, que se acompaña en general de respiración periódica de Cheyne-Stokes (RPCS-AC) alcanza, en algunas series publicadas, hasta el 40% de los pacientes con insuficiencia cardíaca (5,6).
Esta alteración del mecanismo de control de la respiración, descrita y conocida desde el siglo XIX (7), ha recibido atención en años recientes debido a que las nuevas tecnologías de estudio han abierto el camino a potenciales recursos terapéuticos. La RPCS-AC es un fenómeno que puede observarse durante la vigilia, pero que tiene un importante componente dependiente del estado fisiológico del sueño. Con frecuencia, enfermos sin trastornos del ritmo respiratorio en vigilia presentan RPCS-AC durante el sueño. Su ocurrencia provoca episodios de hipoxia-reoxigenación severos, por lo que es esperable que se haya encontrado asociada a mayor mortalidad, a una más rápida progresión de la enfermedad, y al requerimiento de trasplante cardíaco más precoz. El tratamiento de la RPCS-AC en la insuficiencia cardíaca avanzada suprime las apneas, mejora sus consecuencias fisiopatológicas y potencialmente puede mejorar la sobrevida (8).
No es completamente conocido cómo predecir la aparición de este trastorno durante el sueño, por lo que es necesario avanzar en criterios predictivos, que indiquen la necesidad de estudio en pacientes con insuficiencia cardíaca avanzada. La somnolencia diurna, medida objetivamente, se ha encontrado aumentada en algunas series, aunque existen datos contradictorios. Los cuestionarios que evalúan la somnolencia y la función reparadora del sueño no han sido aplicados sistemáticamente en este tipo de pacientes.
Realizamos un estudio con el fin de caracterizar el tipo de trastornos respiratorios del sueño y sus consecuencias en pacientes con insuficiencia cardíaca, y para evaluar la capacidad predictiva de los datos clínicos y de la función pulmonar obtenidos en vigilia.
MATERIAL Y MéTODO
Se estudiaron 35 pacientes consecutivos del Hospital de Clínicas con insuficiencia cardíaca sintomática, en etapa estable de su enfermedad. El proyecto fue presentado al Comité de Ética del Hospital de Clínicas. Se incluyeron en el estudio siempre que en el ecocardiograma presentaran una disfunción sistólica con una fracción de eyección del ventrículo izquierdo igual o menor a 35%. El estudio ecocardiográfico fue realizado en el Departamento de Cardiología del Hospital de Clínicas (ACUSON Sequoia C512). Se excluyeron del estudio si presentaban respiración periódica en vigilia. Para descartarlo, se observaron los movimientos torácicos y abdominales respiratorios en posición sentada durante cinco minutos, buscando alteraciones del ritmo respiratorio, pausas y aumentos o reducciones ostensibles de la amplitud de la excursión respiratoria.
Se realizó una historia clínica codificada dirigida a trastornos del sueño y se aplicó el cuestionario de resultados funcionales del sueño FOSQ (9). Se estudió la función respiratoria en vigilia con: espirometría (Vmáx, SensorMedics), gases en sangre arterial en vigilia (ABL330, Radiometer). Durante el sueño se realizó polisomnografía de noche completa (ATI Delphos) con registro simultáneo de: video con luz infrarroja, posición corporal, electroencefalograma, electrooculograma, electromiograma mentoniano y de miembros, micrófono en el cuello, electrocardiograma, flujo aéreo nasal y bucal (termistor), movimientos respiratorios abdominales y torácicos (sensor piezoeléctrico) y saturación de oxígeno del pulso. La estadificación del sueño se realizó en forma manual mediante lectura del registro diferida, siguiendo criterios estandarizados (10).
A partir del registro se calculó: tiempo total de registro (TTR); eficiencia del sueño (TTS%: tiempo total de sueño en porcentaje del TTR); tiempo en distintos estadios de sueño, expresados en porcentaje del TTS (S1, S2, S3, S4, REM), índice de despertares por hora de sueño (ID/h), índice de apneas e hipopneas por hora de sueño (IAH/h), índices de apneas e hipopneas centrales (sin esfuerzo inspiratorio) por hora de sueño (IAHC/h), índice de apneas e hipopneas obstructivas (con esfuerzo inspiratorio) por hora de sueño (IAHO/h), número de episodios de RPCS por hora de sueño (RPCS/h) y tiempo acumulado con saturación de oxígeno del pulso menor a 90% (TA<90%).
Se utilizaron las siguientes definiciones: polisomnografía con RPCS-AC, cuando existieron ciclos de volumen corriente creciente-decreciente con duplicación del volumen basal, de aproximadamente 60 segundos de duración, o apneas centrales (sin esfuerzo inspiratorio) con un IAHC/h mayor a 10; polisomnografía sin RPCS-AC: IAHC/h menor a 10. Debido a que a lo largo de la noche de sueño se registran sucesivamente apneas centrales y apneas obstructivas, se catalogó como el trastorno como central cuando el IAH/h fue mayor a 10 con un IAHO/h menor a 10. En los casos en que hubo apneas obstructivas en número significativo, el trastorno se catalogó como predominantemente central cuando la relación IAHC/IAHO era mayor a 0,5. Este criterio, si bien es arbitrario, ya que cataloga al trastorno cuando las apneas centrales son más que la mitad de las totales, ha sido utilizado ampliamente (6,17).
El análisis estadístico de las diferencias entre grupos se realizó mediante el uso de test de t para muestras independientes, y chi cuadrado según correspondiese.
RESULTADOS
Se estudiaron 35 pacientes, (33 hombres y 2 mujeres), con una edad promedio de 65,0 ± 11,1 años. La etiología de las cardiopatías mostró la siguiente distribución: 18 con cardiopatía isquémica, 16 pacientes con miocardiopatía dilatada y un paciente con insuficiencia aórtica. Dieciocho pacientes estaban en fibrilación auricular en el momento del estudio. La fracción de eyección del ventrículo izquierdo promedio del grupo fue de 26,8 ± 6,3%. Todos estaban sintomáticos y en etapa estable el momento de la polisomnografía, con disnea clase funcional III y IV.
La historia clínica mostró escasa sintomatología funcional diurna vinculada a trastornos del sueño. De los síntomas que aparecieron durante el sueño, se destacó la inquietud y los movimientos corporales relatados por los acompañantes. No consignaron ronquido significativo ni observación de apneas ostensibles. De los síntomas de la vigilia se buscó especialmente la somnolencia, que si bien estuvo presente en todos los pacientes, no fue un hecho relevante en el grupo con RPCS-AC. Los datos clínicos y fisiológicos se resumen en la tabla 1, agrupados según presentaran o no RPCS-AC en la polisomnografía.
IMC: índice de masa corporal; IECA: inhibidor de la enzima de conversión de la angiotensina; FEVI: fracción de eyección del ventrículo izquierdo; VIS: diámetro sistólico del ventrículo izquierdo; VID: diámetro diastólico del ventrículo izquierdo; AI: aurícula izquierda; VD: ventrículo derecho; CVF: capacidad vital forzada; VEF1s: volumen espiratorio máximo en 1 segundo. FOSQ: puntaje del cuestionario Resultados Funcionales del Sueño. Valores expresados en media ± desvío estándar.
La capacidad vital se encontró en el límite inferior de la normalidad (83,9 ± 19,5%), sin diferencias significativas entre los dos grupos. Los gases en sangre mostraron PaO2 normal (88,3 ± 19,7), con PaCO2 disminuida (36,8 ± 3,5 T), sin diferencias entre grupos.
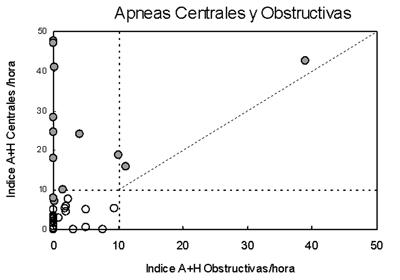
Los datos polisomnográficos se resumen en la tabla 2 (también agrupados según RPCS-AC). Trece pacientes presentaron RPCS-AC durante el sueño. En dos de ellos se registró RPCS con menos de diez apneas por hora. La prevalencia global del trastorno en el grupo es de 37%. Tres pacientes asociaron apneas obstructivas, pero el trastorno fue predominantemente central (figura 1). Ningún paciente se presentó exclusivamente con apneas-hipopneas de tipo obstructivo. Las apneas centrales y los períodos RPCS se observaron exclusivamente en estadio de sueño No REM (figura 2).
Figura 1. Relación entre apneas de mecanismo central y apneas de mecanismo obstructivo. Círculos llenos: pacientes con RPCS. Círculos abiertos: pacientes sin RPCS. Las líneas punteadas marcan los límites normales de los índices apneas/hora. La línea diagonal es el valor de identidad (apneas centrales y obstructivas en igual número).
Figura 2. Trazado representativo de un período de respiración periódica con apneas centrales. Hipnograma: esquema de estadios de sueño. El paciente está en estadio I (sueño superficial) y se despierta en dos oportunidades coincidiendo con los períodos de hiperventilación. Flujo: flujo respiratorio medido en nariz y boca. Se observan cinco apneas en cinco minutos, seguidas de períodos de ventilación creciente-decreciente. Tórax y abdomen: la ausencia de movimientos respiratorios del tórax y del abdomen durante las apneas, indica su mecanismo central (sin esfuerzo inspiratorio). SpO2: dips de desaturación del pulso de oxígeno siguiendo a apneas, con recuperación del valor normal durante la hiperventilación. FC: frecuencia cardíaca a partir del ECG.Taquicardia durante la hiperventilación con despertar.
El análisis de los parámetros respiratorios durante el sueño del grupo de pacientes con RPCS-AC versus pacientes sin RPCS-AC mostró (por definición) más apneas totales: IAH/h = 37,1 ± 21,8 versus 3,7 ± 2,8 (p<0,001); más apneas centrales IAHC/h = 28,8 ± 15,4 versus 2,3 ± 2,5 (p<0,001) y mayor número de episodios de RPCS por hora de sueño: 8,9 ± 17,8 versus 0,0 ± 0,0 (p<0,001). El tiempo acumulado con saturación de la hemoglobina por oxígeno inferior a 90%, expresado como porcentaje de TTS, correspondió a 23,2 ± 24,4% versus 2,4 ± 4,7% (p = 0,008).
La estructura del sueño se encontró alterada en todos los pacientes. La latencia al sueño fue prolongada y la eficiencia del sueño (TTS%) estuvo disminuida en los dos grupos: 54,8 ± 20,5% y 60,4 ± 19,4%. Los pacientes con RPCS-AC mostraron más sueño superficial: 77,4 ± 20,1% versus 63,0 ± 16,7% (p= 0,029) y menos tiempo en sueño REM: 9,9 ± 6,3% versus 16,6 ± 9,8% (p= 0,035). El sueño estuvo más fragmentado en los pacientes con apneas: ID/h= 32,9 ± 19,4 versus 15,8 ± 14,3 (p<0,001). Se presentaron movimientos periódicos de los miembros inferiores en 12 pacientes, cinco de los cuales mostraban RPCS: MPMMII/h = 38,3 ± 19,7 y 27,6 ± 21,1.
DISCUSIóN
El creciente interés científico por el estudio de la RPCS-AC en la insuficiencia cardíaca, proviene de su reconocimiento como predictor independiente de mortalidad (11,12). Una vez que se instala la RPCS-AC en el sueño, parece perdurar en el tiempo, pese a la optimización del tratamiento médico. Por esta razón se han intentado otros tratamientos, como la aplicación de presión positiva por vía nasal en forma no invasiva durante el sueño. Esta modalidad terapéutica, que reduce el edema pulmonar y suprime las apneas (13), se basa en un modelo fisiopatológico que explica el trastorno de la siguiente manera: durante el decúbito, el desplazamiento cefálico de fluidos exagera el estímulo reflejo vagal aferente, induciendo mayor hiperventilación e hipocapnia. Al conciliar el sueño, las oscilaciones del umbral de apnea durante el período de transición sueño-vigilia ponen al sistema de control ventilatorio en una situación vulnerable, y puede suprimirse el impulso neuromuscular inspiratorio por disminución de la PaCO2. Luego de algunos segundos, debido a la retención de CO2, reaparece el estímulo y comienza un ciclo ventilatorio. Este período respiratorio carece de la amortiguación fisiológica que regula el volumen corriente. El mecanismo responsable parece ser una inestabilidad del circuito de control ventilatorio, con ganancia incrementada de los quimiorreceptores. Probablemente la velocidad circulatoria enlentecida module también la longitud temporal del ciclo respiratorio periódico. Se instala así un período de ventilación creciente, que se detiene al llegar a una hipocapnia extrema, decreciendo luego hasta una nueva apnea central (14). Estos ciclos se acompañan de hipoxia-reoxigenación episódica durante el sueño y desencadenan una activación simpático-adrenal (15). Este mecanismo determinaría una agravación de la disfunción ventricular, una más rápida progresión de la insuficiencia cardíaca y una mayor probabilidad de ocurrencia de arritmias malignas determinantes de muerte súbita.
Los pacientes de nuestro estudio, si bien no fueron seleccionados al azar, mostraron una distribución etiológica de sus cardiopatías que resultó ser una muestra representativa de la observación clínica habitual en la atención de insuficiencia cardíaca del Hospital de Clínicas. La presencia de fibrilación auricular crónica estuvo presente en una proporción significativa, pero no constituyó un factor predictivo de apneas del sueño. En otras series, esta arritmia, conjuntamente con el sexo masculino, la edad mayor a 60 años, y la PaCO2 en vigilia menor a 38 T, se ha correlacionado con la ocurrencia de respiración periódica en el sueño (16). En nuestros pacientes la PaCO2 en vigilia fue menor que la normal, sin diferencias entre ambos grupos de pacientes (tabla 2). Tampoco hubo diferencias en cuanto al grado de disfunción sistólica, la edad, el índice de masa corporal y la espirometría.
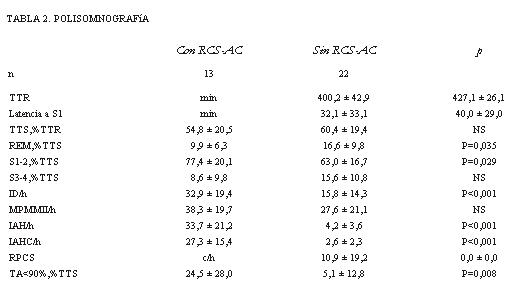
TTR: tiempo total de registro; Latencia a S1: tiempo desde el comienzo del registro hasta el comienzo del sueño; TTS: eficiencia del sueño (tiempo total de sueño en% del TTR); REM: tiempo en estadio de movimientos oculares rápidos (en% del TTS); S1-2 y S3-4: tiempo en estadios de sueño 1-2 y 3- 4 (en% del TTS); ID/h: índice de microdespertares por hora de sueño; IAH/h: índice de apneas + hipopneas por hora de sueño; IAHC/h: índice de apneas + hipopneas centrales por hora de sueño; RCS: ciclos de respiración periódica por hora de sueño; TA<90%: tiempo acumulado con SpO2 <90% (en% del TTS). MPMMII/h: movimientos periódicos de los miembros inferiores por hora de sueño. Valores expresados en media ± desvío estándar.
Encontramos RPCS-AC en 37% de la muestra analizada, cifra similar a series internacionales. Utilizamos un límite de corte en el índice de apneas-hipopneas por hora de sueño (10/h), superior al límite habitualmente usado en el síndrome de apneas-hipopneas obstructivas (5/h), para evitar el sobre-diagnóstico y no incluir pacientes con apneas centrales de la transición sueño-vigilia, que pudieran ser normales. La asociación de RPCS-AC con apneas de tipo obstructivo, por colapso de la orofaringe, puede ser frecuente y tiene implicancias terapéuticas. La utilización de un diagrama como el presentado en la figura 1 es útil para completar el diagnóstico, ya que el predominio de un tipo de apneas es fácilmente visible.
Los estudios retrospectivos han encontrado una prevalencia variable entre 30% y 40% (16,17). Estos estudios presentan sesgos de selección e incluyen pacientes no tratados con betabloqueantes. Cuando se han corregido factores de confusión y se han estudiados enfermos tratados óptimamente, en forma prospectiva, se ha encontrado una prevalencia algo menor: 15% para Ferrier y colaboradores (18); 21% en el estudio de Wang y colaboradores (19); alguna forma de trastorno respiratorio del sueño en 61% de los pacientes y RPCS-AC en 31% para Mac Donald y colaboradores (20). Más allá de estas diferencias, parece ser un trastorno bastante común, con una implicancia clínica relevante. Los estudios que han buscado específicamente su repercusión sobre la mortalidad han mostrado una menor sobrevida, o una progresión más rápida al trasplante. En la revisión de Yumino y colaboradores (21) se informan siete estudios publicados, de los cuales cinco han mostrado mayor mortalidad o progresión acelerada al trasplante. Las conclusiones son limitadas, ya que han incluido sólo 479 pacientes, y han sido realizados contemporáneamente con la acelerada penetración de los betabloqueantes y la espirolactona en el tratamiento, desde la demostración su eficacia en ensayos clínicos. Tal es el caso del estudio CANPAP, realizado entre 1998 y 2000 (22). Serán necesarios más estudios prospectivos para determinar con mayor exactitud la implicancia clínica de la RPCS- AC sobre la mortalidad. Muy probablemente en el futuro no puedan realizarse controles contra placebo, sino que será necesario incluir en el diseño alguna modalidad de tratamiento. El uso de acetazolamida ha mostrado eficacia en suprimir las apneas (23), y la CPAP nasal durante el sueño mejoró la función del ventrículo izquierdo y la sobrevida sin trasplante, siempre que las apneas centrales fueran suprimidas al inicio del tratamiento (24).
El tiempo transcurrido con hipoxia durante el sueño fue significativamente mayor en pacientes con RCS-AC. Siguiendo a cada apnea, la saturación de la hemoglobina por el oxígeno disminuye episódicamente, volviendo a su valor previo luego de la hiperventilación (figura 2). El tiempo acumulado durante el sueño que transcurre en hipoxia (tiempo con SpO2 menor a 90%), es la suma de la duración en estos “dips” de desaturación. Este hecho fisiopatológico daría cuenta de la mayor liberación de catecolaminas, y quizá esté vinculado al peor pronóstico. Los pacientes sin RPCS-AC mantuvieron la SpO2 en valores normales durante el sueño. Es posible que este hallazgo sea altamente específico. Encontrar desaturación durante el sueño en este tipo de pacientes seguramente indica RPCS-AC o patología pulmonar asociada.
La estructura del sueño se encontró alterada en todos los pacientes. La disminución de la eficiencia del sueño es un hecho relevante, ya que está en valores inferiores a nuestra población de enfermos con apneas obstructivas (25). A diferencia de este tipo de pacientes, quienes concilian el sueño precozmente, revelando su somnolencia excesiva, este grupo mostró una latencia al sueño prolongada. En ese sentido tanto la evaluación clínica como el cuestionario de resultados funcionales del sueño muestran que la somnolencia puede ser un hecho presente en la insuficiencia cardíaca, pero no particularmente predominante en los pacientes con RPCS-AC. El FOSQ investiga diversas áreas funcionales que pueden ser afectadas por una mala calidad del sueño, y ha mostrado buena sensibilidad para su detección cuando se ha aplicado al síndrome de apneas-hipopneas obstructivas. Los puntajes encontrados (26) para individuos normales, sin trastornos del sueño son: puntaje total = 21,8 ±1,8; actividad = 21,4 ± 2,9; vigilancia = 20,5 ± 4,3; intimidad = 22,3 ± 3,9; calidad de vida social = 22,6 ± 3,3; capacidades generales = 22,3 ± 2,7. Los puntajes de todos nuestros pacientes se encontraron marcadamente disminuidos con respecto a estos valores. Otros estudios han encontrado somnolencia significativa (27).
La fragmentación del sueño, cuantificada como despertares por hora, fue mayor en los pacientes con apneas, y estuvo en un rango similar al del síndrome de apneas obstructivas. Sin embargo, los despertares tienen un mecanismo particular, ya que se producen luego de comenzada la ventilación, en general coincidiendo con el máximo de volumen corriente alcanzado. Esta reacción se acompaña de movimientos muy aparatosos, que son confundidos con períodos de excitación psicomotriz, cuando en realidad dependen de los amplios movimientos respiratorios. En nuestra práctica clínica, cuando lo hemos buscado específicamente, hemos encontrado frecuentemente este síntoma. La estructura del sueño alterada depende también de otros factores responsables, como los movimientos periódicos de los miembros, de alta frecuencia en pacientes con ICC, cuyo mecanismo no ha sido aún dilucidado (25). Clínicamente, este grupo se diferencia de los pacientes con síndrome de apneas-hipopneas del sueño de tipo obstructivo, cuyos síntomas principales son el ronquido y la somnolencia diurna excesiva persistente. Contrariamente, sus síntomas nocturnos son los movimientos durante el sueño y no hay ronquido ni apneas presenciadas.
Los hallazgos de la función pulmonar en vigilia no resultaron factores predictivos de RPCS-AC durante el sueño. La PaCO2 disminuida parece ser el hallazgo fisiológico mas frecuente, pero en nuestros pacientes no pudo discriminar a priori la ocurrencia del trastorno en el sueño. Es esperable que su valor disminuya en una población de pacientes que hiperventila como consecuencia de la congestión pulmonar.
CONCLUSIONES
La RPCS-AC es un fenómeno frecuente en pacientes con insuficiencia cardíaca avanzada. Si bien se han descrito signos que pueden predecir su ocurrencia durante el sueño, su hallazgo no es universal. Las formas de presentación clínico-fisiológicas fueron similares en pacientes con y sin RCS-AC. La estructura del sueño se encontró severamente alterada en todos los pacientes, independientemente de la ocurrencia de RCS-AC. La fragmentación del sueño y el tiempo en hipoxia están significativamente aumentados en pacientes con RCS-AC.
AGRADECIMIENTOS
Al Departamento de Cardiología del Hospital de Clínicas, por la colaboración en la selección de pacientes y la realización de los ecocardiogramas.
BIBLIOGRAFíA
1. Sociedad Uruguaya de Cardiología. Segundo consenso uruguayo de insuficiencia cardíaca. Rev Urug Cardiol 2001; 16: 31-56.
2. Hunt SA, Abraham WT, Chin MH, Feldman AM, Francis GS, Ganiats TG, et al. ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult. J Am Coll Cardiol 2005; 46: 1-82.
3. Young T, Peppard PE, Gottlieb DJ. Epidemiology of obstructive sleep apnea: a population health perspective. Am J Respir Crit Care Med 2002; 165: 1217-39.
4. Leung RST, Bradley TD. Sleep apnea and cardiovascular disease. Am J Respir Crit Care Med 2001; 164: 2147-5.
5. Shahar E, Whitney CW, Redline S, Lee ET, Newman AB, Javier Nieto F, et al. Sleep-disordered breathing and cardiovascular disease: cross-sectional results of the Sleep Heart Health Study. Am J Respir Crit Care Med 2001; 163: 19–25.
6. Kohnlein T, Welte T, Tan LB, Elliot MW. Central sleep apnoea syndrome in patients with chronic heart disease: a critical review of the current literature. Thorax 2002; 57: 547-4.
7. Cheyne J. A case of apoplexy in which the fleshy part of the heart was converted into fat. Dublin Hospital Reports II, 1818; 2: 216-23
8. Bradley TD, Logan AG, Kimoff RJ, Sériès F, Morrison D, Ferguson K, et al. Continuous positive airway pressure for central sleep apnea and heart failure. N Engl J Med 2005; 353: 2025-33.
9. Weaver TE, Laizner AM, Evans LK, Maislin G, Chugh DK, Lyon K, et al. An instrument to measure functional status outcomes for disorders of excessive sleepiness. Sleep 1997; 20: 835-43.
10. Rechtschaffen A, Kales A. Manual of standarization of terminology. Technique and scoring system for sleep stages of human subjects. NIH publication n.204. Washington, DC: Government Printing Office; 1968.
11. Hanly PJ, Zuberi-Khokhar NS. Increased mortality associated with Cheyne-Stokes respiration in patients with congestive heart failure. Am J Respir Crit Care Med 1996; 153: 272-6.
12. Lanfranchi PA, Braghiroli A, Bosmini E, Mazzuero G, Colombo R, Donner CF, et al. Prognostic value of nocturnal Cheyne-Stokes respiration in chronic heart failure. Circulation 1999; 99: 1435-40.
13. Naughton MT, Bernard DC, Rutherford R, Bardley TD. Effect of continuous positive pressure on central sleep apneas and nocturnal PCO2 in heart failure. Am J Respir Crit Care Med 1994; 150: 1598-604.
14. Javaheri S. A mechanism of central sleep apnea in patients with heart failure. N Engl J Med 1999; 341: 949-54.
15. Naughton MT, Bernard DC, Liu PP, Rutherford R, Rankin F, Bradley TD. Effects of nasal CPAP on sympathetic activity in patients with heart failure and central sleep apnea. Am J Respir Crit Care Med 1995; 152: 473-9.
16. Sin DD, Fitzgerald F, Parker JD, Newton G, Floras JS, Bradley TD. Risk factors for central and obstructive sleep apnea in 450 men and women with congestive heart failure. Am J Respir Crit Care Med 1999; 160: 1101-6.
17. Javaheri S, Parker TJ, Liming JD, Corbett WS, Nishiyama H, Wexler L, et al. Sleep apnea in 81 ambulatory male patients with stable heart failure. Types and their prevalences, consequences, and presentations. Circulation 1998; 97: 2154-9.
18. Ferrier K, Campbell A, Yee B, Richards M, O’Meeghan T, Weatherall M, et al. Sleep-disordered breathing occurs frequently in stable outpatients with congestive heart failure. Chest 2005; 128: 2116-22.
19. Wang H, Parker JD, Newton GE, Floras JS, Mak S, Chiu KL, et al. Influence of obstructive sleep apnea on mortality in patients with heart failure. J Am Coll Cardiol 2007; 49: 1625–31.
20. MacDonald M, Fang J, Pittman SD, White DP, Malhotra A. The current prevalence of sleep disordered breathing in congestive heart failure patients treated with beta-blockers. J Clin Sleep Med 2008; 15:38-42.
21. Yumino D, Bradley TD. Central Sleep Apnea and Cheyne-Stokes Respiration. Proc Am Thorac Soc 2008; 5: 226-36.
22. Bradley TD, Logan AG, Kimoff RJ, Series F, Morrison D, Ferguson K, et al. Continuous positive airway pressure for central sleep apnea and heart failure. N Engl J Med 2005; 353: 2025-33.
23. Arzt M, Floras JS, Logan AG, Kimoff RJ, Series F, Morrison D, et al. Suppression of central sleep apnea by continuous positive airway pressure and transplant-free survival in heart failure: a post hoc analysis of the Canadian Continuous Positive Airway Pressure for Patients with Central Sleep Apnea and Heart Failure Trial (CANPAP). Circulation 2007; 115: 3173-80.
24. Javaheri S. Acetazolamide improves central sleep apnea in heart failure: a double-blind, prospective study. Am J Respir Crit Care Med 2006; 173: 234-7.
25. Chiappella L, Otaño N, Arcos JP. Estructura del sueño alterada en pacientes con insuficiencia cardiaca. Congreso de la Federación Latinoamericana de Sueño, 11. Santiago, 2006.
26. Büttner A, Feier C, Galetke W, Rühle KH. A questionnaire to capture the functional effects of daytime drowsiness on quality of life in case of obstructive sleep apnea syndrome. Functional Outcomes of Sleep Questionnaire (FOSQ). Pneumologie 2008; 62: 548-52.
27. Hanly P, Zuberi-Khokhar N. Daytime sleepiness in patients with congestive heart failure and Cheyne-Stokes respiration. Chest 1995; 107: 952-8.