Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.22 no.1 Montevideo jun. 2007
ARTÍCULO ORIGINAL
El endotelio mantiene elevada la capacidad de conducción arterial y reduce la poscarga dinámica ventricular de una manera frecuencia-dependiente *
DRA. YANINA ZóCALO 1, MSC. DANIEL BIA 2, MSC. ING. FRANCO PESSANA 3,
DR. ING. RICARDO ARMENTANO 4, DR. EDMUNDO CABRERA-FISCHER 5
2. Profesor Adjunto (Grado 3) del Departamento de Fisiología, Facultad de Medicina, Universidad de la República, Montevideo, Uruguay. Becario de Doctorado, PEDECIBA-PNUD.
3. Secretario Académico. Director del Departamento de Tecnología de la Información. Profesor Titular. Investigador. Facultad de Ingeniería y Ciencias Exactas y Naturales, Universidad Favaloro, Buenos Aires, Argentina.
4. Prof. Agregado (Grado 4) del Departamento de Fisiología, Facultad de Medicina, Universidad de la República, Montevideo, Uruguay. Investigador Grado 5, PEDECIBA-Biología. Decano de la Facultad de Ingeniería, Ciencias Exactas y Naturales, Universidad Favaloro, Buenos Aires, Argentina.
5. Investigador Grado 5, PEDECIBA-Biología (Uruguay) y CONICET (Argentina). Profesor Adjunto Depto. Tecnología Biomédica de la Universidad Favaloro, Buenos Aires, Argentina.
Correspondencia: Dra. Yanina Zócalo. General Flores 2125. CP 11800, Departamento de Fisiología, Facultad de Medicina, Universidad de la República, Montevideo, Uruguay. Correo electrónico: yana@fmed.edu.uy.
* Este trabajo obtuvo el premio de Tema Libre Destacado en el 22º. Congreso Uruguayo de Cardiología.
Recibido febrero 27, 2007; aceptado mayo 3, 2007.
RESUMEN
Introducción: Las propiedades geométricas y la viscosidad (V) y elasticidad (E) arteriales son determinantes de la función de conducción (FC) y amortiguamiento arterial (FA), así como del trabajo elástico (WE) y viscoso (WV) desarrollado por el ventrículo durante la eyección (poscarga dinámica externa). Se desconoce el rol endotelial en el control de la V, FC, FA, WE y WV, y resta por establecerse si el endotelio controla la poscarga dinámica de manera frecuencia-dependiente.
Objetivo: Caracterizar el rol endotelial en la regulación de la V, FC, FA, WE y WV, y analizar el control endotelial de la poscarga dinámica ante aumentos de frecuencia de estimulación.
Material y método: Arterias braquiocefálicas ovinas (n=9) se estudiaron en un simulador circulatorio en condiciones hemodinámicas símil fisiológicas. Se midió flujo, presión y diámetro arterial a 60, 80 y 100 latidos/minuto. Para cada frecuencia se calculó E, V, FC, FA, WE y Wv, antes y luego de remover el endotelio. La adecuada eliminación endotelial se comprobó mediante estudios histológicos.
Resultados: La presencia de endotelio permitió mantener reducidos E, V, WE y WV, y elevada la FC (p<0,05). La reducción de los determinantes de la poscarga fue mayor a elevados niveles de frecuencia de estimulación (p<0,05). Conclusiones: El endotelio regula la viscoelasticidad arterial, reduciendo la poscarga dinámica, a la vez que permite mantener elevada la FC y no modifica la capacidad de la arteria de autoprotegerse. La mayor reducción de la poscarga a mayor frecuencia (mayor consumo de oxígeno), supone un beneficio adicional sobre la función ventricular.
Palabras clave: ARTERIA
BIOMECÁNICA
ENDOTELIO
FRECUENCIA CARDÍACA
SUMMARY
Introduction: The geometrical properties, the viscosity (V) and elasticity (E) of the arteries determine the arterial conduit (CF) and buffer (BF) functions, as well as the elastic (WE) and viscous (WV) work developed by the ventricle during the ejection (external dynamic afterload). It remains to be established the role of the endothelium in controlling V, CF, BF, WE and WV, and if the endothelium’s regulation of the dynamic afterload depends on the frequency. Objetive: To characterize the endothelial role in the regulation of V, CF, BF, WE and WV, and to analyze the endothelial control of the dynamic afterload during the increase in the frequency of stimulation.
Methods: Ovine brachiocephalic arteries (n=9) were studied in a circulation mock during physiological haemodynamic conditions. Arterial flow, pressure and diameter were measured at 60, 80 and 100 cycles/minute. At each frequency E, V, CF, BF, WE y Wv, were calculated before and after the endothelium removal. Hystological studies verified the adequacy of the endotelial removal.
Results: The endothelium allowed keeping E, V, WE and WV in low levels, and a high CF (p<0,05). The reduction in the afterload determinants was higher at higher levels of frequency (p<0,05). Conclusions: The endothelium regulates the arterial viscoelasticity, with a reduction in the dynamic afterload; at the time it allows keeping the CF at high levels, and does not change the arterial auto-protection. The higher reduction in the afterload at high frequencies (increased oxigen demand), represents an additional beneficial effect in the ventricle function.
Key words: ARTERY
BIOMECHANIC
ENDOTHELIUM
HEART RATE
INTRODUCCIóN
Las principales funciones del sistema cardiovascular se cumplen mediante acciones e interacciones mecánicas de sus componentes. La función de cada circuito hemodinámico puede analizarse estudiando la bomba (ventrículo) y los conductos (vasos sanguíneos), que funcionan latido a latido, en forma interrelacionada o acoplada (“acoplamiento ventrículo-arterial”). Un adecuado acoplamiento ventrículo-arterial se logra cuando la eficiencia (relación trabajo eyectivo o externo/consumo de oxígeno) de la bomba es elevada (1,2). La frecuencia cardíaca se reconoce como uno de los principales factores determinantes del trabajo eyectivo ventricular y del consumo de oxígeno miocárdico (1,2). Sin embargo, la valoración de los efectos de la frecuencia cardíaca sobre la eficiencia ventricular es compleja, dado que en el sistema cardiovascular intacto las modificaciones de la frecuencia se asocian a cambios en otros determinantes del trabajo y consumo de oxígeno miocárdico (por ejemplo, inotropismo, precarga y poscarga ventricular) (1,2). Al respecto, durante el ejercicio, el aumento del gasto cardíaco estaría determinado principalmente por el incremento del inotropismo ventricular o por la reducción de la poscarga (por ejemplo, vasodilatación arteriolar en el músculo esquelético), o ambos (1,3). En esta condición, el aumento de la frecuencia cardíaca no determinaría directamente un incremento significativo del gasto cardíaco, sino que tendría un rol permisivo en el aumento que se explicaría por las modificaciones en los otros determinantes del trabajo miocárdico, debidas a los cambios en frecuencia (por ejemplo, incremento frecuencia-dependiente del inotropismo) (1,3). Asimismo, a diferencia de lo descripto para el inotropismo y la precarga, existen controversias acerca de cuáles son los efectos de los cambios en la frecuencia cardíaca sobre la poscarga dinámica ventricular.
La poscarga ventricular externa puede analizarse como la suma de dos componentes: el estático, que constituye aproximadamente 80%-95% de la poscarga externa total y es determinado por la resistencia vascular periférica, y el dinámico, que es fundamentalmente determinado por las propiedades geométricas y viscoelásticas arteriales (2,4-7). Estas últimas determinan la impedancia al flujo durante la eyección, la función arterial de conducción y amortiguamiento, y la capacidad de la arteria de disipar y almacenar energía en cada eyección (4,5). Una pared arterial con mayores niveles de respuesta viscosa y elástica determina una mayor impedancia al flujo (menor capacidad de conducción), mayor disipación de energía como calor (trabajo viscoso), a la vez que requiere un mayor gasto energético para la distensión de la pared arterial (trabajo elástico) (6-8). En trabajos previos de nuestro grupo se evidenció que los niveles de respuesta viscosa y elástica, así como el trabajo elástico y viscoso, son modificados por la activación del músculo liso arterial (6,7). Factores neurohumorales, entre los que se destacan los factores endoteliales vasoconstrictores y vasorrelajantes, regulan la actividad muscular lisa arterial, y, consecuentemente, el comportamiento biomecánico arterial (2,8). Hasta el momento el rol endotelial en el control del comportamiento biomecánico arterial ha sido caracterizado en términos de cambios en la complacencia o la respuesta elástica arterial, o ambos (2,9). Sin embargo, restan por ser establecidos los efectos del endotelio sobre la viscosidad, la función de conducción y amortiguamiento arterial, y sobre los determinantes de la poscarga dinámica ventricular externa (trabajo elástico y viscoso). Adicionalmente, se desconoce el control endotelial de la poscarga dinámica varía a distintos niveles de frecuencia cardíaca.
Los objetivos fueron caracterizar: 1) el rol del endotelio en la determinación de los niveles de respuesta viscosa, función arterial de conducción y amortiguamiento, y trabajo elástico y viscoso realizado en cada latido, y 2) analizar el efecto del endotelio sobre los determinantes de la poscarga dinámica ante diferentes frecuencias cardíacas. Así, este trabajo busca contribuir al conocimiento del rol fisiológico del endotelio en la determinación de la capacidad funcional arterial y de la poscarga dinámica ventricular. Para el cumplimiento de los objetivos se realizaron estudios in vitro que permitieron mantener controladas diversas variables que podrían influenciar los niveles de los parámetros biomecánicos y funcionales analizados.
MATERIAL Y MéTODO
INSTRUMENTACIóN QUIRúRGICA
Los procedimientos se realizaron en acuerdo con las guías para el cuidado y uso de animales de laboratorio del US National Institute of Health (NIH publication #85-23, revisada 1996).
Nueve ovejas adultas raza Corriedale (pesos corporales 32,5±2,5 kg) fueron anestesiadas (tiopental sódico, 20 mg/kg intravenoso). Mediante toracotomía se abordaron las arterias braquiocefálicas y se marcaron segmentos de 5-7 cm de longitud mediante puntos de sutura en sus extremos. Los segmentos se instrumentaron con sensores de presión, diámetro, y flujo (6,7,9,10). Para el registro de presión se utilizó un microtransductor de estado sólido (Konigsberg Instruments, Inc., Pasadena, EE.UU.), previamente calibrado utilizando un manómetro de mercurio. El flujo se midió con un sensor (Transonic Systems, Ithaca, EE.UU.) posicionado alrededor del segmento (5). El diámetro arterial se registró mediante sonomicrometría, utilizando cristales de ultrasonido (5 MHz, 4 mm) suturados a la adventicia arterial en sitios diametralmente opuestos (4-7,9,10). La visualización de la señal de ultrasonido en la pantalla de un osciloscopio (modelo 465B; Tektronix TOS 220, Tektronix Inc. Beaverton, EE.UU.) permitió verificar el óptimo posicionamiento de los cristales. Para la obtención del diámetro arterial, el tiempo de tránsito de la señal de ultrasonido (velocidad: 1584 m.s-1) se convirtió a distancia utilizando un sonomicrómetro (1000 Hz de respuesta en frecuencia; Triton Technology Inc., San Diego, EE.UU.) (4-7,9,10). Para evitar la interferencia entre señales, los cristales se situaron distalmente al sensor de presión, separados de él en 2-3 mm. Considerando su importancia en el análisis de las propiedades biomecánicas y propagatorias arteriales, la distancia entre sensores se midió cuidadosamente (2).
Luego de un registro in vivo, los animales se sacrificaron con una sobredosis de tiopental sódico administrado por vía endovenosa, seguido de cloruro de potasio. Después el segmento arterial se escindió para su estudio in vitro.
PROTOCOLO EXPERIMENTAL
Luego de extraídos, los segmentos se estudiaron in vitro en un simulador circulatorio (figura 1) que permitió estudiar las arterias durante condiciones biomecánicas y hemodinámicas (por ejemplo, niveles de tensión circunferencial), similares a las registradas previamente in vivo (figura 2) (10). Los datos se adquirieron utilizando el software LabView 5.1.1 (National Instruments, Austin, EE.UU.) y un programa especialmente desarrollado en el laboratorio.
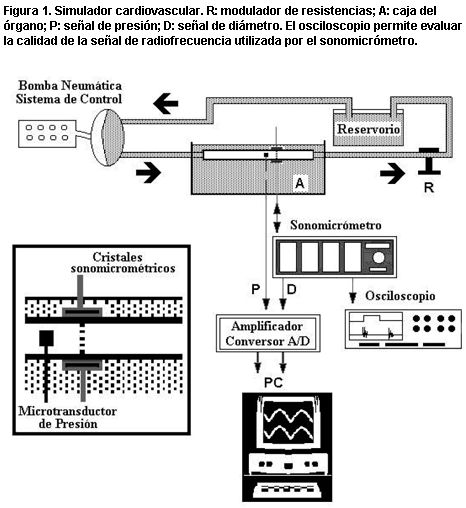
Figura 1. Simulador cardiovascular. R: modulador de resistencias; A: caja del órgano; P: señal de presión; D: señal de diámetro. El osciloscopio permite evaluar la calidad de la señal de radiofrecuencia utilizada por el sonomicrómetro.
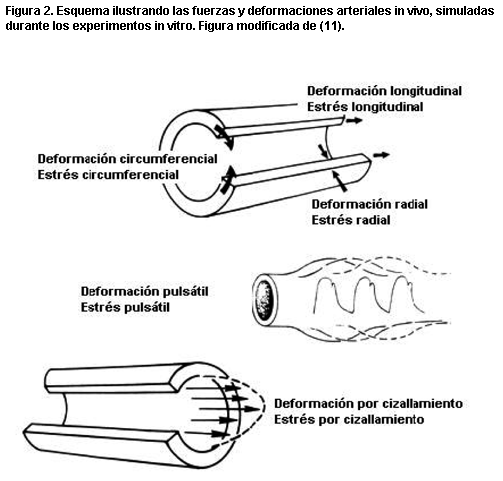
Figura 2. Esquema ilustrando las fuerzas y deformaciones arteriales in vivo, simuladas durante los experimentos in vitro. Figura modificada de (11).
En el simulador los segmentos quedaron inmersos en solución Tyrode (oxigenada, a 37° C y con pH = 7,4) y fueron prefundidos con sangre (hematocrito 30,17±7,7%, viscosidad media 2,33 mPa·s) (7). Los controles del simulador permitieron ajustar la frecuencia de bombeo y los niveles y forma de onda de presión y flujo (9,10). Se realizaron estudios isobáricos e isoflujo, de manera de independizar los resultados obtenidos de potenciales cambios biomecánicos, presión y/o flujo-dependientes (5,7). Luego del período de estabilización se registró presión, diámetro y flujo arteriales en tres condiciones de frecuencia de estimulación, en el rango fisiológico de un individuo adulto en reposo: 60, 80 y 100 latidos/minuto. Los registros se realizaron antes y después de remover el endotelio mediante la técnica previamente descripta (9).
En cada condición experimental, aproximadamente 30 ciclos fueron digitalizados para su posterior análisis (frecuencia de muestreo: 500 Hz).
Luego de la evaluación biomecánica, para el cálculo de la deformación arterial se registró el diámetro arterial a una presión aórtica cercana a 0 mmHg (7). Posteriormente, para poder calcular el espesor parietal, el segmento estudiado de longitud in vivo conocida se pesó en una balanza de precisión.
Finalmente, en forma similar a trabajos previos, se realizaron estudios histológicos (técnicas de tinción: hematoxilina-eosina, Gomori y orceína) para comprobar la indemnidad de la media y adventicia, y confirmar la adecuada remoción endotelial (9).
ANáLISIS DE DATOS
Para poder comparar los cambios biomecánicos relacionados con la remoción endotelial o los cambios en frecuencia de estimulación, o ambos, con independencia de los niveles de presión y flujo, se realizaron estudios isobáricos e isoflujo.
A partir del análisis de los datos, y siguiendo procedimientos utilizados en trabajos previos, se calculó la elasticidad y viscosidad de la pared arterial, la función de conducción y amortiguamiento arterial, la velocidad de onda del pulso, y el trabajo elástico y viscoso (4-7,10). Una descripción detallada de los cálculos realizados puede verse en el Apéndice incluido al final del trabajo.
ESTADíSTICA
Todos los valores se expresaron como valor medio ± desvío estándar (VM±DE). Para cada frecuencia la comparación de cada parámetro en el estado con y sin endotelio se realizó mediante test de T (pareado, dos colas). Para la comparación de los determinantes de poscarga (trabajo elástico y viscoso) a diferentes frecuencias se realizó análisis de varianza (ANOVA) seguido de test de Bonferroni. Se adoptó como estadísticamente significativo un valor de p<0,05. Se utilizó el software SPSS (versión 10.0, Statistical Package for the Social Sciences; SPSS Inc., Chicago, EE.UU.).
RESULTADOS
Los estudios histológicos confirmaron la adecuada remoción del endotelio, manteniéndose la integridad de la capa media y la adventicia.
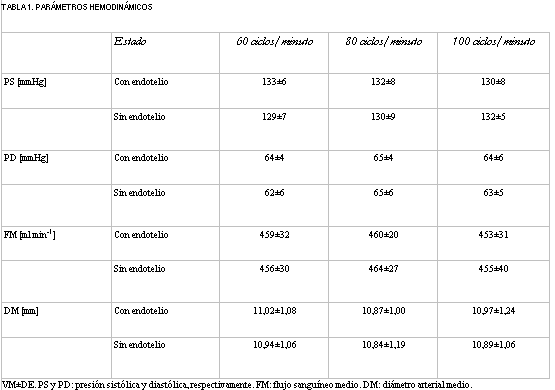
La tabla 1 presenta los valores hemodinámicos obtenidos durante las experiencias. Nótese que no hubo diferencias en presión ni en flujo entre las diferentes condiciones experimentales, permitiendo el análisis isobárico e isoflujo de los datos. Adicionalmente, nótese también que para cada frecuencia los cambios en diámetro producidos por la eliminación del endotelio no alcanzaron significancia estadística.
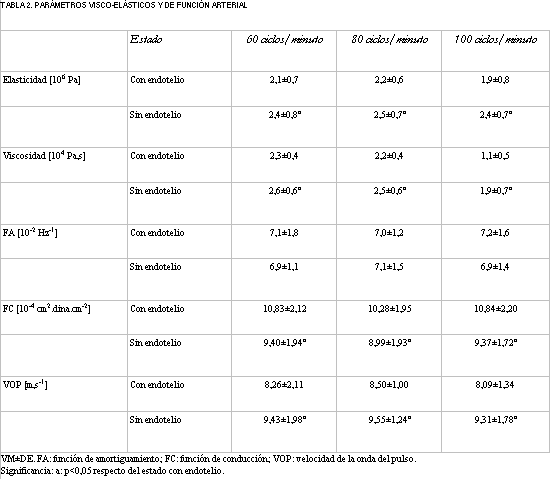
La tabla 2 presenta los valores del módulo elástico y viscoso, y de los parámetros calculados para cuantificar la función arterial. Para todas las condiciones de frecuencia de estimulación, la eliminación del endotelio determinó aumento del módulo elástico y viscoso, y de la velocidad de propagación del pulso (p<0,05), mientras que redujo la función de conducción (p<0,05) y no modificó la capacidad de amortiguamiento arterial. Nótese adicionalmente la reducción del módulo viscoso a mayor frecuencia de estimulación, particularmente cuando la capa endotelial estuvo intacta.
La tabla 3 presenta los niveles de trabajo elástico y trabajo viscoso obtenidos al remover el endotelio o variar los niveles de frecuencia de estimulación de los segmentos, o ambos. Para todas las condiciones de frecuencia de estimulación, la existencia de endotelio intacto permitió mantener reducido el trabajo elástico y viscoso (p<0,05) necesarios para distender la pared arterial. El efecto reductor del trabajo elástico y viscoso fue mayor al aumentar la frecuencia cardíaca (p<0,05) (figura 3).
Tabla 3
Figura 3. Cambios en trabajo elástico (WE) (columnas negras) y trabajo viscoso (WV) (columnas blancas), provocados por la eliminación del endotelio para las tres frecuencias estudiadas. Valores medios ± desvío estándar. Estadística: a y b: p<0,05 respecto del cambio producido a frecuencia 60 y frecuencia 80 ciclos/minuto, respectivamente.
DISCUSIóN
El presente trabajo contribuye al conocimiento del rol del endotelio en la determinación de los niveles de función arterial y poscarga dinámica ventricular por sus dos hallazgos principales:
1. El endotelio permitió mantener bajos niveles de respuesta elástica y viscosa de la pared arterial, contribuyendo a mantener reducido el trabajo elástico y viscoso que deberá realizar el ventrículo izquierdo en cada eyección, y elevada la capacidad de conducción arterial.
2. El efecto reductor de la poscarga dinámica producido por el endotelio fue mayor a medida que se incrementó la frecuencia de estimulación.
Como fue mencionado, las respuestas elástica y viscosa de la pared arterial son determinantes de la función arterial y de los niveles de poscarga dinámica ventricular. En cada ciclo el ventrículo entrega energía al sistema arterial. Parte de la energía entregada se emplea para distender la arteria (trabajo elástico), y depende del nivel de respuesta elástica del vaso, mientras que otra parte de la energía entregada por el ventrículo es disipada en la pared arterial como calor (trabajo viscoso), y depende del nivel de respuesta viscosa parietal. Cuanto mayores sean los módulos o respuestas elástica y viscosa, mayor será la poscarga dinámica ventricular.
Para todos los niveles de frecuencia de estimulación estudiados, en presencia de endotelio las respuestas elástica y viscosa se mantuvieron en niveles bajos (tabla 2), contribuyendo a mantener reducidos los trabajos elástico y viscoso ventricular (tabla 3). A pesar de no haberse obtenido reducciones significativas en los diámetros arteriales, la remoción del endotelio determinó un incremento de la respuesta viscosa y un aumento isobárico de la elasticidad, ambos fenómenos compatibles con un patrón de activación muscular (incremento del tono muscular liso) (tabla 2). Consecuentemente, podría postularse que el endotelio regula la poscarga dinámica, contribuyendo a reducir el costo energético de la eyección ventricular, mediante un mecanismo de activación muscular lisa-dependiente.
Además, el endotelio permitió mantener elevada la capacidad de conducción sanguínea arterial con independencia del nivel de frecuencia (tabla 2). Esto representaría un efecto beneficioso adicional para el sistema cardiovascular, ya que se facilitaría la conducción sanguínea (2). Los cambios en la función de conducción fueron determinados fundamentalmente por la regulación de las propiedades parietales arteriales, más que por modificaciones en la luz vascular, ya que al remover el endotelio los cambios en el diámetro arterial no alcanzaron significancia estadística (tabla 2). En este sentido, al igual que en trabajos previos, en el presente se evidencia que modificaciones en el tono muscular liso pueden tener importantes efectos sobre las funciones arteriales, sin determinar modificaciones en el diámetro arterial (5). Finalmente, la función de amortiguamiento arterial no se modificó al eliminar el endotelio en ninguno de los niveles de frecuencia estudiados.
Como fue mencionado, el efecto reductor del trabajo elástico y viscoso producido por el endotelio fue mayor a medida que el segmento arterial se sometió a mayores frecuencias de estimulación (figura 3). Estos efectos podrían haber sido mediados por modificaciones en otros determinantes del comportamiento biomecánico vascular. Sin embargo, ajustes en los controles del simulador circulatorio posibilitaron estudiar los segmentos en similares condiciones de presión, flujo, temperatura y viscosidad sanguínea, por lo que las modificaciones en el control endotelial de la poscarga dinámica a distintos niveles de frecuencia de estimulación no estarían vinculadas con cambios en esas variables.
Mediante una mayor reducción del trabajo elástico y viscoso, en condiciones de aumento de la frecuencia cardíaca, el endotelio permitiría mantener reducida la poscarga dinámica. Consecuentemente, al aumentar la frecuencia cardíaca el gasto cardíaco podría incrementarse, además de por cambios frecuencia-dependientes en el inotropismo ventricular, por modificaciones en el control endotelial de la poscarga dinámica. En este sentido, ante aumentos de la frecuencia cardíaca que provocarían un incremento proporcional del consumo de oxígeno ventricular (2), el endotelio, mediante mecanismos dependientes de la frecuencia, reduciría la poscarga dinámica ventricular, y, por tanto, el incremento resultante en el consumo de oxígeno miocárdico.
CONCLUSIONES
El endotelio permitió mantener bajos los niveles de respuesta elástica y viscosa de la pared arterial, contribuyendo a mantener elevada la capacidad funcional arterial, y reducidos el trabajo elástico y viscoso que deberá realizar el ventrículo izquierdo en cada eyección.
El efecto reductor de la poscarga dinámica producido por el endotelio fue mayor a medida que se incrementó la frecuencia de estimulación. La mayor capacidad de reducir la poscarga, al aumentar el consumo de oxígeno (mayores frecuencias), supone un beneficio adicional para el corazón que contribuye a mantener elevada la eficiencia ventricular.
APéNDICE
ANáLISIS DE DATOS
Viscosidad y elasticidad parietal
Un procedimiento computarizado (desarrollado por nuestro grupo) que utiliza un modelo matemático lineal autorregresivo con entrada exógena (ARX) se utilizó para calcular los parámetros biomecánicos (7,10). A partir de las señales de P y D medidas, se cuantificó la tensión circunferencial (s) y la deformación (e) arterial como:
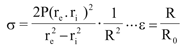
donde R es el radio medio arterial, calculado como R=(re+ri)/2, donde re y ri son el radio externo e interno, respectivamente, y R0 es el radio medio obtenido para una presión cercana a 0 mmHg. El re se calculó a partir de la señal de diámetro medida (re = diámetro externo/2), y el ri se obtuvo según la fórmula:
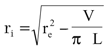
donde V es el volumen arterial, calculado a partir de la masa del segmento, y asumiendo una densidad del tejido de 1,06 g·cm-3, y L es la longitud in vivo del segmento arterial (5).
Una vez obtenidas las señales temporales de s y e arterial, el modelo permite obtener la ecuación constitutiva que describe las propiedades biomecánicas de la pared:
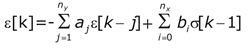
Los coeficientes aj y bi de la ecuación permiten cuantificar, latido a latido, el módulo viscoso (V) y elástico (E) parietal (7,10). Una descripción detallada del desarrollo matemático del análisis de datos mediante el modelo ARX puede encontrarse en trabajos previos (7,10).
Función de amortiguamiento y conducción arterial
La pared vascular se comporta como un filtro pasa-bajos, dado que permite que los componentes de baja frecuencia de la onda de presión se transmitan a la de diámetro, pero filtra (atenúa o reduce) las frecuencias mayores que la frecuencia de corte (fc) (7,10). La frecuencia de corte representa entonces el límite entre las frecuencias no filtradas (rango dinámico) y las filtradas (7,10), y, por tanto, una menor frecuencia de corte implica que una mayor cantidad de frecuencias es filtrada o atenuada. Al igual que en trabajos previos, la función de filtro pasa-bajo de la pared arterial se evaluó considerando la frecuencia de corte de la función transferencia s-e de la pared arterial, utilizando un modelo de primer orden (7,10):
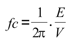
donde E y V son el módulo elástico y viscoso, respectivamente. Considerando que cuanto menor es la frecuencia de corte, mayor es la capacidad de la pared arterial de amortiguar la pulsatilidad y de mantenerse protegida de las elevadas frecuencias (7,10), la función de amortiguamiento (FA) de la pared se cuantificó como:
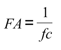
Al igual que en trabajos previos, la función de conducción (FC) sanguínea del segmento arterial se cuantificó como:
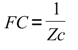
donde Zc es la impedancia característica o local arterial. Para el cálculo de la Zc se utilizó la fórmula de Water-Hammer (4):
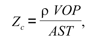
donde r es la densidad sanguínea (asumida igual a 1.055 g.cm-3), AST es el área de sección transversal media arterial, y VOP es la velocidad de propagación de la onda del pulso. Para el cálculo de la VOP se utilizó la fórmula de Moens-Korteweg (4):
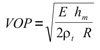
donde E es el módulo elástico, rt representa la densidad del tejido arterial (rt = 1.06 g.cm-3), y hm es el espesor medio de la pared arterial (4).
Trabajo elástico y viscoso
El trabajo elástico (WE) y el viscoso (WV) se calcularon como:
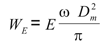
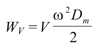
donde Dm es el diámetro medio arterial, w la frecuencia angular (2.p.frecuencia cardíaca), y E y V el módulo elástico y el viscoso, respectivamente (6).
AGRADECIMIENTOS
A la Sociedad Uruguaya de Cardiología por el premio otorgado al presente trabajo durante la realización del 22° Congreso Uruguayo de Cardiología (1-4 de diciembre de 2006, Montevideo, Uruguay). Al Sr. Elbio Agote, funcionario de la Universidad de la República, Facultad de Medicina, por su permanente colaboración. Al PEDECIBA-Biología y a la CSIC-UDELAR (Programa “Recursos humanos”), por las contribuciones realizadas para compra de equipamiento y formación de recursos humanos dentro y fuera del país. A la empresa Buquebus (Sra. Rosario García), por las facilidades otorgadas para el intercambio académico entre las instituciones uruguayas y argentinas.
BIBLIOGRAFíA
1. Opie L. The mechanism of cardiac contraction and relaxation. En: Braunwald E, Zipes D, Libby P, ed. Braunwald's Heart Disease. 7th ed. Philadelphia: W.B. Saunders, 2005: 1751-806.
2. Nichols W, O'Rourke M. Properties of the arterial wall: theory. In: Nichols W, O'Rourke M, ed. McDonald's Blood Flow in Arteries: Theoretical, Experimental and Clinical Principles. 5th. London, UK: Edward Arnold, 2005: 54-72.
3. Berne R, Levy M. The cardiac pump. En: Bircher S,ed. Physiology. 4th ed. Missouri: Mosby, 1998: 431-50.
4. Zócalo Y, Bia D, Armentano R, Camús J, De Forteza E, Cabrera Fischer E. Contrapulsación intraaórtica y determinantes de la poscarga ventricular: estudio experimental en un modelo animal. Rev Urug Cardiol 2006; 21:204-17
5. Bia D, Barra JG, Grignola JC, Ginés FF, Armentano RL. Pulmonary artery smooth muscle activation attenuates arterial dysfunction during acute pulmonary hypertension. J Appl Physiol 2005; 98: 605-13.
6. Armentano R, Barra J, Bia D, Pessana F, Graf S, Craiem D, et al. Smart damping modulation of carotid wall energetics in human hypertension: effects of ACE inhibition. Hypertension 2006; 47:384-90.
7. Zócalo Y, Pessana F, Bia D, Armentano R. Regional differences in veins wall dynamics under arterial hemodynamics conditions: comparison with arteries. Artif Organs 2006; 30:265-75.
8. Midoux N. Réponse transitoire des corps viscoélastiques, Paris: Tec, Doc-Lavoisier, 1993: 114-7.
9. Cabrera-Fischer Ei, Armentano Rl, Pessana F, Graf S, Romero L, Christen AI, et al. Endothelium-dependent arterial wall tone elasticity modulated by blood viscosity. Am J Physiol Heart Circ Physiol 2002; 282: H389-H394.
10. Armentano Rl, Barra JG, Pessana FM, Craiem DO, Graf S, Bia Santana DB, et al. Smart smooth muscle spring-dampers. Smooth muscle smart filtering helps to more efficiently protect the arterial wall. IEEE Eng Med Biol Mag. 2007; 26:62-70.














