Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.21 no.2 Montevideo set. 2006
ACTUALIZACIÓN
Riesgo cardiovascular en pacientes con enfermedad renal crónica
DR. JOSé E. VENTURA 1
1. Profesor Agregado de Cardiología
PALABRAS CLAVE: NEFROPATÍAS
INSUFICIENCIA RENAL
FACTORES DE RIESGO
KEY WORDS: KIDNEY DISEASES
RENAL INSUFFICIENCY
RISK FACTORS
I. INTRODUCCIóN
Las enfermedades cardiovasculares (CV) son la primera causa de muerte en los pacientes con insuficiencia renal extrema (falla renal) en tratamiento dialítico. El alto riesgo CV fue reconocido en 1974, cuando Lindner observó una mortalidad de 56,4% en los pacientes en hemodiálisis crónica al cabo de 13 años de seguimiento, de los que más de la mitad morían por enfermedad CV (1).
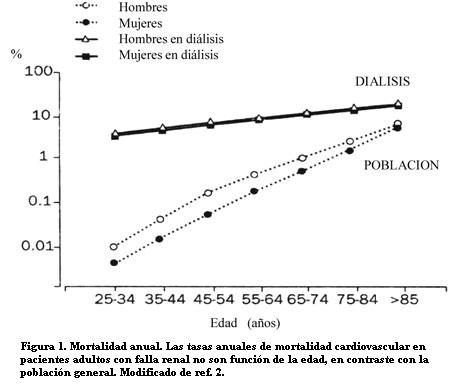
La mortalidad CV de los pacientes en diálisis, ajustada a la edad, es casi 30 veces mayor que la de la población general (2). En los pacientes menores de 45 años es más de 100 veces más alta, y en los jóvenes de entre 25 y 35 años es varios cientos de veces mayor que la mortalidad CV de la población (figura 1).
En la edad pediátrica, en la que la mortalidad CV de la población general es bajísima, 25% de los niños y jóvenes con insuficiencia renal extrema mueren por una enfermedad CV (3).
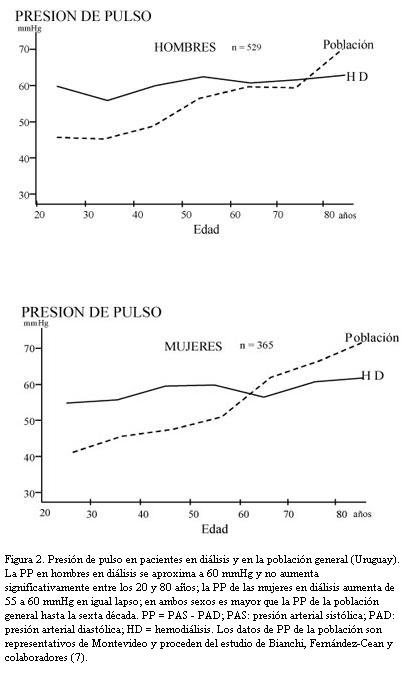
El riesgo CV de la uremia se atribuye a la aceleración de los procesos de ateromatosis y esclerosis arterial (1). La ateromatosis, estimada por el espesor de la íntima-media, es mayor en los pacientes en diálisis crónica que en la población general y la diferencia es significativa a cualquier edad. La ateromatosis de un paciente urémico de 40 años equivale a la de un individuo de 60 años de la población general (4). La amplitud de la presión de pulso (PP), que estima el grado de esclerosis y rigidez arteriales (5), está aumentada desde edades tempranas en los pacientes con falla renal en tratamiento dialítico. Un estudio que comparó las PP de 894 pacientes en diálisis en Uruguay con las PP de la población general (6) encontró valores más altos en los pacientes dializados hasta la sexta década en ambos sexos, demostrando el temprano desarrollo de rigidez y esclerosis arteriales (figura 2).
La severidad del daño aterosclerótico se explica en parte por la alta prevalencia de los factores tradicionales de riesgo CV presentes en la uremia. La diabetes mellitus es tres veces más frecuente en los pacientes en diálisis, la hipertensión arterial (HA) y la dislipidemia (altos triglicéridos y bajo HDL-colesterol) duplican la prevalencia observada en la población general (8). Por otra parte, ciertas condiciones propias del estado urémico: anemia, alteraciones fosfocálcicas, resistencia a la insulina, el síndrome inflamación-malnutrición y el estrés oxidativo (9) facilitan el desarrollo de la aterosclerosis y aumentan el riesgo CV.
Es evidente que la enfermedad CV comienza y se desarrolla durante el curso de la nefropatía, años antes de llegar a la falla renal. Al empezar el tratamiento dialítico 18% de los pacientes han sufrido un infarto agudo de miocardio (IAM), 22% presentan angor (10), 37% han tenido episodios de falla cardíaca congestiva y casi 80% tienen una fracción de eyección ventricular izquierda (FEVI) menor de 40%, o una hipertrofia ventricular izquierda, o ambas (11,12). El estudio de Framingham Offspring Community halló, en una cohorte de 6.233 individuos seguidos durante 15 años, que los que tenían insuficiencia renal leve o moderada (8% de la cohorte) mostraban mayores prevalencias de cardiopatía isquémica, falla cardíaca e hipertrofia ventricular izquierda, que los individuos sin enfermedad renal (13). Diversos estudios han demostrado que los estadios iniciales de las enfermedades renales crónicas, cuando los niveles de insuficiencia son aún leves o moderados, conllevan altos riesgos de enfermedad y muerte CV, y las predicen con independencia de otros factores (14).
II. ENFERMEDAD RENAL CRóNICA
A. DEFINICIóN
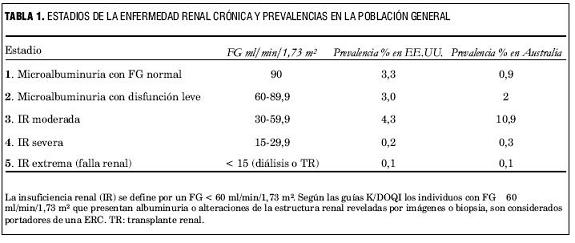
La enfermedad renal crónica (ERC) se identifica por la existencia de albuminuria, la disminución de la tasa de filtrado glomerular (FG), o cualquier alteración de la estructura renal que persistan por más de tres meses, independientemente de sus etiologías. La ERC se caracteriza, en la mayoría de los casos, por la declinación progresiva del FG en lapsos variables. Se distinguen cinco estadios según los niveles de disfunción (tabla 1) (15).
B. PREVALENCIA
La prevalencia de ERC en la población de EE UU (año 2003) se ha estimado próxima a 11% (16); un reciente informe del NHANES 2005 la valora en 13%. En Australia la prevalencia de la ERC era 14% en el año 2003 (17). Estudios en poblaciones con riesgo de desarrollar nefropatía (individuos con diabetes mellitus, HA o con factores genéticos predisponentes) han hallado una frecuencia de 47,4% de ERC, identificada por un FG menor de 60 ml/min/1,73 m2 o por microalbuminuria con FG >/= 60 ml/min/1,73 m2 (18). En todos los estudios la frecuencia de formas asintomáticas y leves de ERC es sorprendentemente alta. El número de pacientes en los estadios 1, 2 y 3 de ERC es más de 100 veces el de los pacientes en diálisis o trasplantados; esta desproporción se explica por la alta probabilidad que tienen de morir por complicaciones CV antes de llegar a la falla renal (19). La ERC afecta alrededor de 19 millones de americanos adultos, y se calcula que el número mundial de individuos con ERC llega a 50 millones, de los que más de la mitad morirán por enfermedades CV (20).
Los dos principales factores de riesgo CV, la diabetes mellitus y la HA, causan la mayoría de casos de ERC. La ERC representa el blanco renal del daño vascular sistémico provocado por la diabetes mellitus y la HA. En los últimos años, la pandemia de diabetes tipo 2 y el aumento de las prevalencias de HA, obesidad y dislipidemia, particularmente en los países en desarrollo (21), han aumentado en forma alarmante la prevalencia de la ERC. La diabetes tipo 2 se ha convertido en la primera causa de insuficiencia renal en el mundo. El 20% de los pacientes diabéticos y 14% de los hipertensos tienen un FG menor de 60 ml/min/1,73 m2. En nuestro país la diabetes y la HA causan las nefropatías que con mayor frecuencia llevan a la falla renal: la nefropatía vascular (incluye la nefroangiosclerosis hipertensiva y la nefropatía isquémica por estenosis arterial o ateroembolias) representa 25%, y la nefropatía diabética 21%. En otros países la nefropatía diabética es 40% de la ERC.
C. ASOCIACIóN CON FACTORES DE RIESGO CV
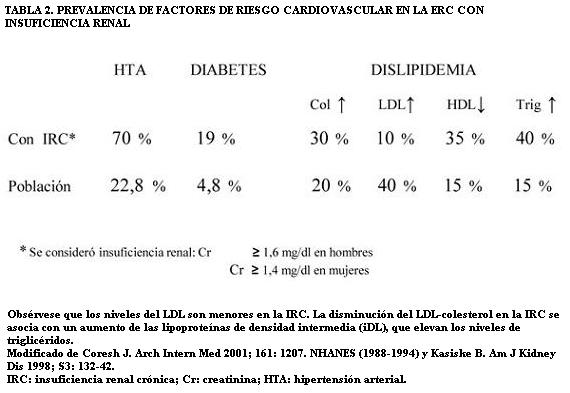
Los factores tradicionales de riesgo CV tienen alta prevalencia en la ERC (tabla 2).
La dislipidemia de la ERC se asocia con aumentos del espesor de la íntima y media carotídeas (22). En el estadio de insuficiencia renal leve existen otras alteraciones proaterogénicas: alta presión nocturna, resistencia a la insulina, aumentos de la lipoproteína (a) sérica, proteína C reactiva y fibrinógeno y alteraciones de la hormona paratiroidea que contribuyen al daño CV (23). El descenso del FG se asocia con aumentos de la dimetil arginina asimétrica (ADMA) y del estrés oxidativo, que disminuyen la capacidad de vasodilatación dependiente del endotelio (24). La disfunción endotelial es uno de los fenómenos iniciales de la aterogénesis.
Por todas estas vías la ERC es uno de los mayores factores de riesgo para el desarrollo de enfermedad CV, independiente de la diabetes mellitus y la HA.
D. ASOCIACIóN CON HIPERTROFIA VENTRICULAR IZQUIERDA
Se ha demostrado la presencia de daño CV preclínico (asintomático) en los primeros estadios de la ERC. La hipertrofia ventricular izquierda (HVI) es el indicador más importante de riesgo CV(25) y se encuentra en 20% de la población general. En los estadios 3 y 4 de la ERC hay HVI en 25% y 50% de los casos. En pacientes pediátricos de entre 3 y 18 años, con ERC en los estadios 2, 3 o 4, se encuentran 10,2% de casos con remodelación ventricular izquierda concéntrica, 12% con HVI concéntrica y 21% con HVI excéntrica (26).
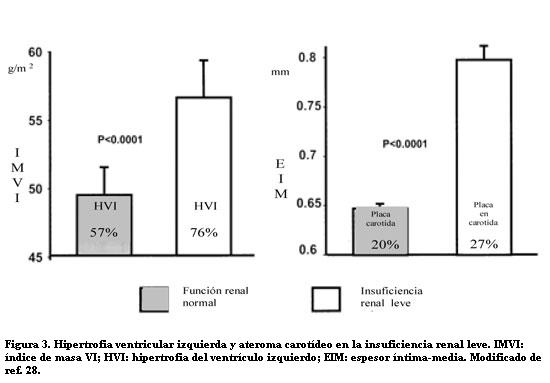
En nuestro medio el grupo de Ambrosoni encontró mayor prevalencia de HVI y aumentos del séptum interventricular, pared posterior y diámetro diastólico ventricular izquierdo en los pacientes con creatininas plasmáticas mayor es de 1,3 mg/dl, que en los que tenían función renal normal (27). Las características de la HVI y otros daños CV preclínicos en la IRC leve fueron demostrados por Leoncini (28). En 934 pacientes hipertensos esenciales no tratados, de edad 50 ± 11 años y clearance de creatinina (Cockcroft-Gault) medio de 82 ± 20 ml/min, se vio que los pacientes con insuficiencia renal leve (clearances entre 60 y 70 ml/min), tenían mayores prevalencias de HVI y placas carotídeas, con valores más altos de masa ventricular izquierda y espesor de la íntima-media, que los que tenían función renal normal (figura 3).
El riesgo de daño de órgano blanco en esa cohorte creció 20% por cada disminución de 10 ml/min del clearance, ajustado a la PA y duración de la HA. Estos hallazgos aportan una explicación del alto riesgo de muerte CV de la ERC.
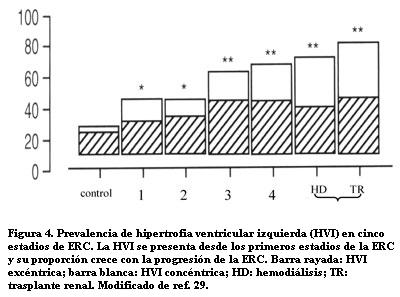
Un estudio de Stewart sobre 296 pacientes no diabéticos ha precisado la frecuencia de HVI en los cinco estadios de la ERC (figura 4) (29).
La HVI observada en la insuficiencia renal leve podría estar influida por la rigidez de la pared arterial. En el HOORN Study se halló que la disminución del FG en hombres se asociaba con mayor masa del ventrículo izquierdo (VI), y que la asociación del FG y la HVI era independiente de la edad, glucemia, HA y enfermedad CV previa, pero no de la rigidez arterial; esto sugiere que la HVI podría estar asociada a los incrementos de la rigidez arterial (30). En los pacientes en diálisis hemos comprobado que la PP (índice de la rigidez arterial) es el factor más fuerte asociado al aumento de masa VI, independiente de la valvulopatía aórtica, anemia y sobrehidratación (31).
III. ENFERMEDAD Y MUERTE CV EN LOS PACIENTES CON ERC
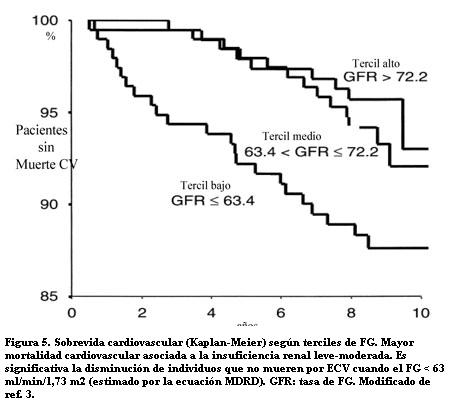
Un estudio de Henry en una cohorte de 631 individuos del HOORN Study (32) demostró una relación directa entre el riesgo de muerte por enfermedad CV y la disfunción renal. Por cada disminución de 5 ml/min en el FG el riesgo de muerte CV aumentó 26% en un lapso de diez años, mientras el riesgo total de muerte aumentó 15%. Es decir, el riesgo de muerte CV se duplicó ante el descenso de 20 ml/min/1,73 m2 del FG. Los resultados persistían luego de ajustar los datos a edad, sexo, glucemia, HA, LDL-colesterol, homocisteína, microalbuminuria y proteína C reactiva, considerados como otros potenciales factores de riesgo CV. Este estudio demostró que los descensos de la función renal de grado leve y moderado se asocian en forma graduada con un riesgo creciente de muerte CV, independiente de otros factores (figura 5).
Los hallazgos de este estudio tienen una aplicación clínica amplia al haberse demostrado en una muestra de la población general de entre 50 y 75 años de edad. En su estudio, Henry valoró la función renal por tres métodos: el nivel plasmático de la creatinina, el clearance de creatinina, calculado con la fórmula de Cockroft y Gault, y el FG estimado por la fórmula MDRD. Los resultados fueron similares con los tres métodos. El valor de creatinina plasmática es un dato inseguro para estimar el FG en individuos añosos o en mujeres de poca masa muscular. El FG calculado mediante la ecuación MDRD, que ajusta la creatinina a edad y sexo, gradúa los estadios de la ERC con mayor sensibilidad que los valores de creatinina. Por ejemplo, con la fórmula MDRD se encuentra que una mujer de 68 años y 50 kg de peso cuya creatinina es 2 mg/dl (doble de lo normal) tiene un FG alrededor de 20 ml/min (insuficiencia renal severa). La fórmula de Cockroft y Gault estima el clearance de creatinina (Ccr) a partir del nivel de la creatinina plasmática: Ccr (ml/min) = (140 - edad (años)) x peso corporal (kg) / 72 x creatinina plasmática (mg/dl).
La fórmula MDRD para el cálculo de la tasa del FG es la siguiente:
FG =186 x creatinina(mg/dl)- 1,154 x
edad(años)- 0,203 x constante
La constante es 1 para hombres blancos y 0,742 para mujeres blancas y en ambos casos se multiplica por 1,21 para individuos de raza negra (33).
Las evidencias epidemiológicas en grandes poblaciones coinciden con los resultados de Henry y subrayan la importancia clínica y de salud pública de la ERC. El ARIC Study demostró en 15.350 individuos de 45 a 64 años con insuficiencia renal leve a severa, que cada descenso de 10 ml/min/1,73 m2 de FG se asociaba con un aumento de 5% del riesgo (ajustado) de enfermedad CV aterosclerótica, con 7% de aumento del riesgo de nuevos eventos CV, y con 6% más de riesgo de recurrencia, en un seguimiento de 6,2 años (34). En 6.354 individuos de 30 a 74 años del 2nd NHANES Mortality Study, muestra representativa de la población general de EE.UU., que excluyó individuos con creatinina plasmática mayor de 3 mg/dl, se observó que aquellos que tenían un FG menor de 70 ml/min corrían un riesgo de muerte CV 69% más alto que los individuos con función renal normal (FG mayor de 90 ml/min) en un seguimiento de 16 años. El riesgo total de muerte fue 51% mayor. Las tasas de mortalidad CV aumentaron en relación inversa a la disminución del FG, independientemente de otros factores: la tasa era de 4,1 muertos/1.000 personas-año cuando los FG eran mayores de 90 ml/min, se duplicaba a 8,6 muertos/1.000 personas-año con FG entre 70 y 89 ml/min, y alcanzaba 20,5 muertos/1.000 personas-año con FG menores de 70 ml/min (35). El FG se valoró con la ecuación MDRD.
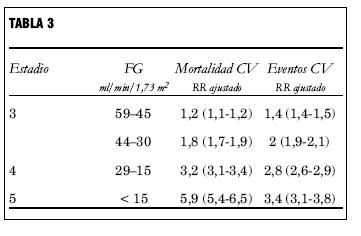
Otro estudio efectuado en una comunidad de 1.120.295 adultos con edad media de 52 años, obtuvo resultados similares: existió una asociación graduada e independiente entre la disminución de FG y los riesgos ajustados de muerte, de eventos CV y de hospitalización, en un seguimiento medio de 2,8 años (tabla 3) (36).
El daño CV asociado a la disfunción renal se demostró también en poblaciones que sumaban otros factores de mayor riesgo CV. En una población del HOPE Study, Mann comparó 980 pacientes con valores de creatinina plasmática entre 1,4 y 2,3 mg/dl y 8.307 que tenían creatininas menores de 1,4 mg/dl. La insuficiencia renal aumentó 40% la probabilidad de eventos CV, y ese riesgo fue independiente de la edad, el género, diabetes mellitus, presión arterial, colesterolemia, tabaquismo y enfermedad CV preexistentes. El grupo con insuficiencia renal tuvo mayores tasas de incidencia de infarto de miocardio, ataque cerebro vascular y muerte CV que el grupo con función renal normal, ajustados a los tratamientos recibidos. Se destaca que el riesgo CV de la insuficiencia renal fue similar al de la diabetes mellitus, la que por sí sola aumenta el riesgo en 42% (37).
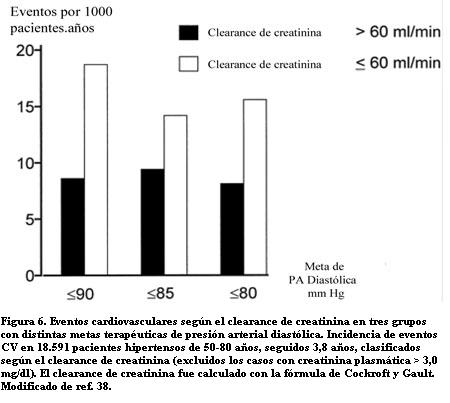
En el HOT Study, Ruilope analizó la frecuencia de muerte y complicaciones CV en pacientes con HA bajo tratamiento, cuyos valores de creatinina plasmática eran menores de 3 mg/dl (38). Los 18.591 pacientes estudiados recibían antihipertensivos apuntando a distintas metas de PA. En un seguimiento de 3,8 años se vio una incidencia mayor de IAM, ataque cerebrovascular y muertes de causa CV en los individuos que tenían clearances de creatinina menores de 60 ml/min, que en aquellos con clearance mayores de 60 ml/min. El riesgo CV casi se duplicaba al pasar de insuficiencia renal leve a moderada, cualquiera fuese la meta de presión arterial buscada e independiente de otros factores de riesgo: edad, sexo, diabetes, colesterol, tabaquismo, enfermedad vascular previa (
figura 6).IV. ERC EN LOS PACIENTES CON CARDIOPATíA
A) PACIENTES CON FALLA CARDíACA CRóNICA
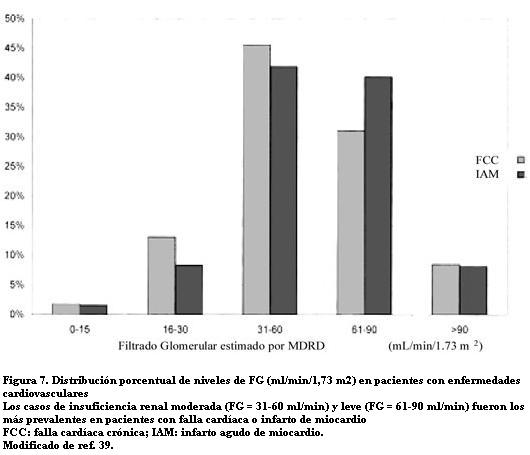
Debido a la coincidencia de los factores de riesgo cardíaco y renal es frecuente descubrir una ERC en los pacientes asistidos por una enfermedad CV. En 755 pacientes hospitalizados por falla cardíaca crónica (FCC) y 709 con IAM, McClellan encontró 60,4% de casos con ERC (con FG menor de 60 ml/min) entre los pacientes con FCC y 51,7% entre los pacientes con IAM (figura 7) (39). El estudio destaca que la ERC se reconoció al alta en sólo 21% de los casos de FCC y en 18% de los IAM.
Mc Alister estudió la prevalencia de insuficiencia renal en 754 pacientes con falla cardíaca sistólica o diastólica (edad media 69 años). En esa población 40% tenían FG entre 30 y 60 ml/min y 16% tenían FG menor de 30 ml/min, es decir 56% tenían una insuficiencia renal moderada o severa (40).
La ERC debe diagnosticarse cuando se descubre albuminuria, la creatinina plasmática aumentada, o por ambas alteraciones. La creatinina elevada tiene sólo el valor de reconocer la disfunción renal, ésta debe calificarse por el nivel del FG calculado según la creatinina, el sexo y la edad del paciente mediante la fórmula MDRD.
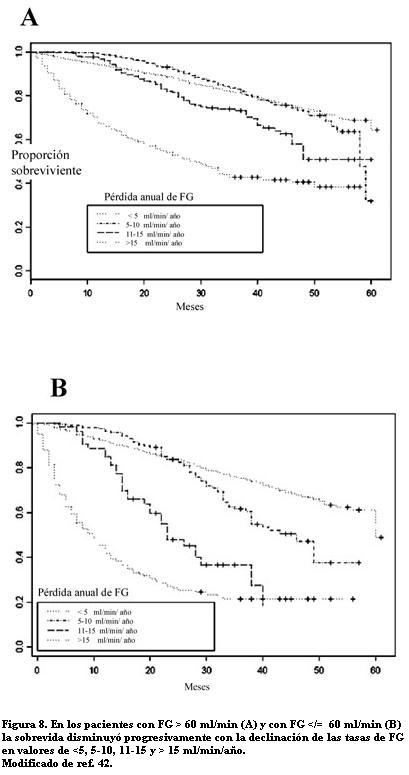
La ERC desarrolla una velocidad de progresión más rápida a la falla renal en los pacientes con cardiopatía, sea ésta una FCC o un IAM (39). Mientras que la declinación normal del FG con la edad en adultos sin ERC es 1 ml/min/año, después de un IAM la ERC progresa con una declinación del FG de 5 ml/min/año (41). Recientemente se observó en 6.640 pacientes con disfunción sistólica ventricular izquierda, que los portadores de ERC aceleraban la declinación del FG y que esto se asociaba con un significativo aumento de la mortalidad. Las mayores tasas de muerte fueron independientes de la clase funcional de la FCC, de la progresión de la FCC, y del nivel inicial de función renal (figura 8) (42). Los autores subrayan la importancia de las medidas seriadas del FG en la determinación del pronóstico de la cardiopatía y se preguntan si las medidas dirigidas a preservar la función renal pueden mejorar la sobrevida de pacientes con FCC.
A su vez, la ERC acelera la evolución de la cardiopatía. En el estudio de prevención y tratamiento SOLVD, sobre pacientes con disfunción ventricular izquierda con o sin síntomas, la IR moderada (clearance de creatinina menor de 60 ml/min/1,73 m2) predijo un aumento de la mortalidad total, que se explicó por la progresión más rápida de la falla cardíaca (43).
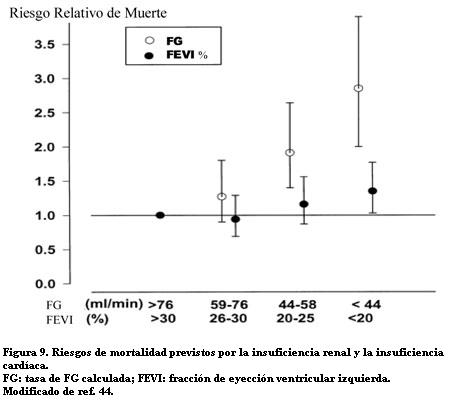
En pacientes con falla cardíaca avanzada la insuficiencia renal predice la mortalidad con más fuerza que la insuficiencia cardíaca valorada por la FEVI y la clase NYHA (figura 9) (44). En ese estudio la disfunción renal no se relacionó con la FEVI, lo que sugiere que factores distintos a la caída del gasto cardíaco estarían vinculados con la muerte.
En la falla cardíaca sistólica estable (6.800 pacientes ambulatorios seguidos durante tres años), Schlipak observó aumentos de la mortalidad a partir del nivel de insuficiencia renal moderada: el riesgo de muerte aumentó 22% con FG 40-50 ml/min, 42% con FG 30-40 ml/min, y se duplicó en la insuficiencia renal severa, con FG 15-30 ml/min, independientemente de otros factores de riesgo (45). En la serie de McClellan (39) la presencia de ERC en los pacientes con FCC o IAM se asoció con mayores tasas de reingreso postalta y mortalidad anual.
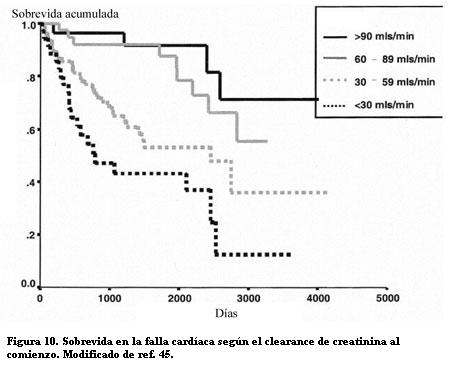
En 754 pacientes añosos con falla cardíaca sistólica o diastólica, de los cuales 43% tenían FEVI menor de 35%, la sobrevida disminuyó progresivamente con cada estadio de la ERC (figura 10) (45). La mortalidad aumentó 1% por cada disminución de 1 ml/min del FG, con independencia de otros factores de riesgo.
B) PACIENTES CON CARDIOPATíA ISQUéMICA
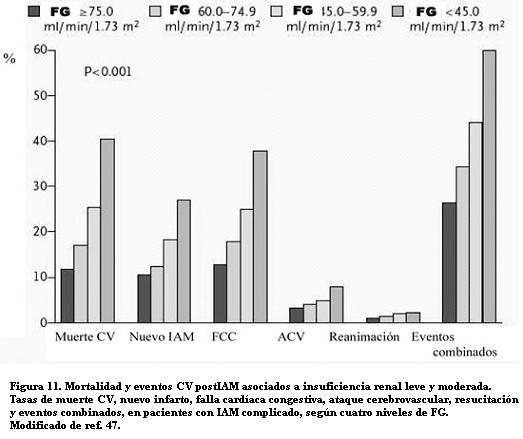
La morbimortalidad de las cardiopatías isquémicas aumenta en presencia de una ERC. En pacientes añosos hospitalizados por IAM las insuficiencias renales leves y moderadas aumentaron 68% el riesgo de muerte por mes; la insuficiencia renal severa subió ese riesgo 2,4 veces (46). Los niveles leve y moderado de insuficiencia renal deben ser considerados como factores mayores de riesgo de muerte después de un IAM. En 14.527 pacientes del estudio VALIANT, con IAM complicado con falla cardíaca o disfunción ventricular izquierda, se observó que la mortalidad y los eventos CV aumentaban gradualmente con el descenso de los niveles de FG entre >75 y <45 ml/min/1,73 m2 (figura 11) (47).
La probabilidad de desarrollar falla cardíaca fue casi tres veces mayor en los casos con FG menor de 45 ml/min/1,73 m2 que en los casos con FG mayor de 75 ml/min/1,73 m2.
Cuando el IAM no se acompaña de falla cardíaca ni hipotensión arterial, la insuficiencia renal leve y la moderada predicen el desarrollo de falla cardíaca congestiva en 40% de los casos por año (46). Esta comprobación, en un estudio que se limitó a pacientes con IAM sin desequilibrios hemodinámicos, permite concluir que la falla cardíaca se desarrolla con rapidez cuando hay IR moderada, y sugiere la necesidad de revisar los tratamientos cardiológicos usuales cuando se descubre insuficiencia renal.
Recientemente, Al Suwaidi en un análisis de más de 18.000 pacientes con síndromes coronarios agudos, que abarcó los estudios GUSTO, PARAGON-A y PURSUIT, observó que en los pacientes con IAM (con y sin elevación ST) la disminución del clearance de creatinina se asociaba en forma independiente con mayores riesgos de muerte y muerte por infarto de miocardio a corto plazo (48).
El estudio GRACE, sobre 11.700 pacientes hospitalizados por síndromes coronarios agudos, mostró que los que tenían clearance de creatinina entre 30 y 60 ml/min (insuficiencia renal moderada) duplicaban el riesgo de muerte comparados con los pacientes con clearance mayor; y los pacientes con clearance de creatinina menor de 30 ml/min (insuficiencia renal severa) multiplicaban casi por cuatro la mortalidad postajuste a variables de confusión (49). En la cardiopatía isquémica, el descenso de los clearances de creatinina desde > 100 a < 60 ml/min/1,73 m2 duplican la probabilidad de isquemia inducida por ejercicio (50); y clearances menores de 60 ml/min/1,73 m2 disminuyen la capacidad de ejercicio físico, independientemente de la existencia de anemia (hemoglobina menor de 12g/dl) (51).
En el estudio HERS (Heart and Estrogen/progestin Replacement Study) sobre 2.391 mujeres postmenopáusicas con cardiopatía isquémica sin falla cardíaca, la diabetes fue el factor de predicción más fuerte del desarrollo de falla cardíaca congestiva, fatal o no, en seis años. La tasa anual de falla cardíaca fue 2,8%, la asociación de diabetes con obesidad (IMC mayor de 35 kg/m2) duplicó esa incidencia (7%), mientras que la asociación de diabetes con clearance de creatinina menor de 42 ml/min multiplicó por cuatro la tasa de falla cardíaca (12,8%). El riesgo vinculado a la insuficiencia renal fue independiente de la HA, el tabaquismo, la HVI, el infarto de miocardio, la fibrilación auricular y el bloqueo de rama izquierda (52).
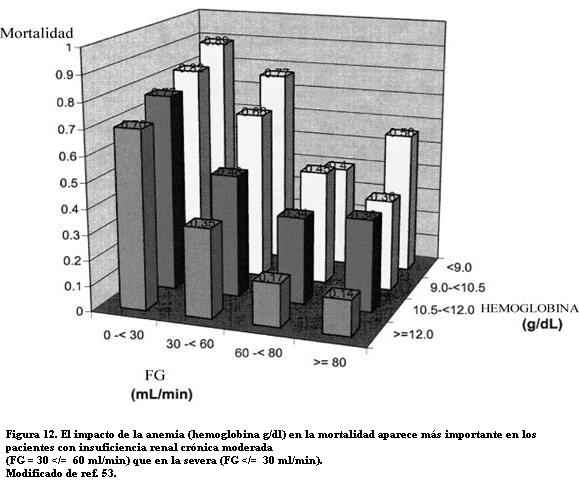
En un estudio canadiense de 5.549 adultos (edad media 66 años) ingresados por diversas cardiopatías (IAM, FCC, angina inestable o fibrilación auricular), se observó que el riesgo de muerte crecía con la insuficiencia renal y con la agravación de la anemia estratificada en cuatro niveles de hemoglobina entre > 12 y < 9 g/dl (figura 12) (53). El resultado fue independiente de la edad, el sexo y los factores de riesgo CV tradicionales.
En el estudio ARIC, de pacientes sin eventos CV al comienzo, la asociación de insuficiencia renal crónica y anemia aumentó el OR de muerte a 2,74 (95% CI, 1,42 a 5,28) (54).
V. ALBUMINURIA Y RIESGO CARDIORRENAL
Richard Bright (1789-1858) señaló la coincidencia de riñones atróficos y cardiomegalia en autopsias de enfermos nefríticos. Como explicación del hallazgo propuso la hipótesis de un aumento del trabajo cardíaco necesario para impulsar la sangre a través de riñones esclerosos. La idea, que prefigura el concepto de HA, surgió durante los estudios que Bright hacía sobre 'casos y observaciones ilustrativos de enfermedad renal acompañada con la secreción de orina albuminosa' (55). Esta fue la primera observación de un vínculo entre la enfermedad renal albuminúrica y una cardiopatía.
La excreción urinaria de albúmina, indicadora de patología glomerular, es reconocida hoy como: 1) signo de daño renal; 2) factor principal de la progresión de la ERC hacia la falla renal, debida al daño túbulo-intersticial causado por la sobrecarga de proteínas reabsorbidas en el túbulo (56); 3) factor independiente de riesgo de desarrollar enfermedad CV, y predictor de alta mortalidad.
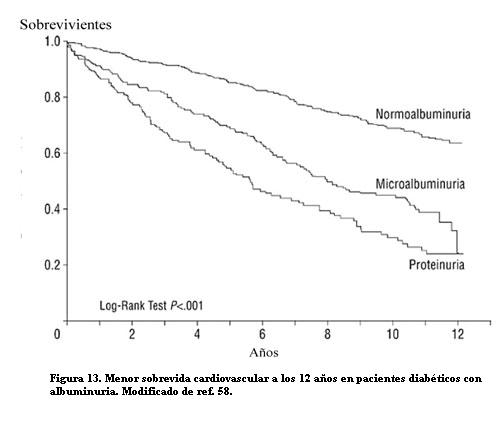
El riesgo CV asociado a la excreción urinaria de albúmina fue reconocido primero en los pacientes con diabetes mellitus tipo 2 (57). El riesgo crece con la magnitud de la albuminuria. En un estudio de 840 pacientes con diabetes 2, la microalbuminuria y la proteinuria mayor se asociaron significativamente con la mortalidad total y CV (cerebrovascular y coronaria): los pacientes con microalbuminuria tuvieron una sobrevida menor que los que tenían valores de albúmina considerados normales, y la sobrevida disminuyó aun más en los que tenían proteinuria franca (figura 13). La asociación fue independiente de los factores tradicionales de riesgo CV y de otras variables relacionadas con la diabetes (58).
La magnitud de la albuminuria se mide usualmente por su tasa de excreción en 24 horas (mg/24h) o por su concentración por litro (mg/L) o por la relación: albuminuria/gramo de creatinina urinaria (mg/g de Crur). Se distinguen tres niveles de albuminuria, según los valores de corte entre albuminuria normal, microalbuminuria y proteinuria o macroalbuminuria (figura 14).
El UKPDS (United Kingdom Prospective Diabetes Study) estudió el riesgo de nefropatía y muerte CV asociado a los niveles de albuminuria en la diabetes 2. Se halló que a los diez años del diagnóstico de diabetes 25% de los pacientes presentaba una ERC; las tasas de muerte aumentaron desde 0,7%/año en los diabéticos sin nefropatía a 2% en los que tenían microalbuminuria, 3,5% en los casos con macroalbuminuria y 12,1% cuando había insuficiencia renal. La mortalidad CV ocupó más de 60% de la mortalidad total (59). En otro estudio (IDNT Cohort), efectuado en una población de 1.715 pacientes hipertensos con diabetes 2 y ERC (albuminuria <900 mg/día, creatinina plasmática entre 1 y 3 mg/dl), los riesgos de IAM, falla cardíaca y ataque cerebrovascular aumentaron en relación con la magnitud de la albuminuria, en forma independiente de otros factores tradicionales de riesgo coronario (60).
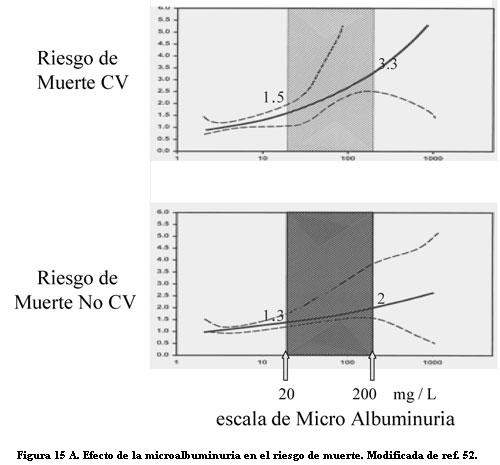
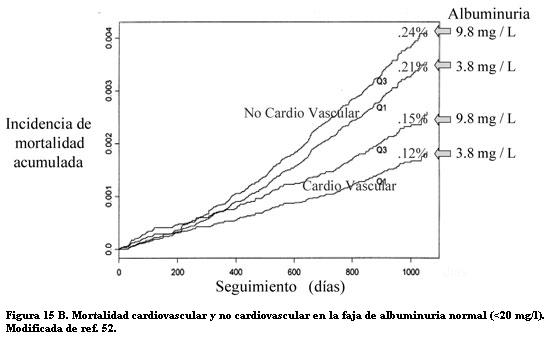
También fuera de la diabetes la albuminuria se mostró asociada con alta incidencia de enfermedad y muerte CV. En la población general, Borch observó una duplicación del riesgo de cardiopatía isquémica cuando existía albuminuria, independiente de los factores de riesgo CV: sexo masculino, HA sistólica, tabaquismo, hipercolesterolemia, bajo HDL (61). En la población general el riesgo CV crece con los niveles de la albuminuria. En una población de más de 40.000 individuos, de los que 7,2% tenían microalbuminuria, se vio que al duplicarse los valores de albuminuria el riesgo relativo de muerte CV aumentaba 29%, y el de muerte por otras causas 12%, ajustados a otros factores de riesgo (62). En ese estudio la mortalidad CV creció sostenidamente con el aumento de la excreción de albúmina dentro de la escala de microalbuminuria (figura 15 A). Además se vio que valores bajos de excreción de albúmina, inferiores a la microalbuminuria y considerados normales, predijeron mayor mortalidad CV y no CV a tres años, cuando la albuminuria aumentaba de 4 a 10 mg/l (figura 15 B).
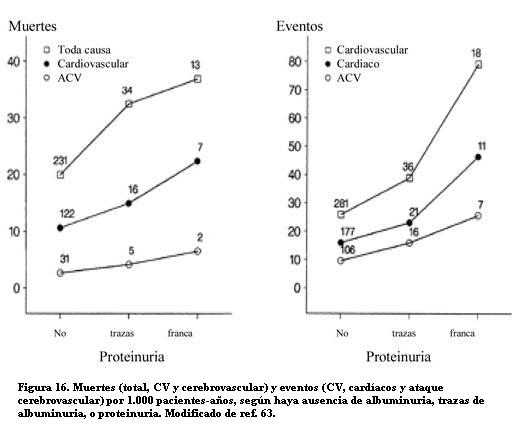
En poblaciones seleccionadas por la existencia de otros factores de riesgo, la albuminuria predijo también mayores probabilidades de daño CV. El estudio Syst - Eur Trial, en pacientes añosos con hipertensión sistólica aislada, observó que las muertes por enfermedad CV y los eventos cerebrales y cardíacos aumentaban sostenidamente con la presencia de albuminuria y con su magnitud (figura 16) (63).
En el INSIGHT Trial se estudiaron pacientes hipertensos esenciales, tratados con una dihidropiridina de larga acción o un diurético para disminuir eventos CV y mortalidad. Los riesgos de muerte CV, de IAM, falla cardíaca y ataque cerebrovascular aumentaron con la elevación de la creatina plasmática, la reducción del clearance de creatinina y con la presencia de albuminuria, después de ajuste a otros factores de riesgo (64). El análisis halló, además, que la proteinuria disminuía el porcentaje de los pacientes que alcanzaban el objetivo terapéutico antihipertensivo. El mismo estudio (INSIGHT) demostró que la albuminuria representaba un riesgo CV muy poderoso, similar al riesgo asociado con un IAM o con elevaciones de la creatinina plasmática, e independiente de otros factores (65) . En el LIFE Study (66), sobre 8.206 pacientes entre 55 a 80 años con HA e HVI, se vio que las tasas de enfermedad y muerte CV aumentaban en forma continua con los valores de albuminuria, ajustada a masa VI, score de riesgo Framingham y tratamientos recibidos. No se encontró un valor de albuminuria que señalara un umbral del riesgo CV, el que aumentaba ya con valores de albuminuria muy inferiores a los conocidos para pacientes diabéticos, coincidiendo con las tendencias encontradas en el estudio HOPE (67). La asociación entre eventos CV y albuminurias inferiores a microalbuminuria se confirmó en el Framingham Heart Study donde, en una muestra de individuos de 55 años de edad media, sin HA, sin diabetes y libres de daño CV, las albuminurias claramente más bajas que la microalbuminuria predijeron mayor riesgo de enfermedad y muerte CV (68). Esta observación refuerza la creciente evidencia contraria a considerar normal la excreción de albúmina menor de 30 mg/g creatininuria.
Los mecanismos que vinculan la excreción de albúmina con el daño CV no se conocen claramente. Se postula que la albuminuria refleja un defecto de la función endotelial sistémica (disfunción endotelial) que afecta distintos órganos (69) y que inicia la aterogénesis. El factor más importante de la disfunción endotelial en la ERC es el exceso de ADMA, la que junto al alto estrés oxidativo deprime la síntesis endotelial de óxido nítrico (70) y la capacidad de vasodilatación. En pacientes añosos con o sin diabetes mellitus, la microalbuminuria se asocia linealmente con defectos de la vasodilatación dependiente del endotelio, lo que apoya la hipótesis de que la baja disponibilidad de óxido nítrico es un importante eslabón entre la microalbuminuria y el daño CV (71). Por otra parte, la evidencia de que la reducción de la albuminuria con fármacos inhibidores de la angiotensina II (IECA) y antagonistas de receptores AT1 (ARA II) protege las funciones renal y cardíaca, refuerza la vinculación patogénica probable entre la albuminuria y el daño renal (72), y el daño CV (73).
Se ha visto que la prevalencia de la microalbuminuria y su vinculación con la cardiopatía isquémica varían según la etnia y el sexo: la asociación de microalbuminuria y mortalidad por cardiopatía isquémica es más fuerte en las mujeres europeas y en pacientes sudasiáticos; en cambio, en pacientes africanos no se encuentra asociación, aunque presentan mayor prevalencia de microalbuminuria (74). No habría, en cambio, diferencias étnicas en la influencia de la albuminuria sobre la progresión de la ERC. Un análisis del estudio RENAAL ha mostrado que el nivel de la albuminuria al comienzo de los seguimientos es el factor más fuerte para predecir la progresión a la falla renal, y que la reducción de la albuminuria con losartán se asocia con menor riesgo de falla renal y es nefroprotector en todos los grupos étnicos (75).
VI. CONCLUSIóN
Los pacientes con una ERC presentan mayor riesgo de eventos coronarios y cerebrovasculares y mayor mortalidad por enfermedad CV, que los individuos sin ERC. La existencia de albuminuria y la disminución del FG predicen el daño CV desde los primeros estadios de la ERC. El riesgo es independiente de los factores tradicionales y se observa en la población general, en los pacientes diabéticos y en otros grupos con alto riesgo CV. La albuminuria refleja la disfunción endotelial, que es un evento temprano de importancia fisiopatológica en la aterogénesis; la disminución del filtrado glomerular se asocia con un desarrollo acelerado de la aterosclerosis. La ERC sufre una declinación más rápida del FG cuando se complica con una cardiopatía, y a su vez facilita la progresión de la cardiopatía isquémica hacia la falla cardíaca. La medida de la albuminuria y la estimación del filtrado glomerular son dos recursos clínicos capitales para clasificar la ERC y definir el pronóstico CV, independiente de la presencia de daño CV, así como para la indicación de medidas de protección cardiorrenal.
BIBLIOGRAFíA
1. Lindner A, Charra B, Sherrard D, Scribner B. Accelerated atherosclerosis in prolonged maintenance hemodialysis. New Engl J Med 1974; 290: 697-701.
2. Parfrey P, Foley R. The clinical epidemiology of cardiac disease in chronic uremia. J Am Soc Nephrol 1999; 10: 1053-8.
3. Parekk R, Carroll C, Wolfe R, Port F. Cardiovascular mortality in children and young adults with end stage kidney disease. J Pediatr 2002; 141: 191-7.
4. Stenvinkel P, Heimbürger O, Paultre F, Diczfalusy U, Wang T, Berglund L, et al. Strong association between malnutrition, inflammation, and atherosclerosis in chronic renal failure. Kidney Int 1999; 55: 1899-911.
5. McEniery C, Yasmin, Wallace S, Maki-Petaja K, McDonnell B, Sharman J, et al. Increased stroke volume and aortic stiffness contribute to isolated systolic hypertension in young adults. Hypertension 2005; 46: 221-6.
6. Ventura J. Alta presión de pulso y riesgo cardiovascular. Nefrología Latinoamericana 2004; 11: 25.
7. Bianchi M, Fernández-Cean J, Carbonell E, Bermúdez C, Manfredi J, Folle L. Encuesta epidemiológica de hipertensión arterial en Montevideo. Rev Med Uruguay 1994; 10: 113-20
8. Longenecker J, Coresh J, Powe N, Levey A, Fink N, Martin A, Klag M. Traditional cardiovascular Disease Risk Factors in Dialysis Patients Compared with the General Population: The CHOICE Study. J Am Soc Nephrol 2002; 13: 1918-27.
9. Himmelfarb J, Stenvinkel P, Ikizler A, Hakim R. The elephant in uremia: Oxidant stress as a unifying concept of cardiovascular disease in uremia. Kidney Int 2002; 62: 1524-38.
10. 1999 Report: Dialysis and Renal Transplantation, Canadian Organ Replacement Register. Ottawa, Ontario: Canadian Institute for Health Information, June 1999, Volume 1.
11. Foley R, Parfrey P, Hefferton D, Kent G, Murray D, Barre P. Advance prediction of early death in patients starting maintenance dialysis. Am J Kidney Dis 1994; 23: 836-45.
12. Foley R, Parfrey P, Harnett J, Kent G, Murray D, Barre P. The prognostic importance of left ventricular geometry in uremic cardiomyopathy. J Am Soc Nephrol 1995; 5: 2024-31.
13. Culleton B, Larson M, Wilson P, Evans J, Parfrey P, Levy D. Cardiovascular disease and mortality in a community-based cohort with mild renal insufficiency. Kidney Int 1999; 56: 2214-9.
14. Sarnak M. Decreased Glomerular Filtration Rate as a Risk Factor for CVD Outcomes. Hypertension 2003; 42: 1050-65.
15 National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: Evaluation, classification and stratification. Am J Kidney Dis 2002; 39, S1-S266.
16. Coresh J, Astor B, Greene T, Eknoyan G, Levey A. Prevalence of chronic kidney disease and decreased kidney function in the adult US population: Third National Health and Nutrition Examination Survey. Am J Kidney Dis 2003; 41: 1-12.
17. McDonald S, Russ G (eds) The Twenty Sixth Report of Australia and New Zealand and Transplant Registry [monografía en línea]. 2003 [ 21p.] Obtenido de: http://www.anzdata.org.au/ (consultado 14/8/06).
18. Flack J. Chronic Kidney Disease. Annual Data Report NKF KEEP. Am J Kidney Dis 2003; 42 (S4): S42-S48.
19. Wheeler D, Townend J, Landray M. Cardiovascular risk factors in predialysis patients. Baseline data from the Chronic Renal Impairment in Birmingham (CRIB) study. Kidney Int 2003; 63 (S84): S201-S203.
20. Dirks J, de Zeeuw D, Agarwal S, Atkins R, Correa-Rotter R, D'Amico G, et al; International Society of Nephrology Commission for the Global Advancement of Nephrology Study Group 2004. Prevention of chronic kidney and vascular disease: Toward global health equity-The Bellagio 2004 Declaration. Kidney Int 2005; 68 (s98): S1-S6.
21. World Health Organization. The World Health Report 2002 (monografía en línea)[ 162p]. Disponible en: http://www.who.int/whr/2002/en/whr02_es.pdf (consultado 7/8/06)
22. Preston E, Ellis M, Kulinskaya E, Davies A, Brown E. Association Between Carotid Artery Intima-Media Thickness and cardiovascular Risk Factors in CKD. Am J Kidney Dis 2005; 46: 856-62.
23. Mann J, Gerstein H, Pogue J, Lonn E, Yusuf S. Cardiovascular risk in patients with early renal insufficiency. Am J Cardiovasc Drugs 2002; 2: 157-62.
24 Yilmaz M, Saglam M, Caglar K, Cakir E, Sonmez A, Zoccali C, et al. The determinants of endothelial dysfunction in CKD: oxidative stress and asymmetric dimethilarginine. Am J Kidney Dis 2005; 47: 42-50.
25. Levy D, Garrison R, Savage D, Kannel W, Castelli W. Prognostic implications of echocardiographically determined left ventricular mass in the Framingham Herat Study. N Engl J Med 1990; 322: 1561-6.
26. Matteucci M, Wühl E, Picca S, et al and ESCAPE Trial Group. Left ventricular geometry in children with mild to moderate chronic renal insufficiency. J Am Soc Nephrol 2006; 17: 218-26.
27. Gómez A, Carbone C, Fortunato C, Pannone R, Ambrosoni P. Left ventricular hypertrophy in predialysis renal failure. Nephrol Dial Transplant 1999; 14: A125.
28. Leoncini G, Viazzi F, Parodi D, Ratto E, Vettoretti S, Vaccaro V, et al. Mild Renal Dysfunction and Cardiovascular Risk in Hypertensive Patients. J Am Soc Nephrol 2004; 15: S88-S90.
29. Stewart G, Gansevoort R, Mark P, Rooney E, McDonagh T, Dargie H, et al. Electrocardiographic abnormalities and uremic cardiomyopathy. Kidney Int 2005; 67: 217-26.
30. Henry R, Kamp O, Kostense P, Spijkerman A, Dekker J, Nijpels G, et al. Mild renal insufficiency is associated with increased left ventricular mass in men, but not in women: an arterial stiffness-related phenomenon. The HOORN Study. Kidney Int 2005; 68 ( 2): 673-9.
31. Ventura J, Tavella N, Romero C, Petraglia, Báez A, Muñoz L. Aortic valve calcification is an independent factor of left ventricular hypertrophy in patients on maintenance hemodialysis. Nephrol Dial Transplant 2002; 17: 1700.
32. Henry R, Kostense P, Bos G, et al. Mild renal insufficiency is associated with increased cardiovascular mortality: the Hoorn study. Kidney Int 2002; 62: 1402-7.
33. Levey A, Bosch J, Lewis J, Greene T, Rogers N, Roth D. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Modification of Diet in Renal Disease Study Group. Ann Intern Med 1999; 130: 461-70.
34. Manjunath G. Tighiouart H, Ibrahim H, MacLeod B, Salem D, Griffith J, et al. Level of kidney function as a risk factor for atherosclerotic cardiovascular outcomes in the community. J Am Coll Cardiol. 2003; 41 ( 1): 47-55 ARIC Study.
35. Muntner P, He J, Hamm L, Loria C, Whelton P. Renal insufficiency and subsequent death resulting from cardiovascular disease in the United States. J Am Soc Nephrol 2002; 13: 745-53.
36. Go A, Chertow G, Fan D, McCulloch Ch, Hsu Ch. Chronic Kidney Disease and the Risks of Death, Cardiovascular Events, and Hospitalization. N Engl J Med 2004; 351: 1296-305.
37. Mann J, Gerstein H, Pogue J, Bosch J, Yusuf S. Renal insufficiency as a predictor of cardiovascular outcomes and the impact of ramipril: the HOPE randomized trial. Ann Intern Med 2001; 134: 629-36.
38. Ruilope L, Salvetti A, Jamerson K, et al. Renal function and intensive lowering of blood pressure in hypertensive participants of the hypertension optimal treatment (HOT) study. J Am Soc Nephrol 2001; 12: 218-25.
39. McClellan W, Langston R, Presley R. Medicare Patients with cardiovascular Disease Have a High Prevalence of Chronic Kidney Disease and a High Rate of Progression to End-Stage Renal Disease. J Am Soc Nephrol 2004; 15: 1912-19.
40. McAlister F, Ezekowitz J, Tonelli M, Armstrong P. Renal insufficiency and heart failure: prognostic and therapeutic implications from a prospective cohort study. Circulation 2004; 109: 1004-9.
41. Hillege HL, van Gilst WH, van Veldhuisen DJ, Navis G, Grobbee DE, de Graeff PA, et al. Accelerated decline and prognostic impact of renal function after myocardial infarction and the benefits of ACE inhibition: the CATS randomized trial. Eur Heart J 2003; 24: 974-80.
42. Khan N, Ma I, Thompson Ch, Humphries K, Salem D, Sarnak M, et al. Kidney function and mortality among patients with left ventricular systolic dysfunction. J Am Soc Nephrol 2006; 17: 244-53.
43. Dries D, Exner D, Domanski M, Greenberg B, Stevenson L. The prognostic implications of renal insufficiency in asymptomatic and symptomatic patients with left ventricular dysfunction. J Am Coll Cardiol 2000; 35: 681-9.
44. Hillege H, Girbes A, de Kam P, Boomsma F, de Zeeuw D, Charlesworth A, et al. Renal function, neurohormonal activation and survival in patients with chronic heart failure. Circulation. 2000; 102: 203-10.
45. Shlipak M, Smith G, Massie B, Krumholz H. Renal Function, Digoxin Therapy, and Heart Failure Outcomes: Evidence from the Digoxin Intervention Group Trial. J Am Soc Nephrol 2004; 15: 2195-203.
46. Shlipak M. Association of renal insufficiency with treatment and outcomes after myocardial infarction in elderly patients. Ann Int Med 2002; 137 ( 7): 555-62.
47. Anavekar N, McMurray J, Velazquez E, Solomon S, Kober L, Rouleau J-L, et al. Relation between Renal Dysfunction and Cardiovascular Outcomes after Myocardial Infarction. N Engl J Med 2004; 351: 1285-95.
48. Al Suwaidi J, Reddan DN, Williams K, Pieper KS, Harrington RA, Califf RM, et al. Prognostic implications of abnormalities in renal function in patients with acute coronary syndromes. Circulation 2002; 106: 974-80.
49. Santopinto J, Fox K, Goldberg R, Budaj A, Pinero G, Avezum A, et al; GRACE Investigators. Creatinine clearance and adverse hospital outcomes in patients with acute coronary syndromes: findings from the global registry of acute coronary events. Heart 2003; 89 ( 9): 1003-8.
50. Ix J, Shlipak G, Liu H, Schiller N, Whooley M. Association between Renal Insufficiency and Inducible Ischemia in Patients with Coronary Artery Disease: The Heart and Soul Study. J Am Soc Nephrol 2003; 14 ( 12): 3233-8.
51. Odden M, Whooley M, Shlipak M. Association of Chronic Kidney Disease and Anemia with Physical Capacity: The Heart and Soul Study. J Am Soc Nephrol 2004; 15: 2908-15.
52. Bibbins-Domingo K, Lin F, Vittinghoff E, Barrett-Connor E, Hulley S, Grady D, et al. Predictors of Heart Failure Among Women With Coronary Disease. Circulation 2004; 110: 1424-30.
53. Keough-Ryan T, Kiberd B, Dipchand C, Cox J, Rose C, Thompson K, et al. Outcomes of acute coronary syndromes in a large canadian cohort: Impact of chronic renal insufficiency, cardíac interventions, and anemia. Am J Kidney Dis 2005; 46: 845.
54. Jurkovitz C, Abramson J, Vaccarino L, Weintraub W, McClellan W. Association of high serum creatinine and anemia increases the risk of coronary events (Results from the prospective community-based Atherosclerosis Risk in Communities (ARIC) study). J Am Soc Nephrol 2003; 14: 2919-25.
55. Bright R. Cases and observations, illustrative of renal disease accompanied with the secretion of albuminous urine. Guy's Hospital Reports 1; 1836: 1: 338-79.
56. Remuzzi G, Bertani T. Pathophysiology of progressive nephropathies. N Engl J Med 1998; 339: 1448-56.
57. Mogensen C. Microalbuminuria predicts clinical proteinuria and early mortality in maturity-onset diabetes. N Engl J Med 1984; 310: 356-60.
58. Valmadrid Ch, Klein R, Moss S, Klein B. The Risk of Cardiovascular Disease Mortality Associated With Microalbuminuria and Gross Proteinuria in Persons With Older-Onset Diabetes Mellitus. Arch Intern Med 2000; 160: 1093-100.
59. Adler A, Stevens R, Manley S, Bilous R, Cull C, Holman R on behalf of the UKPDS Group. Development and progression of nephropathy in type 2 diabetes: The United Kingdom Prospective Diabetes Study (UKPDS 64). Kidney Int 2003; 63: 225-32.
60. Anavekar N, Gans D, Berl T, Rohde R, Cooper W, Bhaumik A, et al. Predictors of cardiovascular events in patients with type 2 diabetic nephropathy and hypertension: A case for albuminuria. Kidney Int 2004; 66 (S92): S50-S55.
61. Borch-Johnsen K, Feldt-Rasmussen B, Strangaard S, et al. Urinary albumin excretion: An independent predictor of ischemic heart disease. Arterioscler Thromb Vasc Biol 1999; 19: 1992-7.
62. Hillege HL, Fidler V, Diercks GF, vanGilst WH, deZeeuw D, vanVeldhuisen DJ, et al. Urinary albumin excretion predicts cardiovascular and non cardiovascular mortality in general population. Circulation 2002; 106: 1777-82.
63. deLeeuw P, Thijs L, Birkenhäger W, Voyaki S, Efstratopoulos A, Fagard R, et al, for the Systolic Hypertension in Europe (Syst-Eur) Trial Investigators. Prognostic Significance of Renal Function in Elderly Patients with Isolated Systolic Hypertension: Results from the Syst-Eur Trial. J Am Soc Nephrol 2002; 13:2213-22.
64. deLeeuw P, Ruilope L, Palmer Ch, Brown M, Castaigne A, Mancia G, et al. Clinical Significance of Renal Function in Hypertensive Patients at High Risk Results From the INSIGHT Trial. Arch Intern Med 2004; 164: 2459-64.
65. Brown MJ, Palmer CR, Castaigne A, de Leeuw PW, Mancia G, Rosenthal T, et al. Morbidity and mortality in patients randomised to double-blind treatment with a long-acting calcium-channel blocker or diuretic in the International Nifedipine GITS Study: Intervention as a goal in Hypertension Treatment (INSIGHT). Lancet 2000; 356: 366-72.
66. Ibsen H, Wachtell K, Olsen M, Borch-Johnsen K, Lindholm L, Mogensen C, et al. Albuminuria and cardiovascular risk in hypertensive patients with left ventricular hypertrophy. Kidney Int 2004; 66 (S92): S56-S58.
67. Gerstein H. HOPE study. JAMA 2001, 286: 421-4.
68. Ärnlöv J, Evans J, Meigs J, Wang Th, Fox C, Levy D, et al. Low-Grade Albuminuria and Incidence of Cardiovascular Disease Events in Nonhypertensive and Nondiabetic Individuals. The Framingham Heart Study. Circulation 2005; 112: 969-75.
69. Deckert T, Feldt-Rasmussen B, Borch-Johnsen K, Jensen T, Kofoed-Enevoldsen A. Albuminuria reflects widespread vascular damage. The Steno hypothesis. Diabetologia 1989; 32: 219-26.
70. Sydow K, Münzel T. ADMA and oxidative stress. Atherosclerosis 2003; suppl 4: 41-51.
71. Stehouwer C, Henry R, Dekker J, Nijpels G, Heine R, Bouter L. Microalbuminuria is associated with impaired brachial artery, flow-mediated vasodilation in elderly individuals without and with diabetes: Further evidence for a link between microalbuminuria and endothelial dysfunction - The Hoorn Study. Kidney Int 2004; 66: S42-S44.
72. De Zeeuw D, Remuzzi G, Parving HH, Keane WF, Zhang Z, Shahinfar S, et.al. Proteinuria, a target for renoprotection in patients with type 2 diabetic nephropathy: lessons from RENAAL. Kidney Int 2004; 65: 2309-20.
73. Jacobsen P, Parking H. Beneficial impact on cardiovascular risk factors by dual blockade of the renin-angiotensin system in diabetic nephropathy. Kidney Int 2004; 66: S108-S110.
74. Tillin T, Forouhi N, McKeigue P, Chaturvedi N. Microalbuminuria and coronary heart disease risk in an ethnically diverse UK population: a prospective cohort study. J Am Soc Nephrol 2005; 16 ( 12): 3702-10.
75. de Zeeuw D, Ramjit D, Zhang Z, Ribeiro A, Kurokawa K, Lash J, et al. Renal risk and renoprotection among ethnic groups with type 2 diabetic nephropathy: A post hoc analysis of RENAAL. Kidney Int 2006; 69 ( 9): 1675-82. .