Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.21 no.2 Montevideo set. 2006
ARTÍCULO ORIGINAL
Variantes de los genes CYP2C9 y apolipoproteína E en la respuesta individual a la warfarina
DRES. VíCTOR RAGGIO 1,3, PATRICIA ESPERóN 1,4, MARIANA LORENZO 1, IRENE TAUB 2, ALEJANDRO CUESTA 2, ADRIANA RODRíGUEZ 2, VIRGINIA ORTIZ 2, FERNANDO KUSTER 2, RICARDO LLUBERAS 2, MARIO STOLL 1
1. Área Genética Molecular, Comisión Honoraria para la Salud Cardiovascular (CHSCV).2. Servicio de Cardiología, Hospital de Clínicas.
3. Departamento de Genética, Facultad de Medicina.
4. Cátedra Biología Molecular, Facultad de Química.
Este trabajo fue financiado parcialmente por la CHSCV como parte de sus programas de aplicación de la genética a la prevención de la mortalidad cardiovascular. Parte de los diagnósticos moleculares fueron financiados por la empresa ATGen Sistemas Moleculares – Celsius, Montevideo, Uruguay, a través de la donación de los kits necesarios para la realización del diagnóstico genotípico de CYP2C9. Los realizadores del proyecto no recibieron recursos extra por parte de esta u otras empresas.
Correspondencia: Dr. G. Mario Stoll. Área Genética Molecular, CHSCV. Bvar. Artigas 2358, Montevideo, Uruguay.
E-mail: mstoll@montevideo.com.uy
Este trabajo obtuvo el premio a la mejor comunicación libre entre los presentados al 21º. Congreso Uruguayo de Cardiología
RESUMEN
Introducción: la warfarina es el anticoagulante oral más usado en nuestro país y uno de los más usados a nivel mundial. Variantes polimórficas en varios genes influencian la respuesta individual a este fármaco, especialmente de CYP2C9 y de la apolipoproteína E. Nos proponemos estudiar la influencia en una población de pacientes uruguayos de estas variantes en la variabilidad interindividual en la respuesta a la warfarina y el riesgo de efectos adversos durante el tratamiento anticoagulante oral.
Material y método: se incluyeron 55 pacientes en tratamiento crónico con warfarina. Se relevaron datos sobre dosis de mantenimiento, respuesta farmacocinética y efectos adversos. Se determinó el genotipo de los pacientes para las variantes *1, *2 y *3 de CYP2C9 y E2, E3 y E4 de apolipoproteína E.
Resultados: los portadores de la variante *3 son los que requirieron dosis diarias de mantenimiento menores, seguidos por los portadores del alelo *2 y luego los homocigotos *1 (p=0,049). Los portadores de la variante *3 tuvieron también una mayor frecuencia de la tasa internacional normalizada (INR) por encima del rango deseado y requirieron más ajustes de dosis para lograr una adecuada anticoagulación; los eventos adversos fueron más frecuentes en los pacientes de genotipo *1/*3, tanto en relación al riesgo de sangrado como de sobreanticoagulación. La presencia del alelo E4 de la ApoE se asocia levemente a una mayor sensibilidad a la warfarina.
Conclusiones: en el presente estudio, realizado en la primera población nacional proveniente de una policlínica de hipocoagulación, se confirma una mayor sensibilidad a la warfarina de los portadores de alelos variantes *2 y *3 de CYP2C9 y de la variante E4 de la ApoE, lo que puede tener importancia en la individualización de la dosis y los riesgos durante el tratamiento con este fármaco. La determinación del genotipo del paciente debería tomarse en cuenta en: situaciones de alto riesgo presumible, para explicar fisiopatológicamente eventos adversos durante la anticoagulación y en pacientes jóvenes sometidos a procedimientos de cirugía cardíaca, que se enfrentan potencialmente a varios años de anticoagulación. Se continuará este primer estudio para la evaluación ulterior del componente genómico de riesgo en la anticoagulación.
PALABRAS CLAVE: GENES
WARFARINA
APOLIPOPROTEÍNAS E
[RELACION DOSIS –
RESPUESTA DROGA]
SUMMARY
Introduction: warfarin is the most frequently used oral anticoagulant in Uruguay and worldwide. Polymorphic variants in various genes modulate individual response to this drug, especially CYP2C9. We studied the influence of these genetic variants on interindividual variability in response to warfarin and the risk of adverse reactions in an uruguayan population.
Materials and methods: the study involved 55 patients undergoing chronic oral anticoagulant treatment with warfarin. Data on daily maintenance dose, pharmacokinetic response and adverse reactions was collected. CYP2C9 *1, *2 and *3, and Apoe E2, E3 and E4, genotype was determined by standard procedures.
Results: carriers of CYP2C9 *3 allele required the lesser manteinance dose, followed by *2 allele carriers and then *1 homocygotes (p=0.049). CYP2C9 *3 allele carriers had more episodes of above de range International Normalized Ratio and required more dose adjustments to achieve a proper anticoagulation; adverse events were more frequent in patients with CYP2C9 *1/*3, regarding bleeding events as wells as overanticoagulation. Presence of ApoE E4 allele is associated with a moderately elevated sensibility to warfarin.
Conclusions: this study is the first carried out on this subjet in an uruguayan population and confirms an increased sensibility to warfarin and risk of adverse effects in carriers of CYP2C9 *3 allele and in carriers of ApoE E4 variant, wich could be useful in warfarin dose and risk individualization during treatment with this drug. Genotypic data should be considered when establishing the best individual dose for individuals at high risk of bleeding, in those who suffered an adverse effect with this drug for physiopathlogic diagnosis and in young patients who underwent cardiac surgery who would potentially face a long term anticoagulant therapy. We will continue evaluating genomic components of risk during anticoagulation
KEY WORDS: GENES
WARFARIN
APOLIPOPROTEINS E
[DOSE RESPONSE
RELATIONSHIP, DRUG]
INTRODUCCIóN
La warfarina es el anticoagulante oral más usado en nuestro país y uno de los más usados a nivel mundial. Está ampliamente demostrada su efectividad en la prevención del accidente cerebrovascular en los pacientes con fibrilación auricular (1). Debido a su rango terapéutico estrecho, a su uso en pacientes ancianos y con daño en el árbol vascular, se asocia con un riesgo significativo de sangrado y requiere un monitoreo frecuente del tratamiento. Por otra parte, las dosis de mantenimiento y la respuesta a este fármaco, en relación al efecto anticoagulante y la necesidad de ajustes, es muy variable entre los pacientes (2). Parte de esta variabilidad interindividual es debida a características genéticas de los pacientes (3). Actualmente, en la “era genómica” de la medicina (4), se comienzan a conocer algunos de los genes que determinan esta variabilidad y que pueden influir en las conductas terapéuticas (5).
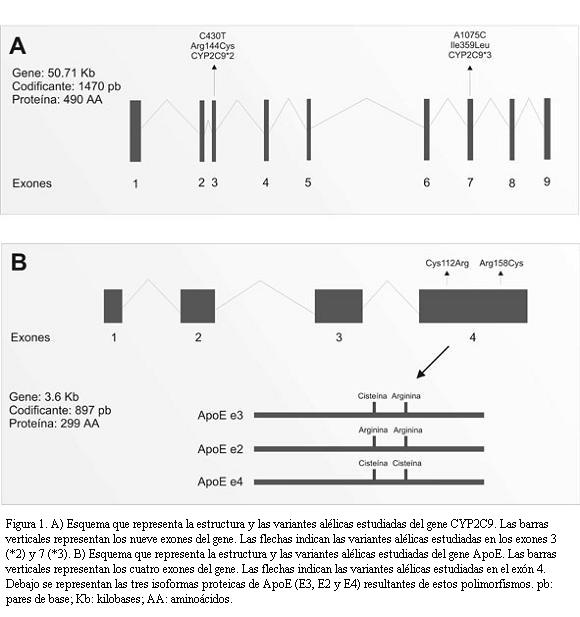
El principal de estos genes, vinculado fundamentalmente a una mayor sensibilidad a la warfarina, es CYP2C9 (10q24.2) (6). Este gen codifica una hidroxilasa dependiente del citocromo P-450, principal metabolizador de la warfarina (7). Se han reportado diversas variantes alélicas (polimorfismos) de este gen, dos de los cuales son funcionalmente relevantes: los alelos CYP2C9*2 (Arg144Cys) y CYP2C9*3 (Ile359Leu) (figura 1A). Dichas variantes tienen un metabolismo deficiente de la hidroxilación de la S-warfarina in vitro. Se ha estimado que la variante *3 tiene una eficiencia de 5% y la *2 de 12% respecto del alelo normal en relación al metabolismo de la warfarina (8). En los portadores del alelo *3 el clearance de warfarina está entre un 40% y un 75% del de los homocigotos *1/*1 (9). Asimismo, varios estudios han analizado la asociación de estos alelos con diversos fenotipos vinculados al tratamiento anticoagulante con warfarina (10-12). De estos estudios se destaca que existe una fuerte asociación entre los alelos variantes de CYP2C9 y el requerimiento de dosis menores de warfarina (es decir, se trataría de alelos que aumentan la sensibilidad a la warfarina determinando un fenotipo “metabolizador lento”) y el riesgo de complicaciones hemorrágicas (13).
Se ha planteado que el polimorfismo de apolipoproteína E (ApoE) (19q13.2) modifique los requerimientos de anticoagulantes cumarínicos (14). La ApoE juega un rol fundamental en el metabolismo de los lípidos plasmáticos, que funciona como ligando de receptores de partículas lipoproteicas, y posiblemente afecte los niveles plasmáticos y la captación hepática de vitamina K. Dos polimorfismos simples en el gene ApoE dan lugar a tres isoformas proteicas denominadas e2, e3 y e4 (figura 1B), extensamente estudiadas en relación con la patología cardiovascular aterosclerótica y sus efectos sobre la concentración de lípidos plasmáticos (15). Los primeros estudios que analizan específicamente la respuesta a la warfarina en función del genotipo de ApoE, sugieren esta influencia, si bien no dan resultados concluyentes (16,17).
Dadas las diferencias en las frecuencias de diversos alelos en diferentes poblaciones, el efecto de genotipos específicos sobre la respuesta a fármacos puede ser también variable de población a población; por este motivo, las asociaciones farmacogenéticas deben ser validadas para cada grupo étnico o población humana particular (18). Si bien hay abundante bibliografía sobre el efecto de las variantes de CYP2C9 en poblaciones europeas y norteamericanas, no hay datos sobre las mismas en Latinoamérica. En relación con los polimorfismos de ApoE, recién se están empezando a publicar trabajos en relación con su influencia sobre el tratamiento con warfarina y de obtenerse resultados consistentes sería otro de los factores genéticos a tener en cuenta a la hora de individualizar el tratamiento. Por lo tanto, en este trabajo nos planteamos como objetivo evaluar la influencia en una población de pacientes uruguayos del genotipo de CYP2C9 y de ApoE en la variabilidad interindividual en la respuesta a la warfarina y el riesgo de efectos adversos durante el tratamiento con este fármaco.
MATERIAL Y MéTODO
PACIENTES
Se incluyeron pacientes en régimen de anticoagulación crónica controlados en la Policlínica de Anticoagulación del Servicio de Cardiología del Hospital de Clínicas, entre setiembre de 2004 y junio de 2005. Luego de la consulta de control habitual y habiendo obtenido su consentimiento, se realizó una entrevista en la que se recabó la información previamente estipulada. Se obtuvieron datos sobre el seguimiento de cada paciente que se tenía en la ficha estandarizada de la policlínica. La realización de este estudio no alteró la práctica habitual y la aplicación de los protocolos establecidos para control de la anticoagulación en estos pacientes. En casos en que la historia del paciente o la historia familiar era sugestiva de un componente genético en la enfermedad cardiovascular, se incluyó a la familia en los programas preventivos desarrollados por la Policlínica de Genética Cardiovascular.
Se consideraron las variables: sexo, edad, indicación de anticoagulación y tabaquismo. Se tomó la dosis diaria de mantenimiento de warfarina indicada y se consideró como una dosis alta 8 mg/día. Ello surge de la media más un desvío estándar de la mejor estimación que tenemos de la dosis que se administra en nuestra policlínica (19). Se consideraron variables clínicas indicadoras de la respuesta farmacocinética: valores mínimo y máximo de la tasa internacional normalizada (INR), cantidad de ajustes de dosis necesarios, cantidad de INR por encima y por debajo del rango objetivo. Éstos se analizaron en relación con la cantidad de controles realizados. Creemos que estas tres variables definidas son más significativas de la dificultad en el manejo que normalizando las mismas al tiempo de seguimiento o a la asiduidad de consulta, o ambas, particularmente en el medio en que se realizó el estudio. Se registraron los eventos adversos y la ocurrencia de interacciones farmacológicas con consecuencias clínicas (sangrado o aumento del INR al introducir otra medicación). Se definió como evento adverso el aumento de INR por encima de 5 (sobreanticoagulación) y la ocurrencia de sangrados de cualquier entidad. Se consideraron sangrados mayores a los fatales, intracraneanos, oculares y que requirieron transfusión o internación. La indicación de anticoagulación se clasificó en: 1) prótesis valvular, aunque tuviera otra indicación; 2) fibrilación auricular, aunque hubiera sufrido un evento tromboembólico; 3) trombosis venosa profunda o tromboembolismo pulmonar, o ambos; 4) síndromes protrombóticos, y 5) otros, que incluye accidente cerebrovascular.
Los resultados de los diagnósticos moleculares fueron comunicados a los pacientes y los médicos tratantes en una consulta de asesoramiento genético y mediante un informe escrito, luego de finalizado el estudio.
DIAGNóSTICOS MOLECULARES
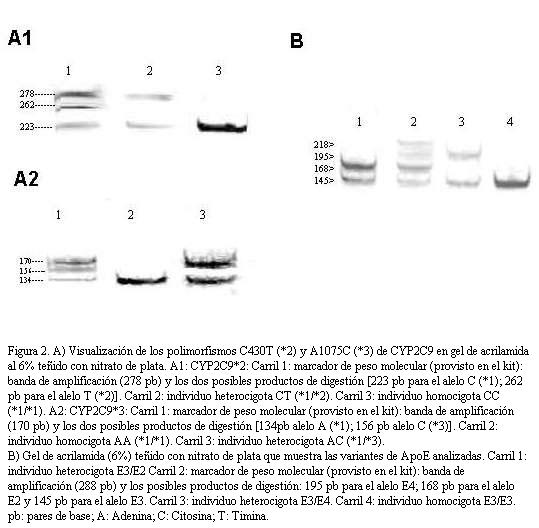
A partir de una muestra de sangre periférica (3 ml) se extrajo ácido desoxirribonucleico (ADN) del paciente mediante el uso de un kit de purificación de ADN genómico (Fermentas, Lituania) de acuerdo con el protocolo del fabricante. El genotipo de los pacientes para las variantes *1, *2 y *3 del gene CYP2C9; y E2, E3 y E4 del gene de la apolipoproteína E fue realizado utilizando kits diagnósticos comerciales (ATGen Sistemas Moleculares, Celsius, Uruguay). Brevemente, el método utiliza la amplificación por polymerase chain reaction (PCR) de segmentos de ADN del gene y la detección de la presencia/ausencia de la variante alélica en estudio por digestión con una enzima de restricción específica y posterior determinación electroforética de la longitud de los fragmentos generados (figura 2).
ANáLISIS ESTADíSTICO
El análisis se realizó utilizando el paquete estadístico SPSS (SPSS para Windows versión 10.0.1). Las variables continuas se expresaron en media ± 1 DS y se informó la cota superior e inferior cuando se entendió conveniente. Para la comparación de las edades se usó ANOVA de una vía. Se asumió que el resto de las variables continuas no tenían una distribución normal y, por lo tanto, se utilizaron los tests de Mann-Whiney y Kruskal Wallis. Las variables nominales se describen mediante frecuencia absoluta y relativa en porcentaje. Para su comparación se utilizó el test de chi cuadrado o test exacto de Fisher cuando correspondía. Se consideró significativo un valor p de dos colas menor o igual a 0,05.
El proyecto de investigación fue aprobado por el Comité de Ética del Hospital de Clínicas. En todos los casos se obtuvo consentimiento informado.
RESULTADOS
En el período mencionado se refirieron 55 pacientes y fueron todos incluidos y analizados. Las características de los mismos se presentan en la tabla 1. La mayoría fueron mujeres, la edad media 59 años y 71% estaban anticoagulados por tener una prótesis valvular o tener fibrilación auricular, o ambas. La dosis de mantenimiento diaria osciló entre 1,7 mg/día (11 mg/semanales) y 16,4 mg/día (115 mg/semanales) con una media de 6,0 mg/día.
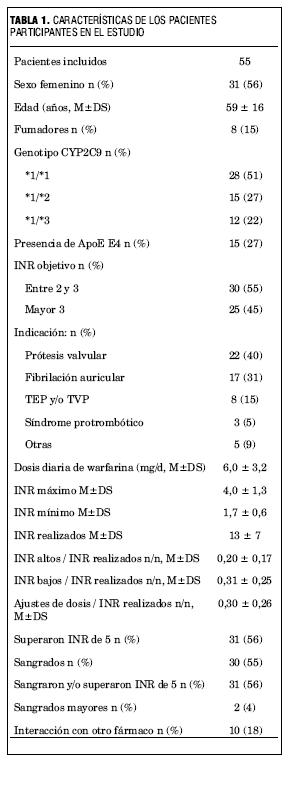
Se identificaron 28 (51%) individuos portadores del genotipo *1/*1, 15 (27%) del genotipo *1/*2 y 12 (22) del genotipo *1/*3. No se encontraron individuos homocigotos o heterocigotos compuestos para los alelos variantes estudiados. Hubo 15 (27%) individuos portadores del alelo E4 de la ApoE.
CYP2C9
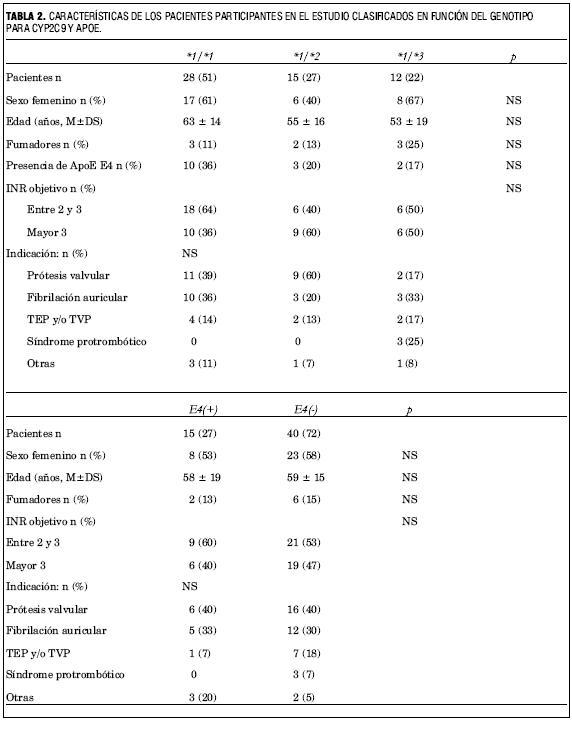
En la tabla 2 se muestran las características de los pacientes separados de acuerdo al genotipo de CYP2C9. No hubo diferencias significativas en cuanto edad, sexo, tabaquismo e indicación de la anticoagulación. Hubo una mayor frecuencia de portadores del genotipo ApoE E4+ entre los individuos de genotipo CYP2C9 *1/*1 respecto del resto, si bien la diferencia tampoco fue estadísticamente significativa (36% versus 20% y 17%).
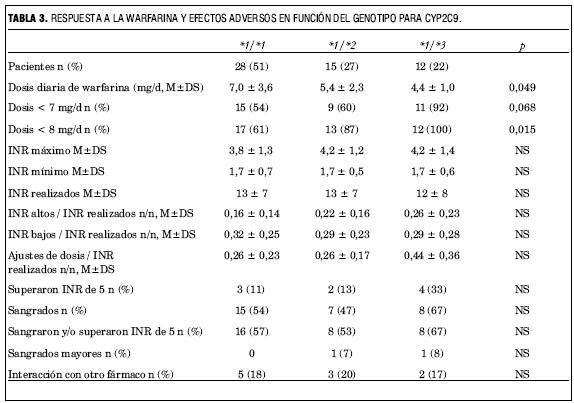
En relación con la respuesta farmacocinética y el riesgo de efectos adversos (tabla 3), los portadores de la variante *3 son los que requirieron dosis diarias de mantenimiento menores, seguidos por los portadores del alelo *2 y luego los homocigotos *1 (p=0,049). Ningún paciente de los portadores del alelo *3 y solo dos (13%) de los *2 tenía indicada una dosis de warfarina alta (= 8 mg/día) (p=0,015). Los portadores de esta variante tuvieron también una mayor frecuencia de INR por encima del rango deseado y requirieron más ajustes de dosis para lograr una adecuada anticoagulación, aunque estas diferencias no alcanzaron significación estadística.
Los eventos adversos fueron más frecuentes en los pacientes de genotipo *1/*3, tanto en relación al riesgo de sangrado como de sobreanticoagulación (p=NS). Ningún paciente de genotipo *1/*1 presentó un sangrado mayor. Los portadores del alelo *2 no presentaron un riesgo aumentado de sangrado.
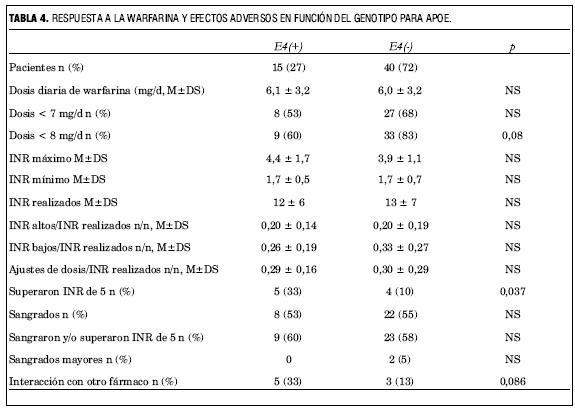
APOE
Para analizar el efectos de las variantes de ApoE se dividió a los pacientes en función de si eran portadores o no del alelo E4. En este análisis se evidencia que: no hay diferencias significativas en las características basales de los grupos así conformados (tabla 2); y que la presencia del alelo E4 de la ApoE se asocia levemente a una mayor sensibilidad a la warfarina (tabla 4). Si bien los pacientes portadores de este alelo requirieron dosis diarias de warfarina similares a los no portadores (6,1±3,2 versus 6,0±3,2 mg, p=NS), y no hubo diferencias significativas en la tasa de eventos adversos, más pacientes portadores del alelo E4 superaron un INR de 5 (33% versus 10%, p=0,037) y el INR máximo alcanzado por ellos fue mayor (4,4±1,7 versus 3,9±1,1) aunque la diferencia en este caso no fue significativa. Además, más pacientes de este grupo sufrieron una interacción farmacológica clínicamente significativa (33% versus 13%, p=NS).
PRESENCIA DE ALELOS DE RIESGO
Se analizaron los resultados de la anticoagulación en todos los pacientes clasificados en tres grupos; los que no tenían variantes genéticas consideradas sensibilizadoras frente a los efectos de la warfarina en ninguno de los dos genes analizados, los que tenían en uno y los que tenían en ambos (tabla 5). Las dosis de mantenimiento de warfarina fueron 7,2±3,8 mg, 5,5±2,6 mg y 4,9±3,1 mg, respectivamente, y a pesar de ello el INR máximo alcanzado fue creciente entre estos tres grupos (p=NS); 33% de los que no tenían una variante sensibilizadora recibían dosis altas (versus 20% de los otros dos grupos, p=NS). Los que no tenían ninguna variante no presentaron nunca INR por encima de 5 (versus 23% en los que tenían en uno de los genes y 40% en los que tenían en ambos, p=0,043), no presentaron sangrados mayores, muy pocas veces tuvieron interacciones con otros fármacos y requirieron menor número de ajustes de dosis.
COMBINACIóN DE GENOTIPOS
Entre los individuos *1/*1 para CYP2C9 (n=28), los portadores del alelo E4 de ApoE (n=10) reciben una dosis de mantenimiento de warfarina algo menor que los individuos que no portan este alelo (6,7±3,3 versus 7,2±3,9 mg, p= NS). Esta diferencia no se observa entre los portadores de alelos variantes de CYP2C9: ya que, entre los que tienen alguna de las variantes de CYP2C9 (n=27) los portadores del alelo E4 (n=5) de ApoE reciben dosis similares a los que no (4,9± 3,1 versus 5,0±2,1 mg). Los dos individuos que portan los genotipos *1/*3 de CYP2C9 y E4+ de ApoE son los que requieren las dosis más bajas de warfarina (2,5 mg/día); ambos han presentado INR por encima de 5 y sangrados.
DISCUSIóN
En el presente estudio, realizado en la primera población nacional proveniente de una policlínica de hipocoagulación, se confirma una mayor sensibilidad a la warfarina de los portadores de alelos variantes de CYP2C9 y de la variante E4 de la ApoE, lo que puede tener importancia en la individualización de la dosis y de los riesgos durante el tratamiento con este fármaco. Si bien son pocas las variables estudiadas en las que se han alcanzado diferencias significativas, las tendencias son siempre coherentes. Considerando el carácter multifactorial de las variables en estudio, pudiera ocurrir que el efecto genético que se busca evidenciar sea de una magnitud que no puede ser bien apreciada con nuestra muestra. Además, como se observa en la tabla 2, hay una mayor frecuencia de portadores del alelo E4 de ApoE entre los individuos de genotipo *1/*1 para CYP2C9, lo que probablemente sea debido al azar ya que ambos genes segregan independientemente, por lo que los genotipos de ApoE se deberían distribuir homogénemente entre los genotipos de CYP2C9. Esta asimetría seguramente está produciendo una atenuación de los efectos observados en este trabajo, ya que estos dos genotipos tienen efectos contrarios sobre la respuesta a la warfarina.
Las diferencias encontradas entre los pacientes portadores de los tres genotipos de CYP2C9 más frecuentes en la población son concordantes con lo reportado en la bibliografía y con la fisiopatología molecular de estas variantes. El producto del alelo *2 tiene una menor interacción con el cofactor citocromo P450 oxidoreductasa, lo que reduce la actividad máxima de la enzima (20), mientras que el producto del alelo *3 tiene una menor afinidad por la warfarina debido a que la sustitución Ile359Leu afecta al sitio de unión al sustrato (21). Esta variante tiene una eficiencia en la metabolización de la warfarina 95% menor que la del alelo normal, por lo que en general estos pacientes requieren dosis significativamente menores de warfarina para alcanzar los valores de INR deseados. Por otra parte, la variante *2 mantiene cierta actividad residual, por lo que es de esperar que en estado heterocigota reduzca levemente la dosis de warfarina requerida y no aumente significativamente los riesgos de sangrado.
Son menos conocidos los efectos de los polimorfismos de ApoE sobre la respuesta a la warfarina (14,16,17). En este estudio se muestra una tendencia a un mayor número de complicaciones (INR altos e interacciones farmacológicas) en los portadores del alelo E4. La vitamina K es transportada por quilomicrones y captada por el hígado a través de receptores de ApoE (22). Asimismo, se ha demostrado que este polimorfismo tiene influencia sobre fenotipos patológicos, como la osteoporosis, a partir de sus efectos sobre los lípidos plasmáticos y el transporte de vitamina K(23), por lo que este podría ser un mecanismo que explique estos hallazgos.
El conocimiento del genotipo de CYP2C9 permite una mejor valoración clínica tanto en situaciones posteriores al inicio del tratamiento como anteriores cuando se consideren riesgos por antecedentes personales o familiares, o por la extensión del tratamiento. Las indicaciones deben estar centradas en la prevención de accidentes hemorrágicos. Se puede plantear el uso de dosis menores de inicio de warfarina (1-1,5 mg versus 5 mg), particularmente en pacientes de alto riesgo, o portadores conocidos o posibles de alelos variantes (24,25). La monitorización más estrecha del INR, sobre todo durante el establecimiento de la anticoagulación, en portadores de estas variantes puede resultar en la prevención de las complicaciones. El conocimiento del genotipo metabolizador de la warfarina debería tenerse en cuenta en situaciones como: enfermedad intercurrente, cambios de medicación o aumentos de dosis y cuando se administran fármacos que son metabolizados competitivamente por el sistema del citocromo P-450 (26). Asimismo, en estos pacientes se deben evitar fármacos inhibidores de CYP2C9 como el gemfibrozil y las dihidropiridinas, u otros que modifiquen el INR como la amiodarona y ciertos antibióticos (27). La identificación de pacientes con alteraciones severas en el metabolismo de la warfarina los haría candidatos para otro tipo de terapias anticoagulantes como otros derivados de la cumarina cuyo metabolismo es menos influenciado por CYP2C9: fenoprocumona, fluindiona o acenocumarol, o los nuevos inhibidores de la trombina orales.
Una de las limitantes para una más potente evaluación de las correlaciones genotipo-fenotipo en este estudio reside en el relativamente pequeño número de pacientes incluido, teniendo en cuenta las múltiples interacciones posibles y el efecto buscado, lo que hace que la mayoría de las diferencias entre los pacientes con distinto genotipo no alcancen significación estadística en esta muestra poblacional. Sin embargo, como se esperaba del diseño con las limitaciones expuestas, los hallazgos coinciden con lo reportado en la bibliografía internacional en estudios con un mayor número de pacientes y las tendencias encontradas son plenamente coincidentes para los fenotipos analizados, un claro indicador de la concordancia de nuestra población con otras analizadas. La frecuencia (49%) de portadores de alelos variantes encontrada en la población estudiada es mayor que la esperada. Según los datos de poblaciones extranjeras (28) y de estudios previos en la población uruguaya (29) los portadores de alelos variantes de CYP2C9 rondarían 30%-35%. Las dos explicaciones posibles para este hecho son: que se trate de un desvío al azar o a un efecto de selección involuntario por parte de los investigadores o los pacientes, o ambos, que resultara en que aquellos pacientes con un curso más complicado de su anticoagulación fueran incluidos preferencialmente en el estudio. Esto se afirma, además, si atendemos a que la frecuencia de sangrados (55%) es mayor que la observada en otro estudio reciente de la misma policlínica (19). Aunque la prevalencia de estas variantes está sobrevalorada en esta población, la frecuencia obtenida de 49% es un indicador importante de la prevalencia en los pacientes con las complicaciones mencionadas en la población hipocoagulada.
La sensibilidad a la warfarina es un rasgo multifactorial, que depende de factores no genómicos como la edad, el índice de masa corporal, la disponibilidad de vitamina K, la nutrición y el uso concomitante de otros fármacos. Asimismo, otros genes han sido involucrados: tanto variantes infrecuentes de CYP2C9 (no analizadas en este trabajo) (30), como polimorfismos en los genes del factor IX (31), de CYP2C19 y de CYP2A6 (32). Los polimorfismos del gene de la vitamina K epóxido reductasa (VKORC1) también afectan la respuesta a la warfarina (33), aparentemente con un peso tan importante como el de CYP2C9 (34). Mutaciones en este gene, además, se han asociado con resistencia a la warfarina (35). Nos proponemos incluir en el futuro alguno de estos genes, especialmente VKORC1, para continuar con nuestra estrategia de enfoque del componente genómico de riesgo en la anticoagulación.
No se han realizado trabajos retrospectivos que analicen el efecto de estas variantes genéticas sobre los riesgos teratogénicos de la warfarina administrada accidental o erróneamente durante el embarazo.
CONCLUSIONES
Hemos puesto en práctica el estudio de variantes para dos genes relacionado con la sensibilidad a la anticoagulación con warfarina, en una población de pacientes de nuestro medio y obtenido resultados que son de utilidad para el manejo clínico de los mismos. Los pacientes portadores del alelo *3 de CYP2C9 son los que requieren dosis diarias de mantenimiento de warfarina menores, requieren más modificaciones de dosis para mantener el INR en el rango deseado y tienen mayor riesgo de sangrado y sobreanticoagulación durante la anticoagulación oral. Los portadores del alelo E4 de la ApoE tienen también una tendencia mayor a complicaciones durante la anticoagulación oral pero el efecto de esta variante es más leve. Además, detectamos una posible interacción no descripta entre CYP2C9 y ApoE sobre la respuesta a la warfarina que ameritaría un mayor estudio.
La detección de los pacientes sensibles a la warfarina por su genotipo permite prever eventos futuros y un manejo individualizado de la indicación y el control de la anticoagulación. En casos como el de la warfarina, donde las dosis individuales se deben ajustar de acuerdo a la respuesta clínica, se observa una buena correlación con las dosis empíricas determinadas para cada genotipo (36), por lo que en algunas situaciones se puede usar el conocimiento del genotipo del paciente como guía durante el inicio de la anticoagulación. Se ha demostrado que es particularmente importante el efecto de estas variantes en el momento de la inducción de la anticoagulación. Estudios recientes que analizaron prospectivamente el impacto de las variantes *2 y *3 de CYP2C9, muestran que el riesgo de tener al menos un INR por encima del rango se multiplicaba por entre tres y seis veces en la primera semana de tratamiento. Este impacto de las variantes genéticas no se observaba a la tercera semana de tratamiento, presumiblemente como resultado de una exitosa individualización de la dosis (37). Hemos reportado previamente el caso de un paciente homocigoto *3/*3 en quien se debió suspender en las primeras semanas el tratamiento por un aumento disparado del INR y sangrado, al recibir dosis estándar de warfarina (38). Se han comenzado a realizar estudios prospectivos para valorar la utilidad de “genotipar” a los pacientes previo al inicio de la anticoagulación oral, con resultados preliminares que indican la factibilidad y eficacia de este encare cuando se puede sospechar un riesgo aumentado (39,40).
El conocimiento del genotipo de CYP2C9 permite una aproximación cualitativa, y, con la sumatoria de otros elementos, valora la dificultad de manejo y el riesgo de eventos adversos. Proponemos que la determinación del genotipo del paciente debería tomarse en cuenta en situaciones de alto riesgo presumible, para explicar fisiopatológicamente eventos adversos durante la anticoagulación y en pacientes jóvenes sometidos a procedimientos de cirugía cardíaca, que se enfrentan potencialmente a varios años de anticoagulación.
BIBLIOGRAFíA
1. Go AS, Hylek EM, Chang Y, Phillips KA, Henault LE, Capra AM, et al. Anticoagulation therapy for stroke prevention in atrial fibrillation: how well do randomized trials translate into clinical practice? JAMA 2003; 290(20): 2685-92.
2. Hirsh J, Dalen JE, Anderson DR, Poller L, Bussey H, Ansell J, et al. Oral Anticoagulants: Mechanism of Action, Clinical Effectiveness, and Optimal Therapeutic Range. Chest 2001; 119: 8S–21S
3. Weinshilboum R. Inheritance and drug response. N Engl J Med 2003; 348: 529-37.
4. Guttmacher A, Collins F. Genomic Medicine: a primer. N Engl J Med 2002; 347(19): 1512-20.
5. Evans WE, Relling M. Pharmacogenomics: translating functional genomics into rational therapeutics. Science 1999; 286: 487-91.
6. Takahashi H, Echizen H. Pharmacogenetics of CYP2C9 and interindividual variability in anticoagulant response to warfarin. Pharmacogenomics J 2003; 3: 202-14.
7. Lee CR, Goldstein JA, Pieper JA. Cytochrome P450 2C9 polymorphisms: a comprehensive review of the in-vitro and human data. Pharmacogenetics 2002; 12: 251-63.
8. Aithal GP, Day CP, Kesteven P, Daly AK. Association of polymorphisms in the cytochrome P450 CYP2C9 with warfarin dose requirement and risk of bleeding complications. Lancet 1998; 353: 717-9.
9. Kirchheiner J, Brockmoller J. Clinical consequences of cytochrome P450 2C9 polymorphisms. Clin Pharmacol Ther 2005;77(1): 1-16.
10. Higashi MK, Veenstra DL, Kondo LM, Wittkowsky AK, Srinouanprachanh SL, Farin FM, et al. Association between CYP2C9 genetic variants and anticoagulation-related outcomes during warfarin therapy. JAMA 2002; 287: 1690-8.
11. Herman D, Locatelli I, Grabnar I, Peternel P, Stegnar M, Mrhar A, et al. Influence of CYP2C9 polymorphisms, demographic factors and concomitant drug therapy on warfarin metabolism and maintenance dose. Pharmacogenomics J 2005; 5(3): 193-202.
12. Pchelina SN, Sirotkina OV, Taraskina AE, Vivalova TV, Shwarzman AL, Scwartz EI. The frequency of p450 2C9 genetic variants in the Russian population and their associations with individual sensitivity to warfarin therapy. Thromb Res 2005; 115(3): 199-203.
13. Sanderson S, Emery J, Higgins J. CYP2C9 gene variants, drug dose, and bleeding risk in warfarin-treated patients: A HuGEnet™ systematic review and meta-analysis. Genet Med 2005; 7(2): 97-104.
14. Visser L, Trienekens P, De Smet P, Vulto A, Hofman A, van Duijn C, et al. Patients with ApoE e4 allele require lower doses of coumarin anticoagulants. Pharmacogenet Genomics 2005; 15(2): 69-74.
15. Eichner JE, Dunn ST, Perveen G, Thompson DM, Stewart KE, Stroehla BC. Apolipoprotein E Polymorphism and Cardiovascular Disease: A HuGE Review. Am J Epidemiol 2002; 155: 487-95.
16. Kohnke H, Sorlin K, Granath G, Wadelius M. Warfarin dose related to apolipoprotein E (APOE) genotype, Eur J Clin Pharmacol 2005; 61(5-6): 381-8.
17. Kohnke H, Scordo MG, Pengo V, Padrini R, Wadelius M. Apolipoprotein E (APOE) and warfarin dosing in an Italian population. Eur J Clin Pharmacol 2005; 61(5-6): 781-3.
18. Morton NE. Outline of genetic epidemiology, Basel: S Karger, 1982.254p
19. Valenzuela H, Cuesta A, Ortiz V, Taub I, Lluberas R. Resultados de la anticoagulación con warfarina en pacientes con prótesis valvular mecánica mitral y aórtica (resumen). Rev Urug Cardiol.2005; 20: 199
20. Crespi CL, Miller VP. The R144C change in the CYP2C9*2 allele alters interaction of the cytochrome P450 with NADPH: cytochrome P450 oxidoreductase. Pharmacogenetics 1997; 7: 203-10.
21. Haining RL, Hunter AP, Veronese ME, Trager WF, Rettie AE. Allelic variants of human cytochrome P450 2C9: baculovirus-mediated expression, purification, structural characterization, substrate stereoselectivity, and prochiral selectivity of the wild-type and I359L mutant forms. Arch Biochem Biophys 1996; 333: 447-58.
22. Kohlmeier M, Salomon A, Saupe J, Shearer MJ. Transport of vitamin K to bone in humans. J Nutr 1996; 126: 1192S-1196S.
23. Newman P, Bonello F, Wierzbicki AS, Lumb P, Savidge GF, Shearer MJ. The uptake of lipoproteinborne phylloquinone (vitamin K1) by osteoblasts and osteoblast-like cells: role of heparan sulphate proteoglycans and apolipoprotein E. J Bone Miner Res 2002; 17: 426-33.
24. Mannucci PM. Genetic control of anticoagulation. Lancet 1999; 353: 688-9.
25. James AH, Britt RP, Risking CL, Thompson SG. Factors affecting the maintenance dose of warfarin. J Clin Pathol 1992; 45: 704-6.
26. Loebstein R, Yonath H, Peleg D, Almog S, Rotenberg M, Lubetsky A, et al. Interindividual variability in sensitivity to warfarin - Nature or nurture? Clin Pharmacol Ther 2001; 70(2): 159-64.
27. Verstuyft C, Robert A, Morin S, Loriot MA, Flahault A, Beaune P, et al. Genetic and environmental risk factors for oral anticoagulant overdose. Eur J Clin Pharmacol 2003; 58(11): 739-45.
28. Hillman MA, Wilke RA, Caldwell MD, Berg RL, Glurich I, Burmester JK. Relative impact of covariates in prescribing warfarin according to CYP2C9 genotype. Pharmacogenetics 2004; 14(8): 539-47.
29. ATGen, 2004. Comunicación personal.
30. King B, Khan T, Aithal G, Kamali F, Daly A. Upstream and coding region CYP2C9 polymorphisms: correlation with warfarin dose and metabolism. Pharmacogenetics 2004; 14(12): 813-22.
31. Chu K, Wu SM, Stanley T, Stafford DW, High KA. A mutation in the propeptide of factor IX leads to warfarin sensitivity by a novel mechanism. J Clin Invest 1996; 98: 1619-25.
32. Goldstein JA. Clinical relevance of genetic polymorphisms in the human CYP2C subfamily. Br J Clin Pharmacol 2001; 52(4): 349-55.
33. Rieder MJ, Reiner AP, Gage BF, Nickerson DA, Eby CS, McLeod HL, et al. Effect of VKORC1 Haplotypes on Transcriptional Regulation and Warfarin Dose. N Engl J Med 2005; 352(22): 2285-93.
34. D´Andrea G, D’Ambrosio RL, Di Perna P, Chetta M, Santacroce R, Brancaccio V, et al. A polymorphism in the VKORC1 gene is associated with an interindividual variability in the dose-anticoagulant effect of warfarin. Blood 2005; 105(2): 645-9.
35. Rost S, Fregin A, Ivaskevicius V, Conzelmann E, Hortnagel K, Pelz HJ, et al. Mutations in VKORC1 cause warfarin resistance and multiple coagulation factor deficiency type 2. Nature 2004; 427(6974): 537-41.
36. Kirchheiner J, Brockmoller J. Clinical consequences of cytochrome P450 2C9 polymorphisms. Clin Pharmacol Ther 2005; 77(1): 1-16.
37. Lindh JD, Lundgren S, Holm L, Alfredsson L, Rane A. Several-fold increase in risk of overanticoagulation by CYP2C9 mutations. Clin Pharmacol Ther 2005; 78(5): 540-50.
38. Raggio V, Neira P, Esperón P, Lorenzo M, Stoll M. Respuesta terapéutica inadecuada a la warfarina en un paciente genéticamente susceptible. Rev Med Uruguay 2005; 21: 242-6.
39. Voora D, Eby C, Linder MW, Milligan PE, Bukaveckas BL, McLeod HL, et al. Prospective dosing of warfarin based on cytochrome P-450 2 C9 genotype. Thromb Haemost 2005; 93(4): 700-5.