Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.21 no.1 Montevideo abr. 2006
Consenso uruguayo de manejo del infarto agudo de miocardio con elevación del segmento ST
SOCIEDAD URUGUAYA DE CARDIOLOGÍA, DEPARTAMENTO CLÍNICO DE MEDICINA. HOSPITAL DE CLÍNICAS
GRUPOS DE TRABAJO
GRUPO 1. MANEJO PREHOSPITALARIO
Mario Lado (coordinador)
Pablo Asadurian
Jorge Buccino
Jaime García
Gabriela Pascal
Antonio Mombelli
Pablo Pardo
Andrea Simeone
Alejandro Vázquez
GRUPO 2. EVALUACIóN INICIAL PREHOSPITALARIA
Norberto Liñares (coordinador)
Marta Rago (coordinadora)
Pablo Álvarez Rocha
Pedro Amonte
Raúl Centurión
Nichan Kundadjian
Edgardo Núñez
Héctor Píriz
Eduardo Poloni
Osiris Rocha
GRUPO 3. MANEJO MéDICO INICIAL Y EN LA EVOLUCIóN INTRAHOSPITALARIA
Omar Montes de Oca (coordinador)
J. Castelli
Miriam Díaz Díaz
Gastón Garcés
Daniel Losa
José Martínez Ramos
Hugo Olaizola
Sonia Rossi
Mauricio Sáez
GRUPO 4. MEDIDAS ANTITROMBóTICAS
Gustavo Vignolo (coordinador)
Pablo Díaz (coordinador)
Cecilia Carrizo
Inés Sevrini
Irene Taub
Marcelo Viana
GRUPO 5. TRATAMIENTO DE REPERFUSIÓN
César Pardiñas (coordinador)
Ariel Bango
Fernando Canosa
Pablo Díaz
Tomás Dieste
Ariel Durán
Juan Gaspar
Gustavo Junker
Luis Landoni
Ademar López
Daniel Mallo
Edgardo Sandoya
Rosario Sóñora
Frank Torres
Andrés Tuzman
Pablo Vázquez
Néstor Zefferino
Ma. Fernanda Xalambrí
GRUPO 6. MANEJO DE LAS COMPLICACIONES. INSUFICIENCIA CARDíACA
Walter Olivera (coordinador)
Pedro Alzugaray
Sergio Cáceres
Álvaro Lorenzo
Gloria Rieppi
Álvaro Rodríguez
Jordan Tenzi
José Gabriel Terra
GRUPO 7. MANEJO DE LAS COMPLICACIONES. TRASTORNOS DEL RITMO
Walter Reyes (coordinador)
Alejandro Cuesta
Marcos Mouliá
J. Pontet
Enrique Spera
Gonzalo Varela
GRUPO 8. ESTRATIFICACIÓN DE RIESGO
Fernando Kuster (coordinador)
Carolina Artucio
Raúl Centurión
Virginia Collazzi
Daniela Korytniki
Mariela Lujambio
Gabriel Vanerio
GRUPO 9. MANEJO AL ALTA HOSPITALARIA
Filomena Pignataro (coordinadora)
Alfredo Álvarez Rocha
Ivanna Duro
Elba Estévez
Beatriz Goja
Marcela González
Ma. del Carmen Lizuaín
Edgardo Sandoya
José Urroz
COMISIÓN COORDINADORA
Adriana Belloso
Ricardo Lluberas
Walter Olivera
Pablo Díaz
Ariel Durán
Andrés Tuzman
COMITÉ DE REDACCIÓN
Adriana Belloso
Mario Lado
Ricardo Lluberas
Jorge Mayol
Omar Montes de Oca
Walter Olivera
Filomena Pignataro
Walter Reyes
1. INTRODUCCIÓN
La cardiopatía isquémica en general y el infarto agudo de miocardio (IAM) en particular son una de las causas más importantes de muerte en nuestro país.
La cardiología ha mostrado enormes avances en lo referente a recursos diagnósticos, terapéuticos y de prevención de la enfermedad coronaria. La multiplicidad y complejidad de las posibilidades de manejo de los pacientes con síndromes coronarios agudos hacen necesaria la elaboración de pautas de Consenso, que den un marco normativo razonable para el desempeño de los colegas de nuestro medio.
En los últimos años la Sociedad Uruguaya de Cardiología (SUC) definió, en consensos respectivos, pautas de manejo en los síndromes coronarios agudos sin elevación del segmento ST y en el dolor torácico.
En el año 2004, el Comité de Hemodinamia y Cardiología Intervencionista de la SUC realizó un taller sobre el manejo del IAM con elevación del segmento ST. En ese taller se valoró pertinente llamar a un Consenso nacional para el manejo de esta entidad, dada su importancia y la necesidad de elaborar pautas uniformes y adaptadas a nuestra realidad.
En ese mismo año la SUC y el Departamento Clínico de Medicina del Hospital de Clínicas tomaron este planteo y trazaron un programa de actividades para la elaboración de un Consenso uruguayo de manejo del IAM con elevación del segmento ST.
Numerosos colegas provenientes de múltiples especialidades convergieron en varias reuniones de elaboración y discusión. Se conformaron grupos de trabajo para los diferentes tópicos que elaboraron sus pautas respectivas, que fueron resumidas en un grupo de redacción conformado por coordinadores de grupos.
Posteriormente, el proyecto final elaborado por el grupo de redacción fue sometido a la discusión general de los participantes del Consenso para su posterior aprobación, resultando en este documento final.
Este documento final tiene la forma de una guía sencilla y práctica para el desempeño del médico que debe manejar un (IAM) con elevación del segmento ST, por lo que las recomendaciones se hacen con una mínima fundamentación.
Quienes deseen profundizar en los conceptos que fueron vertidos en el proceso del Consenso, de gran riqueza por cierto, pueden solicitar el material correspondiente en la secretaría de la SUC.
El desarrollo de este documento está basado en capítulos que abarcan todas las fases del IAM, desde la prehospitalaria hasta las recomendaciones al alta y las medidas de prevención secundaria.
Nuestra experiencia muestra que estas medidas preventivas se realizan en forma por demás incompleta, motivo por el cual se hace especial énfasis en este tópico.
Este Consenso pretende integrar el conocimiento actual en el manejo del IAM con elevación del segmento ST a nuestra realidad. No pretende ser una norma rígida sino una guía para la acción. Una de las funciones más relevantes del médico es poder adaptar a su entorno asistencial particular la evidencia disponible, de tal manera de ofrecer al paciente la mejor opción posible.
2. CLASIFICACIÓN DE LAS RECOMENDACIONES
Las recomendaciones fueron clasificadas según una adaptación de los criterios propuestos por el Colegio Norteamericano de Cardiología (ACC), la Asociación Norteamericana de Cardiología (AHA) (1) y la Sociedad Europea de Cardiología (ESC) (2), y que ya ha sido asumida en otros consensos de la SUC.
Fueron establecidas tres clases de recomendaciones en base al nivel de acuerdo existente entre los participantes del Consenso:
- Clase I:
Estas clases de recomendaciones se basan en diferentes niveles de evidencia:
- Nivel A:
3. CONSIDERACIONES PREVIAS
La magnitud del problema de la enfermedad coronaria en general y del IAM en particular en cuanto a su mortalidad y morbilidad los hace sumamente relevantes en materia de salud de nuestra población.
Los integrantes de este Consenso jerarquizan, entonces, que es fundamental establecer todas las medidas preventivas necesarias en esta materia.
En este sentido destacan como de primera importancia que:
1. Nuestra Sociedad debería intensificar al máximo las medidas de prevención primaria en salud cardiovascular, promoviendo hábitos saludables en nuestra población (abandono de la adicción al tabaco, ejercicios periódicos, dieta sana baja en grasas, evitando el exceso de sobrepeso) (recomendación I, C).
2. Es función del médico recomendar y efectuar al paciente controles periódicos de los factores de riesgo de enfermedad coronaria mayores (abandono del tabaquismo, control de presión arterial, diabetes mellitus, dislipidemia y sobrepeso) (recomendación I, C).
3. El médico debería calcular el riesgo cardiovascular absoluto para determinar las estrategias preventivas necesarias (recomendación I,B).
4. A los pacientes con enfermedad coronaria conocida o con riesgo equivalente (diabetes mellitus, insuficiencia renal crónica o riesgo cardiovascular elevado), se les debe manejar rigurosamente con las medidas correspondientes de prevención secundaria (recomendación I, A).
5. La población debería ser instruida en la consulta precoz ante la sospecha de IAM:
a) la población en general y los pacientes con enfermedad coronaria conocida en particular deberían ser educados en el reconocimiento de los síntomas del IAM, de tal manera que puedan efectuar la consulta lo más precozmente posible (recomendación I, C).
b) la población debería, de acuerdo a cada realidad particular, conocer cuál es el mecanismo más apto para la consulta más precoz ante la sospecha de un IAM (emergencia móvil, puerta de emergencia, etc.) (recomendación I, C), aunque debería promoverse que el traslado se realice en ambulancia con equipo de monitorización y reanimación (recomendación I, C).
c) Si el paciente recibe nitratos previamente, debería recomendársele que se administre una dosis sublingual ante la presencia de dolor torácico sugestivo de isquemia en curso. Si no hay respuesta adecuada a los cinco minutos de su administración, debería consultar a su sistema asistencial lo más rápidamente posible (recomendación I, C).
4. FASE PREHOSPITALARIA
En la fase prehospitalaria las medidas deberán estar orientadas especialmente a evitar la muerte precoz. En este sentido la medida más eficaz es el traslado a un centro hospitalario lo más rápidamente posible (en lo factible monitorizado y con equipo de reanimación avanzada).
1. Los pacientes con dolor torácico sugestivo de IAM deberían recibir una dosis de ácido acetilsalicílico vía oral masticable de 250-500 mg lo más rápidamente posible (recomendación I, C).
2. En los pacientes con dolor torácico sugestivo de IAM debería colocarse una vía venosa por punción de vena periférica lo antes posible (recomendación I, C).
3. A los pacientes con dolor torácico sugestivo de IAM se les debería realizar un electrocardiograma de 12 derivaciones, en el primer contacto con el sistema asistencial al que consultó, en un plazo de diez minutos por sus implicancias diagnósticas y terapéuticas (recomendación I, C).
4. Debería administrarse oxígeno suplementario cuando hay elementos clínicos de edema pulmonar y/o saturación de O2 arterial menor de 90% en la oximetría del pulso (recomendación I,B).
5. Es razonable administrar oxígeno suplementario en todos los pacientes en las primeras seis horas del IAM (recomendación IIa,C).
6. Los nitratos son el primer fármaco a administrar en presencia de angor en el curso de un IAM con elevación del segmento ST. A los pacientes con dolor anginoso en curso debería administrarse un preparado de nitratos sublingual (nitroglicerina 0,35 mg o dinitrato de isosorbide 2,5 a 5 mg), que puede repetirse a los cinco minutos hasta tres dosis si fuera necesario (recomendación I,C).
7. Cuando el dolor no cede inicialmente con nitratos, debería calmarse con opiáceos (recomendación I,C). El fármaco de elección es la morfina, que tiene un alto poder analgésico, además de ansiolítico, sedante y venodilatador. La dosis será 3-4 mg por vía intravenosa en 30 segundos, que pueden repetirse cada 5-10 minutos hasta calmar el dolor.
8. La vía de traslado más adecuada del paciente con sospecha de IAM es la ambulancia especializada, dotada de personal entrenado y del equipamiento para el manejo del paciente crítico y especialmente para la reanimación cardiovascular avanzada (recomendación I, C).
9. Los participantes del Consenso ven altamente positiva la propuesta de constitución de una coordinación centralizada de los diferentes servicios para el manejo del IAM. Mediante esta coordinación habría un uso más efectivo de los recursos disponibles (recomendación I, C).
El fundamento de estas primeras medidas se remite a las próximas secciones, donde se considera cada una de estas en la fase hospitalaria.
En las sesiones del Consenso se planteó la iniciativa de una coordinación centralizada para el manejo del IAM en nuestro país. Se coincidió en que esta propuesta redundaría en una mejor utilización de los recursos, aunque se reconoció la dificultad para concretarla entre todos los actores. El plenario del Consenso hace un llamado a las autoridades y a los diferentes actores participantes en el manejo del IAM para constituir una coordinación centralizada de esta naturaleza.
4A. TROMBOLíTICOS PREHOSPITALARIOS
Hay evidencia de que los trombolíticos son eficaces en el tratamiento del IAM en una relación tiempo-dependencia (3). Con el fin de obtener mínimos tiempos de demora en el tratamiento, se han efectuado varios ensayos de trombolíticos prehospitalarios que han demostrado en su conjunto una reducción de mortalidad global en relación con la administración de trombolíticos intrahospitalarios (4-12).
También hay evidencia de que la utilización de trombolíticos prehospitalarios sería superior a la angioplastia primaria en pacientes con IAM de poco tiempo de evolución (13).
Los estudios realizados son esencialmente de trombolíticos fibrino-específicos. Hay poca evidencia en cuanto a la utilización de estreptoquinasa prehospitalaria.
Por otra parte, la estreptoquinasa tiene el inconveniente de necesitar refrigeración para su almacenamiento y requiere tiempos de infusión prolongados, difíciles de instrumentar en una ambulancia.
Para el Consenso, la utilización de trombolíticos intrahospitalarios debe plantearse sobre todo en los pacientes de poco tiempo de evolución, donde los trombolíticos son más eficaces y donde, por otra parte, juega en forma desfavorable para el tratamiento por angioplastia primaria la demora intrínseca que tiene su instrumentación.
Se resalta, además, que sería más adecuada para la administración de trombolíticos prehospitalarios la utilización de trombolíticos fibrino-específicos, y especialmente aquellos que pueden administrarse en bolo, como el tenecteplase.
1. Es razonable la administración de trombolíticos prehospitalarios (serían preferibles los fibrino-específicos) en aquellos pacientes con IAM con elevación del segmento ST muy tempranos (tiempo de evolución menor de 3 horas), en especial cuando la realización de una angioplastia primaria no puede instrumentarse rápidamente (tiempo primer contacto médico-balón mayor de 90 minutos) (recomendación IIa, B).
5. FASE HOSPITALARIA
5A. LUGAR DE INTERNACIÓN
El paciente con IAM con elevación del segmento ST tiene riesgo de muerte especialmente por arritmias en las primeras horas. Esto obliga a la monitorización electrocardiográfica inicial y la necesidad de disponer de rápido tratamiento de las arritmias ventriculares graves.
El paciente podrá ser manejado inicialmente en el departamento de emergencia o rápidamente transferido a la unidad correspondiente de internación. La condición insoslayable es que ningún traslado dentro del ambiente hospitalario retrase la instauración de las medidas de manejo y tratamiento iniciales.
De acuerdo a su evolución, el paciente podrá ser trasladado a otros niveles de internación con menos exigencia de control y de recursos.
La movilización precoz es otro objetivo principal del manejo para prevenir la trombosis venosa y sus complicaciones y posibilitar el alta lo más rápidamente posible. Consiguientemente el plan de manejo y por tanto su lugar de internación deberá contemplar esta necesidad de movilización precoz.
1. Los pacientes con IAM con elevación del segmento ST deberían estar en un ambiente hospitalario inicial que sea confortable, provisto de monitorización electrocardiográfica, oximetría del pulso y rápido acceso a la desfibrilación y monitoreo hemodinámico (recomendación I,C).
2. El tipo de unidad de internación debería ser una unidad cardiológica o, en su defecto, una unidad polivalente (recomendación I,C).
3. El paciente con inestabilidad eléctrica o hemodinámica grave debería ser manejado en un nivel asistencial de cuidados intensivos (recomendación I, C).
4. El paciente que evoluciona sin complicaciones podrá ser manejado inicialmente en un nivel asistencial de cuidados intermedios (recomendación I,C).
5. El paciente que evoluciona sin complicaciones podrá ser transferido a un ámbito de cuidados convencionales al tercer o cuarto día de evolución y ser dado de alta hospitalaria posteriormente a su estratificación de riesgo, luego de los cinco a siete días de evolución (recomendación I,C).
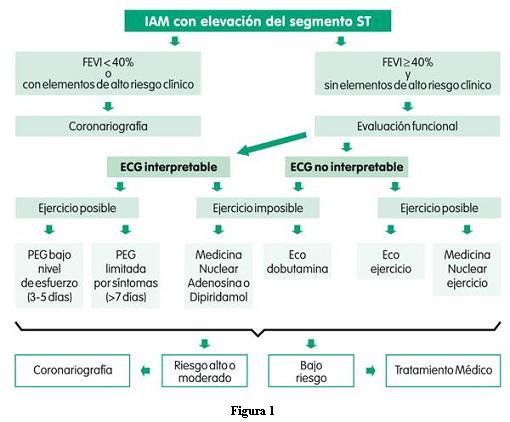
5B. EVALUACIÓN INICIAL
La prioridad en el manejo del IAM con elevación del segmento ST debe ser la reperfusión lo más rápido posible. Ninguna de las medidas iniciales puede demorar la puesta en práctica del tratamiento de reperfusión.
1. Se deberá hacer una historia clínica orientada a la caracterización del dolor y sus síntomas asociados, los antecedentes y los factores de riesgo coronario, riesgo de sangrado y síntomas de enfermedad cerebrovascular (recomendación I, C).
2. Se deberá hacer un examen orientado a la pesquisa de complicaciones del IAM, así como a la presencia de signos de déficit neurológico (recomendación I, C).
3. Se debería hacer un electrocardiograma de 12 derivaciones en los primeros 10 minutos del arribo del paciente. El electrocardiograma podrá repetirse a los 5-10 minutos si el primero no es concluyente para el diagnóstico de IAM con elevación del segmento ST (recomendación I, C).
4. En pacientes con IAM con elevación del segmento ST inferior se deberían registrar las derivaciones precordiales derechas (V3R, V4R) para el diagnóstico de IAM de ventrículo derecho. En pacientes en que se sospeche un IAM posterior se deberían registrar las derivaciones posteriores (V7, V8, V9) (recomendación I, C).
5. Se deberían realizar exámenes de laboratorio que no podrán diferir la estrategia de reperfusión (recomendación I, C). Los exámenes de laboratorio serán:
a. marcadores séricos de necrosis miocárdica (CK-MB o troponinas ToI, o ambos), preferentemente en forma cuantitativa;
b. hemograma;
c. INR;
d. KPTT;
e. ionograma en sangre con magnesemia;
f. azoemia;
g. creatininemia;
h. glicemia;
i. perfil lipídico.
El diagnóstico de IAM con elevación del segmento ST tiene como eje central el electrocardiograma. Como este diagnóstico puede implicar una estrategia de reperfusión donde "el tiempo es miocardio", la realización del registro electrocardiográfico no puede demorarse más de 10 minutos.
Como se verá más adelante, bastará con tener una elevación del segmento ST mayor de 0,1 mV en dos derivaciones contiguas o la presencia de un nuevo o presumiblemente nuevo bloqueo de rama izquierda para definir una estrategia de reperfusión.
Sin embargo, la especificidad diagnóstica del electrocardiograma para el IAM está disminuida en algunas circunstancias. En el caso de la elevación del segmento ST en región anterior, se observa que se incrementa la precisión diagnóstica considerando una elevación del mismo de 0,2 mV en lugar de 0,1 en derivaciones V1 a V4 (14). Otro ejemplo es la presencia de un bloqueo de rama izquierda. En este caso, la especificidad en el diagnóstico de IAM se incrementa si se encuentra una elevación del segmento ST mayor de 0,1 mV en derivaciones con QRS positivo, una depresión del segmento ST mayor de 0,1 mV en V1 a V3, o una elevación del segmento ST mayor de 0,5 mV en derivaciones con QRS negativo (15).
Dentro de los marcadores de necrosis, las troponinas son las preferidas por su alta sensibilidad y especificidad. La determinación recomendable es la cuantitativa, aunque pueden utilizarse métodos cualitativos que son menos precisos y sensibles (16,17).
Dado que la CK-MB y las troponinas demoran de tres a seis horas en elevarse, si la determinación ha sido realizada muy tempranamente, puede no detectar la necrosis. En este caso, especialmente ante una duda diagnóstica, se recomienda repetir la determinación a las 6-9 horas siguientes.
Los marcadores de necrosis pueden ser utilizados para estimar una reperfusión con trombolíticos. En este caso no son adecuados los métodos cualitativos. Por otra parte, los marcadores de necrosis, en función del curso temporal que tienen, no pueden ser utilizados para el diagnóstico de recurrencia del infarto en las primeras 18 horas del inicio de los síntomas (1).
Es recomendable evaluar el perfil lipídico antes de las 24 horas del ingreso, dado que en los días siguientes a un infarto puede haber modificaciones sustanciales del mismo (descenso del colesterol total y del LDL colesterol).
6. Debería realizarse una placa de tórax con equipo portátil en las primeras horas del ingreso (recomendación I, C).
7. Puede ser útil un ecocardiograma al pie de la cama en las primeras horas, especialmente en los pacientes que presentan dudas diagnósticas (bloqueo de rama izquierda, marcapaso, infarto posterior con depresión de ST anterior) (recomendación IIa, B), o para el diagnóstico diferencial de disección aórtica (recomendación I, B).
5C. TRATAMIENTO
5c1. Oxígeno
1. Debería administrarse oxígeno suplementario cuando hay elementos clínicos de edema pulmonar o saturación de O2 arterial menor de 90% en la oximetría del pulso, o ambas (recomendación I,B).
2. Es razonable administrar oxígeno suplementario en todos los pacientes en las primeras horas de su admisión (recomendación IIa,C).
Es indiscutible la indicación de oxígeno cuando hay insuficiencia cardíaca congestiva o cuando hay desaturación de oxígeno arterial.
Dado que los pacientes con IAM no complicado pueden tener una cierta desaturación inicial de oxígeno, es razonable su administración rutinaria, que no se justifica más allá de las seis horas iniciales (18-21).
La recomendación del Consenso es que se administre oxígeno con máscara de flujo libre o catéter nasal a 2 l por minuto. Si hay desaturación de oxígeno a pesar de ello se puede incrementar a 4 l por minuto. Los casos más severos de desaturación requerirán de intubación endotraqueal y asistencia respiratoria mecánica.
5c2. Analgesia y sedación
Uno de los objetivos iniciales debe ser calmar el dolor y la ansiedad, dado que estos contribuyen a incrementar la actividad simpática, estimulando el consumo de oxígeno miocárdico.
1. Cuando el dolor no cede inicialmente con nitratos, debería calmarse con opiáceos (recomendación I,C).
El fármaco de elección es la morfina, que tiene un alto poder analgésico, además de ansiolítico, sedante y venodilatador (1,2). La dosis será 3-4 mg por vía intravenosa en 30 segundos, que pueden repetirse cada 5-10 minutos hasta calmar el dolor.
En caso de que el paciente presente bradicardia o hipotensión, o ambas (especialmente en los IAM inferiores), se puede optar por la meperidina, que es un potente analgésico y además tiene efecto vagolítico. La dosis es 25 mg por vía intravenosa cada 5-10 minutos hasta el control del dolor (22-24).
2. Es razonable administrar ansiolíticos del tipo benzodiazepinas (recomendación IIa, C).
Los factores psicológicos pueden favorecer la aparición de arritmias cardíacas y recurrencia de la isquemia. Los fármacos recomendados son: diazepam (5 mg cada 12 horas vía oral) y alprazolam (0,5 mg cada 12 horas vía oral).
5c3. Dieta
1. La dieta debería ser reducida en contenido graso y colesterol, con menos de 7% del total de calorías como grasas no saturadas y menos de 200 mg de colesterol diarios, con incremento del consumo de ácidos grasos omega-3, adecuado aporte calórico para los requerimientos básicos y rica en fibras (recomendación I,C).
2. La ingesta de sodio debería restringirse en los pacientes con hipertensión o insuficiencia cardíaca, o ambos (recomendación I,B).
5c4. Nivel de actividad
1. En el paciente no complicado debería indicarse reposo en cama absoluto en las primeras 12 horas. Luego podrá iniciar esfuerzos progresivos durante su período de internación (recomendación I,C).
Es aconsejable el reposo absoluto en cama durante las primeras 12 horas.
Si el paciente está estable y lo tolera, luego de este lapso se puede sentar en un sillón.
Al segundo día se le puede permitir deambulación breve en la habitación, aseo personal y baño asistido.
A partir del tercer día puede permanecer sentado más tiempo y comenzar a caminar, se puede duchar. La instrucción de esfuerzos progresivos debe tener en cuenta que el paciente no complicado y de bajo riesgo puede ser dado de alta hospitalaria entre los cinco a siete días de su ingreso (1,2).
Los nitratos son el primer fármaco a administrar en presencia de angor en el curso de un IAM con elevación del segmento ST.
5c5. Nitratos
1. A los pacientes con dolor anginoso en curso debería administrarse un preparado de nitratos sublinguales (nitroglicerina 0,35 mg o dinitrato de isosorbide 2,5 a 5 mg), que puede repetirse a los cinco minutos, hasta tres dosis si fuera necesario. De mantenerse el dolor luego de estas tres dosis, debería indicarse nitroglicerina intravenosa (recomendación I, C).
2. Los nitratos por vía intravenosa, por vía oral o tópicos están indicados en pacientes con isquemia persistente, hipertensión arterial o congestión pulmonar (recomendación I, B).
3. Los nitratos por vía intravenosa, por vía oral o tópicos pueden indicarse en pacientes sin isquemia persistente, hipertensión arterial o congestión pulmonar (recomendación IIb, B).
4. Los nitratos no deberían administrarse en pacientes con hipotensión sistólica menor de 90 mmHg, bradicardia menor de 50 latidos por minuto y en sospecha de infarto de ventrículo derecho (recomendación III, C).
5. Los nitratos no deberían administrarse en pacientes que hayan recibido inhibidores de la fosfodiesterasa por disfunción eréctil en las últimas 24 horas (recomendación III, B).
El efecto beneficioso de los nitratos se explica porque producen reducción de las demandas de oxígeno y mejoría del flujo sanguíneo coronario (25).
Su efecto en la mortalidad del IAM con elevación del segmento ST cuando se usan en forma sistemática es una reducción pequeña de la misma (de tres a cuatro vidas salvadas por cada 1.000 pacientes tratados) (26-28).
Su escaso efecto en la reducción de la mortalidad hace que los nitratos deban usarse siempre y cuando permitan la administración de otros fármacos, como los betabloqueantes y los inhibidores de la enzima conversora de angiotensina (IECA), que determinan una reducción de la mortalidad más contundente (1,2).
Cuando los nitratos están indicados por isquemia persistente, hipertensión arterial o congestión pulmonar, habitualmente se inicia nitroglicerina intravenosa, que puede continuarse por 24-48 horas. Más allá de este período, dado que hay rápida tolerancia a la acción de la nitroglicerina intravenosa, si hay necesidad de mantener los nitratos se recomienda pasar a preparados por vía oral o tópicos a la dosis efectiva más baja posible y con un intervalo libre de droga de 8-12 horas (1).
Si no se presentan estas condiciones, la administración de nitratos, aunque permitida pues se ha constatado un beneficio marginal (recomendación IIb, B), no tiene mayor justificación al haber otros fármacos de mayor eficacia, como los betabloqueantes y los IECA.
Deben evitarse los nitratos en pacientes que han recibido recientemente inhibidores de la fosfodiesterasa, como el sildenafil, o en situaciones en que pueda producirse repercusión hemodinámica (29-31).
5c6. Betabloqueantes
1. Los betabloqueantes orales deberían administrarse lo más precozmente posible en todos los pacientes que no tengan contraindicaciones (recomendación I, A).
2. Es razonable administrar betabloqueantes intravenosos en pacientes que presentan hipertensión arterial o taquiarritmias (recomendación IIa, B).
3. Los betabloqueantes intravenosos pueden administrarse precozmente en todos los pacientes que no tengan contraindicaciones (recomendación IIb, A).
4. Los betabloqueantes orales deberían administrarse en todos los pacientes que no tengan contraindicaciones en forma indefinida luego del alta hospitalaria (recomendación I, A).
Los betabloqueantes intravenosos han mostrado una reducción significativa de la mortalidad en la era pretrombolítica (32-34). Estudios realizados en la era de la reperfusión muestran resultados controvertidos en relación con la mortalidad (35-37), por lo que el Consenso ha definido como una recomendación de tipo IIb la indicación del uso sistemático precoz en el IAM con elevación del segmento ST.
Hay acuerdo general en cuanto al uso selectivo de betabloqueantes intravenosos en presencia de hipertensión arterial o taquiarritmias (1,2).
La evidencia sostiene, por otra parte, el uso de betabloqueantes en forma sistemática por vía oral lo más precozmente posible y luego mantenerlos a largo plazo, en tanto no existan contraindicaciones (38-45).
El Consenso deIAM con elevación del segmento ST concuerda en que las contraindicaciones absolutas para el uso de betabloqueantes son: asma o enfermedad reactiva de la vía aérea en actividad, hipotensión sintomática o shock, bloqueo auriculoventricular de segundo o tercer grado, falla cardíaca con severa descompensación, IAM secundario a uso de cocaína.
Es de destacar que no constituyen contraindicaciones para el uso de betabloqueantes: la edad, la diabetes, la arteriopatía obstructiva periférica, la enfermedad pulmonar obstructiva crónica sin reactividad bronquial en actividad, la insuficiencia renal crónica (1,2).
5c7. Inhibidores de la enzima cardioversora de la angiotensina
1. Los IECA por vía oral deberían administrarse precozmente (en las primeras 24 horas) en los pacientes que cursan un IAM con elevación del segmento ST de pared anterior, que presentan congestión pulmonar o una fracción de eyección de ventrículo izquierdo (FEVI) menor de 40% (recomendación I,A).
2. Es razonable administrar IECA vía oral precozmente (en las primeras 24 horas) en todos los pacientes que no presentan contraindicaciones (recomendación IIa, B).
3. Los IECA por vía oral deberían administrarse antes del alta en todos los pacientes con IAM con elevación del segmento ST que no tengan contraindicaciones y mantenerlos en forma indefinida (recomendación I,A).
Una revisión sistemática de la evidencia sobre los IECA en el IAM con elevación del segmento ST muestra que estos fármacos producen una reducción pequeña pero significativa de la mortalidad a 30 días (27,28,46-50).
A la luz de que este efecto es modesto y ante la posibilidad de efectos colaterales indeseables, el Consenso hace una recomendación del uso de IECA sistemático de tipo IIa.
En el paciente de alto riesgo [IAM anterior, congestión pulmonar, FEVI menor de 40%, la indicación precoz no ofrece discusión (tipo I)].
De comenzarse la administración de IECA en las primeras horas del IAM, se recomienda su indicación luego de cumplida la terapéutica de reperfusión, iniciando el tratamiento con dosis bajas con incrementos progresivos hasta llegar a la dosis máxima a las 24-48 horas. La presión arterial sistólica para iniciar los IECA debe ser mayor de 100 mmHg.
Deben evitarse los IECA intravenosos especialmente en las primeras 24 horas por el riesgo de hipotensión y su efecto deletéreo (51).
El beneficio de los IECA a largo plazo ha sido demostrado, por lo que se plantea su indicación sistemática antes del alta si no existen contraindicaciones (46,52-59).
Las contraindicaciones son: presión arterial sistólica menor de 100 mmHg, insuficiencia renal significativa (creatinina mayor de 3 mg/dl), hiperpotasemia (potasio en sangre mayor de 5,5 mEq/l), estenosis bilateral de las arterias renales, antecedentes de alergia a los IECA (angiodedema) (1).
5c8. Bloqueadores de los receptores de angiotensina II
En pacientes que cursan IAM con elevación del segmento ST, los bloqueadores de los receptores de angiotensina II (ARA) tienen su uso cuando se trata de infartos extensos, con signos clínicos o radiológicos de falla ventricular izquierda o FEVI menor de 40%.
1. Los ARA deberían administrarse en pacientes cursando un IAM con elevación del segmento ST que no toleren el uso de IECA y que tengan signos clínicos o radiológicos de falla cardiaca o FEVI menor de 40%.
Valsartan y Candesartan han demostrado eficacia en esta recomendación (recomendación I, B).
2. Los ARA pueden ser una alternativa terapéutica a los IECA en pacientes cursando un IAM con elevación del segmento ST que toleren el uso de IECA y que tengan signos clínicos o radiológicos de falla cardíaca o FEVI menor de 40%.
Valsartan y Candesartan han demostrado eficacia en esta recomendación (recomendación IIa, B).
Los ARA están indicados en caso de intolerancia a los IECA y la función ventricular izquierda esté comprometida o haya insuficiencia cardíaca clínica
Por otra parte, si bien pueden ser una alternativa a los IECA, la evidencia contundente a favor de estos últimos fármacos hace que el grupo de Consenso los prefiera en caso de indicaciones compartidas (60,61).
5c9. Reperfusión
El tratamiento de reperfusión ha sido uno de los más importantes avances en el tratamiento del IAM con elevación del segmento ST.
Los métodos de reperfusión pueden ser químicos (fibrinolíticos) (3) o mecánicos (angioplastia primaria) (62).
Ambos métodos son eficaces. Debe elegirse el mejor método de reperfusión de acuerdo a la realidad de cada servicio, donde el aspecto más importante a definir es la demora en la instauración de la reperfusión (3,63-71).
La estrategia de reperfusión se justifica plenamente en el IAM con elevación del segmento ST o con bloqueo de rama izquierda nuevo o presuntamente nuevo.
El tiempo que se acepta como máximo para plantear una estrategia de reperfusión a punto de partida de la evidencia disponible es de hasta 12 horas del comienzo de los síntomas, aunque en casos particulares pueda justificarse extender este período a las horas siguientes (1,2). La excepción más notoria a este plazo es en el shock cardiogénico, donde los tiempos de beneficio demostrado, como veremos, son más prolongados.
Si bien se puede afirmar una superioridad global de la angioplastia primaria sobre los trombolíticos en cuanto a reducción de mortalidad, esta supremacía es más notoria en los pacientes tardíos (luego de las primeras tres horas) (71,73). En los pacientes muy precoces, los trombolíticos han demostrado un beneficio que se equipara con la angioplastia primaria y hasta podría superarla (en especial con trombolíticos fibrinoespecíficos) (13,72,73).
Por otra parte, cualquiera sea la opción de reperfusión que adoptemos, esta debe iniciarse en el menor tiempo posible.
Debemos recordar que el tiempo es músculo y que la masa de músculo cardíaco que preservemos en la etapa aguda va a condicionar el pronóstico hospitalario y tardío del paciente.
- La elección del método de reperfusión
Cuando nos enfrentamos a un paciente con IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda debemos plantearnos la opción entre los trombolíticos y la angioplastia primaria.
En esta decisión debemos considerar varios aspectos:
- el nivel de riesgo del IAM;
- el riesgo de la trombolisis;
- tiempo de transporte a una sala de cardiología intervencionista experimentada.
¿Cuándo preferir la trombólisis?
- cuando la estrategia invasiva tiene demoras:
- tiempo puerta-balón mayor de 90 minutos;
- cuando la estrategia invasiva no es una opción:
- acceso vascular imposible;
- no se dispone de sala de hemodinamia experimentada;
¿Cuándo preferir la angioplastia primaria?
- IAM de alto riesgo (Killip 3 o 4);
- contraindicación para los trombolíticos;
- cuando la estrategia invasiva no tiene demoras:
- tiempo puerta-balón menor de 90 minutos;
- duda diagnóstica de IAM con elevación del segmento ST (en este caso es preferible realizar una angiografía que someter al paciente a los riesgos de los trombolíticos que no estarían justificados).
La trombólisis debe preferirse cuando se tiene un tiempo excesivo de demora para la realización de la angioplastia primaria (74), o cuando no es posible su realización por ausencia de acceso vascular o de sala de hemodinamia con experiencia en esta técnica (1).
La angioplastia primaria, por otra parte, se prefiere en especial en aquellos pacientes de alto riesgo, como los portadores de insuficiencia cardíaca o shock (75-77).
- Trombolíticos
Por razones obvias de disponibilidad de recursos, la mayoría de los pacientes podrán ser tratados con trombolíticos y en menor proporción con angioplastia primaria.
El grupo de Consenso considera, a la luz de los datos vertidos en las sesiones realizadas, que hay una indicación de trombolíticos significativamente baja en nuestro país.
Es necesario que los médicos actuantes y los administradores de salud establezcan y coordinen planes de tratamiento del IAM con elevación del segmento ST que permitan llegar a la mayor proporción de la población con los recursos adecuados, incluyendo la posibilidad de trombolíticos.
1. En ausencia de contraindicaciones, los trombolíticos deberían administrarse en pacientes con IAM con elevación del segmento ST con inicio de los síntomas de hasta 12 horas de evolución y que presenten una elevación del segmento ST mayor de 0,1 mV en por lo menos dos derivaciones contiguas (recomendación I,A).
2. En ausencia de contraindicaciones, los trombolíticos deberían administrarse en pacientes con IAM con nuevo o presuntamente nuevo bloqueo de rama izquierda, con inicio de los síntomas de hasta 12 horas de evolución (recomendación I,A).
3. En ausencia de contraindicaciones, los trombolíticos deberían administrarse en pacientes con IAM con imagen electrocardiográfica de infarto posterior verdadero con inicio de los síntomas de hasta 12 horas de evolución (recomendación IIa,C).
4. En ausencia de contraindicaciones, es razonable administrar trombolíticos en pacientes con IAM con elevación del segmento ST con 12 a 24 horas de evolución, que presenten síntomas de isquemia en curso y que presenten una elevación del segmento ST mayor de 0,1 mV en por lo menos dos derivaciones contiguas (recomendación IIa, B).
5. Los trombolíticos no deberían administrarse en pacientes con IAM con elevación del segmento ST de más de 24 horas de evolución (recomendación III, C).
6. Los trombolíticos no deberían administrarse en pacientes que presentan solamente depresión del segmento ST como signo isquémico, con excepción de un infarto posterior (recomendación III, A).
No hay duda de que los trombolíticos reducen la mortalidad en el IAM con elevación del segmento ST cuando son administrados en las primeras 12 horas de evolución. Lo mismo puede afirmarse cuando el paciente se presenta con bloqueo de rama izquierda nuevo o presuntamente nuevo (3).
El infarto posterior se manifiesta en el electrocardiograma con una onda R en derivaciones precordiales derechas y depresión del segmento ST de V1 a V4. En este caso se recomienda realizar registro de derivaciones V7, V8 y V9.
Una situación relativamente común es la presentación tardía, entre 12 y 24 horas de evolución desde el inicio de los síntomas. En este caso, el Consenso estima razonable el tratamiento con trombolíticos cuando hay síntomas de isquemia en curso (1).
Por otra parte, el Consenso considera no recomendable administrar trombolíticos más allá de las 24 horas de evolución o cuando el electrocardiograma muestra sólo una depresión del segmento ST (con excepción del infarto posterior), pues no hay evidencias de su beneficio (3).
En relación con las contraindicaciones para los trombolíticos, su presencia debe considerarse a la hora de elegir el método de reperfusión (1). Es obvio que en todo paciente donde hay peligro de sangrado, la balanza debería inclinarse a la indicación de angioplastia si ella es posible en los plazos razonables.
Se consideran contraindicaciones absolutas:
- Antecedentes de accidente vascular encefálico hemorrágico.
- Conocimiento de una malformación vascular cerebral (por ejemplo, malformación arteriovenosa).
- Proceso maligno intracraneano.
- Accidente vascular encefálico isquémico en los últimos tres meses (excepción: cuando el evento es de menos de tres horas de evolución).
- Sospecha de disección aórtica.
- Sangrado activo (se excluye menstruación).
- Diátesis hemorrágica.
- Traumatismo significativo encefálico o facial en los últimos tres meses.
Son contraindicaciones relativas:
- Hipertensión severa incontrolable en la admisión (presión sistólica mayor de 180 mmHg, presión diastólica mayor de 110 mmHg).
- Accidente vascular encefálico isquémico más allá de los tres meses, demencia u otra enfermedad intracraneana (excluyendo las citadas en contraindicaciones absolutas).
- Reanimación cardiorrespiratoria prolongada (más de diez minutos) o traumática.
- Sangrado interno en las últimas cuatro semanas.
- Punción de vaso no compresible.
- Embarazo.
- Úlcera péptica activa.
- Uso de anticoagulantes orales. Cuanto mayor es el INR, mayor es la posibilidad de complicación hemorrágica.
- Para la esteptoquinasa: exposición previa entre cinco días a seis meses (por la eventualidad de alergia), o alergia conocida a estreptoquinasa.
- No es contraindicación la retinopatía diabética
En relación con el tipo de trombolítico a utilizar, hay evidencia que la estreptoquinasa tiene un beneficio algo menor en reducción de mortalidad que otros trombolíticos fibrinoespecíficos (78). Sin embargo, el alto costo de estos agentes en nuestro país los hace prohibitivos. De hecho, no existen disponibles para su uso, salvo excepción en algunas instituciones. El grupo de Consenso considera que es pertinente el uso de la estreptoquinasa como trombolítico, dada su eficacia demostrada desde los inicios de la era trombolítica.
1. Debe tenerse especial cuidado en qué tipo de estreptoquinasa se utiliza, dado que en el mercado existen marcas cuya actividad puede ser menor que la declarada y que debería conocerse.
2. Hace un llamado a la posibilidad de que el sistema de salud pudiera implementar una cobertura de trombolíticos fibrinoespecíficos, que han demostrado eficacia y que podrían utilizarse con más seguridad en una eventual trombolisis prehospitalaria.
- Angioplastia primaria
1. La angioplastia primaria debería realizarse en pacientes con IAM con elevación del segmento ST, bloqueo de rama izquierda nuevo o presuntamente nuevo, o infarto posterior verdadero con inicio de los síntomas de hasta 12 horas de evolución (recomendación I, A).
La angioplastia primaria es de elección cuando el paciente presenta una insuficiencia cardíaca severa o shock (75-77). En estos pacientes el beneficio de la angioplastia es significativamente mayor en relación con los trombolíticos.
2. La angioplastia primaria debería indicarse en pacientes con IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda de hasta 36 horas de evolución que se presentan con shock cardiogénico de menos de 18 horas de evolución que tengan menos de 75 años (recomendación I, A), o 75 años o más (recomendación I, B).
3. La angioplastia primaria debería indicarse en pacientes con IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda de hasta 12 horas de evolución que se presentan con insuficiencia cardíaca severa (Killip 3) (recomendación I, B).
Como dijimos, la eficacia de la angioplastia primaria está demostrada en las primeras 12 horas de evolución del infarto. Se puede extender este período en determinadas situaciones, una de las cuales –tal como lo señalamos– es el shock cardiogénico. Hay otras situaciones que merecen consideración:4. Es razonable realizar angioplastia primaria en el IAM con elevación del segmento ST o bloqueo de rama izquierda nuevo o presuntamente nuevo en pacientes que tienen entre 12 y 24 horas de evolución y que presenten:
a. insuficiencia cardíaca severa (recomendación IIa, C);
b. inestabilidad eléctrica severa (recomendación IIa, C);
c. persistencia de síntomas isquémicos (recomendación IIa, C).
La angioplastia primaria debe hacerse solamente en el vaso culpable a no ser que el paciente se presente en shock, en cuyo caso se justifica la revascularización de todos los vasos posibles (1).
El cardiólogo intervencionista que hace la angioplastia primaria debería tener buen nivel de entrenamiento (realizar personalmente más de 75 angioplastias anuales), y trabajar en un laboratorio que tenga volumen apropiado de procedimientos (más de 200 angioplastias con al menos 36 angioplastias primarias anuales) (1).
Se han realizado varios estudios randomizados para comparar la realización de trombolíticos in situ contra la transferencia del paciente a un centro terciario para realizar angioplastia primaria. Globalmente estos estudios indican que el traslado para angioplastia primaria es eficaz y seguro (con un muy bajo índice de complicaciones durante el transporte) (73,79-83).
- Angioplastia de rescate
La angioplastia de rescate es aquella que se realiza cuando hay una falla de los trombolíticos en reperfundir la arteria, realizándose la desobstrucción mecánica posterior a los mismos (84).
Uno de los mayores inconvenientes que tiene esta opción terapéutica es que no existe ningún criterio no invasivo certero de que ha fallado la reperfusión (renivelación del segmento ST, arritmias de reperfusión, pico enzimático precoz) (85).
La indicación de angioplastia de rescate debe ser con criterio clínico. Ante una mala evolución clínica inicial posterior a la administración de trombolíticos, se debe realizar una angiografía y practicar angioplastia si la arteria culpable está ocluida o tiene un flujo distal comprometido.
El plazo razonable para plantearse la angioplastia de rescate son las 12 horas iniciales, con excepción del shock, donde se justifica un plazo más prolongado (1,2).
1. La angioplastia de rescate debería indicarse en pacientes con IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda de hasta 12 horas de evolución que luego del tratamiento trombolítico se presentan con insuficiencia cardíaca severa (Killip 3) (recomendación I, B).
2. La angioplastia de rescate debería indicarse en pacientes con IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda de hasta 36 horas de evolución que luego del tratamiento trombolítico se presentan con shock cardiogénico de menos de 18 horas de evolución que tengan menos de 75 años (recomendación I,B), o 75 años o más (recomendación IIa, B).
3. Es razonable indicar una angioplastia de rescate en el IAM con elevación del segmento ST o con nuevo o presuntamente nuevo bloqueo de rama izquierda en pacientes que luego del tratamiento trombolítico se presentan con:
a. persistencia de síntomas de isquemia (recomendación IIa, C);
b. inestabilidad eléctrica severa (recomendación IIa, C).
- Angioplastia facilitada
La angioplastia facilitada es la angioplastia que es precedida en forma planificada de un tratamiento farmacológico que ayude a la reperfusión tal como una dosis plena de trombolíticos, media dosis de trombolíticos, inhibidores de la glicoproteína IIb-IIIa, o combinación de ambos tipos de fármacos.
Como veremos más adelante, la combinación de inhibidores de la glicoproteína IIb-IIIa con angioplastia en el IAM ha sido testada y ha demostrado beneficio, especialmente con abciximab y en los pacientes de mayor riesgo (86-88).
En relación con la asociación con trombolíticos o en forma combinada con ambos fármacos, el estado del conocimiento sobre el tema no nos permite en el momento actual hacer una recomendación definitiva y se debe aguardar más información sobre el tema (89-92). El exceso de sangrado es una preocupación.
1. En pacientes con un IAM con elevación del segmento ST o bloqueo de rama izquierda nuevo o presuntamente nuevo, es razonable administrar abciximab lo más rápido posible antes de la angioplastia primaria (recomendación IIa, A).
2. En pacientes con un IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda puede plantearse una angioplastia facilitada con asociación con trombolíticos o trombolíticos e inhibidores de la glicoproteína IIb-IIIa, especialmente en pacientes de alto riesgo, sin riesgo alto de sangrado y donde la angioplastia primaria puede demorarse (recomendación IIb, B).
5c10. Medidas antitrombóticas
- Acido acetilsalicílico
El ácido acetilsalicílico (AAS) ha demostrado reducción de mortalidad del IAM con elevación del segmento ST, independientemente del método de reperfusión utilizado. Por este hecho está indicado sistemáticamente en este cuadro clínico, salvo contraindicación para el mismo (hipersensibilidad o eventualidad de complicaciones hemorrágicas).
Su administración debe hacerse inmediatamente de planteado el diagnóstico probable de IAM con elevación del segmento ST.
El beneficio del AAS es evidente a largo plazo, por lo que está indicado indefinidamente luego de un IAM con elevación del segmento ST (93-96).
1. Se debería administrar AAS a todos los pacientes con sospecha clínica de IAM (recomendación I, A).
2. La dosis inicial debería ser de 160 mg (recomendación I, A) hasta 325 mg (recomendación I, C). La dosis inicial más práctica es 250 mg (recomendación I,C).
3. La administración de AAS es independiente del tratamiento de reperfusión utilizado (recomendación I, A).
4. Es recomendable inicialmente utilizar comprimidos sin cobertura entérica para lograr una absorción oral más rápida (recomendación I, B).
5. Se debería administrar una dosis diaria de AAS (75 a 160 mg) en forma indefinida luego del IAM (recomendación I, A).
- Heparina no fraccionada
En relación con la heparina no fraccionada debemos considerar varios aspectos.
El primero es su uso adjunto al tratamiento trombolítico.
Hay un acuerdo indiscutido en que la heparina debe utilizarse asociada a la administración de trombolíticos fibrinoespecíficos (escasamente utilizados en nuestro medio) (1,2).
Considerando trombolíticos como la estreptoquinasa, varios ensayos (97-99) mostraron que la heparina no era necesaria como coadyuvante, por lo que se planteó como una recomendación de tipo III. Sin embargo, evidencia más reciente (100-101) plantea la posibilidad del beneficio de su asociación, por que se plantea como una recomendación de tipo IIb.
1. En pacientes con IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda tratados con trombolíticos fibrinoespecíficos se debe asociar heparina no fraccionada intravenosa (recomendación I, C).
2. En pacientes con un IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda tratados con estreptoquinasa se puede asociar heparina no fraccionada intravenosa (recomendación IIb, B).
El segundo aspecto es su uso adjunto a la angioplastia primaria.
En este sentido es habitual su indicación cuando se realiza el procedimiento, buscando conseguir un tiempo de coagulación activada entre 250 y 350 segundos y de 200 segundos cuando se asocia a inhibidores de la glicoproteína IIb-IIIa.
No hay uniformidad de criterios referidos a cuánto tiempo se mantiene esta indicación después de la angioplastia. En general, se acepta que una vez terminado el procedimiento no hay motivo para mantener el tratamiento con heparina a no ser que existan indicaciones precisas para ello (riesgo de reoclusión por resultado final de angioplastia insatisfactorio o un notorio componente trombótico intraarterial, riesgo clínico de embolia sistémica) (1,2).
1. En pacientes con un IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda tratados con angioplastia, se debería administrar heparina no fraccionada intravenosa durante el procedimiento (recomendación I, C).
2. En pacientes con un IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda tratados con angioplastia que tengan alto riesgo de reoclusión o de embolia sistémica, es razonable administrar heparina no fraccionada intravenosa luego del procedimiento (recomendación IIa, C).
3. En pacientes con un IAM con elevación del segmento ST o bloqueo de rama izquierda nuevo o presuntamente nuevo tratados con angioplastia sin riesgo de reoclusión o embolia sistémica, puede administrarse heparina no fraccionada intravenosa luego del procedimiento (recomendación IIb, C).
El tercer aspecto es el uso de heparina no fraccionada en situaciones en que habría indicaciones precisas para la misma (1,2).
Una indicación precisa es el riesgo de embolia sistémica que se observa en pacientes con infarto extenso o anterior, fibrilación auricular, embolia previa, trombos intracavitarios o shock cardiogénico.
Los pacientes que no han tenido tratamiento de reperfusión pueden estar expuestos al riesgo de embolismo sistémico y pulmonar, en especial en los días en que la deambulación es limitada y en que las otras medidas antitrombóticas que la heparina pueden no haber logrado su efecto pleno. Por este motivo, se recomienda la administración de heparina por al menos 48 horas.
Por otra parte, la profilaxis de la trombosis venosa profunda y el consiguiente embolismo pulmonar deben basarse en la deambulación precoz. Es dudoso el beneficio de la profilaxis con heparina de esta complicación si el paciente está deambulando.
Dado que estas indicaciones son compartidas con la heparina de bajo peso molecular, se exponen en conjunto.
1. La heparina no fraccionada intravenosa (bolo de 60 U/kg, máximo 4.000 U por vía intravenosa; infusión inicial de 12 U/kg/h, máximo 1.000 U/h) o heparina de bajo peso molecular, deberían ser administradas a pacientes con IAM con elevación del segmento ST con alto riesgo de embolia sistémica (infarto extenso o anterior, fibrilación auricular, embolia previa, trombo de ventrículo izquierdo conocido o shock cardiogénico) (recomendación I, C).
2. Es razonable que los pacientes con IAM con elevación del segmento ST que no recibieron tratamiento de reperfusión, que no tienen contraindicación para anticoagulación, sean tratados con heparina no fraccionada intravenosa o subcutánea, o con heparina de bajo peso molecular subcutánea por lo menos durante 48 horas (recomendación IIa,C).
3. Puede indicarse heparina no fraccionada o heparina de bajo peso molecular subcutánea para la profilaxis sistemática de la trombosis venosa profunda, aunque es dudoso su beneficio con el uso rutinario de AAS y la deambulación precoz (recomendación IIb, C).
4. En pacientes cuya condición clínica requiere reposo prolongado o actividad mínima, o ambos, es razonable el tratamiento con heparina no fraccionada intravenosa o subcutánea, o con heparina de bajo peso molecular subcutánea hasta que el paciente deambule (recomendación IIa, C).
- Heparina de bajo peso molecular
Las heparinas de bajo peso molecular se han generalizado en nuestra práctica clínica. Su eficacia demostrada en los síndromes coronarios agudos sin elevación del segmento ST, asociada a la comodidad de administración subcutánea y la ausencia de necesidad de controles, las han popularizado.
En pacientes con IAM con elevación del segmento ST la acumulación de evidencia es bastante menor. La investigación se ha realizado especialmente con enoxaparina asociada a administración de trombolíticos. En relación con el uso adjunto al tratamiento trombolítico se deben realizar varias consideraciones.
La enoxaparina asociada a agentes trombolíticos fibrinoespecíficos mostró, en general, menor tasa de reoclusión y mayor tasa de permeabilidad tardía, menor ocurrencia de reinfarto o isquemia recurrente en comparación con placebo o heparina no fraccionada (102,103). Debe observarse que puede haber mayor riesgo de sangrado, especialmente en añosos.
En relación con la estreptoquinasa asociada a enoxaparina, un estudio (104) mostró, en relación con el placebo, mejor resolución del segmento ST y mayor permeabilidad angiográfica. Esto se asoció a una reducción significativa de eventos clínicos, indicando menor reoclusión.
Un estudio recientemente publicado comparó la administración de reviparina (una heparina de bajo peso molecular) durante siete días contra placebo en pacientes con IAM con elevación del segmento ST (105). Es de destacar que en este estudio de más de 15.000 pacientes, 73% fueron tratados con trombolíticos en su enorme mayoría no fibrino-específicos (estreptoquinasa y uroquinasa). En este estudio el end point principal (muerte, reinfarto y accidente vascular encefálico a 7 y 30 días) fue significativamente menor en el grupo de pacientes tratados con reviparina. Hubo exceso de sangrado menor aunque el sangrado mayor con peligro vital fue muy poco frecuente.
En virtud de estas consideraciones entendemos que hasta el momento la asociación de trombolíticos con heparina de bajo peso molecular puede recomendarse. En relación con los agentes fibrinoespecíficos, si bien los resultados angiográficos y clínicos fueron favorables, fue un llamado de alerta la incidencia de sangrado, especialmente en añosos. En relación con la estreptoquinasa y su asociación con heparina de bajo peso molecular el reciente trabajo comentado sostiene su recomendación.
1. En pacientes con IAM con elevación del segmento ST o bloqueo de rama izquierda nuevo o presuntamente nuevo tratados con estreptoquinasa es razonable administrar heparina de bajo peso molecular (recomendación IIa, B).
2. En pacientes con un IAM con elevación del segmento ST o bloqueo de rama izquierda nuevo o presuntamente nuevo tratados con trombolíticos fibrinoespecíficos, se puede asociar heparina de bajo peso molecular (recomendación IIb, B).
El segundo aspecto es su uso adjunto a la angioplastia primaria.
La heparina de bajo peso molecular ha ganado terreno también en el campo de la cardiología intervencionista, habiendo demostrado ser útil como alternativa a la heparina no fraccionada en la intervención percutánea.
De la misma manera que para la heparina no fraccionada se acepta que no hay mayor justificación (aunque no haya contraindicación) para continuar, luego de un procedimiento exitoso, con heparina de bajo peso molecular en los pacientes sin riesgo de reoclusión o embolia sistémica.
1. En pacientes con un IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda tratados con angioplastia, es razonable administrar heparina de bajo peso molecular como alternativa a la heparina no fraccionada intravenosa durante el procedimiento (recomendación IIa, C).
2. En pacientes con un IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda tratados con angioplastia, que tengan alto riesgo de reoclusión o de embolia sistémica, es razonable administrar heparina de bajo peso molecular como alternativa a la heparina no fraccionada intravenosa luego del procedimiento (recomendación IIa, C).
3. En pacientes con un IAM con elevación del segmento ST o bloqueo de rama izquierda nuevo o presuntamente nuevo tratados con angioplastia sin riesgo de reoclusión o embolia sistémica puede administrarse heparina de bajo peso molecular luego del procedimiento (recomendación IIb, C).
En relación con las indicaciones precisas para la heparina de bajo peso molecular ya fueron referidas en la sesión de heparina no fraccionada.
- Tienopiridinas
Estos fármacos antiplaquetarios han sido incorporadas en la práctica clínica, dado que en una angioplastia convencional han reducido significativamente la oclusión trombótica cuando se coloca un stent.
La ticlopidina ha sido desplazada por el clopidogrel pues este tiene menos efectos colaterales y, además, se administra en una sola dosis diaria de 75 mg (106,107).
El clopidogrel se administra usualmente asociado a AAS.
El tiempo de indicación depende del tipo de stent utilizado.
Cuando se trata de un stent convencional se recomienda por lo menos un mes, aunque la evidencia actual sugiere extender la indicación al año si no hay riesgo de sangrado (108). En los pacientes en que se haya colocado un stent liberador de fármacos, se plantea indicar clopidogrel por lo menos por seis meses si el fármaco liberado es paclitaxel y tres meses si se trata de sirolimus (1).
El clopidogrel puede ser, además, una alternativa a AAS en caso de hipersensibilidad o grave intolerancia gastrointestinal a este último fármaco.
El clopidogrel demora aproximadamente siete días en lograr su efecto antiagregante plaquetario máximo cuando se comienza a medicar con la dosis diaria de 75 mg. Este hecho ha determinado que se haya generalizado el uso de la dosis carga, que abrevia este tiempo. Con la dosis carga de 300 mg se logra el máximo efecto antiagregante a las diez horas. En caso de una dosis carga de 600 mg, este tiempo se reduce a dos horas. A punto de partida de este conocimiento, la dosis carga de 600 mg se ha difundido para la indicación en los pacientes críticos.
Cuando se administra clopidogrel, el paciente tiene una tendencia al sangrado que puede constituir un serio problema en caso de indicación de una cirugía mayor como es la cirugía de revascularización miocárdica. En este caso se recomienda suspender el clopidogrel, de ser posible, cinco a siete días previos a su realización.
Recientemente se han conocido los resultados de estudios clínicos en pacientes con IAM que no fueron sometidos a angioplastia primaria, donde se comparó la administración de clopidogrel o placebo (109). Los resultados fueron favorables para los pacientes tratados con clopidogrel con un nivel adecuado de seguridad (no hubo un exceso de sangrado en estos pacientes). Por este motivo el Consenso adopta la recomendación de que es razonable administrar clopidogrel asociado a AAS en aquellos pacientes que no hayan sido sometidos a angioplastia primaria. Es opinable en este caso si se debe administrar dosis carga de clopidogrel.
1. El clopidogrel debería ser administrado asociado a AAS en todos los pacientes portadores de IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda que fueron tratados con angioplastia coronaria con colocación de stent (recomendación I, B).
2. Es razonable asociar clopidogrel a AAS en los pacientes que sufrieron un IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda que fueron tratados con trombolíticos o no fueron sometidos a reperfusión (recomendación IIa, B).
3. Es razonable que el clopidogrel sea una alternativa de sustitución en caso de intolerancia gastrointestinal severa o hipersensibilidad a AAS (recomendación IIa, C).
- Inhibidores de la glicoproteína IIb-IIIa
Los inhibidores de la glicoproteína IIb-IIIa son fármacos antiplaquetarios que en nuestro medio se utilizan escasamente, especialmente motivado por su alto costo.
Los inhibidores de la glicoproteína IIb-IIIa asociados a la angioplastia primaria han sido testados (especialmente el abciximab) en varios ensayos clínicos. Estos ensayos evidencian el beneficio del abciximab en los end points combinados muerte y reinfarto o muerte, reinfarto o nueva revascularización de urgencia. El beneficio podría ser especialmente en los pacientes de alto riesgo (86-88).
No hay mayor evidencia respecto al uso de otros inhibidores de la glicoproteína IIb-IIIa, como el tirofiban y el eptifibatide, aunque el beneficio demostrado de estos fármacos en los síndromes coronarios agudos sin elevación del segmento ST hace posible, por extensión, su uso.
1. En pacientes con un IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda es razonable administrar abciximab lo más rápido posible, antes de la angioplastia primaria (recomendación IIa, A).
2. En pacientes con un IAM con elevación del segmento ST o nuevo o presuntamente nuevo bloqueo de rama izquierda puede administrarse tirofiban o eptifibatide antes de la angioplastia primaria (recomendación IIb, C).
En relación con los inhibidores de la glicoproteína IIb-IIIa asociados a trombolíticos se han realizado ensayos con abciximab y agentes fibrinoespecíficos que mostraron reducción de la tasa de reinfarto. Sin embargo, ha preocupado el exceso de sangrado, especialmente en pacientes añosos (102,110,111).
3. En pacientes menores de 75 años con un IAM con elevación del segmento ST o bloqueo de rama izquierda nuevo o presuntamente nuevo tratados con trombolíticos fibrinoespecíficos (mitad de dosis), puede asociarse abciximab (recomendación IIb,B).
- Anticoagulantes orales
Estudios clínicos han analizado el efecto de estos fármacos postinfarto, solos o combinados con AAS. Los regímenes que han mostrado ser más eficaces son los de dosis medias de warfarina con dosis bajas de AAS. El beneficio se ha observado particularmente en la reducción de la tasa de reinfarto no fatal y de accidente vascular encefálico, aunque a un costo de incremento significativo de sangrado no fatal (112-115).
Para el grupo de Consenso el uso de anticoagulantes orales solos o asociados a AAS en forma sistemática postinfarto no se sustenta por estos estudios.
La warfarina puede plantearse como una alternativa cuando hay intolerancia o alergia a AAS. Sin embargo, en estas circunstancias el grupo de Consenso prefiere el uso de clopidogrel por su buena tolerancia y ausencia de requerimiento de controles.
Los anticoagulantes orales tienen su lugar cuando hay una indicación precisa para ellos, como fibrilación auricular o presencia de trombo intracavitario.
Hay además evidencia de que la warfarina a largo plazo podría ser útil para la prevención de eventos embólicos en pacientes con disfunción severa del ventrículo izquierdo con o sin insuficiencia cardíaca (116). Sin embargo, el exceso de sangrado y las dificultades de la anticoagulación limitan esta indicación.
Dado el beneficio conocido de AAS en pacientes con infarto, los anticoagulantes orales cuando están indicados deberían administrarse habitualmente asociados con el primero. La dosis de anticoagulantes orales en asociación con AAS debe ajustarse para lograr un INR de 2.0-3.0 (1).
1. En pacientes con un IAM con elevación del segmento ST o bloqueo de rama izquierda nuevo o presuntamente nuevo con fibrilación auricular paroxística o persistente deberían indicarse anticoagulantes orales (recomendación I, A).
2. En pacientes con un IAM con elevación del segmento ST o bloqueo de rama izquierda nuevo o presuntamente nuevo con trombo en estudios de imagen deberían indicarse anticoagulantes orales por lo menos durante tres meses (recomendación I, B) o indefinidamente en caso de ausencia de riesgo de sangrado (recomendación I, C).
3. En pacientes con un IAM con elevación del segmento ST o bloqueo de rama izquierda nuevo o presuntamente nuevo con disfunción severa y extensas anomalías de la contracción regional del ventrículo izquierdo es razonable administrar anticoagulantes orales (recomendación IIa, A).
4 En pacientes con un IAM con elevación del segmento ST o bloqueo de rama izquierda nuevo o presuntamente nuevo con alergia o intolerancia a AAS, pueden administrarse anticoagulantes orales como alternativa (recomendación IIb, B).
5c11. Calcioantagonistas
Los calcioantagonistas no son utilizados habitualmente en el IAM con elevación del segmento ST. Su indicación queda reducida a la situación de síntomas de isquemia que no pueden controlarse con betabloqueantes y nitratos (ya sea porque están contraindicados o no son efectivos), o ante taquiarritmias que no pueden controlarse con betabloqueantes (1,2).
Los calcioantagonistas deben utilizarse en ausencia de insuficiencia cardíaca o bloqueo auriculoventricular avanzado.
Debería proscribirse el uso de nifedipina pues ha mostrado tener mayor incidencia de efectos adversos en síndromes coronarios agudos.
1. Es razonable indicar calcioantagonistas, como el diltiazem o verapamil, en pacientes con un IAM con elevación del segmento ST o bloqueo de rama izquierda nuevo o presuntamente nuevo que presenten síntomas de isquemia que no puedan controlarse con betabloqueantes y nitratos (recomendación IIa, C).
2. Es razonable indicar calcioantagonistas, como el diltiazem o verapamil, en pacientes con un IAM con elevación del segmento ST o bloqueo de rama izquierda nuevo o presuntamente nuevo que presenten taquiarritmias no controlables con betabloqueantes (recomendación IIa, C).
3. En los pacientes que han sufrido un IAM con elevación del segmento ST los anticálcicos dihidropiridinicos de acción corta (nifedipina) no deberían ser usados (recomendación III, B).
4. En los pacientes que han sufrido un IAM con elevación del segmento ST, el diltiazem y verapamil no deberían usarse si hay congestión pulmonar o FEVI menor de 40% (recomendación III, A).
5c12. Control de la glicemia
1. Se debería indicar infusión de insulina a todo IAM con elevación del segmento ST complicado y con hiperglicemia con el fin de normalizar la misma (I,B).
2. Es razonable indicar infusión de insulina durante las primeras 48 horas de todo IAM con elevación del segmento ST con hiperglicemia con el fin de normalizar la misma (IIa, B).
3. En el paciente con IAM con elevación del segmento ST e hiperglicemia más allá de las primeras 48 horas se individualizará el tratamiento con dieta, insulina o hipoglucemiantes orales (recomendación IIa, C).
Se ha demostrado que los pacientes críticos que tienen un inadecuado control de sus niveles de glicemia presentan una peor evolución (117,118). Por este motivo se recomienda un estricto control de sus niveles de glicemia. No están definidos totalmente los niveles que deben manejarse como aceptables, pues hay diferentes criterios entre los autores (80-110 mg/dl o 100-139 mg/dl).
Luego del período inicial se individualizará para cada paciente el esquema de tratamiento adecuado.
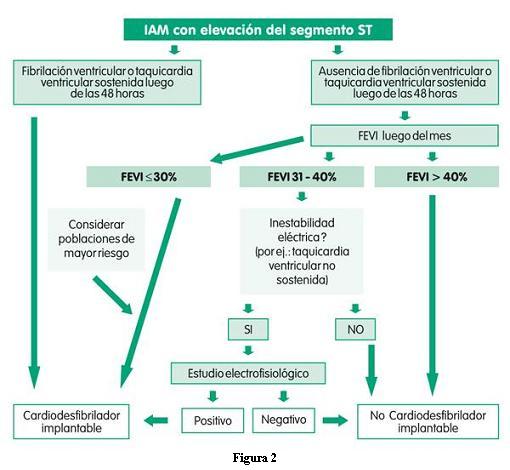
5D. COMPLICACIONES
5d1. Congestión pulmonar
La insuficiencia cardíaca incrementa notoriamente la mortalidad en el IAM. La presencia de edema pulmonar incrementa a más de 20% la mortalidad hospitalaria (119-121).
El mecanismo básico de la congestión pulmonar es el incremento de la presión de llenado del ventrículo izquierdo, que puede ocurrir por disfunción diastólica o sistólica, o ambas, a la que puede asociarse una insuficiencia mitral. El incremento de la presión capilar lleva a la redistribución de fluidos desde el espacio intravascular al extravascular (intersticio pulmonar y alvéolos), produciendo edema pulmonar.
La congestión pulmonar puede presentarse al inicio del infarto o en la evolución. El edema pulmonar en pacientes con insuficiencia cardíaca o disfunción ventricular previas, o que aparece en los días siguientes a la instalación del IAM, se asocia habitualmente con hipervolemia. En cambio, los pacientes que tienen edema pulmonar precoz y no tenían disfunción ventricular izquierda previa, tienen normovolemia. Este aspecto es muy importante a la hora de indicar medidas de reducción de la precarga, pues en estas condiciones puede haber hipotensión seria con evolución al shock (1).
Las medidas inmediatas ante la congestión pulmonar deben ser elevar la oxigenación arterial y reducir la precarga para aliviar la congestión.
El oxígeno debe administrarse con máscara de flujo libre o catéter nasal. No se recomienda ventilación no invasiva pues puede tener efectos deletéreos en el curso de un IAM. Si las medidas de suplemento de oxígeno y de depleción de precarga no son efectivas, debe valorarse intubación y asistencia respiratoria mecánica. Esta indicación está planteada cuando la saturación de oxígeno arterial no puede mantenerse por encima de 90%.
El manejo inicial de la precarga incluye indicar morfina, nitratos, diuréticos y evitar los agentes inotrópicos negativos (betabloqueantes y anticálcicos) (1,2,122).
En relación con los nitratos, se recomienda su uso inicial sublingual para luego continuar, si es necesario, con la vía intravenosa. La nitroglicerina debe administrarse inicialmente en dosis de 10-20 µg/minuto con incremento gradual, si es preciso, de 5-10 µg/minuto cada 5-10 minutos hasta lograr el cese de la disnea o el descenso de la presión arterial sistólica más de 10% del valor inicial en normotensos o más de 30% en hipertensos, o cuando la frecuencia cardíaca aumentó un 10% el valor basal.
Como dijimos previamente, debe prestarse especial atención al estado de la volemia antes de la realización de medidas deplectivas con diuréticos.
Se recomienda como diurético a la furosemide, a dosis inicial de 20-40 mg, que puede repetirse si es necesario cada una a cuatro horas. Dosis moderadas de furosemide (80 mg), pueden indicarse si el paciente recibía previamente diuréticos, presenta insuficiencia cardíaca o renal previa.
En la evolución deberá considerarse la indicación de inhibidores de la enzima conversora de angiotensina. Es preferible una forma de efecto corto como el captopril, en dosis bajas (1 mg a 6,25 mg), incrementando la dosis según la evolución hasta lograr un efecto máximo a las 24-48 horas. La presión arterial sistólica debe ser superior a 100 mmHg y no menor de 30 mmHg del valor inicial para comenzar IECA. Posteriormente se podrá pasar a fármacos de mayor tiempo de efecto, como el enalapril o el ramipril.
En la etapa evolutiva hospitalaria se deberá valorar, además, la indicación de agentes bloqueantes de aldosterona. Uno de ellos (epleronona) (123), mostró reducción de muerte y necesidad de nuevas internaciones cuando se administró postIAM en pacientes con insuficiencia cardíaca y fracción de eyección de ventrículo izquierdo menor de 40%. Además, es conocido que la espirolactona es beneficiosa en pacientes con insuficiencia cardíaca crónica (124).
Por otra parte, los betabloqueantes están claramente indicados en la insuficiencia cardíaca crónica, tal como ha sido acordado en el Consenso uruguayo de insuficiencia cardíaca de la SUC. Estos fármacos deben incorporarse en el paciente que evoluciona con evidencias de insuficiencia cardíaca en la fase evolutiva hospitalaria, una vez superada la fase aguda (125).
Es muy importante realizar un ecocardiograma ante la instalación de una insuficiencia cardíaca en el curso de IAM, pues permite evaluar la función ventricular izquierda y derecha y descartar eventuales complicaciones mecánicas.
Finalmente, debemos recordar que la angioplastia primaria es la opción preferible de reperfusión en paciente con IAM y falla cardíaca. También debe considerarse realizar una coronariografía antes del alta hospitalaria en los pacientes que cursaron con falla cardíaca hospitalaria, para conocer la anatomía y evaluar una eventual revascularización miocárdica.
Por lo anteriormente señalado se formulan las siguientes recomendaciones en pacientes con un IAM con elevación del segmento ST o bloqueo de rama izquierda nuevo o presuntamente nuevo que presentan congestión pulmonar:
1. Oxígeno suplementario para lograr una saturación arterial mayor de 90% (recomendación I, C).
2. Morfina endovenosa (recomendación I, C).
3. Nitratos (por vía sublingual y luego intravenosa si es necesario) (recomendación I, C).
4. Furosemide si hay congestión pulmonar con signos de hipervolemia (recomendación I, C).
5. IECA vía oral en dosis inicialmente bajas, de preferencia de acción corta (recomendación I, A).
6. Betabloqueantes una vez estabilizado el paciente (recomendación I,A)
7. Espirolactona en la fase hospitalaria en pacientes que ya están recibiendo IECA, tienen fracción de eyección del ventrículo izquierdo menor o igual a 40% y tienen síntomas de insuficiencia cardíaca o diabetes (recomendación I, A).
8. Debería realizarse un ecocardiograma urgente para evaluar función ventricular izquierda y derecha y descartar complicaciones mecánicas (recomendación I, C).
9. Ante una congestión pulmonar refractaria es razonable colocar un catéter en arteria pulmonar que puede aportar información útil para su manejo (recomendación IIa, C).
10. Ante una congestión pulmonar refractaria puede colocarse un balón de contrapulsación intraórtica para su mejor manejo (recomendación IIb, C).
11. En pacientes con congestión pulmonar con IAM de menos de 12 horas de evolución está indicada la angioplastia primaria (recomendación I, A).
12. En pacientes con congestión pulmonar refractaria que presenten un IAM entre 12 a 24 horas de evolución es razonable realizar una angioplastia primaria (recomendación IIa, C).
13. Betabloqueantes y anticálcicos no deben ser administrados en la fase aguda si hay signos de congestión pulmonar severos o bajo gasto (recomendación III, B).
5d2. Shock cardiogénico
El shock cardiogénico se caracteriza generalmente por una presión sistólica menor de 90 mmHg, presión capilar pulmonar mayor de 20 mmHg, e índice cardíaco menor de 1,8 latidos por minuto con evidencias clínicas de hipoperfusión periférica (1,2).
El diagnóstico positivo de shock cardiogénico debe ser realizado luego de que otras causas de hipotensión se hayan descartado (hipovolemia, reacción vagal, efecto farmacológico o arritmias). Además, debe considerarse como causa de la situación clínica un infarto de ventrículo derecho en presencia de un infarto inferior y la posibilidad de una complicación mecánica (rotura del séptum interventricular, rotura de músculo papilar). Por este motivo se hace tan importante la realización de un ecocardiograma en un shock cardiogénico.
El shock cardiogénico implica una alta mortalidad, pues está comprometida una gran masa ventricular (se estima en más de 40% del ventrículo izquierdo). Dado que puede haber una gran extensión de miocardio atontado, es que en el shock cardiogénico la maniobra terapéutica más importante es la reperfusión (1,2). Esta medida es la que ha mejorado sustancialmente el pronóstico de una entidad clínica que previamente tenía una elevadísima mortalidad.
En presencia de un shock cardiogénico la actitud terapéutica debe ser enviar lo antes posible al paciente a realización de coronariografía. Se colocará balón de contrapulsación intraórtica y se decidirá si corresponde indicar al paciente angioplastia primaria o cirugía de emergencia. En el caso de un shock cardiogénico de instalación precoz (menos de tres horas del inicio del IAM), hay consenso en que sería beneficioso administrar trombolíticos previos si el tiempo de demora para la realización de angiografía fuera mayor a 90 minutos (126). Esta recomendación puede ser muy importante para centros que no disponen, con esa rapidez, de sala de hemodinamia.
Para el caso de que el paciente tenga más tiempo de evolución, se debería priorizar el traslado a una sala de hemodinamia.
En caso de que no haya ninguna posibilidad de realizar tratamiento invasivo, los trombolíticos están indicados.
El manejo del shock cardiogénico implica habitualmente intubación y asistencia respiratoria mecánica, asegurando una saturación de oxígeno arterial mayor de 90% con ventilación espontánea con oxígeno 100%.
La monitorización invasiva de la presión arterial está indicada, para lo cual debe considerarse la colocación de un catéter arterial para control de la presión arterial periférica. La colocación de un catéter en arteria pulmonar para control de la presión capilar pulmonar y gasto cardíaco puede aportar información valiosa para el diagnóstico y manejo del shock cardiogénico cuando no sea posible realizar un ecocardiograma o no se pueda trasladar a hemodinamia, o no responda al aporte de volumen o el aporte de volumen está contraindicado.
Está indicado el soporte hemodinámico con fármacos simpáticomiméticos y su elección depende de la situación clínica del paciente (1,2,122).
La dobutamina en dosis de 2 a 20 µg/kg/minuto está indicada cuando la presión arterial sistólica es mayor de 90 mmHg, y hay elementos predominantes de congestión pulmonar.
La dopamina en dosis de 5 a 15 µg/kg/minuto está indicada cuando la presión arterial sistólica es menor de 90 mmHg, y hay elementos predominantes de hipoperfusión periférica.
Estos dos fármacos pueden administrarse en forma combinada.
La norepinefrina está indicada en dosis de 0,5 a 30 µg/minuto cuando la presión arterial sistólica es menor de 70 mmHg.
Por último, el balón de contrapulsación intraórtica es muy eficaz en el mantenimiento de la condición hemodinámica del paciente, pues mantiene la perfusión periférica y, por otra parte, favorece la perfusión coronaria. Es especialmente efectivo como mecanismo puente a la realización de revascularización miocárdica, que, como dijimos, es la medida terapéutica que mejor resultado ha dado en la sobrevida de estos pacientes.
1. En pacientes con shock cardiogénico debería indicarse asistencia respiratoria mecánica cuando la hipotensión se mantiene a pesar de las medidas iniciales de reanimación farmacológica o la saturación de oxígeno arterial no es mayor de 90% con ventilación espontánea con oxígeno 100%.(recomendación I, C).
2. En pacientes con shock cardiogénico debería colocarse un balón de contrapulsación intraórtica cuando no hay reversión rápida con tratamiento farmacológico (recomendación I, B).
3. En pacientes con shock cardiogénico debería colocarse un catéter intraarterial para monitorizar la presión arterial por método invasivo (recomendación I, C).
4. En pacientes con shock cardiogénico es razonable colocar un catéter en arteria pulmonar para el control de la presión capilar pulmonar y medida del gasto cardíaco (recomendación IIa, C).
5. En pacientes con shock cardiogénico deberían administrarse fármacos simpaticomiméticos (recomendación I,B):
a. dobutamina cuando la presión arterial sistólica es mayor de 90 mmHg y predominan elementos de congestión pulmonar;
b. dopamina cuando la presión arterial sistólica es menor de 90 mmHg y predominan elementos de hipoperfusión periférica;
c. norepinefrina cuando la presión sistólica es menor de 70 mmHg.
6. La angioplastia primaria debería indicarse en pacientes con IAM con elevación del segmento ST o bloqueo de rama izquierda nuevo o presuntamente nuevo de hasta 36 horas de evolución que se presentan con shock cardiogénico de menos de 18 horas de evolución que tengan menos de 75 años (recomendación I, A), o 75 años o más (recomendación I, B).
7. En pacientes con shock cardiogénico con enfermedad coronaria grave que no pueda resolverse con angioplastia, debería indicarse cirugía de revascularización miocárdica (recomendación I, B).
8. En pacientes con shock cardiogénico deberían administrarse trombolíticos cuando no hay posibilidad de tratamiento invasivo (recomendación I, B).
9. En pacientes con shock cardiogénico de corta evolución (hasta tres horas del inicio del IAM), si se prevé una demora significativa para realizar tratamiento invasivo (más de 90 minutos), es razonable indicar trombolíticos previos al mismo (recomendación IIa, C).
10. En pacientes con shock cardiogénico debería realizarse un ecocardiograma para evaluar la función de ambos ventrículos y posibles complicaciones mecánicas (recomendación I, C).
5d3. Infarto de ventrículo derecho
El IAM de ventrículo derecho se produce por oclusión de la coronaria derecha proximal a sus ramos marginales (127,128). El hecho de que el ventrículo derecho tenga una menor masa muscular, con la consiguiente menor demanda de oxígeno, explica que buena parte de este miocardio esté más atontado que necrótico en un IAM de ventrículo derecho. Consiguientemente, la recuperación es mucho más probable luego de varias semanas (1).
Desde el punto de vista fisiopatológico hay un incremento de la presión de llenado ventricular derecha y caída de su presión sistólica y gasto sistólico. Como consecuencia hay una reducción de la precarga del ventrículo izquierdo y reducción de su gasto sistólico.
Concomitantemente hay protusión del séptum interventricular hacia el ventrículo izquierdo, lo que compromete aun más el gasto de este ventrículo.
En esta circunstancia cualquier situación que disminuya la precarga del ventrículo derecho (hipovolemia, nitroglicerina, diuréticos), la sincronía auriculoventricular (bloqueo auriculoventricular) o aumente la postcarga del ventrículo izquierdo (insuficiencia ventricular izquierda), pueden tener efectos muy deletéreos (1).
Desde el punto de vista clínico se presenta una tríada clásica de hipotensión, pulmones limpios (sin estertores) y presión venosa central elevada (yugulares ingurgitadas) (129).
El electrocardiograma es muy importante en el diagnóstico de infarto de ventrículo derecho, por lo que debería hacerse un registro de derivaciones precordiales derechas en todo infarto inferior (130,131).
El ecocardiograma es de gran utilidad. Puede mostrar dilatación y disfunción del ventrículo derecho, movimiento anormal del séptum interventricular e interauricular y aun haber cortocircuito oximétrico derecha a izquierda a través de un foramen oval permeable (que puede ser causa de hipoxemia no corregible con oxigenoterapia).
La medida más relevante en el manejo debe ser la reperfusión lo más precoz posible para lograr la recuperación de la masa del ventrículo derecho viable (132,133). Los tiempos posibles para la reperfusión son los considerados en el capítulo respectivo.
La precarga del ventrículo derecho debe ser mantenida. Medidas como administrar diuréticos o nitroglicerina pueden ser profundamente deletéreas si no se ha corregido la precarga adecuadamente.
La administración de volumen es el primer paso en el manejo de la hipotensión en el IAM de ventrículo derecho.
Si luego de administrar 0,5 a 1 litro de suero fisiológico se mantiene la hipotensión, debe iniciarse ladministración de dobutamina.
Es común la asociación de alto grado de bloqueo auriculoventricular que debe manejarse con estimulación endocavitaria. Si la estimulación ventricular aislada no corrige la situación hemodinámica, se recomienda estimulación bicameral secuencial.
La instalación de fibrilación auricular es frecuente y debe ser rápidamente corregida.
Cuando la disfunción del ventrículo izquierdo acompaña la del ventrículo derecho, el paciente puede presentarse con severo deterioro hemodinámico por incremento de la postcarga del ventrículo derecho. En este caso, la administración de agentes vasodilatadores arteriales luego de una adecuada reposición de la precarga y aun del balón de contrapulsación intraórtica luego de la corrección de la sístole auricular, el sincronismo auriculoventricular y el inotropismo, pueden ser efectivos.
Por último, hay que considerar que el ventrículo derecho en buena proporción está atontado y que debe haber tiempo para su recuperación. La cirugía en ese período de atontamiento puede ser deletérea y debe posponerse si es posible (1).
1. En pacientes con IAM con elevación del segmento ST inferior se deberían registrar derivaciones precordiales derechas (V3R, V4R) para el diagnóstico de IAM de ventrículo derecho (recomendación I, C).
2. En pacientes con sospecha de IAM de ventrículo derecho debería realizarse un ecocardiograma (recomendación I, C).
3. En pacientes con IAM de ventrículo derecho se plantean las siguientes medidas terapéuticas:
a. reperfusión lo más temprana posible (recomendación I, C);
b. corregir la bradicardia: atropina y estimulación endocavitaria si es necesario (recomendación I, C);
c. mantener la sincronía auriculo-ventricular (recomendación I, C);
d. optimizar la precarga del ventrículo derecho con volumen si la presión venosa central es normal o baja (recomendación I, C);
e. optimizar la postcarga del ventrículo derecho corrigiendo la insuficiencia ventricular izquierda concomitante (recomendación I, C);
f. administrar inotrópicos si no hay respuesta adecuada a la corrección de la precarga (recomendación I, C);
g. luego de IAM con significativa disfunción del ventrículo derecho es razonable diferir una indicación de cirugía de revascularización miocárdica por cuatro semanas para permitir la recuperación contráctil del ventrículo derecho (recomendación IIa, C).
5d4. Complicaciones mecánicas
Las complicaciones mecánicas se presentan con una distribución temporal bimodal: la primera en las 24 horas iniciales y la otra a los 3-5 días (134).
- Rotura de pared libre ventricular
Se caracteriza en la mayoría de los casos por un súbito colapso con disociación electromecánica, habitualmente mortal.
En 25% de los casos se presenta en forma subaguda, con pequeñas cantidades de sangre en el pericardio. En este caso el cuadro clínico puede simular un reinfarto pues se presenta con dolor y nueva elevación del segmento ST. Los hallazgos físicos son típicos de taponamiento cardíaco.
El ecocardiograma es diagnóstico. La presencia de derrame pericárdico no es suficiente, pues es común en el IAM. Debe verse una masa ecodensa que corresponde a coágulos (hemopericardio).
La pericardiocentesis puede ser salvadora de vida al aliviar el taponamiento, aunque la solución definitiva es la cirugía de urgencia.
Cuando el paciente se presenta con severo deterioro hemodinámico, la demora para realizar coronariografía no es recomendable.
1. En pacientes con rotura de pared libre ventricular debería realizarse un ecocardiograma de emergencia (recomendación I, C).
2. En pacientes con rotura de pared libre ventricular debería indicarse la cirugía de urgencia (recomendación I, B).
3. En pacientes con rotura de pared libre ventricular es razonable practicar pericardiocentesis para aliviar el taponamiento cardíaco con severo deterioro hemodinámico como puente a la cirugía (recomendación IIa, C).
4. En pacientes con rotura de pared libre ventricular con severo deterioro hemodinámico, no debería realizarse coronariografía (recomendación III, C).
- Rotura del séptum interventricular
Se caracteriza clínicamente por un deterioro hemodinámico de rápida instalación asociada a soplo holosistólico. Este soplo puede ser de difícil auscultación en pacientes graves. Puede haber frémito sistólico.
El ecocardiograma es el paso diagnóstico fundamental. Habitualmente es suficiente con la técnica transtorácica.
El cateterismo derecho en el estudio hemodinámico puede aportar en el diagnóstico mostrando un salto oximétrico a nivel ventricular y una onda V gigante post QRS. Este cateterismo además permite –cuando no se puede realizar seguimiento ecocardiográfico durante la reanimación– evaluar la respuesta terapéutica.
También está indicada la realización de monitoreo de la presión arterial invasivo para el manejo terapéutico.
El balón de contrapulsación intraaórtica está indicado en el manejo del paciente para estabilizarlo previo a la cirugía.
Están indicados los vasodilatadores arteriales, como el nitroprusiato de sodio, si las condiciones hemodinámicas lo permiten para disminuir la postcarga y así disminuir el grado de cortocircuito izquierda-derecha.
La cirugía de urgencia está indicada aún cuando no haya gran compromiso hemodinámico dado que la rotura puede crecer rápidamente.
La angiografía coronaria está indicada y se debe complementar en el acto quirúrgico la reparación del séptum con revascularización coronaria si es necesario.
1. En pacientes con sospecha de rotura del séptum interventricular debería realizarse un ecocardiograma de urgencia (recomendación I, C).
2. En pacientes con rotura del séptum interventricular debería realizarse un monitoreo invasivo de la presión arterial (recomendación I, C).
3. En pacientes con sospecha de rotura del séptum interventricular es razonable colocar un catéter en arteria pulmonar con objetivos diagnósticos (salto oximétrico) y monitoreo de la presión capilar pulmonar (recomendación IIa, C).
4. En pacientes con rotura del séptum interventricular debería colocarse un balón de contrapulsación intraaórtica (recomendación I, B).
5. En pacientes con rotura del séptum interventricular deberían administrarse vasodilatadores arteriales si las condiciones hemodinámicas lo permiten (recomendación I, B).
6. En pacientes con rotura del séptum interventricular debería, si es posible, realizarse coronariografía antes de la cirugía (recomendación I, C).
7. En pacientes con rotura del séptum interventricular debería realizarse la cirugía de reparación de urgencia asociada, si es necesario, a cirugía de revascularización miocárdica (recomendación I, B).
- Insuficiencia mitral aguda
Puede deberse a dilatación del anillo valvular por dilatación del ventrículo izquierdo con insuficiencia severa, disfunción de músculo papilar o por rotura del mismo producida habitualmente por infarto inferior.
La rotura de músculo papilar típicamente se presenta con un súbito deterioro hemodinámico con edema pulmonar y shock.
El soplo sistólico es habitualmente poco audible. El frémito sistólico no es habitual.
El ecocardiograma es el paso diagnóstico fundamental. Habitualmente es suficiente con la técnica transtorácica.
El cateterismo derecho puede aportar en el diagnóstico mostrando una onda V gigante coincidiendo con el QRS. Este cateterismo permite, además, cuando no se puede realizar seguimiento ecocardiográfico, evaluar la respuesta terapéutica.
También está indicada la realización de monitoreo invasivo de la presión arterial para el manejo terapéutico.
En caso de una rotura de músculo papilar, debe considerarse la cirugía de urgencia.
El balón de contrapulsación intraaórtica está indicado en el manejo del paciente para estabilizarlo previo a la cirugía.
Están indicados los vasodilatadores arteriales, como el nitroprusiato de sodio, si las condiciones hemodinámicas lo permiten, para disminuir la postcarga y así disminuir el grado de regurgitación mitral.
La angiografía coronaria está indicada para conocer la anatomía coronaria y definir el tipo de revascularización complementaria a la cirugía sobre la válvula mitral.
El tipo de cirugía es habitualmente reemplazo valvular mitral y revascularización miocárdica.
1. En pacientes con sospecha de insuficiencia mitral aguda debería realizarse un ecocardiograma de urgencia (recomendación I, C).
2. En pacientes con insuficiencia mitral aguda con severo deterioro clínico debería realizarse un monitoreo invasivo de la presión arterial (recomendación I, C).
3. En pacientes con sospecha de insuficiencia mitral aguda es razonable colocar un catéter en arteria pulmonar con objetivos diagnósticos (onda V gigante) y monitoreo de la presión capilar pulmonar (recomendación IIa, C).
4. En pacientes con insuficiencia mitral aguda con severo deterioro clínico debería colocarse un balón de contrapulsación intraaórtica (recomendación I, B).
5. En pacientes con insuficiencia mitral aguda deberían administrarse vasodilatadores arteriales si las condiciones hemodinámicas lo permiten (recomendación I, B).
6. En pacientes con rotura de músculo papilar debería, si es posible, realizarse coronariografía antes de la cirugía (recomendación I, C).
7. En pacientes con rotura de músculo papilar debería realizarse la cirugía sobre válvula mitral de urgencia asociada, si es necesario, a cirugía de revascularización miocárdica (recomendación I, B).
En caso de que no exista rotura de músculo papilar debe realizarse tratamiento agresivo de reducción de la postcarga, que incluya, si es necesario, balón de contrapulsación intraaórtica.
La reperfusión miocárdica en los tiempos estipulados puede ser una medida fundamental en estos casos sin rotura de músculo papilar. Este tratamiento de reperfusión y las medidas médicas agresivas pueden permitir una mejoría de la insuficiencia mitral y de la condición clínica en los días siguientes en muchos casos, evitando la cirugía sobre la válvula mitral.
5d5. Trastornos del ritmo
Los trastornos del ritmo son frecuentes en el IAM. Se presentan habitualmente en forma precoz y tienen implicancia pronóstica temprana y alejada.
- Mecanismos
Los mecanismos electrofisiológicos involucrados son varios.
Las arritmias ventriculares están condicionadas por la necrosis e isquemia que promueven alteraciones electrofisiológicas que favorecen mecanismos de reentrada y de automatismo anormal.
Las arritmias auriculares están vinculadas a falla ventricular, estimulación simpática, infarto auricular, insuficiencia valvular, pericarditis, que también promueven reentrada y automatismo anormal.
Las bradiarritmias pueden producirse por: alteraciones del sistema nervioso autónomo, hipertonía vagal, o isquemia-injuria del sistema de conducción.
- Arritmias ventriculares
- Fibrilación ventricular
1. La fibrilación ventricular o taquicardia ventricular sin pulso deberían recibir choque eléctrico no sincronizado con energía inicial de 200 J (monofásico) o 150 J (bifásico); si no es exitoso, segundo choque de 200-300 J (monofásico) o 200 J (bifásico), y si es necesario un tercero de 360 J (monofásico) o 200 J (bifásico) (recomendación I, B).
2. En la fibrilación ventricular o taquicardia ventricular sin pulso refractarias a la desfibrilación, es razonable administrar amiodarona 300 mg o 5 mg/kg intravenosa en bolo, seguido de nuevo choque eléctrico no sincronizado (recomendación IIa, B).
3. En pacientes con fibrilación ventricular o taquicardia ventricular sin pulso refractarias a la desfibrilación se puede administrar lidocaína 1 mg/kg hasta un máximo de 100 mg por vía intravenosa en bolo, que puede repetirse 0,5 mg/kg hasta 50 mg por vía intravenosa a los cinco minutos si es necesario, seguido de nuevo choque eléctrico (recomendación IIb, B).
4. En pacientes postreversión de fibrilación ventricular o taquicardia ventricular sin pulso puede indicarse:
a. Infusión de amiodarona 1 mg/min por seis horas y luego 0,5 mg/min por 18 horas (recomendación IIb, B).
b. Infusión de lidocaína 1-4 mg/min por 24-48 horas (recomendación IIb, B).
5. En pacientes con extrasistolía ventricular compleja en las primeras 24-48 horas (frecuente, polimorfa, duplas, taquicardia ventricular no sostenida) es razonable:
a. Optimizar tratamiento betabloqueante (recomendación IIa, B).
b. Administrar lidocaína profiláctica 1 mg/kg hasta un máximo de 100 mg por vía intravenosa en bolo, seguida de goteo 1-4 mg/min (recomendación IIa, B).
6. Puede considerarse lidocaína profiláctica en las primeras 24 horas para prevenir una fibrilación ventricular o taquicardia ventricular:
a. en pacientes que no reciben tratamiento de reperfusión (recomendación IIb, B);
b. en pacientes con monitorización electrocardiográfica no confiable (recomendación IIb, C);
c. cuando no hay un desfibrilador disponible (recomendación IIb, C).
7. No debería realizarse administración profiláctica de fármacos antiarrítmicos en pacientes que reciben tratamiento de reperfusión (recomendación III, B).
La incidencia de fibrilación ventricular primaria en el IAM sigue siendo significativa; implica, además, una mayor morbimortalidad, y su aparición es impredecible. Requiere una rápida reversión con choque eléctrico. Su manejo está pautado en diversas guías (140-143). Actualmente se prefiere la cardioversión bifásica (144).
La lidocaína, cuando es administrada en forma apropiada, ha demostrado disminuir significativamente la incidencia de fibrilación ventricular primaria. Sin embargo, su uso profiláctico fue desaconsejado en las guías de IAM ACC/AHA de 1996 y cayó en desuso desde ese momento. La información considerada para incluir a la lidocaína como indicación clase III, fue fundamentalmente el metaanálisis de MacMahon y colaboradores, a pesar de que los propios autores concluyen que el número de eventos reportados es muy bajo, el seguimiento corto, no disponen de datos completos sobre las causas de muerte, y que no es posible definir si el uso de lidocaína es beneficioso o peligroso. Se consideró también un metaanálisis de Hine y colaboradores que examinaron seis estudios publicados entre 1970 y 1973 con el uso de diferentes protocolos de lidocaína profiláctica; ninguno de estos estudios individualmente mostró un efecto perjudicial del uso de lidocaína, pero el análisis en conjunto sí lo mostró; sin embargo, es de notar que la mortalidad al alta hospitalaria no fue diferente y que las causas de muerte no fueron analizadas. Finalmente, se consideraron otros dos estudios, de Teo y colaboradores y DeSilva y colaboradores, que no mostraron aumento de la mortalidad con el uso de lidocaína profiláctica, por el contrario, este último ensayo mostró un beneficio (145-149).
En suma, podemos afirmar que la evidencia actual en relación con el uso profiláctico de lidocaína muestra: 1) previene la fibrilación ventricular primaria; 2) cuando es administrada apropiadamente no aumenta la incidencia de bradiarritmias; 3) no existe evidencia concluyente de que aumente la mortalidad. Es en este sentido, entonces, que parece razonable admitir su uso en situaciones particulares.
- Taquicardia ventricular
1. La taquicardia ventricular polimórfica sostenida (mayor de 30 segundos o colapso hemodinámico) se tratará igual que la fibrilación ventricular o taquicardia ventricular sin pulso: choque eléctrico no sincronizado con energía inicial de 200 J (monofásico) o 150 J (bifásico); si no es exitoso, segundo choque de 200-300 J (monofásico) o 200 J (bifásico), y si es necesario un tercero de 360 J (monofásico) o 200 J (bifásico) (recomendación I, B).
2. La taquicardia ventricular monomorfa sostenida asociada con angor, edema pulmonar o hipotensión (presión arterial sistólica menor 90 mmHg) debería tratarse con choque eléctrico sincronizado inicial de 100 J (monofásico, bifásico). Si no es exitoso, aumentar la energía de los choques subsiguientes. Utilizar anestesia breve siempre que lo permita la situación hemodinámica (recomendación I, B).
3. La taquicardia ventricular monomorfa sostenida no asociada con angor, edema pulmonar o hipotensión (presión arterial sistólica menor de 90 mmHg) debería tratarse con:
a. Cardioversión sincronizada de inicio 50 J (monofásico, bifásico), previa anestesia (recomendación I, B).
b. Amiodarona 150 mg por vía intravenosa o 5 mg/kg por vía intravenosa en 10 min, que se puede repetir a los 10-15 min si es necesario (seguido de cardioversión eléctrica si no revierte) (recomendación I,B).
4. En la taquicardia ventricular monomorfa sostenida sin repercusión hemodinámica se puede administrar lidocaína 1 mg/kg, hasta un máximo de 100 mg por vía intravenosa en bolo, que se puede repetir 0,5 mg/kg hasta un máximo de 50 mg por vía intravenosa si es necesario (seguido de cardioversión eléctrica si no revierte) (recomendación IIb, B).
5. En la taquicardia ventricular polimorfa refractaria es razonable:
a. Corregir disionías y alteraciones ácido base (recomendación IIa, C).
b. Betabloqueantes por vía intravenosa si no existen contraindicaciones (recomendación IIa, B).
c. Amiodarona 1 mg/min por seis horas y luego 0,5 mg/min por 18 horas (recomendación IIa, B).
d. Considerar balón de contrapulsación o revascularización de urgencia o ambos (recomendación IIa, B).
e. Si existe bradicardia menor a 60 latidos por minuto o QT largo: suspender fármacos que prolongan el QT (amiodarona), y valorar colocación de marcapaso transitorio (recomendación IIa, C).
6. Postreversión de taquicardia ventricular sin pulso se puede indicar:
a. Infusión de amiodarona 1 mg/min por vía intravenosa por seis horas y 0,5 mg/min por vía intravenosa por 18 horas, por 24-48 horas (recomendación IIb, B).
b. Infusión de lidocaína 1-4 mg/min por vía intravenosa por 24-48 horas (recomendación IIb, B).
- Extrasistolía ventricular
1. No está indicado tratar las extrasístoles ventriculares no complejas (recomendación III, A).
- Ritmo idioventricular acelerado y ritmos de la unión acelerados
1. No está indicado tratarlos (recomendación III, C).
- Arritmias supraventriculares
1. En la fibrilación auricular/flutter auricular con repercusión hemodinámica:
a. Cardioversión eléctrica sincronizada 200 J monofásico, 100 J bifásico para fibrilación, 100 J monofásico y 50 J bifásico para flutter (recomendación I,C).
b. Pacientes que no revierten con cardioversión o recurrencia precoz: amiodarona intravenosa, 5 mg/kg en 30-60’, seguido de 1,2-1,8 g/día en infusión o vía oral hasta 10 g y luego mantenimiento 200-400 mg/día (recomendación I,C).
2. En la fibrilación auricular/flutter auricular sostenido con isquemia persistente, pero sin compromiso hemodinámico:
a. Betabloqueantes vía oral o intravenosa (salvo contraindicación) (recomendación I, C).
b. Diltiazem o verapamil vía oral o intravenosa (si están contraindicados los betabloqueantes) (recomendación I,C).
c. Cardioversión eléctrica sincronizada 200 J monofásico, 100 J bifásico para fibrilación, 100 J monofásico y 50 J bifásico para flutter (recomendación I, C).
3. En fibrilación auricular/flutter auricular sostenido o crónico sin compromiso hemodinámico o isquemia, está indicado el control de la frecuencia, preferentemente con betabloqueantes. Debe considerarse la anticoagulación y la reversión a ritmo sinusal (recomendación I, C).
4. En la fibrilación auricular/flutter auricular persistente o recurrente, considerar anticoagulación (recomendación I, A).
5. En la fibrilación auricular paroxística más factores de riesgo embólico, considerar anticoagulación (recomendación I, C).
6. La taquicardia paroxística supraventricular reentrante debería ser tratada con la siguiente secuencia:
a. masaje del seno carotídeo (recomendación I, C);
b. adenosina intravenosa 6 mg en bolo, si no hay respuesta en 1-2 minutos administrar 12 mg que pueden repetirse de ser necesario (recomendación I, C);
c. betabloqueantes intravenosos: metoprolol 2,5-5 mg, que puede repetirse hasta un total de 15 mg en 15 minutos; atenolol 2,5-5 mg que puede repetirse hasta un total de 10 mg en 15 minutos (recomendación I,C);
d. diltiazem intravenoso 20 mg en dos minutos, continuando con una infusión de 10 mg/hora (recomendación I, C).
7. Las extrasístoles supraventriculares no requieren tratamiento específico (recomendación III, C).
- Bradiarritmias
Las bradiarritmias en el curso de un IAM no son manejadas en forma profiláctica, sino que se tratan cuando se presentan.
En los trastornos de conducción auriculoventricular es fundamental determinar clínicamente el nivel de bloqueo. Si este es a nivel del nodo AV (vinculado en general a IAM inferior, por isquemia del nodo o hipervagotonía, casi siempre reversible, de buen pronóstico), la conducta es en general expectante; puede administrarse atropina en casos de hipotensión asociada a la bradicardia o incluso tener que estimular transitoriamente. Si el nivel de bloqueo es infranodal (vinculado en general a IAM anterior y asociado a bloqueo de rama, por compromiso distal del sistema His-Purkinje, de mal pronóstico), es altamente probable que sea necesario el implante de un marcapaso, transitorio o definitivo. No estaría indicado en este último caso el uso de atropina ya que puede agravar el trastorno de conducción en el sistema His-Purkinje al mejorar la conducción en el nodo AV.
- Indicaciones de marcapaso transitorio
Las indicaciones de marcapaso transitorio en pacientes con IAM son:
1. Bloqueo auriculoventricular completo, con escape de QRS ancho o mal tolerado (recomendación I, C).
2. Bloqueo de rama alternante (recomendación I, C).
3. Bloqueo de rama nuevo y bloqueo auriculoventricular de segundo grado tipo II (recomendación I, C).
4. Bloqueo de rama derecha más bloqueo fascicular y bloqueo auriculoventricular de segundo grado tipo II (recomendación I, C).
5. Bloqueo auriculoventricular de segundo grado tipo II con QRS normal, bloqueo de rama previo, o bloqueo fascicular nuevo o previo en IAM anterior (recomendación IIa, C).
6. Bloqueo de rama nuevo y bloqueo auriculoventricular de primer grado o de segundo grado tipo I (recomendación IIa, C).
7. Bloqueo de rama derecha más bloqueo fascicular y bloqueo auriculoventricular de primer o segundo grado tipo I (recomendación IIa, C).
8. Bloqueo fascicular más bloqueo aurículo-ventricular de segundo grado tipo II en IAM no anterior (recomendación IIb, C).
9. Bloqueo de rama previo más bloqueo auriculoventricular de primer grado o segundo grado tipo I (recomendación IIb, C).
10. Bloqueo de rama nuevo (recomendación IIb, C).
11. Bloqueo de rama derecho más bloqueo fascicular (recomendación IIb, C).
- Indicaciones de marcapaso definitivo
Las indicaciones de marcapaso definitivo en pacientes con IAM son las siguientes:
1. Bloqueo auriculoventricular de segundo o tercer grado persistente (en IAM inferior más de 14 días) (recomendación I, C).
2. Bloqueo auriculoventricular de segundo o tercer grado transitorio infra His. Si el nivel de bloqueo no es claro (ausencia de bloqueos de rama), considerar estudio electrofisiológico (recomendación I, B).
3. Bloqueo de rama alternante (recomendación I, C).
4. Disfunción sinusal sintomática y persistente, intrínseca o extrínseca (recomendación I, C).
5. Pacientes en ritmo sinusal deberían recibir un sistema secuencial AV (recomendación I, C).
6. Todos los pacientes con indicación de marcapaso post IAM deben ser evaluados para implante de cardiodesfibrilador implantable o resincronización, o ambos (recomendación I, C).
7. No tienen indicación de marcapaso definitivo los pacientes con:
a. Bloqueo auriculoventricular transitorio a nivel nodal (recomendación III, C).
b. Bloqueo auriculoventricular transitorio más hemibloqueo anterior izquierdo (HBAI) aislado (recomendación III, C).
c. HBAI nuevo sin bloqueo auriculoventricular (recomendación III, C).
d. Bloqueo auriculoventricular de primer grado con bloqueo de rama previo o indeterminado (recomendación III, C).
- Indicaciones de marcapaso transcutáneo profiláctico
1. En todas las indicaciones de implante de marcapaso transitorio: previo al mismo o cuando esto no es posible (recomendación I, C).
2. Para el traslado de pacientes con cualquier trastorno de conducción (recomendación I, C).
3. Bloqueo auriculoventricular de segundo grado tipo I, en pacientes con QRS normal, o cualquier tipo de bloqueo de rama (recomendación I, C).
6. ESTRATIFICACIÓN DE RIESGO
6A. ESTRATEGIA PARA LA ESTRATIFICACIÓN DE RIESGO
El uso de los métodos no invasivos e invasivos
Una vez superada la etapa aguda del IAM y antes del alta debe establecerse una estrategia para estratificar el riesgo de nuevos eventos mayores, como muerte o reinfarto.
El riesgo de un paciente posterior a un IAM está determinado por múltiples variables, pero podemos resumirlas en tres: función ventricular, isquemia y arritmias. Esto quiere decir, en otras palabras, que el paciente luego de un IAM puede morir por insuficiencia cardíaca, nuevos eventos isquémicos o arritmia ventricular maligna.
Los esfuerzos para estratificar el riesgo deben orientarse, por tanto, a evaluar estas tres condiciones.
Riesgo global
1. Todo paciente que cursó un IAM con elevación del segmento ST debería tener estratificado su riesgo antes del alta hospitalaria (recomendación I, C).
Uno de los predictores de mortalidad global de mayor peso es la FEVI (1,2).
Si el paciente no fue sometido precozmente a ventriculografía (por ejemplo en el curso de una angioplastia primaria), se debe hacer una estimación no invasiva de la función ventricular en la etapa hospitalaria. El método más sencillo es el ecocardiograma, pero puede utilizarse otro, por ejemplo la ventriculografía isotópica.
2. Todo paciente que ha cursado un IAM con elevación del segmento ST debería tener evaluada su función ventricular (recomendación I, C).
Una vez considerada la función ventricular y a los efectos de un ordenamiento, analizaremos el riesgo del paciente en sus dos componentes esenciales: el riesgo isquémico y el riesgo de muerte súbita.
6a1. Riesgo isquémico
La pauta para el análisis de este riesgo se esquematiza en la figura 1.
Primeramente será necesario evaluar si el paciente tiene indicadores clínicos de alto riesgo. Se consideran indicadores de alto riesgo clínico: la presencia de angina de reposo o ante esfuerzo leve en la fase de recuperación del infarto, insuficiencia cardíaca en el período intrahospitalario, inestabilidad hemodinámica y arritmias ventriculares malignas (taquicardia ventricular sostenida, fibrilación ventricular) luego de las 48 horas iniciales del infarto (150-152).
1. Todo paciente que ha cursado un IAM con elevación del segmento ST debería ser evaluado con coronariografía antes del alta si es portador de elementos clínicos de alto riesgo (angina postinfarto, insuficiencia cardíaca intrahospitalaria, inestabilidad hemodinámica, arritmias ventriculares malignas) (recomendación I, C).
Si el paciente tiene indicadores de alto riesgo clínico o su FEVI por debajo de 40%, se lo considera de riesgo elevado y, por lo tanto, se deriva directamente a coronariografía.
2. En los pacientes que tienen los siguientes criterios de riesgo luego de un IAM con elevación del segmento ST, está indicada una coronariografía en forma directa:
a. FEVI menor a 40% (recomendación IIa, C).
b. Angina postinfarto (recomendación I, A).
c. Insuficiencia cardíaca intrahospitalaria (recomendación I, B).
d. Inestabilidad hemodinámica persistente (recomendación I, B).
e. Arritmias ventriculares malignas (recomendación IIa, C).
Si el paciente no tiene ninguno de estos criterios debe considerarse la realización de un test funcional para la detección de isquemia (1,2,153,154).
En la elección del tipo de test funcional deberá considerarse si tiene un electrocardiograma interpretable de las alteraciones que la isquemia pueda producir y si es capaz de realizar un ejercicio.
En el caso de que tenga ambas condiciones el método de elección es la prueba ergométrica graduada. Este es el método más accesible y, por otra parte, nos otorga muy valiosa información pronóstica.
3. En aquellos pacientes con IAM con elevación del segmento ST no seleccionados para cateterismo y sin criterios de alto riesgo clínico, si tienen un electrocardiograma interpretable y pueden realizar un ejercicio, el test de elección para evaluar la presencia de isquemia inducible es la prueba ergométrica graduada (recomendación I, B)
Esta prueba ergométrica graduada puede hacerse a los tres a cinco días del IAM en pacientes estables, con bajo nivel del esfuerzo. El límite de la realización de este estudio es haber alcanzado 70% de la frecuencia máxima calculada para la edad o 5 mets de erogación metabólica, la aparición de síntomas o signos de isquemia, como angor o disnea, la aparición de una depresión significativa del segmento ST, de hipotensión intraesfuerzo o aparición de arritmias severas.
En el caso que se prefiera una prueba ergométrica graduada limitada por síntomas, debe aguardarse hasta el séptimo día del postinfarto.
Si el paciente tiene un electrocardiograma no interpretable y puede hacer ejercicio, debe adoptarse una técnica de detección de imagen para isquemia, asociada a ejercicio. La técnica puede ser ecocardiográfica o de medicina nuclear (estudio de perfusión).
4. En aquellos pacientes con IAM con elevación del segmento ST no seleccionados para cateterismo y sin criterios de alto riesgo clínico, si tienen un electrocardiograma no interpretable y pueden realizar un ejercicio, el test de elección para evaluar la presencia de isquemia inducible es una técnica por imágenes (ecocardiograma o medicina nuclear) asociada a ejercicio (recomendación I, B).
Si el paciente no es capaz de realizar un ejercicio debe hacerse un test de inducción de isquemia por método farmacológico. En caso de utilizar el ecocardiograma se administra dobutamina y en caso de utilizarse medicina nuclear se administra adenosina o dipiridamol.
5. En aquellos pacientes con IAM con elevación del segmento ST no seleccionados para cateterismo y sin criterios de alto riesgo clínico, si no pueden realizar un ejercicio, el test de elección para evaluar la presencia de isquemia inducible es una técnica por imágenes (ecocardiograma o medicina nuclear) asociada a estímulo farmacológico (recomendación I, B).
De acuerdo con el resultado de estos estudios se optará por una estrategia invasiva o no invasiva para el estudio del paciente. En los pacientes que tienen indicadores de riesgo alto o moderado se justifica el estudio invasivo, mientras que a los pacientes que no tienen ninguno de estos criterios se los considera de bajo riesgo y son derivados a tratamiento médico (1,2,154).
6. En los pacientes con IAM con elevación del segmento ST que hayan sido sometidos a test funcional y que tengan indicadores en estos tests de riesgo alto o moderado, se debería indicar una coronariografía, mientras que en los que muestran bajo riesgo se debería indicar, sin otra estratificación de riesgo isquémico, el tratamiento médico (recomendación I, B).
Los criterios de riesgo de estos estudios no invasivos se desarrollan en la tabla 1, modificada de las definiciones de ACC/AHA (155).
- Indicación de coronariografía
La coronariografía deberá plantearse cuando el paciente presente criterios de riesgo clínicos, cuando presente disfunción ventricular izquierda significativa o cuando los estudios funcionales muestren un riesgo alto o intermedio.
Si bien puede plantearse la indicación de coronariografía en forma sistemática luego de un infarto de miocardio, el Consenso considera más adecuado la estratificación de riesgo por método no invasivo en los pacientes que no tengan indicadores de riesgo. Esta estrategia ayuda a reducir costos y a evitar procedimientos invasivos que puedan resultar innecesarios.
1. Debería indicarse la realización de coronariografía en pacientes con isquemia miocárdica espontánea o inducida por el ejercicio leve durante la recuperación de IAM con elevación del segmento ST (recomendación I, A).
2. Debería indicarse la realización de coronariografía en pacientes con resultados de estudio funcional de riesgo intermedio o alto riesgo luego del IAM con sobreelevación del segmento ST (recomendación I, B).
3. Debería indicarse la realización de coronariografía antes de la cirugía de una complicación del IAM si el paciente se encuentra suficientemente estable: insuficiencia mitral aguda, CIV, seudoaneurisma, aneurisma de ventrículo izquierdo (recomendación I, B).
4. Debería indicarse la realización de coronariografía en pacientes con inestabilidad hemodinámica persistente (recomendación I, B).
5. Debería indicarse la realización de coronariografía en pacientes con un IAM con sobreelevación del segmento ST que presenten insuficiencia cardaca clínica durante el episodio agudo, pero posteriormente se demostró función ventricular izquierda conservada (recomendación I, C).
6. Es razonable plantear la realización de coronariografía cuando el IAM se sospecha de causa diferente a la trombosis de placa de ateroma. Esto incluye embolia coronaria, ciertas enfermedades metabólicas y hematológicas, espasmo coronario (recomendación IIa, C).
7. Es razonable plantear la realización de coronariografía en pacientes con alguna de las siguientes condiciones: diabetes mellitus, FEVI menor de 40%, insuficiencia cardiaca congestiva, arritmias ventriculares malignas, revascularización previa (recomendación IIa, C).
8. La coronariografía puede ser considerada como estrategia de rutina para evaluación de riesgo luego del IAM con sobreelevación del segmento ST (recomendación IIb, B).
Como se observa en el punto 7, se incluye como recomendación IIa de coronariografía a pacientes diabéticos; pacientes con revascularización previa. Esta indicación es recogida de otras guías reconocidas internacionalmente (1), y se fundamenta en que en estos pacientes la probabilidad de estar ante una enfermedad coronaria grave es alta.
La coronariografía aporta datos anatómicos que permiten una valoración pronóstica y un tratamiento adecuado. La angioplastia coronaria y la cirugía de revascularización miocárdica deben ser consideradas en los pacientes que presenten lesiones coronarias obstructivas significativas revascularizables. No es cometido de este Consenso analizar las condiciones en que están indicadas cada una de estas técnicas de revascularización.
Cuando el paciente ha sido sometido a una angiografía en la fase inicial del infarto y fue tratado con angioplastia de la lesión culpable (ya sea primaria o de rescate), puede presentar además otras lesiones coronarias que no fueron tratadas en esa instancia.
En relación con las otras lesiones no tratadas, el Consenso plantea que debe valorarse la importancia que cada una de estas lesiones tiene en cuanto a severidad y extensión del músculo cardíaco que ponen en riesgo.
En el caso que se observe una lesión severa proximal con un compromiso isquémico extenso, se considera razonable coordinar al paciente en diferido ya sea con angioplastia o cirugía, para completar la revascularización, sin mediar otra estratificación.
Si se estima que la lesión no es significativa o que la extensión de la isquemia no es de jerarquía, se recomienda evaluar el riesgo isquémico con un test funcional para detectar isquemia (de preferencia por imágenes de medicina nuclear o ecocardiograma), en caso de duda sobre la severidad de la lesión o la extensión de la isquemia que esta determina, o ambas.
6a2. Riesgo de muerte súbita
- Arritmias ventriculares luego de las 48 horas.
Indicaciones de estudio electrofisiológico y cardiodesfibrilador implantable
La otra vertiente en la evaluación del riesgo del paciente es la vinculada a la muerte súbita por arritmias ventriculares.
Aunque la FEVI es predictora de mortalidad global y no solo de muerte por arritmia ventricular, es el parámetro más sencillo y de más peso disponible para tratar de identificar aquellos pacientes con mayor riesgo de muerte súbita.
Estudios recientes apoyan el uso profiláctico de desfibrilador implantable en pacientes al menos 40 días post IAM, con FEVI menor de 30%, que no hayan tenido una angioplastia o cirugía de revascularización en los tres meses anteriores, ni sean candidatos actuales para revascularización, estén en clase funcional IV o tengan una expectativa de vida comprometida por enfermedad extracardíaca.
Es admitido utilizar, siempre en asociación a la FEVI, otros parámetros clínicos o paraclínicos no invasivos de estratificación de riesgo: edad, ancho del QRS, clase funcional III, FEVI menor de 25%, taquicardia ventricular no sostenida, alternancia de onda T, electrocardiograma (ECG) de señal promediada, variabilidad de la frecuencia cardíaca, sensibilidad de barorreceptores.
En pacientes con FEVI entre 30% y 40% en los cuales se asocia además alguno de los criterios clínicos o paraclínicos mencionados previamente, por ejemplo taquicardia ventricular no sostenida, es válido realizar un estudio electrofisiológico para estratificar el riesgo.
Aquellos pacientes con FEVI mayor de 40% no requieren tratamiento antiarrítmico específico alguno.
En los pacientes postinfarto de alto riesgo, el cardiodesfibrilador ha demostrado ser el recurso terapéutico más eficaz para la prevención de muerte súbita. Esto ha sido demostrado tanto en prevención secundaria (ensayos AVID, CIDS, CASH) como en prevención primaria (ensayos MADIT I, MADIT II y MUSTT).
El tratamiento antiarrítmico empírico o guiado por estudio electrofisiológico no ha demostrado eficacia en pacientes de alto riesgo (156-183).
La figura 2 esquematiza el manejo preventivo de la muerte súbita en los pacientes postIAM.
Si el paciente tiene fibrilación ventricular o taquicardia ventricular sostenida más allá de las 48 horas del IAM que no sean debidas a causa isquémica, se debe colocar un cardiodesfibrilador implantable sin necesidad de más estudios para la arritmia.
Más allá de la situación anterior, la evaluación del riesgo de muerte súbita postIAM tiene como eje la determinación de la función ventricular, que debe hacerse luego del mes del infarto.
Cuando el paciente tiene 30% de FEVI o menos, hay evidencia de que la colocación de un cardiodesfibrilador implantable disminuye la posibilidad de muerte. En este caso no se justifica otra cosa que su implantación, sin necesidad de otros estudios de la arritmia.
A pesar de la fuerte evidencia a favor de colocar un cardiodesfibrilador en estas circunstancias, se recomienda, dado el costo de esta terapia, tratar de seleccionar en esta población el subgrupo con mayor riesgo de muerte súbita, considerando, por ejemplo, edad, la presencia de fibrilación auricular, FEVI menor de 25%, pacientes en clase III, con creatinina >1,4 mg %, QRS > 130 seg, bloqueo de rama izquierda, taquicardia ventricular no sostenida, etcétera.
El estudio electrofisiológico se justifica cuando el paciente tiene una FEVI entre 31% y 40% y tiene inestabilidad eléctrica (por ejemplo, una taquicardia ventricular no sostenida). Si en el estudio electrofisiológico se induce una fibrilación o una taquicardia ventricular se indica un cardiodesfibrilador implantable. Si no hay inestabilidad eléctrica con FEVI entre 31% y 40% o si hay inestabilidad eléctrica sin arritmia inducible en el estudio electrofisiológico, no se justifica su indicación (recomendación IIb, B).
Cuando el paciente tiene una FEVI mayor de 40% no se justifica el estudio electrofisiológico ni el implante de cardiodesfibrilador.
1. Debería indicarse el implante de cardiodesfibrilador en todo paciente con fibrilación ventricular o taquicardia ventricular sostenida luego de las 48 horas de IAM no debidas a nuevos eventos isquémicos (recomendación I, A).
2. Debería indicarse el implante de cardiodesfibrilador como prevención primaria de muerte súbita en pacientes con FEVI 30%-40% al mes de IAM, que presentan inestabilidad eléctrica (por ejemplo taquicardia ventricular no sostenida) y tienen fibrilación ventricular o taquicardia ventricular inducible en estudio electrofisiológico (recomendación I, B).
3. Es razonable el implante de cardiodesfibrilador como prevención primaria de muerte súbita en pacientes con FEVI menor de 30% al mes de IAM o tres meses postcirugía de revascularización miocárdica, aunque no tengan arritmia ventricular grave (recomendación IIa, B).
4. Es razonable seleccionar a las poblaciones de mayor riesgo de muerte súbita para el implante de cardiodesfibrilador como prevención primaria de muerte súbita en pacientes con FEVI < 30% al mes de IAM o tres meses postcirugía de revascularización miocárdica (recomendación IIa, C).
5. Puede indicarse el implante de cardiodesfibrilador implantable como prevención primaria de muerte súbita en pacientes con FEVI 30%-40% al mes de IAM e inestabilidad eléctrica (por ejemplo taquicardia ventricular no sostenida), no inducible en estudio electrofisiológico (recomendación IIb, B).
6. En todos los pacientes con indicación de cardiodesfibrilador post IAM debe ser evaluado el modo de estimulación: VVI de respaldo, auriculoventricular, biventricular (recomendación I,C).
7. El implante de cardiodesfibrilador implantable no está indicado en pacientes sin fibrilación ventricular o taquicardia ventricular sostenida luego de las 48 horas y que la FEVI al mes de IAM es mayor de 40% (recomendación III, C).
En relación con los estudios no invasivos de las arritmias ventriculares (promediación de señales, monitoreo de 24 horas, etcétera), su valor predictivo positivo extremadamente bajo hace que no tengan indicación habitual sistemática, aunque pueden ser de utilidad cuando se seleccionan poblaciones de mayor riesgo.
7. RECOMENDACIONES AL ALTA.
PREVENCIÓN SECUNDARIA
Una vez que el paciente ha superado la etapa aguda y se considera que está fuera de riesgo significativo, puede ser dado de alta.
El Consenso considera razonable que un IAM con elevación del segmento ST que evoluciona sin complicaciones esté internado una media de cinco a siete días. En este período el paciente debe haber tenido su evaluación de riesgo.
El riesgo de isquemia recurrente luego de un infarto de miocardio es muy alto, lo que justifica la aplicación de medidas de prevención secundaria.
Se entiende por prevención secundaria un conjunto de medidas encaminadas a disminuir la posibilidad de nuevos eventos cardíacos y mejorar la calidad de vida. Las medidas básicas de prevención secundaria están resumidas en la tabla 2.
7A. DIETA
1. Los pacientes que han sufrido un IAM con elevación del segmento ST deberían realizar un control de su peso (índice de masa corporal 18,5-24,9 kg/m2; cintura menor de 102 cm en hombres, menor de 88 cm en mujeres) (recomendación I, B).
En el manejo del sobrepeso la meta es conseguir un índice de masa corporal (IMC) entre 18,5 y 24,9 kg/m2 (1,184). En todo paciente se debe calcular el IMC y medir la cintura.
Se debe indicar una dieta con ingesta de grasas inferior a 30% del aporte calórico total, de las que las saturadas deben ser menos de 5%, las poliinsaturadas 10% y las monoinsaturadas el 15% restante. Esto se debe a que los ácidos grasos saturados elevan el LDL/colesterol, los ácidos grasos poliinsaturados disminuyen el LDL/colesterol, y los monoinsaturados disminuyen el LDL y aumentan el HDL. La ingesta de colesterol debe ser menor a 300 mg diarios.
Los hidratos de carbono pueden aumentar los triglicéridos y el VLDL y disminuir el HDL, por ello se recomienda limitar el consumo de alimentos con hidratos de carbono de absorción rápida, sin disminuir los hidratos de carbono complejos. Su consumo debe representar 55%-60% del aporte calórico de la dieta.
La fibra alimentaria tiene importante aplicación en pacientes diabéticos y cada vez se conoce mejor su papel beneficioso en la reducción del LDL de 4% a 10%. Se deben aconsejar las comidas ricas en fibras y de absorción más lenta para evitar los picos hiperglicémicos postprandiales.
Las proteínas deben ofrecer entre 10% y 15% del valor calórico diario y debe preferirse las proteínas de origen vegetal del tipo de la proteína de soja. El consumo de 25-50 g/día de proteína de soja reduce el LDL entre 4% y 8%.
Las recomendaciones de tratar el sobrepeso y la obesidad no solamente surgen de la evidencia que relaciona a esta condición con aumento de morbimortalidad de causa cardiovascular, sino que hay estudios randomizados que evidencian que el descenso del peso reduce factores de riesgo mayores y emergentes de enfermedad cardiovascular con descenso de cifras de presión arterial, mejora el perfil lipídico y corrige la hiperglicemia.
No es solo el porcentaje de grasa corporal, sino también su distribución lo que determina el riesgo asociado a la obesidad. La obesidad centroabdominal se asocia a resistencia a la insulina, hipertrigliceridemia e hipertensión arterial. De gran importancia se considera la medida de la cintura, considerándose de riesgo cuando es mayor o igual de 102 cm en el hombre y mayor o igual de 88 cm en la mujer. Los objetivos son prevenir la ganancia de peso, reducir en 10% el peso corporal y mantener el descenso alcanzado a largo plazo.
Como recomendaciones generales en la dieta se propone:
- Dieta variada con proporciones en la ingesta calórica adecuada para el mantenimiento del peso ideal.
- Se fomente el consumo de frutas y verduras, cereales integrales y pan, productos lácteos bajos en grasas, pescado y carne magra.
- Aceite de pescado y ácidos grasos omega 3 que poseen propiedades protectoras específicas.
- La ingesta total de grasa no debe sobrepasar 30% de la ingesta calórica total y la de ácidos grasos saturados no debe exceder un tercio de la ingesta de grasa total.
- La grasa saturada debe reemplazarse por hidratos de carbono complejos y ácidos grasos monoinsaturados y poliinsaturados procedentes de alimentos de origen vegetal y del pescado.
- La ingesta de colesterol debe ser menor de 300 mg/día.
- La limitación de la ingesta de sal es un elemento primordial en el control de la presión arterial.
- El consumo de bebidas alcohólicas se debe abordar en forma individual en cada paciente. En ningún caso el médico promoverá el consumo de bebidas alcohólicas como un instrumento para la prevención cardiovascular.
En suma, se recomienda el consumo de frutas, vegetales, granos, lácteos descremados, pescado, pollo, carnes magras, aceites vegetales y abundante agua.
La dieta mediterránea que se basa en las recomendaciones ya enunciadas demostró, a través del Lyon Diet Study (185), una reducción de la tasa de recurrencias en pacientes que sufrieron un primer infarto de miocardio durante los cuatro años siguientes.
7B. EJERCICIO FíSICO
1. Basados en su nivel de riesgo y en lo posible con una prueba ergométrica graduada para guiar la prescripción, los pacientes que han sufrido un IAM con elevación del segmento ST deberían realizar ejercicio físico por lo menos tres a cuatro veces semanales durante 30 minutos, suplementado con un aumento en la actividad física diaria (caminatas al trabajo, durante el trabajo, jardinería, mantenimiento y limpieza del hogar, etcétera) (recomendación I, B).
Estudios prospectivos de cohortes han demostrado que el riesgo relativo de enfermedad coronaria es dos veces mayor en personas sedentarias que en aquellas que no lo son. Hay, además, evidencia del beneficio de los programas de ejercicio luego de eventos coronarios agudos (186,187).
Los beneficios de la actividad física son: 1) a nivel del músculo esquelético mejora el contenido de mioglobina, aumenta los depósitos de glucógeno y su capacidad de oxidación, aumenta la oxidación de ácidos grasos, incrementa la masa magra muscular y disminuye la masa grasa; 2) a nivel miocárdico aumenta el tono parasimpático, disminuye el tono simpático, con lo que aumenta el umbral de fibrilación ventricular, tiene efecto antitrombótico, mejora la función endotelial aumentando la liberación de óxido nítrico, disminuye el consumo de oxígeno miocárdico; 3) a nivel metabólico mejora el perfil lipídico, disminuyendo el LDL y los triglicéridos y aumentando el HDL, y mejora la tolerancia a la glucosa; 4) disminuye la presión arterial; 5) aumenta la capacidad aeróbica máxima. Por todo esto se recomienda, como mínimo, treinta minutos de actividad tres a cuatro días por semana, siendo óptimo en forma diaria. El ejercicio físico puede ser caminar, hacer bicicleta u otros aeróbicos. También se debe incrementar la actividad de la vida diaria.
Se deberá concordar con el paciente qué tipo de actividades le serán posibles efectuar en su vida diaria a los efectos de lograr un plan realizable de incremento diario de la actividad física que pueda mantener en forma indefinida.
En pacientes de alto riesgo y en aquellos con múltiples factores de riesgo coronario se deben realizar programas de actividad graduada y vigilada. Estos programas habitualmente incluyen acciones preventivas más allá del entrenamiento físico, que son muy recomendables.
2. La rehabilitación cardíaca, así como programas de prevención secundaria cuando se encuentran disponibles, están recomendados para pacientes postIAM con elevación del segmento ST, especialmente aquellos de alto riesgo o con múltiples factores de riesgo mayores a controlar, o ambos (recomendación I, C).
7C. SUPRESIóN DEL TABAQUISMO
1. Los pacientes que han sufrido un IAM con elevación del segmento ST deben suprimir el tabaquismo y ser educados en estrategias para evitar la recaída. El consejo de dejar de fumar se debe brindar siempre al paciente y familiares y se puede asociar a tratamiento farmacológico y programas específicos de abandono del tabaquismo si son necesarios. Si bien el consejo debe ser firme, debe haber una actitud de empatía con el paciente, de comprensión de las dificultades que se le presentan en el proceso de cesación o frente a una recaída (recomendación I, B).
El tabaquismo está reconocido como un factor mayor independiente de riesgo cardiovascular y aumenta el riesgo de IAM, muerte súbita, stroke isquémico y hemorrágico, aneurisma aórtico y arteriopatía obstructiva de miembros inferiores. Según la Organización Mundial de la Salud (OMS), 25% de las muertes por cardiopatía isquémica coronaria son atribuibles al consumo de tabaco. En nuestro país sería la causa de 724 muertes.
A pesar de que el riesgo aumenta de acuerdo a la intensidad del tabaquismo, no hay nivel seguro de consumo y fumar uno a cuatro cigarrillos duplica el riesgo de IAM en la mujer.
El mantenimiento del tabaquismo luego de un IAM aumenta sustancialmente el riesgo de reoclusión de las arterias coronarias luego de un infarto y de los by pass y los stents luego de cirugía o angioplastia, comprobándose a los ocho años el doble de mortalidad con respecto a los que dejaron de fumar (188-193).
Múltiples estudios demuestran una disminución de la mortalidad por enfermedad coronaria atribuible a la reducción en los factores mayores de riesgo, particularmente el tabaquismo. Se considera que 25% de la disminución de la cardiopatía isquémica en Estados Unidos en los últimos 20 años se debe a la disminución del consumo de tabaco.
El abandono del consumo de tabaco luego de un IAM tiene mayor efecto en la reducción del riesgo de eventos que cualquier otra intervención (188).
La cesación del tabaquismo reduce rápidamente el riesgo de eventos cardiovasculares, con una disminución de 50% de riesgo de IAM y muerte súbita al año de dejar de fumar y riesgo similar al de los no fumadores a los cinco años.
El objetivo terapéutico es siempre la cesación completa. El médico debe tener la capacidad de transmitir claramente al paciente que sufrió un infarto, la necesidad absoluta de dejar de fumar, ya que no existe ningún nivel seguro de consumo.
Hay que tener presente que son muy frecuentes las recaídas, sobre todo en las primeras semanas de cesación del tabaquismo.
Las Guías para el tratamiento del consumo y dependencia del tabaco (CDC) (190,191) establecen: 1) El tabaquismo es una enfermedad crónica, por lo que frecuentemente requiere intervenciones reiteradas. 2) Los tratamientos actuales pueden lograr la abstinencia prolongada o permanente y son costo-efectivos. 3) A todo fumador se le debe ofrecer: a) en cada consulta, información sobre el daño ocasionado por el tabaco; b) uno de los tratamientos comprobadamente efectivos: i) consejo y terapias comportamentales siempre. La efectividad del consejo médico tiene relación con su intensidad; ii) fármacos: se deberían emplear siempre salvo que haya contraindicaciones.
Los tratamientos comportamentales y las terapias farmacológicas duplican o triplican los índices de cesación a largo plazo y se deben brindar combinados a todos los pacientes que presentan cardiopatía isquémica.
Los tratamientos comportamentales tienen como objetivo tratar la dependencia psicológica y consisten en brindar directivas para el manejo de automatismos y condicionamientos que dificultan el abandono del tabaquismo, apelando a la creatividad del fumador y del médico. En el paciente con cardiopatía isquémica se deben instrumentar intervenciones más intensivas y sostenidas. Es útil la entrega simultánea de material de autoayuda. El apoyo familiar, laboral, etcétera, permitirá controlar el componente social de la adicción (tabla 3).
El tratamiento farmacológico incluye tratamientos de sustitución nicotínica y no nicotínicos. Está destinado fundamentalmente a tratar la adicción física a la nicotina.
Los tratamientos de sustitución nicotínica han demostrado ser eficaces y seguros en la cardiopatía isquémica estable, no estando establecida su seguridad en los síndromes coronarios agudos. Por este motivo se recomienda su utilización luego de lograr la estabilidad clínica del paciente. Las opciones son chicles o parches de nicotina.
El tratamiento no nicotínico consiste básicamente en la administración de bupropion.
Los tratamientos de sustitución nicotínica y el bupropion han demostrado ser tratamientos efectivos, con mayor eficacia cuando se asocian a estrategias comportamentales.
La seguridad de la farmacoterapia en los síndromes coronarios agudos no está aún establecida. En este grupo, las intervenciones comportamentales han demostrado ser muy efectivas y se deberían brindar a todos los fumadores desde la etapa de hospitalización.
Para mayor profundización sobre el tema se recomienda acceder al documento elaborado por el grupo correspondiente del Consenso (doctores Goja, Pignataro y Estévez).
7D. CONTROL DE LA PRESIÓN ARTERIAL
1. Los pacientes que han sufrido un IAM con elevación del segmento ST deberían tener su presión arterial por debajo de 140/90 mmHg (130/80 mmHg si son diabéticos o portadores de enfermedad renal crónica) (recomendación I, B).
El JNC 7 (Seventh Report of the Joint Nacional Comité of Prevention, Detection, Evaluation and Treatment of High Blood Pressure) hace esta recomendación para todos los pacientes postIAM (194).
La mayoría de los pacientes deberán recibir por lo menos dos fármacos para manejar estas cifras. Los medicamentos de primera línea para esta pauta son los betabloqueantes y los IECA, dada su acción complementaria en materia de prevención secundaria.
2. Los pacientes que han sufrido un IAM con elevación del segmento ST que presentan cifras de presión arterial de 120/80 mmHg o mayor deberían realizar cambios en su estilo de vida tendientes a controlar estas cifras tensionales (recomendación I, B).
El JNC-7 también enfatiza la importancia de los cambios de estilo de vida en todos aquellos pacientes con presión de 120/80 mmHg o mayor. Debe estimularse en estos pacientes el control de peso, la reducción de la ingesta de sodio y la realización de ejercicio físico.
3. En los pacientes que han sufrido un IAM con elevación del segmento ST los anticálcicos dihidropiridinicos de acción corta (nifedipina) no deberían ser usados para el tratamiento de la hipertensión arterial (recomendación III, B).
Es conocido el efecto deletéreo de estos medicamentos en el tratamiento de la hipertensión arterial en pacientes con síndromes coronarios agudos, por lo que no deben indicarse (195).
7E. CONTROL DE LA DIABETES
1. Los pacientes diabéticos que han sufrido un IAM con elevación del segmento ST deberían tener su HbA1C por debajo de 7% (recomendación I, B).
Se ha demostrado que existe una reducción de mortalidad aguda y al año en diabéticos que tienen un estricto control de sus niveles de glicemia (196,197).
7F. MANEJO DE LOS LÍPIDOS
1. En los pacientes que han sufrido un IAM con elevación del segmento ST debería realizarse un perfil lipídico preferentemente en ayunas y en las primeras 24 horas del IAM (un examen reciente previo es otra alternativa) (recomendación I, C).
2. Los pacientes que han sufrido un IAM con elevación del segmento ST deberían tener niveles de LDL colesterol menor de 100 mg/dl (recomendación I, A).
3. Es razonable que los pacientes que han sufrido un IAM con elevación del segmento ST tengan niveles de LDL colesterol menor de 70 mg/dl (recomendación IIa, B).
4. En los pacientes que han sufrido un IAM con elevación del segmento ST deberían indicarse estatinas, independientemente de los niveles de LDL colesterol (recomendación I, A).
5. En los pacientes que han sufrido un IAM con elevación del segmento ST el nivel de triglicéridos debería ser menor de 50 mg/dl y el de HDL colesterol mayor o igual a 40 mg/dl (recomendación I, B).
6. En los pacientes que han sufrido un IAM con elevación del segmento ST los fármacos de elección para el descenso del LDL colesterol deberían ser las estatinas (recomendación I, A).
7. En los pacientes que han sufrido un IAM con elevación del segmento ST con triglicéridos mayor o igual de 150 mg/dl o HDL colesterol menor de 40 mg/dl, o ambos, debería enfatizarse en la pérdida de peso y la realización de ejercicio (recomendación I, B).
8. En los pacientes que han sufrido un IAM con elevación del segmento ST con triglicéridos entre 200 y 499 mg/dl es razonable indicar fibratos luego de descender el LDL colesterol (recomendación IIa, B).
9. En los pacientes con triglicéridos mayor o igual de 500 mg/dl es razonable indicar fibratos antes de descender el LDL colesterol (recomendación IIa, B).
Es actualmente conocido que en la prevención secundaria el manejo de los lípidos es fundamental. Las pautas tanto nacionales –Primer Consenso Uruguayo de Aterosclerosis; SUC-Sociedad Uruguaya de Aterosclerosis– como internacionales enfatizan el valor de los niveles de LDL como el eje de esta prevención (1,2,198). Hay acuerdo general en que los niveles de LDL deben estar por debajo de 100 mg/dl, aunque hay evidencia reciente que en pacientes de muy alto riesgo, entre los que se incluyen los que han sufrido un síndrome coronario agudo, sería más beneficioso tener niveles por debajo de 70 mg/dl (199).
Múltiples ensayos han demostrado que las estatinas, tanto en prevención primaria como secundaria, disminuyen la morbilidad y mortalidad cardiovascular así como también reducen la mortalidad total (198-211).
Actualmente se sabe que esto se debe no solo a la significativa reducción sobre el LDL, sino a efectos probablemente independientes de la reducción del colesterol, como son corrección de la función endotelial, reducción de factores trombogénicos, reducción de parámetros inflamatorios y protección de la oxidación lipídica.
En este aspecto los nuevos estudios de intervención con estatinas apoyan esta afirmación. En estos estudios se ha verificado que los efectos beneficiosos de las estatinas se verifican aun en poblaciones en que puede catalogarse el valor de LDL como bajo (206,207,211).
Por todo lo expresado se deben indicar estatinas en el período postIAM.
Se recomienda iniciar las mismas en el período hospitalario, dado que de esta manera además se logra una mayor adherencia al tratamiento a largo plazo (209-212).
En relación con los otros parámetros del perfil lipídico, en presencia de HDL bajo o triglicéridos altos, o ambos, la primera medida debe ser recomendar la dieta y el ejercicio físico. Cuando nos encontramos con niveles elevados de triglicéridos debe considerarse la administración de fibratos asociados a estatinas. El orden de inicio en la administración de estos medicamentos depende de las cifras de triglicéridos. Cuando son extremadamente elevadas se recomienda iniciar con fibratos (1).
7G. BETABLOQUEANTES
1. Los betabloqueantes orales deberían administrarse en todos los pacientes que han sufrido un IAM con elevación del segmento ST, que no tengan contraindicaciones, en forma indefinida luego del alta hospitalaria (recomendación I, A).
2. En los pacientes que han sufrido un IAM con elevación del segmento ST que cursen con insuficiencia cardíaca moderada a severa deberán recibir los betabloqueantes con un esquema de titulación gradual y controlado (recomendación I, B).
Hay fuerte evidencia de que los betabloqueantes en prevención secundaria luego de un IAM son beneficiosos. Hay duda respecto a cuánto tiempo mantenerlos. Los datos de grandes ensayos sostienen su uso por dos o tres años, aunque parece razonable mantenerlos a largo plazo si no hay efectos secundarios o contraindicaciones (1,2,38-45).
Los pacientes que presenten disfunción ventricular izquierda postinfarto se benefician de la administración de betabloqueantes (41,45). Su administración en este caso se deberá realizar en forma controlada y progresiva.
7H. ANTIAGREGANTES PLAQUETARIOS
1. Se debería administrar una dosis diaria de AAS (75 a 160 mg) en forma indefinida luego del infarto agudo de miocardio (recomendación I, A).
La evidencia a favor de AAS en prevención secundaria es indiscutible y este fármaco debe mantenerse a largo plazo luego de un IAM (93-95).
Al igual que los betabloqueantes se ha propuesto administrarlo en forma crónica si no hay contraindicaciones.
2. En casos de alergia o intolerancia al AAS, puede utilizarse como sustituto clopidogrel (75 mg vía oral diarios) (recomendación I, C).
El clopidogrel es una buena alternativa cuando el paciente no tolera la aspirina.
7I. INHIBIDORES DE LA ENZIMA CONVERSORA
DE ANGIOTENSINA
1. Los IECA deberían administrarse antes del alta en todos los pacientes con IAM con elevación del segmento ST que no tengan contraindicaciones y mantenerlos en forma indefinida (recomendación I, A).
También estos fármacos en prevención secundaria han demostrado su beneficio, por lo que debería continuarse con su administración vez indicados en la fase aguda del IAM y luego del alta en forma indefinida (46,48-50,52-59).
En relación con otros fármacos bloqueadores del sistema renina-angiotensina-aldosterona tales como los bloqueadores de los receptores de angiotensina II o antialdosterónicos como la espirolactona, nos remitimos a las indicaciones realizadas para la fase hospitalaria y que pueden mantenerse en el período posterior al alta.
7J. TERAPIA DE REEMPLAZO HORMONAL
1. La terapéutica de sustitución hormonal con estrógenos más progestágenos no debería ser indicada de inicio a las mujeres postmenopáusicas luego de un IAM con elevación del segmento ST para la prevención de eventos coronarios (recomendación III, A).
2. Las mujeres postmenopáusicas que están bajo terapéutica de estrógenos y progestágenos deberían suspenderla al momento de presentar un IAM con elevación del segmento ST. En aquellas pacientes que, pasada la etapa aguda, deseen mantener una terapéutica crónica previa con estos fármacos, deberán hacerlo con conocimiento de un incremento del riesgo de eventos cardiovasculares, entre otros (recomendación III, B).
Estas recomendaciones están basadas en los estudios HERS, HERS-2 y Women Health Initiative (213-215). La evidencia de estos estudios muestra que la terapéutica de sustitución hormonal no tiene beneficios en materia de prevención primaria o secundaria cardiovascular y que además puede incrementar el riesgo de progresión de enfermedad coronaria, cáncer de mama, stroke y embolia pulmonar.
7K. ANTIOXIDANTES
1. Las vitaminas antioxidantes, tales como vitamina E o C, no deben indicarse a los pacientes postIAM con elevación del segmento ST para prevenir eventos coronarios (recomendación I II, A).
Estas recomendaciones están basadas en los resultados de estudios recientes que no han demostrado beneficio de estos agentes (216,217).
7L. ANALGÉSICOS
1. Los inhibidores COX2 no deberían ser indicados en los pacientes que han sufrido un IAM (recomendación III, B).
Es conocido en el momento actual el efecto deletéreo que producen los inhibidores COX2 en pacientes de riesgo cardiovascular, pues incrementan las posibilidades de infarto y accidente vascular encefálico isquémico (218). Es por este motivo que el Consenso aconseja no administrarlos en pacientes que sufrieron un IAM.
7M. SEGUIMIENTO MÉDICO DEL PACIENTE.
Luego del alta hospitalaria el médico deberá ser un permanente controlador de la situación clínica del paciente, así como consejero para la prevención secundaria. Entre las funciones que debería cumplir el médico con un paciente que ha sufrido un IAM con elevación del segmento ST, se destacan:
1. Evaluar en la evolución la presencia de sintomatología cardiovascular y la clase funcional (recomendación I, C).
2. Controlar la lista de medicamentos utilizados, su dosis y posología (recomendación I, C).
3. Chequear la función ventricular y la presencia de arritmias graves (valorar utilidad de un Holter) en aquellos con FEVI de 31% a 40% (recomendación I, C).
4. Enfatizar las ventajas de una buena prevención secundaria para el paciente con su familia (recomendación I, C).
5. Evaluar el estado psicosocial del paciente, buscando indicadores de ansiedad o depresión o trastornos del sueño y el apoyo social y familiar (recomendación I, C).
6. Discutir en detalle temas como el reinicio del trabajo, actividad sexual, viajes, conducir automóviles, y niveles de actividad física (recomendación I, C).
7. Discutir con el paciente y su familia (recomendación I, C):
- Nivel de riesgo de nuevos eventos cardiovasculares.
- Necesidad de conocimiento de normas de resucitación básica.
- Síntomas a reconocer tempranamente para solicitar asistencia precoz.
- Posibilidades de integración a grupos de rehabilitación cardiovascular.
Entre las consultas más frecuentes está la del reinicio de la actividad laboral y la actividad sexual. La primera depende en mucho del tipo de actividad, de sus exigencias físicas y la sobrecarga psíquica. En general es razonable considerar el reinicio del trabajo luego de las dos semanas del alta, aunque debe considerarse cada caso en particular.
En referencia con la actividad sexual, esta puede ser iniciada en el paciente estable luego de la semana del alta, en tanto no tenga indicadores de alto riesgo clínico o funcional. Por otra parte, el paciente estable puede ser aconsejado a conducir automóviles luego de la semana y realizar viajes en avión o terrestres prolongados luego de las dos semanas del alta (1,2).
8. BIBLIOGRAFíA
1. Antman EM, Anbe DT, Armstrong PW, Bates ER, Green LA, Hand M, et al. ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction: A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Revise the 1999 Guidelines for the Management of patients with acute myocardial infarction). J Am Coll Cardiol 2004; 44: E1-E211.
2. Van-de-Werf F, Ardissino D, Betriu A, Cokkinos DV, Falk E, Fox KA, et al. Management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force on the Management of Acute Myocardial Infarction of the European Society of Cardiology. Eur Heart J. 2003; 24: 28-66.
3. Indications for fibrinolytic therapy in suspected acute myocardial infarction: collaborative overview of early mortality and major morbidity results from allrandomised trials of more than 1000 patients. Fibrinolytic Therapy Trialists'(FTT) Collaborative Group. Lancet 1994; 343: 311-22.
4. Weaver WD, Cerqueira M, Hallstrom AP, Litwin PE, Martin JS, Kudenchuk PJ, et al. Prehospital-initiated vs hospital-initiated thrombolytic therapy: The Myocardial Infarction Triage and Intervention Trial. JAMA 1993; 270: 1211-6.
5. McNeill AJ, Cunningham SR, Flannery DJ, Dalzell GW, Wilson CM, Campbell NP, et al. A double blind placebo controlled study of early and late administration ofrecombinant tissue plasminogen activator in acute myocardial infarction. Br Heart J 1989; 61: 316-21.
6. Castaigne AD, Herve C, Duval-Moulin AM, Gaillard M, Dubois-Rande JL, Boesch C, et al. Prehospital use of APSAC: results of a placebo-controlled study. Am J Cardiol. 1989; 64: 30A-33A.
7. Barbash GI, Roth A, Hod H, Miller HI, Modan M, Rath S, et al. Improved survival but not left ventricular function with early and prehospitaltreatment with tissue plasminogen activator in acute myocardial infarction. Am J Cardiol 1990; 66: 261-6.
8. Schofer J, Buttner J, Geng G, Gutschmidt K, Herden HN, Mathey DG, et al. Prehospital thrombolysis in acute myocardial infarction. Am J Cardiol 1990; 66: 1429-33.
9. Feasibility, safety, and efficacy of domiciliary thrombolysis by general practitioners: Grampian region early anistreplase trial. GREAT Group. BMJ. 1992; 305:548-53.
10. The European Myocardial Infarction Project Group. Prehospital thrombolytic therapy in patients with suspected acute myocardial infarction. N Engl J Med 1993; 329: 383-9.
11. Morrow DA, Antman EM, Sayah A, Schuhwerk KC, Giugliano RP, de-Lemos JA, et al. Cardiovascular Division and TIMI Study Group, Department of Medicine, Brigham and Women's Hospital, Evaluation of the time saved by prehospital initiation of reteplase for ST-elevation myocardial infarction: results of The Early Retavase-Thrombolysis in Myocardial Infarction (ER-TIMI) 19. trial J Am Coll Cardiol 2002; 40(1): 71-7.
12. Morrison LJ, Verbeek PR, McDonald AC, Sawadsky BV, Cook DJ. Mortality and Prehospital Thrombolysis for Acute Myocardial Infarction: A Meta-analysis. JAMA 2000; 283: 2686-92.
13. Bonnefoy E, Lapostolle F, Leizorovicz A, Steg G, McFadden EP, Dubien PY, et al. Primary angioplasty versus prehospital fibrinolysis in acute myocardial infarction: a randomised study, Comparison of Angioplasty and Prehospital Thromboysis in Acute Myocardial Infarction study group. Lancet 2002; 360: 825-9.
14. Menown IB, Mackenzie G, Adgey AA. Optimizing the initial 12-lead electrocardiographic diagnosis of acute myocardial infarction. Eur Heart J 2000; 21: 275-83.
15. Sgarbossa EB, Pinski SL, Barbagelata A, Underwood DA, Gates KB, Topol EJ, et al. Electrocardiographic diagnosis of evolving acute myocardial infarction in the presence of left bundle-branch block. GUSTO-1 (Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries)Investigators. N Engl J Med 1996; 334: 481-7.
16. Alpert JS, Thygesen K, Antman E, Bassand JP. Myocardial infarction redefined: a consensus document of the Joint European Society of Cardiology/American College of Cardiology Committee for the redefinition of myocardial infarction. J Am Coll Cardiol 2000; 36: 959-69.
17. Tanasijevic MJ, Cannon CP, Wybenga DR, et al. Myoglobin, creatine kinase MB, and cardiac troponin-I to assess reperfusion after thrombolysis for acute myocardial infarction: results from TIMI 10A. Am Heart J 1997; 134: 622-30.
18. Maroko PR, Radvany P, Braunwald E, Hale SL. Reduction of infarct size by oxygen inhalation following acute coronary occlusion. Circulation 1975; 52: 360-8.
19. Madias JE, Hood WB. Reduction of precordial ST-segment elevation in patients with anterior myocardial infarction by oxygen breathing. Circulation 1976; 53: I198-200.
20. Fillmore SJ, Shapiro M, Killip T. Arterial oxygen tension in acute myocardial infarction: serial analysis of clinical state and blood gas changes. Am Heart J 1970; 79: 620-9.
21. Sukumalchantra Y, Danzig R, Levy SE, Swan HJ. The mechanism of arterial hypoxemia in acute myiocadial infarction. Circulation 1970; 41: 641-50.
22 Alderman EL. Analgesics in the acute phase of myocardial infarction. JAMA 1974; 229: 1646-8.
23. Herlitz J. Analgesia in myocardial infarction. Drugs 1989; 37: 939-44.
24. Lee G, DeMaria AN, Amsterdam EA, Realyvasquez F, Angel J, Morrison S, et al. Comparative effects of morphine, meperidine and pentazocine on cardiocirculatory dynamics in patients with acute myocardial infarction. Am J Med 1976; 60: 949-55.
25. Abrams J. Hemodynamic effects of nitroglycerin and long-acting nitrates. Am Heart J 1985; 110: 216-24.
26. Yusuf S, Collins R, MacMahon S, Peto R. Effect of intravenous nitrates on mortality in acute myocardial infarction: an overview of the randomised trials. Lancet 1988; 1: 1088-92.
27. Gruppo Italiano per lo Studio della Sopravvivenza nell’infarto Miocardico (GISSI). GISSI-3: effects of lisinopril and transdermal glyceryl trinitrate singly and together on 6- week mortality and ventricular function after acute myocardial infarction. Lancet 1994; 343: 1115-22.
28. ISIS-4 (Fourth International Study of Infarct Survival) Collaborative Group. ISIS-4: a randomised factorial trial assessing early oral captopril, oral mononitrate, and intravenous magnesium sulphate in 58,050 patients with suspected acute myocardial infarction. Lancet 1995; 345: 669-85.
29. Come PC, Pitt B. Nitroglycerin-induced severe hypotension and bradycardia in patients with acute myocardial infarction. Circulation 1976; 54: 624-8.
30. Kinch JW, Ryan TJ. Right ventricular infarction. N Engl J Med 1994; 330: 1211-7.
31. Cheitlin MD, Hutter AM, Brindis RG, Ganz P, Kaul S, Russell RO, et al. ACC/AHA expert consensus document, Use of sildenafil (Viagra) in patients with cardiovascular disease: American College of Cardiology/American Heart Association. J Am Coll Cardiol 1999; 33: 273-82.
32. Yusuf S, Peto R, Lewis J, Collins R, Sleight P. Beta blockade during and after myocardial infarction: an overview of the randomized trials. Prog Cardiovasc Dis 1985; 27: 335-71.
33. First International Study of Infarct Survival Collaborative Group. Randomised trial of intravenous atenolol among 16 027 cases of suspected acute myocardial infarction: ISIS-1. Lancet 1986; 2:57-66.
34. The MIAMI Trial Research Group. Metoprolol in acute myocardial infarction: patient population. Am J Cardiol 1985; 56: 10G-14G.
35. Roberts R, Rogers WJ, Mueller HS, Lambrew CT, Diver DJ, Smith HC, et al. Immediate versus deferred beta-blockade following thrombolytic therapy in patients with acute myocardial infarction: Results of the Thrombolysis in Myocardial Infarction (TIMI) II-B Study. Circulation 1991; 83: 407-16.
36. Van-de-Werf F, Janssens L, Brzostek T, et al. Short-term effects of early intravenous treatment with a beta-adrenergic blocking agent or a specific bradycardiac agent in patients with acute myocardial infarction receiving thrombolytic therapy. J Am Coll Cardiol 1993; 22: 407-16.
37. Pfisterer M, Cox JL, Granger CB, Brener SJ, Naylor CD, Califf RM, et al. Atenolol use and clinical outcomes after thrombolysis for acute myocardial infarction: the GUSTO-I experience, Global Utilization of Streptokinase and TPA(alteplase) for Occluded Coronary Arteries. J Am Coll Cardiol 1998; 32: 634-40.
38. Chae CU, Hennekens CH. Beta blockers. In: Hennekens CH, ed. Clinical trials in cardiovascular disease: a companion to Braunwald’s Heart Disease. Philadelphia: WB Saunders, 1999: 79-94.
39. Hochman JS, Califf RM. Acute myocardial infarction. In: Antman EA, Colucci WS, Gotto AM, Josephson ME, Loscalzo J, Oparil S, Popma JJ, eds. Cardiovascular therapeutics: a companion to Braunwald’s heart disease. 2nd ed. Philadelphia: WB Saunders, 2002: 235-91.
40. Yusuf S,Wittes J, Friedman L. Overview of results of randomized clinical trials in heart disease: I treatments following myocardial infarction. JAMA 1988; 260: 2088-93.
41. Beta-Blocker Heart Attack Study Group. The beta-blocker heart attack trial. JAMA 1981; 246: 2073-4.
42. Freemantle N, Cleland J, Young P, Mason J, Harrison J. Beta blockade after myocardial infarction: systematic review and meta regression analysis. BMJ 1999; 318: 1730-7.
43. The Beta-Blocker Pooling Project Research Group. The Beta-Blocker Pooling Project (BBPP): subgroup findings from randomized trials in post infarction patients. Eur Heart J 1988; 9: 8-16.
44. Barron HV, Viskin S, Lundstrom RJ, Wong CC, Swain BE, Truman AF, et al. Effect of beta-adrenergic blocking agents on mortality rate in patients not revascularized after myocardial infarction: data from a large HMO. Am Heart J 1997; 134: 608-13.
45. Dargie HJ. Effect of carvedilol on outcome after myocardial infarction in patients with left-ventricular dysfunction: the CAPRICORN randomised trial. Lancet 2001; 357: 1385-90.
46. Latini R, Maggioni AP, Flather M, Sleight P, Tognoni G. ACE inhibitor use in patients with myocardial infarction: summary of evidence from clinical trials. Circulation 1995; 92: 3132-7.
47. Ambrosioni E, Borghi C, Magnani B, for the Survival of Myocardial Infarction Long-Term Evaluation (SMILE) Study Investigators. The effect of the angiotensin-converting-enzyme inhibitor zofenopril on mortality and morbidity after anterior myocardial infarction. N Engl J Med 1995; 332: 80-5.
48. The Chinese Cardiac Study (CCS-1) Group. Oral captopril versus placebo among 13.634 patients with suspected acute myocardial infarction: interim report from the Chinese Cardiac Study (CCS-1). Lancet 1995; 345: 686-7.
49. ACE Inhibitor Myocardial Infarction Collaborative Group. Indications for ACE inhibitors in the early treatment of acute myocardial infarction: systematic overview of individual data from 100,000 patients in randomized trials. Circulation 1998; 97: 2202-12.
50. Teo KK, Yusuf S, Pfeffer M, Torp-Pedersen C, Kober L, Hall A, et al. Effects of long-term treatment with angiotensin-converting-enzyme inhibitors in the presence or absence of aspirin: a systematic review. Lancet 2002; 360: 1037-43.
51. Sigurdsson A, Swedberg K. Left ventricular remodelling, neurohormonal activation and early treatment with enalapril (CONSENSUS II) following myocardial infarction. Eur Heart J 1994; 15(Suppl B): 14-9; discussion 26.
52. Pfeffer MA, Braunwald E, MoyéLA, Basta L, et al, for the SAVE Investigators. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction: results of the survival and ventricular enlargement trial. N Engl J Med 1992; 327: 669-77.
53. The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators. Effect of ramipril on mortality and morbidity of survivors of acute myocardial nfarction with clinical evidence of heart failure. Lancet 1993; 342: 821-8.
54. Køber L, Torp-Pedersen C, Carlsen JE, et al, for the Trandolapril Cardiac Evaluation (TRACE) Study Group. A clinical trial of the angiotensin-converting-enzyme inhibitor trandolapril in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 1995; 333: 1670-6.
55. Johnstone D, Limacher M, Rousseau M, Liang CS, Ekelund L, Herman M, et al. Clinical characteristics of patients in studies of left ventricular dysfunction(SOLVD). Am J Coll Cardiol 1992; 70: 894-900.
56. Effect of enalapril on mortality and the development of heart failure in asymptomatic patients with reduced left ventricular ejection fractions. The SOLVD Investigattors. N Engl J Med 1992; 327: 685-91.
57. Rutherford JD, Pfeffer MA, Moye LA, Davis BR, Flaker GC, Kowey PR, et al. Effects of captopril on ischemic events after myocardial infarction: Results of the Survival and Ventricular Enlargement trial. Circulation 1994; 90: 1731-8.
58. Yusuf S, Sleight P, Pogue J, Bosch J, Davies R, Dagenais G, for the Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. N Engl J Med 2000; 342: 145-53.
59. Fox KM for the EURopean trial On reduction of cardiac events with Perindopril in stable coronary Artery disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPAstudy). Lancet 2003; 362: 782-8.
60. Dickstein K, Kjekshus J, for the OPTIMAAL Steering Committee of the OPTIMAAL Study Group. Effects of losartan and captopril on mortality and morbidity in high-risk patients after acute myocardial infarction: the OPTIMAAL randomised trial. Optimal Trial in Myocardial Infarction with Angiotensin II Antagonist Losartan. Lancet 2002; 360: 752-60.
61. Pfeffer MA, McMurray JJ, Velazquez EJ, Rouleau JL, Kober L, Maggioni AP, et al. Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both. N Engl J Med 2003; 349: 1893-906.
62. Keeley EC, Boura JA, Grines CL. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials. Lancet 2003; 361: 13-20.
63. Zeymer U, Tebbe U, Essen R, Haarmann W, Neuhaus KL, for the ALKK-Study Group. Influence of time to treatment on early infarct-related artery patency after different thrombolytic regimens. Am Heart J 1999; 137: 34-8.
64. De-Luca G, Suryapranata H, Zijlstra F, et al, for the ZWOLLE Myocardial Infarction Study Group. Symptom-onset-to-balloon time and mortality in patients with acute myocardial infarction treated by primary angioplasty. J Am Coll Cardiol 2003; 42: 991-7.
65. De-Luca G, Suryapranata H, Ottervanger JP, Antman EM. Time delay to treatment and mortality in primary angioplasty for acutemyocardial infarction: every minute of delay counts. Circulation 2004; 109: 1223-5.
66. Brodie BR, Stuckey TD, Wall TC, Kissling G, Hansen CJ, Muncy DB, et al. Importance of time to reperfusion for 30-day and late survival and recovery of left ventricular function after primary angioplasty for acute myocardial infarction. Am J Coll Cardiol 1998; 32: 1312-9.
67. Brodie BR, Stone GW, Morice MC, Cox DA, Garcia E, Mattos LA, et al. Importance of time to reperfusion on outcomes with primary coronary angioplasty for acute myocardial infarction (results from the Stent Primary Angioplasty in Myocardial Infarction Trial). Am J Cardiol 2001; 88: 1085-90.
68. Antoniucci D, Valenti R, Migliorini A, Moschi G, Trapani M, Buonamici P, et al. Relation of time to treatment and mortality in patients with acute myocardial infarction undergoing primary coronary angioplasty. Am J Cardiol 2002; 89: 1248-52.
69. Berger PB, Ellis SG, Holmes DR, Granger CB, Criger DA, Betriu A, et al. Relationship between delay in performing direct coronary angioplasty and early clinical outcome in patients with acute myocardial infarction: results from the global use of strategies to open occluded arteries in Acute Coronary Syndromes(GUSTO-IIb) trial. Circulation 1999; 100: 14-20.
70. Cannon CP, Gibson CM, Lambrew CT, Shoultz DA, Levy D, French WJ, et al. Relationship of symptom-onset-to-balloon time and door-to-balloon time with mortality in patients undergoing angioplasty for acute myocardial infarction. JAMA 2000; 283: 2941-7.
71. Zijlstra F, Patel A, Jones M, Grines CL, Ellis S, Garcia E, et al. Clinical characteristics and outcome of patients with early (<2 h), intermediate(2-4 h) and late (>4 h) presentation treated by primary coronary angioplasty or thrombolytic therapy for acute myocardial infarction. Eur Heart J. 2002; 23: 550-7.
72. Steg PG, Bonnefoy E, Chabaud S, Lapostolle F, Dubien PY, Cristofini P, et al. Impact of time to treatment on mortality after prehospital fibrinolysis or primary angioplasty: data from the CAPTIM randomized clinical trial. Circulation. 2003; 108: 2851-6.
73. Widimsky P, Budesinsky T, Vorac D, Groch L, Zelizko M, Aschermann M, et al. Long distance transport for primary angioplasty vs immediate thrombolysis in acute myocardial infarction: Final results of the randomized national multicentre trial--PRAGUE-2. Eur Heart J 2003; 24: 94-104.
74. Nallamothu BK, Bates ER. Percutaneous coronary intervention versus fibrinolytic therapy in acute myocardial infarction: is timing (almost) everything?. Am J Cardiol 2003; 92: 824-6.
75. Wu AH, Parsons L, Every NR, Bates ER, for the Second National Registry of Myocardial Infarction. Hospital outcomes in patients presenting with congestive heart failure complicating acute myocardial infarction: a report from the Second National Registry of Myocardial Infarction (NRMI-2). J Am Coll Cardiol 2002; 40: 1389-94.
76. Hochman JS, Sleeper LA, Webb JG, et al, for the Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock (SHOCK) Investigators. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. N Engl J Med 1999; 341: 625-34.
77. Hochman JS, Sleeper LA, White HD, Dzavik V, Wong SC, Menon V, et al. One-year survival following early revascularization for cardiogenic shock. JAMA 2001; 285: 190-2.
78. The GUSTO investigators. An international randomized trial comparing four thrombolytic strategies for acute myocardial infarction. N Engl J Med 1993; 329: 673-82.
79. Andersen HR, Nielsen TT, Rasmussen K, Thuesen L, Kelbaek H, Thayssen P, et al. A comparison of coronary angioplasty with fibrinolytic therapy in acute myocardial infarction. N Engl J Med 2003; 349: 733-42.
80. Aversano T, Aversano LT, Passamani E, Knatterud GL, Terrin ML, Williams DO, et al. Thrombolytic therapy vs primary percutaneous coronary intervention for myocardial infarction in patients presenting to hospitals without on-site cardiac surgery: a randomized controlled trial. JAMA 2002; 287: 1943-51.
81. Widimský P, Groch L, Zelízko M, Aschermann M, Bednár F, Suryapranata H. Multicentre randomized trial comparing transport to primary angioplasty vs immediate thrombolysis vs combined strategy for patients with acute myocardial infarction presenting to a community hospital without a catheterization laboratory: The PRAGUE study. Eur Heart J 2000; 21: 823-31.
82. Vermeer F, Oude-Ophuis AJ, vd-Berg EJ, Brunninkhuis LG, Werter CJ, Boehmer AG, et al. Prospective randomised comparison between thrombolysis, rescue PTCA, and primary PTCA in patients with extensive myocardial infarction admitted to a hospital without PTCA facilities: a safety and feasibility study. Heart 1999; 82: 426-31.
83. Grines CL, Westerhausen DR, Grines LL, Hanlon JT, Logemann TL, Niemela M, et al. A randomized trial of transfer for primary angioplasty versus on-site thrombolysis in patients with high-risk myocardial infarction: the Air Primary Angioplasty in Myocardial Infarction study. J Am Coll Cardiol 2002; 39: 1713-9.
84. Ellis SG, da-Silva ER, Heyndrickx G, Talley JD, Cernigliaro C, Steg G, et al. Randomized comparison of rescue angioplasty with conservative management of patients with early failure of thrombolysis for acute anterior myocardial infarction. Circulation 1994; 90: 2280-4.
85. Goldman LE, Eisenberg MJ. Identification and management of patients with failed thrombolysis after acute myocardial infarction. Ann Intern Med 2000; 132: 556-65.
86. Stone GW, Grines CL, Cox DA, et al, for the Controlled Abciximab and Device Investigation to Lower Late Angioplasty Complications (CADILLAC) Investigators. Comparison of angioplasty with stenting, with or without abciximab, in acute myocardial infarction. N Engl J Med 2002; 346: 957-66.
87. Montalescot G, Barragan P, Wittenberg O, et al, for the Abciximab before Direct Angioplasty and Stenting in Myocardial Infarction Regarding Acute and Long-Term Follow-up (ADMIRAL) Investigators. Platelet glycoprotein IIb/IIIa inhibition with coronary stenting for acute myocardial infarction. N Engl J Med 2001; 344: 1895-903.
88. Antoniucci D, Rodriguez A, Hempel A, Valenti R, Migliorini A, Vigo F, et al. A randomized trial comparing primary infarct artery stenting with or without abciximab in acute myocardial infarction. J Am Coll Cardiol 2003; 42: 1879-85.
89. Herrmann HC, Moliterno DJ, Ohman EM, Stebbins AL, Bode C, Betriu A, et al. Facilitation of early percutaneous coronary intervention after reteplase with or without abciximab in acute myocardial infarction: results from the SPEED(GUSTO-4 Pilot) Trial. J Am Coll Cardiol 2000; 36: 1489-96.
90. Ross AM, Coyne KS, Reiner JS, et al, for the Plasminogen-activator Angioplasty Compatibility Trial (PACT) investigators. A randomized trial comparing primary angioplasty with a strategy of short-acting thrombolysis and immediate planned rescue angioplasty in acute myocardial infarction: the PACT trial. J Am Coll Cardiol 1999; 34: 1954-62.
91. Fernandez-Aviles F, Alonso JJ, Castro-Beiras A, Vazquez N, Blanco J, Alonso-Briales J, et al. Prospective randomized trial comparing a routine invasive strategy within 24 hours of thrombolysis versus ischaemia-guided conservative approach for acute myocardial infarction with ST-segment elevation (GRACIA-1): a randomised controlled trial. Lancet 2004; 364: 1045-53.
92. Kastrati A, Mehilli J, Schlotterbeck K, et al, for the Bavarian Reperfusion Alternatives Evaluation (BRAVE) Study Investigators. Early administration of reteplase plus abciximab vs abciximab alone in patients with acute myocardial infarction referred for percutaneous coronary intervention: a randomized controlled trial. JAMA 2004; 291: 947-54.
93. ISIS-2 (Second International Study of Infarct Survival) Collaborative Group. Randomised trial of intravenous streptokinase, oral aspirin, both, or neither among 17,187 cases suspected acute myocardial infarction: ISIS-2. Lancet 1988; 2: 349-60.
94. Roux S, Christeller S, Lüdin E. Effects of aspirin on coronary reocclusion and recurrent ischemia after thrombolysis: a metaanalysis. J Am Coll Cardiol 1992; 19: 671-7.
95. Antithrombotic Trialists’ Collaboration. Collaborative metaanalysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high-risk patients. BMJ 2002; 324: 71-86.
96. Hennekens CH, Dyken ML, Fuster V. Aspirin as a therapeutic agent in cardiovascular disease: a statement for healthcare professionals from the American Heart Association. Circulation 1997; 96: 2751-3.
97. Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto Miocardico. GISSI-2: a factorial randomised trial of alteplase versus streptokinase and heparin versus no heparin among12,490 patients with acute myocardial infarction. Lancet 1990; 336: 65-71.
98. The International Study Group. In-hospital mortality and clinical course of 20,891 patients with suspected acute myocardial infarction randomised between alteplase and streptokinase with or without heparin. Lancet 1990; 336: 71-5.
99. ISIS-3 (Third International Study of Infarct Survival) Collaborative Group. ISIS-3: a randomised comparison of streptokinase vs tissue plasminogen activator vs anistreplase and of aspirin plus heparin vs aspirin alone among41,299 cases of suspected acute myocardial infarction. Lancet 1992; 339: 753-70.
100. Collins R, Peto R, Baigent C, Sleight P. Aspirin, heparin, and fibrinolytic therapy in suspected acute myocardial infarction. N Engl J Med 1997; 336: 847-60.
101. The GUSTO Angiographic Investigators. The effects of tissue plasminogen activator, streptokinase, or both on coronary-artery patency, ventricular function, and survival after acute myocardial infarction. N Engl J Med 1993; 329: 1615-22.
102. Assessment of the Safety and Efficacy of a NewThrombolytic Regimen (ASSENT)-3 Investigators. Efficacy and safety of tenecteplase in combination with enoxaparin, abciximab, or unfractionated heparin: the ASSENT-3 randomised trial in acute myocardial infarction. Lancet 2001; 358: 605-13.
103. Wallentin L, Goldstein P, Armstrong PW, Granger CB, Adgey AA, Arntz HR, et al. Efficacy and safety of tenecteplase in combination with the low-molecular-weight heparin enoxaparin or unfractionated heparin in the prehospital setting: the Assessment of the Safety and Efficacy of a New Thrombolytic Regimen (ASSENT)-3 PLUS randomized trial in acute myocardial infarction. Circulation 2003; 108: 135-42.
104. Simoons M, Krzeminska-Pakula M, Alonso A, et al, for the AMISK Investigators. Improved reperfusion and clinical outcome with enoxaparin as an adjunct to streptokinase thrombolysis in acute myocardial infarction: the AMI-SK study. Eur Heart J 2002; 23: 1282-90.
105. The CREATE Trial Group Investigators. Effect of reviparin, a low molecular weight heparin on mortality, reinfarction and strokes in patients with acute myocardial infarction presenting with ST-segment elevation JAMA 2005; 293: 427-35.
106. Bertrand ME, Rupprecht HJ, Urban P, Gershlick AH, for the Investigators FT. Double-blind study of the safety of clopidogrel with and without a loading dose in combination with aspirin compared with ticlopidine in combination with aspirin after coronary stenting: the clopidogrel aspirin stent international cooperative study (CLASSICS). Circulation 2000; 102: 624-9.
107. Mehta SR, Yusuf S, Peters RJ, Bertrand ME, Lewis BS, Natarajan MK, et al. Effects of pretreatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronary intervention: the PCI-CURE study. Lancet 2001; 358: 527-33.
108. Steinhubl SR, Berger PB, Mann JT 3rd, Fry ET, DeLago A, Wilmer C, et al. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA 2002; 288: 2411-20. Erratum in: JAMA 2003; 289: 987.
109. Sabatine MS, Cannon CP, Gibson CM, Lopez-Sendon JL, Montalescot G, Theroux P, et al. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST-segment elevation. N Engl J Med 2005; 352: 1179-89.
110. Topol EJ, for the GUSTOV Investigators. Reperfusion therapy for acute myocardial infarction with fibrinolytic therapy or combination reduced fibrinolytic therapy and platelet glycoprotein IIb/IIIa inhibition: the GUSTO V randomised trial. Lancet 2001; 357: 1905-14.
111. Strategies for Patency Enhancement in the Emergency Department (SPEED) Group. Trial of abciximab with and without low-dose reteplase for acute myocardial infarction. Circulation 2000; 101: 2788-94.
112. van-Es RF, Jonker JJ,Verheugt FW, Deckers JW, Grobbee DE for the Antithrombotics in the Secondary Prevention of Events in Coronary Thrombosis-2 (ASPECT-2) Research Group. Aspirin and coumadin after acute coronary syndromes (the ASPECT-2 study): a randomised controlled trial. Lancet 2002; 360: 109-13.
113. Brouwer MA, van-den-Bergh PJ, Aengevaeren WR, Veen G, Luijten HE, Hertzberger DP, et al. Aspirin plus coumarin versus aspirin alone in the prevention of reocclusion after fibrinolysis for acute myocardial infarction: results of the Antithrombotics in the Prevention of Reocclusion In Coronary Thrombolysis(APRICOT)-2 Trial. Circulation 2002; 106: 659-65.
114. Hurlen M, Abdelnoor M, Smith P, Erikssen J, Arnesen H. Warfarin, aspirin, or both after myocardial infarction. N Engl J Med 2002; 347: 969-74.
115. Fiore LD, Ezekowitz MD, Brophy MT, Lu D, Sacco J, Peduzzi P, for the Combination Hemotherapy and Mortality Prevention (CHAMP) Study Group. Department of Veterans Affairs Cooperative Studies Program Clinical Trial comparing combined warfarin and aspirin with aspirin alone in survivors of acute myocardial infarction: primary results of the CHAMPstudy. Circulation 2002; 105: 557-63.
116. Vaitkus PT, Barnathan ES. Embolic potential, prevention and management of mural thrombus complicating anterior myocardial infarction: a meta-analysis. J Am Coll Cardiol 1993; 22: 1004-9.
117. van-den-Berghe G, Wouters P, Weekers F, Verwaest C, Bruyninckx F, Schetz M, et al. Intensive insulin therapy in the critically ill patients. N Engl J Med 2001; 345: 1359-67.
118. Goldberg PA, Siegel MD, Sherwin RS, Halickman JI, Lee M, Bailey VA, et al. Implementation of a safe and effective insulin infusion protocol in a medical intensive care unit. Diabetes Care 2004; 2: 461-7.
119. Morrow DA, Antman EM, Charlesworth A, Cairns R, Murphy SA, de-Lemos JA, et al. TIMI risk score for ST-elevation myocardial infarction, A convenient, bedside, clinical score for risk assessment at presentation: An intravenous nPA for treatment of infarcting myocardium early II trial substudy. Circulation 2000; 102(17): 2031-7.
120. Lee KL, Woodlief LH, Topol EJ, et al, for the GUSTO-I Investigators. Predictors of 30-day mortality in the era of reperfusion for acute myocardial infarction: results from an international trial of 41,021 patients. Circulation 1995; 91: 1659-68.
121. Killip T, Kimball JT. Treatment of myocardial infarction in a coronary care unit: a two-year experience with 250 patients. Am J Cardiol 1967; 20: 457-64.
122. Guidelines 2000 for cardiopulmonary resuscitation and emergency cardiovascular care: part 7 the era of reperfusion: section 1acute coronary syndromes (acute myocardial infarction). Circulation 2000; 102: I172-203.
123. Pitt B, Remme W, Zannad F, Neaton J, Martinez F, Roniker B, et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 348: 1309-21.
124. Pitt B, Zannad F, Remme WJ, Cody R, Castaigne A, Perez A, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure: Randomized Aldactone Evaluation Study Investigators. N Engl J Med 1999; 341: 709-17.
125. Hunt SA, Baker DW, Chin MH, et al. ACC/AHA guidelines for the evaluation and management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Revise the 1995 Guidelines for the Evaluation and Management of Heart Failure). American College of Cardiology Web site. Available at: http://www.acc.org/clinical/guidelines/failure/hf_index.htm, 2001.
126. Hochman JS. Cardiogenic shock complicating acute myocardial infarction: expanding the paradigm. Circulation 2003; 107: 2998-3002.
127. Andersen HR, Falk E, Nielsen D. Right ventricular infarction: frequency, size and topography in coronary heart disease: a prospective study comprising 107 consecutive autopsies from a coronary care unit. J Am Coll Cardiol 1987; 10: 1223-32.
128. Kinch JW, Ryan TJ. Right ventricular infarction. N Engl J Med 1994; 330: 1211-7.
129. Dell’Italia LJ, Starling MR, O’Rourke RA. Physical examination for exclusion of hemodynamically important right ventricular infarction. Ann Intern Med 1983; 99: 608-11.
130. Robalino BD, Whitlow PL, Underwood DA, Salcedo EE. Electrocardiographic manifestations of right ventricular infarction. Am Heart J 1989; 118: 138-44.
131. Braat SH, Brugada P, de ZwaanC, Coenegracht JM, Wellens HJ. Value of electrocardiogram in diagnosing right ventricular involvement in patients with an acute inferior wall myocardial infarction. Br Heart J 1983; 49: 368-72.
132. Zeymer U, Neuhaus KL, Wegscheider K, Tebbe U, Molhoek P, Schroder R. Effects of thrombolytic therapy in acute inferior myocardial infarction with or without right ventricular involvement, HIT-4 Trial Group: Hirudin for Improvement of Thrombolysis. J Am Coll Cardiol 1998; 32: 876-81.
133. Moreyra AE, Suh C, Porway MN, Kostis JB. Rapid hemodynamic improvement in right ventricular infarction after coronary angioplasty. Chest 1988; 94: 197-9.
134. Birnbaum Y, Fishbein MC, Blanche C, Siegel RJ. Ventricular septal rupture after acute myocardial infarction. N Engl J Med 2002; 347: 1426-32.
135. Crenshaw BS, Granger CB, Birnbaum Y, et al, for the GUSTO-I (Global Utilization of Streptokinase and TPAfor Occluded Coronary Arteries) Trial Investigators. Risk factors, angiographic patterns, and outcomes in patients with ventricular septal defect complicating acute myocardial infarction. Circulation 2000; 101: 27-32.
136. Lamas GA, Mitchell GF, Flaker GC, Smith SC, Gersh BJ, Basta L, et al. Clinical significance of mitral regurgitation after acute myocardial infarction: Survival and Ventricular Enlargement Investigators. Circulation 1997; 96: 827-33.
137. Thompson CR, Buller CE, Sleeper LA, Antonelli TA, Webb JG, Jaber WA, et al. Cardiogenic shock due to acute severe mitral regurgitation complicating acute myocardial infarction, a report from the SHOCK Trial Registry: SHould we use emergently revascularize Occluded Coronaries in cardiogenic shock?. J Am Coll Cardiol 2000; 36(3 Suppl A): 1104-9.
138. Fasol R, Lakew F, Wetter S. Mitral repair in patients with a ruptured papillary muscle. Am Heart J 2000; 139: 549-54.
139. Becker RC, Gore JM, Lambrew C, Weaver WD, Rubison RM, French WJ, et al. A composite view of cardiac rupture in the United States National Registry of Myocardial Infarction. J Am Coll Cardiol 1996; 27: 1321-6.
140. The American Heart Association in collaboration with the International Liaison Committee on Resuscitation. Guidelines 2000 for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Part 6: advanced cardiovascular life support: section 5: pharmacology I: agents for arrhythmias. Circulation 2000; 102(8 Suppl): I112-28.
141. The American Heart Association in collaboration with the International Liaison Committee on Resuscitation. Guidelines 2000 for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Part 6: advanced cardiovascular life support: section 7: algorithm approach to ACLS emergencies: section 7A: principles and practice of ACLS. Circulation 2000; 102(8 Suppl): I136-9.
142. The American Heart Association in collaboration with the International Liaison Committee on Resuscitation. Guidelines 2000 for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Part 7: the era of reperfusion: section 1: acute coronary syndromes (acute myocardial infarction). Circulation 2000; 102(8 Suppl): I172-203.
143. The American Heart Association in collaboration with the International Liaison Committee on Resuscitation. Guidelines 2000 for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Part 8: advanced challenges in resuscitation: section 1: life-threatening electrolyte abnormalities. Circulation 2000; 102(8 Suppl): I217-22.
144. Cummins RO, Hazinski MF, Kerber RE, Kudenchuk P, Becker L, Nichol G, et al. Low-energy biphasic waveform defibrillation: evidence-based review applied to emergency cardiovascular care guidelines; a statement for healthcare professionals from the American Heart Association Committee on Emergency Cardiovascular Care and the Subcommittees on Basic Life Support, Advanced Cardiac Life Support, and Pediatric Resuscitation. Circulation 1998; 97: 1654-67.
145. MacMahon S, Collins R, Peto R, Koster RW, Yusuf S. Effects of prophylactic lidocaine in suspected acute myocardial infarction: An overview of results from the randomized, controlled trials. JAMA 1988; 260(13): 1910-6.
146. Hine LK, Laird N, Hewitt P, Chalmers TC. Meta-analytic evidence against prophylactic use of lidocaine in acute myocardial infarction. Arch Intern Med 1989; 149: 2694-8.
147. Teo KK, Yusuf S, Furberg CD. Effects of prophylactic antiarrhythmic drug therapy in acute myocardial infarction: an overview of results from randomized controlled trials. JAMA 1993; 270: 1589-95.
148. DeSilva RA, Hennekens CH, Lown B, Casscells W. Lignocaine prophylaxis in acute myocardial infarction: an evaluation of randomised trials. Lancet 1981; 2: 855-8.
149. WymanMG, WymanMR, Cannon D, Criley JM. Prevention of Primary Ventricular Fibrillation in Acute Myocardial Infarction with Prophylactic Lidocaine. Am J Cardiol 2004; 94: 545-51.
150. Simoons ML, Vos J, Tijssen JG, Vermeer F, Verheugt FW, Krauss XH, et al. Long-term benefit of early thrombolytic therapy in patients with acute myocardial infarction: 5 year follow-up of a trial conducted by the Interuniversity Cardiology Institute of The Netherlands. J Am Coll Cardiol 1989; 14: 1609-15.
151. Mueller HS, Cohen LS, Braunwald E, Forman S, Feit F, Ross A, et al. Predictors of early morbidity and mortality after thrombolytic therapy of acute myocardial infarction: Analyses of patient subgroups in the Thrombolysis in Myocardial Infarction (TIMI) trial, phase II. Circulation 1992; 85: 1254-64.
152. Maggioni AP, Zuanetti G, Franzosi MG, Rovelli F, Santoro E, Staszewsky L, et al. Prevalence and prognostic significance of ventricular arrhythmias after acute myocardial infarction in the fibrinolytic era: GISSI-2 results. Circulation 1993; 87: 312-22.
153. Villella A, Maggioni AP, Villella M, Giordano A, Turazza FM, Santoro E, et al. Prognostic significance of maximal exercise testing after myocardial infarction treated with thrombolytic agents, the GISSI-2 data-base: Gruppo Italiano per lo Studio della Sopravvivenza Nell'Infarto. Lancet 1995; 346(8974): 523-9.
154. Ross J, Gilpin EA, Madsen EB, Henning H, Nicod P, Dittrich H, et al. A decision scheme for coronary angiography after acute myocardial infarction. Circulation 1989; 79: 292-303.
155. ACC/AHA 2002 guidelines update for the management of patients with chronic stable angina: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines (committee to update the 1999 guidelines for the management of patinets with chronic stable angina). [monografía en línea]. 2002. [125pág. ] Obtenido de: http//:www.acc.org/clinical/guidelines/stable/stable_clean.pdf. (consultado 23/5/06)
156. Gregoratos G, Abrams J, Epstein AE, Freedman RA, Hayes DL, Hlatky MA, et al. ACC/AHA/NASPE 2002 guideline update for implantation of cardiac pacemakers and antiarrhythmia devices: summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/NASPE Committee to Update the 1998 Pacemaker Guidelines). Circulation 2002; 106: 2145-61.
157. The Antiarrhythmic Versus Implantable Defibrillators (AVID) Investigators. A comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. N Engl J Med 1997; 337: 1576-83.
158. Connolly SJ, Gent M, Roberts RS, Dorian P, Roy D, Sheldon RS, et al. Canadian implantable defibrillator study (CIDS): a randomized trial of the implantable cardioverter defibrillator against amiodarone. Circulation 2000; 101: 1297-302.
159. Kuck KH, Capatto R, Siebels J, Ruppel R. Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest: the Cardiac Arrest Study Hamburg(CASH). Circulation 2000; 102: 748-54.
160. Connolly SJ, Hallstrom AP, Cappato R, Schron EB, Kuck KH, Zipes DP, et al. Meta-analysis of the implantable cardioverter defibrillator secondary prevention trials. AVID, CASH and CIDS studies. Antiarrhythmics vs Implantable Defibrillator study. Cardiac Arrest Study Hamburg . Canadian Implantable Defibrillator Study. Eur Heart J 2000; 21(24): 2071-8.
161. Moss AJ, Hall WJ, Cannom DS, Daubert JP, Higgins SL, Klein H, et al. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia: Multicenter Automatic Defibrillator Implantation Trial Investigators. N Engl J Med 1996; 335: 1933-40.
162. Moss AJ, Zareba W, Hall WJ, Klein H, Wilber DJ, Cannom DS, et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med 2002; 346(12): 877-83. Epub 2002 Mar 19.
163. A randomized study of the prevention of sudden death in patients with coronary artery disease. Multicenter Unsustained Tachycardia Trial Investigators. N Engl J Med. 1999; 341(25): 1882-90.
164. Nanthakumar K, Epstein AE, Kay GN, Plumb VJ, Lee DS. Prophylactic implantable cardioverter-defibrillator therapy in patients with left ventricular systolic dysfunction: a pooled analysis of 10 primary prevention trials. J Am Coll Cardiol 2004; 44: 2166-72.
165. Josephson M, Wellens HJ. Implantable defibrillators and sudden cardiac death. Circulation 2004; 109: 2685-91.
166. Hohnloser SH, Kuck KH, Dorian P, Roberts RS, Hampton JR, Hatala R, et al. Prophylactic use of an implantable cardioverter-defibrillator after acute myocardial infarction. N Engl J Med 2004; 351: 2481-8.
167. Wilber DJ, Zareba W, Hall WJ, Brown MW, Lin AC, Andrews ML, et al. Time dependence of mortality risk and defibrillator benefit after myocardial infarction. Circulation 2004; 109: 1082-4.
168. Gillis AM. Prophylactic Implantable Cardioverter-Defibrillator after Myocardial Infartion: Not for Everyone. N Engl J Med 2004; 351: 2540-2.
169. Bardy GH, Lee KL, Mark DB, Poole JE, Packer DL, Boineau R, et al. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med 2005; 352: 225-37.
170. Gehi A, Haas D, Fuster V. Primary Prophylaxis with the Implantable Defibrillator: The Need for Improved Risk Stratification. JAMA 2005; 294(8): 958-60.
171. McClellan MB, Tunis SR. Medicare coverage of ICDs. N Engl J Med 2005; 352: 222-4.
172. Bristow MR, Saxon LA, Boehmer J, Krueger S, Kass DA, De-Marco T, et al. Cardiac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med 2004; 350: 2140-50.
173. Buxton AE, Moss AJ. Controversies in Cardiovascular Medicine: Should every one with an ejection fraction less or equal to 30%receive an implantable cardioverter defibrillator?. Circulation 2005; 111: 2537-49.
174. Hohnloser SH, Gersh BJ. Changing late prognosis of acute myocardial infarction. Impact on management of ventricular arrhythmias in the era of reperfusion and the implantable cardioverter-defibrillator. Circulation 2003; 107: 941-6.
175. Domanski MJ, Sakseena S, Epstein AE, Hallstrom AP, Brodsky MA, Kim S, et al. Relative effectiveness of the implantable cardioverter-defibrillator and antiarrhythmic drugs in patients with varying degrees of left ventricular dysfunction who have survived malignant ventricular arrhythmias: AVID Investigators, Antiarrhythmics Versus Implantable Defibrillators. J Am Coll Cardiol 1999; 34: 1090-5.
176. La-Rovere MT, Bigger JT Jr, Marcus FI, Mortara A, Schwartz PJ. Baroreflex sensitivity and heart-rate variability in prediction of total cardiac mortality after myocardial infarction: ATRAMI (Autonomic Tone and Reflexes After Myocardial Infarction) Investigators. Lancet 1998; 351: 478-84.
177. Zuanetti G, Neilson JM, Latini R, Santoro E, Maggioni AP, Ewing DJ. Prognostic significance of heart rate variability in post-myocardial infarction patients in the fibrinolytic era, The GISSI-2 results: Gruppo Italiano per lo Studio della Sopravvivenza nell' Infarto Miocardico. Circulation 1996; 94: 432-6.
178. Savard P, Rouleau JL, Ferguson J, Poitras N, Morel P, Davies RF, et al. Risk stratification after myocardial infarction using signal-averaged electrocardiographic criteria adjusted for sex, age, and myocardial infarction location. Circulation 1997; 96: 202-13.
179. Gomes JA, Winters SL, Martinson M, Machac J, Stewart D, Targonski A. The prognostic significance of quantitative signal-averaged variables relative to clinical variables, site of myocardial infarction, ejection fraction and ventricular premature beats: a prospective study. J Am Coll Cardiol 1989; 13(2): 377-84.
180. Maggioni AP, Zuanetti G, Franzosi MG, Rovelli F, Santoro E, Staszewsky L, et al. Prevalence and prognostic significance of ventricular arrhythmias after acute myocardial infarction in the fibrinolytic era. GISSI-2 results. Circulation 1993; 87: 312-22.
181. Schwartz PJ, La-Rovere MT, Vanoli E. Autonomic nervous system and sudden cardiac death: experimental basis and clinical observations for post-myocardial infarction risk stratification. Circulation 1992; 85(suppl I): I-77-I-91.
182. Hohnloser SH, Franck P, Klingenheben T, Zabel M, Just H. Open infarct artery, late potentials, and other prognostic factors in patients after acute myocardial infarction in the thrombolytic era: A prospective trial. Circulation 1994; 90: 1747-56.
183. Hohnloser SH, Klingenheben T, Zabel M, Schopperl M, Mauss O. Prevalence, characteristics and prognostic value during long-term follow-up of nonsustained ventricular tachycardia after myocardial infarction in the thrombolytic era. J Am Coll Cardiol 1999; 33: 1895-902.
184. Nutrition and Your Health: Dietary Guidelines for Americans. Fourth Edition. US Department of Agriculture. Washington: US Department of Health and Human Services, 1995.
185. de-Lorgeril M, Salen P, Martin JL, Monjaud I, Delaye J, Mamelle N. Mediterranean diet, traditional risk factors, and the rate of cardiovascular complications after myocardial infarction: final report of the Lyon Diet Heart Study. Circulation 1999; 99: 779-85.
186. O'Connor GT, Buring JE, Yusuf S, Goldhaber SZ, Olmstead EM, Paffenbarger RS Jr, et al. An overview of randomized trials of rehabilitation with exercise after myocardial infarction. Circulation 1989; 80: 234-44.
187. Dorn J, Naughton J, Imamura D, Trevisan M. Results of a multicenter randomized clinical trial of exercise and long-term survival in myocardial infarction patients: the National Exercise and Heart Disease Project (NEHDP). Circulation 1999; 100: 1764-9.
188. Aberg A, Bergstrand R, Johansson S, Ulvenstam G, Vedin A, Wedel H, et al. Cessation of smoking after myocardial infarction: Effects on mortality after 10 years. Br Heart J 1983; 49: 416-22.
189. Barry J, Mead K, Nabel EG, Rocco MB, Campbell S, Fenton T, et al. Effect of smoking on the activity of ischemic heart disease. JAMA 1989; 261: 398-402.
190. Department of Health and Human Services. Good Information For Smokers: You Can Quit Smoking (sitio web). 2003 : [2 pantallas]. Obtenido de: http://www.surgeongeneral.gov/tobacco/lowlit.htm. (consultado 23/5/06)
191. Fiore MC, Bailey WC, Cohen SJ, Dorfman SF, Goldstein MG, Gritz ER, et al. Treating Tobacco Use and Dependence. Quick Reference Guide for Clinicians. (sitio web). 2000: [10 pantallas]. Obtenido de: http://www.surgeongeneral.gov/tobacco/tobaqrg.htm (consultado 23/5/06)
192. Fiore MC, Smith SS, Jorenby DE, Baker TB. The effectiveness of the nicotine patch for smoking cessation: a meta-analysis. JAMA 1994; 271: 1940-7.
193. Kimmel SE, Berlin JA, Miles C, Jaskowiak J, Carson JL, Strom BL. Risk of acute first myocardial infarction and use of nicotine patches in a general population. J Am Coll Cardiol 2001; 37: 1297-302.
194. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL Jr, et al. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA 2003; 289: 2560-72.
195. Furberg CD, Psaty BM, Meyer JV. Nifedipine: Dose-related increase in mortality in patients with coronary heart disease. Circulation 1995; 92: 1326-31.
196. Malmberg K, Ryden L, Efendic S, Herlitz J, Nicol P, Waldenstrom A, et al. Randomized trial of insulin-glucose infusion followed by subcutaneous insulin treatment in diabetic patients with acute myocardial infarction (DIGAMI study): effects on mortality at 1 year. J Am Coll Cardiol; 26: 57-65.
197. UKProspective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998; 352: 837-53.
198. Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Third Report of the National Cholesterol Education Program (NCEP). Final Report National Institutes of Health. NIH Publication No. 02-5215, September 2002.
199. Grundy SM, Cleeman JI, Merz CN, Brewer HB Jr, Clark LT, Hunninghake DB, et al. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation 2004; 110: 227-39.
200. The Scandinavian Simvastatin Survival Study (4S) group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994; 344: 1383-9.
201. Sacks FM, Pfeffer MA, Moye LA, Rouleau JL, Rutherford JD, Cole TG, et al. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels: Cholesterol and Recurrent Events Trial investigators. N Engl J Med 1996; 335: 1001-9.
202. The Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. N Engl J Med 1998; 339: 1349-57.
203. Riegger G, Abletshauser C, Ludwig M, Schwandt P, Widimsky J, Weidinger G, et al. The effect of fluvastatin on cardiac events in patients with symptomatic coronary artery disease during one year of treatment. Atherosclerosis 1999; 144: 263-70.
204. The Post Coronary Artery Bypass Graft Trial Investigators. The effect of aggressive lowering of low-density lipoprotein cholesterol levels and low-dose anticoagulation on obstructive changes in saphenous-vein coronary-artery bypass grafts. N Engl J Med 1997; 336: 153-62.
205. Knatterud GL, Rosenberg Y, Campeau L, Geller NL, Hunninghake DB, Forman SA, et al. Long-term effects on clinical outcomes of aggressive lowering of low-density lipoprotein cholesterol levels and low-dose anticoagulation in the post coronary artery bypass graft trial: Post CABG Investigators. Circulation 2000; 102: 157-65.
206. Heart Protection Study (HPS) trial investigators. MRC/BHF Heart Protection Study of cholesterol lowering with Randomised trial of cholesterol lowering in 4444 patients with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial. Lancet 2002; 360: 7-22.
207. Sever PS, Dahlof B, Poulter NR, Wedel H, Beevers G, Caulfield M, et al; ASCOT investigators. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial—Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial. Lancet 2003; 361: 1149-58.
208. Arntz HR, Agrawal R, Wunderlich W, Schnitzer L, Stern R, Fischer F, et al. Beneficial effects of pravastatin (+/-colestyramine/niacin) initiated immediately after a coronary event (the randomized Lipid-Coronary Artery Disease [L-CAD] Study). Am J Cardiol 2000; 86: 1293-8.
209. Schwartz GG, Olsson AG, Ezekowitz MD, Ganz P, Oliver MF, Waters D, et al. Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIRACL study: a randomized controlled trial. JAMA 2001; 285: 1711-8.
210. Stenestrand U, Wallentin L for the Swedish Register of Cardiac Intensive Care (RIKS-HIA). Early statin treatment following acute myocardial infarction and 1-year survival. JAMA 2001; 285: 430-6.
211. Topol EJ. Intensive statin theraphy: a sea change in cardiovascular prevention [Editorial]. N Engl J Med 2004; 350(15): 1562-4.
212. Aronow HD, Novaro GM, Lauer MS, Brennan DM, Lincoff AM, Topol EJ, et al. In-hospital initiation of lipid-lowering therapy after coronary intervention as a predictor of long-term utilization: a propensity analysis. Arch Intern Med 2003; 163: 2576-82.
213. Hulley S, Grady D, Bush T, et al, for the Heart and Estrogen/progestin Replacement Study (HERS) Research Group. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. JAMA 1998; 280: 605-13.
214. Grady D, Herrington D, Bittner V, Blumenthal R, Davidson M, Hlatky M, et al. Cardiovascular disease outcomes during 6 to 8 years of hormone therapy: Heart and Estrogen/progestin Replacement Study follow-up (HERS II). JAMA 2002; 288: 49-57.
215. Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women's Health Initiative randomized controlled trial. JAMA. 2002; 288: 321-33.
216. Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto miocardico. Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. Lancet 1999; 354: 447-55.
217. Yusuf S, Dagenais G, Pogue J, Bosch J, Sleight P. Vitamin E supplementation and cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N Engl J Med 2000; 342: 154-60.
218. FitzGerald G. Coxibs and Cardiovascular Disease. N Engl J Med 2004; 351: 1709-11.