Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.20 no.3 Montevideo Nov. 2005
REVISIóN
Cardioimplante celular para reparar tejido cardíaco: ¿un nuees. Daniel Bigalli, Andrés Bico, Elvira Gossio
Cardioimplante celular para reparar tejido cardíaco:
¿un nuevo concepto terapéutico?
DRES. DANIEL BIGALLI 1, ANDRéS BICO 2, ELVIRA GOSSIO 3
1. Cirujano Cardíaco. Servicio de Cirugía Cardíaca-CICU. Centro Cardiovascular del Sanatorio Casa de Galicia.
2. Jefe de Servicio de Hemoterapia y Medicina Transfusional. Sanatorio Casa de Galicia.
3. Jefe de Servicio de Hematología. Sanatorio Casa de Galicia.
Correspondencia: Dr. Daniel Bigalli. Millán 4480. Montevideo-Uruguay. E-mail: dbigalli@cicu.com.uy
RESUMEN
El concepto clásico de que el corazón es un órgano no regenerativo ha cambiado en los últimos años: hoy día se considera que el corazón es un órgano en regeneración continua. Los mecanismos que posee el organismo para la renovación de tejidos son limitados y dependen de la rapidez de instauración del daño.
El cardioimplante celular consiste en injertar células diferenciadas o progenitoras en el miocardio lesionado, con el fin de inducir el crecimiento de nuevas fibras musculares y el desarrollo de angiogénesis, para mejorar y contribuir a la contracción sincrónica.
Se han utilizado diferentes poblaciones celulares para tal fin, injertadas directamente en el miocardio o inyectadas en la circulación.
En experimentación animal, en modelos de infarto de miocardio, el implante de células autólogas diferenciadas (cardiomiocitos embrionarios, fetales, mioblastos esqueléticos) ha mostrado un mejoramiento en la función ventricular. Por otra parte, la utilización de células madre de médula ósea o tejidos extramedulares ha producido la regeneración de cardiomiocitos y estructuras vasculares incluyendo células endoteliales y musculares lisas.
El 15 de junio de 2000 se inició en Francia la fase I clínica en diez pacientes con cardiopatía isquémica necrótica, disfunción ventricular izquierda severa. Los pacientes fueron tratados con implante epicárdico de mioblastos esqueléticos en las zonas no viables y revascularización en zonas isquémicas remotas al implante. El 60% de las zonas no viables donde se trasplantaron los mioblastos adquirieron un aumento del espesor sistólico y contractilidad en las zonas necróticas.
En el mundo ya han sido tratados cientos de pacientes, con diferentes poblaciones celulares, la mayoría con insuficiencia cardíaca secundaria a cardiopatía isquémica-necrótica, en los cuales se han obtenido resultados alentadores.
Las evidencias actuales sugieren que en un futuro cercano el cardioimplante celular podría ser una opción válida para el tratamiento de ciertas enfermedades cardíacas.
PALABRAS CLAVE:
MIOCITOS CARDíACOS
MIOBLASTOS
REVISIóN [TIPO DE PUBLICACIóN]
SUMMARY
The classic concept that the heart is known as a non-regenerative organ has changed in the last years: today it is considered as an organ in continuous regeneration.
The mechanisms to renew tissues are limited and depend on the speed of the production of the damage.
The cellular cardiac implant consists on grafting differentiated or progenitor cells in the damaged myocardium, to achieve the growth of new muscle fibers and angiogenesis, in order to improve and help synchronic contraction.
Different cellular populations have been used to graft directly in the damaged myocardium or injected in the circulation.
In animal experimentation, in models of myocardial infarction, the autologous transplantation of differentiated cells into damaged myocardium (such as cardiomyocyte, smooth muscle cells, fibroblasts, skeletal myoblasts) has proven successful results in the ventricle function.
On the other side, the use of mother cells has produced the regeneration of cardiomyocytes and vascular structures as endothelial and smooth muscle cells.
On June 15, 2000 in France began the first phase I human trial of autologous skeletal myoblast transplantation, in 10 patients with: 1.severe left ventricular dysfunction, 2. history of myocardial infarct with a residual discrete, akinetic and metabolically nonviable scar and 3. indication for concomitant coronary artery bypass grafting in remote ischemic myocardium. In this clinical trial 60% of the initially akinetic cell implanted scar areas demonstrated a new post-operative systolic thickening with contractility.
In the world, hundreds of patients have been treated with different population cells, most of them with chronic ischemic-necrotic heart failure in which successful results have been obtained.
The actual evidences suggest that in a near future the cellular cardiac implant could be a good option for the treatment of some cardiac diseases.
KEY WORDS:
MYOCITES, CARDIAC
MYOBLASTS
REVIEW [PUBLICATION TYPE]
INTRODUCCIóN
Clásicamente se consideraba que a los pocos meses de nacer ya poseíamos el número máximo de cardiomiocitos, y que a partir de ese momento las células que se perdían ya no iban a ser reemplazadas.
Este concepto clásico de incapacidad de replicación ha cambiado en los últimos años por los resultados obtenidos en experimentación animal y en ensayos clínicos, que han demostrado que el corazón es un órgano en regeneración continua, que aumenta la producción de nuevas células musculares en respuesta a diferentes estímulos fisiológicos y patológicos (1,2).
Los cardiomiocitos se generan a partir de un precursor celular que se divide y da lugar a grupos de células del mismo tipo. Durante la vida fetal, estas células comienzan a diferenciarse y aparecen en su citoplasma las miofibrillas contráctiles, conservando su capacidad de división a pesar de encontrarse en un estadio indiferenciado. Esta capacidad se mantiene hasta los tres o cuatro meses de vida posnatal.
En el corazón posnatal normal, los cardiomiocitos en mitosis son aproximadamente 14 x 106 y se estima que la pérdida progresiva de cardiomiocitos es de 6,4 x 106 cada año, lo que demuestra que a lo largo de la vida se produce un recambio lento de los mismos, a partir de células madre cardíacas y de otros tejidos.
Este índice mitótico normal se incrementa en presencia de ciertas enfermedades, como, por ejemplo: infarto de miocardio, cardiopatías dilatadas idiopáticas (3).
Los mecanismos que posee el organismo de regeneración, reparación y renovación de tejidos son limitados y dependientes de la rapidez de instauración del daño o degeneración. De esta manera, la muerte de grandes cantidades de tejido de manera aguda no es susceptible de ser reparada por los mecanismos naturales del organismo debido a la escasez de células madre (4-6).
En la actualidad contamos con nuevas posibilidades terapéuticas basadas en la medicina regenerativa, que se propone reparar los tejidos dañados, utilizando mecanismos similares a los que de forma natural usa el organismo para la renovación de las poblaciones celulares que van envejeciendo y que deben ser sustituidas por otras que suplen su función.
Las nuevas terapias basadas en el implante de células madre para regenerar tejidos enfermos constituyen actualmente una posibilidad para el tratamiento de ciertas enfermedades cardíacas (7-15).
SELECCIóN CELULAR
El objetivo del cardioimplante celular es que las células trasplantadas en el tejido cardíaco, alogénicas (de la misma especie) o autólogas (del mismo individuo), se diferencien en cardiomiocitos y participen en la mejoría funcional de los ventrículos afectados.
Las células que poseen potencialidad para el desarrollo de la corrección cardíaca pueden ser de variada procedencia, pero teóricamente es posible recurrir a células naturalmente contráctiles, como las células del tejido cardíaco o del músculo esquelético, o a células que puedan ser orientadas hacia un fenotipo contráctil, como las células madre embrionarias o adultas.
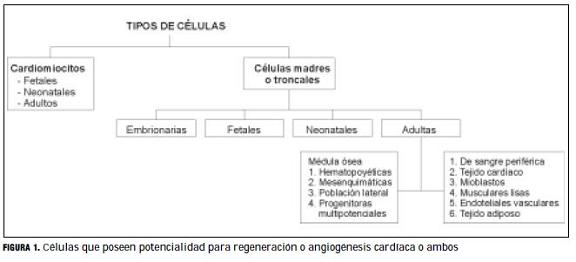
Aquí se enumeran las células estudiadas que podrían contribuir en el proceso de regeneración cardíaca o angiogénesis, o ambos (figura 1).
1. CARDIOMIOCITOS (EMBRIONARIOS, FETALES, ADULTOS)
En 1993, Koh y colaboradores, en forma experimental, demostraron el éxito del injerto de cardiomiocitos embrionarios y fetales en el tejido cardíaco normal y enfermo (16,17). Estas células se injertan satisfactoriamente en el miocardio, demostrándose posteriormente la presencia de discos intercalares y conexina 43, que son marcadores de la unión intracelular requerida para el acoplamiento eléctrico entre los cardiomiocitos injertados y los nativos.
Las uniones desarrolladas entre el miocardio huésped y las células injertadas dan por resultado una mejor función sistólica y diastólica.
Otros estudios no han demostrado que se formen uniones con los cardiomiocitos del receptor (18).
La utilización de este tipo celular en la práctica clínica es muy complicada, ya que debe ser obtenido de embriones o fetos, creando problemas en cuanto a su disponibilidad, problemas inmunológicos y cuestiones éticas inherentes a su utilización (14,15).
Los cardiomiocitos adultos son células terminales diferenciadas, por lo que no se dividen y no se logra expandirlos en medios de cultivo (19). Sin embargo, se ha identificado una población de cardiomiocitos que proliferan en el corazón adulto, lo que aumenta la expectativa, si se logra estimularlos in vivo o aislarlos y multiplicarlos ex vivo, para utilizarlos en la regeneración de tejido cardíaco enfermo (20).
2. CéLULAS MADRE O TRONCALES (STEM CELLS)
La célula madre (CM) o troncal se define como una célula progenitora con dos características principales:
1. Capacidad de proliferar durante un tiempo prolongado, dando lugar a células hijas idénticas a ella (autorrenovación).
2. Capacidad de diferenciarse hacia células maduras y funcionales (diferenciación) (21). Además poseen capacidad funcional de implantación persistente en tejidos sanos y enfermos.(22)
Las células madre están reguladas por un mecanismo de división conservador (asimétrico), de forma tal que de su división se genera una célula equivalente a la original y otra que da cuenta del resto del programa de diferenciación. Este mecanismo de “automantenimiento” controla de forma estricta el número de células madre que existe en un determinado órgano.
No todas las células madre de un órgano participan activamente en el proceso de regeneración y mantenimiento de la funcionalidad. La mayoría se encuentra en un estado de reposo (quiescencia), lo que las protege de agresiones externas y del proceso de envejecimiento celular.
Cuando las células madre que están contribuyendo agotan su potencial y desaparecen, son sustituidas paulatinamente por la progenie de otras nuevas que se activan (sucesión clonal) (23).
2a. Células madre embrionarias (CME)
Pueden aislarse de la masa celular interna del embrión en estadio de blastocisto (7-14 días), y son capaces de generar “todos” los tipos celulares del cuerpo, es decir, son células pluripotenciales. Tienen la capacidad de proliferar en un estado indiferenciado a través de un tiempo prolongado de cultivo. Pueden diferenciarse en cada tipo de tejido y formar derivados de las tres capas germinales: ectodermo, mesodermo y endodermo (24).
De estas células se derivará, tras muchas divisiones celulares, el otro tipo de células, las células madre órgano-específicas.
In vitro, estas células pueden diferenciarse espontáneamente a cardiomiocitos y a células endoteliales (25,26).
A pesar de sus ventajas, los problemas éticos mayores con las células embrionarias humanas limitan su desarrollo y las aplicaciones terapéuticas.
2b. Células madre fetales
Se obtienen de las gónadas de los fetos.
2c. Células madre del cordón umbilical
Se obtienen de la sangre del cordón umbilical.
2d. Células madre adultas (CMA)
Las CMA han sido aisladas de diferentes tejidos del adulto: hematopoyético, músculo cardíaco, músculo esquelético, gastrointestinal, renal, epidérmico, adiposo, hígado, pulmón, páncreas, etcétera. Eran consideradas multipotenciales, es decir, su capacidad de diferenciación estaría más limitada, de forma tal que una célula derivada del tejido mesodérmico solo podía dar lugar a tejidos derivados mesodérmicos. Sin embargo estudios recientes describiendo la plasticidad de las CMA, han conducido a intensas discusiones, donde parecería que alguna o todas las CMA tendrían capacidad pluripotencial, similar a las células madre embrionarias.
Aunque no hay una definición “oficial” de la plasticidad de las células madre, podría ser definida como la capacidad de dar origen a células adquiriendo características morfológicas y funcionales de un tejido diferente de aquel del que la célula originariamente derivó (27-29).
Las células madre hematopoyéticas son capaces de diferenciarse en tejidos como músculo cardíaco, endotelio, o en tejidos derivados de las tres capas embrionarias (29-32).
El trasplante de CM de la médula ósea en el miocardio no viable ofrece una nueva posibilidad de restauración de la disfunción cardíaca en corazones infartados (33-36).
Las células madre adultas pueden aislarse de la médula ósea o de tejidos extramedulares.
A) Células madre adultas de médula ósea
Existen cuatro líneas celulares que pueden ser aisladas de la médula ósea:
- Células madres hematopoyéticas.
- Células madre mesenquimáticas.
- Células población lateral.
- Células progenitoras multipotenciales adultas.
1. Células madre hematopoyéticas (CMH)
Estas células se están utilizando desde hace más de 50 años en el trasplante de médula ósea, y han mostrado su efectividad en el tratamiento de diversas enfermedades. En los primeros tiempos su fuente casi exclusiva era la médula ósea; posteriormente se extrajeron de la sangre periférica y del cordón umbilical (37). Se aíslan de la médula ósea identificándolas por medio de marcadores de superficie: CD133+, CD34+, CD34-, CD38+, CD117+ (c-kit), CD34-, CD38-, Lin- (marcadores de linaje celular) (38).
Varios autores señalan que en algunos casos se pueden expresar CD45 (39).
Las células CD34- podrían representar un estadio más primitivo que el de las CD34+ (40).
También es posible que algunas de las células CD34- correspondan a la subpoblación medular recientemente identificada como “población lateral”, que contiene una alta proporción de células CD34- (29,40-42).
Las CMH son capaces de contribuir a la angiogénesis y la vasculogénesis in vivo de forma tal que las células CD34+ no solo contienen progenitores hematopoyéticos, sino también células progenitoras endoteliales (29,43).
El grupo de Anversa y Orlic ha demostrado, en un modelo de infarto de miocardio murino, que la inyección de estas células en el corazón dañado da por resultado la colonización, en más de la mitad del área infartada, produciendo un mejoramiento en la contractilidad y una disminución del proceso apoptótico (31).
El potencial de las CMH para adquirir características de músculo cardíaco, esquelético, de neuronas adultas, y de contribuir a otros tejidos como el epitelio pulmonar, gastrointestinal, renal o de piel se ha descrito recientemente in vivo (44-46).
2. Células madre mesenquimáticas (CMM)
Son identificadas y aisladas por distintos marcadores de superficie como: SH2, SH3, CD29, CD44, CD71, CD 90, CD133 y CD106 (31).
In vitro las CMM son capaces de diferenciarse en tejidos mesodérmicos funcionales, como tejido cardíaco, óseo, muscular esquelético (47).
Estas células pueden tener un papel potencial para el tratamiento de enfermedades cardíacas, fundamentalmente para la regeneración muscular.
3. Células población lateral (del inglés: “side population cells”)
Se han aislado de médula ósea y de músculo. Estas células son progenitores biogénicos (48), a nivel experimental, en un modelo murino de infarto de miocardio, se ha logrado diferenciarlas en células con características de músculo cardíaco y endotelio (49).
4. Células progenitoras multipotenciales adultas (del inglés: “multipotent adult progenitor cells”=MAPC)
Esta población celular fue descubierta en el año 2002 en la Universidad de Minesota (EE.UU.). Son auténticas células pluripotenciales con capacidad de diferenciarse en tejidos procedentes de cualquiera de las tres capas embrionarias (endodermo, mesodermo y ectodermo), muy similar al de las células madre embrionarias (39,50).
Por otra parte, las condiciones que se requieren para que se diferencien en tipos celulares específicos no están totalmente esclarecidas, por lo que constituye un tema de gran interés y objeto de diversas investigaciones en la actualidad (51).
B) Células madre adultas de tejidos extramedulares
1. Células madre de sangre periférica
Son similares a las obtenidas de la médula ósea (9).
Estas células autólogas mononucleares pueden movilizarse desde la médula ósea, con la administración de citoquinas en la forma de factores de crecimiento, por ejemplo: factor estimulante de colonias de granulocitos, estatinas y luego ser extraídas para su utilización (52).
2. Células madre cardíacas
Beltrami y colaboradores han demostrado, en experimentación animal, que en el corazón adulto es posible aislar células madre multipotenciales capaces de diferenciarse in vitro e in vivo en cualquiera de los tejidos necesarios para reconstituir un corazón dañado, esto es, endotelio, músculo liso y músculo cardíaco (53).
Si estos resultados pudieran ser reproducidos en humanos, las perspectivas terapéuticas serían enormes.
3. Células madre de músculo esquelético (mioblastos)
Las células satélite o mioblastos son las células precursoras de las fibras musculares localizadas por debajo de la membrana basal. Aunque las células satélite se encuentran habitualmente en estado quiescente, ante la presencia de un daño muscular son capaces de proliferar y diferenciarse hacia nuevas fibras musculares (54). Son muy resistentes a la isquemia, se multiplican después de una injuria y poseen un alto poder para mitosis múltiples (55,56).
La posibilidad de expandir in vitro el número de progenitores musculares ha permitido realizar estudios en modelos animales con infarto de miocardio en los que se han implantado mioblastos, demostrando que dichas células son capaces de injertarse y terminar su proceso de diferenciación hacia fibras musculares, contribuyendo a mejorar la función cardíaca y la supervivencia de los animales (56-58).
A pesar del beneficio terapéutico observado en los modelos animales, existe una importante controversia sobre si las células musculares esqueléticas implantadas en el miocardio son capaces de adquirir las características necesarias para poder transmitir el estímulo electromecánico. Mientras que algunos de los estudios iniciales indicaban que los mioblastos, una vez implantados, expresan proteínas específicas de músculo cardíaco: conexina 43 o discos intercalares (59), otros más recientes sugieren que los mioblastos no se transdiferencian a músculo cardíaco (60,61).
En cualquier caso, la inyección de mioblastos autólogos en animales con infarto de miocardio ha demostrado ser eficaz y ha dado lugar al desarrollo de ensayos clínicos en pacientes con infarto de miocardio, en los que también se ha demostrado beneficios (48).
4. Células musculares lisas
Pueden obtenerse de un segmento de arteria, del apéndice cecal o del útero.
Estudios in vitro han demostrado la expansión de estas células. Luego del implante en el miocardio patológico, las células musculares lisas proliferan y se hipertrofian en respuesta a las contracciones (62).
5. Células endoteliales vasculares
Pueden obtenerse de arterias o venas con el fin de producir angiogénesis y neovascularización (63). Se han trasplantado experimentalmente células maduras endoteliales expandidas en miocardio isquémico. Las células endoteliales inducen un extenso plexo capilar, pero no pueden promover la formación de vasos suficientes para regenerar el miocardio isquémico. Sin embargo, las células endoteliales bien diferenciadas de las venas umbilicales humanas forman cardiomiocitos, lo que permite plantear la utilización del cordón umbilical como fuente de células endoteliales humanas como fin terapéutico.
También podrían multiplicarse ex vivo progenitores endoteliales humanos circulantes (64).
6. Células madre del tejido adiposo
El tejido adiposo, como la médula ósea, deriva del mesénquima embrionario y contiene un estroma que puede ser aislado con facilidad. En esta fracción estromal existen células madre multipotentes que pueden diferenciarse a células adipocitarias, osteogénicas y biogénicas.
A nivel experimental, estas células aisladas en el tejido adiposo del conejo y cultivadas en presencia de 5-azacitidina se transforman en células del tipo de cardiomiocito: latido espontáneo luego de tres semanas, expresión de cadena pesada de la miosina, de a-actinina y de la troponina (65).
También en ratas se ha podido obtener la diferenciación espontánea a cardiomiocitos (66).
VíAS UTILIZADAS PARA EL IMPLANTE CELULAR
Las diferentes vías utilizadas para el cardioimplante celular son resumidas en la tabla 1.

La vía epicárdica quirúrgica fue la primera utilizada en la fase clínica, en pacientes con insuficiencia cardíaca crónica (isquémica-necrótica). El implante celular se realiza en el espesor del tejido necrótico-no viable por múltiples punciones (67).
La vía endoventricular, a través de catéteres especiales diseñados para tal fin, guiados mediante mapeo electromecánico, fluoroscopía biplana, ultrasonido o bajo resonancia nuclear magnética (RNM); mediante éstos se implantan por múltiples punciones en el espesor del miocardio enfermo (68-71).
La vía intravenosa sistémica tiene la desventaja de que la distribución de las células, inyectadas no es selectiva (72).
La vía intracoronaria se basa en el potencial migratorio de las células, las que son retenidas a través de la membrana basal. Esta vía es utilizada principalmente para los pacientes con IAM a los que se le realiza angioplastia primaria y luego se inyectan las células madre en la arteria tratada . Algunos trabajos han mostrado que por esta vía se podrían producir microembolias y potencialmente disminuir el aporte sanguíneo en pacientes isquémicos (74-78). También podría ser útil en cardiopatías no isquémicas (67).
La vía intravenosa coronaria consiste en introducir un catéter especial en el seno coronario y luego se avanza el extremo del mismo hacia la vena interventricular anterior, y desde ésta se realizan las microinfusiones de las células a través de múltiples punciones (73).
ENSAYOS CLíNICOS
El 15 de junio de 2000, Menasché y colaboradores (79) iniciaron en Francia la fase I clínica. En este ensayo se incluyeron diez pacientes con cardiopatía isquémica necrótica, disfunción ventricular izquierda severa (FEVI £ 35%), zona necrótica no viable, y con indicación para cirugía de revascularización en un área isquémica diferente a la zona del infarto.
Este protocolo constó de tres pasos:
1) Biopsia muscular del vasto lateral del muslo.
2) Cultivo de la biopsia en el laboratorio durante dos a tres semanas hasta obtener un campo celular abundante, viable y altamente purificado (al menos 400.000.000 células con 50% de mioblastos).
3) Cirugía: cardioimplante de mioblastos en la éscara posinfarto (vía epicárdica) y, en áreas isquémicas remotas, revascularización con puentes coronarios.
Los resultados obtenidos mostraron que 60% de las áreas aquinéticas iniciales donde se implantaron los mioblastos presentaban un nuevo espesamiento sistólico posoperatorio. Los diez pacientes de este grupo mejoraron la FEVI en un 13% de promedio y 11 de los 18 segmentos tratados adquirieron contractilidad. Hubo una muerte temprana y cuatro pacientes presentaron en el período posoperatorio taquicardia ventricular (80). Posteriormente se concluyó que estas arritmias habían sido como respuesta al suero fetal bovino, utilizado como medio de crecimiento en los cultivos de mioblastos (81).
Desde el comienzo de la fase clínica, cientos de pacientes, la mayoría con cardiopatía isquémica-necrótica, han sido tratados en el mundo con cardioimplante celular.
En la tabla 2 se detallan los principales ensayos clínicos publicados en la literatura desde 2003 a 2005 en nueve países, en los que se utilizó la vía epicárdica-quirúrgica para el implante de mioblastos o células madre de médula ósea y revascularización miocárdica en áreas isquémicas diferentes a las zonas necróticas, la mayoría en pacientes con cardiopatías isquémicas necróticas.
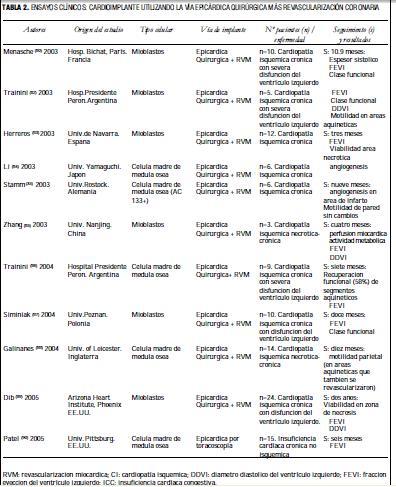
Si bien el número de pacientes tratados no es importante, los resultados han sido satisfactorios con seguimientos de hasta dos años; la mayoría concluye que existieron cambios en las zonas no viables, observando neoangiogénesis, incremento del espesor sistólico de la pared, recuperación funcional y en algunos casos aumento de la actividad metabólica y viabilidad positiva (80,90).
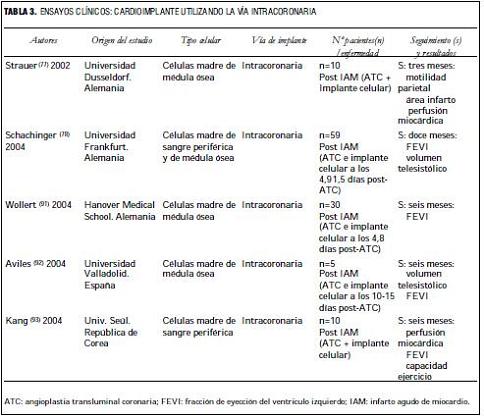
En la tabla 3 se detallan ensayos clínicos, desde 2002 a 2004, utilizando la vía intracoronaria, todos ellos en pacientes convalecientes de infartos agudos, a quienes se les realizó angioplastia de rescate y posteriormente la inyección de células madre (de médula ósea o de sangre periférica) en el vaso tratado. Seguimiento de hasta 12 meses, con resultados favorables, demostrando un incremento de la motilidad parietal y aumento de la perfusión miocárdica (110-114).
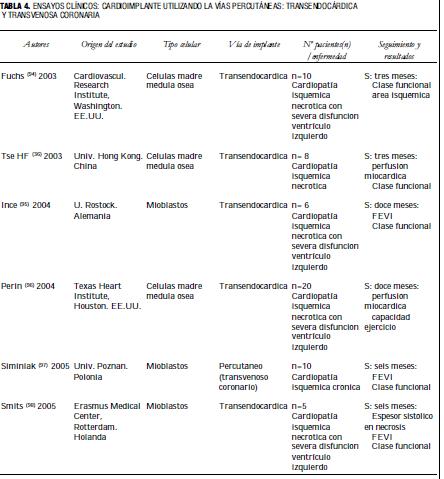
En la tabla 4 se observan los ensayos clínicos en los que se utilizaron las vías transendocárdica y transvenosa coronaria (119), en pacientes con patología isquémica necrótica. Los autores también observaron resultados alentadores (115-120).
En la mayoría de estos estudios los investigadores utilizaron poblaciones celulares heterogéneas, número de células injertadas diferentes, distintas técnicas de implante, lo que limita de forma importante las conclusiones, ya que no es posible determinar cuáles son exactamente las células responsables del beneficio terapéutico.
ANGIOGéNESIS COMO COADYUVANTE
DEL TRASPLANTE CELULAR
Recientemente se ha puesto de manifiesto el interés de promover angiogénesis cardíaca por medio del trasplante de células endoteliales vasculares o células progenitoras endoteliales (15,99-101). Esta posibilidad encierra un potencial importante como coadyuvante del trasplante celular biogénico, con el fin de inducir angiogénesis en el miocardio lesionado, debido a que la mortalidad de las células después del implante en las áreas fibróticas puede ser alta, por los bajos niveles de oxígeno y nutrientes.
De allí que la terapia basada en células angiogénicas es un desarrollo importante para tratar la isquemia del miocardio debido a la inestabilidad y las respuestas adversas que se presentan a los vectores angiogénicos de la terapia génica (102) y las limitaciones en el empleo de los factores de crecimiento, los que presentan riesgos de efectos sistémicos (angiogénesis de retina, hiperplasia de la íntima arterial con desarrollo de placas de ateromas y potenciación en el crecimiento y en las metástasis de tumores ocultos).
Existen dos modalidades para producir angiogénesis: 1) terapia génica utilizando adenovirus como vectores con la administración de factores de crecimiento angiogénicos (factor de crecimiento endotelial vascular, factor de crecimiento fibroblástico, factor de crecimiento hepatocítico), y 2) el trasplante celular, utilizando células madre mesenquimáticas o hematopoyéticas, principalmente células progenitoras endoteliales (CD 34+) (103). Ambas han mostrado ser efectivas, mejorando el flujo sanguíneo colateral en el miocardio isquémico (104-106).
CONCLUSIONES
- Los resultados obtenidos en experimentación animal y en ensayos clínicos han demostrado que el corazón se encuentra en un proceso continuo de crecimiento, muerte y renovación.
- El uso de células madre multipotentes, capaces de diferenciarse en cualquier tipo celular, se presenta como una estrategia terapéutica prometedora. Sin embargo, el tipo celular óptimo, número de células a implantar, vías de implante y la población de pacientes no han sido aún identificados.
- La mayoría de las evidencias sugieren que en un futuro cercano el cardioimplante celular podría ser una opción válida para el tratamiento de ciertas enfermedades cardíacas.
-
BIBLIOGRAFíA
1. Anversa P, Kajstura J. Ventricular myocytes do not terminally differentiate in the adult mammalian heart. Circ Res 1996; 78: 536-46.
2. Beltrami AP, Urbanek K, Kajstura J, Yan SM, Pinato N, Bussoni R, et al. Human cardiac myocytes divide after myocardial infarction. N Engl J Med 2001; 344: 1750-7.
3. Rosenthal N. High hopes for the heart. N Engl J Med 2001; 344: 1785-7.
4. Quani F, Urbanek K, Beltrami AP, Finato H, Beltrami CA, Nadal-Ginard B, et al. Chimerism of the transplanted heart. N Engl J Med 2002; 346: 5-15.
5. Taylor DA, Hurban R, Rodríguez ER, Goldschmidt-Clermont PJ. Cardiac chimerism as a mechanism for self-repair: does it happen and if so to what degree? Circulation 2002; 106: 2-4.
6. Massa M, Rosti V, Ferrario M, Campanelli R, Ramajoli I, Rosso R, et al. Increased circulating hematopoietic and endothelial progenitor cells in the early phase of acute myocardial infarction. Blood 2005; 105: 199-206.
7. Nadal-Ginard B. Inducción de cardiomiocitos en el corazón adulto: futuro de la regeneración miocárdica como alternativa al trasplante. Rev Esp Cardiol 2001; 54: 543-50.
8. Tam SK, Gu W, Nadal-Ginard B. Molecular cardiomyoplasty: potential cardiac gene therapy for chronic heart failure. J Thorac Cardiovasc Surg 1995; 109: 918-24.
9. Clarke DL, Johanson CB, Wilbertz J, Veress B, Nilsson E, Karlstrom H, et al. Generalized potential of adult neural stem cells. Science 2000; 288: 1660-3.
10. Atkins BZ, Hueman MT, Meuchel J, Hutcheson KA, Glower DD, Taylor DA. Cellular cardiomyoplasty improves diastolic properties of injured heart. J Surg Res 1999; 85: 234-42.
11. Rajnoch C, Chachques JC, Berrebi A, Bruneval P, Benoit MO, Carpentier A. Cellular therapy reverses myocardial dysfunction. J Thorac Cardiovasc Surg 2001; 121: 871-8.
12. Orlic D. Adult bone marrow stem cells regenerate myocardium in ischemic heart disease. Ann N Y Acad Sci 2003; 996: 152-7.
13. Min JY, Yang Y, Sullivan MF, Ke Q, Converso KL, Chen Y, et al. Long-term improvement of cardiac function in rats after infarction by transplantation of embryonic stem cells. J Thorac Cardiovasc Surg 2003; 125: 361-9.
14. Min JY, Sullivan MF, Yang Y, Zhang JP, Converso KL, Morgan JP, et al. Significant improvement of heart function by cotrasplantation of human mesenchymal stem cells and fetal cardiomyocytes in postinfarcted pigs. Ann Throrac Surg 2002; 74: 1568-75.
15. Chiu RC. Therapeutic cardiac angiogenesis and myogenesis: the promises and challenges on a new frontier. J Thorac Cardiovasc Surg 2001; 122: 851-2.
16. Koh GY, Klung MG, Soonpaa MH, Field LJ. Long-term survival of AT1 cardiomyocyte grafts in syngeneic myocardium. Am J Physiol 1993; 264: 1727-33.
17. Soonpaa MH, Koh GY, Klug MG, Field LJ. Formation of nascent intercalated disks between grafted fetal cardiomyocytes and host myocardium. Science 1994; 264: 98-101.
18. Etzion S, Battler A, Barbash IM, Cagnano E, Zarin P, Granot Y, et al. Influence of embryonic cardiomyocyte transplantation on the progression of heart failure in a rat model extensive myocardial infarction. J Mol Cell Cardiol 2001; 33: 1321-30.
19. Reinecke H, Zhang M, Bartosek T, Murry CE. Survival integration and differenciation of cardiomyocyte grafts. A study in normal and injured rat hearts. Circulation 1999; 100: 193-202.
20. Reinlib L, Field LJ. Cell trasplantation as future therapy for cardiovascular disease? Circulation 2000; 101: 182-7.
21. Prósper F, Herreros J. Células madres adultas: Rev Argent Cardiol 2004; 72: 68-73.
22. Körbling M, Estrov Z. Adult stem cells for tissue repair - A new therapeutic concept? N Engl J Med 2003; 349: 570-82.
23. Weissman IL. Stem cells: units of development, units of regeneration, and units in evolution. Cell 2000; 100: 157-68.
24. Min JK, Yang Y, Sullivan MF, Ke Q, Converso KL, Chen Y, et al. Long-term improvement of cardiac function in rats after infarction by transplantation of embryonic stem cells. J Thorac Cardiovasc Surg 2003; 125: 361-9.
25. Klug MG, Soonpaa MH, Koh GY, Field LJ. Genetically selected cardiomyocytes from differentiating embryonic stem cells form stable intracardiac grafts. J Clin Invest 1996; 98: 216-24.
26. Kehat I, Kenyagin-Karsenti D, Snir M, Segev H, Amit M, Gepstein A, et al. Human embryonic stem cells can differentiate into myocytes with structural and functional properties of cardiomyocytes. J Clin Invest 2001; 108: 407-14.
27. Blau HM, Brazelton TR, Weimann JM. The evolving concept of a stem cell: entity or function? Cell 2001; 105: 829-41.
28. Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-González XR, et al. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature. 2002; 418: 41-9.
29. Grant MB, May WS, Caballero S, Brown GA, Guthrie SM, Mames RN, et al. Adult hematopoietic stem cells provide functional hemangioblast activity during retinal neovascularization. Nat Med 2002; 8: 607-12.
30. Lagasse E, Connors H, Al-Dhalimy M, Reitsma M, Doce M, Osborne L, et al. Purified hematopoietic stem cells ca differentiate into hepatocytes in vivo. Nat Med 2000; 6: 1229-34.
31. Orlic D, Kajstura J, Chimenti S, Jakonjuk I, Anderson SM, Li B, et al. Hematopoietic stem cells regenerate infarcted myocardium. Nature 2001; 410: 701-5.
32. Krausse DS, Theise ND, Collector MI, Henegariu O, Hwang S, Gardner R, et al. Multi-organ, multi-lineage engraftment by a single bone marrow-derived stem cell. Cell 2001; 105: 369-77.
33. Assmus B, Schächinger V, Teupe C, Britten M, Lehmann R, Dobert N, et al. Transplantation of progenitor cells and regeneration enhancement in acute myocardial infarction (TOPCARE-AMI). Circulation 2002; 106: 3009-17.
34. Hamano K, Nishida M, HirataK, Mikamo A, Li TS, Harada M, et al. Local implantation of autologous bone marrow cells for therapeutic angiogenesis in patients with ischemic heart disease: clinical trial and preliminary results. Jpn Circ J 2001; 65: 845-7.
35. Stamm C, Westphal B, Kleine HD, Petzsch M, Kittner C, Klinge H, et al. Autologous bone marrow stem cell transplantation for myocardial regeneration. Lancet 2003; 361: 45-6.
36. Tse HF, Kwong YL, Chan JK, Lo G, Ho CL, Lau CP. Angiogenesis in ischemic myocardium by intramyocardial autologous bone marrow mononuclear cell implantation. Lancet 2003; 361: 47-9.
37. Yin AH, Miraglia S, Zanjani ED, Almeida-Porada G, Ogawa M, Leary AG, et al. AC 133, a novel marker for human hematopoietic stem and progenitor cells. Blood 1997; 90: 5002-12.
38. Eaves CJ. Myelopoiesis. In: Henderson ES, Lister TA, Greaves MF, et al. Leukemia. 7. ed. Philadelphia: Saunders; 2002:19-46.
39. Verfaillie CM, Pera MF, Lansdorp PM. Stem cells: Hype and reality. Hematology 2002; 1: 369-91.
40. Thomas TE, Miller CL, Eaves CK. Purification of hematopoietic stem cells for further biological studies. Methods 1999; 17: 202-18.
41. Guo Y, Lubbert M, Engelhardt M. CD34¯ hematopoietic stem cells: current concepts and controversies. Stem Cells 2003; 21: 15-20.
42. Zanjani ED, Almeida-Porada G, Livingston AG, Porada CD, Ogawa M. Engraftment and multilineage expression of human bone marrow CD34¯ cells in vivo. Ann NY Acad Sci 1999; 872: 220-31.
43. Rafii S, Lyden D. Therapeutic stem and progenitor cell transplantation for organ vascularization and regeneration. Nat Med 2003; 9: 702-12.
44. Laflamme MA, Myerson D, Saffitz JE, Murry CE. Evidence for cardiomyocyte repopulation by extracardiac progenitors in transplanted human hearts. Circ Res 2002; 90: 634-40.
45. Martin-Rendon E, Watt SM. Stem cell plasticity. Br J Haematol 2003; 122: 877-91.
46. La Barge MA, Blau HM. Biological progression from adult bone marrow to mononucleate muscle stem cell to multinucleate muscle fiber in response to injury. Cell 2002; 111: 589-601.
47. Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, et al. Multilineage potential of adult human mesenchymal stem cells. Science 1999; 284: 143-7.
48. Asakura A, Seale P, Girgis-GabardoA, Rudnicki MA. Myogenic specification of side population cells in skeletal muscle. J Cell Biol 2002; 159: 123-34.
49. Jackson KA, Majka SM, Wang H, Pocius J, Hartley CJ, Majesky MW, et al. Regeneration of ischemic cardiac muscle and vascular endothelium by adult stem cells. J Clin Invest 2001; 107: 1395-402.
50. Jiang Y, HendersonD, Blackstad M, Chen A, Millar RF, Verfaillie CM. Neuroectodermal differentiation from mouse multipotent adult progenitor cells. Proc Natl Acad Sci USA 2003; 100: 11854-60.
51. Daley GQ, Goodell MA, Snyder EY. Realistic prospects for stem cell therapeutics. Hematology 2003; 1: 398-418.
52. Chachques JC, Duarte F, Herreros J, Prosper F, Giambroni R, Julia P, et al. Cellular myogenic and angiogenic therapy for patients with cardiac or limb ischemia. Basic Appl Myol 2003; 13: 29-38.
53. Beltrami AP, Barlucchi L,Torella D, Baker M, Limana F, Chimenti S, et al. Adult cardiac stem cells are multipotent and support myocardial regeneration. Cell 2003; 114: 763-76.
54. Fujii T, Yau T, Weisel R, Ohno N, Mickle D, Shiono N, et al. Cell transplantation to prevent heart failure: a comparison of cell types. Ann Thorac Surg 2003; 76: 2062-70.
55. Chachques JC, Cattadori B, Herreros J, Prosper F, Trainini JC, Blanchard D, et al. Treatment of heart failure with autologous skeletal myoblasts. Herz 2002; 27: 570-8.
56. Taylor DA, Atkins BZ, Hungspreugs P, Jones TR, Reedy MC, Hutcheson KA, et al. Regenerating functional myocardium: improved performance after skeletal myoblast transplantation. Nat Med 1998; 4: 929-33.
57. Atkins BZ, Hueman MT, Meuchel JM, Cottman MJ, Hutcheson KA, Taylor DA. Myogenic cell transplantation improves in vivo regional performance in infarcted rabbit myocardium. J Heart Lung Transplant 1999; 18: 1173-80.
58. Ghostine S, Carrion C, Souza LC, Richard P, Bruneval P, Vilquin JT, et al. Long-term efficacy of myoblast transplantation on regional structure and function after myocardial infarction. Circulation 2002; 106: 1131-6.
59. Chiu RC, Zibaitis A, Kao RL. Cellular cardiomyoplasty: myocardial regeneration with satellite cell implantation. Ann Thorac Surg 1995; 60: 12-8.
60. Reinecke H, Poppa V, Murry CE. Skeletal muscle stem cells do not transdifferentiate into cardiomyocytes after cardiac grafting. J Mol Cell Cardiol 2002; 34: 241-9.
61. Reinecke H, MacDonald GH, Hauschka SD, Murry CE. Electromechanical coupling between skeletal and cardiac muscle. Implications for infarct repair. J Cell Biol 2000; 149: 731-40.
62. Li RK, Jia ZQ, Weisel RD, Merante F, Mickle DA. Smooth muscle cell transplantation into myocardial scar tissue improves heart function. J Mol Cell Cardiol 1999; 31: 513-22.
63. Kim EJ, Li RK, Weisel RD, Mickle DA, Jia ZQ, Tomita S, et al. Angiogenesis by endotelial cell transplantation. J Thorac Cardiovasc Surg 2001; 122: 963-71.
64. Kawamoto A, Gwon HC, Iwaguro H, Yamaguchi JI, Uchida S, Masuda H, et al. Therapeutic potential of ex vivo expanded endotelial progenitor cells for myocardial ischemia. Circulation 2001; 103: 634-7.
65. Rangappa S, Fen C, Lee EH, Bongso A, Wei ESK. Transformation of adult mesenchymal stem cells isolated from the fatty tissue into cardiomyocytes. Ann Thorac Surg 2003; 75: 775-9.
66. Laharrague P, Casteilla L, Planat V. Células madre no medulares para la terapia celular de la cardiopatía isquémica. Rev Arg Cir Cardiovasc 2004; 2: 16-23.
67. Thompson R, Parsa J, Van den Bos VJ, Davis BH, Toloza EM, Klem I, et al. Video-assisted thoracoscopic transplantation of myoblasts into the heart. Ann Thorac Surg 2004; 78: 303-7.
68. Perin E, Doman H, Borojevic R, Silva S, Sousa MD, Mesquita, et al. Transendocardial, autologous bone marrow cell transplantation for severe, chronic ischemic heart failure. Circulation 2003; 107: 2294.
69. Fuchs S, Baffour R, Zhou YF, Shou M, Pierre A, Tio FA, et al. Transendocardial delivery of autologous bone marrow enhances collateral perfusion and regional function in pigs with chronic experimental myocardial ischemia. J Am Coll Cardiol 2001; 37: 1726-32.
70. Kraitchman DL, Heldman AW, Atalar E, Amado LC, Martin BJ, Pittenger MF, et al. In vivo magnetic resonance imaging of mesenchymal stem cells in myocardial infarction. Circulation 2003; 107: 2290-3.
71. Garot J, Unterseeh T, Teiger E, Champagne S, Chazaud B, Gherardi R, et al. Magnetic resonance imaging of targeted catheter-based implantation of myogenic precursor cells into infarcted left ventricular myocardium. J Am Coll Cardiol 2003; 41: 1841-6.
72. Bittira B, Shum-Tim D, Al-Khaldi A, Chiu RC. Mobilization and homing of bone marrow stromal cells in myocardial infarction. Eur J Cardiothorac Surg 2003; 24: 393-8.
73. Thompson CA, Nasseri BA, Makower J, Houser S, Mc Garry M, Lamson T, et al. Percutaneous transvenous cellular cardiomyoplasty. A novel nonsurgical approach for myocardial cell transplantation. J Am Coll Cardiol 2003; 41: 1964-71.
74. Suzuki K, Murtuza B, Suzuki N, Smolenski RT, Yacoub MH. Intracoronary infusion of skeletal myoblasts improves cardiac function in doxorubicin-induced heart failure. Circulation 2001; 104: 1213-7.
75. Vulliet PR, Greeley M, Halloran SM, MacDonald KA, Kittleson MD. Intra-coronary arterial injection of mesenchymal stromal cells and microinfarction in dogs. Lancet 2004; 363: 783-4.
76. Wang JS, Shum-Tim D, Chedrawy E, Chiu RC. The coronary delivery of marrow stromal cells for myocardial regeneration: pathophysiologic and therapeutic implications. J Thorac Cardiovasc Surg 2001; 122: 699-705.
77. Strauer BE, Brehm M, Zeus T, Kostering M, Hernandez A, Sorg RV, et al. Repair of infarcted myocardium by autologous intracoronary mononuclear bone marrow cell transplantation in humans. Circulation 2002; 106: 1913-8.
78. Schachinger V, Assmus B, Britten MB, Honold J, Lehmann R, Teupe C, et al. Transplantation of progenitor cells and regeneration enhancement in acute myocardial infarction: final one-year results of the TOPCARE-AMI Trial. J Am Coll Cardiol 2004; 44: 1690-9.
79. Menasche P, Hagege AA, Scorsin M, Pouzet B, Desnos M, Duboc D, et al. Myoblast transplantation for heart failure. Lancet 2001; 357: 279-80.
80. Menasche P, Hagege AA, Vilquin JT, Desmos M, Abergel E, Pouzet B, et al. Autologous skeletal myoblast transplantation for severe postinfarction left ventricular dysfunction. J Am Coll Cardiol 2003; 42: 2063-9.
81. Chachques JC, Herreros J, Trainini J, Juffe A, Rendal E, Prosper F, Genovese J. Autologous human serum for cell culture avoids the implantation of cardioverter-defibrillators in cellular cardiomyoplasty. Int J Cardiol 2004; 95: S29-33.
82. Trainini JC, Lago N, Giordano R, De Paz J, Genovese J, Barisani JL, et al. Cardioimplante de mioblastos autólogos en la insuficiencia ventricular postinfarto. Rev Arg Cir Cardiovasc 2003; 2: 136-45.
83. Herreros J, Prosper F, Pérez A, Gavira JJ, García-Velloso MJ, Sánchez PL, et al. Autologous intramyocardial injection of cultured skeletal muscle derived stem cells in patients with non-acute myocardial infarction. Eur Heart J 2003; 24: 2012-20.
84. Li TS, Hamano K, Hirata K, Kobayashi T, Nishida M. The safety and feasibility of the local implantation of autologous bone marrow cells for ischemic heart disease. J Card Surg 2003; 18: S69-75.
85. Zhang F, Gao X, Yiang ZJ, Ma W, Li C, Kao RL. Cellular cardiomyoplasty: a preliminary clinical report. Cardiovasc Radiat Med 2003; 4: 39-42.
86. Trainini JC, Lago N, Klein G, Mouras J, Masoli O, Barisani JL, et al. Cardiomioplastia celular con médula ósea autóloga en pacientes con cardiomiopatía isquémica. Rev Arg Cardiol 2004; 72: 418-25.
87. Siminiak T, Kalawski R, Fiszer D, Jerzykowska O, Rzezniczak J, Rozwadowska N, et al. Autologous skeletal myoblast transplantation for the treatment of postinfarction myocardial injury: phase I clinical study with 12 months of follow-up. Am Heart J 2004; 148: 531-7.
88. Galinanes M, Loubani M, Davies J, Chin D, Pasi J, Bell PR. Autotransplantation of unmanipulated bone marrow into scarred myocardium is safe and enhances cardiac function in humans. Cell Transplant 2004; 13: 7-13.
89. Dib N. Resúmenes de los ensayos clínicos presentados en la 54ª Sesión Científica Anual del American College of Cardiology (Orlando, Florida, Estados Unidos, 6-10 de marzo de 2005). Rev Esp Cardiol 2005; 58: 666-78.
90. Patel A, Benetti, Gefner L, Paganini R, Brusich D, Kormos RL, et al. Stem cells given in minimally invasive procedure improve heart function. (PW). 2005. Disponible en: http: //www.stemcellnetwork.ca/news/articles.php?id=705. (Consultado 28 octubre 2005).
91. Wollert KC, Meyer GP, Loty J, Ringes-Lichtenberg S, Lippolt P, et al. Intracoronary autologous bone-marrow cell transfer after myocardial infarction: the BOOST randomized controlled clinical trial. Lancet 2004; 364: 141-8.
92. Aviles FF, San Román JA, García Frade J, Valdés M, Sánchez A, De La Fuente L, et al. Regeneración miocárdica mediante la implantación intracoronaria de células madre en el infarto agudo de miocardio. Rev Esp Cardiol 2004; 57: 191-3.
93. Kang HJ, Kim HS, Zhang SY, Park KW, Cho HJ, Koo BK, et al. Effects of intracoronary infusion of peripheral blood stem-cells mobilised with granulocyte-colony stimulating factor on left ventricular systolic function and restenosis after coronary stenting in myocardial infarction: the MAGIC cell randomised clinical trial. Lancet 2004; 363: 751-6.
94. Fuchs S, Satler LF, Kornowski R, Okubagzi P, Weisz G, Baffour R, et al. Catheter-based autologous bone marrow myocardial injection in no-option patients with advanced coronary artery disease: a feasibility study. J Am Coll Cardiol 2003; 41: 1721-4.
95. Ince H, Petzsch M, Rehders TC, Chatteriee T, Nienaber CA. Transcatheter transplantation of autologous skeletal myoblasts in postinfarction patients with severe left ventricular dysfunction. J Endovasc Ther 2004; 11: 695-704.
96. Perin EC, Dohmann HF, Borojevic R, Silva SA, Sousa AL, Silva GV, et al. Improved exercise capacity and ischemia 6 and 12 months after transendocardial injection of autologous bone marrow mononuclear cells for ischemic cardiomyopathy. Circulation. 2004; 110: II213-8.
97. Siminiak T, Kalawski R, Fiszer D, Jerzykowska O, Rzezniczak J, Rozwadowska N, et al. Percutaneous trans-coronary-venous transplantation of autologous skeletal myoblasts in the treatment of post-infarction myocardial contractility impairment: the POZNAN trial. Eur Heart J 2005; 26: 1188-95.
98. Smits PC,Van Genns RJ, Poldermans D, Bountioukos M, Onderwater EE, Lee CH, et al. Catheter-based intramyocardial injection of autologous skeletal myoblasts as a primary treatment of ischemic heart failure: clinical experience with six-month follow-up. Cell Transplant 2005; 14: 11-9.
99. Weber A, Pedrosa I, Kawamoto A, Himes N, Munasinghe J, Asahara T, et al. Magnetic resonance mapping of transplanted endothelial progenitor cells for therapeutic neovascularization in ischemic heart disease. Eur J Cardiothorac Surg 2004; 26: 137-43.
100. Yau T, Li G, Zhang Y, Weisel R, Mickle D, Li RK.Vascular endothelial growth factor receptor upregulation in response to cell-based angiogenic gene therapy. Ann Thorac Surg 2005; 79: 2056-63.
101. Chachques JC, Duarte F, Cattadori B, Shafy A, Lila N, Chatellier G, et al. Angiogenic growth factors and/or cellular therapy for myocardial regeneration: a comparative study. J Thorac Cardiovasc Surg 2004; 128: 245-53.
102. Lee RJ, Springer ML, Blanco-Bose WE, Ursell PC, Blau HM. VEGF gene delivery to myocardium: deleterious effects of unregulated expression. Circulation 2000; 102: 898-901.
103. Matsuda H. The current trends and future prospects of regenerative medicine in cardiovascular diseases. Asian Cardiovasc Thorac Ann 2005; 13: 101-2.
104. Hendel RC, Henry TD, Rocha-Singh K, Isner JM, Kereiakes DJ, Giordano FJ, et al. Effect of intracoronary recombinant human vascular endothelial growth factor on myocardial perfusion: evidence for a dose-dependent effect. Circulation 2000,101: 118-21.
105. Kalka C, Tehrani H, Laudenberg B, Vale PR, Isner JM, Asahara T, et al. VEGF gene transfer mobilizes endothelial progenitor cells in patients with inoperable coronary disease. AnnThorac Surg 2000; 70: 829-34.
106. Symes JF, Losordo DW, Vale PR, Lathi KG, Esakof DD, Mayskiy M, et al. Gene therapy with vascular endothelial growth factor for inoperable coronary artery disease. Ann Thorac Surg 1999; 68: 830-6.