Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.20 no.3 Montevideo Nov. 2005
ARTíCULO ORIGINAL
Dres. Norberto Tavella, José Ventura, Carlos Romero y colaboradores
Factores asociados con enfermedad valvular aórtica en pacientes con falla renal
DRES. NORBERTO TAVELLA 1, JOSé VENTURA 2, CARLOS ROMERO 1, ALICIA PETRAGLIA 2,
ÁLVARO BáEZ 1, LEóN MUñOZ 1, ALICIA OLASCOAGA 3, WALTER ALALLóN 3
1. Departamento de Cardiología. Hospital de Clínicas.
2. Servicio de Asistencia Renal Integral (SARI).
3. Departamento de Laboratorio Clínico. Hospital de Clínicas.
RESUMEN
La frecuencia de estenosis valvular aórtica en pacientes con falla renal es mayor que en la población general, lo que sugiere la presencia de mecanismos patogénicos acelerados o diferentes.
En 135 pacientes con falla renal en tratamiento dialítico estudiamos las prevalencias de fibrosis y estenosis valvular aórtica y los factores presuntamente asociados con ella. Los datos clínicos y de laboratorio se obtuvieron de los registros de diálisis, en todos se hizo un ecocardiograma Doppler y se calculó el gradiente transvalvular aórtico y el índice de masa ventricular izquierda (IMVI). En 116 pacientes dosificamos colesterol total (CT), triglicéridos, HDL-colesterol, apolipoproteína A1 y B y lipoproteína (a); se calculó el LDL-colesterol, relación CT/HDL-colesterol, y el índice apo B/apo A1.
La frecuencia de fibrosis (72%) y estenosis (6%) valvular aórtica fue más del doble que la conocida en la población general. El análisis multivariado mostró una asociación independiente de la patología valvular aórtica con la edad (p<0,0005), diabetes mellitus (p=0,013) y tiempo en diálisis (p=0,013). Concentraciones de CT mayores de 200 mg/dL se asociaron con patología valvular aórtica (p<0,004). La valvulopatía no mostró asociación con tabaquismo, hipertensión arterial o alteraciones fosfo-cálcicas. Comparadas con las normales, las válvulas con fibrosis tuvieron mayor valor de velocidad máxima (p<0,01), gradiente transvalvular (p=0,005) e IMVI (p=0,005).
La alta frecuencia de enfermedad valvular aórtica en diálisis sugiere que los pacientes con falla renal presentan factores que favorecen su aparición; los cuatro factores independientes que identificamos: edad, diabetes mellitus, tiempo en diálisis e hipercolesterolemia se asocian también tradicionalmente con la aterosclerosis.
Los aumentos de gradiente transvalvular y de IMVI en la fibrosis valvular aórtica señalan la presencia de alteraciones funcionales y morfológicas en etapas previas a la estenosis aórtica.
PALABRAS CLAVE: ESTENOSIS DE LA VáLVULA AóRTICA
FIBROSIS
FACTORES EPIDEMIOLóGICOS
INFORME DE CASO
SUMMARY
The prevalence of aortic valve stenosis in renal failure patients is higher than the observed in general population, suggesting accelerated or different pathogenic mechanisms.
We studied the prevalence of aortic valve fibrosis and stenosis in 135 renal failure patients on maintenance dialysis, and the possible associated factors.
Clinical and laboratory data were collected from dialysis registers; a cardiac echo-Doppler study was performed in all patients and the aortic transvalvular gradient and left ventricle mass index were calculated (LVMI). We measured total cholesterol (TC), triglycerides, HDL-cholesterol, apolipoprotein A1 and B and lipoprotein (a) in 116 patients; LDL-cholesterol, TC/HDL-cholesterol, and apo B/apo A1 ratio were calculated.
The frequencies of aortic valve fibrosis (72%) and stenosis (6%) were more than double than in general population. An independent association of aortic valve disease with age (p<0,0005), diabetes mellitus (p=0,013), and time on dialysis (vintage) (p=0,013), was demonstrated by multivariate analysis.
TC concentrations higher than 200 mg/dL were associated with aortic valve disease (p<0,004). There was no association with smoking, hypertension or phospho-calcium alterations. Compared to normal, fibrotic valves had higher values of maximal velocity (p<0,01), transvalvular gradient (p=0,005) and LVMI (p=0,005). The high prevalence of aortic valve disease in dialysis patients suggests that renal failure is a predisposing condition; the four independent factors that we recognized: age, diabetes mellitus, time on dialysis and hypercholesterolemia, are also traditionally associated with atherosclerosis. Higher transvalvular gradients and LVMI values suggest the presence of functional and morphologic alterations prior to aortic stenosis.
KEY WORDS: AORTIC VALVE STENOSIS FIBROSIS
EPIDEMIOLOGIC FACTORS
CASE REPORT
INTRODUCCIóN
La estenosis aórtica calcificada no reumática, asentando en válvulas aórticas tricúspides, constituye actualmente la forma anatómica más frecuente de esta enfermedad (1-4). Ya no se acepta que se trate de una patología “degenerativa” vinculada a la edad, sino que es un proceso activo de naturaleza inflamatoria con una anatomía patológica similar a la de la aterosclerosis (4-12).
La fibrosis valvular aórtica (diagnosticada por ecocardiografía) tiene alteraciones anatómicas iguales a las que se comprueban en la estenosis aórtica constituida, por lo que se consideran como diferentes etapas del mismo proceso (8,13).
Se ha identificado la existencia de factores de riesgo para la estenosis aórtica similares a los de la aterosclerosis, tales como el sexo masculino, la edad, la hipercolesterolemia, el LDL-colesterol y la lipoproteína(a) elevados, el valor bajo de HDL-colesterol, la historia de hipertensión arterial, el tabaquismo y la diabetes (14-17).
En los pacientes con falla renal la incidencia y prevalencia de estenosis aórtica es mayor que en la población normal, lo que sugiere procesos patogénicos que pueden ser cualitativa o cuantitativamente diferentes (18-21).
En este trabajo nos propusimos estudiar la frecuencia de estenosis y fibrosis valvular aórticas en una población con falla renal y los factores asociados con ellas.
MATERIAL Y MéTODO
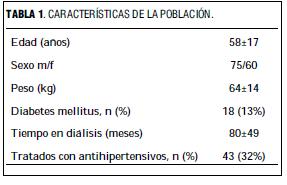
Se estudiaron todos los pacientes de tres centros de diálisis (n=135) de Montevideo, con más de seis meses de tratamiento hemodialítico.
Las características de la población se muestran en la tabla 1. Se consideraron diabéticos a los pacientes diagnosticados y tratados como tales por el nefrólogo actuante.
DATOS DE LA DIáLISIS
Se obtuvieron datos de los controles clínicos y humorales de los registros médicos. En cada paciente se calcularon los valores medios anuales de la presión arterial sistólica (PAS) y diastólica (PAD) medidas antes de cada sesión de diálisis, el peso corporal antes y después de cada diálisis, azoemia, potasio, calcio y fósforo plasmáticos, hematocrito y hemoglobina, registrados en el año anterior al estudio ecocardiográfico.
El peso seco, considerado como la medida del peso corporal sin exceso de agua, fue el establecido por los nefrólogos tratantes. Con este valor se calculó la sobrehidratación máxima (peso prediálisis-peso seco) y la sobrehidratación residual al fin de la diálisis (peso posdiálisis-peso seco). El porcentaje de reducción de urea (PRU), obtenido según la fórmula: 1 – (azoemia posdiálisis / azoemia prediálisis), se usó para estimar la eficiencia del tratamiento dialítico. La superficie corporal se calculó por la fórmula de Dubois y Dubois.
La PAD se definió por la fase V de Korotkoff, la presión arterial media (PAM) se calculó: PAM = PAD + 1/3 (PAS-PAD).
ESTUDIO ECOCARDIOGRáFICO
El ecocardiograma se realizó al final de una sesión de diálisis para evitar potenciales modificaciones atribuibles a la ganancia de líquido entre las diálisis. Se obtuvieron cortes estándar paraesternales izquierdos (eje largo y eje corto), cuatro y dos cámaras desde el ápex y cuatro cámaras subcostal, en las modalidades M, bidimensional y Doppler. Las medidas se realizaron según las recomendaciones de la American Society of Echocardiography (22). Se midió la velocidad máxima del flujo en la válvula aórtica y a partir de ella se calculó el gradiente máximo de presión transvalvular. Se registró la presión arterial en el momento de la ecografía.
Para el cálculo de masa cardíaca se utilizó la fórmula de Devereux (23): masa ventricular izquierda (g) = 1,04 (SIVD + DDVI + PPD)3 – DDVI3 – 13,6, siendo SIVD el espesor del séptum interventricular en diástole, DDVI el diámetro diastólico del ventrículo izquierdo y PPD la pared posterior del ventrículo izquierdo en diástole, medidos en cm. El índice de masa se calculó dividiendo la masa ventricular izquierda entre la superficie corporal. Se consideraron normales los índices de masa inferiores a 137 g/m 2 en el hombre y 112 g/m2 en la mujer.
En la válvula aórtica se estudió el aspecto ecográfico por modo bidimensional, la velocidad máxima de flujo a nivel valvular y el gradiente máximo de presión transvalvular. La válvula fue clasificada como: 1) normal, 2) fibrosada (cuando se observó aumento de la ecogenicidad y del espesor sin restricción del movimiento y con una velocidad máxima menor de 2,5 m/s), o 3) estenótica (por engrosamiento de las valvas con reducción de la apertura sistólica y velocidad máxima anterógrada ³ 2,5 m/s) (24). Dos ecocardiografistas realizaron los registros que se grabaron en VHS y fueron revisados por otro cardiólogo (CR) que desconocía los valores del estudio original. Se usó un ecocardiógrafo ATL, modelo HDI 3000, con transductor de 2,5 MHz.
ESTUDIO DEL METABOLISMO LIPíDICO
Se realizó en 116 pacientes, a quienes se extrajo sangre luego de 9-12 horas de ayuno, como establece el 2º Consenso Uruguayo de Dislipidemias (25). Las muestras fueron de sangre venosa separando el suero por centrifugación, conservándolo a -20°C hasta su procesamiento en un período no mayor a 30 días.
Todas las determinaciones fueron realizadas en un multianalizador BM Hitachi 911, empleándose reactivos, calibradores y controles de la firma Boehringer Manheim.
A todas las muestras se les realizó:
- dosificación de CT por técnica enzimática (26,27);
- dosificación de triglicéridos por técnica enzimática (26,27);
- dosificación de HDL-colesterol por técnica directa con polietilenglicol (28);
- cálculo de LDL-colesterol de acuerdo a la fórmula de Friedewald (29);
- cálculo de índice CT/HDL-colesterol (30);
- dosificación de apolipoproteína A1 y B por métodos inmuno-turbidimétricos (31);
- cálculo del índice Apo B/Apo A1;
- dosificación de lipoproteína (a) por técnica inmunoturbidimétrica (31).
MéTODOS ESTADíSTICOS
Se utilizaron la media y el desvío estándar como variables descriptivas y la correlación de Pearson de primer grado y la regresión lineal múltiple para medir el grado de asociación entre las variables. Las comparaciones entre los valores se hicieron con el test de t para muestras no pareadas. En todos los casos se exigió un nivel de 5% de significación. Se utilizó el programa SPSS 10.0 para el procesamiento de los datos.
RESULTADOS
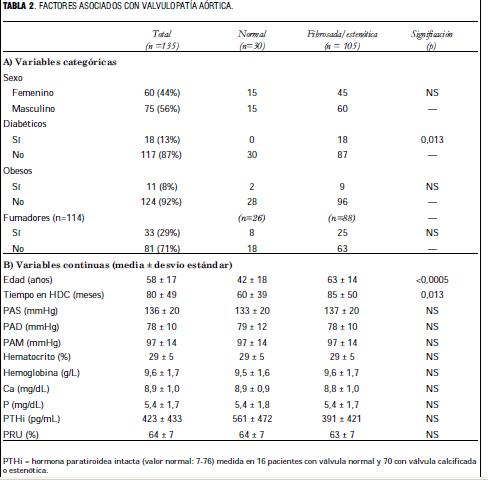
La válvula aórtica se encontró fibrocalcificada en 97 casos (72%), estenosada en 8 (6%) y fue normal en 30 casos (22%).
La edad, el tiempo en diálisis y la frecuencia de diabetes fueron significativamente mayores entre los pacientes con valvulopatía aórtica que en el grupo normal (tabla 2).
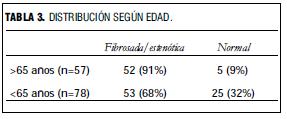
La frecuencia de fibrocalcificación (con o sin estenosis aórtica) se asoció con edad mayor de 65 años (p=0,001) (tabla 3).
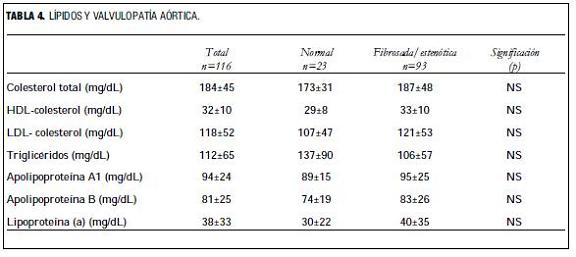
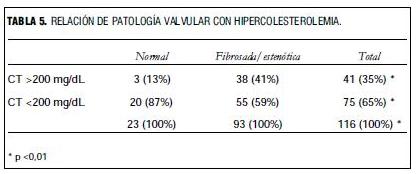
Analizando los valores lipídicos como variables continuas no hay diferencias entre los dos grupos, pero si consideramos como hipercolesterolemia a los valores iguales o superiores a 200 mg/dL de CT, existe asociación con la válvula patológica (tablas 4 y 5).
La velocidad máxima del flujo fue significativamente mayor en la válvula fibrosada que en la válvula normal: 1,56±0,39 versus 1,37±0,33 m/s, p=0,01. La velocidad máxima en la válvula estenótica fue 2,83±0,65 m/s (p=0,0001 comparada con la válvula fibrosada).
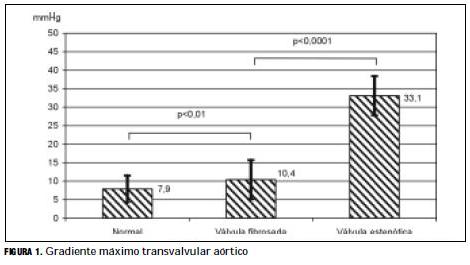
En correspondencia, el gradiente máximo de presión transvalvular fue más alto en las válvulas fibrosadas que en las normales: 10,4±5,3 versus 7,9±3,6 mmHg, y mayor aun en las válvulas con estenosis (33,1±15,6 mmHg) (tabla 6 y figura 1).
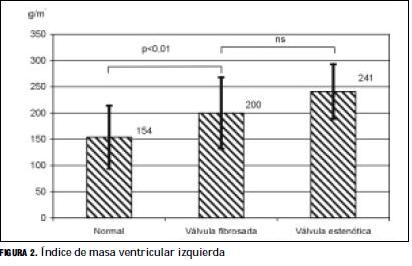
El IMVI se encontró significativamente mayor en los casos con válvula aórtica fibrosada que en los casos con válvula normal: 200±68 versus 154±60 g/m2, p=0,01 (tabla 6 y figura 2).
DISCUSIóN
La prevalencia de estenosis aórtica en nuestro grupo de pacientes con falla renal crónica es de 6%, aproximadamente tres veces mayor que la prevalencia informada en otros grupos en población general estudiados con la misma metodología (2%) (15). La prevalencia de fibrosis aórtica es de 72% versus 26% en población general. En otra serie con sujetos normales, la prevalencia de estenosis valvular aórtica fue de 2,2% (32). En ambas series la prevalencia de fibrosis y estenosis valvular aórtica aumenta con la edad, tal como sucede en nuestra serie (tabla 3).Hemos considerado la fibrosis y estenosis valvular aórticas como etapas de la misma enfermedad y las agrupamos como opuestas a la válvula normal en un análisis de los factores asociados. Este concepto se basa en los datos histológicos de ambos tipos de válvula y los resultados histoquímicos (8-13).
Se demostró asociación entre patología valvular aórtica (fibrosis y estenosis) y la edad, el tiempo en diálisis y la diabetes mellitus, tres factores estrechamente asociados a la aterosclerosis. La severidad de la aterosclerosis aumenta con la edad, de manera tal que los añosos tienen una carga de placas mayor que los jóvenes (33), por lo que en el contexto clínico es usual considerar a la edad como un sucedáneo de esta enfermedad (34,35). El tiempo en diálisis es un representante de la exposición de los pacientes a las condiciones de falla renal crónica no compensadas por esta terapéutica y que son capaces de elevar de 5 a 50 veces la mortalidad con respecto a la población general (36) y los coloca en una escala similar a la de aquellos que han tenido un infarto de miocardio.
Los pacientes con diabetes 2 tienen un riesgo de morir por causas cardiovasculares equivalente a los pacientes no diabéticos que han tenido un infarto de miocardio (37) y lo mismo sucede con los ataques cerebrovasculares (38), por lo que en el ATP III se recomienda considerarlos como pacientes con enfermedad arterial coronaria, aun cuando no hayan tenido ningún evento clínico (39). Por lo tanto, la asociación con la edad, el tiempo en diálisis y la diabetes, puede interpretarse como una asociación de la enfermedad valvular aórtica con la aterosclerótica.
No se comprobó en este grupo asociación con hipertensión arterial y tabaquismo, reconocidos factores de riesgo de aterosclerosis y patología valvular aórtica en la población general. Es posible que otros factores de mucho peso en este grupo de pacientes, tales como la desnutrición, el estado inflamatorio crónico, el estrés oxidativo, etcétera, sean capaces de borrar el efecto de aquellos factores.
No se encontraron diferencias significativas de las distintas fracciones lipídicas al comparar los pacientes con válvulas normales y los que tienen fibrosis o estenosis aórtica. Esto llama la atención porque en la población general se ha encontrado una diferencia significativa en el nivel de lipoproteína (a) y HDL-colesterol entre los normales y quienes tienen la válvula enferma (15). En otro estudio realizado por nuestro grupo (40) encontramos que los pacientes con falla renal en hemodiálisis crónica, comparados con una población normal, tenían mayor concentración de lipoproteína (a) y menor de HDL-colesterol. Pensamos que el peso de este factor de riesgo, característico de los pacientes en diálisis, es de tal magnitud que extingue las diferencias entre los subgrupos.
En cambio, cuando consideramos la colesterolemia como variable discreta con un valor de corte en 200 mg/dL, a partir del cual se considera que existe hipercolesterolemia, comprobamos diferencias significativas entre los pacientes con válvula sana y los que tienen fibrosis o estenosis aórtica. Este resultado coincide con los hallazgos en la población general (15,32) y apoya la hipótesis del origen ateroesclerótico de la valvulopatía.
El HDL-colesterol bajo compromete la función de transporte del LDL-colesterol desde los tejidos hacia el hígado. La molécula de lipoproteína (a) tiene un polo aterogénico constituido por la apolipoproteína B y un polo trombótico constituido por un glucopéptido plasminógeno-símil; ambos factores podrían contribuir a la fibrocalcificación valvular aórtica.
En este estudio no encontramos una asociación entre la elevación del producto fosfo-cálcico y de la hormona paratiroidea con la enfermedad de la válvula aórtica. Al respecto existen datos contradictorios en la bibliografía. Maher encontró esa relación; en cambio, Straumann no la encuentra (41,42). Una posible explicación es que los valores de calcio y fósforo se encuentran dentro de límites normales.
Cuando las valvas se mueven sin limitaciones, pero tienen un aspecto engrosado que las diferencia de las normales, se hace el diagnóstico de fibrosis valvular aórtica; si la velocidad máxima supera los 2,5 m/s el diagnóstico es de estenosis valvular aórtica (15). Este límite, arbitrario aunque útil desde el punto de vista práctico, establece un corte en un proceso que es continuo de acuerdo con los hallazgos histológicos e histoquímicos. El hallazgo de una velocidad máxima mayor que la normal en estos casos representa la repercusión funcional de las alteraciones anatómicas de la fibrosis aórtica.
En base a esta velocidad máxima se calculó el gradiente de presión entre ventrículo izquierdo y aorta, el que resultó ser significativamente mayor en el grupo de los pacientes con fibrosis valvular aórtica que en los normales, aunque no tanto como para definir a estos pacientes como portadores de estenosis aórtica, de acuerdo con la definición que adoptamos, pero que de todas formas indica la existencia de un obstáculo al flujo sistólico.
El IMVI es mayor en quienes tienen fibrosis aórtica que en los normales. En otro estudio realizado por nosotros sobre la hipertrofia ventricular izquierda analizamos en una regresión lineal múltiple nueve covariables que potencialmente podrían afectar el IMVI; encontramos que existían cuatro factores que se asociaban en forma independiente con el IMVI: presión de pulso, nivel de hemoglobina, gradiente de presión transvalvular aórtica y sobrehidratación crónica (43). Si bien la magnitud del gradiente de presión parece pequeña para repercutir en la masa ventricular, es necesario tener en cuenta que estos gradientes, que fueron medidos en reposo, aumentan por los incrementos del gasto cardíaco que ocurren en la actividad diaria. Este hallazgo, que hasta donde sabemos no ha sido comunicado por otros grupos, constituye, desde nuestro punto de vista, la alteración funcional correspondiente a la alteración anatómica mínima y permite considerar a la fibrosis y la estenosis aórticas como etapas evolutivas de la misma enfermedad.
BIBLIOGRAFíA
1. Stephan PJ, Henry AC, Hebeler RF, Whiddon L, Roberts WC. Comparison of age, gender, number of aortic valve cusps, concomitant coronary artery bypass grafting and magnitude of left ventricular systemic arterial peak systolic gradient in adults having aortic valve replacement for isolated aortic valve stenosis. Am J Cardiol 1997; 97: 166-72.
2. Roberts WC, Virmani R. Aschoff bodies at necropsy in valvular heart disease. Evidence from an analysis of 543 patients over 14 years of age that rheumatic heart disease, at least anatomically, is a disease of the mitral valve. Circulation 1978; 57: 803.
3. Fligner CL, Reichenbach DD. Pathology and etiology of heart disease. En: Valvular Heart Disease. Catherine M. Otto (ed). Philadelphia: Saunders, 1999: 13-43.
4. Tavella N, Barreiro D, Cura L, Vignolo G. Estenosis valvular aórtica. Rev Urug Cardiol 2004; 19: 99-121.
5. Mohler ER, Sheridan MJ, Nichols R. Development and progression of aortic valve stenosis: Atherosclerosis risk factors, a causal relationship? Clin Cardiol 1991; 14: 995-9.
6. Mohler ER. Are atherosclerotic processes involved in aortic valve calcification? Lancet 2000; 356: 524-5.
7. Otto CM. Aortic stenosis. Clinical evaluation and optimal timing of surgery. Cardiol Clin 1998; 16: 353-73.
8. Otto CM, Kuusisto J, Reichenbach DD, Gown AM, O´Brien KD. Characterization of the early lesion of “degenerative” valvular aortic stenosis. Histological and immunohistochemical studies. Circulation 1994; 90: 844-53.
9. O´Brien KV, Kuusisto J, Reichenbach DD, Ferguson M, Giachelli C, Alpers CH, et al. Osteopontin is expresed in human aortic valvular lesions. Circulation 1995; 92: 2163-8.
10. Demer LL. A skeleton in the atherosclerosis closet. Circulation 1995; 92: 2029-32.
11. Roberts WC. The senile cardiac calcification syndrome. Am J Cardiol 1986; 58: 572-4.
12. O´Brien KD, Shavelle DM, Caulfield MT, Mc Donald TO, Olin-Lewis K, Otto CM, et al. Association of angiotensin-converting enzyme with low-density lipoprotein in aortic valvular lesions and in human plasma. Circulation 2002; 106: 2224-30.
13. Otto CM. Aortic stenosis: even mild disease is significant. Eur Heart J 2004; 25: 185-7.
14. Aronow WS, Schwartz KS, Koenisberg M. Correlation of serum lipids, calcium, and phosphorus, diabetes mellitus and history of systemic hypertension with presence or absence of calcified or thickened aortic cusps or root in elderly patients. Am J Cardiol 1987; 59: 998-9.
15. Stewart BF, Siscovick D, Lind BK, Gardin JM, Goltdiener JS, Smith VE, et al, for the Cardiovascular Health Study. Clinical factors associated with calcific aortic valve disease. J Am Coll Cardiol 1997; 29: 630-4.
16. Sprecher DL, Schaeffer EJ, Kent KM, Gregg RE, Zech LA, Hoeg JM. Cardiovascular features of homozygous familial hypercholesterolemia: Analysis of 16 patients. Am J Cardiol 1984; 54: 20-30.
17. Kagaguchi A, Yutani C, Yamamoto A. Hypercholesterolemic valvulopathy: an aspect of malignant atherosclerosis. Therap Apher Dial 2003; 7: 439-43.
18. Fujise K, Amerling R, Sherman W. Rapid progression of mitral and aortic stenosis in a patient with secondary hyperparathyroidism. Br Heart J 1993; 70: 282-4.
19. Malergue MC, Urena P, Prieur P, Guedon-Rapoud C, Petrover M. Incidence and development of aortic stenosis in chronic hemodialysis. Arch Mal Coeur 1998; 90: 1595-601.
20. Michel PL. Aortic stenosis in chronic renal failure patients treated by dialysis. Nephrol Dialysis Transpl 1998; 13: 44-8.
21. London GM, Pannier B, Marchais SJ, Guerin AP. Calcification of the aortic valve in the dialyzed patient. J Am Soc Nephrol 2000; 11: 778-83.
22. Sanh DJ, De María A, Kisslo J, Weyman AE. Recommendations regarding quantitation in M mode echocardiography: Results of a survey of echocardiographic measurements. Circulation 1978; 78: 1072–83.
23. Devereux RB, Alonso DR, Lutas EM, Goltlieb YJ, Campo E, Sachs I, et al. Echocardiographic assessment of left ventricular hypertrophy: comparison to necropsy findings. Am J Cardiol 1986; 57: 450-8.
24. Fendley Stewart B, Siscovick D, Lind BK, Gardin JM, Goltdiener JS, Smith VE, et al, for the Cardiovascular Health Study. Clinical factors associated with calcific aortic valve disease. J Am Coll Cardiol 1997; 29: 630-4.
25. Sociedad Uruguaya de Ateroesclerosis. Segundo Consenso Uruguayo sobre Dislipemias. Rev Urug Cardiol 1998; 13: 176-204.
26. Methoden der enzymatschen analyse. 3th. ed. Verlag Chemie, 1974: 1878.
27. Trinder P. Determination of glucose in blood using glucose oxidase with an alternative oxygen acceptor. Ann Clin Biochem 1969; 6: 24-7.
28. Sugiuchi H, Uji Y, Okabe H, Irie T, Uekama K, Kayahara N. Direct measurement of high density lipoprotein cholesterol in serum with poliethilenglicol modified enzymes and sulfated aciclodextrin. Clin Chem 1995; 41: 717-23.
29. Friedewald WF, Levy RI, Frederickson DS. Estimation of LDL-cholesterol concentration without use of the preparative ultracentrifuge. Clin Chem 1972; 18: 499-502.
30. Castelli WP, Doyle JT, Gordon T, Hames CG, Hjortland MC, Hulley SB, et al. HDL-cholesterol and other lipids in coronary heart disease. Circulation 1977; 55: 767-72.
31. Tietz NW. Clinical Guide to Laboratory Tests. 3a. ed. Philadelphia: WB Saunders, 1995: 400-1.
32. Lindroos M, Kupari M, Heikkila J, Tiulis R. Prevalence of aortic valve abnormalities in elderly: an echocardiographic study of a random population sample. J Am Coll Cardiol 1993; 21: 1220-5.
33. Wilson PWF, D’Agostino RB, Levy D, Belanger AM, Silbershatz H, Kannel WB. Prediction of coronary heart disease using risk factors categories. Circulation 1998; 97: 1837-47.
34. Grundy SM. Primary prevention of coronary heart disease. Integrating risk assessment with intervention. Circulation 1999; 100: 988-98.
35. Smith SC, Jackson R, Pearson TA, Fuster V, Yusuf S, Faergeman O, et al . Principles for National and Regional Guidelines on Cardiovascular Disease Prevention. A scientific statement from the World Heart and Stroke Forum. Circulation 2004; 109: 3112-21.
36. Foley RN, Parfrey PS, Sarnak MJ. Clinical epidemiology of cardiovascular disease in chronic renal disease. Am J Kidney Dis 1998; 21(Suppl 3): S112-S119.
37. Haffner SM, Lheto S, Ronnemaa T, Pyorala K, Laaloo M. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med 1998; 339: 229-34.
38. Chong Do Lee, Folsom AR, Pankow JS, Brancati FL. Atherosclerosis Risk In Communities (AIRC) Study Investigators. Cardiovascular events in diabetic and nondiabetic adults with or without history of myocardial infarction. Circulation 2004; 109: 855-60.
39. Layerle B, Vignolo W. Corazón y Diabetes. Rev Urug Cardiol 2005; 20: 41-52.
40. Olascoaga A, Ventura J, Tavella N, Romero C, Petraglia A, Báez A, et al. Lipoproteínas (a) y riesgo aterogénico en pacientes en hemodiálisis crónica. Rev Mex Patol Clín 2001; 48: 161-5.
41. Maher E, Young G, Smyth-Wallsh B, Pugh S, Curtis J. Aortic and mitral valve calcification in patients with end-stage renal disease. Lancet 1987; ii: 875-7.
42. Straumann E, Meyer B, Misteli M, Blumberg A, Jenzer H. Aortic and mitral valve disease in patients with end-stage renal failure on long-term haemodialysis. Br Heart J 1992; 67: 236-9.
43. Ventura JE, Tavella N, Romero C, Petraglia A, Báez A, Muñoz L. Aortic valve calcification is an independent factor of left ventricular hypertrophy in patients on maintenance haemodialysis. Nephrol Dial Transplant 2002; 17: 1795-801.