Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.20 no.3 Montevideo Nov. 2005
ARTíCULO ORIGINAL
Br. Daniel Bia, Dres. Ricardo Armentano, Yanina Zócalo y colaboradores
Evaluación de la función arterial mediante estudios in vivo e in vitro: validación de homoinjertos arteriales criopreservados
BR. DANIEL BIA 1, DRES. RICARDO ARMENTANO 2, YANINA ZÓCALO 3, HÉCTOR PÉREZ 4, MARÍA SALDÍAS 5,
BIOING. SEBASTIÁN GRAF 6, DRES. WALTER SILVA 7, OSCAR ÁLVAREZ 8, INÉS ÁLVAREZ 9
1. Profesor Agregado. ESFUNO-DIBA, Facultad de Enfermería, Universidad de la República. Asistente del Departamento de Fisiología. Facultad de Medicina. Universidad de la República.
2. Profesor Honorario del Departamento de Fisiología, Facultad de Medicina. Grado 5-PEDECIBA-Biología, Uruguay. Decano de la Facultad de Ingeniería y Ciencias Exactas y Naturales. Universidad Favaloro.
3. Asistente del Departamento de Fisiología. Facultad de Medicina, Universidad de la República.
4. Coordinador del Área de Criopreservación de Tejidos. Instituto Nacional de Donación y Trasplante de Órganos, Tejidos y Células.
5. Asistente del Instituto Nacional de Donación y Trasplante de Órganos, Tejidos y Células.
6. Director del Departamento de Electrónica. Facultad de Ingeniería y Ciencias Exactas y Naturales. Universidad Favaloro.
7. Coordinador del Equipo de Ablaciones, Instituto Nacional de Donación y Trasplante de Órganos, Tejidos y Células.
8. Asistente del Instituto Nacional de Donación y Trasplante de Órganos, Tejidos y Células.
9. Profesora Directora del Instituto Nacional de Donación y Trasplante de Órganos, Tejidos y Células.
Departamento de Fisiología, Facultad de Medicina, Universidad de la República, Uruguay.
ESFUNO. Facultad de Enfermería, Universidad de la República, Montevideo, Uruguay.
Facultad de Ingeniería y Ciencias Exactas y Naturales. Universidad Favaloro. Buenos Aires, Argentina.
Instituto Nacional de Donación y Trasplante de Órganos, Tejidos y Células. Ministerio de Salud Pública-Facultad de Medicina. Universidad de la República. Montevideo, Uruguay.
Correspondencia: Daniel Bia Santana. Departamento de Fisiología, Facultad de Medicina, Universidad de la República. General Flores 2125, CP: 11800, Montevideo, Uruguay. E-mail: dbia@fmed.edu.uy
RESUMEN
Introducción: buscando reducir las diferencias entre la función de conducción (FC) y amortiguamiento (FA) de las prótesis vasculares y las arterias nativas, la utilización de homoinjertos criopreservados es una alternativa de creciente interés. El Instituto Nacional de Donación y Trasplante de Órganos, Tejidos y Células ha utilizado técnicas de criopreservación de vasos sanguíneos para ser utilizados como sustitutos vasculares.
Objetivos: 1) Evaluar la capacidad de la metodología de criopreservación utilizada para mantener la capacidad funcional de homoinjertos vasculares criopreservados/descongelados (C/D). 2) Evaluar la similitud funcional de los homoinjertos C/D y otros sustitutos actualmente utilizados (venas safenas y politetrafluoretileno expandido [ePTFE]), con las arterias de potenciales receptores.
Método: se midieron de forma no invasiva presión (tonometría), diámetro y espesor parietal (ecografía), en carótidas de pacientes normotensos e hipertensos. In vitro, en condiciones hemodinámicas similares a las de normotensos e hipertensos, se midió presión, diámetro y espesor en segmentos arteriales carotídeos frescos y criopreservados, y en venas safenas de donantes multiorgánicos, y en prótesis de ePTFE. Se calculó la FC como 1/Zc (Zc: impedancia característica), y FA como h/E (E, h: módulo elástico y viscoso).
Resultados: en ambas condiciones hemodinámicas, los homoinjertos frescos y criopreservados no mostraron diferencias biomecánicas ni funcionales. En condiciones de normotensión e hipertensión los homoinjertos C/D presentaron la mayor similitud biomecánica y funcional con las arterias de pacientes.
Conclusión: la criopreservación permitió mantener la capacidad funcional de homoinjertos vasculares. Los homoinjertos C/D mostraron la mayor similitud funcional con las arterias de potenciales receptores.
PALABRAS CLAVE: ARTERIAS
CRIOPRESERVACIóN
CIRUGíA CARDIOVASCULAR
ECOGRAFíA
HOMOINJERTOS
TONOMETRíA
VISCOELASTICIDAD
FUNCIóN ARTERIAL
SUMMARY
Introduction: cryopreserved vessels emerge as an option of growing interest in the search for vascular substitutes that overcome the limitations of those nowadays available due to conduit (CF) and buffering (BF) function mismatch between prosthesis and native arteries. In this way, in our Instituto Nacional de Donación y Trasplante de Órganos, Tejidos y Células techniques of cryopreservation have been used to preserve and storage vascular segments to be used as grafts.
Objectives: to evaluate: 1) the capability of the employed cryopreservation methodology, to preserve the functional behaviour of cryopreserved/defrosted homografts, and 2) the functional similarity between potential recipient arteries and both, cryopreserved/defrosted homografts, and currently used vascular substitutes.
Methods: carotid pressure (tonometry) and diameter (ultrasound) were measured in normotensive and hypertensive subjects. In in vitro studies, during haemodynamic conditions similar to those of in vivo, pressure, diameter and wall thickness were measured in segments of fresh and cryopreserved/defrosted carotid arteries and saphenous veins from multiorgan donors, and in expanded politetrafluorethyilene (ePTFE) prosthesis. The CF was calculated as 1/Zc (Zc: characteristic impedance) and the BF as h /E (h, E: viscous and elastic modulus, respectively).
Results: fresh and cryopreserved/defrosted homografts did not show biomechanical, nor functional differences, neither during normotensive, nor during hypertensive conditions. Both, during hypertensive and normotensive situations the cryopreserved/defrosted homografts evidenced the major biomechanical and functional similarity with the subjects’ arteries.
Conclusion: the cryopreservation technique employed did not modify the functional capacity of the vascular homografts. Cryopreserved/defrosted homografts were the vascular substitutes with the major functional similarity with potential native arteries.
KEY WORDS: ARTERIES
CRYOPRESERVATION
CARDIOVASCULAR SURGERY
HOMOGRAFTS
TONOMETRY
VISCOELASTICITY
ARTERIAL FUNCTION
INTRODUCCIóN
En la búsqueda de sustitutos arteriales que superaran las limitaciones de los existentes, la utilización de injertos arteriales autólogos surgió como una prometedora alternativa. Sin embargo, solo en limitadas ocasiones es posible utilizar una arteria autóloga en la reconstrucción o bypass arterial, sin generar disturbios hemodinámicos significativos en el territorio vascular de donde es escindida. Estas limitaciones son obviamente mayores cuando se requiere contar con vasos sanguíneos para cirugías de grandes y medianas arterias (por ejemplo, reconstrucción carotídea o aórtica). Esta limitación podría superarse con el uso de arterias de donantes cadavéricos, preservadas y almacenadas en bancos de tejidos (1). A pesar de unos promisorios inicios, la utilización de homoinjertos arteriales frescos y criopreservados en bancos de tejidos se cuestionó y abandonó durante años por la aparición de fenómenos de rechazo y la falta de un método de preservación adecuado, circunstancias que conducían a un significativo deterioro de los implantes y pérdida del homoinjerto (2). El uso de materiales sintéticos superó en parte el problema, disminuyendo el rechazo tisular, pero con una alta incidencia de falla de los implantes (por ejemplo, trombosis, hiperplasia intimal). Por lo tanto, considerando las limitaciones de las prótesis arteriales actualmente utilizadas, encontrar un método de preservación válido para los homoinjertos continúa siendo una necesidad apremiante y de constante estudio.
La introducción de técnicas como la criopreservación ha determinado un importante avance en el campo de la preservación tisular y la reconstrucción vascular. En las últimas décadas, luego de los malos resultados iniciales con esta técnica, las investigaciones se orientaron a la búsqueda de procedimientos que minimizaran el daño tisular, obteniéndose progresos en las soluciones crioprotectoras utilizadas y en los métodos de congelación y almacenamiento, que impulsaron la creación y el desarrollo de bancos de homoinjertos cardiovasculares (3). En nuestro país, el Instituto Nacional de Donación y Trasplante de Órganos, Tejidos y Células (INDT, ex Banco Nacional de Órganos y Tejidos) ha utilizado técnicas de criopreservación, específicas para cada tejido a criopreservar, permitiendo obtener un stock de diversos materiales biológicos, entre los que se encuentran válvulas cardíacas y segmentos vasculares –arteriales y venosos–, procedentes de donantes multiorgánicos (4). Empleando las bajas temperaturas criogénicas como herramienta para mantener la viabilidad en suspensión por tiempos prolongados, el método de criopreservación/descongelado permite recuperarla en el momento oportuno de la utilización del material. Sin embargo, como todo procedimiento destinado a generar un insumo terapéutico, la utilidad del mismo debe evaluarse, valorando la “calidad” del producto antes de su implantación.
En la evaluación de la metodología de preservación y la potencial utilidad clínica de un sustituto arterial, diversas características deben ser consideradas. Entre ellas, es fundamental evaluar la capacidad del procedimiento para preservar la función arterial. Cada segmento arterial desempeña dos principales funciones, esencialmente mecánicas: conducir sangre hacia los tejidos periféricos, ofreciendo baja impedancia al flujo (función conducto, FC), y amortiguar la pulsatilidad de presión y flujo generada por la eyección ventricular (función de amortiguamiento, FA) (5,6). Durante la criopreservación se han descrito alteraciones de componentes celulares y extracelulares de la pared arterial (7), determinantes del comportamiento mecánico y la función arterial. Por lo tanto, la función arterial podría alterarse durante la criopreservación, siendo necesaria su evaluación. Por otra parte, teniendo en cuenta que la susceptibilidad a la injuria de la criopreservación difiere entre las arterias (por ejemplo, elásticas versus musculares), la técnica de criopreservación debe adaptarse al tipo de arteria a preservar, y los resultados de la evaluación de un determinado segmento arterial, no pueden generalizarse (7).
Varios factores, además de los mencionados anteriormente, fundamentan la necesidad de la evaluación biomecánica de los segmentos criopreservados/descongelados. Determinar si existen alteraciones del comportamiento biomecánico arterial, relacionadas con el procedimiento de criopreservación en sí mismo, permitiría validar la técnica de criopreservación o determinar acciones tendentes a mejorarla. Asimismo, la comparación de las propiedades de los sustitutos arteriales con las de arterias in vivo permitiría establecer si los primeros pueden ser utilizados en la reconstrucción arterial. Finalmente, la evaluación pre y posimplante permitirían determinar si los cambios en el sustituto arterial son previos a la implantación, o se deben a la interacción donante-receptor. En este sentido, estudios biomecánicos y funcionales pre y pos-implante son necesarios, y solo la evaluación de segmentos implantados permitirá determinar la utilidad clínica del sustituto vascular.
En este trabajo nos centraremos en la evaluación preimplante de potenciales sustitutos arteriales. Los objetivos fueron:
- Evaluar la capacidad de la metodología de criopreservación utilizada en el INDT para mantener la capacidad funcional de homoinjertos vasculares criopreservados/descongelados (C/D). Para cumplir este objetivo, se realizaron estudios in vitro, en los que se compararon homoinjertos frescos y C/D.
- Evaluar la similitud funcional que los homoinjertos C/D y otros sustitutos actualmente utilizados presentan con las arterias de potenciales receptores (individuos normotensos e hipertensos). Para cumplir con este objetivo se realizaron estudios in vivo e in vitro, y se comparó la capacidad funcional de arterias de individuos normotensos e hipertensos con la de diversos sustitutos arteriales.
La importancia y vigencia del trabajo se halla en el significado que tendrá para el INDT y para los usuarios de estos insumos terapéuticos contar con homoinjertos arteriales, validados desde el punto de vista biomecánico y funcional, utilizando para ello metodologías de análisis consideradas estándar oro. Sin duda, una adecuada valoración de la utilidad clínica de estos homoinjertos requiere de otros estudios in vitro en los que se evalúen otras variables (por ejemplo, reactividad muscular, función endotelial), así como también de una segunda etapa en la que mediante estudios in vivo se evalúe el comportamiento posimplante del sustituto.
REVISIóN DE LA LITERATURA
El restablecimiento del flujo sanguíneo, interrumpido por obstrucción de la luz de un segmento arterial, puede requerir la confección de puentes vasculares o la reconstrucción del segmento vascular alterado, o ambos. En dichas situaciones diversos materiales protésicos, biológicos o sintéticos han sido utilizados (8), con resultados que difieren, dependiendo, entre otros factores, del vaso comprometido y del sustituto empleado, pero que en cualquier caso no han sido óptimos. Dada la importancia de las enfermedades cardiovasculares y las elevadas fallas de los sustitutos disponibles, en la actualidad existe gran interés en el desarrollo de sustitutos vasculares que mejoren los resultados de los actualmente disponibles (9).
Múltiples factores han sido relacionados con las elevadas tasas de falla protésica señaladas. Diversos estudios han evidenciado que cuanto menor es el desacople, o diferencia en las propiedades mecánicas y funcionales de la prótesis vascular y los vasos sanguíneos nativos, menores son las alteraciones hemodinámicas relacionadas con la falla protésica (por ejemplo, desarrollo de hiperplasia intimal por desacople biomecánico o de impedancias, o ambos) (10,11). En este sentido, actualmente es aceptado que el sustituto o prótesis arterial “ideal” debe reproducir las principales funciones mecánicas del sector vascular al que sustituirá o al que se incorporará (10,11), condición que las prótesis actualmente disponibles no cumplen.
La criopreservación es considerada un procedimiento útil para el almacenamiento de tejidos a fin de ser utilizados posteriormente en procedimientos quirúrgicos. La utilización de venas y arterias humanas obtenidas de donantes cadavéricos e implantadas en pacientes luego de un procedimiento de C/D, ha mostrado superar las tasas de sobrevida de diversos materiales sintéticos (1,12,13). En diversas partes del mundo, y en nuestro país, estas arterias y venas C/D han sido utilizadas en la reconstrucción de segmentos arteriales, reconstrucción de cavidades cardíacas en alteraciones congénitas y/o para la confección de accesos en pacientes dializados (1,14-17). Se han descrito diversas potenciales ventajas de estos bioimplantes vasculares, en relación con prótesis sintéticas, lo que ha aumentado el interés en su utilización. Entre ellas se destacan las propiedades hemostáticas en los sitios de sutura, la ausencia de trombogenicidad, el aceptable comportamiento hemodinámico, la ausencia de hemólisis y su mayor resistencia a la colonización microbiana.
En numerosos trabajos se han evaluado los efectos del procedimiento de C/D y se han descrito alteraciones en los diferentes componentes estructurales (celulares y extracelulares) de la pared vascular y reactividad del músculo liso y endotelio vascular (1,2,18-22). En cambio, pocos estudios han evaluado los efectos de la C/D en el comportamiento mecánico de los segmentos arteriales a implantar y se desconocen los efectos de la criopreservación/descongelado sobre las funciones arteriales de conducción y amortiguamiento. Asimismo, los resultados de los trabajos que evalúan las propiedades mecánicas de los vasos C/D son controversiales. Langerak y colaboradores (23) no encontraron cambios significativos en la elasticidad, distensibilidad, reclutamiento de colágeno y estrés de quiebre de la aorta torácica descendente humana luego de la criopreservación/descongelado. Pukacki y colaboradores (24), estudiando arterias ilíacas y femorales humanas, no encontraron diferencias en la elasticidad y complacencia de arterias frescas y C/D. Finalmente, Adham y colaboradores (25) y Gournier y colaboradores (26) no hallaron alteraciones de la elasticidad de aortas torácicas descendentes humanas luego de ser sometidas a criopreservación. Contrariamente a estos resultados, Rosset y colaboradores (7), evaluando varios parámetros mecánicos (por ejemplo, complacencia, índice de rigidez, pulsatilidad) de arterias carótidas humanas, encontraron modificaciones de las propiedades elásticas parietales y del área de la relación presión-diámetro arterial (relacionada con la viscosidad arterial), luego de la criopreservación. Adicionalmente, Rigol y colaboradores (18) encontraron alteraciones en las células musculares luego de la criopreservación/descongelado, y Blondel y colaboradores (27) hallaron cambios en indicadores biomecánicos luego de la criopreservación/descongelado de arterias ilíacas humanas.
Las controversias en los resultados obtenidos podrían ser explicadas, al menos en forma parcial, por dos factores:
- Diferencias en el procedimiento de C/D o segmentos vasculares utilizados, o ambos.
- Diferencias en el análisis biomecánico realizado.
En relación con los protocolos de C/D se han utilizado múltiples variables del procedimiento, las que difieren, entre otros factores, en el medio solvente y soluto criopreservante; concentraciones; tiempo de exposición de los tejidos al medio criopreservante; utilización de medios suplementarios; técnicas de enfriamiento (tasas de enfriamiento, temperaturas mínimas, etcétera); técnicas de descongelado (tasas de descongelado) (3). Actualmente, no existen a nivel mundial estándares definitivos para el procedimiento de C/D, por lo que cada banco de tejidos, dentro de pautas-marco internacionales, define el procedimiento de criopreservación a utilizar. Sin embargo, hay evidencias respecto a que los mejores resultados se obtienen con la criopreservación en nitrógeno gaseoso, utilizando dimetilsufóxido como agente criopreservante, y tasas de congelado y descongelado programadas (28). En ese sentido, el protocolo de C/D utilizado en nuestro país, y en el presente trabajo, se ajusta a los protocolos que han evidenciado los mejores resultados.
En relación con las diferencias en el análisis biomecánico, la bibliografía disponible muestra importantes limitaciones a una adecuada valoración mecánica-funcional de los segmentos vasculares C/D. Estas se deben principalmente a:
- Primero: la mayoría de los estudios realizados utilizan “anillos” o “tiras” arteriales (1,2,25,29). Sin embargo, para reproducir las condiciones hemodinámicas de in vivo y preservar la forma e integridad de la pared arterial, indispensable para el análisis de la prótesis como tal, es necesario analizar las propiedades mecánicas de la pared vascular usando segmentos arteriales (23,27).
- Segundo: falta de estudios que evalúen la doble función fisiológica del segmento arterial: conducir sangre y amortiguar la pulsatilidad de flujo y presión arterial (6). La importancia de esta caracterización es evidente, teniendo en cuenta que la utilización de segmentos C/D para reemplazar segmentos vasculares dañados se realiza a fin de mantener la integridad funcional (30), y no solo como material que resista fracturas.
- Tercero: ausencia de estudios dinámicos y pulsátiles que sometan a segmentos arteriales a presiones, frecuencias, flujos, etcétera, que simulen diversas condiciones hemodinámicas reales. Solo mediante estos estudios es posible evaluar el comportamiento mecánico de los segmentos C/D en las condiciones en que se encontrarán una vez implantados. Estos estudios permiten, además, someter al segmento a condiciones hemodinámicas variables y evaluar el comportamiento del segmento arterial frente a condiciones extremas. Teniendo en cuenta que la colocación de una prótesis vascular frecuentemente se indica en pacientes con enfermedades cardiovasculares (por ejemplo, pacientes hipertensos), esto permitiría valorar y predecir el funcionamiento protésico en dichas condiciones. Asimismo, las propiedades arteriales frecuencia o velocidad-dependientes (por ejemplo, viscosidad o inercia parietal) y la capacidad de amortiguar y disipar energía (6,31) solo pueden valorarse adecuadamente mediante estudios dinámicos.
- Cuarto: debido a que la pared arterial presenta una relación presión-diámetro no lineal, que determina que su viscoelasticidad sea presión o distensión-dependiente, la adecuada comparación biomecánica de segmentos arteriales requiere independizarse de estos factores mediante comparaciones isobáricas e isométricas (6,31), las que solo en limitadas ocasiones han sido realizadas.
- Quinto: estudios que identifiquen si las posibles diferencias entre arterias C/D y de pacientes se deben al proceso de C/D y/o al hecho de haber sido ablacionadas y analizadas in vitro. La mayoría de los trabajos que evalúan la C/D utilizan como control a segmentos vasculares frescos, lo que permite evaluar los efectos del proceso de C/D en el comportamiento mecánico, pero la falta de comparación con los segmentos vasculares de pacientes deja planteada la interrogante de la utilidad de los segmentos C/D para ser implantados.
En suma, considerando los antecedentes y el estado actual del conocimiento acerca del tema, es que se propone el presente trabajo. El mismo intenta contribuir a la caracterización de las propiedades mecánicas y funcionales de segmentos arteriales C/D obtenidos en el INDT, así como determinar la relación entre ellas y las de segmentos arteriales de sujetos normotensos e hipertensos. Para ello, la evaluación biomecánica comprendió el estudio de la función de segmentos vasculares mediante estudios dinámicos, isofrecuencia e isobáricos.
MATERIAL Y MéTODO
Para la caracterización biomecánica vascular se evaluó el espesor parietal, el diámetro arterial (D) y la presión intravascular (P), utilizando dos tipos de registros diferentes:
- Registros no invasivos de arterias carótidas comunes (ACC) de pacientes.
- Registros in vitro de homoinjertos arteriales y otros sustitutos vasculares.
ESTUDIOS EN PACIENTES (REGISTROS NO INVASIVOS)
Quince hombres normotensos (edad: 51±11 años) y 15 hipertensos (edad: 50±9 años) fueron examinados en posición decúbito dorsal, luego de diez minutos de reposo. Todas las mediciones se realizaron por un mismo técnico, entrenado para estos registros.
Para la evaluación no invasiva del espesor íntima-media se utilizaron las imágenes ecográficas en modo B de las arterias carótidas. Para ello se examinaron las arterias con un transductor de 7.5 MHz (ATL HDI 5000, Miami Lakes, EE.UU.) hasta visualizar dos líneas paralelas en la pared posterior, correspondientes a las interfases lumen-íntima y media-adventicia. Una vez que las líneas paralelas fueron visibles por al menos 1 cm, se congeló la imagen de fin de diástole y se la transfirió mediante una placa de adquisición de video a una computadora, donde fue almacenada para su posterior análisis. Éste, basado en la densidad de los niveles de gris y en algoritmos específicos de reconocimiento tisular, fue realizado en forma automática por un software especialmente diseñado para estos fines (32,33).
Para determinar el diámetro instantáneo intraluminal, mediante el ecógrafo se visualizó la arteria carótida a estudiar y, simultáneamente, se digitalizaron las imágenes con una computadora. Una vez digitalizada una secuencia de imágenes, el software, utilizando un algoritmo de reconocimiento de bordes análogo al del IMT, permitió calcular la curva de diámetro de un latido promedio y lo almacenó en un archivo de texto (32,33).
La señal temporal de presión (P) se midió utilizando un tonómetro de tipo lápiz (Millar Instruments Inc), el cual posee un transductor de P en uno de sus extremos. Para el registro de la señal de P, se apoyó el tonómetro sobre la superficie de piel adyacente a la arteria carótida y se presionó hasta lograr un aplanamiento arterial. En ese momento, la P medida se aproximó a la intraarterial. Posteriormente la señal se amplificó y digitalizó mediante una PC. Para calibrar la señal, en el momento de la digitalización se registró con un esfigmomanómetro semiautomático (Dinamap Critikon) la presión arterial humeral (braquial) media y diastólica del paciente. Estos valores se le asignaron al valor medio y mínimo de la señal, respectivamente. A partir de la señal tonométrica digitalizada se interpolaron y se promediaron los valores correspondientes a cada latido, de manera de obtener la curva de P de un latido promedio (32,33).
Simultáneamente a los registros ecográficos y tonométricos, se registró un electrocardiograma de superficie, que permitió la sincronización de las señales de P y D (32,33).
ESTUDIOS EN SUSTITUTOS ARTERIALES
(REGISTROS IN VITRO)
De 15 donantes multiorgánicos (edad: 29±5 años), procurados según criterios legales de regulación (ley 14.005), se obtuvieron segmentos de ACC y venas safenas (VS), siguiendo normativas internacionales. Los criterios de exclusión de donantes estuvieron de acuerdo con los estándares de la Asociación Española de Bancos de Tejidos. Segmentos de 5 cm de longitud de cada ACC (izquierda y derecha) y de las venas safenas derechas fueron escindidos (isquemia caliente: 53-60 minutos), lavados y almacenados en solución fisiológica y antibiótica a 4ºC durante 48 horas (isquemia fría). En cada donante se estudiaron un segmento de ACC y las VS en estado fresco. El segmento de ACC restante se estudió luego de C/D, siguiendo el procedimiento descrito en la figura 1.
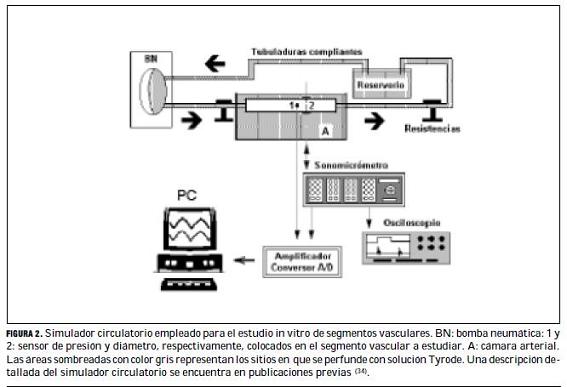
Cada segmento vascular y ocho segmentos de ePTFE (6 mm, Gore-Tex Vascular Graft, W.L. Gore & Associates, Inc., Flagstaff, EE.UU.) se estudió –a la longitud in vivo, para los segmentos vasculares–, en un simulador circulatorio (sistema in vitro) (figura 2). Una descripción detallada del simulador se encuentra en trabajos previos (34).
Los segmentos fueron inmersos y perfundidos con solución Tyrode (oxigenada, 37°C, pH=7,4). Los controles del simulador permitieron ajustar los niveles de frecuencia de bombeo y P, y las formas de onda de P. Para medir P, cada segmento se instrumentó con un microtransductor de estado sólido (Konigsberg Instruments, Inc., Pasadena, EE.UU.). Cada segmento se instrumentó con un par de cristales de ultrasonido y el D se midió mediante sonomicrometría (Triton Technology Inc. San Diego, EE.UU.). Una vez instrumentados, los segmentos se sometieron a formas de onda y niveles de frecuencia, P y flujo, similares a los registrados previamente en los pacientes normotensos e hipertensos. De cada segmento, 30 latidos fueron digitalizados (frecuencia muestreo = 200 Hz), para ser posteriormente analizados.
ANáLISIS DE DATOS
Idéntico análisis se realizó a partir de las señales de P y D obtenidas en los registros no invasivos e in vitro.
FUNCIóN DE AMORTIGUAMIENTO
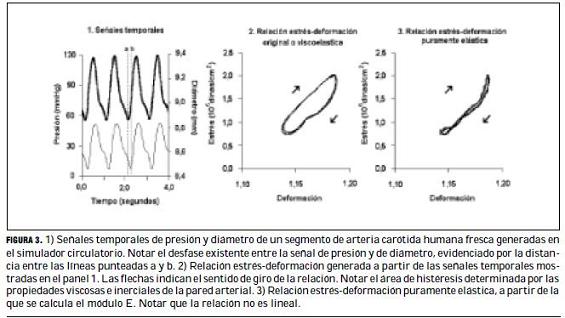
En las arterias de pacientes, evaluadas en forma no invasiva, se obtuvo el espesor parietal mediante el IMT. En los segmentos estudiados in vitro el espesor parietal se cuantificó como la diferencia entre el radio vascular externo (re), obtenido mediante la medición ultrasónica, y el radio interno (ri), calculado con la ecuación 1, donde V es el volumen y L la longitud del segmento estudiado (31). El valor de V se obtiene a partir del valor de masa y densidad del material (31). En todos los casos, la deformación (e) se calculó mediante la ecuación 2, donde Ro es el radio medio existente a una presión estimada de 25 mmHg y R es el radio medio parietal calculado por la ecuación 3 (31).
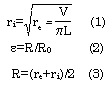
El estrés parietal (s) se calculó como (31):
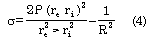
donde P es la presión lateral vascular.
Se utilizó una metodología que permitió evaluar la viscoelasticidad parietal, mediante el análisis de la relación –en el dominio temporal (31)– aplicando un modelo viscoelástico simple (Kelvin-Voigt). La representación física de este modelo contiene un elemento elástico (resorte) y uno viscoso (amortiguador) en paralelo, y permite matemáticamente representar a la pared vascular mediante la ecuación (31):
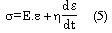
donde E es el módulo elástico, h es el módulo viscoso y de/dt es la primera derivada de la deformación respecto del tiempo. En este análisis, las propiedades inerciales de la pared vascular fueron despreciadas para simplificar la evaluación. A partir de las señales de presión y diámetro (figura 3a), se obtiene el s y la e, y se construye la relación s-e (figura 3b). Dicha relación presenta un área de histéresis, determinada por el retraso, que la viscosidad parietal le impone a la señal de diámetro respecto de la de presión (figura 3a). Seguidamente se calculó separadamente el módulo viscoso y el elástico mediante el método de eliminación iterativa del área de histéresis que consiste en incrementar matemáticamente el valor de h de la ecuación 5, hasta reducir al mínimo el área de la relación s-e (figura 3c) (32). El valor de h alcanzado en ese momento es el módulo de viscosidad (31). A partir de la relación s-e obtenida luego de minimizada el área de histéresis, denominada relación “elástica pura” (figura 3c), puede calcularse el módulo E, para un nivel de deformación o estrés, o ambos, determinado como la tangente de la relación s-e en dicho nivel (31).
Utilizando el modelo de Kelvin-Voigt, la capacidad o función de amortiguamiento parietal (FA) puede calcularse mediante la ecuación (6,35,36):
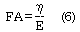
Un elevado valor de FA se relaciona con una mayor capacidad parietal de amortiguar la onda de presión o flujo o ambos (6).
FUNCIóN DE CONDUCCIóN
Finalmente, la evaluación de la capacidad o función de conducción (FC) puede realizarse mediante el cálculo de la impedancia característica (Zc) (6). Conceptualmente una prótesis que imponga baja impedancia (resistencia) al flujo poseerá una elevada FC, consecuentemente la FC puede evaluarse como (6):
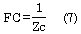
La Zc puede calcularse a partir de las señales de presión y diámetro vascular mediante la ecuación de Water-Hammer (34):
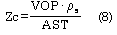
donde la VOP es la velocidad de la onda del pulso, r s la densidad del líquido de perfusión, y AST el área de sección transversal (asumiendo geometría cilíndrica, AST = ri2).
RESULTADOS
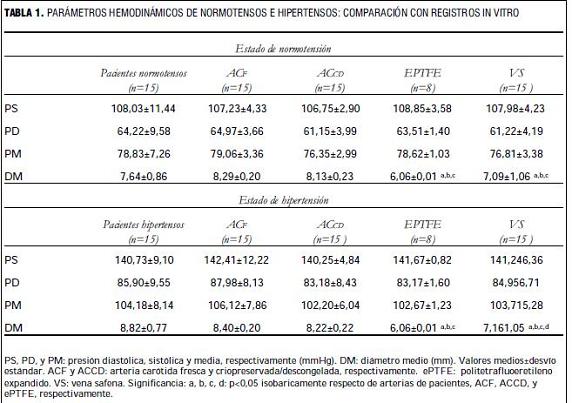
La tabla 1 muestra los parámetros hemodinámicos registrados en sujetos normotensos e hipertensos, y los obtenidos durante las experiencias in vitro. Nótese que los registros, permitieron alcanzar situaciones isobáricas, en niveles de normotensión e hipertensión, para todos los segmentos estudiados (tabla 1).
La figura 3 muestra ondas de presión y diámetro arteriales registradas en un experimento típico, in vitro. Nótese que la morfología de las ondas fue similar a la fisiológica.
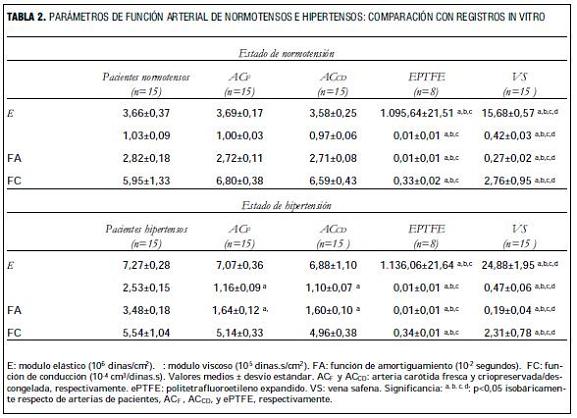
La tabla 2 presenta los parámetros biomecánicos y funcionales registrados en sujetos normotensos e hipertensos, y los obtenidos durante las experiencias in vitro.
Tanto en condiciones de normotensión como de hipertensión, la elasticidad y viscosidad, así como la FA y FC de las ACF y ACCD fue similar.
En condiciones de normotensión, los homoinjertos arteriales ACF y ACCD no mostraron diferencias significativas en viscoelasticidad, FC y FA con las arterias carótidas de pacientes normotensos. En condiciones de hipertensión, los homoinjertos arteriales ACF y ACCD no mostraron diferencias significativas en elasticidad y FC con respecto a las arterias carótidas de pacientes hipertensos, pero sí presentaron diferencias en viscosidad y FA (p<0,05).
Las VS y los segmentos de ePTFE presentaron diferencias en las propiedades mecánicas y capacidad funcional con las arterias de los pacientes, tanto en condiciones de normotensión como de hipertensión. Sin embargo, es de notar que las mayores diferencias mecánicas se encontraron entre los segmentos de ePTFE y las arterias de pacientes, siendo los primeros los segmentos más rígidos (mayor elasticidad) de todos los segmentos evaluados y presentando a la vez una viscosidad prácticamente nula.
DISCUSIóN
En la siguiente discusión se detallarán los principios fisiológicos que fueron tenidos en cuenta al diseñar el estudio, y se analizarán los dos principales resultados de nuestro trabajo:
1. La técnica de criopreservación arterial utilizada permitió mantener incambiada la viscoelasticidad y función de conducción y amortiguamiento arterial de arterias elásticas humanas.
2. Tanto en situaciones de normotensión como de hipertensión, los homoinjertos arteriales fueron los sustitutos que presentaron mayor similitud biomecánica y funcional con las arterias de pacientes.
FUNCIóN DE CONDUCCIóN LOCAL
En el control del flujo de sangre que llega a los lechos periféricos, la resistencia concentrada en la microcirculación –resistencia vascular periférica– juega un rol primordial. Para vencer dicha resistencia al flujo sanguíneo, es necesario que en el territorio arterial existan elevados niveles de P media (5). Consecuentemente, una adecuada FC arterial requiere que éstas impongan mínima resistencia o impedancia al flujo sanguíneo, minimizando así la disminución de la P media (6). Dos características fundamentales de las arterias determinan la baja impedancia al flujo: 1) gran área de sección transversal, y 2) paredes capaces de distenderse durante la eyección ventricular. Teniendo en cuenta ambas características, es posible evaluar la FC de un segmento arterial mediante la impedancia arterial local o característica (Zc), que refiere a la resistencia que un segmento o “anillo” arterial le impone al flujo, y que es determinada por factores geométricos y parietales (6,37,38).
Desde el corazón hacia la periferia, las arterias disminuyen sus diámetros y aumentan su rigidez en forma gradual, de manera que no hay sitios en donde los niveles de FC de segmentos inmediatos presenten grandes diferencias. Diversos trabajos han mostrado que en los sitios donde se producen cambios abruptos de FC (por ejemplo, estenosis arteriales, anastomosis protésico-arteriales), se generan disturbios hemodinámicos que pueden resultar perjudiciales para los segmentos involucrados y/o para el resto del sistema cardiovascular (10,11). En este sentido, cuanto mayor es la diferencia o desacople existente entre la FC (o Zc) de la prótesis implantada y la arteria nativa, menor es el restablecimiento del flujo sanguíneo hacia los lechos periféricos, mayor la probabilidad de sufrir eventos trombóticos y/o hiperplasia intimal en la anastomosis protésico-arterial, y en el caso de prótesis colocadas en grandes vasos, mayor es la poscarga ventricular (10,11,39).
En este contexto, y debido a que nuestros resultados muestran que los homoinjertos ACF y ACCD fueron los que presentaron la mayor similitud en FC con las arterias de pacientes, estos sustitutos serían los que generarían los menores disturbios hemodinámicos, secundarios a desacople de impedancias. Esto ocurrió tanto al compararlos con pacientes normotensos como hipertensos. Consecuentemente, los homoinjertos frescos o criopreservados podrían considerarse una interesante alternativa para la reconstrucción arterial o realización de puentes.Adicionalmente, la FC de las AC de donantes multiorgánicos no presentó diferencias luego del proceso de criopreservación.
Ambos hallazgos demuestran que es posible contar en el INDT con segmentos de arterias elásticas humanas que, luego de ser descongelados, mantienen la capacidad de conducir sangre. Por lo tanto al menos la FC del territorio arterial podría ser restablecida eficazmente mediante la utilización de un homoinjerto C/D.
FUNCIóN DE AMORTIGUAMIENTO LOCAL
La FA de la pared arterial es determinada principalmente por sus niveles de elasticidad y viscosidad. La elasticidad de la pared arterial contribuye al amortiguamiento parietal al permitir que los segmentos arteriales actúen como “reservorios” y “eyectores” sanguíneos. Durante la eyección ventricular cada segmento de las arterias elásticas se distiende y almacena volumen (5). La distensión vascular permite reducir la presión arterial y ventricular sistólica, determinando menor demanda energética ventricular y menor erosión mecánica parietal (5). Durante la diástole el segmento recobra su posición original (disminuye su diámetro) al tiempo que impulsa la sangre previamente almacenada. Este retroceso elástico es gradual y determina que la P arterial diastólica no se reduzca abruptamente y, por consiguiente, que sus valores permanezcan suficientemente elevados para asegurar la perfusión distal (5). Disminuir la P sistólica y mantener elevada la P arterial diastólica permite mantener reducida (amortiguar) la P de pulso arterial. Adicionalmente, la elasticidad contribuye a impedir la sobredistensión y ruptura arterial en situaciones de grandes elevaciones de P o distensión, o ambos (6,40). La elasticidad parietal depende de las propiedades elásticas de los componentes pasivos (elastina y colágeno) y activos (células de músculo liso vascular) (6,31). Estos tres componentes operan de forma tal que la elastina y el músculo liso gobiernan la elasticidad parietal a bajas y medianas P, estando en esas condiciones las fibras de colágeno enrolladas (no estiradas) (6,31). A elevadas P, las fibras de colágeno son estiradas y por ende la elasticidad (rigidez) parietal se incrementa (6,31).
La viscosidad de la pared arterial es una propiedad que determina que la pared se resista de una manera velocidad o frecuencia-dependiente a ser deformada, determinando que la arteria se oponga a cambios rápidos en sus dimensiones. La viscosidad determina que parte de la energía que la onda de P le entrega a la pared arterial no se almacene como energía potencial, sino que se disipe en forma de calor. Así, la viscosidad contribuye al amortiguamiento determinando disipación de energía y, si bien durante mucho tiempo se consideró un componente resistivo despreciable en la función arterial, hoy día se reconoce su importante rol en la función cardiovascular en condiciones fisiológicas y fisiopatológicas (32,41-43). En este sentido, la viscosidad permite atenuar la onda de P que se propaga a través de las paredes vasculares (44), previene el arribo temprano y fenómenos de resonancia causados por las ondas reflejadas que viajan desde la periferia hacia el corazón a partir de sitios de reflexión (45) y/o protegen a la pared arterial de los componentes o armónicos de la onda de P de altas frecuencias, evitando la fatiga temprana de la pared arterial. Al respecto, el incremento en los niveles de viscosidad arterial encontrado en pacientes con hipertensión arterial sistémica (tabla 2) ha sido postulado como un mecanismo de compensación vascular, ante la elevada tensión parietal (32). La viscosidad parietal depende fundamentalmente de las propiedades pasivas de los componentes parietales, principalmente del músculo liso vascular, y de su nivel de activación (31).
Diferencias o desacoples en los niveles de viscoelasticidad, y consecuentemente en la FA, entre los sustitutos arteriales y las arterias nativas, han mostrado provocar importantes perjuicios a nivel de la anastomosis protésico-arterial y del resto del sistema cardiovascular. Por esta razón, se considera que el sustituto arterial “ideal” debe poseer similares niveles de viscosidad y elasticidad que la arteria a la que será anastomosado.
Nuestros resultados muestran que los homoinjertos ACF y ACCD fueron los únicos segmentos estudiados in vitro que no presentaron diferencias significativas en los niveles de elasticidad, viscosidad y FA, respecto de las AC de pacientes normotensos. Cuando fueron comparados con las arterias de hipertensos, las diferencias en viscosidad y FA se hicieron significativas. De todas maneras, las diferencias fueron siempre menores que las existentes entre las VS o ePTFE, y las arterias de pacientes. Considerando los resultados obtenidos podría postularse que contar con homoinjertos ACF y ACCD permitiría reducir el desacople viscoelástico existente actualmente entre los sustitutos vasculares implantados y las arterias nativas.
Otro aspecto importante es que los niveles de viscosidad, elasticidad y FA, no presentaron diferencias entre AC frescas y C/D. Consecuentemente, el proceso de criopreservación permitiría mantener estas propiedades arteriales en valores similares a los de segmentos frescos. Teniendo en cuenta los determinantes de los niveles de elasticidad y viscosidad, puede afirmarse que el procedimiento de criopreservación utilizado no determinó modificaciones de los mismos que determinaran cambios biomecánicos o funcionales de estos constituyentes parietales.
CONCLUSIóN
La técnica de criopreservación arterial utilizada permitió mantener incambiada la viscoelasticidad y función de conducción y amortiguamiento arterial de arterias elásticas humanas. Los resultados permiten objetivar la calidad preimplante de las funciones biomecánicas de las arterias elásticas C/D utilizadas con fines clínicos. La evaluación de segmentos C/D con la metodología de análisis empleada, considerada estándar oro en la caracterización mecánica arterial, permitió al INDT contar con información objetiva que respalda la utilización del insumo terapéutico.
Tanto en situaciones de normotensión como de hipertensión, los homoinjertos arteriales fueron los sustitutos que presentaron mayor similitud biomecánica y funcional con las arterias de pacientes respecto a sustitutos actualmente utilizados. Al menos teóricamente, la implantación de un homoinjerto arterial minimizaría la probabilidad de generar nuevas alteraciones cardiovasculares posimplante, por reproducir en mayor grado la funcionalidad arterial.
La evaluación y el seguimiento posimplante de los homoinjertos son necesarios para obtener conclusiones definitivas acerca de su utilidad para restablecer la función arterial y, por lo tanto, acerca de su utilidad clínica.
AGRADECIMIENTOS
Al Sr. E. Agote, funcionario del Departamento de Fisiología, por su imprescindible cooperación durante la planificación y realización de los experimentos. Al personal del INDT. A los Dres. R. Anzíbar, F. Díaz, Sebastián Laza y María Saldía por sus contribuciones al artículo.
BIBLIOGRAFíA
1. Pascual G, Martínez S, García-Honduvilla N, Corrales C, Bellon JM, Bujan J. Long-term behaviour of cryopreserved arterial grafts versus prosthetic micrografts. Eur J Vasc Endovasc Surg 2004; 27: 423-31.
2. Rendal Vázquez ME, Rodríguez Cabarcos M, Martínez Santos MV, Fernández Mallo RO, Sánchez Ibáñez J, Segura Iglesias R, et al. Functional assessment of cryopreserved human femoral arteries for pharmaceutical research. Cell Tissue Bank 2004; 5: 105-10.
3. Wusteman MC, Pegg DE, Warwick RM. The banking of arterial allografts in the United kingdom. A technical and clinical review. Cell Tissue Bank 2000; 1: 295-301.
4. Álvarez I, Del Carmen Saldías M, Wodowoz O, Pérez Campos H, Machín D, et al. Progress of National Multi-tissue Bank in Uruguay in the International Atomic Energy Agency (IAEA) Tissue Banking Programme. Cell Tissue Bank 2003; 4: 173-8.
5. Nichols WW, O’Rourke MF. Properties of the arterial wall, in Nichols W and Michael F (eds), McDonald’s Blood Flow in Arteries. Theoretical, Experimental and Clinical Principles. 4th edition. London: Edward Arnold, 1998: 54-72.
6. Bia D, Barra JG, Grignola JC, Gines FF, Armentano RL. Pulmonary artery smooth muscle activation attenuates arterial dysfunction during acute pulmonary hypertension. J Appl Physiol 2005; 98: 605-13.
7. Rosset E, Friggi A, Novakovitch G, Rolland PH, Rieu R, Pellissier JF: Effects of cryopreservation on the viscoelastic properties of human arteries. Ann Vasc Surg 1996; 10: 262-72.
8. Tai NR, Salacinski HJ, Edwards A, Hamilton G, Seifalian AM. Compliance properties of conduits used in vascular reconstruction. Br J Surg 2000; 87: 1516-24.
9. Kreienberg PB, Darling III RC, Chang BB, Champagne BJ, Paty PSK, Roddy SP, et al. Early results of a prospective randomized trial of spliced vein versus politetrafluorethylene graft with a distal vein cuff for limb-threatening ischemia. J Vasc Surg 2002; 35: 299-306.
10. Tai NR, Giudiceandrea A, Salacinski HJ, Seifalian AM, Hamilton G. In vivo femoropopliteal arterial wall compliance in subjects with and without lower limb vascular disease. J Vasc Surg 1999; 30: 936-45.
11. Seifalian AM, Tiwari A, Hamilton G, Salacinski HJ. Improving the clinical patency of prosthetic vascular and coronary bypass grafts: the role of seeding and tissue engineering. Artificial Organs 2002, 26: 307-20.
12. Wagstaff SA, Grigg MJ. Arterial homografts: a possible solution to an infective dilemma. Cardiovasc Surg 1996; 4: 796-800.
13. Stanke F, Riebel D, Carmine S, Cracowski JL, Caron F, Magne JL, et al. Functional assessment of human femoral arteries after cryopreservation. J Vasc Surg 1998; 28: 273-83.
14. Anzíbar R, Leone R, Tambasco J, Quiñones O, Nozar JV. Uso de homoinjertos en cirugía cardíaca. Rev Urug Cardiol 2004; 19: 155.
15. Anzíbar R. Use of cardiovascular allograft for correction of congenit cardiopaties or associated pathology, 12 years of experience (PW). 2004. Obtenido de: http: //www.bnut.hc.edu.uy/prog_def.htm. (Consultado 27 octubre 2005).
16. Díaz F, Kamaid E, Bariani M, Giossa W, Suaya H, Álvarez O, et al. Management of arterial cryopreserved homografts in vascular surgery. World Congress on Tissue Banking, 4. Rio de Janeiro, 2005.
17. Forbess JM. Conduit selection for right ventricular outflow tract reconstruction: contemporary options and outcomes.Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2004; 7: 115-24.
18. Rigol M, Heras M, Martínez A, Zurbano MJ, Agusti E, Roig E, et al. Changes in the cooling rate and medium improve the vascular function in cryopreserved porcine femoral arteries. J Vasc Surg 2000; 31: 1018-25.
19. Wusteman MC, Pegg DE. Differences in the requirements for cryopreservation of porcine aortic smooth muscle and endothelial cells. Tissue Eng 2001 Oct; 7: 507-18.
20. Wusteman MC, Pegg DE, Robinson MP, Wang LH, Fitch P. Vitrification media: toxicity, permeability, and dielectric properties. Cryobiology 2002 Feb; 44: 24-37.
21. Herrera B, Eisenberg G, Holberndt O, Desco MM, Rabano A, García-Barreno P, et al. Paradoxical effects of temperature on vascular tone. Cryobiology 2000; 41: 43-50.
22. Arnaud F. Endothelial and smooth muscle changes of the thoracic and abdominal aorta with various types of cryopreservation. J Surg Res 2000; 89: 147-54.
23. Langerak R, Maarten Groenink, Ernst E. van der Wall, Clae Wassenaar, Ed Vanbavel, et al. Impact of current cryopreservation procedures on mechanical and functional properties of human aortic homografts. Transplant Int 2001; 14: 248-2.
24. Pukacki F, Jankowski T, Gabriel M, Oszkinis G, Krasinski Z, Zapalski S. The mechanical properties of fresh and cryopreserved arterial homografts. Eur J Vasc Endovasc Surg 2000; 20: 21-4.
25. Adham M, Gournier JP, Favre JP, De La Roche E, Ducerf C, Baulieux J. Mechanical characteristics of fresh and frozen human descending thoracic aorta. J Surg Res 1996; 64: 32-4.
26. Gournier JP, Adham M, Favre JP, Raba M, Bancel B, Lepetit JC, et al. Cryopreserved arterial homografts: preliminary study. Ann Vasc Surg 1993; 7: 503-11.
27. Blondel WC, Lehalle B, Lercher MN, Dumas D, Bensoussan D, Stoltz JF. Rheological properties of healthy and atherosclerotic human arteries. Biorheology 2003; 40: 369–76.
28. Song YC, Pegg DE, Hunt CJ. Cryopreservation of the common carotid artery of the rabbit: optimization of dimethyl sulfoxide concentration and cooling rate. Cryobiology 1995; 32: 405-21.
29. Vischjager M, Van Gulik TM, Van Marle J, Pfaffendorf M, Jacobs MJ. Function of cryopreserved arterial allografts under immunosuppressive protection with cyclosporine A. J Vasc Surg 1996; 24: 876-82.
30. Park JC, Sung HJ, Lee DH, Park YH, Cho BK, Suh H. Viability of cells in cryopreserved canine cardiovascular organs for transplantation. Yonsei Med J 2000; 41: 556-62.
31. Armentano RL, Barra JG, Levenson J, Simon A, Pichel RH. Arterial wall mechanics in conscious dogs. Assessment of viscous, inertial, and elastic moduli to characterize aortic wall behavior. Circ Res 1995; 76: 468-78 (a).
32. Armentano RL, Graf S, Barra JG, Velikovsky G, Baglivo H, Sanchez R, et al. Carotid wall viscosity increase is related to intima-media thickening in hypertensive patients. Hypertension 1998; 31(1 Pt 2): 534-9.
33. Graf S, Gariepy J, Massonneau M, Armentano RL, Mansour S, Barra JG, et al. Experimental and clinical validation of arterial diameter waveform and intimal media thickness obtained from B-mode ultrasound image processing. Ultrasound Med Biol 1999; 25: 1353-63.
34. Bia D, Armentano RL, Zócalo Y, Barmak W, Migliaro E, Cabrera Fischer EI. In vitro model to study arterial wall dymamics through pressure-diameter relationship analysis. Latin American Applied Research 2005; 35: 217-24.
35. Bia D, Armentano RL, Grignola JC, Craiem D, Zocalo YA, Gines FF, et al. The vascular smooth muscle of great arteries: local control site of arterial buffering function? Rev Esp Cardiol 2003; 56: 1202-9.
36. Bia D, Armentano R, Craiem D, Grignola J, Gines F. Smooth muscle role on pulmonary arterial function during acute pulmonary hypertension in sheep. Acta Physiol Scand 2004,181: 1-8.
37. Li JKJ. The Arterial Circulation. Physical Principles and Clinical Applications. Towota, New Jersey: Humana Press, 2000.
38. Cholley BP, Lang RM, Korcarz CE, Shroff SG. Smooth muscle relaxation and local hydraulic impedance properties of the aorta. J Appl Physiol 2001; 90: 2427-38.
39. Morita S, Asou T, Kuboyama I, Harasawa Y, Sunagawa K, Yasui H. Inelastic vascular prosthesis for proximal aorta increases pulsatile arterial load and causes left ventricular hypertrophy in dogs. J Thorac Cardiovasc Surg 2002; 124: 768-74.
40. Roach MR, Burton AC. The reason for the shape of the distensibility curves of arteries. Can J Biochem Physiol 1957; 35: 681-90.
41. Stefanadis C, Dernellis J, Vlachopoulos C, Tsioufis C, Tsiamis E, Toutouzas K, et al. Aortic function in arterial hypertension determined by pressure-diameter relation: effects of diltiazem, Circulation 1997; 96: 1853-8.
42. Gow BS, Taylor MG. Measurement of viscoelastic properties of arteries in the living dog. Circ Res. 1968; 23: 111-22.
43. Imura T, Yamamoto K, Satoh T, Kanamori K, Mikami T, Yasuda H. In vivo viscoelastic behavior in the human aorta. Circul Res 1990; 66: 1413-9.
44. Fung YC, Fronek K, Patitucci P. Pseudoelasticity of arteries and the choice of its mathematical expression. Am J Physiol 1979; 237: H620-H631.
45. Shadwick RE. Mechanical design in arteries. J Exp Biol 1999; 202: 3305-13.