Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Cardiología
On-line version ISSN 1688-0420
Rev.Urug.Cardiol. vol.20 no.3 Montevideo Nov. 2005
ARTÍCULO ORIGINAL
Dres. Ricardo Armentano, Yanina Zócalo, Juan Barra y colaboradores
Disipación energética y protección vascular durante la hipertensión arterial sistémica: rol del músculo liso
DRES. RICARDO ARMENTANO 1, YANINA ZÓCALO 2, JUAN BARRA 3, BR. DANIEL BIA 4,
BIOING. SEBASTIÁN GRAF 5, MAG. FRANCO PESSANA 6, ING. DAMIÁN CRAIEM7, DR. RAMIRO SÁNCHEZ 8
1. Prof. Honorario del Departamento de Fisiología, Facultad de Medicina Grado 5 PEDECIBA-Biología. Decano de la Facultad de Ingeniería y Ciencias Exactas y Naturales. Universidad Favaloro.
2. Asistente del Departamento de Fisiología, Facultad de Medicina, Universidad de la República.
3. Profesor Asociado e Investigador del Departamento de Ciencias Fisiológicas, Farmacológicas y Bioquímicas de la Universidad Favaloro.
4. Profesor Agregado, ESFUNO-DIBA, Facultad de Enfermería, Universidad de la República. Asistente del Departamento de Fisiología, Facultad de Medicina.
5. Director Departamento de Electrónica. Facultad de Ingeniería y Ciencias Exactas y Naturales. Universidad Favaloro.
6. Director del Departamento de Tecnología de la Información, Facultad de Ingeniería y Ciencias Exactas y Naturales. Universidad Favaloro.
7. Investigador Asistente de la Facultad de Ingeniería y Ciencias Exactas y Naturales, Universidad Favaloro.
8. Jefe del Servicio de Hipertensión Arterial, Hospital Universitario, Fundación Favaloro.
Facultad de Ingeniería y Ciencias Exactas y Naturales. Universidad Favaloro, Buenos Aires, Argentina.
Departamento de Fisiología, Facultad de Medicina, Universidad de la República, Uruguay.
Facultad de Enfermería, Universidad de la República, Montevideo, Uruguay.
Servicio de Hipertensión Arterial, Hospital Universitario, Fundación Favaloro, Buenos Aires, Argentina.
Correspondencia: Dra. Yanina Zócalo. Departamento de Fisiología, Facultad de Medicina, Universidad de la República. General Flores 2125, CP: 11800, Montevideo, Uruguay. E-mail: yana@fmed.edu.uy
RESUMEN
Introducción: las arterias amortiguan las oscilaciones de alta frecuencia de las ondas de presión y flujo disipando energía. El amortiguamiento protege la pared arterial de daños relacionados con dichas oscilaciones.
Objetivo: analizar el rol del músculo liso vascular (MLV) en la protección parietal y disipación energética de arterias carótidas (ACC) de sujetos normotensos, hipertensos e hipertensos tratados con inhibidores de la enzima conversora de angiotensina (ECA).
Métodos: presión (tonometría) y diámetro (ecografía) carotídeos se registraron en sujetos normotensos (n=12) e hipertensos (n=22) asignados aleatoriamente a tratamiento placebo (n=10) o inhibidores de la ECA (ramipril 5-10 mg/día, n=12). Se midió in vitro, presión y diámetro en ACC de donantes (n=14; tono vascular nulo), en condiciones hemodinámicas similares a las de los sujetos. Se calculó para cada latido, usando modelización adaptativa, el índice viscoso, elástico e inercial, la energía disipada (Wh) y el amortiguamiento parietal.
Resultados: en los hipertensos, la Wh fue mayor (p<0,05) que en los normotensos, mientras que la protección parietal fue similar. Solo en los hipertensos tratados, la Wh se acercó a los valores de los normotensos, sin cambiar la protección parietal. En situación de tono nulo (in vitro) la Wh y la protección parietal fueron menores que en los normotensos (p<0,01), evidenciando la dependencia de estos parámetros con el tono muscular.
Conclusión: el sistema arterial mantiene la protección parietal. El MLV protege a la pared disipando energía. En hipertensos, la disipación energética aumenta, y se mantiene el amortiguamiento y protección parietal. La disipación energética puede reducirse (tratamiento), disminuyendo la poscarga ventricular y manteniendo la protección arterial.
PALABRAS CLAVE: ARTERIAS
MúSCULO LISO
HIPERTENSIóN
CIRCULACIóN SANGUíNEA
SUMMARY
Introduction: arteries smooth out the high frequency components of the pressure and flow waves, dissipating energy. The arterial buffering protects the vascular wall from potential damages related to those high frequency components.
Objective: to analyse the role of the vascular smooth muscle (VSM) in the protective effect against high frequency oscillations and in the energy dissipation, of human carotid arteries (CCA) from normotensive subjects, hypertensive patients without treatment, and hypertensive treated with angiotensin converting enzyme (ACE) inhibitors.
Methods: noninvasive CCA pressure (tonometry) and diameter (echography) waveforms were measured in normotensive subjects (n=12) and in hypertensive patients (n=22) randomized into placebo (n=10) or ACE inhibitors (ramipril, 5-10 mg/day during 3 months, n=12). In vitro, pressure and diameter were registered in CCAs (n=14, null tonus) obtained from donors and submitted to haemodynamic conditions similar to those of the in vivo studies. Using adaptative modelling, we calculated, for each beat, the viscous, elastic and inertial indexes; the dissipated viscous energy (Wh) and the wall protection.
Results: in hypertensive patients, Wh was higher (p<0,05) than in normotensive subjects, while the wall protection remained unchanged. Only in the treated hypertensives, Wh was reduced and it was near to the normotensive values, without changes in the wall protection. During the null tonus condition, both, Wh and the wall protection were lower than in the the normotensive subjects (p<0,01). This showed the dependence of those parameters on the VSM tone.
Conclusion: the arterial system keeps the vascular wall protection. The VSM protects the vascular wall, dissipating energy. During hypertension the energy dissipation increases, and the buffering and wall protection is preserved. The energy dissipation can be reduced (treatment), reducing the ventricular charge, at the time the wall protection is kept unchanged.
KEY WORDS: ARTERIES
MUSCLE,SMOOTH, VASCULAR
HYPERTENSION
BLOOD PRESSURE
INTRODUCCIóN
Las grandes y medianas arterias actúan como conductos de baja impedancia al flujo sanguíneo (función conducto), a la vez que amortiguan o filtran las oscilaciones de alta frecuencia de las ondas de presión y flujo determinadas por la actividad pulsátil ventricular (función amortiguamiento o filtro) (1). Asimismo, la baja impedancia al flujo y el amortiguamiento arterial son importantes en el mantenimiento de una poscarga ventricular reducida, un adecuado acoplamiento ventrículo-arterial y un reducido estrés parietal arterial (1). A nivel vascular, el amortiguamiento parietal protege a la pared arterial de potenciales daños relacionados con los componentes de alta frecuencia de la señal de presión.
La función de conducción, como la de amortiguamiento, es esencialmente mecánica y depende fundamentalmente de la geometría arterial y de las propiedades viscoelásticas de la pared de la arteria (1-3). Las propiedades viscosas y elásticas de cada uno de los componentes parietales, sus cantidades absolutas y relativas, y la forma en la que los diferentes componentes se organizan, determinan el comportamiento mecánico de la pared arterial (1). En este sentido, la pared puede considerarse como un material complejo, con componentes principalmente elásticos, como las fibras de colágeno y elastina, y materiales principalmente viscosos, como el músculo liso vascular (MLV). La cantidad y el grado de activación de este último son los principales determinantes del comportamiento viscoso, como lo demuestra el aumento de la viscosidad durante la activación del MLV con fenilefrina o durante estados de hipertensión renovascular (2-4), y la relación entre el incremento en la viscosidad parietal en carótidas y femorales y el aumento del espesor parietal arterial (5,6).
El comportamiento elástico de la pared arterial permite que las arterias actúen como “reservorios” y “eyectores” sanguíneos. Durante la sístole las propiedades elásticas determinan la distensión arterial y el almacenamiento de energía entregada por el ventrículo, la que se devuelve al sistema durante la diástole. La distensión sistólica vascular reduce la presión sistólica arterial y ventricular, disminuyendo la demanda energética ventricular y la erosión mecánica parietal. Asimismo, durante la diástole, el retroceso elástico gradual impulsa la sangre hacia la periferia e impide que la presión arterial diastólica disminuya en forma abrupta, manteniéndola en valores elevados para asegurar la perfusión periférica continua. De esta manera, la elasticidad arterial contribuye al amortiguamiento de la pulsatilidad, determinando una distribución más homogénea de la presión intravascular durante el ciclo arterial. Adicionalmente, parte de la energía entregada por el ventrículo no es almacenada durante la sístole y devuelta en diástole, sino que se disipa o “pierde” en forma de calor en la propia pared arterial (2,7-9). Esta pérdida o disipación de energía depende de las propiedades viscosas parietales, las que determinan que la pared se resista a la deformación de un modo dependiente de la velocidad o frecuencia, evitando cambios abruptos en sus dimensiones. En este sentido, la viscosidad contribuye al amortiguamiento arterial parietal mediante la disipación intraparietal de energía.
Actualmente es reconocido el rol de la viscosidad arterial en la función cardiovascular normal y en diversas situaciones patológicas (6,10). Durante mucho tiempo fue considerado un componente resistivo despreciable en la función arterial (11) y, consecuentemente, su rol en la función de amortiguamiento parietal ha sido poco estudiado. En algunas investigaciones se analiza el fenómeno de amortiguamiento viscoso como un retardo de fase entre las señales de presión y diámetro arterial (1). Un enfoque alternativo es analizarlo como un fenómeno de disipación energética que reduce las oscilaciones de alta frecuencia del sistema (1,7,12-14). Teniendo en cuenta que las vibraciones de alta frecuencia se asocian a mayor probabilidad de daño estructural, el amortiguamiento viscoso protegería a la arteria de la potencial injuria relacionada con los componentes de alta frecuencia de la onda de presión, evitando su transmisión a la señal de diámetro.
Está descrito que el aumento de la activación muscular y el espesor de la pared arterial en la hipertensión arterial puede ser considerado un mecanismo de adaptación tendente a mantener reducidos niveles de estrés circunferencial o deformación arterial (15-18). Más aun, este mecanismo adaptativo podría mantener elevada la capacidad de amortiguamiento o filtrado de las vibraciones (armónicas) de elevada frecuencia presentes en la onda de presión. En este sentido, el MLV ejercería un rol activo en la protección de la pared arterial contra las elevadas frecuencias mediante la modulación de la viscosidad parietal y, por lo tanto, de la energía disipada en la pared arterial. Este potencial “mecanismo adaptativo”, que supone un aumento en la viscosidad parietal y mayor disipación energética, protegería a la pared, pero al mismo tiempo determinaría un incremento en la poscarga ventricular.
Trabajos de nuestro grupo han mostrado que durante la hipertensión arterial tanto el atenolol como el ramipril aumentan la complacencia arterial, pero solo el ramipril incrementa la complacencia en forma independiente de los cambios en la presión (19). Este efecto del ramipril estaría dado por su acción directa sobre las propiedades viscoelásticas de las paredes de las grandes y medianas arterias, y en particular sobre su MLV. Asimismo, en estudios previos se demostró que el tratamiento de pacientes hipertensos con inhibidores de la enzima de conversión de la angiotensina (ECA) presenta efectos beneficiosos en la función arterial (20).
En este contexto, el objetivo del presente trabajo fue evaluar la protección parietal y la disipación energética de la arteria carótida común (ACC) de individuos normotensos, hipertensos no tratados e hipertensos tratados con inhibidores de la ECA, para analizar el rol del MLV en la función de amortiguamiento, protección parietal, y la disipación energética arterial. Para ello se estudió en forma no invasiva la ACC de sujetos normotensos y pacientes hipertensos (antes y después de tres meses de tratamiento con ramipril), y mediante registros in vitro de segmentos de ACC provenientes de donantes multiorgánicos (con tono muscular abolido).
MATERIAL Y MéTODO
Todos los procedimientos se desarrollaron acorde a las normativas éticas de las instituciones participantes.
El diseño del trabajo demandó que el registro del espesor parietal, del diámetro arterial y de la presión intravascular se realizara en dos modalidades:
a) Estudios in vivo no invasivos en individuos normotensos e hipertensos.
b) Estudios in vitro en segmentos de ACC de donantes multiorgánicos.
ESTUDIOS IN VIVO
Se estudiaron 12 individuos normotensos (grupo NTA, 50±13 años de edad, seis mujeres) y 22 pacientes con hipertensión arterial sistémica esencial (grupo HTA, presión arterial sistólica/diastólica entre 140-179/ 90-109 mmHg). Luego de cuatro semanas de reposo farmacológico en las que no se administraron fármacos antihipertensivos, 12 pacientes hipertensos fueron asignados, en forma aleatoria, al tratamiento antihipertensivo (grupo HTA-tratado, 51±7 años de edad, seis mujeres) con ramipril (5-10 mg/día durante tres meses), mientras que los diez pacientes hipertensos restantes recibieron placebo (grupo HTA-placebo, 50±13 años de edad, cinco mujeres). La presión arterial fue registrada utilizando un sistema Dinamap 8100 (Critikon, Tampa, FL, EE.UU.). Los individuos participantes dieron su consentimiento en forma escrita.
Los registros se realizaron con el paciente en posición decúbito dorsal, luego de diez minutos de reposo. Todas las mediciones fueron realizadas por un mismo profesional, especialmente entrenado para este tipo de registros.
DETERMINACIóN DEL ESPESOR PARIETAL (COMPLEJO íNTIMA-MEDIA) Y DIáMETRO ARTERIAL
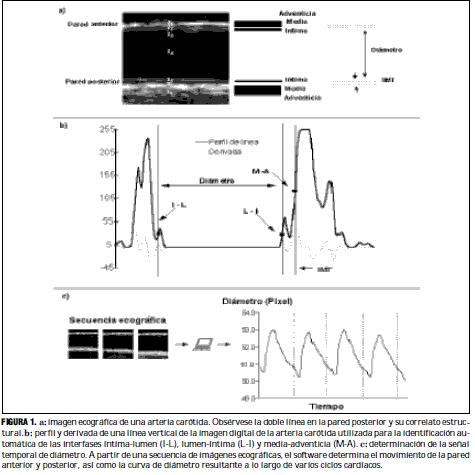
Para la evaluación del espesor íntima-media se utilizaron imágenes ecográficas en modo B (6). Con un transductor de 7,5 MHz (ATL HDI 5000, Miami Lakes, EE.UU.) se examinaron las ACC derechas, a 3 cm de la bifurcación, hasta visualizar dos líneas paralelas en la pared posterior, correspondientes a las interfases lumen-íntima y media-adventicia (figura 1a). Una vez que dichas líneas fueron claramente visibles, por lo menos en una longitud de 1 cm, la imagen se congeló en fin de diástole, y se la transfirió mediante una placa de adquisición de video a una computadora donde se almacenó para su posterior análisis. Éste, basado en la densidad de los niveles de gris y en algoritmos específicos de reconocimiento tisular, se realizó en forma automática mediante un software específico. La figura 1b muestra una línea vertical de la imagen digital de la figura 1a, en la que puede observarse el perfil de los tonos de gris (en una escala de 0 a 255) y su derivada. A partir de los valores máximos de la derivada es posible localizar las interfases íntima-lumen (I-L), lumen-íntima (L-I) y media-adventicia (M-A). De esta manera, el diámetro luminal queda definido como la distancia entre I-L y L-I, mientras que el espesor íntima-media (IMT) queda definido como la distancia que separa a L-I de M-A. Extendiendo el cálculo anterior a toda la imagen, se obtiene un valor promedio del espesor parietal y del diámetro arterial. Para determinar el diámetro instantáneo intraluminal se visualizó la ACC y simultáneamente se digitalizó una secuencia de imágenes en una computadora. Un software específico, utilizando un algoritmo de reconocimiento de bordes análogo al del IMT, permitió calcular la forma de onda de diámetro de un latido promedio, el cual es almacenado en un archivo (figura 1c). Este procedimiento de medición de dimensiones vasculares fue previamente validado mediante estudios que incluyeron su comparación con registros sonomicrométricos (21).
DETERMINACIóN DE LA SEñAL TEMPORAL DE PRESIóN
La señal de presión se registró en el mismo sitio que la del diámetro, utilizando un tonómetro de tipo lápiz (Millar Instruments Inc.), que posee un microtransductor de presión en un extremo, conectado a un amplificador y una computadora mediante una placa de adquisición de señales. Para el registro de la señal de presión se apoya el extremo del tonómetro sobre la superficie de piel adyacente a la arteria carótida. La señal de presión obtenida es luego calibrada usando los valores de presión arterial media y diastólica en la arteria humeral del paciente registrados mediante un esfigmomanómetro semiautomático (Dinamap Critikon). Estos valores fueron asignados al valor medio y mínimo, respectivamente, de la señal obtenida por tonometría (5). A partir de la señal tonométrica digitalizada se interpolaron y promediaron los valores correspondientes a cada latido, de manera de obtener la curva de presión de un latido promedio.
Simultáneamente a los registros ecográficos y tonométricos se registró un electrocardiograma de superficie que permitió sincronizar las señales de presión y diámetro, utilizando el complejo QRS.
ESTUDIOS IN VITRO
Se estudiaron segmentos de ACC de siete donantes multiorgánicos (edad: 30±5 años), obtenidos siguiendo normativas internacionales. Los criterios de exclusión de donantes estuvieron de acuerdo con los estándares de la Asociación Española de Bancos de Tejidos. Una vez expuesta la arteria, se marcó, mediante puntos de sutura en los extremos, un segmento de aproximadamente 6 cm de longitud en cada ACC (izquierda y derecha). Seguidamente los segmentos se escindieron (isquemia caliente: 53-60 min) y sumergieron en solución fisiológica.
Luego de 5-6 días de almacenados, cada segmento de ACC se estudió –a la longitud determinada in vivo– en un simulador circulatorio (sistema in vitro). Los segmentos montados en el simulador quedaron inmersos y se perfundieron con solución fisiológica. Los controles del simulador permitieron ajustar los niveles de frecuencia de bombeo y presión, y las formas de onda de presión. En cada segmento estudiado la presión se registró con un microtransductor de estado sólido (Konigsberg Instruments, Inc., Pasadena, EE.UU.) y el diámetro con un par de cristales de ultrasonido suturados a la adventicia del vaso. El tiempo de tránsito de la señal de ultrasonido entre los cristales se convirtió en distancia mediante un sonomicrómetro (Triton Technology Inc. San Diego, EE.UU.). Los segmentos de ACC se sometieron a formas de onda y niveles de frecuencia y presión similares a las registradas en los pacientes, consignándose en cada uno una serie de 30 latidos a frecuencia de muestreo de 200 Hz.
ANáLISIS DE DATOS
Un mismo procedimiento de análisis se utilizó para los datos obtenidos in vivo e in vitro. Se usó un procedimiento computarizado para determinar la relación presión-diámetro (P-D) y calcular los parámetros mecánicos, utilizando un sistema desarrollado en nuestro laboratorio (3,22). Las señales de presión y diámetro se interpolaron en tiempo para obtener el mismo número de muestras adquiridas y posibilitar los cálculos de un ciclo cardíaco promedio. Para ajustar los datos y calcular los parámetros biomecánicos se usó un modelo lineal Auto Regresivo con entrada eXógena (ARX). A partir del modelo se calcularon los índices elástico (E), viscoso (V) e inercial (M) de la pared.
Considerando que el volumen de la pared arterial no cambia instantáneamente y asumiendo incompresibilidad de la pared arterial (23), la masa de la ACC es más apropiada que el IMT para cuantificar el remodelamiento parietal (24). Por lo cual, se calculó la masa de la ACC como: 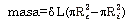
Para un sistema con un único grado de libertad, puede derivarse una ecuación diferencial de segundo orden (25):
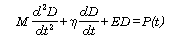
Siendo 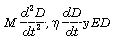 los componentes de presión mecánica relacionados con la masa, viscosidad y elasticidad, respectivamente.
los componentes de presión mecánica relacionados con la masa, viscosidad y elasticidad, respectivamente.
Una medición cuantitativa de la protección parietal puede realizarse utilizando el ancho de banda de la potencia media, derivada de la función “transferencia presión-diámetro en función de la frecuencia”, utilizando diagramas de Bode (26). Considerando este método, previamente utilizado por otros autores, nosotros propusimos evaluar la capacidad parietal de filtrar los armónicos de alta frecuencia presentes en la onda de presión, amortiguando la señal, mediante un nuevo índice (DF):

siendo fC la frecuencia de corte del filtro, cuando se utiliza un modelo de tercer orden, evaluada a -3dB (26).
En los sistemas con amortiguamiento viscoso, la disipación viscosa de energía (27), W en cada pulso (o latido) puede calcularse como (28):
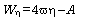
siendo w la frecuencia angular [2p(frecuencia cardíaca)], wh representa el módulo de pérdida (1), y A es el área de sección transversal media.
El estrés circunferencial medio (sM, kPa) se calculó, de acuerdo con la ecuación de Lamé, como:

donde Pm y Dm son la presión y diámetro arterial medios, respectivamente, y h el espesor parietal. En los estudios no invasivos el h se estimó a partir del IMT.
ANáLISIS ESTADíSTICO
Todos los valores se expresaron como valor medio ± desvío estándar. Los efectos intrínsecos (basal) del MLV fueron evaluados mediante comparaciones entre las ACC estudiadas in vitro (tono nulo) y las arterias del grupo normotenso (tono normal) utilizando test de t no pareados. Los efectos de la hipertensión fueron evaluados comparando los valores obtenidos en los grupos NTA e HTA mediante test de t no pareados. Los efectos del tratamiento farmacológico (o con placebo) fueron establecidos mediante test de t pareados entre el grupo tratado y el grupo HTA. Cuando fueron necesarias comparaciones múltiples, se utilizó análisis de varianza para muestras repetidas seguido del test de Bonferroni. En todos los casos un valor de p<0,05 se consideró estadísticamente significativo.
RESULTADOS
La tabla 1 muestra los valores de las variables hemodinámicas e indicadores estructurales de la pared arterial. En la tabla 2 se presentan los parámetros biomecánicos y de función arterial.
ROL DEL TONO MUSCULAR BASAL
El rol del tono del MLV basal en las propiedades mecánicas arteriales se analizó mediante comparaciones entre el grupo NTA y las arterias estudiadas in vitro (ver tablas 1 y 2). En el grupo NTA, el espesor parietal fue mayor (18%, p<0,05), con similar masa por unidad de longitud y un menor diámetro arterial, lo que estaría relacionado con la existencia de tono muscular basal. En relación con las propiedades mecánicas y protección parietal, la activación muscular basal reduce la rigidez elástica (43%, p<0,05), aumenta la viscosidad (112%, p<0,01) y determina una mayor protección arterial evaluada mediante el DF (p<0,05), con similar disipación de energía y menor estrés parietal (35%, p<0,01).
EFECTOS DE LA HIPERTENSIóN ARTERIAL
Comparados los datos de las ACC de los sujetos del grupo HTA con los del grupo NTA, se observa un aumento de la presión, los diámetros arteriales, el espesor parietal (18%, p<0,05), la masa parietal por unidad de longitud (36%, p<0,01), la rigidez elástica (79%, p<0,01) y la viscosidad parietal (82%, p<0,01) (tablas 1 y 2). Adicionalmente, durante la HTA el estrés circunferencial (37%, p<0,01) y la disipación energética (193%, p<0,01) aumentaron respecto del estado NTA, mientras que el DF no presentó modificaciones significativas (tabla 2).
EFECTOS DEL TRATAMIENTO CON RAMIPRIL
Luego de tres meses de tratamiento con ramipril, la presión arterial sistólica y media se redujeron (p<0,05). Adicionalmente, la masa parietal disminuyó (18%, p<0,05), con mantenimiento del espesor parietal. En relación con los indicadores biomecánicos y de protección parietal, luego de tres meses de tratamiento con ramipril, disminuyeron la rigidez elástica (26%, p<0,05), viscosidad (27%, p<0,01), estrés (22%, p<0,05) y disipación energética parietal (49%, p<0.01), en tanto que la protección parietal, evaluada por el DF, se mantuvo sin cambios (tablas 1 y 2).
GRUPO PLACEBO
Luego de tres meses de tratamiento, no se encontraron cambios en el grupo de pacientes con HTA tratados con placebo en ninguna de las variables evaluadas (tabla 3).
DISCUSIóN
El objetivo del presente trabajo fue evaluar la protección parietal y la disipación energética en la ACC de individuos normotensos, hipertensos, e hipertensos tratados durante tres meses con un inhibidor de la ECA, analizando el rol que ejerce sobre estos parámetros el MLV.
CONSIDERACIONES METODOLóGICAS
La dependencia del comportamiento mecánico de la pared arterial con la frecuencia de estimulación debe ser tenida en cuenta para realizar una adecuada evaluación mecánica (1,3). En este sentido, si bien los análisis estáticos (por ejemplo, el test estrés-deformación incremental) permiten evaluar las propiedades mecánicas frecuencia dependientes (por ejemplo, viscosidad), una completa evaluación de las mismas exige la realización de estudios dinámicos en condiciones hemodinámicas similares a las reales. En consecuencia, en este estudio el comportamiento mecánico de la pared arterial se evaluó mediante un análisis dinámico in vivo e in vitro.
Las técnicas utilizadas para el registro de presión y diámetro han mostrado elevada precisión y reproducibilidad (1,5). La metodología de obtención de la onda de diámetro a partir de los registros ecográficos fue previamente validada (6,21).
Para la obtención de los índices elástico, viscoso e inercial, se usó una modelización adaptativa (22). Inicialmente la pared se modeló utilizando un sistema de tercer orden. Posteriormente, considerando que la pared puede ser descrita mediante tres parámetros que representan las propiedades elástica, viscosa e inercial, se propuso una simplificación de segundo orden. Ambos modelos (segundo y tercer orden) no presentaron diferencias en el rango de frecuencias fisiológico, por lo que fue posible, entonces, aceptar la reducción del modelo propuesta, simplificando el análisis.
CONSIDERACIONES FUNCIONALES
Existen dos teorías que intentan explicar el comportamiento viscoso de la pared arterial. La teoría pasiva asigna el comportamiento viscoso a las propiedades intrínsecas pasivas de los materiales que constituyen la pared arterial, reconociendo al MLV como el principal determinante. La teoría activa explica la viscosidad como un fenómeno asociado a todo mecanismo que determine generación de tensión activa en la pared arterial (por ejemplo, la respuesta miogénica) (29).
En los registros in vitro, en la condición de tono muscular nulo, se halló mayor diámetro y menor espesor parietal, lo cual es relacionado con la existencia de tono basal en la condición NTA, que determina reducción del diámetro arterial y aumento del espesor. Asimismo, la menor viscosidad parietal de las ACC registradas in vitro, en comparación con la observada de los individuos normotensos, apoya la dependencia de la viscosidad con la actividad del MLV. La energía disipada fue similar entre los segmentos in vitro y los sujetos normotensos debido a la compensación de la reducción en la viscosidad con el aumento del área de sección transversal en la condición de tono nulo. Por el contrario, el DF, indicador de amortiguamiento y protección parietal fue menor, y el estrés parietal mayor en los registros in vitro, en la condición de tono nulo, que en la condición de NTA. Estos hallazgos sugieren que en el estado basal, el MLV contribuye a mantener una elevada protección parietal y reducido estrés circunferencial en forma eficaz y eficiente, ya que lo hace con baja disipación energética. En este sentido, se mantiene protegida la pared arterial del daño potencial de las armónicas de elevada frecuencia de la señal de presión, pero sin que esto suponga una elevada carga ventricular, optimizando el acoplamiento ventrículo-arterial.
En pacientes hipertensos, el aumento del espesor, diámetros y masa arterial indicarían la existencia de cambios estructurales a nivel parietal (remodelado). Asimismo, durante la hipertensión arterial la rigidez arterial (E), viscosidad y disipación energética fueron mayores. Por el contrario, el amortiguamiento parietal se mantuvo sin cambios significativos respecto de la condición de normotensión. Por consiguiente, las modificaciones arteriales que se producen durante la HTA podrían interpretarse como mecanismos de compensación que posibilitan mantener la protección local de la pared arterial, atenuando las ondas de deformación arterial de corta longitud de onda y elevada frecuencia, del tipo de las oscilaciones naturales de la pared arterial (30), que podrían dañar la pared. Sin embargo, dado el aumento de la disipación energética, la compensación arterial durante la HTA, que resulta beneficiosa para la arteria, supone un mayor costo energético y un incremento de la poscarga ventricular y un subóptimo acoplamiento ventrículo-arterial.
El tratamiento con ramipril (y no el tratamiento con placebo) determinó una reducción del diámetro y masa parietal, a la vez que mantuvo el espesor arterial, con reducción del estrés circunferencial. Asimismo, luego del tratamiento, la viscosidad, elasticidad y energía disipada disminuyeron mientras que la protección parietal se mantuvo. Los resultados obtenidos evidencian que el espesor parietal no sería un indicador adecuado del comportamiento biomecánico y funcional de la pared arterial. La masa parietal, en cambio, podría ser un evaluador de los cambios arteriales durante la HTA, y de los efectos del tratamiento.
Por otra parte, los resultados ponen de manifiesto que la disipación energética arterial puede reducirse, disminuyendo la poscarga dinámica ventricular, manteniendo a la vez la protección arterial local. Esto supondría efectos beneficiosos para el sistema cardiovascular en su conjunto y sería un factor a tener en cuenta en la indicación y monitoreo del tratamiento antihipertensivo.
De acuerdo con trabajos previos, en los que los efectos del ramipril se relacionaron con efectos directos sobre la pared de las grandes arterias, en este trabajo evidenciamos que los efectos en el amortiguamiento parietal en los pacientes hipertensos luego del tratamiento con ramipril, se relacionaron con cambios intrínsecos en la pared arterial (19). Particularmente, la reducción de la disipación de energía luego del tratamiento con ramipril podría explicarse, al menos parcialmente, por cambios en el MLV.
Es posible postular que durante la HTA, el sistema arterial, mediante el control de la cantidad y/o la activación del MLV de la pared vascular (hiperactividad, hiperplasia y/o hipertrofia), mantiene la protección parietal, evitando que los componentes de alta frecuencia presentes en la onda del pulso se transmitan a la onda de diámetro, erosionando de esta manera la pared del vaso (15,18). Considerando que la viscosidad parietal ha mostrado ser un parámetro presión-independiente, sensible a la cantidad y al grado de activación del MLV (2), es posible concluir que los diferentes niveles de viscosidad y disipación energética encontrados en pacientes hipertensos respecto de los hipertensos tratados son determinados por cambios intrínsecos en la pared arterial (y no por las diferencias en los niveles de presión arterial). Esto también podría postularse considerando la mayor masa parietal en los pacientes con HTA y la reducción de la misma luego del tratamiento con ramipril. Estos resultados concuerdan con lo reportado, tiempo atrás, por Mayet y colaboradores (31), quienes describieron que el tratamiento con inhibidores de la ECA reduce la hipertrofia del MLV.
CONCLUSIóN
El mantenimiento de la protección parietal es un objetivo fundamental en el sistema arterial.
El MLV juega un rol central en la protección de la pared arterial, al disipar energía, evitando que los componentes de alta frecuencia de la onda de presión se transfieran al diámetro arterial.
Durante la hipertensión arterial la disipación energética aumenta y el sistema arterial mantiene el amortiguamiento y la protección de la pared, a pesar de las diferencias en las condiciones hemodinámicas. Para ello, modula la cantidad y el grado de activación del MLV presente en sus paredes. Estas modificaciones determinan en forma simultánea un aumento en la poscarga dinámica ventricular.
El tratamiento con ramipril determinó cambios en la geometría y en las propiedades mecánicas arteriales, con reducción de la energía disipada y el mantenimiento de la protección arterial. Los cambios determinados pueden explicarse, al menos parcialmente, por cambios en el MLV.
AGRADECIMIENTOS
A Sanofi-Aventis, por la provisión de ramipril y de placebo. Al Sr. Elbio Agote, por su imprescindible colaboración durante las experiencias in vitro. A la Dra. Inés Álvarez y al Dr. Héctor Pérez Campos, del Instituto Nacional de Donación y Trasplante de Órganos, Tejidos y Células: INDT, (ex Banco Nacional de Órganos y Tejidos).
Este trabajo se realizó en el marco del convenio de cooperación existente entre la Universidad de la República (Uruguay) y la Universidad Favaloro (Argentina). El trabajo fue parcialmente financiado por el Programa para el Desarrollo de las Ciencias Básicas (PEDECIBA/Uruguay), y la Fundación Universitaria Dr. René G. Favaloro (Buenos Aires, Argentina).
GLOSARIO
ACC: arteria carótida común; ECA: enzima de conversión de la angiotensina; HTA: grupo de individuos hipertensos; MLV: músculo liso vascular; NTA: grupo de individuos normotensos; DF: factor de amortiguamiento; Wh: índice de disipación de energía viscosa.
BIBLIOGRAFíA
1. Nichols WW, O’Rourke MF. McDonald’s Blood Flow in Arteries. Theoretical, Experimental and Clinical Principles. London: Edward Arnold, 1998: 101-67.
2. Bia Santana D, Barra JG, Grignola JC, Gines FF, Armentano RL. Pulmonary artery smooth muscle activation attenuates arterial dysfunction during acute pulmonary hypertension. J Appl Physiol 2005; 98: 605-13.
3. Armentano RL, Barra JG, Levenson J, Simon A, Pichel RH. Arterial wall mechanics in conscious dogs. Assessment of viscous, inertial, and elastic moduli to characterize aortic wall behavior. Circ Res 1995; 76: 468-78.
4. Barra JG, Levenson J, Armentano RL, Cabrera Fischer EI, Pichel RH, Simon A. In vivo angiotensin II receptor blockade and converting enzyme inhibition on canine aortic viscoelasticity. Am J Physiol 1997; 272: H859-H868.
5. Armentano R, Megnien JL, Simon A, Bellenfant F, Barra J, Levenson J. Effects of hypertension on viscoelasticity of carotid and femoral arteries in humans. Hypertension 1995; 26: 48-54.
6. Armentano RL, Graf S, Barra JG, Velikovsky G, Baglivo H, Sánchez R, et al. Carotid wall viscosity increase is related to intima-media thickening in hypertensive patients. Hypertension 1998; 31: 534-9.
7. Bertram CD. Energy dissipation and pulse wave attenuation in the canine carotid artery. J Biomech 1980; 13: 1061-73.
8. Bergel DH. The dynamic elastic properties of the arterial wall. J Physiol 1961; 156: 458-69.
9. Murphy RA. Mechanics of vascular smooth muscle. In: Shepherd JT, Abboud FM, eds. Peripheral Circulation and Organ Blood Flow: Handbook of Physiology, the Cardiovascular System. Vol III. Bethesda: American Physiological Society, 1983: 325-51.
10. Stefanadis C, Stratos C, Vlachopoulos C, Marakas S, Boudoulas H, Kallikazaros I, et al. Pressure-diameter relation of the human aorta. A new method of determination by the application of a special ultrasonic dimension catheter. Circulation 1995; 92: 2210-9.
11. Giezeman MJ, VanBavel E, Grimbergen CA, Spaan JA. Compliance of isolated porcine coronary small arteries and coronary pressure-flow relations. Am J Physiol 1994; 267: H1190-H1198.
12. Bodley WE. Energy dissipation in mammalian arteries: an assessment of the distribution of energy dissipation between the blood and the vessel wall. J Biomech 1976; 9: 489-94.
13. Fung YC, Fronek K, Patitucci P. Pseudoelasticity of arteries and the choice of its mathematical expression. Am J Physiol 1979; 237: H620-H631.
14. Taylor MG. Wave transmission through an assembly of randomly branching elastic tubes. Biophys J 1966; 6: 697-716.
15. Glagov S, Vito R, Giddens DP, Zarins CK. Micro-architecture and composition of artery walls: relationship to location, diameter and the distribution of mechanical stress. J Hypertens 1992; 10: S101-S104.
16. Guo X, Kassab GS. Distribution of stress and strain along the porcine aorta and coronary arterial tree. Am J Physiol Heart Circ Physiol 2004; 286: H2361-H2368.
17. Fridez P, Makino A, Miyazaki H, Meister JJ, Hayashi K, Stergiopulos N. Short-Term biomechanical adaptation of the rat carotid to acute hypertension: contribution of smooth muscle. Ann Biomed Eng. 2001; 29: 26-34.
18. Gibbons GH, Dzau VJ. The emerging concept of vascular remodeling. N Engl J Med 1994; 330: 1431-8.
19. Armentano RL, Graf S, Ramírez AJ, Espinosa JD, Brandani L, Baglivo H, et al. Mechanical vs intrinsic components in the improvement of brachial arterial compliance. Comparison of the effects of atenolol versus ramipril in hypertensive patients. Medicina (Buenos Aires) 2001; 61: 535-40.
20. Savolainen A, Keto P, Poutanen VP, Hekali P, Standertskjold-Nordenstam CG, Rames A, et al. Effects of angiotensin-converting enzyme inhibition versus beta-adrenergic blockade on aortic stiffness in essential hypertension. J Cardiovasc Pharmacol 1996; 27: 99-104.
21. Graf S, Gariepy J, Massonneau M, Armentano RL, Mansour S, Barra JG, et al. Experimental and clinical validation of arterial diameter waveform and intimal media thickness obtained from B-mode ultrasound image processing. Ultrasound Med Biol 1999; 25: 1353-63.
22. Gamero LG, Armentano RL, Barra JG, Simon A, Levenson J. Identification of arterial wall dynamics in conscious dogs. Exp Physiol 2001; 86: 519-28.
23. Dobrin PB, Rovick AA. Influence of vascular smooth muscle on contractile mechanics and elasticity of arteries. Am J Physiol 1969; 217: 1644-51.
24. Girerd X, Giannattasio C, Moulin C, Safar M, Mancia G, Laurent S. Regression of radial artery wall hypertrophy and improvement of carotid artery compliance after long-term antihypertensive treatment in elderly patients. J Am Coll Cardiol 1998; 31: 1064-73.
25. Peterson LH, Jensen RE, Parnell J. Mechanical properties of arteries in vivo. Circ Res 1960; 8: 622-39.
26. Desplantez A, Cornu C, Goubel F. Viscous properties of human muscle during contraction. J Biomech 1999; 32: 555-62.
27. Stefanadis C, Dernellis J, Tsiamis E, Diamantopoulos L, Michaelides A, Toutouzas P. Assessment of aortic line of elasticity using polynomial regression analysis. Circulation 2000; 101: 1819-25.
28. Varanasi KK. Models of Damped Systems. In: On the Design of a Precision Machine for Closed-Loop Performance, MS thesis, Chapter 3. Massachusetts Institute of Technology, Cambridge, Massachusetts. 2002.
29. Milnor WR. Hemodynamics. Baltimore, MD: Williams & Wilkins, 1982.
30. Pontrelli G, Rossoni E. Numerical modelling of the pressure wave propagation in the arterial flow. Int J Numer Meth Fluids 2003; 43: 651-71.
31. Mayet J, Stanton AV, Sinclair AM, MacKay J, Shahi M, Foale RA, et al. The effects of antihypertensive therapy on carotid vascular structure in man. Cardiovasc Res 1995; 30: 147-52.