Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.19 no.2-3 Montevideo nov. 2004
REVISIÓN
Estenosis valvular aórtica (parte I)
DRES. NORBERTO TAVELLA 1, DANIEL BARREIRO 2, LEANDRO CURA 3, GUSTAVO VIGNOLO 4
1. Ex profesor de cardiología del Hospital de Clínicas.
2. Cardiólogo.
3. Cardiólogo cirujano.
4. Profesor adjunto de cardiología del Hospital de Clínicas.
PALABRAS CLAVE:
ESTENOSIS DE LA VáLVULA AóRTICA
DISFUNCIóN VENTRICULAR IZQUIERDA
REVISIóN [TIPO DE PUBLICACIóN]
KEY WORDS:
AORTIC VALVE STENOSIS
VENTRICULAR DISFUNCTION, LEFT
REVIEW [PUBLICATION TYPE]
I) INTRODUCCIÓN
La estenosis valvular aórtica ocupa el tercer lugar en frecuencia en el mundo occidental entre las enfermedades cardiovasculares, luego de la hipertensión arterial y la enfermedad coronaria (1).
Un conjunto de avances ocurridos en los últimos años han producido cambios en nuestro encare de la misma de importancia suficiente como para justificar una puesta al día del tema.
Su causa más frecuente es un proceso inflamatorio de naturaleza similar a la aterosclerosis, debido a esto se ha hecho más frecuente entre personas de mayor edad y su presentación clínica es más atípica que lo que se describía clásicamente. Entre los exámenes complementarios, la ecocardiografía Doppler, debido a su sensibilidad y especificidad, ha pasado a tener un lugar principal en la valoración de estos enfermos.
La ergometría, considerada contraindicada durante muchos años, puede hacerse sin riesgo en los pacientes asintomáticos y aporta elementos de gran utilidad con respecto a la conducta. El tratamiento quirúrgico ha confirmado sus excelentes resultados y se han definido con precisión las indicaciones en caso de función normal y alterada.
Dejamos de lado las estenosis supra e infravalvulares, por tratarse de un tema diferente, y nos centraremos en la forma valvular, que puede definirse como el síndrome originado por la obstrucción a este nivel en el tracto de salida del ventrículo izquierdo.
II) FISIOPATOLOGÍA
La disminución del orificio aórtico impone una sobrecarga a la eyección del ventrículo izquierdo, que se compensa generando una presión sistólica mayor y prolongando el período eyectivo. En esta forma se mantienen el vaciamiento del ventrículo y el gasto cardíaco dentro de niveles normales. La pérdida de energía producida por el pasaje a través de la zona estrechada produce una caída de presión que genera un gradiente sistólico entre el ventrículo y la aorta, proporcional a la severidad del obstáculo (2).
El aumento de presión sistólica en el ventrículo izquierdo produce hipertrofia de tipo concéntrico por desarrollo de miofibrillas en paralelo en cada una de las fibras. El estrés inicialmente aumentado por el incremento de la presión se normaliza por el mayor espesor de la pared. La complacencia ventricular izquierda (aumento de volumen/aumento de presión) se reduce por el aumento de la rigidez de la pared y la dificultad de la relajación miocárdica, esto incrementa la presión diastólica final. La aurícula izquierda debe contraerse con más energía por esta sobrecarga y se hipertrofia. La disminución de la complacencia ventricular está en la base de la insuficiencia cardíaca diastólica que se observa en la mayoría de las estenosis aórticas severas (3).
En la estenosis aórtica ocurre isquemia miocárdica por distintos mecanismos, el más sencillo es la existencia de una enfermedad coronaria aterosclerótica asociada, que existe hasta en 56% de los casos. Aumenta con la edad en las distintas series, y en cada una de ellas, cuanto mayor es la edad promedio, se hace más frecuente (4-10).Existe un grupo de pacientes que sin tener obstrucción coronaria tienen isquemia y angina de pecho. Esta situación se ha explicado por el aumento de masa miocárdica, la mayor distancia entre los capilares y la fibra miocárdica, el mayor consumo de oxígeno generado por la elevada presión sistólica, la prolongación del período eyectivo y el menor aporte producido por el acortamiento del período diastólico y la dificultad en la relajación.
La perfusión del ventrículo izquierdo se efectúa preponderantemente durante la diástole, ya que en la sístole la elevada presión intratisural bloquea la circulación. Este fenómeno se hace más marcado en la estenosis aórtica y cualquier proceso que lo comprometa, como la elevada presión diastólica y la relajación alterada, que son capaces de producir isquemia (11).
Las arterias coronarias epicárdicas tienen un calibre mayor en estos pacientes, lo que puede compensar parte de estas alteraciones (12).
Se ha comprobado mediante ecocardiografía Doppler transesofágica, que la perfusión coronaria durante la sístole disminuye en forma marcada y llega a invertirse (13).
La hipertrofia ventricular es un mecanismo de compensación que se acompaña de un mayor consumo de oxígeno por el aumento de masa, pero este aumento del consumo es mayor aun cuando la hipertrofia no es suficiente para normalizar el estrés sistólico en la pared del ventrículo. Esta hipertrofia “inadecuada” produce un pico de presión sistólica mayor con el consiguiente aumento del estrés, lo que aumenta mucho el consumo de oxígeno y produce isquemia por este mecanismo (14).
El aumento desproporcionado de presión en el ventrículo izquierdo inicia un reflejo a partir de barorreceptores subendocárdicos, que produce una súbita vasodilatación periférica y está en la base del síncope de esfuerzo (15).
La sobrecarga de trabajo unida a la isquemia que es preponderante en el sector subendocárdico, provocan degeneración de algunas fibras y claudicación de la función sistólica del ventrículo izquierdo. La elevación de la presión diastólica final del ventrículo izquierdo se transmite a la aurícula izquierda y venas pulmonares, lo que reduce la capacidad pulmonar, produce disnea de esfuerzo progresiva, ortopnea y crisis de edema agudo de pulmón. La hipertensión pulmonar, inicialmente pasiva, se hace activa sobrecargando al ventrículo derecho, que en las fases avanzadas también claudica generando cuadros de insuficiencia cardíaca global con hígado cardíaco e ictericia.
La aparición de síntomas en la estenosis aórtica indica que se han superado los mecanismos de compensación y marca un punto de inflexión en el pronóstico; este momento depende de la severidad de la estenosis aórtica, de la capacidad de compensación cardíaca y de la resistencia periférica.
1) ÁREA VALVULAR
La severidad de la estenosis aórtica puede evaluarse por la relación entre el área valvular aórtica que existe y la que es normal para cada sujeto, este valor es de 3,4 cm2/m2 (16), y se relaciona con el gasto cardíaco normal en condiciones basales que también depende de la superficie corporal y es de 3,6 L/m2 (17).
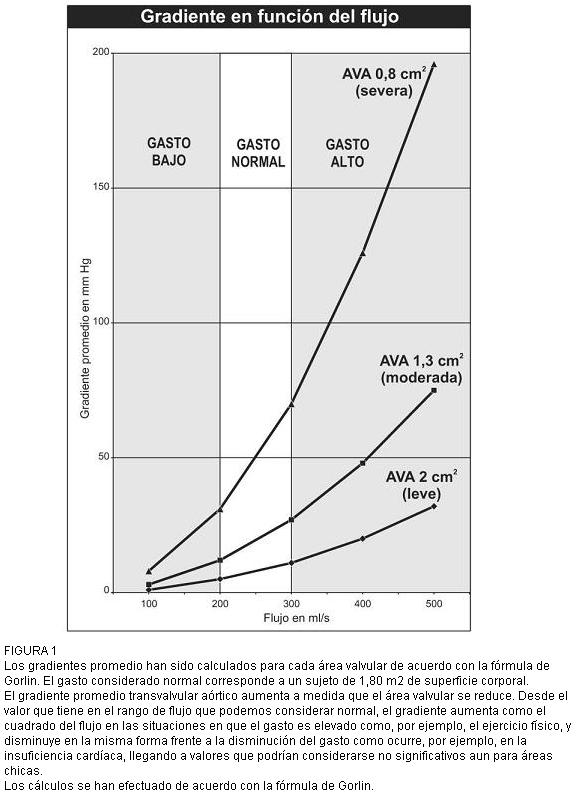
Con un gasto cardíaco normal, el gradiente aumenta en función de la reducción del área valvular aórtica y por esa razón se lo usó para definir la severidad de la estenosis, pero los cambios de flujo valvular lo modifican en forma importante, como puede calcularse de acuerdo con la fórmula de Gorlin* y como se ve en la figura 1.
Para determinada área un aumento de flujo, como el que ocurre en un ejercicio normal, determina un aumento del gradiente proporcional al cuadrado del incremento y una disminución, como puede verse en la insuficiencia cardíaca, que lo reduce a niveles aparentemente no significativos (figura 1). En esta situación es necesario calcular el área para tener idea de la severidad del proceso. El área valvular aórtica no permite anunciar en forma segura la aparición de síntomas, ni siquiera cuando ésta se normaliza para la superficie corporal (14).
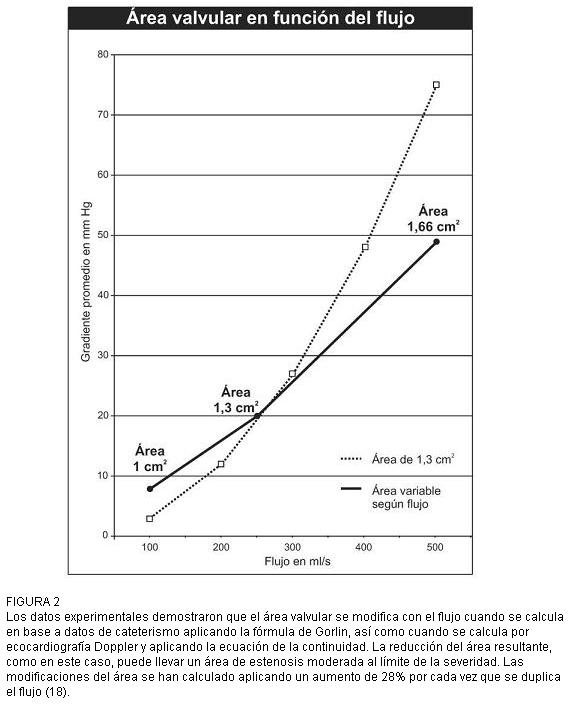
La causa de este fracaso es la incidencia de los otros factores y el hecho de que las dimensiones de la válvula varían con el flujo. Esta variación ocurre aplicando cualquiera de los métodos usados para determinarla, a saber, el método de Gorlin, midiendo gasto y gradiente por cateterismo y la aplicación de la ecuación de continuidad a las medidas de ecodoppler (15-17). Cuando el flujo aumenta, el área valvular aumenta por distensión real de las estructuras y por imprecisiones de las fórmulas simplificadas que se usan en ambos casos (figura 2) (18).
2) RESISTENCIA PERIFéRICA
La resistencia periférica también constituye un factor que aumenta la poscarga del ventrículo izquierdo. Históricamente se ha considerado de menor importancia en los pacientes con estenosis valvular aórtica, ya que se consideraba que una estenosis severa era incompatible con hipertensión arterial. Este concepto no es verdadero, y ha podido establecerse que los pacientes hipertensos llegan a la descompensación con áreas valvulares significativamente mayores que los normotensos (19), indicando que ese factor está contribuyendo a la descompensación.
En la insuficiencia cardíaca inducida por estenosis aórtica existe un aumento de resistencia periférica que puede ser controlado mediante la administración intravenosa de nitroprusiato (20), que ayuda a compensar la insuficiencia.
Estos dos ejemplos son suficientes para destacar la importancia de la resistencia periférica.
3) FACTOR MIOCáRDICO
El miocardio compensa con su hipertrofia la sobrecarga de trabajo que impone la estenosis aórtica. Cualquier factor que comprometa su eficiencia, como puede ser la isquemia producida por una enfermedad coronaria concomitante, adelantará la descompensación. Cuando la hipertrofia produce un aumento del espesor de la pared capaz de normalizar el estrés sistólico, hablamos de hipertrofia adecuada, si no es capaz de hacerlo la hipertrofia es inadecuada y en ella la presión sistólica, el estrés y la isquemia son mayores.
III) ETIOPATOGENIA
Existen muchas etiologías de la estenosis valvular aórtica que se encuentran bien resumidas en todos los textos. En nuestro análisis estudiaremos la estenosis aórtica reumática por su importancia histórica y la estenosis valvular calcificada “degenerativa”, por su frecuencia y por la interesante discusión que existe con respecto a su patogenia.
1) ESTENOSIS AóRTICA REUMáTICA
La estenosis aórtica reumática era la forma etiológica más frecuente en la primera mitad del siglo XX (21).
En un estudio anatómico publicado en 1978, sólo la tercera parte de los casos se atribuyen a esta etiología (22) y en los años de 1990 constituyen sólo 1% (23). Este cambio dramático en la etiología de la estenosis aórtica ha ocurrido en el mundo occidental como resultado de la mejoría de las condiciones socioeconómicas y de higiene, que han hecho disminuir en forma significativa la fiebre reumática (24-30), y del aumento en la expectativa de vida, que ha hecho posible que se manifiesten otras formas etiológicas vinculadas con la edad.
FIGURA 1
Los gradientes promedio han sido calculados para cada área valvular de acuerdo con la fórmula de Gorlin. El gasto considerado normal corresponde a un sujeto de 1,80 m2 de superficie corporal.
El gradiente promedio transvalvular aórtico aumenta a medida que el área valvular se reduce. Desde el valor que tiene en el rango de flujo que podemos considerar normal, el gradiente aumenta como el cuadrado del flujo en las situaciones en que el gasto es elevado como, por ejemplo, el ejercicio físico, y disminuye en la misma forma frente a la disminución del gasto como ocurre, por ejemplo, en la insuficiencia cardíaca, llegando a valores que podrían considerarse no significativos aun para áreas chicas.
Los cálculos se han efectuado de acuerdo con la fórmula de Gorlin.
Algunas características permiten identificar la estenosis reumática: la presencia de fusión comisural, los nódulos de Aschoff en la microscopia, y su frecuente asociación con la afección reumática de la válvula mitral (22).
Los pacientes difieren también en su presentación clínica ya que se hacen sintomáticos a una edad menor, promedialmente a los 48 años (31), y muestran una menor tendencia a la progresión de la obstrucción (32).
2) ESTENOSIS AóRTICA CALCIFICADA “SENIL”
Actualmente la gran mayoría de las estenosis valvulares aórticas que vemos en nuestro país son aisladas, calcificadas, del tipo que se ha descrito como “degenerativa”, y se localizan en válvulas bicúspides o tricúspides. Varias teorías han intentado explicar la génesis de la enfermedad.
a) Teoría del estrés mecánico
La calcificación de la válvula aórtica, descrita por Monckeberg en 1904, fue atribuida a la sobrecarga producida por el trabajo (wear and tear), que provocaría una rotura de las fibras colágenas en los puntos de mayor estrés que secundariamente se calcificarían (33).
El inicio de las lesiones en los puntos de flexión de las valvas, así como la precocidad del desarrollo de la enfermedad en las válvulas, que por ser bicúspides soportan una sobrecarga mayor, apoyaría esta interpretación (10). Variaciones mínimas en el tamaño de las cúspides aórticas que aumentan el estrés, pueden ser responsables del mismo proceso en válvulas tricúspides (34).
La teoría de la sobrecarga mecánica no excluye otras interpretaciones ya que está bien establecido que en algunos procesos, como la aterosclerosis, existen factores que localizan un proceso general en determinados puntos del aparato circulatorio. La aceptación de la teoría del estrés mecánico implica que estamos frente a un proceso de envejecimiento inevitable sobre el que no podemos actuar.
El envejecimiento normal de las valvas produce un aumento de células adiposas entre la capa fibrosa y la ventricularis, disminución del espesor de la esponjosa y engrosamiento a nivel de los nódulos de Arancio sin repercusión funcional. Difiere de las lesiones estenóticas en que no tiene células inflamatorias, lípidos extracelulares, colágeno, elastina ni calcio (35).
b) Teoría aterosclerótica
La teoría que despierta mayor interés en el momento actual establece que el proceso que da inicio a la calcificación valvular es activo, de naturaleza inflamatoria, y muy similar a la aterosclerosis.
Las lesiones iniciales de la estenosis valvular aórtica calcificada se presentan macroscópicamente como engrosamientos subendoteliales que asientan en el lado aórtico de la valva. La membrana basal está rota por debajo del endotelio y entre éste y la lámina elástica interna, que está desplazada, hay una acumulación de lípidos extracelulares, proteínas y células. La zona fibrosa vecina a la lesión también está espesada e infiltrada con lípidos, proteínas y depósitos cálcicos.
FIGURA 2
Los datos experimentales demostraron que el área valvular se modifica con el flujo cuando se calcula en base a datos de cateterismo aplicando la fórmula de Gorlin, así como cuando se calcula por ecocardiografía Doppler y aplicando la ecuación de la continuidad. La reducción del área resultante, como en este caso, puede llevar un área de estenosis moderada al límite de la severidad. Las modificaciones del área se han calculado aplicando un aumento de 28% por cada vez que se duplica el flujo (18).
Las células que se encuentran en la lesión son macrófagos, células espumosas y linfocitos T. Existen también células con proteínas contráctiles, algunas células musculares lisas y mioblastos. Estas células de tipo inflamatorio están en la superficie de la lesión mientras en la parte profunda predominan las zonas calcificadas (36).
El aspecto de las lesiones iniciales de la estenosis valvular aórtica es claramente de naturaleza inflamatoria y similar a las etapas iniciales de la aterosclerosis, como ellas, ocurre en sectores en que se rompe la membrana basal; existe un gran acúmulo de lípidos, macrófagos y linfocitos T y en ambos casos existe injuria endotelial como factor precipitante. La cantidad de células lisas es menor y la calcificación mayor en la topografía valvular en la que no hay neovascularización, pero estas diferencias no son esenciales (figura 3) (33-38).
La asociación entre estenosis aórtica y enfermedad coronaria aterosclerótica tiene una frecuencia mayor que la que cabría esperar por simple asociación (39).
La frecuencia de enfermedad coronaria aumenta con la edad, como en la población general, pero en la estenosis que asienta en válvulas tricúspides es independiente de ella (10), es decir, tiene una frecuencia mucho mayor.
Roberts, analizando el síndrome de la calcificación cardíaca senil, atribuye la estenosis aórtica y mitral a un proceso de naturaleza aterosclerótica (39).
Otro elemento sugestivo es que la enfermedad coronaria aterosclerótica y la estenosis aórtica calcificada tienen los mismos factores de riesgo, entre los que se han identificado la edad, el sexo masculino, la lipoproteína (a), el colesterol, la altura, la hipertensión arterial, el hábito de fumar y la diabetes (40-42).
Pacientes con hipercolesterolemia familiar homocigota, que tienen niveles de colesterol sanguíneo de 500 mg/dl, tienen manifestaciones de cardiopatía isquémica y de estenosis aórtica en la adolescencia (43). Las lesiones producidas por este trastorno metabólico extremo han sido descritas como aterosclerosis maligna, las válvulas tienen depósitos de lípidos, células inflamatorias y calcio, ocasionados en muy corto tiempo. En la hipercolesterolemia familiar heterocigota, en la que las cifras de colesterol total no son tan elevadas, ocurre el mismo proceso en un período mayor (44).
c) Teoría de la enfermedad calcificante
En determinadas circunstancias aparece una tendencia a la calcificación en los tejidos que afecta también a la válvula aórtica, aumentando la frecuencia de estenosis valvular aórtica. Enfermedades poco frecuentes, como el hiperparatiroidismo (45) o la enfermedad de Paget (46), tienen este efecto.
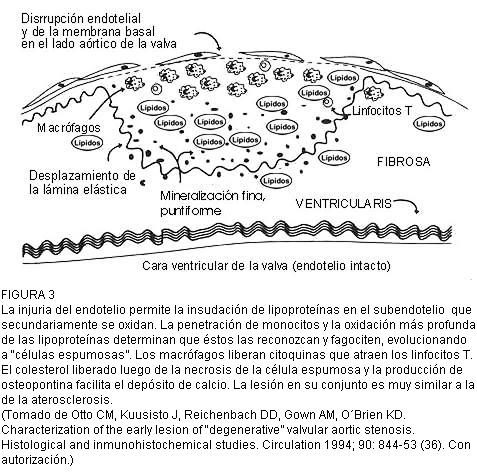
FIGURA 3
La injuria del endotelio permite la insudación de lipoproteínas en el subendotelio que secundariamente se oxidan. La penetración de monocitos y la oxidación más profunda de las lipoproteínas determinan que éstos las reconozcan y fagociten, evolucionando a “células espumosas”. Los macrófagos liberan citoquinas que atraen los linfocitos T. El colesterol liberado luego de la necrosis de la célula espumosa y la producción de osteopontina facilita el depósito de calcio. La lesión en su conjunto es muy similar a la de la aterosclerosis.
(Tomado de Otto CM, Kuusisto J, Reichenbach DD, Gown AM, O´Brien KD. Characterization of the early lesion of “degenerative” valvular aortic stenosis. Histological and inmunohistochemical studies. Circulation 1994; 90: 844-53 (36). Con autorización.)
La osteoporosis senil y la insuficiencia renal crónica constituyen los ejemplos más frecuentes de lo mismo. En los pacientes dializados es muy frecuente la estenosis aórtica y la enfermedad coronaria; en ellos existen trastornos del metabolismo fosfocálcico, tendencia a la calcificación de los tejidos y un tipo especial de dislipemia, que asociado a un estado de inflamación generalizado puede encontrarse en la base de un proceso aterosclerótico precoz que afecte arterias y válvulas (47-52). El riesgo es tan importante que se han iniciado estudios randomizados en base a estatinas a los efectos de prevenir estos efectos (53).
La demostración de la tendencia a la calcificación no debe considerarse como excluyente de las otras teorías sino como complementaria (10).
IV) CLÍNICA
ETAPA ASINTOMáTICA
Las formas leves, moderadas y las severas en su etapa inicial, son habitualmente asintomáticas. El diagnóstico es útil para controlar adecuadamente al paciente y establecer el pronóstico.
Los signos típicos de estenosis aórtica están bien descritos en todos los textos de cardiología. Se ausculta un soplo sistólico eyectivo, áspero, con epicentro en foco aórtico, irradiación subclavicular y a vasos del cuello así como hacia el ápex, donde su tonalidad es más aguda. El segundo ruido es poco intenso o está ausente y el pulso carotídeo es parvus y tardus. Esta forma de presentación es muy específica pero poco sensible, de modo que si esperamos encontrarla la diagnosticaremos pocas veces (54).
El soplo sistólico es un elemento constante, pero puede ser poco intenso o auscultarse en lugares atípicos como el ápex, lo que conduce a errores diagnósticos. Cuando es intenso se relaciona con la severidad, pero la inversa no es cierta. El hecho de que la estenosis aórtica sea más frecuente en pacientes añosos ha aumentado el porcentaje de formas clínicas atípicas.
Cuando hay dudas con respecto al origen del soplo, la disminución o desaparición del segundo ruido y la potenciación posextrasistólica apoyan el origen aórtico. El pulso parvus y tardus era típico de la forma de etiología reumática que ocurría en jóvenes; en la forma calcificada de los añosos es poco frecuente debido a la asociación con hipertensión arterial o aterosclerosis (55).
Frente a estas dificultades diagnósticas es aconsejable ser amplio en la indicación de ecocardiografía, que debería hacerse siempre que la intensidad del soplo fuera de tres o más o se acompañara de disminución de R2.
ETAPA SINTOMáTICA
Cuando aparecen los síntomas de estenosis aórtica hay un cambio en el pronóstico que obliga al clínico a identificar bien esta etapa.
La disnea de esfuerzo es el síntoma más frecuente y el que aparece primero, puede ser una disnea franca o una sensación poco definida de molestia, o de incapacidad para el esfuerzo.
La causa más frecuente es una presión diastólica final elevada en el ventrículo izquierdo por lo que debe considerarse como una insuficiencia cardíaca diastólica (3).
Es comprensible que una fibrilación auricular en este contexto pueda precipitar una descompensación aguda, lo mismo que la anemia o la fiebre.
La angina de pecho es el segundo síntoma en frecuencia en la estenosis aórtica y se presenta con una frecuencia variable en las distintas series, está en relación con la edad promedio de las mismas. En nuestra serie de 373 casos de pacientes con estenosis aórtica a quienes se les hizo cateterismo cardíaco, y una historia clínica completa, el angor apareció en 163 pacientes (44%) y su frecuencia aumentó en forma significativa con la edad (9a, 9b). La presencia del síntoma predice la existencia de enfermedad coronaria en forma significativa.
La ausencia de angor, en cambio, no permite excluir la enfermedad coronaria, el valor predictivo negativo es solo de 53% y resultó, de acuerdo con el teorema de Bayes, de una sensibilidad baja del síntoma y la elevada prevalencia de la enfermedad (tabla 1).

Se ha tomado como criterio de enfermedad coronaria la comprobación de disminución del diámetro de 50% o más. Se estudió la capacidad del angor para predecir la existencia de estas lesiones resultando una sensibilidad baja (53%) y especificidad mayor (68%). El bajo valor predictivo negativo (53%) no permite excluir lesiones por este criterio (9a).
Existe, como puede apreciarse, un grupo importante de pacientes que tiene angor sin tener lesiones coronarias (53/163 = 32%). Este grupo tiene un gradiente significativamente mayor que los que tienen lesiones coronarias. Este hallazgo coincide con la interpretación del angor como resultado de tensión parietal exagerada, por hipertrofia inadecuada.
El grupo de pacientes que con enfermedad coronaria significativa y estenosis aórtica, factores ambos que producen isquemia miocárdica, y que sin embargo no tienen angor, probablemente sean representantes de isquemia silente (tabla 1).
El síncope de esfuerzo es un síntoma tardío y bastante característico de la estenosis aórtica. Se ha atribuido a arritmias ventriculares severas o bloqueos cardíacos precipitados por el esfuerzo. También lo puede explicar un aumento de la presión de un grado tal que aun un ventrículo con función sistólica normal no puede mantener.
El ejercicio por sí produce una vasodilatación muscular que se compensa por un aumento del gasto cardíaco que en el caso de la estenosis aórtica está limitado.
Otra explicación es la existencia de un reflejo originado en un barorreceptor ventricular que produce una vasodilatación súbita (15).
La aparición de arritmias no está considerada como síntoma en la estenosis aórtica. Algunos autores han comenzado a incluirla y nos parece correcto, siempre y cuando sean arritmias de jerarquía o de repercusión en la función (56); la sobrecarga de la aurícula izquierda puede precipitar una fibrilación auricular que a su vez compromete la función.
Los síntomas pueden ser vagos: molestia indefinida, inestabilidad, y tanto el médico como el paciente no saben a qué atribuirlos, en esa situación una prueba ergométrica puede ayudar a definir la situación.
La hipertensión pulmonar aparece en las etapas terminales de la evolución de la estenosis aórtica y se asocia con deterioro clínico y una elevada frecuencia de muerte súbita (57). Se ha demostrado en 29% de los cateterismos cardíacos que se hacen previamente a la cirugía (58), y aunque en una época se sostuvo que tenía escasa trascendencia pronóstica, actualmente se la reconoce como un predictor independiente de mortalidad quirúrgica, pese a ello su presencia no contraindica la intervención, ya que los beneficios compensan el riesgo (59).
V) VALORACIÓN PARACLÍNICA
ELECTROCARDIOGRAMA
La gran mayoría de los pacientes con estenosis aórtica severa tienen signos electrocardiográficos de hipertrofia ventricular izquierda, y estos cambios son más frecuentes cuanto mayor es el gradiente. Es importante destacar que un trazado normal no excluye esta enfermedad (60). En muchos ocurren, además, cambios del ST-T, que indican sobrecarga ventricular izquierda.
La disminución de la complacencia que acompaña a la hipertrofia ventricular izquierda determina un aumento de la presión diastólica final, lo que produce hipertrofia auricular izquierda que se registra en el electrocardiograma (61).
Pueden aparecer diferentes trastornos del ritmo, bloqueos de rama y bloqueos auriculoventriculares, que requieren la implantación de marcapasos.
No es rara la fibrilación auricular que tiene consecuencias hemodinámicas perjudiciales debido al aumento de la presión diastólica del ventrículo izquierdo, que hace más necesaria la sístole auricular.
RADIOLOGÍA
La radiología permite evaluar la hipertrofia ventricular izquierda, la dilatación posestenótica de la aorta y la calcificación valvular. En la etapa compensada de la estenosis aórtica, la hipertrofia concéntrica se manifiesta en la radiografía de frente por un redondeamiento del arco inferior del borde izquierdo del corazón. En la etapa descompensada el ventrículo izquierdo se dilata y aparece congestión venosa pulmonar.
La dilatación posestenótica de la aorta puede verse en la placa de frente, es raro que no exista y su ausencia lleva a plantear una topografía no valvular de la estenosis (62).
La calcificación valvular se ve en aquellas incidencias en que la válvula no se superpone a la columna y con mayor facilidad con la fluoroscopía. Su presencia es constante luego de los 40 años.
La tomografía computada aporta datos en el diagnóstico de la estenosis aórtica, pero no es un examen de primea línea debido a las limitaciones que impone la motilidad cardíaca, a un examen que requiere 100 milisegundos para obtener una imagen. Permite demostrar la hipertrofia ventricular izquierda, la dilatación posestenótica de la aorta y la existencia de calcio en la válvula y el anillo, así como su distribución (63).
ECOCARDIOGRAFÍA
La ecocardiografía se ha constituido progresivamente en la técnica fundamental para el diagnóstico y seguimiento de los pacientes con valvulopatías, desplazando al cateterismo cardíaco y la fonomecanocardiografía.
Sus características de estudio no invasivo, fácilmente reproducible, y con criterios de sensibilidad y especificidad, incluso superiores a otras técnicas, la han transformado en la herramienta ideal.
Refiriéndonos específicamente a los pacientes con estenosis aórtica, la ecocardiografía permite realizar un diagnóstico de valoración anatómica, de situación hemodinámica y de repercusión funcional.
a) Valoracion anatómica
La válvula normal está constituida por un anillo fibroso, que sirve de sostén, y tres velos denominados valvas sigmoideas que ocupan un área de 3 cm2 a 4 cm2. Cuando la válvula abre, estos velos quedan paralelos a la pared aórtica con una separación normal de aproximadamente 2 cm entre sus cúspides.
Debajo de la válvula aórtica se encuentra el tracto de salida del ventrículo izquierdo (TSVI) constituido por el septum interventricular y la valva anterior de la mitral. La patología que afecta al TSVI no es materia de este capítulo, pero no podemos ignorar que la misma puede distorsionar o confundir la interpretación de los resultados.
Situaciones como:
- hipertrofia ventricular izquierda obstructiva;
- membrana subaórtica fija;
- o el movimiento anterior sistólico de la válvula mitral.
pueden ocasionar obstrucciones fijas o dinámicas que confunden o dificultan la valoración de la patología valvular aórtica.
En la evaluación anatómica de la válvula se valora el diámetro del anillo, el número de valvas y su movimiento de apertura, y el aspecto morfológico de las mismas.
Número de valvas: la válvula normal es tricúspide, una válvula congénitamente alterada puede ser bicúspide (más frecuente) o unicúspide (muy poco frecuente).
Apertura valvular: la apertura normal es de unos 20 mm aproximadamente. Medir la apertura valvular es un dato orientador, pero no define criterios específicos de severidad. Con el modo M una apertura mayor a 12 mm plantea estenosis leve, y menor a 8 mm estenosis severa.
Con el modo bidimensional se puede utilizar la planimetría para trazar el área de apertura valvular. Es un método discutido en su confiabilidad, aunque trabajos recientes (64) con equipos modernos demostraron una sensibilidad de 75% y buena correlación con otros métodos, por ejemplo, concordancia de r 0,90 con la ecuación de continuidad, y r 0,98 con planimetría por ecocardiograma transesofágico (ETE), y r 0,89 con ecuación de Gorlin.
Aspecto morfológico: podemos describir si existe engrosamiento, fibrosis, calcificación, fusión de comisuras o doming.
Con este análisis morfológico de la válvula aórtica y los antecedentes del paciente podemos definir la etiología de la estenosis:
a) Congénita: se observa en niños y adultos jóvenes en quienes se diagnostica una válvula aórtica unicúspide (muy rara) o bicúspide (predominante), con sigmoideas no engrosadas y movimiento de apertura limitado, generando la clásica apertura en domo o cúpula con desvío de las cúspides hacia el centro de la aorta, por fusión congénita de alguna de las comisuras. La gravedad de la estenosis depende del gradiente generado y los síntomas. Algunos casos en la infancia pasan desapercibidos o sin tratamiento al ser leves, pero favorecen la asociación con un proceso degenerativo precoz de la válvula en etapas tempranas de la vida (menor de 70 años) (65,66).
b) Inflamatoria: afecta fundamentalmente a los pacientes que han padecido fiebre reumática en su niñez o juventud. El proceso inflamatorio crónico a nivel cardiovascular se limita a las válvulas cardíacas, mayormente las válvulas mitral y aórtica, con engrosamiento, fusión de comisuras, y progresiva disminución del área de apertura.
c) Degenerativa: es la característica calcificación senil que se produce sobre válvulas normales, o previamente alteradas. El proceso de calcificación se produce desde la base hacia la cúspide, aumentando la rigidez de los velos valvulares con la correspondiente disminución de la apertura valvular. Es la etiología más frecuente en pacientes mayores de 70 años (tabla 2) (67).
b) Valoración hemodinámica
En la estenosis aórtica realizamos la valoración hemodinámica o de severidad utilizando el Doppler espectral (continuo y pulsado) con transductores de baja frecuencia 2 a 2,5 mHz.
El Doppler color no aporta mayor beneficio en las lesiones estenosantes, salvo ubicar correctamente la dirección del flujo cuando no sigue el eje central.
Con el Doppler espectral debemos medir y calcular:
1) Velocidad máxima: V2 (es la velocidad posestenosis).
2) Gradiente máximo: 4 x V22 (ecuación de Bernoulli).
3) Gradiente medio: promedio de la sumatoria de las velocidades sobre la curva de velocidad máxima.
4) Área por ecuación de continuidad:
A1= Área del tracto de salida del VI. (r2 x p)
ITV1= Integral de velocidad del TSVI
ITV2= Integral de velocidad de flujo posestenosis (V2)

5) Índice de obstrucción: V1/V2
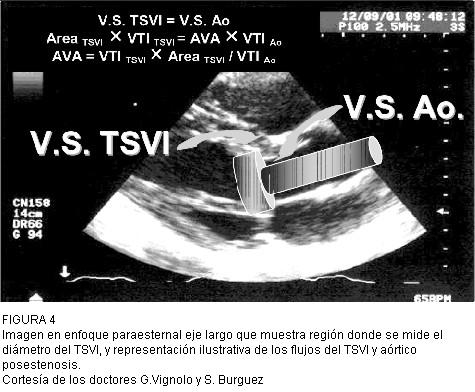
Estas mediciones implican buscar con el Doppler la mejor señal de flujo y para ello se utilizan distintos enfoques: apical cinco cámaras, apical tres cámaras, paraesternal derecho, subcostal y supraesternal. Desde estos enfoques buscamos registro de mayor velocidad, contorno mejor delineado y señal plena, como el más confiable (figura 4).
La velocidad máxima es la medición directa de la velocidad de flujo posestenosis, depende directamente del gasto cardíaco y la función ventricular, es un parámetro de alta especificidad y baja sensibilidad. Velocidades mayores a 4 m/s demostraron una especificidad de 90% y una sensibilidad de 44% para el diagnóstico de estenosis severa (68,69).
El gradiente máximo es consecuencia directa de la velocidad máxima (4 xV22), comparte su sensibilidad y especificidad así como la dependencia al gasto cardíaco y la función ventricular. Un gradiente mayor de 70 mmHg es el punto de corte para considerar una estenosis como severa.
El gradiente medio surge de la curva de velocidad, se divide la curva en unidades de tiempo similares, se mide la velocidad en cada división y se calcula el gradiente, el promedio de esa sumatoria es el gradiente medio, actualmente está integrado en el software de los equipos, por lo cual es un dato que surge al trazar el contorno de la curva espectral, tiene similar especificidad y sensibilidad que el gradiente máximo, el punto de corte para severidad es 50 mmHg (68a).
El cálculo del área obliga a medir con Doppler pulsado la velocidad del flujo en el TSVI (V1) y su integral, aproximadamente 1 cm por debajo del plano valvular para evitar la aceleración preestenótica. También se mide el diámetro del tracto de salida del ventrículo izquierdo a nivel del plano del anillo en enfoque paraesternal eje largo, y luego se calcula el área del TSVI A1= (D/2)2 x ð (68a,70,71).
Con estas mediciones calculamos el área aórtica aplicando la ecuación de continuidad:
La debilidad de esta fórmula radica en que la medición del diámetro del TSVI a veces es técnicamente dificultosa y cualquier error se potencia pues lo elevamos al cuadrado.
El índice de obstrucción es la correlación entre V1/V2, o sea entre la velocidad de flujo pre y posestenosis. Es el parámetro más independiente del gasto cardíaco y la función ventricular, pues la influencia sobre ambas velocidades es equivalente.
En un trabajo de Oh y colaboradores (68a), se demostró que un coeficiente de 0,25 o menor tiene una sensibilidad de 92% y una especificidad de 87% para áreas aórticas de 0,75 cm2 y una correlación de 0,94 con el cateterismo cardíaco. Existen también trabajos de correlación a nivel nacional (68b).
La correcta valoración de una estenosis aórtica desde el punto de vista ecográfico implica informar todos los parámetros descritos, y de la conjunción de estos con la clínica surge la situación del paciente (figura 5).
Estos son criterios internacionalmente propuestos (tabla 3), tomados a partir del consenso uruguayo en valvulopatías, las guías de valvulopatías de la ACC/AHA, y las guías españolas de valvulopatías (72,73), pero no son aplicados en todos los servicios aún.
c) Repercusión funcional
y asociación lesional
Finalmente, en la valoración ecocardiográfica se debe consignar la repercusión funcional de la estenosis, y cualquier otra alteración concomitante. En este sentido se considera como repercusión funcional:
a) Hipertrofia ventricular izquierda, generalmente asociada a estenosis severas y donde interesa especificar el grado de hipertrofia, y su característica de simétrica o asimétrica, obstructiva o no obstructiva.
b) Función ventricular. Es muy importante determinar correctamente la función ventricular para conocer la situación del paciente. Una estenosis aórtica con función sistólica deprimida (fracción de eyección del ventrículo izquierdo menor a 35%) puede presentarse con bajo gradiente sistólico (gradiente medio menor a 40 mmHg) y ser severa por criterio de área (menor a 1 cm2) o índice de obstrucción. Estos casos deben diferenciarse de los pacientes con miocardiopatía primaria y fracción de eyección del ventrículo izquierdo (FEVI) severamente disminuida, que aparentan tener una estenosis aórtica severa por la escasa motilidad de la válvula, y para diferenciarlos requieren de estudios complementarios, como ser ecocardiografía con dobutamina.(74).
Con respecto a la asociación lesional:
a) En pacientes jóvenes con valvulopatía bicúspide congénita es posible encontrar una coartación aórtica asociada.
b) En los casos de valvulopatía aórtica reumática debe informarse si existe afectación de otras válvulas, fundamentalmente la válvula mitral bajo la forma de estenosis o insuficiencia mitral reumática, o ambas.
c) También es frecuente la asociación con insuficiencia aórtica y debe consignarse su severidad.
Hay algunas consideraciones en la valoración de la estenosis aórtica que debemos tener siempre presentes:
1) En la exploración del flujo aórtico posestenótico se debe tener cuidado de no confundirlo con el flujo de una insuficiencia mitral o tricuspídea que transcurra pegada al septum interauricular, o con el flujo de una obstrucción del tracto de salida del ventrículo izquierdo.
FIGURA 4
Imagen en enfoque paraesternal eje largo que muestra región donde se mide el diámetro del TSVI, y representación ilustrativa de los flujos del TSVI y aórtico posestenosis.
Cortesía de los doctores G.Vignolo y S. Burguez

2) El flujo en el TSVI (V1) debe medirse cuidadosamente evitando la aceleración preestenótica, pues velocidades mayores a 1,7 m/s plantean una probable infraestimación del área por la ecuación de continuidad (75).
3) La presencia de fibrilación auricular obliga a varias mediciones del flujo pre y posestenosis (se recomienda cinco mediciones) y efectuar un promedio de ellas para el cálculo de gradientes y área.
ERGOMETRíA
Durante años se consideró que la realización de una ergometría en pacientes con estenosis aórtica implicaba un aumento del riesgo (72), sin embargo la experiencia ha demostrado que en las formas asintomáticas puede hacerse en forma segura (76-81). Estos pacientes se encuentran en actividad y en el curso de su vida normal realizan ejercicios que pueden ser comparables a los de la prueba, por lo que parece razonable investigar qué ocurre en esa situación (77).
El resultado de la prueba ergométrica aporta elementos útiles para el manejo de los pacientes, el primero es la aparición de síntomas en pacientes inicialmente considerados asintomáticos por el interrogatorio; esto ocurre con una frecuencia vecina a 40% (78). Este resultado se atribuye a que los pacientes se autolimitan en la vida normal con lo que nunca alcanzan este grado de actividad, o que no reconozcan síntomas mínimos. Estos “seudoasintomáticos” deben ser reclasificados, y en caso de tener una estenosis severa tienen indicación quirúrgica de clase I (72).
La caída de presión durante la prueba se interpreta como un signo de falla miocárdica durante el esfuerzo, la prueba debe interrumpirse y es indicación de cirugía tipo II a (72). La aparición de arritmias severas así como una gran limitación de la capacidad funcional, sin constituir una indicación formal, obligan a considerar la necesidad de cirugía.
La depresión anormal del segmento ST no puede tomarse como índice de enfermedad coronaria ya que en la estenosis aórtica existen anomalías del electrocardiograma, hipertrofia ventricular izquierda y limitación de la capacidad vasodilatadora que pueden explicar este resultado (56,78).
La respuesta ergométrica anormal, aun cuando no indica directamente la cirugía, es un índice de mal pronóstico ya que el porcentaje de eventos cardíacos y la necesidad de cambio valvular en los próximos meses es mayor que en el grupo en que la prueba es normal; en estos pacientes no se han publicado casos de muerte súbita (80).
CATETERISMO CARDÍACO
El cateterismo cardíaco fue el método de elección para estudiar la estenosis aórtica antes de la aparición del eco Doppler. Permite medir el gradiente transvalvular aórtico, estudiar la función de otras válvulas y la del ventrículo, las presiones del circuito pulmonar y el gasto cardíaco. Con estos datos se pueden calcular las resistencia sistémicas y pulmonares y, aplicando la fórmula de Gorlin, el área valvular aórtica.
La medida del gradiente es una maniobra que puede ser difícil y prolonga el tiempo del cateterismo, el catéter en el ventrículo izquierdo produce extrasístoles que deben evitarse porque alteran las medidas y la presencia del catéter a nivel del área valvular puede aumentar el gradiente en las formas más severas.
La aparición de un método capaz de suministrar la misma información en forma confiable y reproducible ha desplazado el cateterismo, de modo que en el momento actual el método preferido es el eco Doppler. Sólo en casos de discrepancia puede estar indicado el cateterismo con este objetivo, que deberá entonces hacerse con todas las precauciones.
La cineangiocoronariografía es el único método disponible que permite descartar en forma segura la existencia de lesiones coronarias, ya que la negatividad de las pruebas de isquemia tienen un valor relativo. En la estenosis aórtica la frecuencia de enfermedad coronaria es muy alta y como la presencia de lesiones coronarias severas modifica la estrategia quirúrgica, el estudio debe realizarse antes de la cirugía. La única excepción sería un sujeto de bajo riesgo por la edad, esta situación es poco frecuente en nuestro medio, donde la enfermedad predomina en los sujetos añosos.
VI) EVOLUCIóN Y PRONóSTICO
La estenosis aórtica es una enfermedad progresiva en la que las lesiones constituidas luego de una injuria inicial evolucionan con un ritmo diferente, según los casos, hacia formas más severas.(82-96). Las formas congénitas varían mucho, existen variedades en las que la lesión tiene una entidad suficiente en el momento del nacimiento como para tener repercusión funcional y obligar a una intervención, y otras como la válvula bicúspide en la que la alteración inicial solo facilita el desarrollo de un eventual proceso patológico que tendrá repercusión después de muchos años.
La fiebre reumática produce la lesión durante el empuje que progresa a posteriori con un ritmo más lento que la forma senil fibrocalcificada (32).
La forma senil fibrocalcificada es la que ha sido mejor estudiada por haber sido la forma predominante en la etapa histórica en que existieron métodos de diagnóstico adecuados para valorarla en forma no invasiva. La esclerosis valvular aórtica ha sido definida como un aumento en la ecogenicidad y en el espesor de las valvas sin restricción de su motilidad (42). La velocidad anterógrada a través de la válvula es inferior a 2,5 m/s, o sea que el gradiente es inferior a 25 mmHg. Comparando la velocidad y el gradiente promedio en estas válvulas con las normales es sensiblemente mayor, lo que significa que existe una alteración funcional acompañando lo anatómico (50).
La esclerosis y la estenosis aórtica representan diferentes etapas de un mismo proceso patológico con histología común (35). Estos pacientes tienen aumentado en 50% el riesgo de muerte de causa cardiovascular e infarto de miocardio no fatal en un seguimiento a cinco años de 5.201 casos de mayores de 65 años, lo que ha permitido afirmar que la válvula aórtica es una “ventana” que permite observar lo que ocurre en las coronarias (97,98).
FIGURA 5
La imagen A corresponde a un enfoque paraesternal izquierdo eje largo, para la determinación del diámetro del tracto de salida del ventrículo izquierdo. En la imagen B se muestra la determinación de velocidad en el tracto de salida del ventrículo izquierdo por Doppler pulsado, en tanto que en la imagen C se hace lo propio con la velocidad transvalvular aórtica máxima por Doppler continuo. La velocidad transvalvular máxima (4,62 m/s), los gradientes transvalvulares (86 mmHg máximo y 55 mmHg medio) y el área valvular aórtica calculada por ecuación de continuidad (0,84 cm²) corresponden a una estenosis aórtica severa.
Consideramos que existe estenosis valvular aórtica cuando las valvas están engrosadas, su apertura está reducida en el eco bidimensional y la velocidad de flujo anterógrado es 2,5 m/s, lo que equivale a un gradiente transvalvular mayor a 25 mmHg. En la estenosis valvular aórtica en etapa asintomática el pronóstico es igual al de una población de la misma edad y sexo; existen casos de muerte súbita, con una frecuencia inferior a 0,5% por año, según algunos autores, ninguna ocurrió en ausencia total de síntomas o con prueba ergométrica normal (80). En función de estos datos no se aconseja el cambio de válvula, ya que la mortalidad quirúrgica, aun en los mejores centros, supera este número. La estenosis aórtica progresa en esta etapa con variaciones individuales que hacen imposible prever la evolución de un caso concreto, sin embargo, promedialmente, aumenta la velocidad de 0,3 m/s por año y el gradiente 7±7 mmHg por año y el área disminuye 0,12±0,19 cm2 (80) por año. Existen estudios observacionales con gran número de casos en los que se observa una menor progresión de la estenosis aórtica en los pacientes que reciben estatinas (95,96), pero faltan estudios randomizados que lo demuestren en forma indudable.
La estenosis se considera leve cuando la velocidad está entre 2,5 y 3 m/s, moderada entre 3 y 4 m/s y severa si es más de 4 m/s. Los diferentes índices de severidad son capaces de predecir en qué momento aparecerán los síntomas. Analizando la velocidad puede preverse que a los cinco años 84% estará libre de síntomas en la forma leve, 23% en la moderada y ninguno en la severa (80). De manera que si bien la severidad de la estenosis no indica la cirugía, obliga a estar muy atento con respecto a la aparición de síntomas.
VII) TRATAMIENTO MéDICO
Es poco lo que puede hacerse con tratamiento médico en la estenosis aórtica, pero no debe dejarse de lado la profilaxis de la endocarditis infecciosa, debe hacerse en todas las etapas de la enfermedad mediante la cuidadosa higiene dental y la administración de antibióticos adecuados en las intervenciones con riesgo de bacteriemia (99). La profilaxis de fiebre reumática debe hacerse en los casos en que exista evidencia de esta enfermedad (64).
La enfermedad coronaria se asocia con mucha frecuencia, y además de sus complicaciones propias aumenta el riesgo de una eventual cirugía. En este sentido debe prestarse atención especial a los factores de riesgo coronario. El riesgo coronario en la enfermedad valvular aórtica existe ya en la etapa de esclerosis aórtica, enfermedad diagnosticada por ecocardiografía y habitualmente considerada benigna, el riesgo de muerte por causa cardiovascular y de infarto de miocardio no fatal aumenta un 50%. Este hallazgo fundamenta el concepto de que la comprobación de enfermedad aórtica, de cualquier severidad, es un fuerte indicador de riesgo coronario (98).
La hipertensión arterial debe tratarse como factor de riesgo coronario y como causa de descompensación de la estenosis aórtica. Deben evitarse tratamientos agresivos que disminuyen la precarga ventricular (19).
La diabetes, el hábito de fumar y la obesidad deben tratarse como factores de riesgo coronario y causa de aceleración en la progresión de la estenosis aórtica.
Los pacientes con estenosis aórtica pueden hacer ejercicio aun competitivo en las formas leves. En las formas moderadas debe evitarse la competitividad y es conveniente graduarlo de acuerdo con el resultado de la ergometría, en las formas severas debe ser de poca intensidad (64).
Los pacientes deben ser educados con respecto a la naturaleza de su enfermedad y a los síntomas típicos o atípicos que advierten el cambio evolutivo.
La insuficiencia cardíaca sistólica descompensada se trata con diuréticos, inhibidores de la enzima de conversión y digitálicos, debe manejarse con cuidado la disminución de la precarga que puede disminuir el gasto cardíaco. La fibrilación auricular debe revertirse a ritmo sinusal si es posible, en caso contrario debe controlarse la frecuencia cardíaca (64).
El nitroprusiato intravenoso ha demostrado gran eficacia para el control de los síntomas en esta etapa (20).
VIII) TRATAMIENTO QUIRúRGICO DE LA ESTENOSIS VALVULAR AóRTICA
La estenosis aórtica, causa más frecuente de obstrucción del tracto de salida del ventrículo izquierdo, es la valvulopatía que motiva el mayor número de intervenciones quirúrgicas en cirugía cardíaca de adultos.
En Uruguay se realizan cada año entre 300 y 400 cambios valvulares aórticos por prótesis en pacientes adultos, y la gran mayoría se debe a estenosis valvular.
Como se mencionó anteriormente, la estenosis aórtica cursa un período asintomático más o menos prolongado, en el cual la severidad de la estenosis progresa. El área valvular se reduce entre 0,1 cm2 y 0,3 cm2 por año y el gradiente transvalvular aumenta promedialmente 7±7 mmHg en igual tiempo. Esta etapa asintomática puede posteriormente dar lugar a la etapa sintomática que todos conocemos, con disnea, angina o síncope (80).
Durante la etapa asintomática la enfermedad presenta una muy baja mortalidad, 0,5% a 1% por año, lo que no difiere significativamente de la mortalidad general para ese rango etario.
Por esta razón, en esta etapa libre de síntomas, los pacientes con estenosis aórtica severa, salvo excepciones como la indicación de cirugía cardíaca por otra causa, no tienen indicación de cirugía ya que la morbimortalidad de la misma supera a la de la evolución con tratamiento médico conservador.
La aparición de los síntomas marca un punto de inflexión en la evolución de la enfermedad y la cirugía se hace obligatoria, ya que sin tratamiento quirúrgico el pronóstico vital y funcional empeora drásticamente (100-102).
Con la aparición de síntomas como angina, síncope o disnea el pronóstico sin cirugía es malo.
La sobrevida media de los pacientes portadores de estenosis aórtica severa sintomática es de dos a tres años. Cuando el síntoma presente es angina de pecho, la sobrevida media es de cinco años; cuando se trata de síncope la sobrevida media es de tres años, y cuando se trata de insuficiencia cardíaca la sobrevida media es menor a dos años.
De estos datos surgen dos conceptos relevantes: primero, la necesidad de indicar la cirugía en la estenosis valvular aórtica severa cuando presenta síntomas, por mínimos que estos sean. Segundo, subraya la importancia que tiene un seguimiento clínico y paraclínico estricto de los pacientes asintomáticos con el fin de detectar la aparición de síntomas muchas veces minimizados o incluso inadvertidos por el paciente.
En la tabla 4 se resumen las recomendaciones de cirugía de la ACC/ AHA para pacientes portadores de estenosis aórtica (72).
En el paciente adulto el tratamiento quirúrgico de elección para la estenosis aórtica continúa siendo la sustitución valvular por una prótesis.
La valvuloplastia con balón como alternativa al tratamiento quirúrgico no ha dado resultados duraderos; pueden constituir una excepción a algunas formas congénitas no calcificadas en que hay buenos resultados. En la forma senil calcificada el resultado es transitorio, y al cabo de seis meses la situación es similar a la inicial. En los casos en que una insuficiencia cardíaca severa hace riesgosa la cirugía, la valvuloplastia puede mejorar transitoriamente el cuadro clínico reduciendo los riesgos operatorios (función de puente).
Los procedimientos de plastia valvular quirúrgica son realizados sólo en algunos casos especiales por presentar resultados muy inferiores a los obtenidos con la implantación de prótesis modernas.
El reemplazo valvular aórtico se realiza con empleo de circulación extracorpórea. El abordaje más frecuentemente utilizado es la esternotomía media. Una vez establecida la circulación extracorpórea se ocluye transitoriamente la aorta ascendente mediante un clamp y se realiza la protección miocárdica utilizando distintos tipos de soluciones cardiopléjicas. Esto permite trabajar con el corazón inmóvil y reduce los efectos deletéreos de la isquemia miocárdica.
Se realiza una aortotomía que permite observar la válvula aórtica desde su cara aórtica. Se reseca la válvula patológica y en su lugar se implanta una prótesis valvular de tamaño adecuado, de acuerdo a la superficie corporal del paciente.
TIPO DE PRóTESIS VALVULARES
La elección del tipo de prótesis a implantar merece un análisis particular en cada paciente.
No existe la prótesis ideal. La misma debería tener las siguientes características: biocompatibilidad, excelente comportamiento hemodinámico, gran durabilidad, resistencia a la ruptura, a la infección y a la trombosis, debería ser de fácil implantación, silenciosa y de bajo costo.
En los últimos años el desarrollo de mejores materiales para la construcción de válvulas mecánicas, los avances en el tratamiento, técnicas de preservación y antimineralización de los tejidos biológicos para válvulas biológicas, sumado a mejoras en el diseño valvular, han permitido la confección de prótesis valvulares con excelentes resultados clínicos. De todas formas, ninguna de estas prótesis disponibles reúne todas las características de la prótesis ideal. Cada tipo presenta ventajas y desventajas si se las compara con otras, por lo que para cada paciente en particular debe considerarse cuál es la más adecuada.
Las prótesis valvulares se dividen en dos grandes grupos: mecánicas y biológicas.
Las primeras presentan una mayor durabilidad. Si bien está descrita la falla estructural de prótesis mecánicas, los modelos de última generación excepcionalmente presentan deterioro estructural. Por esta razón se utilizan preferentemente en pacientes jóvenes con una expectativa de vida larga. Tienen como desventaja principal que el paciente debe ser anticoagulado de por vida, con los riesgos y costos que ello implica, para reducir el riesgo de trombosis sobre la válvula.
Las prótesis biológicas no requieren anticoagulación para toda la vida, si bien la mayoría de los cirujanos recomiendan el uso de warfarina los primeros tres meses hasta que se produzca la endotelización del soporte protésico. La desventaja de este tipo de válvulas es que tienen una vida libre de disfunción más reducida. Por esta razón se recomiendan en pacientes añosos o pacientes con contraindicación de anticoagulación. Existen dos subgrupos de válvulas biológicas, aquellas dotadas de soporte rígido y las que no presentan soporte. Las primeras son las que se implantan con mayor frecuencia por la gran experiencia obtenida, facilidad de su implante y los buenos resultados. Sin embargo, el gradiente transvalvular protésico en este tipo de prótesis con soporte es por lo general mayor que el observado en las prótesis mecánicas de igual tamaño, lo que es otra desventaja frente a estas últimas. En los últimos años se han desarrollado modelos de válvulas biológicas sin soporte que al no reducir el orificio efectivo generan menores gradientes transvalvulares. La utilización de este tipo de prótesis no se ha generalizado por varios motivos: costos elevados, requieren una técnica de implante distinta a la empleada con las prótesis con soporte, en general prolonga los tiempos quirúrgicos (mayor tiempo de circulación extracorpórea y de isquemia miocárdica), para algunos cirujanos aún no hay evidencia suficiente sobre su superioridad.(103-108).
Dentro de cada grupo, mecánicas y biológicas, existen varios tipos diferentes. Cada uno de ellos encuentra su superioridad frente a los otros en las distintas situaciones clínicas, pero su análisis detallado excede los objetivos de este trabajo, por lo que sólo los enumeraremos en la tabla 5.
RESULTADOS
Luego de la cirugía se producen importantes cambios anatómicos y hemodinámicos. Casi todos los pacientes declaran un alivio de los síntomas como disnea y angor luego de la cirugía.
Puede apreciarse una importante reducción posoperatoria de los volúmenes telediastólicos y telesistólicos ventriculares (109-111).
Una revisión que incluyó trabajos disponibles en la literatura de los últimos 23 años respecto a lo que ocurre con los pacientes sometidos a sustitución valvular por estenosis aórtica, mostró que luego de la corrección de la estenosis se produce una reducción de la masa ventricular izquierda. La reducción más importante de la masa miocárdica se produce en los primeros seis meses del posoperatorio (112).
La segunda observación es que la fracción de eyección ventricular se incrementó en el grupo de pacientes que presentaban baja fracción de eyección en el preoperatorio. Esto es esperable porque el desarrollo de hipertrofia concéntrica en los pacientes con estenosis aórtica es una adaptación ventricular al incremento de la presión intracavitaria, para mantener el estrés parietal. Como la sustitución valvular reduce la poscarga del ventrículo, consecuentemente se produce una nueva adaptación y la reducción de la hipertrofia.
La mayor parte de los trabajos incluidos en dicha revisión señalan un incremento significativo de la función ventricular, pero algunos mostraron efectos opuestos.
Debe tenerse presente que la estenosis aórtica tiene una alta prevalencia en la población añosa, en la que también es alta la prevalencia de otras enfermedades cardíacas. Por lo tanto, el grado de mejoría de la fracción de eyección seguramente depende de múltiples factores.
Es frecuente ver pacientes que, por la evolución de su enfermedad, llegan a la cirugía con un compromiso severo de la función ventricular, lo que genera gradientes bajos a uno y otro lado del plano valvular. La sobrevida sin cirugía en este grupo de pacientes es muy mala.
Si bien la mortalidad operatoria de los pacientes con disfunción severa del ventrículo izquierdo y bajo gradiente transvalvular es alta, cercana a 20%, el estudio de los pacientes que sobrevivieron a la cirugía mostró un incremento sustancial en la fracción de eyección(113).
La mortalidad hospitalaria global, luego de realizar la sustitución valvular aórtica como único procedimiento, o asociado a otros procedimientos cardíacos es de 3% a 6%. Cuando se analizan los pacientes a los que se les realizó sólo sustitución valvular aórtica, la mortalidad es inferior a 2%. En aquellos a los que se les agregó otro procedimiento, como revascularización miocárdica o cirugía de otra válvula cardíaca, la mortalidad asciende a 6% (114).
Se han identificado varios factores de riesgo de mortalidad temprana luego de la sustitución valvular por una estenosis aórtica (114).
Los pacientes pertenecientes a una clase funcional III y IV tienen mayor riesgo de muerte temprana luego de la cirugía.
También se asocia a mayor mortalidad el deterioro de la fracción de eyección ventricular izquierda y la presencia de remodelación ventricular.
La edad avanzada representa un factor de riesgo de mortalidad. Sin embargo, numerosos estudios demuestran el beneficio de la cirugía en el paciente añoso. Un trabajo reciente que analizó la evolución de 115 pacientes mayores de 80 años a los que se les sustituyó la válvula aórtica solo o combinado con revascularización coronaria quirúrgica, mostró una mortalidad hospitalaria de 8,5%. El seguimiento luego del alta se logró en todos los casos. La sobrevida actuarial a uno y cinco años fue de 86,4% y 69,4%, respectivamente (115). Esto justifica la indicación de cirugía en pacientes añosos siempre que no exista contraindicación por otra causa.
El sexo femenino también se asocia a mayor mortalidad quirúrgica.
Otros importantes factores de riesgo son la insuficiencia valvular aórtica asociada, la presencia de coronariopatía, la fibrilación auricular, y la insuficiencia renal.
La sobrevida global, incluida la mortalidad hospitalaria, es de 75%, 60% y 40% a los cinco, diez y quince años, respectivamente (114).
BIBLIOGRAFíA
1. Stephan PJ, Henry AC, Hebeler RF, Whiddom L, Roberts WC. Comparison of age, gender, number of aortic valve cusps, concomitant coronary artery bypass graffing and magnitude of left ventricular systemic arterial peak systolic gradient in adults having aortic valve replacement for isolated aortic valve stenosis. Am J Cardiol 1997; 97: 166-72.
2. Levinson GE, Alpert JS. Aortic stenosis. In: Alpert J, Dalsen J, Rahimtoola S. Valvular Heart Disease. Philadelphia: Lippincott Williams y Wilkins, 2000: 183.
3. Faggiano P, Sabatini T, Rusconi C, Ghizzoni G, Sorgato A. Abnormalities of left ventricular filling in aortic stenosis: usefulness of combined evaluation of pulmonary veins and mitral flow by means of transthoracic Doppler echocardiography. Int J Cardiol 1995; 49: 77-85.
4. Green SJ, Pizzarello RA, Padmanabhan VT, Ong LY, Hall MH, Tortolani AJ. Relation of angina pextoris to coronary artery disease in aortic valve stenosis. Am J Cardiol 1985; 55: 1063-5.
5. Vandeplas A, Willems JL, Plesens J, De Geest H. Frecuency of angina pestoris and coronary artery disease in severe isolated valvular aortic stenosis. Am J Cardiol 1988; 62: 117-20.
6. Chobardl R, Wurzel M, Teplitsky I, Menkes H, Tamari I. Coronary artery disease in patients 35 years of age or older with valvular aortic stenosis. Am J Cardiol 1989; 64: (12): 811-2.
7. Alexopoulos D, Kolovu G, Kirlakidis M, Antonopoulos A, Adamopoulos S, Sleight P, et al. Angina and coronary artery disease in patients with aortic valve disease. Angiology 1993; 44(9): 707-11.
8. Safford RE, Bove AA. Prediction of coronary artery disease by left ventricular regional wall motion abnormalities in patients with stenosis of the aortic valve. Br Heart J 1987; 57: 237-41.
9a. Lluberas R, Mallo D, Koritnichci D, Pousso J, Artuccio C, Tavella N. Prevalencia de lesiones coronarias significativas y angina de pecho en la estenosis aórtica. Rev Urug Cardiol 2000; 15: 90-5.
9b. Menéndez H, Ginés F, Lluberas R, Dieste T, Vázquez M, Buitrón F. Prevalencia de la enfermedad coronaria en la estenosis aórtica. Rev Urug Cardiol 1988; 3: 233.
10. Davies MJ, Treasure T, Parker DJ. Demographic characteristics of patients undergoing aortic valve replacement for stenosis: relation to valve morphology Heart 1996; 75: 174-8.
11. Gould L. Why angina pectoris in aortic stenosis. Circulation 1997; 95: 790-2.
12. Abdulali SA, Baliga BG, Clayden AD, Smith DR. Coronary artery luminal diameter in aortic stenosis. Am J Cardiol 1985; 55: 450-3.
13. Omran H, Fehske W, Rabahieh R, Hagendorf A, Luderitz B. Relation between symptoms and profiles of coronary artery blood flow velocities in patients with aortic valve stenosis: a study using transesoesophageal Doppler echocardiography. Heart 1996; 75: 377-83.
14. Julius BK, Spillman M, Vassalli G, Villari B, Eberli FR, Otto M. Angina pectoris in patients with Aortics stenosis and normal coronary arteries. Circulation 1997; 95: 892-8.
15. Richards AM, Nichols MG, Ikram H, Hamilton EJ, Richards RD. Syncope in aortic valvular stenosis. Lancet 1984; 2: 1113-6.
16. Milnor WR. Hemodynamics. Baltimore/London: Williams y Wilkins, 1982: 136.
17. Gutgessel HP, Rembold CM. Growth of the Human Heart relative to body surface area. Am J Cardiol 1990; 65: 661-8.
18. Burwash IG, Thomas DD, Sadahiro M, Pearlman AS, Verrier ED, Thomas R, et al. Dependence of Gorlin formula and continuity equation valve areas on transvalvular volume flow rate in valvular aortic stenosis. Circulation 1994; 89: 827-35.
19. Antonini-Canterin F, Huang G, Cervesato E, Faggiano P, Pavan D, Piazza R, et al. Symptomatic aortic stenosis: does systemic hypertension play an additional role? Hypertension 2003; 41(6): 1268-72.
20. Khot UN, Novaro GM, Popovic ZB, Mills RM, Thomas JD, Tuzcuem, et al. Nitroprusside in critically ill patients with left ventricular dysfunction and aortic stenosis. N Engl J Med 2003; 48(18): 1756-63.
21. Wood P. Disease of the Heart and Circulation. 2nd. ed. Philadelphia: JB Lippincott, 1957: 568.
22. Roberts WC, Virmani R. Aschoff bodies at necropsy in valvular heart disease. Evidence from an analysis of 543 patients over 14 years of age that rheumatic heart disease, at least anatomically, is disease of the mitral valve. Circulation 1978; 57: 803.
23. Fligner CL, Reichenbach DD. Patology and Etiology of Heart Disease. Chapter 2. In: Otto CM. Valvular heart disease. Philadelphia: WB Saunders, 13-43.
24. Carrol JD, Feldman T. Percutaneous mitral ballon valvotomy and the new demographic of the mitral stenosis. JAMA 1993; 270: 1731-6.
25. Bisno AL. The rise and fall of rheumatic fever. JAMA 1985; 84: 538-41.
26. Gordis L. The virtual disappearence of rheumatic fever in the United States. Circulation 1985; 72: 1155-62.
27. Portillo JM, Ruocco G. Alcance de la fiebre reumática en el Uruguay. Arch Pediatr Uruguay 1969; 40(2): 144-63.
28. Portillo JM, Ruocco G, Mascardó Y, Franco S, Batthyany E. Informe de la República Oriental del Uruguay a la V conferencia sobre la fiebre reumática en las Américas. Buenos Aires, Agosto 1974.
29. Giachetto G, Franco S, Guariglia R. Aspectos epidemiológicos y clínicos de la fiebre reumática. Arch Pediatr Uruguay 1994; 65: (3): 11-5.
30. Tavella N, Pousso J, Mallo D, Lluberas R, Dieste T, Korytnicki D, et al. Datos sobre la demografía de la estenosis mitral en el Uruguay. Rev Urug Cardiol 2001; 16: 81-5.
31. Stone PH. Management of the patient with asymptomatic aortic stenosis. J Card Surg 1994; 9: 139-44.
32. Wagner S, Selzer A. Progression of aortic stenosis: a longitudinal hemodynamic study. Circulation 1982; 65: 709-12.
33. Molher AR. Are atheroesclerotic processes involved in aortic valve calcification. Lancet 2000; 356: 524-5.
34. Vollebergh FEMG, Becker AE. Minor congenital variations of valves: possible link with isolated aortic stenosis. Br Heart J 1977; 39: 1006-11.
35. Otto CC. Aortic stenosis. Clinical evaluation and optimal timing of surgery. Cardiology Clinics 1998; 16: 353-73.
36. Otto CM, Kuusisto J, Reichenbach DD, Gown AM, O´Brien KD. Characterization of the early lesion of “degenerative” valvular aortic stenosis. Histological and inmunohistochemical studies. Circulation 1994; 90: 844-53.
37. O´Brien KV, Kuusisto J, Reichenbach DD, Ferguson M, Giachelli C, Alpers CH, et al. Osteopontin is expressed in human aortic valvular lesions. Circulation 1995; 92: 2163-8.
38. Demer LL. A skeleton in the atheroesclerosis closet. Circulation 1995; 92: 2029-32.
39. Roberts WC. The senile cardiac calcification syndrome. Am J Cardiol 1986; 58: 572-4.
40. Aronow WS, Schwarts KS, Koenisberg M. Correlation of serum lipids, calcium, and phosphorous diabetes mellitus and history of systemic hypertension with presence or abscense pf calcified or thinckened aortic cusps or root in elderly patients. Am J Cardiol 1987; 59: 998-9.
41. Molher ER, Sheridan MJ, Nichols R. Development and progression of aortic valve stenosis: atheroesclerosis risk factors, a casual relationship? Clin Cardiol 1991; 14: 995-9.
42. Stewart BF, Siscovick D, Lind BK, Gardin JM, Goltdiener JS, Smith VE, et al for the Cardiovascular Heart Study. Clinical Factors associated with calcific Aortic valve disease. J Am Coll Cardiol 1997; 29: 630-4.
43. Sprecher DL, Schaeffer EJ, Kent KM, Gregg RE, Zech LA, Hoeg JM. Cardiovascular features of homozygous familiar hypercholesterolemia: analysis of 16 patients. Am J Cardiol 1984; 54: 20-30.
44. Kagaguchi A, Yutani C, Yamamoto A. Hypercholesterolemic valvulopathy: an aspect of malignant atherosclerosis. Therap Apher Dial 2003; 7: 439-43.
45. Fujise K, Amerling R, Sherman W. Rapid preogression of mitral and aortic stenosis in a patient with secondary hyperparathyroidism. Br Heart J 1993; 70(3): 282-4.
46. Strickberger SA, Schulman SP, Hutchins GM. Association of Paget’s disease of bone with calcific aortic valve disease. Am J Med 1987; 82: 953-6.
47. Malergue MC, Urena P, Prieur P, Guedon-Rapoud C, Petrover M. Incidence and developpment of aortic stenosis in chronic hemodyalysis. Arch Mal Coeur 1998; 90(12): 1595-601.
48. Michel PL. Aortic stenosis in chronic renal failure patients treated by dialysis. Nephrol Dialysis Transpl 1998; 13(4): 44-8.
49. London GM, Paunier B, Marchais SJ, Guerin AP. Calcification of the aortic valve in the dialyzed patient. J Am Soc Nephrol 2000; 11: 778-83.
50. Ventura JE, Tavella N, Romero C, Petragia AA, Baez AA, Muñoz LL. Aortic valve calcification is an independant factor of left ventricular hypertrophy in patients on maintenance haemodialysis. Nephrol Dial Transplant 2002; 17: 1795-801.
51. Tavella N, Romero CE, Alvarez A, Ventura J. Uraemic dislipidaemia predicts all cause of death ion chronic Hemodiálisis patients. World Congress of Nephrology 2003. Berlin. Filename 552881.
52. Stevinkel P, Heimburger O, Paultr F, Diczfalusy U, Wang T, Berglund L, et al. Strong association between malnutrition inflammation, and atherosclerosis in chronic renal failure. Kidney Int 1999; 55: 1899-911.
53. Fellstrom BG, Holdaas H, Jardine AG. Why do we need a statin trial in hemodialysis patients? Kidned Int 2003; 63(84): S204-S206.
54. Otto CM. Valvular heart disease. In: Aortic Stenosis. Philadelphia: WB Saunders, 1999: 189 (Chapter 9).
55. Das P, Rimingon H, Mc Grame K, Chambers J. The valve of treadmill exercise testing in apparently asymptomatic aortic stenosis. J Am Coll Cardiol 2001; 37: (suppl A) 489 A Abstract.
56. Amato MCM, Moffa PJ, Werner KE, Ramires JAF. Treatment decision in asympomatic aortic valve stenosis: role of exercise testing. Heart 2001; 86: 381-6.
57. Mc Henry MM, Rice J, Matlof HJ, Flamm MD Jr. Pulmonary hypertension and sudden death in aortic stenosis. Br Heart J 1979; 41: 463-7.
58. Silverik, Aurigemma G, Krendel S, Barry N, Ockene Y, Alpert J. Pulmonary artery hypertension in severe aortic stenosis: incidence and mechanism. Am Heart J 1993; 125: 146-50.
59. Malouf JP, Enriquez-Sarano M, Pellika PA, Oh JK, Bailey KR, Chandrasekaran K, et al. Severe pulmonary hypertension in patients with severe aortic valve stenosis: clinical profile and prognostic implications. J Am Coll Cardiol 2002; 40: 789-95.
60. Siegel RJ, Roberts WC. Electro cardiographic observations in severe aortic valve stenosos. Am Heart J 1982; 103: 210-5.
61. Sutnick AI, Soloff LA. P. wave abnormalities as an electrocardiographic index of hemodynamically significant aortic stenosis. Circulation 1963; 28: 814.
62. Levinson GE, Alpert JS. Aortic stenosis. In: Alpert DJ, Rahimtoola S. Valvular Heart Disease. Philadelphia: Lippincott Williams & Wilkins, 2000: 195.
63. Boxt LM, Lipton MJ, Kwong Ry Rybikif, Clouse ME. Computed tomography for assessments of cardiac chambers, valves, myocardium and pericardium. Cardiol Clin 2003; 21: 561-86.
64. Ocura H, Yoshida K, Hozumi T, Akasaka T, Yoshikawa J. Planimetry and transthoracic two-dimensional Echocardiography in noninvasive assessment of aortic valve area in patients with valvular stenosis. JACC 1997; 30: 753-9.
65. Braunwald E, Goldblatt A, Aygen M, Rockoff SD, Morrow AG.. Congenital aortic stenosis: clinical and hemodinamic finding on 100 patients. Circulation 1963, 27: 426.
66. Selzar A. Changing aspects of the natural history of valvular aortice stenosis. N Engl J Med 1987; 317: 91.
67. Passik CS, Ackerman DM, Pluth JR, Edwards WD. Temporal changes in the causes of aortic stenosis. A surgical pathologic, study of 646 cases. Mayo Clin Proc 1987; 62: 119.
68a. Oh JF, Taliercio CP, Holmes DR Jr, Rieder GS, Bailey KR, Seward JB, et al. Prediction of severity of aortic stenosis by Doppler aortic valve area determination: Prospective Doppler-catheterization correlation in 100 patients. JACC 1988; 11: 1227-34.
68b. Beltrán A, González Moreno J, Amonte P, Galain G, Kuster F, Ortiz A, et al. Correlación del Eco-Doppler con la hemodinamia en la cuantificación de los gradientes valvulares aórticos. Rev Urug Cardiol 1988; 3: 216.
69. Pellikka PA, Nishimura RA, Bailey KR, Tajik AJ. The natural history of adults with asyntomatic hemodynamically significant aortic stenosis. JACC 15: 1012-17.
70. Skajaerge T, Hegrenaes L, Hatle L. Non invasive estimation of valve area in patients with aortic stenosis by doppler ultrasound and two dimensional echocardiography. Circulation 1985; 72: 810-8.
71. Zoghi W, Farmer KL, Soto JG, Nelson JG, Quiñones MA. Accurate noninvasive quantification of stenosis aortic valve area by Doppler echocardiography. Circulation 1989; 73: 452-9.
72. ACC/AHA guidelines for the management of patients with valvular heart disease. A report of the American College of Cardiology/ American Heart Association Task Force on Practice guidelines. JACC 1998, 32: 1486-588.
73. Azpitarte J, Alonso AM, Gallego FG, González Santos JM, Pare C, Tello A. Guías de práctica clínica de la Sociedad Española de Cardiología en Valvulopatías. Rev Esp Cardiol 2000; 53: 1209-78.
74. Connolly H, Oh JK, Sehaff H, Roger J, Osbor S, Hodge D, et al. Severe aortic stenosis with low transvalvular Zhon gradient and severe left ventricular dysfunction. Circulation 2000; 101: 1940-6.
75. Zhon YQ, Faerestrond S, Matre K. Velocity distributions in the left ventricular outflow tract in patients with valvular aortic stenosis. Effect on the measurement of aortic valve area by using the continuity equation. Eur Heart J 1995; 16: 383-93.
76. Atwood JE, Kawanishi S, Myers J, Froelicher VF. Exercise testing in patients with aortic stenosis. Chest 1988; 93: 1083-7.
77. Clyne CA, Arrighi JA, Maron BJ, Bonow RO, Cannon RO. Systemic and left ventricular responses to exercise stress of asyntomatic patients with valvular aortic stenosis. Am J Cardiol 1991; 68: 1469-76.
78. Otto CM, Pearlman S, Kraft CD, Mykaye Hull CY, Burwash IG, Gradner CJ. Physiological changes with maximal exercise in asymptomatic valvular aortic stenosis assessed by Doppler echocardiography. JACC 1992; 20: 1160-7.
79. Carabello BA. Aortic Stenosis. N Engl J Med 2002; 346: 677-82.
80. Otto CM, Burwash IG, Legget ME, Munt BI, Fujikoa M, Jealy NL, et al. Prospective study of asymptomatic valvular aortic stenosis. Clinical, echocardiographic and exercise predictors of outcome. Circulation 1997; 95: 2262-70.
81. Linderhom H, Osterman G, Teien D. Detection of coronaty artery disease by means of exercise, ECG inpatients with aortic stenosis. Acta Med Scand 1985; 218: 181-8.
82. Faggiano P, Antonini-Canterin F, Erlicher A, Romeo C, Cervesato E, Pavan D, et al.Progression of aortic valve sclerosic to aortic stenosis. Am J Cardiol 2003; 91: 99-101.
83. Cosmi JE, Kort S, Tunick PA, Rosenzweig BP, Freedberg RS, Katz ES ,et al. The risk of the development of aortic stenosis in patients with “benign” aortic valve thickening. Arch Intern Med 2002; 162: 2345-7.
84. Chietlin MD, Gertz EW, Brundage BH, Carlson CJ, Quash JA, Bode RS. Rate of progression of severity of valvular aortic stenosis in the adult. Am Heart J 1979; 6: 689-700.
85. Nitta M, Nakamura T, Hultgren HN, Bilisoly J, Tovey DA. Progression of aortic stenosis in adult men: detection by noninvasive methods. Chest 1987; 92: 40-3.
86. Turina M, Hess O, Sepulcri F, Krayenbuhl HP. Spontaneous course of aortic valve disease. Eur Heart J 1987; 8: 487-83.
87. Otto CM, Pearlman AS, Gardner CL. Hemodynamic progression of aortic stenosis assessed by Doppler echocardiography. J Am Coll Cardiol 1989; 13: 545-50.
88. Roger VL, Tajik AJ, Bailey KR, Oh JK, Taylor CL, Seward JB. Progression of aortic stenosis in adults: new appraisal using Doppler echocardiography. Am Heart J 1990; 2: 331-8.
89. Faggiano P, Ghizzoni G, Sorgato A, Sabatini T, Simoncelli V, Gardini A, et al. Rate of progression of valvular aortic stenosis in adults. Am J Cardiol 1992; 70: 229-33.
90. Peter M, Hoffmann A, Parker C, Luscher T, Burckharrdt D. Progression of aortic stenosis: role of age and concomitant coronary artery disease. Chest 1993; 6: 1715-9.
91. Iivananinen AM, Lindroos M, Tilvis R, Heikkila J, Kupari M. Calcific degeneration of the aortic valve in old age: is the development of flow obstruction predictable? J Intern Med 1996; 239: 269-73.
92. Bahler RC, Desser DR, Finkelhor RS, Brener SJ, Youssefi M. Factors leading to progression of valvular aortic stenosis. Am J Cardiol 199; 84: 1044-8.
93. Palta S, Pai AM, Gill KS, Pai RG. New insights into the progression of aortic stenosis implications for secondary prevention. Circulation 2000; 101: 2497-502.
94. Ngo MV, Gottdiener JS, Fletcher RD, Fernicola DJ, Gersh BJ. Smoking and obesity are associated with the progression of aortic stenosis. Am J Geriatr Cardiol 2001; 10: 86-90.
95. Novaro GM, Tiong IY, Pearce GL, Lauer MS, Sprecher DL, Griffin BP. Effect of hydroxymethylglutaryl coenzyme A reductase inhibitions on the progression of calcific aortic stenosis. Circulation 2001; 101: 2205-9.
96. Bellamy MF, Pellikka PA, Klarich K, Tajik AJ, Enriquez-Sarano M. Association of cholesterol levels, hydroxymethylglutaryl coenzyme-A reductase inhibitor treatment, and progression of aortic stenosis in the community. J Am Coll Cardiol 2002; 40: 1723-30.
97. Otto CM, Lind BK, Kitzman DW, Gersh BJ, Siscovick DS, for the Cardiovascular Heart Study. Association of aorticvalve sclerosis with cardiovascular mortality in the elderly. N Engl J Med 1999; 341: 142-7.
98. Carabello BA. Aortic sclerosis a window to the coronaries arteries? N Engl J Med 1999; 341: 193-5.
99. Dajani AS, Taubert KA, Wilson W. Prevention of bacterial endocarditis: recommendations by the American Heart Association. Circulation 1997; 96: 358-66.
100. Aronow WS, Ahn C, Kronzon I, Nanna M. Prognosis of congestive heart failure in patients aged 62 years with unoperated severe valvular aortic stenosis. Am J Cardiol 1993; 72: 846-8.
101. Aronow WS, Ahn C, Kronzon I, Nanna M. Prognosis of patients with heart failure and unoperated severe aortic valvular regurgitation and relation to ejection fraction. Am J Cardiol 1994; 74: 286-8.
102. Gradman AH, Harbison MA, Berger HJ, Geha AS, Shaw RK, Crocco CJ, et al. Ventricular arrhythmias late after aortic valve replacement and their relation to left ventricular performance. Am J Cardiol 1981; 48: 824-31.
103. Waszyrowski T, Kasprzak JD, Krzeminska-Pakula M, Drozdz J, Dziatkowiak A, Zaslonka J. Regression of left ventricular dilatation and hypertrophy after aortic valve replacement. Int J Cardiol 1996; 57: 217-25.
104. Pibarot P, Dumesnil JG, Leblanc MH, Cartier P, Metras J. Changes in left ventricular mass and function after aortic valve replacement: a comparison between stentless and stented bioprosthetic valves. J Am Soc Echocardiogr 1999; 12: 981-7.
105. Walther T, Falk V, Langebartels G, Kruger M, Bernhardt U, Diegeler A, et al. Prospectively randomized evaluation of stentless versus conventional biological aortic valves: impact on early regression of left ventricular hypertrophy. Circulation 1999; 100:II6-10.
106. De Paulis R, Sommariva L, Colagrande L, De Matteis GM, Fratini S, Tomai F, et al. Regression of left ventricular hypertrophy after aortic valve replacement for aortic stenosis with different valve substitutes. J Thorac Cardiovasc Surg 1998; 116: 590-8.
107. Thomson HL, O’Brien MF, Almeida AA, Tesar PJ, Davison MB, Burstow DJ. Haemodynamics and left ventricular mass regression: a comparison of the stentless, stented and mechanical aortic valve replacement. Eur J Cardiothorac Surg 1998; 13: 572-5.
108. Rajappan K, Melina G, Bellenger NG, Amrani M, Khaghani A, Pennell DJ, et al. Evaluation of left ventricular function and mass after Medtronic Freestyle versus homograaortic root replacement using cardiovascular magnetic resonance. J Heart Valve Dis 2002; 11: 60-5.
109. Zussa C, Polesel E, Rigo F, Guarracino F. Left ventricular remodeling after aortic valve replacement with the Toronto-SPV prosthesis. Semin Thorac Cardiovasc Surg 1999; 11: 103-6.
110 Krayenbuehl HP, Hess OM, Schneider J, Turina M. Left ventricular function and myocardial structure in aortic valve disease before and after surgery. Herz 1984; 9: 270-8.
111. Lee JW, Choi KJ, Lee SG, Choo SJ, Kim JO, Kang DH, et al. Left ventricular muscle mass regression after aortic valve replacement. J Korean Med Sci 1999; 14: 511-9.
112. Systematic Review of the outcome of Aortic Valve Replacement in Patients Whith Aortic Stenosis. Ann Thorac Surg 2004; 78: 90-5.
113. Connolly HM, Oh JK, Schaff HV, Roger VL, Osborn SL, Hodge DO, et al. Severe aortic stenosis with low transvalvular gradient and severe left ventricular dysfunction: result of aortic valve replacement in 52 patients. Circulation 2000; 101: 1940-6.
114. Kirklin JW. Cardiac Surgery. 2nd ed. New York: Churchil Livingstone,1996: 491-571.
115. Chiappini B, Camurri N, Laforte A, Di Marco L, Di Bartolomeo R, Marinelli G. Outcome after aortic valve replacement in octogenarians. Ann Thorac Surg 2004; 78: 85-9.