Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.19 no.2-3 Montevideo nov. 2004
ATENEO CLíNICO
A
Ecocardiograma con dobutamina.
Un caso poco frecuente pero grave
DRES. GUSTAVO VIGNOLO 1, ARIEL DURáN 1, ÁLVARO GONZáLEZ RAMA 2, RICARDO LLUBERAS 3
1. Profesor Adjunto de Cardiología.
2. Médico Cardiólogo.
3. Profesor de Cardiología.
Departamento de Cardiología. Hospital de Clínicas. Facultad de Medicina. Universidad de la República
Pensamos que este es un nuevo modo de estimular el intercambio de conocimientos y experiencias entre los socios y que resultará beneficioso para el desarrollo de la cardiología nacional.
HISTORIA CLíNICA
Paciente de 56 años, sexo femenino, con antecedentes personales de tabaquismo intenso, portadora de arteriopatía obstructiva crónica de miembros inferiores de cinco años de evolución con un perímetro de marcha actual de 20 metros. Niega historia de dolor precordial, disnea, edemas de miembros inferiores o palpitaciones.
Es enviada a policlínica para valoración preoperatoria de revascularización quirúrgica de miembros inferiores.
Examen físico: se comprobó un ritmo regular de 60 lpm, con ruidos cardíacos normales, sin soplos. En el examen cardiovascular periférico se comprobó pulsos radiales normales, pulsos femorales disminuidos, sin pulsos distales en ambos miembros inferiores. Presión arterial: 110/70 mmHg. El electrocardiograma se muestra en la figura 1.
* * *
Este caso clínico forma parte del gran capítulo de la valoración preoperatoria de cirugía no cardíaca. Como premisa básica se debe estimar el riesgo de eventos cardiovasculares asociados con la cirugía planeada, de acuerdo a la situación cardiovascular del paciente. Aplicando el algoritmo de evaluación preoperatoria de cirugía no cardíaca de American College of Cardiology/American Heart Association (ACC/AHA), la cirugía es de coordinación por lo que corresponde una evaluación cardiovascular previa (1). La paciente no presenta predictores de riesgo elevado (síndrome coronario agudo, insuficiencia cardíaca descompensada, arritmia grave o valvulopatía severa) ni predictores de riesgo moderado (infarto previo, angina estable, insuficiencia cardíaca compensada, diabetes o insuficiencia renal) ni predictores de bajo riesgo (edad avanzada, electrocardiograma anormal, ritmo no sinusal, baja capacidad funcional, stroke previo, hipertensión arterial no controlada). Dado que la paciente sólo puede caminar unos 20 metros sin claudicación de miembros inferiores podría definirse su capacidad funcional como mala y esto configurar un predictor de bajo riesgo, pero como la limitación depende de su arteriopatía de miembros inferiores, la capacidad funcional cardiovascular puede considerarse como no definible. Por otro lado, aun en caso de considerar a la capacidad funcional como baja, esto no cambia el esquema de estudio, dado que tener predictores de riesgo bajo se considera equivalente a no tenerlos. Por lo tanto, el riesgo de la paciente es bajo en base a sus antecedentes.
La siguiente pregunta es cuál es el riesgo de la cirugía planeada. Este se evaluó como elevado, dado que se trata de una cirugía arterial periférica. Reviste especial jerarquía conocer con precisión el procedimiento quirúrgico que se planea realizar, en especial si implica clampeo aórtico, porque conllevaría un riesgo adicional por el aumento de la poscarga que esto implica.
Si la clase funcional de la paciente fuera buena podría intervenirse sin más evaluación. Sin embargo, dado que el umbral para la isquemia de miembros inferiores es muy bajo, grados aun severos de isquemia miocárdica podrían no manifestarse clínicamente, simplemente por incapacidad para ejercitar. Es por esto que frente a un procedimiento de alto riesgo, se decidió solicitar un estudio funcional para descartar isquemia. Por otro lado, la probabilidad de enfermedad arterial coronaria en pacientes con arteriopatía obstructiva crónica de miembros inferiores es elevada en función de datos epidemiológicos (apéndice 1). Esto reafirma la indicación de realizar un estudio funcional como fue referido.Si bien el estudio funcional resulta de gran valor para catalogar el riesgo de la paciente en el preoperatorio, un resultado positivo no debería implicar automáticamente la realización de una coronariografía previa a la cirugía, sino que su realización dependería del tipo de resultado en relación a la magnitud de la isquemia detectada.
El reducido perímetro de marcha de la paciente hace impracticable la ergometría convencional. La ergometría con esfuerzo de miembros superiores podría constituir una opción conveniente porque permitiría definir la clase funcional de la paciente, además de provocar isquemia (2). Sin embargo, este estudio no está disponible en nuestro hospital.
Se optó entonces por un estudio con imágenes y estímulo farmacológico. En nuestro caso se solicitó un ecocardiograma con dobutamina.
El ecocardiograma con dobutamina se realizó según el protocolo habitual del laboratorio de ecocardiografía. Se verificó la ausencia de contraindicaciones antes de comenzar el estudio. Se realizó monitorización electrocardiográfica continua, así como registro de presión arterial y frecuencia cardíaca cada tres minutos. El protocolo utilizado fue el de detección de isquemia, consistente en la infusión de dosis progresivas de dobutamina, entre 10 y 40 µg/kg/min, con incrementos de 10 µg/kg/min cada tres minutos.
El ecocardiograma basal mostró un ventrículo izquierdo de dimensiones normales, con función sistólica global normal (FEVI 60%), hipertrofia ventricular izquierda leve e hipoquinesia posterior basal.
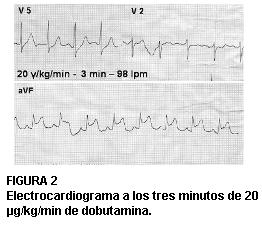
Durante la segunda etapa del ecocardiograma con dobutamina, a 20 µg/kg/min la paciente presenta dolor epigástrico intenso, aquinesia posterior mediobasal e inferior basal y supradesnivel del segmento ST en cara inferior de hasta 3 mm (figura 2). La tabla 1 muestra la planilla de control del estudio.
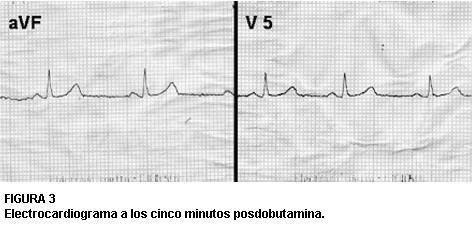
Se suspendió rápidamente la infusión de dobutamina y se administró metoprolol 1 mg por vía intravenosa por minuto por dos minutos, con remisión completa del angor. Se comprobó la renivelación completa del ST a los cinco minutos (figura 3).
El ecocardiograma con dobutamina fue informado como positivo para isquemia miocárdica posteroinferior, configurando una prueba de alto riesgo por ser positiva a baja dosis de dobutamina, presentar supradesnivel de ST y angor intenso durante la prueba.
Este resultado merece algunos comentarios. La isquemia fue provocada por un bajo nivel de consumo de oxígeno, dado que el doble producto correspondiente fue de 21.560, con escaso ascenso respecto al basal (17.600). Esto reafirma la severidad de la isquemia y el bajo umbral isquémico para la misma. La frecuencia cardíaca y la presión arterial sistólica son los determinantes mayores del consumo miocárdico de oxígeno. Un efecto precoz de la dobutamina es la mejoría de la función sistólica aun antes de aumentar la frecuencia cardíaca en forma significativa. Esto se acompaña de vasodilatación periférica por efecto beta 2 agonista, lo que determina un aumento del volumen sistólico. Dado que el umbral isquémico es tan bajo en este caso, el aumento del volumen sistólico puede haber jugado un rol en el desencadenamiento de la isquemia, aunque no es habitualmente reconocido como un determinante mayor del consumo miocárdico de oxígeno.
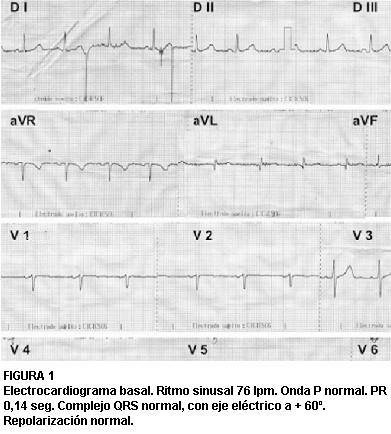
FIGURA 1
Electrocardiograma basal. Ritmo sinusal 76 lpm. Onda P normal. PR 0,14 seg. Complejo QRS normal, con eje eléctrico a + 60º. Repolarización normal.
El resultado de alto riesgo isquémico del ecocardiograma con dobutamina se consideró como indicación formal de coronariografía.
En cuanto a la oportunidad de la misma, se plantearon dos posibilidades:
- Emergencia. Fue planteado que la elevación del segmento ST fuera traducción de un accidente de placa con oclusión coronaria. Si este fuera el caso, que es poco probable, el ST hubiera renivelado al suspender la dobutamina y administrar una baja dosis de beta bloqueante, con remisión total del dolor. Esta no fue la interpretación inicial, por lo que el equipo de cardiología intervencionista no consideró la coronariografía de emergencia.
- Urgencia. Con ingreso previo de la paciente a unidad de cuidados coronarios, tratamiento con antiagregantes plaquetarios, heparina de bajo peso molecular y beta bloqueantes, realizando la coronariografía en 48-72 horas. Esta fue la estrategia por la que se optó.
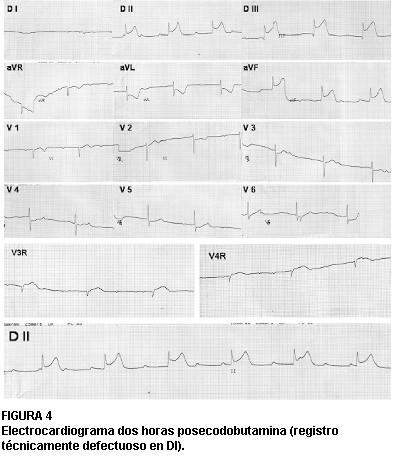
Dos horas después, previo a su ingreso a la unidad cardiológica, la paciente instala dolor precordial y epigástrico muy intenso, shock con presión arterial sistólica de 70 mmHg, bradicardia de 35 lpm y obnubilación. Es trasladada rápidamente a emergencia donde se comprueba el electrocardiograma (ECG) de la figura 4.
El diagnóstico fue de infarto agudo de miocardio de cara inferior (ST en DII, DIII y aVF) en etapa hiperaguda con extensión a ventrículo derecho (ST en V3R y V4R) e isquemia lateral alta (¯ST en aVL - su ausencia en DI puede corresponder a un defecto técnico en el registro de esta derivación), complicado con bloqueo auriculoventricular completo con escape nodal a 35 lpm (bradicardia de 35 lpm, con complejos angostos y ondas P a 100 lpm sin relación con los complejos QRS).
El infarto agudo de miocardio es una complicación poco frecuente del ecocardiograma con dobutamina. En un apartado final se resume la evidencia al respecto.
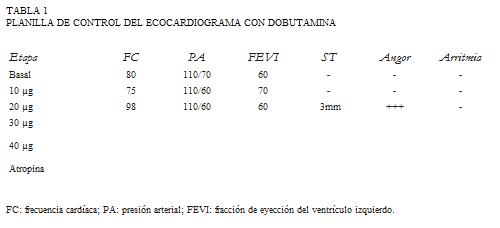
FIGURA 2
Electrocardiograma a los tres minutos de 20 µg/kg/min de dobutamina.
En este caso el infarto debe vincularse a un accidente de placa inducido por la dobutamina. El estrés con dobutamina probablemente haya determinado dos efectos mayores: por un lado puso en evidencia la existencia de una lesión crítica a través de las diferentes evidencias de isquemia analizadas. Por otro lado, determinó un accidente de placa con oclusión coronaria. Un mecanismo probablemente involucrado consiste en el aumento de las fuerzas de cizallamiento a nivel de la placa, vinculado al aumento de la contractilidad miocárdica, como se invoca frente a otros gatillos o desencadenantes de eventos coronarios agudos. Este mecanismo podría explicar la instalación diferida del infarto, dependiendo ésta del retraso entre el accidente de placa y la oclusión coronaria trombótica.
El tratamiento inmediato incluyó la infusión rápida de suero salino isotónico, como tratamiento eficaz del shock vinculado a infarto de ventrículo derecho, atropina 1 mg intravenosa, que revirtió transitoriamente el bloqueo aurículo ventricular completo y ácido acetilsalicílico 500 mg por vía oral.
Se coordinó rápidamente el traslado a sala de hemodinamia, donde llegó en aproximadamente 25 minutos, para realización de coronariografía y angioplastia primaria como tratamiento de reperfusión del infarto de miocardio.
Se optó por el abordaje radial, considerando prudente evitar el abordaje femoral en una paciente con enfermedad arterial periférica severa.
Se colocó un marcapaso transvenoso transitorio con catéter de Furman, por abordaje yugular derecho, para asegurar una frecuencia ventricular apropiada durante el procedimiento y eventualmente luego del mismo.
Una alternativa a la estimulación ventricular aislada hubiera sido la estimulación bicameral, con colocación de un cable adicional en la aurícula derecha, para asegurar la sincronía auriculoventricular como forma de optimizar el llenado ventricular.
La coronariografía mostró:
- Oclusión proximal de arteria coronaria derecha (ACD) con imagen de trombo en su interior, sin circulación colateral evidente.
- Lesión severa de arteria descendente anterior (ADA) en tercio medio, inmediatamente distal al origen del primer ramo diagonal.
- Arteria circunfleja sin lesiones.
De acuerdo a este resultado, el vaso responsable del infarto en curso es la arteria coronaria derecha y está formalmente indicada la angioplastia (ATC) primaria sobre este vaso.
La conducta a adoptar con la lesión de ADA merece una consideración especial. Las conductas posibles incluyen:
- Angioplastia de la lesión de ADA, bajo la estrategia de revascularización completa en la angioplastia primaria en el infarto complicado con shock cardiogénico. Esta opción es discutible en base a que si bien la paciente está en shock, el bloqueo auriculoventricular completo es un factor corregible que puede pesar fuertemente en la repercusión hemodinámica y la angioplastia de ACD puede revertirlo. La angioplastia de ADA agrega el riesgo diferido de reestenosis en un vaso del que no existe evidencia de que genere isquemia, de acuerdo al resultado del ecodobutamina. Como contrapartida, la lesión de ADA es muy severa y, en caso de no dilatarla, si ocurriera reestenosis de la ACD, esto podría implicar un riesgo isquémico muy elevado para la paciente.
FIGURA 3
Electrocardiograma a los cinco minutos posdobutamina.
- En este punto existían dos alternativas: realizar la angioplastia de ADA según evolución hemodinámica inicial sólo en caso de no mejorar rápidamente luego de reperfundida la ACD, o no realizar angioplastia de ADA en este procedimiento, difiriéndola o supeditándola a que en la evolución, de ser ésta favorable, se demuestre isquemia en su territorio.
La conducta adoptada fue ATC primaria de ACD, con stent 3,0 x 16 mm, con éxito angiográfico y ATC de lesión de tercio medio de ADA, con stent 2,5 x 13 mm con éxito angiográfico sobre ADA, aunque con pérdida del ramo diagonal adyacente a la lesión.
Pocos minutos después de la dilatación de ADA la paciente reinstala angor con ST en cara inferior. Se realiza una coronariografía selectiva derecha y se comprueba nuevamente oclusión de ACD con imagen de trombo intrastent.
El tratamiento de la trombosis aguda del stent incluye un tratamiento anticoagulante apropiado, controlando el tiempo de coagulación activado, antiagregación plaquetaria intensa, de preferencia con inhibidores IIb/IIIa (no disponibles en nuestro hospital) y sobredilatación del stent. Esta medida se basa en que una de las causas de la trombosis es la mala aposición del stent. La nueva dilatación se realizó con un balón 3,5 x 20 mm, con éxito angiográfico mantenido (ausencia de lesión residual y flujo TIMI 3).
Fue referida la utilización de dispositivos para evitar la embolia coronaria distal (por ejemplo, PercuSurge®, AngioGuard®) pero no están disponibles en nuestro medio; en cualquier caso, un argumento en contra para el uso de estos dispositivos es la demora en la dilatación del vaso culpable que ellos implican. También se mencionó la potencial utilidad de dispositivos de aspiración de trombos intracoronarios.
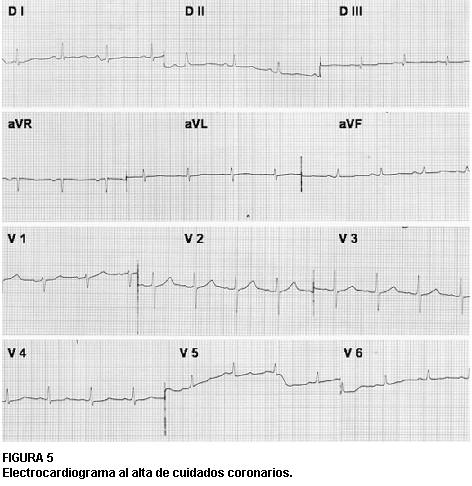
La evolución fue muy buena con desaparición del angor, remisión de las alteraciones electrocardiográficas, con conducción auriculoventricular normal (figura 5) y desaparición de alteraciones de la motilidad segmentaria. Se asistió a una rápida mejoría hemodinámica sin necesidad de soporte inotrópico o vasoactivo. La paciente fue dada de alta a sala general a las 72 horas. Se realizó tratamiento antiagregante con AAS y clopidogrel a dosis habituales.
Luego de superada esta grave complicación del ecodobutamina, debe reconsiderarse la oportunidad quirúrgica para revascularización de miembros inferiores. Si bien la revascularización coronaria fue completa, podría ocurrir reestenosis, en especial tomando en cuenta que los stents utilizados no son elusores de fármacos que prevengan la reestenosis (rapamicina o paclitaxel). Por esto, podría recomendarse la intervención precoz sobre los 30 días del evento agudo. Sin embargo, la cirugía vascular implica suspender la antiagregación plaquetaria. Esto no sería conveniente hasta que la endotelización de los stents sea completa, lo que habitualmente ocurre hacia el fin del primer mes en los stents sin drogas y del tercer mes en los elusores de fármacos.
FIGURA 4
Electrocardiograma dos horas posecodobutamina (registro técnicamente defectuoso en DI).
CONCLUSIÓN
Se ha presentado el caso de una paciente en el preoperatorio de revascularización de miembros inferiores que es referida para valoración cardiovascular preoperatoria. La valoración con tests no invasivos para descartar isquemia es práctica frecuente en estos pacientes, pero en este caso ocurrió una complicación grave e infrecuente del ecocardiograma con dobutamina, con infarto de cara inferior y ventrículo derecho con bloqueo auriculoventricular completo y shock cardiogénico, por inestabilización de una placa proximal de ACD con trombosis sobreagregada. La ATC primaria de ACD se complicó con trombosis aguda intrastent vinculable a mala posición del stent que se solucionó con sobredilatación del mismo, con éxito angiográfico final. La evolución fue buena, analizándose la oportunidad más razonable para realizar la revascularización de miembros inferiores que motivó su consulta inicial.
APÉNDICE 1
RELACIÓN EPIDEMIOLÓGICA ENTRE ENFERMEDAD ARTERIAL PERIFÉRICA Y ENFERMEDAD ARTERIAL CORONARIA
Los pacientes con enfermedad arterial periférica padecen frecuentemente de enfermedad coronaria y cerebrovascular concomitante (3,4). La prevalencia relativa de cada una de ellas depende en parte de los criterios diagnósticos utilizados. En una serie al respecto, los pacientes con enfermedad arterial periférica estudiados sistemáticamente con coronariografía tuvieron mayor prevalencia de lesión de tronco de coronaria izquierda (18% versus <1%) y mayor prevalencia de lesión de tres vasos (63% versus 11%), en comparación con los pacientes sin enfermedad arterial periférica (5). En el estudio CAPRIE el 21% de los pacientes con enfermedad arterial periférica tenía historia de infarto de miocardio y el 26% tenía historia de angina (6). En el Cardiovascular Health Study, los pacientes con índice tobillo brazo anormal tenían una prevalencia doble de antecedente de infarto de miocardio, angina, insuficiencia cardíaca congestiva o enfermedad cerebrovascular en comparación con aquellos con índice normal (3).
FIGURA 5
Electrocardiograma al alta de cuidados coronarios.
La relación entre enfermedad arterial periférica y enfermedad arterial coronaria es aun más pronunciada en pacientes añosos, como surge de la serie de Ness y colaboradores, que mostró que el 68% de los pacientes de una serie con media de edad de 80 años y enfermedad arterial periférica presentaban cardiopatía isquémica (4).
La enfermedad arterial periférica también se asocia con aumento del riesgo de muerte cardiovascular y éste es máximo en los pacientes con enfermedad periférica más severa (3,4,6-11). Es así que la mortalidad a un año de los pacientes con isquemia crítica es de 25% aproximadamente y alcanza el 45% en los que han requerido amputación (12,13). De acuerdo al estudio Framingham, los pacientes con enfermedad arterial periférica, aun en ausencia de antecedente de infarto de miocardio o accidente cerebrovascular isquémico, tienen aproximadamente el mismo riesgo relativo de muerte de causa cardiovascular que aquellos con historia de cardiopatía isquémica o enfermedad cerebrovascular (14).
APéNDICE 2
SEGURIDAD Y COMPLICACIONES DEL ECOCARDIOGRAMA CON DOBUTAMINA
A pesar de la presentación dramática de este infarto de miocardio como complicación del ecocardiograma con dobutamina, este es un estudio seguro, con baja incidencia de complicaciones. La incidencia de complicaciones graves (taquicardia ventricular, fibrilación ventricular, infarto de miocardio o necesidad de internación) no supera el 0,5% en estudios con grandes números de pacientes (15).
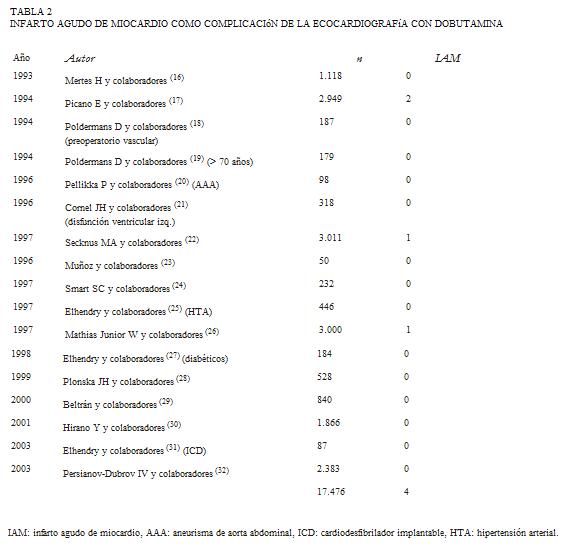
Respecto a la incidencia del infarto de miocardio realizamos una búsqueda al respecto que se resume en la tabla 2. Sobre un total de 17.476 pacientes sólo fueron reportados cuatro infartos agudos de miocardio, lo que corresponde a 0,023%.
En un trabajo de Poldermans y colaboradores sobre 187 pacientes en preoperatorio de cirugía vascular, no hubo ningún infarto como complicación del estudio de ecodobutamina, lo que remarca la seguridad de este estudio en un grupo de pacientes que podría incluir a nuestro caso (18). Este estudio también reafirma el elevado valor predictivo del ecodobutamina en el preoperatorio vascular dado que en esta población ocurrieron 18 eventos cardiovasculares perioperatorios: cinco infartos fatales, tres infartos no fatales, nueve episodios de angina inestable y un episodio de edema agudo de pulmón. Todos estos eventos ocurrieron en pacientes con ecodobutamina positivo para isquemia y, por el contrario, ningún evento ocurrió en pacientes con estudios negativos, por lo que el valor predictivo negativo de un ecocardiograma con dobutamina en el preoperatorio vascular fue de 100%. El valor predictivo positivo, sin embargo, fue bajo (32%), por lo que la conducta probablemente no deba definirse únicamente en base a un resultado positivo.
Un metaanálisis sobre el valor diagnóstico de seis métodos diagnósticos para predecir riesgo cardiovascular en pacientes que serían sometidos a cirugía vascular mayor demostró que el ecocardiograma con dobutamina tuvo la mayor sensibilidad (85%) y una especificidad razonable (70%) para predecir muerte e infarto (33). Se comprobó una tendencia a un mayor rendimiento diagnóstico de la ecodobutamina en comparación con otros estudios, pero esto sólo fue estadísticamente significativo en comparación con el centellograma de perfusión miocárdico.
Del análisis de la literatura nacional surgen dos estudios sobre la seguridad del ecodobutamina. Tanto en el estudio de Muñoz y colaboradores (23) sobre 50 pacientes, como en el de Beltrán y colaboradores (29) sobre 840 pacientes, no se reporta ningún infarto de miocardio, siendo nula la mortalidad en ambas series. En el estudio de Muñoz y colaboradores la prueba debió ser suspendida en 14% de los casos por efectos secundarios (hipertensión arterial, angor, arritmia ventricular o hipotensión sintomática). En el estudio de Beltrán y colaboradores las complicaciones fueron poco frecuentes: un episodio de taquicardia ventricular sostenida, extrasístole ventricular compleja en el 10% de los casos, extrasístole ventricular aislada en 15,4% y fibrilación auricular o taquicardia paroxística supraventricular en 4,6%, debiéndose suspender la prueba por efectos secundarios en solamente seis pacientes.
El estudio de Lattanzi y colaboradores sobre 26.438 ecocardiogramas con dobutamina, incluidos en 35 estudios clínicos con más de 100 tests cada uno, reportó 79 complicaciones graves (infarto, taquicardia ventricular sostenida, fibrilación ventricular, asístole o hipotensión severa sintomática), concluyendo que la incidencia de complicaciones graves es de 1 cada 335 estudios (34).
En definitiva, el análisis de la literatura permite afirmar que el ecocardiograma con dobutamina es seguro, con baja incidencia de complicaciones graves, incluyendo el infarto agudo de miocardio. Esto es válido cuando el estudio es realizado por cualquier indicación, pero también en la valoración preoperatoria de cirugía vascular, con una valor diagnóstico elevado en este contexto.
BIBLIOGRAFíA
1. Eagle KA, Berger PB, Calkins H, Chaitman BR, Ewy GA, Fleischmann KE, et al. ACC/AHA guideline update for perioperative cardiovascular evaluation for noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Update the 1996 Guidelines on Perioperative Cardiovascular Evaluation for Noncardiac Surgery). 2002. American College of Cardiology Web site. Available at: http:/www.acc. org/clinical/guidelines/perio/dirIndex.htm.
2. Chaitman BR. Exercise Stress Testing. In: Braunwald E, Zipes DP, Libby P (eds). Heart Disease. Philadelphia: WB Saunders, 2001.
3. Newman AB, Siscovick DS, Manolio TA, Polak J, Fried LP, Borhani NO, Wolfson SK. . Ankle-arm index as a marker of atherosclerosis in the Cardiovascular Health Study. Cardiovascular Heart Study (CHS) Collaborative Research Group. Circulation 1993; 88: 837-45.
4. Ness J, Aronow WS. Prevalence of coexistence of coronary artery disease, ischemic stroke, and peripheral arterial disease in older persons, mean age 80 years, in an academic hospital-based geriatrics practice. J Am Geriatr Soc 1999; 47: 1255-6.
5. Sukhija R, Yalamanchili K, Aronow WS. Prevalence of left main coronary artery disease, of three- or four-vessel coronary artery disease, and of obstructive coronary artery disease in patients with and without peripheral arterial disease undergoing coronary angiography for suspected coronary artery disease. Am J Cardiol 2003; 92(3): 304-5.
6. Leng GC, Lee AJ, Fowkes FG, Dunbar J, Housley E, Ruckley CV. Incidence, natural history and cardiovascular events in symptomatic and asymptomatic peripheral arterial disease in the general population. Int J Epidemiol 1996; 25: 1172-81.
7. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet 1996; 348: 1329-39.
8. Criqui MH, Langer RD, Fronek A, Feigelson HS, Klauber MR, McCann TJ, Browner D. Mortality over a period of 10 years in patients with peripheral arterial disease. N Engl J Med 1992; 326: 381-6.
9. Newman AB, Sutton-Tyrrell K, Vogt MT, Kuller LH. Morbidity and mortality in hypertensive adults with a low ankle/arm blood pressure index. JAMA 1993; 270: 487-9.
10. McKenna M, Wolfson S, Kuller L. The ratio of ankle and arm arterial pressure as an independent predictor of mortality. Atherosclerosis 1991; 87: 119-28.
11. Howell MA, Colgan MP, Seeger RW, Ramsey DE, Sumner DS. Relationship of severity of lower limb peripheral vascular disease to mortality and morbidity: A six-year follow-up study. J Vasc Surg 1989; 9: 691-6.
12. Reunanen A, Takkunen H, Aromaa A. Prevalence of intermittent claudication and its effect on mortality. Acta Med Scand 1982; 211: 249-56.
13. Luther M. The influence of arterial reconstructive surgery on the outcome of critical leg ischaemia. Eur J Vasc Surg 1994; 8: 682-9.
14. Kannel WB, Skinner JJ, Schartz MJ. Intermitent claudication incidence in the Framingham study. Circulation 1970; 18: 875.
15. Orsinelli DA, Daniels CJ. Ecocardiografía de esfuerzo farmacológico. Pruebas de esfuerzo con dobutamina y arbutamina. Ecocardiografía de Stress. Ed: Aurigemma GP. McGraw- Hill Interamericana. Clínicas Cardiológicas de Norteamérica 1999; 3: 507-27.
16. Mertes H, Sawada SG, Ryan T, Segar DS, Kovacs R, Foltz J, et al. Symptoms, adverse effects, and complications associated with dobutamine stress echocardiography. Experience in 1118 patients. Circulation 1993; 88(1): 15-9.
17. Picano E, Mathias W Jr, Pingitore A, Bigi R, Previtali M. Safety and tolerability of dobutamine-atropine stress echocardiography: a prospective, multicentre study. Echo Dobutamine International Cooperative Study Group. Lancet 1994; 344(8931): 1190-2.
18. Poldermans D, Fioretti PM, Forster T, Boersma E, Arnese M, du Bois NA, et al. Dobutamine-atropine stress echocardiography for assessment of perioperative and late cardiac risk in patients undergoing major vascular surgery. Eur J Vasc Surg 1994; 8(3): 286-93.
19. Poldermans D, Fioretti PM, Boersma E, Thomson IR, Cornel JH, ten Cate FJ, et al. Dobutamine-atropine stress echocardiography in elderly patients unable to perform an exercise test. Hemodynamic characteristics, safety, and prognostic value. Arch Intern Med 1994; 154(23): 2681-6.
20. Pellikka PA, Roger VL, Oh JK, Seward JB, Tajik AJ. Safety of performing dobutamine stress echocardiography in patients with abdominal aortic aneurysm > or = 4 cm in diameter. Am J Cardiol 1996; 77(5): 413-6.
21. Cornel JH, Balk AH, Boersma E, Maat AP, Elhendy A, Arnese M, et al. Safety and feasibility of dobutamine-atropine stress echocardiography in patients with ischemic left ventricular dysfunction. J Am Soc Echocardiogr 1996; 9(1): 27-32.
22. Secknus MA, Marwick TH. Evolution of dobutamine echocardiography protocols and indications: safety and side effects in 3,011 studies over 5 years. J Am Coll Cardiol. 1997;29(6):1234-40.
23. Muñoz L, Areco D. Incidencia de efectos secundarios y complicaciones en el ecocardiograma de estrés con dobutamina. Rev Urug Cardiol 1996; 11(3): 156 Abs 28.
24. Smart SC, Knickelbine T, Stoiber TR, Carlos M, Wynsen JC, Sagar KB. Safety and accuracy of dobutamine-atropine stress echocardiography for the detection of residual stenosis of the infarct-related artery and multivessel disease during the first week after acute myocardial infarction. Circulation 1997; 95(6): 1394-401.
25. Elhendy A, van Domburg RT, Roelandt JR, Geleijnse ML, Ibrahim MM, Fioretti PM. Safety and feasibility of dobutamine-atropine stress testing in hypertensive patients. Hypertension 1997; 29(6): 1232-9.
26. Mathias Junior W, Beneti LP, dos Santos FC, Duprat R, Beraldo A, Gil MA, et al. Safety and feasibility of dobutamine-atropine stress echocardiography. Arq Bras Cardiol 1997; 69(1): 31-4.
27. Elhendy A, van Domburg RT, Poldermans D, Bax JJ, Nierop PR, Geleijnse ML, et al. Safety and feasibility of dobutamine-atropine stress echocardiography for the diagnosis of coronary artery disease in diabetic patients unable to perform an exercise stress test. Diabetes Care 1998; 21(11): 1797-802.
28. Plonska E, Szwed H, Gasior Z, Drozdz J, Gackowski A, Szyszka A, et al. Side effects during dobutamine stress echocardiography: analysis of 582 studies. Pol Merkuriusz Lek 1999; 7(40): 164-8.
29. Beltrán A, González Moreno JB, Besada L. Seguridad de la ecodobutamina en el diagnóstico de la enfermedad coronaria: nuestra experiencia en 840 estudios de provocación de isquemia. Rev Urug Cardiol 2000; 15(2-3): 121 Abs 6.
30. Hirano Y, Yamamoto T, Uehara H, Nakamura H, Wufuer M, Yamada S, et al. Complications of stress echocardiography. J Cardiol 2001; 38(2): 73-80.
31. Elhendy A, Windle J, Porter TR. Safety and feasibility of dobutamine stress echocardiography in patients with implantable cardioverter defibrillators. Am J Cardiol 2003; 92(4): 475-7.
32. Persianov-Dubrov IV, Alekhin MN, Gogin GE, Glezer MG, Sidorenko BA. Safety of exercise and dobutamine stress echocardiography (results of 2383 tests). Kardiologiia 2003; 43(4): 18-22.
33. Kertai MD, Boersma E, Bax JJ, Heijenbrok-Kal MH, Hunink MG, L’talien GJ, et al. A meta-analysis comparing the prognostic accuracy of six diagnostic tests for predicting perioperative cardiac risk in patients undergoing major vascular surgery. Heart 2003; 89(11): 1327-34.
34. Lattanzi F, Picano E, Adamo E, Varga A. Dobutamine stress echocardiography: safety in diagnosing coronary artery disease. Drug Saf 2000; 22(4): 251-62.
COMENTARIO DEL COMITé EDITORIAL
Creemos de interés realizar algunas consideraciones con respecto al caso que motiva este ateneo. La paciente presentaba una hipoquinesia posterior basal que correspondía con el territorio del infarto de acuerdo al ECG y a la arteria culpable de la coronariografía, que requirió angioplastia primaria. Por lo tanto, puede considerarse que esa hipoquinesia estaba demostrando isquemia antes de comenzar la infusión de dobutamina. La resolución completa de esta alteración después de la revascularización avala este planteo. Por otro lado, la hipoquinesia comprobada se incrementó con la dobutamina, pasando a aquinesia y además se extendió al resto de la pared inferior, como expresión de un trastorno de perfusión mayor en el territorio de la arteria coronaria derecha.
En ese sentido la prueba con dobutamina podría considerarse de riesgo elevado antes de empezar la infusión y obligaría a plantearse la no realización de la misma en estas condiciones, o a tomar extremas precauciones usando muy bajas dosis de dobutamina (2,5 µg/kg/min).
En estas condiciones, la detección de isquemia debería ser lo más precoz posible durante la infusión con dobutamina. Hay evidencias de que la manifestación más precoz de isquemia es el retardo en la contracción o tardoquinesia, evidenciada como un retraso mayor o igual de 100 mseg respecto a los segmentos normales (Matti, Luotolatti y colaboradores, Echocardiography 1998;15[4]:345). Este retraso de la contracción a veces es ostensible como una forma “leve” de hipoquinesia que, a diferencia de la tardoquinesia, implica una reducción del engrosamiento sistólico. Los autores mejoraron la sensibilidad de la prueba tomando esta condición como signo precoz de isquemia.
Una opción eficaz para la demostración de isquemia en pacientes con un trastorno de la motilidad segmentaria en el estudio basal consiste en la administración de nitratos sublinguales o metoprolol en lugar de dobutamina, esperando una normalización de la contractilidad de la pared inferior. La adquisición de las imágenes en forma similar al protocolo de estrés permite objetivar los cambios.