Introducción
La hipertensión pulmonar tromboembólica crónica (HPTEC) constituye la complicación a largo plazo más grave de la embolia pulmonar aguda (EPA), forma parte del grupo clínico 4 de la clasificación internacional de hipertensión pulmonar (HP por obstrucción tromboembólica de las arterias pulmonares) y afecta aproximadamente a un tercio de los pacientes referidos a los centros expertos de HP.1,2 Los estudios epidemiológicos actuales sugieren una incidencia de la HPTEC de 3-5 casos/millón habitantes por año en EE.UU. y Europa y una prevalencia entre 26-38 pacientes/millón habitantes.3,4 Aproximadamente entre el 25% y el 35% de estos pacientes carecen de antecedentes de EPA, lo que plantea la posibilidad de trombosis pulmonar ‘in-situ’ y/o de episodios de EPA silentes.5 La incidencia estimada de HPTEC después de la EPA oscila entre 2,0 y 3,8 %.6,7,8
La HPTEC es una enfermedad progresiva y fatal sin tratamiento, caracterizada desde el punto de vista anatomopatológico, por la presencia de dos tipos de lesiones vasculares: a) la obstrucción fibrotrombótica persistente de las arterias pulmonares elásticas secundaria a la resolución incompleta y organización de los trombos luego de una EPA (afectación proximal a nivel lobar-segmentario y distal a nivel subsegmentario)9 y b) la afectación microvascular distal de vasos <500 μm secundaria, caracterizada por la remodelación no-trombótica de arteriolas y capilares (endomioproliferación). Dicha afectación microvascular distal es secundaria al hiperflujo secundario a la desviación del flujo sanguíneo desde las zonas obstruídas y a la circulación sistémica colateral de las anastomosis sistémico-pulmonares (bronquial, coronaria, intercostales).1,10
El diagnóstico de la HPTEC se basa en los hallazgos obtenidos después de al menos 3 meses de anticoagulación eficaz luego de una EPA e incluye: la presencia de defectos de perfusión pulmonar en áreas bien ventiladas en el centellograma de ventilación/perfusión (V/Q) y signos específicos de coágulos crónicos en la angiotomografía pulmonar (AngioTC) o la arteriografía pulmonar con o sin sustracción digital, como ser estenosis en forma de anillo, membranas/hendiduras, irregularidades de la pared y/o oclusiones totales en las arterias pulmonares (principales, lobares, segmentarias o subsegmentarias), junto con valores de HP precapilar en el cateterismo cardíaco derecho (CCD).1 El diagnóstico precoz de la HPTEC aumenta el beneficio del tratamiento quirúrgico y la supervivencia.2 En comparación con la hipertensión arterial pulmonar idiopática y a igual carga estacionaria (resistencia vascular pulmonar, RVP), en la HPTEC el ventrículo derecho (VD) está menos adaptado, con mayor dilatación y rigidez, como consecuencia de una mayor tensión de su pared asociada al aumento desproporcionado de la carga pulsátil (capacitancia arterial pulmonar, CAP).11,12
Sin tratamiento y dependiendo del grado de HP, la supervivencia media estimada a los 5 años de los pacientes con HPTEC es de ~30% debido a la falla del VD.13 El tratamiento de elección y la única opción potencialmente curativa es la tromboendarterectomía pulmonar (TEA), que consiste en remover y desobstruir en forma mecánica el material fibrótico presente en la pared arterial pulmonar.14,15 Los objetivos de la TEA son: disminuir la poscarga del VD evitando la falla ventricular derecha (estabilización de la hemodinamia), mejorar la eficiencia ventilatoria (estabilización respiratoria) al liberar espacios ventilados no perfundidos, aumentar la capacidad de ejercicio y mejorar la supervivencia significativamente (sobrevida 90% versus 30% en los no operados a los 5 años).1,16
En Uruguay existe desde 2011 un convenio binacional para realizar la TEA en el Hospital Universitario Fundación Favaloro (HUFF) de Argentina, con financiación del Fondo Nacional de Recursos (FNR).17 Los objetivos del presente estudio son: 1) describir y analizar las características demográficas, clínicas, ecocardiográficas y hemodinámicas de la población sometida a TEA y 2) analizar los resultados quirúrgicos y del seguimiento a corto, mediano y largo plazo de los pacientes en estos 13 años de trabajo conjunto.
Materiales y métodos
Se realizó un estudio analítico observacional retrospectivo y descriptivo. Se analizaron las historias clínicas y descripciones operatorias de todos los pacientes uruguayos sometidos a TEA entre enero del 2011 y diciembre del 2023 en el HUFF. Se recogieron variables demográficas, clínicas, hemodinámicas, de tratamiento y supervivencia. Se mantuvo la confidencialidad de los pacientes y la documentación fue aprobada por el Comité de Ética del Hospital Maciel.
Población de Estudio
Se incluyeron pacientes >18 años, excluyendo pacientes con patología psiquiátrica, embarazadas, con contraindicación para la anticoagulación o con enfermedad neoplásica terminal. Todos los pacientes candidatos a TEA cumplían los criterios de definición para HPTEC según las guías 2015 que incluían los criterios hemodinámicos por CCD de una presión arterial pulmonar media (PAPm) ≥25 mmHg, RVP ≥3 unidades Wood (UW) y una presión de oclusión de la arteria pulmonar (POAP) ≤15 mmHg, asociados a defectos de perfusión en el centellograma V/Q y/o en la arteriografía pulmonar, habiendo recibido al menos tres meses de tratamiento anticoagulante óptimo.18 Ninguna cifra de RVP ni la presencia de insuficiencia cardíaca derecha avanzada fueron criterios de exclusión.
Selección de pacientes candidatos a tromboendarterectomía pulmonar
Una vez detectados en nuestra Unidad, los pacientes son referidos al centro experto HUFF donde se realiza una exhaustiva evaluación preoperatoria que comprende: ECG, RxTx, ecocardiograma-Doppler (que incluyó la estimación del cociente TAPSE/PAPs -excursión sistólica del plano del anillo tricuspídeo/presión arterial pulmonar sistólica- como parámetro del acoplamiento ventrículo-arterial)19, estudios de función respiratoria e intercambio gaseoso, prueba de la marcha de 6 minutos (PM6M), pruebas de laboratorio y estudios hematológicos, centellograma V/Q, angioTC de alta resolución y CCD con arteriografía pulmonar y cineangiocoronariografía en sujetos mayores de 45 años o con antecedentes de factores de riesgo cardiovascular o cardiopatía isquémica. Se obtuvo el gasto cardíaco (GC) mediante termodilución y se estimaron la RVP ((PAPm - PAOP)/GC), el índice cardíaco (IC) (GC/superficie corporal) y el volumen sistólico indexado (VSI) (IC/frecuencia cardíaca). La selección de pacientes para el tratamiento quirúrgico se realizó mediante la discusión interdisciplinaria del equipo de HP del HUFF considerando la historia clínica (clase funcional, presencia de comorbilidades incluyendo la expectativa de vida), los resultados de los estudios (severidad de la HP y de la disfunción del VD), así como la accesibilidad quirúrgica y experiencia del cirujano cardíaco.20 Si el paciente era quirúrgico la TEA se realizó en la misma internación.
Técnica operatoria y seguimiento posoperatorio
La técnica operatoria se ajustó al protocolo del grupo de la Universidad de California San Diego (UCSD).21 Se realizó el abordaje quirúrgico de ambas arterias pulmonares mediante esternotomía media con circulación extracorpórea (CEC) y clampeo aórtico. La TEA se realizó durante períodos de parada circulatoria en hipotermia profunda (~17 °C) de veinte minutos, seguidos de lapsos de reperfusión hasta alcanzar una saturación venosa mixta del 90%. Se empleó cardioplegia sanguínea fría anterógrada para la protección miocárdica. El material extraído se clasificó según la clasificación intraoperatoria actual propuesta por la UCSD que emplea niveles según la localización de las lesiones obstructivas (Tabla 1).16,20,22 El posoperatorio inmediato se realizó en el área de Recuperación Cardiovascular (RCV), realizándose monitoreo hemodinámico invasivo y de gases en sangre, oximetría de pulso, ECG, RxTx y ecocardiograma-Doppler. Se recogieron los datos de las complicaciones posoperatorias (injuria por reperfusión, arritmias, necesidad de oxigenación mediante membrana extracorpórea -ECMO- veno-venosa -V-V-, falla cardíaca y necesidad de ECMO veno-arterial -V-A-, complicaciones neurológicas, infecciones, HP residual -HPres-), estancia hospitalaria (que incluyó el preoperatorio) y mortalidad intrahospitalaria (a 30 días). Se definieron: a) lesión pulmonar por reperfusión a la presencia de insuficiencia respiratoria (PaO2/FiO2 <300 mmHg) y de opacidades en la radiografía de tórax en áreas que fueron reperfundidas, en ausencia de otras causas de la hipoxemia o anomalías radiológicas, b) HPRes como aquel valor de PAPm posoperatoria inmediata >25 mmHg23,24,25 y c) HP recurrente (HPRec) en aquellos casos que luego de una TEA exitosa (PAPm posoperatoria normal), reinstala sintomatología con nuevas alteraciones imagenológicas e HP.1
Tabla 1. Clasificación quirúrgica de la enfermedad pulmonar tromboembólica crónica.
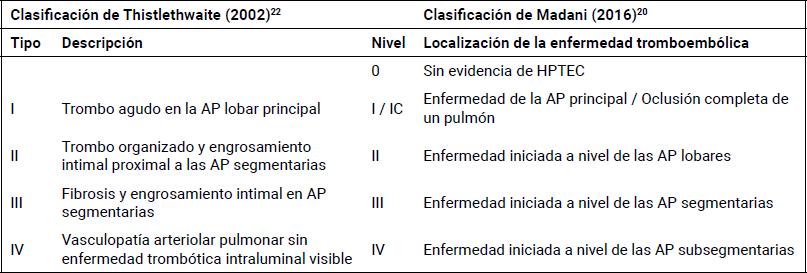
Clasificación quirúrgica de la enfermedad tromboembólica mediante criterios visuales (Thistlethwaite-UCSD)22 o localización anatómica (Madani-UCSD)20. La clasificación histórica propuesta por Thistlethwaite, et al., ha sido validada para predecir resultados quirúrgicos tempranos. Los tipos quirúrgicos más elevados se asocian con peores resultados. La clasificación contemporánea ha sido propuesta por Madani, et al., para abordar especialmente la enfermedad distal y los resultados a largo plazo. Los niveles se correlacionan con la ubicación anatómica y el grado de complejidad quirúrgica, donde un nivel más elevado representa resecciones más difíciles. (El nivel 0 corresponde al tipo 4; los niveles I y II corresponden al tipo 1 o 2; los niveles III y IV corresponden al tipo 3 y el nivel IC es nuevo). AP: arteria pulmonar.
Al alta del HUFF el seguimiento postoperatorio se realizó en la Unidad de HP del Hospital Maciel. Se realizó la valoración clínica, PM6M, laboratorio (con determinación BNP/NT-proBNP), y ecocardiografía-Doppler al menos cada 6 meses y si corresponde estudio hemodinámico (BNP >50 ng/L o NT-proBNP >300 ng/L y/o alta probabilidad de HP por ecocardiografía-Doppler).26 Todos los pacientes fueron tratados con anticoagulación oral en forma crónica, aporte de oxígeno suplementario en la etapa inicial si presentaban insuficiencia respiratoria y a largo plazo si presentaban desaturación arterial en la PM6M y diuréticos y/o vasodilatadores en los pacientes que persistieron con HP con o sin disfunción del VD.
Análisis estadístico
Las variables continuas se expresaron como media ± desviación estándar (DE), o como mediana con rango intercuartílico (P25-P75) y se compararon mediante la prueba de la t de Student o su equivalente no paramétrico según corresponda. Las variables categóricas se expresaron como frecuencias, n (%) y se compararon mediante Chi-cuadrado o test de Fisher. Se compararon los datos clínicos, funcionales, ecocardiográficos y hemodinámicos del preoperatorio y hasta los 3-6 meses del postoperatorio. Se analizaron las características preoperatorias de los sobrevivientes versus los fallecidos en el perioperatorio. Se compararon diferentes variables pre y posoperatorias de los sobrevivientes con y sin HPRes. Se obtuvo la función de supervivencia global (método de Kaplan-Meier) al año, 3 y 5 años. Se tomó como tiempo 0 la fecha de la cirugía. Se consideró significativo un valor de p <0.05. El análisis estadístico se realizó con SPSS versión 20 (SPSS Inc., Chicago, IL, EE. UU.).
Resultados
Características de la población
Durante el período enero 2011-diciembre 2023 fueron evaluados 25 pacientes con diagnóstico de HPTEC. Quince pacientes (60%) fueron operados en el HUFF. Los restantes 10 pacientes (40%) no fueron operados por diferentes motivos: cinco (20%) fueron inoperables (3 por inaccesibilidad quirúrgica y 2 por causas médicas -edad/comorbilidades- con un cociente riesgo/beneficio desfavorable), uno (4%) por negación del paciente, dos (8%) por pérdida del seguimiento y dos (8%) que se encuentran en evaluación para eventual TEA por el HUFF (Figura 1). La incidencia y prevalencia de la HPTEC estimadas en el período fueron de ~0,6/millón de habitantes/año y 9,3/millón de habitantes, respectivamente.
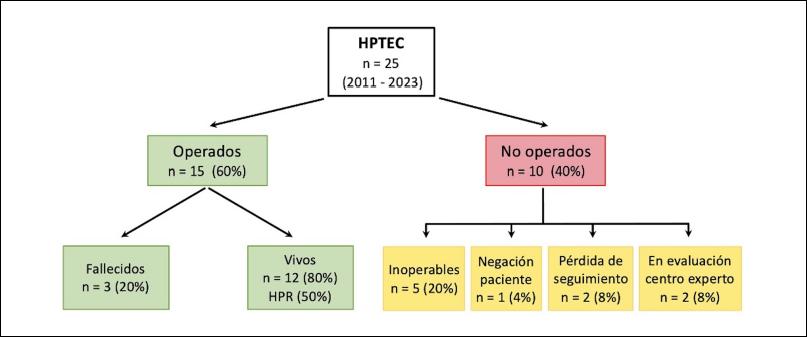
Figura 1. Diagrama de flujo de los pacientes con hipertensión pulmonar tromboembólica crónica (HPTEC).
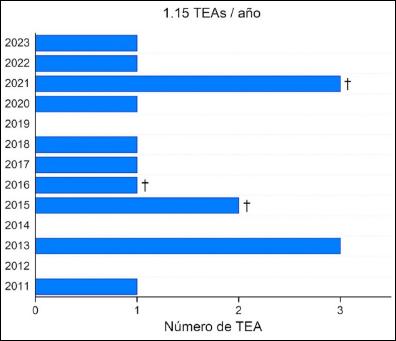
Se analizaron las 15 TEAs realizadas entre el 2011 y 2023 con un promedio de 1,15 TEAs por año (Figura 2). Los datos demográficos, clínicos, ecocardiográficos y hemodinámicos preoperatorios se muestran en la tabla 2. Diez pacientes (67%) tenían antecedentes de enfermedad tromboembólica previa y 8 (53%), hipercoagulabilidad predominando el síndrome antifosfolipídico (6 de los 8). La mediana del tiempo desde el inicio de los síntomas al diagnóstico fue de 36 (22-78) meses. Al diagnóstico la mayoría (86%) se encontraba en clase funcional (CF) III, con elementos de severidad ecocardiográfica (todos menos un paciente presentó desacople ventrículo-arterial con un TAPSE/PAPs <0.3 mm/mmHg) y hemodinámica (RVP 11 ± 5 UW; IC 2.1 ± 0.7 L/min/m2). Diez pacientes (67%) recibieron terapia específica previo a la cirugía: nueve en monoterapia con sildenafil y uno en doble terapia con sildenafil + bosentán.
Tabla 2. Datos preoperatorios de los pacientes.
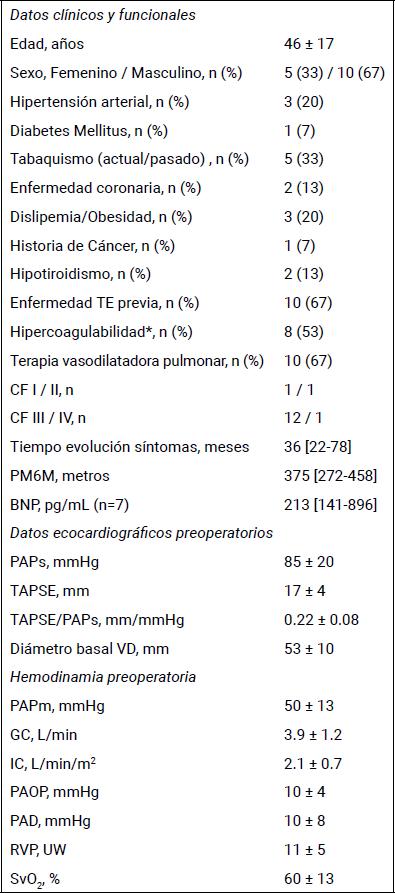
Media ± DE. Mediana [P25-P75]. n = 15. BNP: péptido natriurético cerebral; CF: clase funcional; GC, IC: gasto e índice cardíaco, respectivamente; PAD: presión auricular derecha; PAPm, PAPs: presión arterial pulmonar media y sistólica, respectivamente; PAOP: presión arterial de oclusión pulmonar; PM6M: prueba de marcha en 6 minutos; RVP: resistencia vascular pulmonar; SvO2: saturación venosa mixta de oxígeno; TAPSE: excursión sistólica del plano del anillo tricuspídeo; VD: ventrículo derecho. (*6 pacientes, 40% positivo para anticuerpos fosfolipídicos)
Características intraoperatorias, complicaciones posoperatorias y mortalidad
La tabla 3 resume las características demográficas, clínicas, ecocardiográficas, hemodinámicas preoperatorias, intraoperatorias y las complicaciones perioperatorias de los pacientes vivos (n = 12) y muertos (n = 3). Durante el período de recalentamiento se realizaron procedimientos quirúrgicos cardíacos concomitantes en 5 pacientes (33%) que incluyeron: 4 cierres del foramen oval permeable (3 fueron sobrevivientes), 1 apertura de una comunicación interauricular pequeña de 3 mm que sobrevivió y 1 revascularización miocárdica con puente entre arteria mamaria interna-arteria coronaria descendente anterior que falleció (Tabla 3). En todos los pacientes menos uno (que se negó) se implantó un filtro de Greenfield en la vena cava inferior previo a la cirugía.
Tabla 3. Datos clínicos, funcionales, ecocardiográficos, hemodinámicos e intraoperatorios y complicaciones perioperatorias de los pacientes vivos y fallecidos.
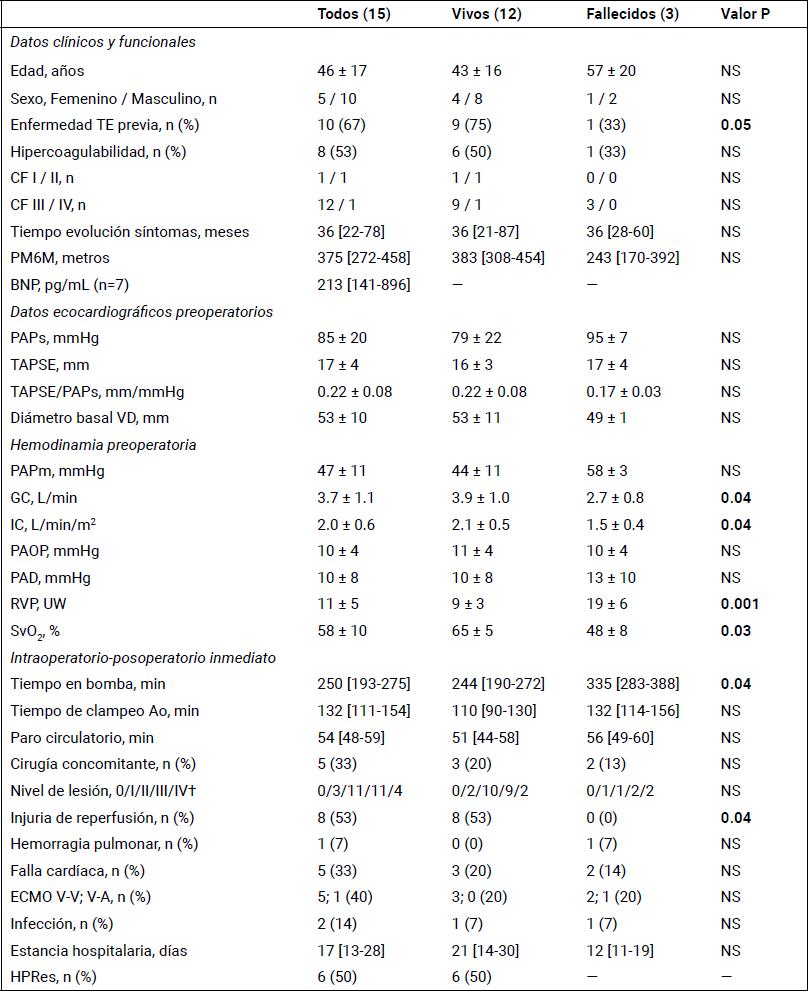
Media ± DE. Mediana [P25-P75]. n = 15. BNP: péptido natriurético cerebral; CF: clase funcional; ECMO: membrana de oxigenación extracorpórea; GC, IC: gasto e índice cardíaco, respectivamente; HPRes: hipertensión pulmonar residual; PAD: presión auricular derecha; PAPm, PAPs: presión arterial pulmonar media y sistólica, respectivamente; PAOP: presión arterial de oclusión pulmonar; PM6M: prueba de marcha en 6 minutos; RVP: resistencia vascular pulmonar; SvO2: saturación venosa mixta de oxígeno; TAPSE: excursión sistólica del plano del anillo tricuspídeo; VD: ventrículo derecho; V-V y V-A: ECMO veno-venoso y veno-arterial, respectivamente. († Clasificación quirúrgica intraoperatoria de la UCSD actualizada).16,20
De los hallazgos intraoperatorios y teniendo en cuenta que el nivel de lesión puede ser diferente en cada pulmón del mismo paciente se objetivaron: 2 lesiones nivel IC, 1 lesión nivel I, 11 lesiones nivel II, 11 lesiones nivel III y 4 lesiones nivel IV (Figura 3).
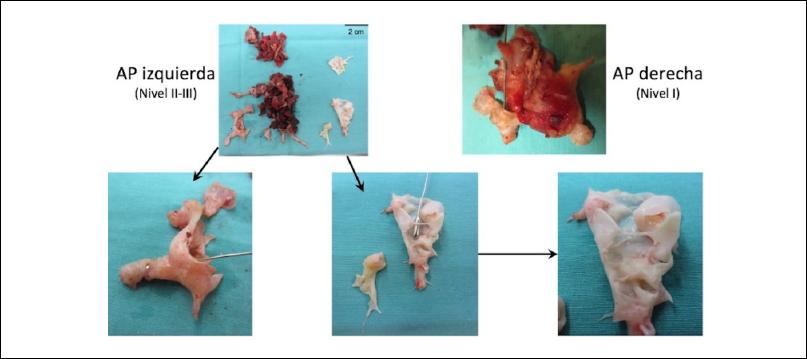
Figura 3. Muestras vasculares fibrotrombóticas quirúrgicas tomadas de un sobreviviente representativo (la enfermedad de nivel I indica material obstructivo en las arterias pulmonares principales; la enfermedad de nivel II comienza en las ramas lobares y la enfermedad de nivel III comienza en las ramas segmentarias. (Clasificación quirúrgica intraoperatoria de la UCSD actualizada, 2016).16
Como complicaciones inmediatas 8 pacientes (53%) desarrollaron injuria de reperfusión y en 6 (40%) fue necesaria la colocación de ECMO, 5 V-V y 1 V-A, este último por acompañarse de falla cardíaca. En 5 casos (33%) existió falla cardíaca, 4 requirieron apoyo inotrópico y en un caso fue necesario la ECMO V-A. Dos pacientes (14%) presentaron infección (uno acompañado de disfunción orgánica múltiple séptica a Pseudomona Aeruginosa que falleció y uno con infección respiratoria a Acinetobacter baumanii que sobrevivió).
La estancia hospitalaria de toda la cohorte fue de 17 (13-28) días, incluyendo los días de internación correspondiente a la valoración y estabilización preoperatoria. La mortalidad intrahospitalaria a los 30 días fue del 20% (3/15), con las siguientes causas de muerte: 1) shock cardiogénico asociado a rotura de arteria pulmonar derecha a la salida de la CEC en paciente con patología a predominio distal bilateral, 2) shock cardiogénico con ECMO A-V que fallece a los 4 días con coagulopatía asociada a múltiples transfusiones por sangrado y falla multiorgánica y 3) shock cardiogénico por falla del VD, agregando sepsis a Pseudomona Aeruginosa a los 19 días del posoperatorio, respectivamente. Si dividimos la cohorte en 2 períodos en función de la mediana temporal de la realización de las TEAs (2011-2016 versus 2017-2023) podemos observar que la mortalidad intrahospitalaria fue del 28,5% (2 en 7) en los primeros 6 años versus 12,5% (1 en 8) en los últimos 7 años (P =NS). A los 3 años y medio se agregó un fallecido por EPA asociado con la pérdida de seguimiento y el abandono de la anticoagulación que en el posoperatorio inmediato tenía una PAPm normal.
La supervivencia al año, 3 y 5 años fue de 80%, 80% y 73%, respectivamente (Figura 4). Luego de una mediana de seguimiento posoperatorio de 34 (7-97) meses se produjeron 4 muertes sin constatarse ningún drop-out (pérdida de seguimiento) hasta la fecha de cierre. En el período hubieron 5 pacientes censurados (no completaron el seguimiento) cuya PAPm posoperatoria fue <30 mmHg. Luego de la TEA, todos los pacientes recibieron warfarina con un valor de INR objetivo entre 2-3, excepto en los pacientes con síndrome antifosfolipídico triple positivo donde el rango objetivo fue más exigente (2,5-3,5).
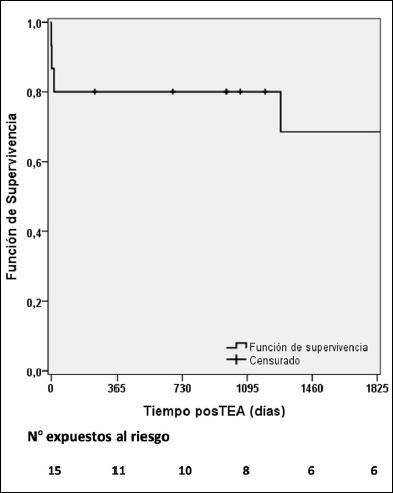
Figura 4. Función de supervivencia de toda la cohorte de pacientes sometidos a tromboendarterectomía pulmonar.
Cuando analizamos las diferencias preoperatorias entre vivos (12) y fallecidos (3) en el posoperatorio inmediato, vemos que a nivel clínico los sobrevivientes tuvieron enfermedad tromboembólica previa, en tanto que los pacientes que fallecieron presentaban RVP extremas (RVP >1000 dinas.s.cm-5), IC y saturación venosa mixta de oxígeno significativamente más bajos (P <0,05), sin diferencias significativas del acoplamiento ventrículo-arterial (TAPSE/PAPs). También se encontraron diferencias significativas en el tiempo de la CEC y el porcentaje de pacientes con injuria pulmonar de reperfusión (Tabla 3).
Cambios posoperatorios luego de la TEA
En la tabla 4 se muestran los datos clínicos, ecocardiográficos y hemodinámicos pre y posoperatorios de los 12 pacientes vivos. Los valores posoperatorios fueron tomados hasta los 3-6 meses luego de la TEA, excepto los valores hemodinámicos que fueron tomados en el área de RCV antes de retirar el catéter balón de arteria pulmonar (~48 hs).
Tabla 4. Datos clínicos, funcionales, ecocardiográficos y hemodinámicos comparativos pre y posTEA de los sobrevivientes.
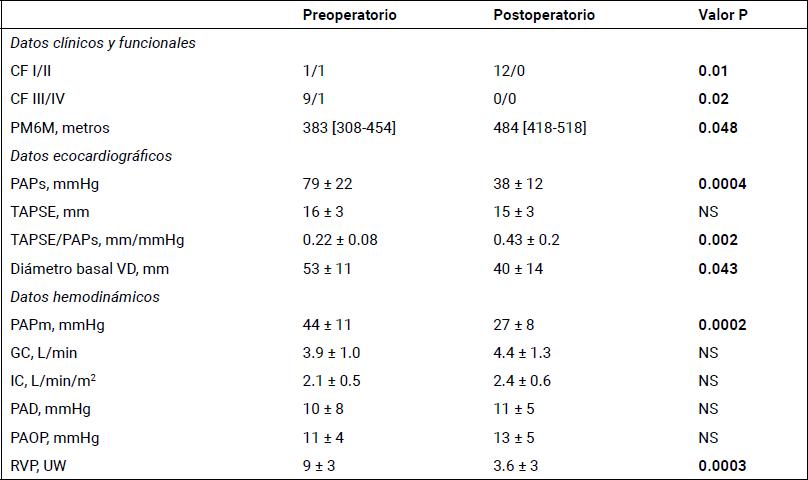
Media ± DE. n = 12. CF: clase funcional; GC, IC: gasto e índice cardíaco, respectivamente; PAD: presión auricular derecha; PAPm, PAPs: presión arterial pulmonar media y sistólica, respectivamente; PAOP: presión arterial de oclusión pulmonar; PM6M: prueba de marcha en 6 minutos; RVP: resistencia vascular pulmonar; TAPSE: excursión sistólica del plano del anillo tricuspídeo; VD: ventrículo derecho.
A nivel clínico se observó una mejoría significativa de la distancia total recorrida en la PM6M. Ello se acompañó de un descenso significativo de la PAPs y del diámetro basal del VD con una mejoría del acoplamiento ventrículo-arterial (TAPSE/PAPs) (P <0,05) (Tabla 4). En lo hemodinámico, si bien el GC e IC no se modificaron [0 (28/-56) %], el descenso de la PAPm y de la RVP fue significativo [-41 (-31/-62) %; -70 (-26/-82) %, respectivamente] (Figura 5A).
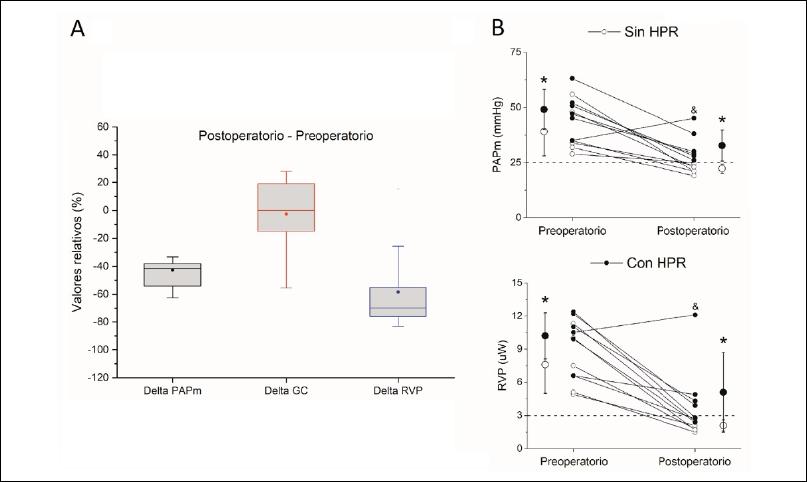
Figura 5. A. Diagrama de cajas que muestra los cambios relativos de la hemodinamia luego de la TEA. (n = 12. Mediana [P25-P75]. Media: punto relleno). B. Valores preoperatorio y posoperatorio de la presión arterial pulmonar media (PAPm) y de la resistencia vascular pulmonar (RVP) comparando pacientes sin hipertensión pulmonar residual (círculos claros; HPR: PAPm >25 mmHg) y con HPR (círculos negros). (n = 12). *P <0.05 entre ambos grupos. & corresponde al paciente con hipoplasia de la arteria pulmonar derecha y lesiones fibrotrombóticas obstructivas distales en el árbol vascular pulmonar contralateral que fueron removidos.
En el posoperatorio inmediato, todos los sobrevivientes redujeron la RVP y PAPm preoperatorias, excepto la paciente con hipoplasia de la arteria pulmonar derecha (Figura 5B). Se detectó HPRes en 6 pacientes (50% de sobrevivientes). Dos de ellos fueron intervenidos en la primera cohorte (2011-16) y los cuatro restantes en la segunda cohorte (2017-23) (P =0,121). Dos de estos seis pacientes presentaron una PAPm ≥30 mmHg recibiendo terapia específica uno con monoterapia (Riociguat v.o.), y otro con triple terapia off-label (Riociguat v.o., Bosentán v.o., Iloprost inhalado) dada la severidad de la HP (PAPm >38 mmHg y RVP >5,3 UW) sin resolución (paciente con hipoplasia de la arteria pulmonar derecha).
El tiempo de paro circulatorio fue significativamente mayor en los pacientes sin HPRes (61 ± 10 versus 47 ± 10 min). En lo funcional, tanto la distancia total recorrida en la PM6M [520 (515-560) versus 405 (400-431) metros] como el cociente TAPSE/PAPs (0,78 ± 0,06 versus 0,43 ± 0,14 mm/mmHg) posoperatorios fueron significativamente mayores en los pacientes sin HPRes respecto a los pacientes con HPRes luego de la cirugía. Ello se asoció con una estancia hospitalaria menor [18 (15-21) versus 29 (16-45) días] aunque sin alcanzar significación estadística. Los sujetos con HPRes presentaron una PAPm y RVP preoperatoria significativamente mayor que los pacientes sin HPRes. Si bien ambos grupos presentaron una caída significativa de la PAPm y RVP luego de la cirugía, los valores del grupo con HPRes permanecieron significativamente más elevados que los del grupo sin HPRes (Figura 5B). Asimismo, el cambio relativo de la PAPm y la RVP fue mayor en los pacientes sin HPRes (-42 ± 18 y -72 ± 10%, respectivamente) respecto a los pacientes con HPRes (-30 ± 29 y -46 ± 43%, respectivamente), aunque sin alcanzar significación estadística. No hubo diferencias significativas de los niveles de lesión del material fibrotrombótico entre ambos grupos (niveles I/II/III/IV: pacientes con HPRes: 1/5/4/1 versus pacientes sin HPRes: 2/4/5/1). El conjunto de datos que apoya los resultados de este estudio no se encuentran disponible.
Discusión
En Uruguay el tratamiento quirúrgico de los pacientes con diagnóstico de HPTEC se inició en 2011 a partir del convenio entre el FNR y el HUFF.27 El presente estudio observacional retrospectivo estimó y analizó las características clínicas, funcionales, hemodinámicas y terapéuticas, así como el pronóstico a corto, mediano y largo plazo de la primera cohorte de TEAs realizadas en pacientes con diagnóstico de HPTEC del Uruguay.
De los datos epidemiológicos surge claramente el subdiagnóstico de la HPTEC que conlleva a una baja tasa de TEA (0,33/millón de habitantes/año en Uruguay, en comparación con 0,9 a 1,7 TEA/millón de habitantes/año en EE.UU. y Europa, respectivamente).23 En acuerdo con los datos internacionales se observó una incidencia del 67% de enfermedad tromboembólica previa. En cuanto a las características demográficas, clínicas y funcionales, llama la atención que se trata de pacientes relativamente jóvenes a predominio de hombres con pocas comorbilidades asociadas. Si bien el estado funcional al momento del diagnóstico fue similar a los datos internacionales con un predominio de CF III y distancia total recorrida en la PM6M disminuida, los datos ecocardiográficos y hemodinámicos preoperatorios mostraron un severo compromiso de la unidad ventrículo-arterial derecha (RVP, PAPm, presión auricular derecha elevados con IC y TAPSE/PAPs muy descendidos) lo que se asoció con un retraso en el diagnóstico de ~36 meses y un alto porcentaje (67%) de pacientes con terapia específica puente off-label.14,28
Comparando los datos de la presente cohorte con una cohorte histórica del HUFF (1992-2010; n = 41; 2,17 TEA/año), no observamos diferencias significativas en la edad, sexo, retardo diagnóstico, estado funcional y hemodinamia, así como en los tiempos quirúrgicos. La mortalidad a los 30 días fue del 17%, similar a la mortalidad de la cohorte actual del 20%.29 Teniendo en cuenta la definición de HPRes empleada en esa cohorte histórica (definida por una RVP >500 dinas.s.cm-5), la cohorte actual presentó 1 paciente con HPRes (1/12: 8%) versus 4/34 (12%) de aquella.
La TEA es una técnica quirúrgica compleja con una prolongada curva de aprendizaje donde la mortalidad perioperatoria está íntimamente ligada al volumen de TEAs/año del centro quirúrgico. Ello involucra no sólo la experiencia del cirujano sino la de todo el equipo multidisciplinario (anestesista, perfusionista, intensivista, cardiólogo, neumólogo, broncoscopista, etc.).23 Se han identificado múltiples factores de riesgo pre y perioperatorios que afectan la supervivencia luego de la TEA. Estos incluyen: la experiencia del equipo quirúrgico y manejo posoperatorio en el área de RCV; el grado, localización y cronicidad de las lesiones; el compromiso hemodinámico de la enfermedad tromboembólica (en especial la correlación de las lesiones obstructivas accesibles con la RVP y el grado de disfunción del VD), y la presencia de comorbilidades (cardiovascular, respiratoria, nefrológica y hematológica) con una relación costo/beneficio desfavorable.20,30 Los valores iniciales (~1997-2010) de los programas de TEA en los centros expertos de España, Francia y Reino Unido tuvieron una mortalidad perioperatoria ~12%. Incluso la propia UCSD, que es actualmente centro referente mundial, presentó una mortalidad perioperatoria del 16,8% en sus primeros 143 pacientes sometidos a TEA entre 1970-1998. La curva de aprendizaje de los centros de referencia internacionales con volúmenes >60 TEAs/año permite alcanzar una mortalidad en torno al 2-3% similar a los valores de referencia de la UCSD.31,32,33
Si bien Latinoamérica cuenta con la posibilidad de TEA desde la década de los años ’90, los datos publicados recientemente refieren reportes de casos no sistematizados de centros que no alcanzan los estándares que acrediten como centro experto. En Chile se reportaron dos casos de TEA en 1996 y 2020.34 En Argentina se reportó una cohorte de 10 TEAs realizadas entre el 2010-2016 (1,5 TEA/año) con una mortalidad hospitalaria del 10%.35 En Colombia, se reportaron ocho TEAs realizadas entre 2010 y 2013 (2,7 TEA/año) con 0% de mortalidad y un seguimiento medio de 24 meses.36 Desde México se han publicado dos artículos, uno correspondiente a un caso y otro a 3 casos.37,38 La serie más grande reportada proviene de Brasil (INCOR, San Pablo), con una cohorte de 110 TEAs entre 2007-2016, observando una mejoría en la mortalidad intrahospitalaria asociado a la curva de aprendizaje anestésico-quirúrgica (de 23,6 a 10,3%).39 En todos los casos, se trataron de pacientes jóvenes (~50 años) con escasa comorbilidad asociada y a predominio de mujeres (~60-65%).
A nivel internacional los registros europeo y americano incluyeron pacientes de mayor edad [60 (59-87) años], con una distribución equilibrada del sexo, un menor retraso diagnóstico (10-15 meses) y menor severidad hemodinámica, asociado a un menor porcentaje (35-40%) de los pacientes tratados con drogas específicas previo a la cirugía.40,41 Ello junto con la alta tasa de procedimientos quirúrgicos al año (>50 TEAs/año) se asoció con una mortalidad perioperatoria significativamente baja (~2-4%), a pesar de tratarse de un mayor porcentaje de pacientes con lesiones obstructivas distales (segmentarias y subsegmentarias).42,43 Si bien la mortalidad global intrahospitalaria de nuestra cohorte resultó relativamente alta (~20%), considerando la caída de la mortalidad al 12,5% en los últimos 7 años, podría representar una mejoría en la curva de aprendizaje de la cirugía dado que no hubo diferencias significativas de las diferentes variables clínicas, ecocardiográficas y hemodinámicas entre ambas cohortes temporales. El volumen de 1-10/TEAs/año del HUFF (mortalidad intrahospitalaria y al año esperables de 7,4% y 11,1%) y el severo compromiso hemodinámico de los pacientes fallecidos (RVP preoperatoria ≥1200 dinas.s.cm-5, mortalidad intrahospitalaria y al año esperables de 10,6% y 12,8%) podrían tener un rol crítico en el pronóstico intrahospitalario y al año observados.16,23 Todos los pacientes censurados no presentaron HPRes, lo que podría explicar la estabilidad de la supervivencia en 5 años.
En cuanto al porcentaje de los pacientes operados y las causas de inoperabilidad, los datos obtenidos en nuestra pequeña cohorte no difieren significativamente con la casuística europea que oscila entre el 50-60%, teniendo entre las principales causas de inoperabilidad la inaccesibilidad de las lesiones, las comorbilidades que determinan un cociente riesgo/beneficio desfavorable y la negativa del paciente.40,44 No obstante, en EE.UU., los centros con mayor volumen de TEA/año llegan a tasas de operabilidad de ~90%.42
En cuanto a las complicaciones posoperatorias, un 53% de los pacientes desarrollaron injuria de reperfusión que fue severa (6 de los 8 pacientes requirieron la colocación de ECMO). Si bien la injuria por reperfusión es inherente a la TEA, la incidencia en centros expertos es del 5-20% y de menor severidad.13,24 El edema pulmonar secundario a la injuria por reperfusión se debe a la alta permeabilidad vascular de aquellas áreas tromboendarterectomizadas que han recuperado la perfusión, donde los neutrófilos y la inflamación estarían involucrados. La cronicidad de las lesiones junto con la severidad de la hemodinamia preoperatoria podrían explicar la alta incidencia y severidad de la injuria por reperfusión observada, así como la mortalidad intrahospitalaria.1,14,42 Además de la injuria por reperfusión, se puede agregar el fenómeno de robo de flujo desde las zonas no obstruidas a las áreas tromboendarterectomizadas como causa de alteración V/Q, y por ende, hipoxemia.14,30
La hemorragia pulmonar puede ocurrir secundario a la disección y lesión vascular durante la endarterectomía de vasos friables, así como de la presencia de colaterales y anastomosis sistémico-pulmonares. En la casuística analizada se registró una muerte postoperatoria inmediata por lesión de la arteria pulmonar derecha durante una TEA en paciente con predominio de patología distal bilateral (7%).
Si bien existe una asociación entre la hemodinámica pulmonar posoperatoria y la supervivencia a largo plazo, hasta la fecha no existe consenso sobre la definición de HPRes posTEA. Entre los criterios utilizados, algunos se basan en la PAPm, mientras que otros utilizaron la RVP o una combinación de ambos. Asimismo, el momento (p. ej., días posoperatorios 1 a 3 o 3 a 6 meses después de la cirugía) y la modalidad (Eco versus CCD) para adquirir las mediciones hemodinámicas han variado entre los estudios. La medición posoperatoria precoz de la PAPm previo al retiro del catéter balón de la arteria pulmonar en la unidad de cuidados intensivos ha demostrado ser útil para el pronóstico después de la TEA.24 La prevalencia de HPRes, definida por un valor de PAPm >25 mmHg en el posoperatorio inmediato, fue de un 50% lo que coincide con las series internacionales.25 Dentro de los posibles mecanismos involucrados en la HPRes posTEA se plantea una TEA incompleta o una enfermedad distal preoperatoria persistente. En nuestra cohorte todos los pacientes con HPRes posoperatoria (PAPm >25 mmHg) tuvieron una RVP preoperatoria significativamente mayor, lo que permitiría plantear un rol predominante de la microvasculopatía distal en la HPRes posTEA.1,14,42 Teniendo en cuenta los valores de HPRes, sólo un paciente presentó una PAPm >38 mmHg y RVP >5.3 UW, lo que podría explicar la ausencia de fallecimientos durante el seguimiento a mediano plazo, excepto el fallecimiento de un cuarto paciente a los 3 años y medio secundario a una nueva EPA por abandono de la anticoagulación y que podría representar un caso de HPRec (7%).16 En este sentido, no hay un consenso en el seguimiento para la detección ni para la definición de la HPRec, estimándose una prevalencia de ~3-4%.1
Los efectos de la TEA sobre la remodelación reversa del VD se producen a corto plazo y se conocen desde hace más de 15 años.45 En nuestra cohorte se observó una caída significativa de las dimensiones del VD acompañándose de una reducción significativa de la regurgitación funcional de la tricúspide (~2.4 m/s) a los 3-6 meses. En lo funcional, si bien el TAPSE no tuvo cambios significativos, el descenso significativo de la PAPs, determinó una mejora significativa del acople ventrículo-arterial, que a su vez fue significativamente mayor en aquellos pacientes sin HPRes alcanzando valores normales. Ello se asoció a un aumento significativo de la distancia total recorrida en la PM6M que también fue más acentuado en los pacientes sin HPRes. La ausencia de mejoría del TAPSE podría explicarse por el cambio en patrón de contracción del VD a predominio del acortamiento radial que se refleja en la mejoría del área fraccional y/o fracción de eyección del VD.46
Por último, no se detectaron eventos neurológicos mayores, lo que podría estar asociado a la juventud de la cohorte junto con el cierre del foramen oval permeable en varios de los pacientes operados (evitando la embolia paradojal) a pesar de un 53% de pacientes con hipercoagulabilidad.30
Limitaciones del estudio
Se trata de una cohorte de TEAs pequeña asociada a un subdiagnóstico de la HPTEC, teniendo en cuenta los mayores valores de incidencia y prevalencia de los registros internacionales contemporáneos sistematizados.4 No se realizó en forma sistemática CCD a los 6-12 meses del posoperatorio para detectar HP persistente o recurrente cuya severidad (PAPm ≥38 mmHg, RVP ≥5,3 UW y capacitancia arterial pulmonar ≤1,8 mL/mmHg) se asocia al pronóstico a largo plazo además de condicionar el tratamiento adyuvante mediante angioplastia de la arteria pulmonar y/o drogas.47
Conclusiones
Se presentó la primera cohorte de TEAs realizadas en pacientes con diagnóstico de HPTEC del Uruguay. La TEA determinó una mejoría significativa en el estado funcional, parámetros ecocardiográficos y hemodinamia de los sobrevivientes, donde el 50% normalizaron la hemodinamia de reposo. La severidad hemodinámica preoperatoria vinculada a las lesiones obstructivas y microangiopatía distales, se asoció con la alta tasa de complicaciones posoperatorias y mortalidad intrahospitalaria. La reducción del retardo en el diagnóstico y envío al HUFF para definir operabilidad y una mayor tasa de TEAs/año (curva de aprendizaje) podrían reducir las complicaciones y la mortalidad perioperatorias.