Introducción
El cáncer de mama (CM) es el cáncer más frecuente a nivel mundial y la primera causa de muerte entre las mujeres1-3. Se estima que en 2020 se diagnosticaron en el mundo 2,26 millones de casos, con una tasa estandarizada por edad de 47,8 casos por 100.000 habitantes. Si bien el CM puede afectar a ambos sexos, en los hombres es extremadamente infrecuente (aproximadamente un caso de cada 100 diagnosticados corresponde al sexo masculino). El presente trabajo se referirá exclusivamente a la patología en mujeres.
La carga de CM, así como sus patrones y tendencias, varían ampliamente en el mundo. Las tasas de incidencia más altas se observan en países de ingresos altos y medios altos; sin embargo, las mayores tasas de mortalidad se registran en poblaciones con menor nivel de desarrollo. Esto se evidencia más claramente si se comparan los cocientes mortalidad/incidencia1,3. En 2021, Lei y colaboradores mostraron que existe una relación directa entre el Índice de Desarrollo Humano (IDH) con las tasas de incidencia de CM, y una relación inversa del mismo con las tasas de mortalidad por este cáncer4.
A nivel mundial, la incidencia del CM ha aumentado en forma continua a lo largo del siglo XX. A partir de la primera década del siglo XXI las tasas de incidencia se han mantenido estables o incluso disminuido en algunos países desarrollados4. En este período, en los países en desarrollo, que presentan tasas de incidencia menores, se observa un rápido incremento de éstas. Al comparar la evolución de las tasas de incidencia ajustadas por edad (TIAE) en poblaciones estratificadas de acuerdo al Índice de Desarrollo Social (IDS), se observa un aumento en todos los quintiles con la excepción del quintil de IDS más alto, en el que las TIAE disminuyeron, con un porcentaje de cambio anual estimado (PCAE) de -0,37 (IC95%: -0,37 -0,17). El incremento más pronunciado ocurrió en los quintiles de IDS medios (PCAE: 1,95, IC95%: 1,92-1,98)5.
Como sucede en casi todos los tipos de cánceres, el riesgo de desarrollar la enfermedad aumenta con la edad. Sin embargo, a diferencia de lo que sucede en la mayoría de los tumores, el aumento no responde a un modelo exponencial, sino que las tasas específicas por edad aumentan hasta un máximo entre los 50 y 55 años, descienden entonces levemente para luego retomar su tendencia ascendente hacia los 65 años6,7. Se ha interpretado que este fenómeno, observado en diferentes poblaciones y denominado gancho de Clemmensen (Clemmensen hook) podría traducir la superposición de dos curvas, correspondientes a la enfermedad en las mujeres pre y posmenopáusicas7,8.
De acuerdo con las estimaciones de Global Cancer Observatory3, Uruguay presenta tasas de incidencia de CM medias altas (segundo quintil) y tasas de mortalidad altas (primer quintil). En consecuencia, sus cocientes mortalidad/incidencia son más desfavorables que los de los países con alto nivel de desarrollo, cuyas tasas de incidencia son más altas, pero las de mortalidad se sitúan en valores intermedios. A nivel nacional, el CM ha ocupado el primer lugar en incidencia y mortalidad en el sexo femenino en las dos últimas décadas9-11. En el quinquenio 2015-2019 se diagnosticaron en promedio 2.005 casos por año y fallecieron anualmente, en promedio, 715 mujeres por esta causa12. De acuerdo a las estimaciones de ese quinquenio, en Uruguay, una de cada 11 mujeres desarrollará CM en algún momento de su vida. Las tasas de incidencia se han mantenido estables, con un descenso sostenido en la mortalidad13.
Si bien Uruguay no cuenta con un programa organizado de tamizaje de CM, desde hace al menos dos décadas se vienen implementando recomendaciones y pautas de aplicación de mamografía de tamizaje, así como campañas de promoción, en las cuales el área de Educación Poblacional de la Comisión Honoraria de Lucha contra el Cáncer (CHLCC) ha tenido un papel destacado. También se han desarrollado políticas de salud pública orientadas a mejorar el acceso a los estudios imagenológicos de cribado, a saber:
- Día de licencia especial con goce de sueldo para la realización de mamografía: la ley 17242 (promulgada en junio de 2000 y reglamentada en septiembre de 2002) estipula: “Las mujeres trabajadoras de la actividad privada y las funcionarias públicas tendrán derecho a un día al año de licencia especial con goce de sueldo a efectos de facilitar su concurrencia a realizarse exámenes de Papanicolau y/o radiografía mamaria, hecho que deberán acreditar en forma fehaciente”14.
- Mamografía de tamizaje sin costo: el decreto 219/006, de julio de 2006, establece la exoneración del pago de la tasa moderadora para mamografía: “Artículo 5: A partir del 1° de julio de 2006, se exonera del pago de tasa moderadora los estudios de colpocitología oncológica (pap) y mamografía de acuerdo a pauta establecida por el Ministerio de Salud Pública”15.
En cuanto a la pauta ministerial, la ordenanza 402 del año 2006 establece que están exoneradas del pago las mujeres entre 40 y 59 años, cada dos años, “cuando los estudios sean normales”16. En 2015, en forma simultánea a la publicación de las pautas nacionales para la detección temprana de CM (Guía de detección precoz del cáncer de mama, noviembre de 2015)17, la ordenanza 842/015 modifica la edad de la población beneficiaria de esta exoneración, estableciendo que corresponde a mujeres de 50 a 69 años18.
Algunos profesionales de la salud de nuestro medio manifiestan tener la impresión de asistir a un aumento de la incidencia de CM en las mujeres más jóvenes. Este trabajo fue diseñado con el objetivo de responder a esta inquietud, describiendo las características biológicas de los CM diagnosticados en Uruguay y las tendencias de incidencia y mortalidad por grupos etarios. Utilizando los datos del Registro Nacional de Cáncer (RNC), registro poblacional de cobertura de todo el país, se intenta responder a las preguntas: ¿presentan los tumores diagnosticados en diferentes grupos de edad características diferentes?, ¿es en Uruguay el CM cada vez más frecuente en las mujeres jóvenes?
Material y método
Para elaborar esta comunicación se seleccionaron todos los casos de CM en personas de sexo femenino registrados en el período 2002-2019. El RNC anota tanto los CM infiltrantes (hasta un primitivo en cada mama) como in situ (un único cáncer in situ por persona). Sin embargo, para el reporte de casos, siguiendo las pautas internacionales a las que adhiere, pautas del European Network of Cancer Registries (ENCR)19, el reporte de los casos incidentes se realiza exclusivamente a partir de las neoplasias malignas infiltrantes, considerando un único CM por paciente.
El RNC también registra las muertes por cáncer en base a la revisión de todos los certificados de defunción del país. Las muertes por CM en mujeres de 1990 a 2020 también se analizaron en este trabajo. Tanto los casos de incidencia como los de mortalidad se codificaron utilizando la Clasificación Internacional de Enfermedades para Oncología, tercera edición CIE-O-320.
Las tasas de incidencia y mortalidad (expresadas por 100.000 personas-año) se ajustaron por edad utilizando el método directo y la población estándar mundial21. Para la estimación de las personas-año en riesgo, se tomaron los datos de población de los censos 1996, 2004 y 201122-24. La estimación de la población en los períodos intercensales se realizó mediante interpolación lineal, y el período poscensal por extrapolación lineal.
Se estudiaron en particular los grupos formados por pacientes a las que se realizó el diagnóstico entre los 20 y 44 años, 45 a 69, y mayores de 69 años. La elección del rango etario 20-44 es fruto de un análisis exploratorio de las tendencias por quinquenio etario en el que se identificaron intervalos de edad en los que las tendencias de incidencia mostraban comportamientos disímiles.
Las tendencias temporales se evaluaron utilizando la regresión de join point25 para detectar puntos en el tiempo en los que se producen cambios. Se utilizó el software disponible públicamente, join point versión 4.7, del Surveillance Research Program of the US National Cancer Institute26, permitiendo un máximo de tres puntos de quiebre. Las tendencias se informaron como crecientes o decrecientes cuando el PCAE fue estadísticamente significativo (p < 0,05), de lo contrario, la tendencia se describió como estable. Para cada estimación de PCAE se calculó el correspondiente intervalo de confianza (IC) de 95% (IC95%).
Se analizó en el período 2015-2019, para los grupos de edades antes mencionados, la distribución de estadios al diagnóstico y perfiles biológicos: receptores hormonales y sobreexpresión de la proteína del receptor 2 del factor de crecimiento epidérmico humano (HER2). Corresponde al período más reciente disponible y con mayor exhaustividad en la información. Para las comparaciones se usó el test de chi cuadrado y el análisis de residuos ajustados con la corrección de Bonferroni para las comparaciones múltiples.
Este trabajo se realizó siguiendo los lineamientos de la guía STROBE para la comunicación de estudios observacionales en epidemiología27.
La información contenida en la base de datos del RNC se recolectó bajo estrictas normas de protección de datos personales para vigilancia epidemiológica.
Resultados
En el período 2002-2019 se registraron 34.113 casos de CM en mujeres en Uruguay, de los cuales 34.109 tenían edad mayor o igual a 20 años. Los CM constituyeron el 28,5% del total de cánceres (excluyendo el cáncer de piel no melanoma) en las mujeres en ese período. La media de edad fue de 62,8 años (IC 62,5- 63,0). La (figura 1) muestra las tasas específicas de incidencia y mortalidad por CM en mujeres en Uruguay en el período 2015-2019. En la curva de distribución de tasas específicas puede observarse el aumento de la incidencia a partir de los 30 años y el gancho de Clemmensen, como se describió anteriormente.
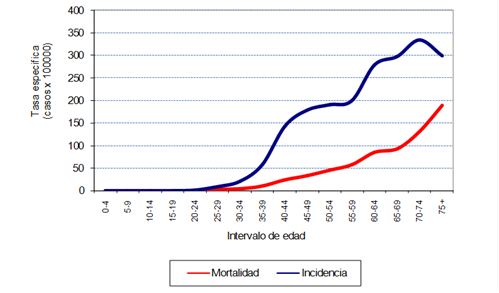
Figura 1: Curva de distribución de tasas específicas por edad de incidencia y mortalidad en el quinquenio 2015-2019. Uruguay.
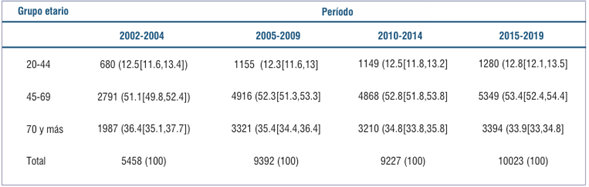
En este período, la proporción de los casos registrados para cada grupo etario no mostró diferencias estadísticamente significativas en los cuatro quinquenios, como se muestra en la (tabla 1) (p=0,27).
Tabla 1: Distribución de casos de cáncer de mama por grupo etario y período (cantidad de casos, porcentaje e intervalo de confianza al 95%), 2002-2019.
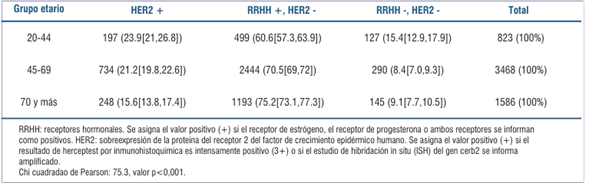
Receptores estrógeno y progesterona y sobreexpresión de HER2
Un factor que puede asociarse a variaciones de la incidencia y la mortalidad es el perfil biológico de los tumores en relación con el estatus de los receptores de estrógeno y progesterona, y la sobreexpresión de HER2. La recolección de esta información comenzó en el RNC en el año 2010, mejorando su captura en forma progresiva, por lo que no está disponible para los primeros períodos.
Resumimos en la (tabla 2) la condición para estos receptores en los casos con información disponible del período 2015-2019 para cada uno de los grupos etarios.
La distribución de los perfiles según los grupos de edad difiere estadísticamente (p<0,001). Analizados por franja de edad se destaca una asociación positiva de los subtipos biológicos agresivos (triple negativos y HER2 positivos) en el grupo de 20 a 44 respecto a las demás franjas etarias consideradas en conjunto (23.9%, IC95% (21.0,26.8) vs 19.4%, IC95% (1.38,20.5) y 15.4%, IC95% (12.9,17.9) vs 8.6% IC95% (7.8,9.4), respectivamente). También se aprecian bajas proporciones del subtipo triple negativo con el grupo 45-69 años (8.4%, IC95% (7.5,9.3) vs 11.3%, IC95% (10.0,12.6)), así como de HER2 positivos en las mujeres de 70 años y más (15.6%, IC95% (13.8,17.4) vs 21.7%, IC95% (20.5,22.9)).
Estadios
La distribución de estadios por grupo etario en el período 2015-2019 se presenta en la (tabla 3). Puede apreciarse que en las mujeres mayores de 70 años es donde encontramos mayor déficit de información sobre la distribución de estadios. Considerando solamente aquellos casos con información, la distribución según los grupos de edad difiere de manera estadísticamente significativa (p<0,001); analizando las combinaciones posibles, se destaca una mayor proporción en el estadio I entre las pacientes de 45 a 69 frente a los restantes grupos etarios (39% IC95% (38,40) vs 31% IC95% (29,33)), del estadio II entre las pacientes de 20-44 (42%, IC95% (39,45) vs 35%, IC95% (34,36)) y estadios IV entre las mujeres de 70 y más años (12% IC95% (11,13) vs 8%, IC95% (7-9)).
Tabla 3: Distribución de estadios TNM para las mujeres portadoras de cáncer de mama por grupo etario, (número de casos, porcentaje e intervalo de confianza al 95%), 2015-2019.
Tendencias de la incidencia en 2002-2019
Las tendencias de las tasas estandarizadas de incidencia (incluyendo todos los segmentos de edades) han permanecido estables en el período. El PCAE para este período es de -0,08 con un valor de la pendiente no significativamente distinto de cero (figura 2).
Los resultados de los análisis de la incidencia por grupos de edad muestran en las mujeres más jóvenes (20-44) tendencias crecientes (PCAE=0.90, IC95% (0.29;1.51), en el grupo de edad intermedia (45-69) tasas estables (PCAE -0.18, IC95% (-0.64;0.29) y en el grupo de mayor edad (70 y más años), tendencia decreciente (PCAE: -0.75, IC95% (-1.33;-0.14)), durante el período 2002-2019 (tabla 4).
En la (figura 2) se muestra la evolución de las tasas en los distintos grupos etarios con la curva join point de mejor ajuste.
Tabla 4: Porcentaje de cambio anual estimado (PCAE) de las tasas ajustadas de incidencia de cáncer de mama con intervalo de confianza al 95% (IC95%) por grupos etarios, período 2002-2019.
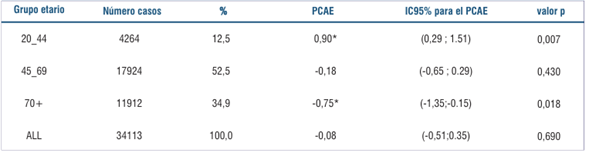
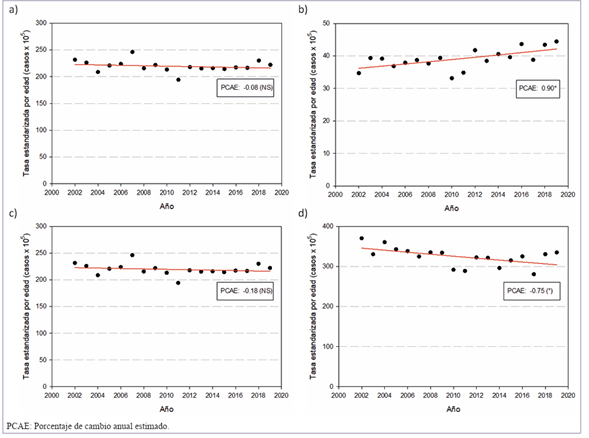
Figura 2: Tendencias de la incidencia de cáncer de mama en el sexo femenino en Uruguay por grupo etario. Período 2002-2019. a. Todas las edades. b. 20 a 44 años c. 45 a 69 años d. 70 años y más. Modelo: Jointpoint.
Tendencias de la mortalidad en 1990-2020
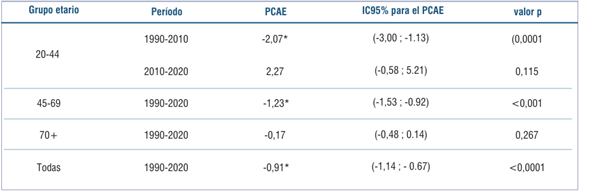
Como se muestra en la (figura 3), las tasas ajustadas de mortalidad por CM han descendido en forma significativa con un porcentaje de cambio anual de -0.91 (IC95% (-1.14;-0.67) en el período 1990-2020.
El grupo de mujeres más jóvenes (20-44) presenta tendencias de mortalidad descendente (PCAE: -2.07*) durante el segmento 1990-2010, seguido de una estabilización durante los últimos años, 2010-2020, con un ascenso no estadísticamente significativo (PCAE: 2.27). En el grupo de edad intermedia (45-69) las tasas de mortalidad disminuyeron significativamente (PCAE: -1.23*) durante 1990-2020. Finalmente, en el grupo de mayor edad (70 y más años), las tasas de mortalidad se mantuvieron estables en el período analizado (tabla 5) y (
).
Tabla 5: Porcentaje de cambio anual estimado (PCAE) de las tasas ajustadas de mortalidad de cáncer de mama con intervalo de confianza al 95% (IC95%) por grupos etarios, período 1990-2020.
Discusión
En este análisis se evidencian tendencias diferenciales en las tasas de incidencia y mortalidad para las mujeres de los tres grupos de edades explorados (menores de 45 años, 45 a 69 y más de 69), así como en la distribución de los perfiles biológicos y estadios de CM.
Hallazgos en relación con la distribución de estadios
En cuanto a la distribución de los casos por estadio en los grupos etarios analizados, el continuo proceso de mejora en la calidad del RNC, que se refleja en una reducción de la proporción de casos sin información de estadio de 61.5% en el período 2005-2009 a 28% en el período 2015-2019, dificulta la interpretación de la evolución temporal de la información.
Más del 70% de los casos de CM en Uruguay en el último quinquenio analizado (2015-2019), se diagnosticaron en estadios precoces (TNM I y II). Esto es el resultado, aun con las limitaciones señaladas, de las estrategias de tamizaje, pero también de las campañas de educación y sensibilización dirigidas a los profesionales de la salud y la población general, y orientadas a estimular la consulta y el diagnóstico precoz u oportuno. Si bien la proporción de casos en estadios precoces es elevada en todos los grupos de edades, se observan diferencias significativas. En las mujeres de la franja de edades intermedias es donde se observa mayor proporción de estadios I, tumores frecuentemente subclínicos (menores de 2 cm, sin compromiso axilar)28. En la medida en que es la franja de edades para las cuales está recomendado el cribado mamográfico, podría considerarse este hallazgo dentro de lo esperable. En cambio, la franja de edad donde es mayor la proporción de casos diagnosticados en etapa avanzada (estadio IV) es la de las mujeres mayores de 70 años. Para las mujeres jóvenes, aun estando fuera de la edad de recomendación de screening, y con las dificultades diagnósticas específicas de este grupo (alta densidad mamaria, tumores que se diagnostican durante el embarazo y la lactancia), la proporción de tumores en etapa precoz es alta, aunque son más frecuentes los diagnósticos en estadio II.
Hallazgos en relación con los perfiles biológicos
Si bien en todos los grupos de edades los tumores de subtipo luminal (RRHH positivos, HER2 negativo) son los más frecuentes, se presentan en una proporción mayor en las mujeres mayores de 70, y la misma decrece progresivamente en las mujeres de los grupos más jóvenes. Del mismo modo, los subtipos agresivos (triple negativo y HER2 positivo) están sobrerrepresentados en las mujeres más jóvenes, y decrecen en las de mayor edad (figura 4). Esto probablemente se explique por varios factores. Por un lado, en las mujeres más jóvenes es más probable la presencia de mutaciones patogénicas de genes vinculados al cáncer hereditario (BRCA1, BRCA2, entre otros). Las portadoras de mutaciones de BRCA1, en particular, presentan alta frecuencia de tumores de tipo basal asociado al fenotipo triple negativo29). Para los tumores HER2 positivos, no se han identificado mutaciones asociadas. Por otra parte, análisis de tendencias temporales por subtipos biológicos han encontrado diferencias entre los distintos grupos, sugiriendo que los factores de riesgo para CM posiblemente operen en forma diferencial para el desarrollo de tumores con distintos perfiles30,31.
Figura 4 Distribución de los distintos perfiles biológicos del cáncer de mama por grupos de edad (de 5 años). Uruguay. (2015-2019).
Hallazgos en referencia con la incidencia
Las tendencias de las tasas estandarizadas de incidencia en la totalidad de la población han permanecido estables en Uruguay en el período 2002-2019.
Para las mujeres de 20 a 44 años, se confirma un incremento en las tasas de incidencia. Este hallazgo está en línea con lo descripto por Heer y colaboradores en 2020, que encontraron un aumento en la incidencia de CM en mujeres menores de 50 años en 20 de 44 poblaciones, en general en países de altos ingresos, en el período 1998-201232. Estudios recientes realizados en Francia33 y en Canadá34 también muestran un aumento de las tasas de incidencia de CM en mujeres jóvenes (menores de 40 años).
En la medida en que las mujeres jóvenes no integran la población objetivo de los programas de tamizaje, el aumento en la incidencia de CM en este grupo etario no sería en principio atribuible a una mayor detección y, en cambio, podría reflejar una mayor exposición a factores de riesgo, sean estos genéticos, reproductivos (paridad, edad al nacimiento del primer hijo, lactancia), dietéticos, por consumo de alcohol u otros.
En relación con el sobrepeso y la obesidad, que constituyen importantes factores de riesgo para el CM en la posmenopausia, su rol en las mujeres premenopáusicas no está tan claramente establecido35,36.
Respecto a las conductas reproductivas, las primeras investigaciones mostraron que un primer embarazo a término a una edad temprana reduce el riesgo de CM, y sugirieron que el efecto protector observado se debió en gran parte a la edad de la madre más que a la cantidad de embarazos. Investigaciones posteriores demostraron que cada nacimiento adicional (y el período de lactancia asociado) que ocurría antes de los 30 años contribuía a una reducción del riesgo de CM37. El metaanálisis realizado por Continous Update Project del World Cancer Research Fund para la investigación del cáncer estimó la disminución del riesgo de CM en un 2% cada cinco meses de lactancia materna total38. En las mujeres de 45 a 69 años, la incidencia ha permanecido estable a lo largo de todo el período. Llama la atención en este grupo etario, potencialmente afectado por el tamizaje, que no se hayan detectado variaciones significativas en la incidencia en el período analizado. A partir de la puesta en práctica de un programa organizado de tamizaje, sería de esperar un aumento inicial de las tasas de incidencia en las franjas etarias que son objeto del cribado, seguido de una disminución, para ubicarse luego en cifras similares a las iniciales o que siguen la tendencia que se presentaba al momento de comenzar el programa. Tal lo sucedido tras la implementación de un programa de mamografías en Alemania, en 200339. Este incremento inicial en las tasas de incidencia en las mujeres dentro del rango de edades afectadas, se presentaría a expensas fundamentalmente de un incremento de los diagnósticos en etapas tempranas (pero no una reducción significativa de los diagnósticos en etapa avanzada)40,41.
La detección precoz del CM en Uruguay se ha basado en una estrategia oportunista desarrollada a partir de la última década del siglo pasado, basada en la realización de mamografías (con una importante incorporación de mamógrafos en distintas zonas del país), el examen clínico y la promoción del autoexamen mamario42. Por otra parte, la ausencia de pautas nacionales fijas hasta consolidarse en noviembre de 2015, implicó que las franjas de edad de la población objetivo sufrieran cambios con el tiempo, y dejó cierta libertad a los profesionales para la discrecionalidad de las recomendaciones17.
Para las mujeres mayores de 69 años, se observa una disminución en la incidencia a razón de 0.75% anual, que podría reflejar diagnósticos que se “adelantaron”, realizándose a edades más jóvenes en etapas subclínicas o un subdiagnóstico en las de edades más avanzadas.
Hallazgos en referencia con la mortalidad
La tendencia global de la mortalidad por CM en Uruguay a partir de 1990 ha sido al descenso, a razón de 0.91% anual, tal como ha ocurrido en la mayoría de los países de Europa43 y en Estados Unidos44,45. Este descenso se atribuye en parte al diagnóstico precoz, pero principalmente a la mejora del tratamiento y la adecuación de los recursos terapéuticos a las características del tumor44,46,47.
A fines del siglo XX, aún se discutía en Uruguay el valor pronóstico-predictivo de la determinación de los receptores hormonales para el CM48. Es a inicios de los primeros años del presente siglo que se universaliza en el país la práctica de caracterizar los tumores en función del estatus de los RRHH. A mediados de la primera década del siglo XXI, junto con el acceso a tratamientos anti-HER2, se extienden los test para determinar la sobreexpresión de la proteína. También se incorporan nuevos fármacos de quimioterapia, como los taxanos, mejorando el arsenal terapéutico49.
En cuanto a otras tecnologías, el FNR incorpora la cobertura financiera para bloqueo HER2 en adyuvancia para la enfermedad operable HER2 positivo en 2006. En 2008, agrega la indicación para enfermedad avanzada y en neoadyuvancia. En 2010, agrega un tratamiento de segunda línea para enfermedad HER2+ (lapatinib) y en 2017 la asociación trastuzumab-pertuzumab en primera línea y TDM-1 en segunda línea. Para la enfermedad hormonosensible, además del tamoxifeno (modulador selectivo de receptores de estrógeno) disponible desde los años 90, a principios de la década de 2000 se incorporan los inhibidores de la aromatasa (letrozole y anastrozole), y en 2009 el FNR incorpora fulvestrant, un degradador selectivo del receptor de estrógeno50, como tratamiento de segunda línea.
En las mujeres de 20 a 44 años, la mortalidad experimentó un descenso significativo entre 1990 y 2010, incluso mayor que en los demás grupos etarios. Sin embargo, a partir de 2010 se observa una interrupción del descenso con un tramo ascendente que no llega a ser significativo. Este fenómeno también ha sido observado en otros países. En Estados Unidos los datos del National Center for Health Statistics muestran que el descenso de la mortalidad observado en todos los grupos etarios cesó en 2010 en el grupo de menores de 40 años45, lo que se ha atribuido, por lo menos parcialmente, al aumento de los casos de enfermedad avanzada en esa franja etaria. En Brasil, se observó un incremento de la tasa de mortalidad de las mujeres de 30 a 39 años51.
Otro factor que podría explicar la detención del descenso de la mortalidad en las pacientes jóvenes es la caracterización de los tumores, con mayor representación en las pacientes jóvenes de los subtipos agresivos (HER2+ y triple negativos)52,53.
Lamentablemente, los datos del RNC (sobre todo a principios del período analizado) son incompletos en cuanto al estadio de los casos registrados y los perfiles biológicos de los tumores, lo que impide un análisis de tendencias temporales por estadio o por subtipo.
En las mujeres de edades intermedias (45 a 69 años), se observó un descenso sostenido de las tasas de mortalidad. El impacto del cribado mamográfico se evalúa justamente por la reducción en las tasas de mortalidad54, esperable a partir de la edad de inicio del tamizaje. Sin embargo, esta reducción no se explica solo por el diagnóstico precoz y oportuno a través del tamizaje, sino también por la mejora en los tratamientos44,55.
Para las mujeres mayores de 70 años, las tasas de mortalidad se mantuvieron estables. Como se analizó previamente, es en este grupo de edades que se encontró la mayor proporción de casos diagnosticados en etapa de enfermedad diseminada (estadio IV). En las pacientes mayores, los tratamientos se ven limitados fundamentalmente por las comorbilidades, lo cual explicaría que esta sea la única franja etaria en que no se observa disminución de las tasas de mortalidad en ningún momento del período analizado. Varios estudios han señalado peores tasas de sobrevida para mujeres añosas, comparadas con las jóvenes, corregidos otros factores pronósticos como estadio y perfil biológico56,57.
En el informe presentado por el FNR evaluando el desempeño de los tratamientos adyuvantes con trastuzumab, en los primeros años en que se ofrece cobertura financiera para éstos, llama la atención la baja probabilidad de sobrevida a tres años para las mujeres mayores de 60 años (68.4%), comparado con las mujeres menores de 50 años (87%) y de 50 a 59 (90.3%)58. En un análisis más reciente, centrado en las pacientes que recibieron tratamiento anti-HER2 en contexto de enfermedad avanzada comparando dos grandes grupos: 70 y más años y menores de 70 años, se observó que la supervivencia de estos grupos fue diferente, a favor de los menores de 70 años, siendo esta diferencia estadísticamente significativa (p=0,012)59.
El presente estudio es, en nuestro conocimiento, el primer trabajo de estas características realizado en una población latinoamericana. Como fortaleza, destacamos que es un estudio poblacional a escala nacional. La principal limitación es que la tendencia temporal de la incidencia refiere a un período corto, de menos de 20 años. Por otra parte, al contar con información exhaustiva sobre estadio y características de los tumores solo para el período más reciente, no es posible evaluar las tendencias de incidencia y mortalidad por subgrupos que consideren dichas características.
Conclusiones
Este trabajo intenta la caracterización epidemiológica del CM en Uruguay, describiendo sus características y las tendencias recientes de incidencia y mortalidad en tres grupos etarios. Encontramos diferencias significativas tanto en perfiles biológicos y distribución de estadios al momento del diagnóstico, como en las tendencias temporales de la incidencia y la mortalidad. En ese sentido, se confirma la hipótesis de un aumento de la incidencia en mujeres jóvenes, en particular en el grupo etario de 20 a 44 años. Las diferencias en los distintos grupos etarios podrían estar reflejando no solo diferencias en cuanto al impacto de las estrategias de diagnóstico precoz y cribado a nivel poblacional, y del manejo terapéutico para las diferentes franjas etarias, sino, además, diferencias intrínsecas de las características biológicas de la enfermedad.